Гистология лепры. Поражения нервной системы при лепре
Добавил пользователь Morpheus Обновлено: 21.01.2026
Научно-исследовательский институт по изучению лепры, Астрахань
ФГУ Научно-исследовательский институт по изучению лепры Министерства здравоохранения и социального развития Российской Федерации, Астрахань
Диагностическое и прогностическое значение белков острой фазы при инвалидизирующих осложнениях лепрозного процесса
Журнал: Клиническая дерматология и венерология. 2012;10(1): 9‑12
Меснянкина О.А., Дегтярев О.В., Наумов В.З., Дуйко В.В. Диагностическое и прогностическое значение белков острой фазы при инвалидизирующих осложнениях лепрозного процесса. Клиническая дерматология и венерология. 2012;10(1):9‑12.
Mesniankina OA, Degtiarev OV, Naumov VZ, Duĭko VV. Diagnostic and prognostic implications of acute phase proteins for incapacitating complications of the leprotic process. Klinicheskaya Dermatologiya i Venerologiya. 2012;10(1):9‑12. (In Russ.).
В исследование были включены 75 бактериоскопически негативных больных лепрой в стадии клинического регресса со специфическим поражением периферической нервной системы и опорно-двигательного аппарата разной степени выраженности. Результаты изучения содержания α1-антитрипсина, α1-кислого гликопротеина, α2-макроглобулина и гаптоглобина в сыворотке крови свидетельствовали о том, что выраженный острофазовый ответ у больных лепрой отражает степень тяжести патологического процесса. При этом снижение концентрации α2-макроглобулина на фоне растущего уровня α1-кислого гликопротеина свидетельствует о снижении реактивных возможностей организма и является неблагоприятным прогностическим признаком развития осложнений лепрозного процесса и рецидива заболевания. Параллельный мониторинг уровня α1-антитрипсина, α2-макроглобулина, гаптоглобина и α1-кислого гликопротеина в крови бактериоскопически негативных больных лепрой с осложнениями специфической полиневропатии позволяет контролировать их течение, прогнозировать обострение и предупреждать прогрессирование специфических осложнений со стороны опорно-двигательного аппарата, ведущих к инвалидизации и медико-социальной дезадаптации больных, за счет своевременной коррекции реабилитационных мероприятий.
Одной из актуальных проблем современной лепрологии являются инвалидизирующие осложнения со стороны опорно-двигательного аппарата (ОДА), в основе которых лежит хроническая специфическая полиневропатия. По данным В.В. Анохиной и Н.Г. Урляповой [1], более 1 /4 (26,4%) больных лепрой в Астраханской области имеют разнообразные инвалидизирующие последствия лепрозной невропатии. При этом в структуре инвалидности преобладают тяжелые деформации и поражения (80,8%), в значительной степени снижающие качество жизни больных лепрой, нуждающихся в постоянном наблюдении, уходе, лечении и реабилитации.
Поражение периферической нервной системы при лепре с развитием чувствительных, двигательных и трофических расстройств осуществляется в результате проникновения M. leprae в шванновские клетки периферических нервов, где происходит размножение возбудителя, вследствие чего инфицированные шванновские клетки повреждаются и лизируются [2].
Поздняя диагностика заболевания и несвоевременное начало специфической терапии приводят к образованию выраженных необратимых деформаций и инвалидизации пациентов, которые снижают качество жизни и затрудняют их социальную адаптацию.
Изменения в костях, развивающиеся в результате нейротрофических нарушений, в той или иной степени определяются практически у всех больных лепроматозным типом лепры. Даже у больных без видимых клинических изменений могут определяться остеопороз с участками остеосклероза — начальные признаки трофических нарушений. В 78,5% случаев костные деформации под влиянием сульфонов не претерпевают положительных изменений (остаются на том же уровне или продолжают прогрессировать). Дополнительным инвалидизирующим фактором является острый неспецифический остеомиелит, чаще развивающийся на фоне выраженных нейротрофических изменений в костях стоп [3].
Одними из наиболее частых и тяжелых осложнений лепрозного неврита являются нейротрофические язвы стоп, встречающиеся у 20—30% больных лепрой [4]. Они возникают на фоне длительного течения основного заболевания, отличаются упорным течением, приводят к утяжелению инвалидизации [5].
Лечение осложнений лепрозного процесса, физическая и социальная реабилитация больных являются причиной периодических госпитализаций в противолепрозные учреждения. При этом пациенты с поражением ОДА составляют 80,6% от общего числа госпитализированных [6].
Проградиентный характер специфической полиневропатии обусловливает неизбежное прогрессирование и утяжеление инвалидизирующих осложнений со стороны ОДА, несмотря на адекватно проводимую противолепрозную терапию и отсутствие кожных проявлений заболевания.
В связи с этим актуальной задачей современной лепрологии является поиск диагностических маркеров, свидетельствующих об активности деструктивных процессов и способствующих прогнозированию течения патологического процесса, а также разработка на их основе комплекса мер вторичной профилактики инвалидизирующих осложнений со стороны ОДА и медико-социальной реабилитации пациентов.
Цель исследования — совершенствование диагностики инвалидизирующих осложнений лепрозного процесса.
Материал и методы
В исследование были включены 75 больных лепрой в стадии клинического регресса, бактериоскопически негативные, находившиеся на стационарном и амбулаторном лечении в ФГУ НИИЛ Минздравсоцразвития России по поводу осложнений лепрозного процесса и сопутствующих заболеваний.
У всех обследованных были выявлены специфические неврологические нарушения. Поражение локтевого нерва отмечалось у 32 человек, срединного — у 22, лучевого — у 1, малоберцового — у 17, большеберцового — у 36. Наличие трофических язв стоп в точках опоры на подошвенной поверхности стопы в основании большого, III и V пальцев или на пятке отмечалось у 21 пациента. Обширные длительно незаживающие трофические язвы с частыми обострениями и проградиентным течением хронического остеомиелита явились причиной ампутаций нижних конечностей у 11 больных.
Мутиляции фаланг пальцев кисти разной степени тяжести отмечались у 32 больных, пальцев стоп — у 36.
Таким образом, у всех обследованных были выявлены специфические неврологические нарушения, у большинства осложненные развитием амиотрофий и контрактур, а в ряде случаев — трофических язв, остеомиелита и мутиляций, приводящих к необратимым деформациям конечностей.
В зависимости от степени поражения периферической нервной системы (ПНС) и выраженности клинических признаков специфического поражения ОДА все больные были разделены на три группы. В 1-ю группу вошли 37 больных с осложнениями хронического специфического полиневрита в виде рецидивирующих трофических язв, хронического остеомиелита и мутиляций конечностей разной степени. 2-ю группу составили 24 пациента без деструктивных поражений ОДА, но имеющие последствия специфического поражения ПНС в виде амиотрофий и контрактур. В 3-ю группу вошли 14 больных, у которых проявления хронического специфического полиневрита ограничивались лишь нарушением чувствительности.
Для определения концентрации α1-антитрипсина (α1-АТ), α1-кислого гликопротеина (α1-КГП), α2-макроглобулина (α2-МГ) и гаптоглобина (ГГ) иммунотурбидиметрическим методом в сыворотке крови использовали коммерческие тест-наборы с поликлональными антителами к белкам фирмы «Sentinel» (Италия).
Измерения проводили с помощью программируемого фотометра Humalyzer 2000 (Германия).
В качестве контроля использовали сыворотки крови 35 доноров, сопоставимых по полу и возрасту, не имеющих инфекционных заболеваний и поражений ОДА.
Статистическую обработку результатов проводили с использованием программы Microsoft Office Exсel. Достоверность данных оценивали с помощью критерия Стьюдента.
Результаты исследования
Результаты изучения содержания α1-АТ, ГГ, α2-МГ у больных лепрой с клиническими проявлениями осложнений специфической полиневропатии и без таковых свидетельствуют об отсутствии значимых различий этих показателей в указанных группах, что не позволяет рекомендовать использование данных белков в качестве индикаторов поражения ОДА у больных лепрой (табл. 1). Однако наблюдаемый нами в обеих группах выраженный острофазовый ответ, являясь отражением местных и системных изменений в организме, подтверждает наличие патологических процессов в нервной ткани, в том числе и у пациентов, не имеющих осложнений специфической полиневропатии. В связи с этим данную категорию пациентов следует рассматривать как группу риска дальнейшего прогрессирования патологических изменений и возможного развития деструктивных осложнений со стороны ОДА. По данным клинических наблюдений, хронический проградиентный характер течения специфического патологического процесса, вовлечение аутоиммунных механизмов способствуют усугублению со временем остеодеструктивных поражений, даже несмотря на проводимую адекватную терапию. Повышение концентрации α1-КГП у больных с осложнениями специфического полиневрита отражает снижение иммунологической реактивности у данной категории пациентов, вызванное длительным течением специфического процесса, возможной причиной которого является персистенция M. leprae.
Для уточнения диагностического и прогностического значения ингибиторов протеолиза изучали их содержания у больных лепрой в зависимости от степени поражения ПНС и выраженности клинических признаков специфического поражения ОДА у больных трех групп: с деструктивными осложнениями специфического полиневрита (1-я группа; 37 человек), без деструктивных осложнений (2-я группа; 24 человека) и с незначительными проявлениями хронического специфического полиневрита (3-я группа; 14 человек).
Наибольший уровень ГГ и α1-КГП у больных без клинических признаков деструктивных процессов со стороны ОДА, но имеющих осложнения специфического полиневрита в виде амиотрофий и контрактур позволяет сделать вывод о возможном субклиническом течении остеодеструктивных процессов, вызывающем повышенную стимуляцию системы протеолиза и, как следствие, соответствующую защитную реакцию антипротеолитической системы (табл. 2). В связи с этим пациентов, имеющих признаки специфического поражения ПНС, но без явлений деструкции ОДА, с повышенным уровнем ингибиторов протеаз, следует рассматривать как группу повышенного риска в плане возможного прогрессирования патологического процесса и развития деструктивных осложнений, приводящих к инвалидизации и медико-социальной дезадаптации, значительно ухудшающей качество их жизни. Более низкие концентрации ГГ и α1-КГП в группе пациентов с деструктивными осложнениями специфического полиневрита могут свидетельствовать о суб- и декомпенсации системы антипротеолитической защиты.
Практически равные значения α1-АТ в группах больных с разными по степени тяжести клиническими проявлениями специфической полиневропатии являются следствием разнонаправленных процессов, определяющих итоговую концентрацию данного белка. Повышение уровня α1-АТ является отражением активации защитной антипротеолитической системы. Однако при ее декомпенсации может произойти снижение активности ингибиторов, что создает предпосылки к прогрессированию воспалительных и деструктивных процессов [7, 8]. Снижение уровня антитрипсиновой активности может происходить вследствие не только образования α1-АТ-комплексов с протеолитическими ферментами, но и инактивации его свободными радикалами (образуются при активации полиморфноядерных лейкоцитов), окисляющими активный центр α1-АТ, что приводит к потере его активности [9]. Таким образом, преобладание тех или иных процессов определяет уровень данного ингибитора в сыворотке крови. Именно поэтому определение содержания данного белка у больных с осложнениями специфического полиневрита можно использовать лишь в качестве дополнительного лабораторного теста.
Выводы
Параллельный мониторинг за уровнем α1-АТ, α2-МГ, ГГ и α1-КГП в крови бактериоскопически негативных больных лепрой с осложнениями специфической полиневропатии позволяет контролировать их течение, прогнозировать обострение и предупреждать прогрессирование специфических осложнений со стороны ОДА, приводящих к инвалидизации и медико-социальной дезадаптации больных, проводить своевременную коррекцию реабилитационных мероприятий.
Повышение уровня α1-АТ, ГГ и α1-КГП на фоне снижения α2-МГ и растущего титра антител у больных лепрой, не имеющих осложнений специфической полиневропатии или с таковыми, но без клинических признаков деструкции (амиотрофии, контрактуры) должно расцениваться как неблагоприятный прогностический признак, свидетельствующий о прогрессировании патологических изменений и возможном развитии деструктивных осложнений со стороны ОДА.
Гистология лепры. Поражения нервной системы при лепре
ФГБУ «Научно-исследовательский институт по изучению лепры» Минздрава России, Астрахань, Россия, 414057
Случай семейной лепры
Журнал: Клиническая дерматология и венерология. 2018;17(5): 47‑52
РЕЗЮМЕ Несмотря на спорадический характер заболеваемости лепрой в России, появление новых случаев может быть связано не только с увеличением потока мигрантов из высоко эндемичных по лепре стран, но и с развитием болезни у лиц, имеющих длительный контакт с больными лепрой. Вероятность заболевания лепрой находится в прямой зависимости от длительности и близости контакта с источником болезни. По сравнению с общей популяцией у лиц, длительно проживающих совместно с больными лепрой, риск заражения выше. Среди членов семей больных лепрой чаще заболевают кровные родственники. Описано клиническое наблюдение развития лепроматозной лепры у пациентки, имеющей родителей, больных лепрой. При проведении бактериоскопического и гистологического исследований у пациентки обнаружены кислотоустойчивые микобактерии в биоптате и скарификатах кожи (БИН=3,67). Идентификацию Mycobacterium leprae проводили методом полимеразной цепной реакции (ПЦР) с гибридизацией на основе DNA-STRIP технологии с использованием праймеров GenoType Leprae DR («Hain Lifescience», Германия). Во всех образцах были идентифицированы M. leprae, чувствительные к основным противолепрозным препаратам (рифампицин, офлоксацин, дапсон). При серологическом исследовании сыворотки крови методом ИФА на наличие антител классов IgM, IgG к специфическому антигену M. leprae (DIS-BSA) было обнаружено значительное превышение оптической плотности антител как класса IgM, так и класса IgG. Кроме того, при HLA-генотипировании у больной, так же, как и у ее матери, выявлен гаплотип HLA-DRB1-*15-DQA1-*0102- DQB1-*0602/08, ранее определенный как маркер предрасположенности к лепре в русской популяции. Таким образом, внедрение при обследовании больных лепрой и контактных лиц, помимо стандартных бактериоскопических и гистологических методов, молекулярно-генетических, серологических и иммуногенетических, позволяет подтвердить диагноз лепры на ранних сроках заболевания.
Лепра — генерализованное хроническое инфекционное заболевание человека, поражающее кожу, слизистые оболочки, нервную систему и внутренние органы; возбудителем является Mycobacterium leprae, открытая Хансеном в 1874 г. [1]. Несмотря на давность открытия возбудителя, патогенез заболевания до конца не выяснен. Это в первую очередь связано с уникальными особенностями лепры, к числу которых относятся длительный инкубационный период, невозможность культивирования возбудителя на искусственных питательных средах, трудности экспериментального моделирования на животных [2]. По данным ВОЗ, при ежегодном выявлении в мире более 200 тыс. новых случаев заболевания лепрой около 2 млн больных имеют инвалидизирующие осложнения даже на фоне комбинированной лекарственной терапии (MDT) [3].
Несмотря на то что лепру считают «малоконтагиозной» инфекцией, вероятность заболевания находится в прямой зависимости от длительности и характера контакта, интенсивность передачи возбудителя (инфицированность) намного превышает уровень клинической заболеваемости [4]. Это объясняется высокой степенью резистентности населения к лепрозной инфекции. По сравнению с общей популяцией, у лиц, длительно проживающих совместно с больными лепрой, в зависимости от типа заболевания риск заражения гораздо выше [5, 6]. В настоящее время общепризнано, что среди членов семей больных лепрой чаще заболевают кровные родственники [7]. Однако при лепре в условиях спорадической заболеваемости, длительного инкубационного периода, при наличии субклинических, стертых и малобактериальных формах сложно проследить родословную семейной заболеваемости. До момента заболевания детей многие родители умирают, поэтому обследовать ядерные семьи (включающие родителей и их детей) при лепре проблематично [8]. Кроме того, сложность в постановке диагноза заключается в том, что в клинической практике диагноз ставится на оценке кожных проявлений, положительном бактериоскопическом индексе (БИН), основанном на подсчете микобактерий при окраске мазка по Цилю—Нильсену, и гистологическом исследовании образцов кожи. Однако чувствительность стандартных методов (в частности бактериоскопии) невелика. Возможности современных молекулярно-генетических методов позволяют идентифицировать ДНК возбудителя заболевания в клинических образцах с высокой степенью чувствительности и специфичности и в короткие сроки.
Ниже представлено клиническое наблюдение развития заболевания лепрой у больной, имеющий длительный семейный контакт (рис. 1, 2). Рис. 2. Пациентка Р. Лепроматозная лепра (вид сзади). Рис. 1. Пациентка Р. Лепроматозная лепра (вид спереди).
Больная Р., 1967 г. р., жительница Астрахани, обратилась в клинику НИИЛ в сентябре 2015 г., заподозрив у себя лепру. Больной себя считает с января 2015 г., когда впервые заметила в области нижней части спины изменения на коже в виде отдельных пятен бледно-красного цвета. В марте 2015 г. появились онемение, покалывание и ощущение ползания «мурашек» в области рук и ног, изменения на коже прогрессировали — увеличилось их количество и размеры, появились пятна на конечностях, животе, изменился цвет элементов (красная окраска стала более насыщенной). В июле 2015 г. с вышеописанными жалобами больная обратилась в городскую поликлинику по месту жительства. Была осмотрена врачами-специалистами, однако диагноз лепры установлен не был.
Учитывая отсутствие положительной динамики от лечения, самостоятельно обратилась в НИИЛ в связи с тем, что ее родители были больными лепроматозной лепрой, однако они были переведены на амбулаторное лечение еще до ее рождения. Больная была осмотрена врачом-дерматовенерологом и 23.09.15 госпитализирована в клиническое отделение НИИЛ. При поступлении на коже груди и живота имелись поверхностные инфильтраты без четких границ, местами сливающиеся между собой, красноватого цвета. В поясничном отделе инфильтрация красновато-синюшного цвета с переходом на ягодицы. На правой ягодице отмечались лепромы диаметром до 0,3—0,5 см, эластичной консистенции. На кистях и стопах поверхностная инфильтрация красновато-синюшного цвета, сухость и шелушение ладоней и подошв. Разреженность бровей. Неврологический статус: пациентка хорошо дифференцирует разницу между болевой и тактильной чувствительностью (за исключением дистальных отделов, где дифференциация нарушена, в результате чего дает путаные ответы при повторении раздражения). На нижних конечностях от колена до стопы участки гипестезии чередуются с участками полной потери чувствительности. На верхних конечностях в области предплечья и кисти участки гипестезии преимущественно на разгибательных поверхностях. На некоторых элементах, характеризующих поражение кожного покрова (область спины, груди, правого предплечья), отмечается гипестезия (снижение болевой чувствительности). Нейротрофических язв нет.
У пациентки взяты соскобы со слизистой носа, биопсии и скарификаты кожи для проведения бактериоскопического, гистологического исследований и постановки полимеразно-цепной реакции (ПЦР). При бактериоскопическом исследовании в соскобе со слизистой поверхности носа микобактерии лепры не обнаружены, а во всех скарификатах кожи обнаружены гомогенные и зернистые микобактерии лепры (БИН=3,67).
Заключение патолого-морфологического исследования биоптатов кожи из лепром с левого бедра и правой ягодицы: фрагменты кожи с участками атрофии эпидермиса, умеренно выраженный кератоз. В толще дермы и вокруг придатков кожи в большом количестве периваскулярные, периневральные инфильтраты из эпителиоидных лимфоидных клеток и гистиоцитов, образующие гранулемы, отдельные из которых с некрозом в центре. Очаги склероза. При окраске по Цилю−Нильсену в инфильтратах обнаружено большое количество кислотоустойчивых палочковидных микобактерий в виде групп из 5—7 микобактерий.
Молекулярно-генетическую идентификацию микобактерий проводили методом ПЦР с дальнейшей гибридизацией с использованием праймеров набора GenoType Leprae DR («HainLifescience», Германия). Метод основан на DNA-STRIP технологии и позволяет идентифицировать M. leprae и ее устойчивость к основным противолепрозным препаратам (рифампицину, офлоксацину, дапсону). Определение устойчивости к рифампицину обеспечивается выявлением наиболее значимых мутаций гена rpoB, кодирующего β-субъединицу РНК-полимеразы. Определение устойчивости к офлоксацину или другим фторхинолонам обеспечивается обнаружением наиболее значимой мутации в гене gyrA, кодирующем α-субъединицу ДНК-гиразы. Для исследования устойчивости к дапсону изучалась соответствующая область гена folP1, кодирующая синтез дигидроптеората. Амплификацию проводили в термоциклере Терцик (ООО «НПО ДНК-Технология», Россия). Гибридизацию ДНК выполняли на автоматическом приборе GT-Blot-48 («HainLifescience», Германия). Учет результатов осуществляли визуально с помощью прилагаемого к каждому набору шаблона и в автоматическом сканирующем устройстве GenoScan («HainLifescience», Германия), принцип работы которого заключается в автоматическом анализе параметров сканированных стрипов. При молекулярно-генетическом исследовании во всех стрипах были обнаружены M. leprae, чувствительные ко всем трем антимикобактериальным препаратам.
Кроме того, у больной было проведено серологическое исследование сыворотки крови методом ИФА на наличие антител классов IgM, IgG к специфическому антигену M. leprae - DIS-BSA. Была значительно превышена оптическая плотность (ОП) антител класса IgM — 1,15 при норме 0,20±0,05. ОП антител класса IgG составила 0,66 (норма 0,25±0,05). Учитывая тот факт, что пациентка происходит из семьи больных лепрой, и у матери ранее было проведено иммуногенетическое исследование и определен HLA-гаплотип, у больной была взята кровь для HLA-генотипирования по 14 группам аллелей гена DRB1, 8 аллелям гена DQA1 и 12 аллелям гена DQB1. У больной был установлен такой же, как и у матери, гаплотип HLA-DRB1-*15-DQA1-*0102-DQB1-*0602/8, ранее выявленный как маркер предрасположенности к лепре в русской популяции [9].
Таким образом, применение различных методов исследования, как стандартных (бактериоскопического и гистологического), так и молекулярно-генетических (ПЦР с дальнейшей гибридизацией, HLA-генотипирование) и серологических с учетом данных анамнеза и клинической картины, позволило установить диагноз: «Лепра, лепроматозный тип, активная стадия. cопутствующий диагноз: нейропатия локтевого и срединного нервов с двух сторон с чувствительными нарушениями».
С 29.09.15 больная получает комбинированную противолепрозную терапию (дапсон 100 мг 2 таблетки ежедневно, рифампицин 4 таблетки по 150 мг 1 раз в месяц). Лечение получает в полном объеме, переносит удовлетворительно, побочных эффектов на данные лекарственные препараты не выявлено. Также проводится комплексная метаболическая терапия, включающая нейропротекторы, гепатопротекторы и физиолечение, на фоне которых отмечается положительная клиническая и клинико-лабораторная динамика со стороны лепрозного процесса. В период лечения лепрозный процесс соответствует стационарной фазе, обострений не отмечалось. Изменения на коже регрессируют. Отмечается снижение БИН до 0,53. При бактериоскопии скарификатов кожи единичные гомогенные M. leprae и зернистые формы обнаруживаются только на двух участках, что также подтверждено результатами ПЦР-анализа. Кроме того, отмечается отчетливая положительная динамика в уровне специфических антимикобактериальных антител класса IgМ до ОП=0,43, что свидетельствует об эффективности терапии. Однако сохраняющаяся серопозитивность, положительный БИН и обнаружение единичных M. leprae не позволяют утверждать о наступлении клинико-лабораторного регресса заболевания. На данный момент больная продолжает получать специфическую противолепрозную терапию, симптоматическую терапию (коррекция АД), курсы гепатопротекторов (гептрал, хофитол, резалют), нейропротекторов (цитофлавин, тиолипон), а также физиотерапию — скенар-терапию на область голени, магнитотерапию и лазеротерапию на область нижних конечностей, амплипульс-терапию, УЗ-терапию на поясничную область.
Эпидемиология лепры характеризуется неоднородностью в восприимчивости к заболеванию, в том числе и среди лиц семейного контакта. В основе такой гетерогенности могут лежать разные механизмы. В большом эпидемиологическом исследовании, проведенном в Бангладеш, описаны до шести таких механизмов [10], основными из которых в разной ассоциации являются бытовые контакты и генетический фактор. Бытовые контакты подразумевают длительность контакта и тип лепры больного члена семьи. Кроме того, к ним можно отнести и такой общий фактор, особенно характерный для высоко эндемичных по лепре стран, как бедность [11]. К генетическим факторам относится индивидуальная наследственная предрасположенность. Так, в семьях больных лепрой даже при условии максимального риска заражения заболеваемость не превышает 35% [12]. Исследования целого генома, проведенные во Вьетнаме и Бразилии, показали, что генетический механизм при лепре может быть двухступенчатым, т. е. восприимчивость к заболеванию и развитие типа лепры определяются группой аллелей генов на разных хромосомах [13, 14]. Восприимчивость к инфекционным заболеваниям, в первую очередь, ассоциирована с полиморфизмом генов иммунного ответа (HLA), в том числе и при лепре [15, 16]. В описанном нами клиническом случае мать больной была выписана на амбулаторное лечение в 1963 г. и, несмотря на то, что оставалась бактериоскопически негативной, на протяжении всего времени вплоть до своей смерти в 2014 г. лечилась по поводу трофических язв. Кроме того, нужно отметить, что при отрицательной бактериоскопии скарификатов с кожи и соскобов из носа у больной отмечались повышенные титры специфических антител. Так, уровень IgM периодически повышался до 0,65 ед. ОП, а IgG — до 0,88 ед. О.П. Ранее было показано, что у части больных лепрой, находящихся в стадии клинического регресса, трофические язвы колонизированы различными микобактериями, в том числе и M. leprae [17]. Кроме того, у матери сохранялась длительная серопозитивность. Все это свидетельствует о персистенции M. leprae в организме. Исходя из вышесказанного, можно предположить, что при длительном контакте с матерью, при наличии HLA-гаплотипа предрасположенности к развитию лепры и при возникновении различных провоцирующих факторов (стресс, заболевания, вредные привычки) у больной могла развиться лепра.
Заключение
Заболеваемость лепрой в России сведена до спорадического уровня, благодаря проводимым долгие годы планомерным противоэпидемическим мероприятиям. Встречающиеся в настоящее время новые случаи заболевания в своем большинстве выявляются в семьях больных лепрой. Следует отметить, несмотря на то, что инкубационный период при лепре лишен четко определенных сроков, считается, что он может длиться от нескольких месяцев до 20 лет и более. Какова длительность инкубационного периода в описанном нами случае, трудно сказать, так как у больной был не кратковременный контакт с инфектом, а длительный, практически на протяжении всей жизни. Выявленный ранее в НИИЛ в 2009 г. больной М., 58 лет, также был из семьи больных лепрой, находящихся длительное время на амбулаторном лечении. Все это диктует необходимость при обследовании амбулаторных больных и контактных лиц, помимо стандартных бактериоскопических и гистологических методов исследования включать серологические и иммуногенетические. А внедрение таких молекулярно-генетических методов как ПЦР позволяет подтвердить диагноз лепры на самых ранних сроках заболевания.
Сведения об авторах
V.Z. Naumov — Academic Secretary, Candidate of Medical Science Leprosy Research Institute, Astrakhan, Russia.
Сбор и обработка материала — Л.В. Сароянц, В.В. Дуйко, К.Ш. Арнаудова
Написание текста - Л.В. Сароянц, К.Ш. Арнаудова
Редактирование — В.З. Наумов, Л.В. Сароянц
Collecting and interpreting the data — L.V. Saroyants, K.Sh. Arnaudova, V.V. Duiko
Drafting the manuscript — L.V. Saroyants, K.Sh. Arnaudova
Revising the manuscript — L.V. Saroyants, V.Z. Naumov
Лепра, или проказа
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Лепра: причины появления, симптомы, диагностика и способы лечения.
Определение
Лепра, более известная как проказа, - хроническое инфекционное заболевание, являющееся одним из видов гранулематоза и вызываемое кислотоустойчивой палочковидной бациллой Mycobacterium leprae или Mycobacterium lepromatosis.
Болезнь поражает в основном кожный покров, периферические нервы, слизистую оболочку верхних дыхательных путей и органы зрения.
Лепра известна с давних пор и упоминается в письменных источниках древних цивилизаций Египта, Индии и Китая. В древних рукописях говорилось, что больные лепрой часто подвергались гонениям.
Проказа, из-за которой у людей западают носы, выпадают брови и деформируются пальцы, кажется сегодня архаизмом Средневековья. Но «болезнь дьявола», как ее нередко называли, до сих пор никуда не делась, хотя в мире и достигнуты значительные успехи в борьбе с ней. Начиная с 2000 года заболевание ликвидировано в глобальных масштабах (достигнут показатель распространенности менее одного случая заболевания на 10 000 человек). На начало 2020 года в Российской Федерации состояло на учете 202 больных лепрой, более 60% из которых жители Астраханской области.
Несмотря на медицинские успехи в лечении лепры, во многих странах люди, страдающие этой болезнью, живут в изоляции и подвергаются различным формам дискриминации.
Причины появления лепры
Проказу считают малозаразным заболеванием, поскольку решающим фактором является длительный, повторный и непосредственный контакт с больным человеком, во время которого происходит сенсибилизация организма.
Таким образом, вероятность заболевания находится в прямой зависимости от длительности и характера контакта с больным человеком.
Врачи называют группы риска, то есть лиц, наиболее подверженных заражению: к ним относятся аллергики, больные СПИДом и люди, проживающие в районах с плохими условиями жизни.
Коварство лепры состоит в том, что она может «дремать» в организме и год, и пять, и сорок лет. Характеризуется затяжным течением с периодическими обострениями и способна маскироваться под другие болезни, чаще всего кожные.
Патогенез заболевания до конца не выяснен в связи с невозможностью культивирования возбудителя на искусственных питательных средах и трудностями экспериментального моделирования на животных. Нет четкого понимания, возможно ли полное излечение болезни или остается скрытая возможность ее рецидива на фоне ослабления иммунитета.
Классификация заболевания
В зависимости от течения заболевания выделяют 4 формы:
- недифференцированная лепра,
- туберкулоидная лепра,
- лепроматозная лепра,
- пограничная (диморфная) лепра.
При хорошем иммунном статусе у пациента развивается относительно благоприятная туберкулоидная форма, неблагоприятной считается лепроматозная форма проказы.
Клинические разновидности лепры различаются симптоматикой и сферой поражения внутренних органов. Течение болезни в каждом случае проходит четыре стадии: стационарную, прогрессирующую, регрессивную и в завершение болезни - резидуальную.
Симптомы лепры
Во время первых двух стадий очаги заболевания могут обостряться, несмотря на интенсивность терапии. Для лепроматозной формы характерны преимущественно кожные поражения, а при туберкулоидной - поражение периферических нервных стволов. Недифференцированная и пограничная формы могут трансформироваться в лепроматозную или туберкулоидную.
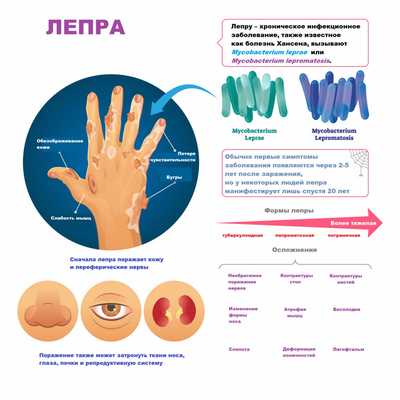
Лепра является генерализованным заболеванием, то есть распространяется на кожу, слизистые оболочки носа и ротоглотки, переднюю камеру глаз, кожные и другие периферические нервы, тканевые макрофаги, надпочечники и яички.
Изменения кожи выглядят как красно-бурые пятна на лице, руках, ногах и спине. Вначале кожа гладкая и блестящая, но спустя несколько лет уплотняется и становится бугристой. В дальнейшем бугристая поверхность начинает шелушиться, покрываться язвами и теряет чувствительность. На лице формируется характерная «львиная маска». По мере развития патологии у больного выпадают брови и ресницы, западает спинка носа, нос проседает и приобретает седловидную форму, носовые ходы искривляются, в результате чего нарушается функция дыхания, наблюдаются частые носовые кровотечения, свисают мочки ушей, голос становится хриплым и гнусавым.
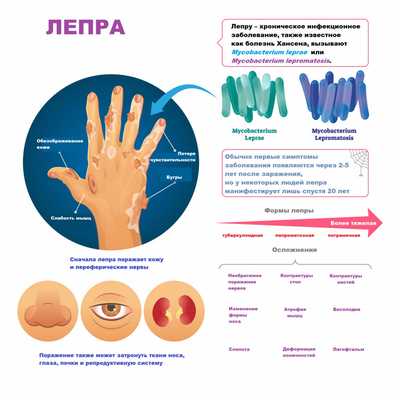
Нередко наблюдаются невриты локтевого, срединного, лицевого, ушного и других нервов. Из-за поражения нервных окончаний кода теряет чувствительность, позже у больного может развиваться парез или паралич конечностей, на стопах появляются трофические язвы и контрактуры, атрофируются мышцы. Внутренние органы обычно не поражаются.
Ухудшается зрение, а при отсутствии адекватного лечения может наступить полная слепота. Лимфатические узлы, особенно бедренные, паховые и локтевые, часто увеличены, отмечаются лепроматозные периоститы и оститы, приводящие к остеопорозу и остеомаляции. У мужчин вследствие инфильтрации и рубцевания яичек развивается бесплодие.
Диагностика лепры
Диагноз устанавливают по факту контакта с больными лепрой в анамнезе. Поставить достоверный диагноз можно только после выделения микобактерии M. leprae. Материал для исследования получают путем соскоба с пораженного участка кожи, предварительно сделав небольшой разрез глубиной 2-3 мм. Также можно взять пункцию из увеличенных лимфоузлов. Полученный материал окрашивают по Цилю-Нильсену (окрашивает кислотоустойчивые бактерии).
При сомнительных результатах проводят биопробу на морских свинках (резистентных к M. leprae и неустойчивых к M. tuberculosis).
Кроме того, для дифференциации формы заболевания проводят кожную пробу с аллергеном M. leprae. При туберкулоидной лепре проба положительная, при лепроматозной форме - отрицательная.
Определить разновидность лепры позволяет лепроминовый тест, дающий резко положительный результат при туберкулоидной форме болезни и отрицательный - при лепроматозной форме. Пограничные формы дают слабоположительный либо отрицательный ответ.
Общий анализ крови демонстрирует незначительную анемию, увеличение СОЭ.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий.
Читайте также:
- Признание болезни в прошлом. Пример признания наркомании в прошлом
- Генетическая регуляция формирования органов желудочно-кишечного тракта
- Изменения глаз, конъюктивы при отравлении йодом
- Внутриротовые аппараты. Составные части ортопедических аппаратов.
- Изменения брюшной полости при системных заболеваниях
