Гликоген в слизистой рта. Содержание гликогена при отсутствии зубов
Добавил пользователь Alex Обновлено: 22.01.2026
Московский государственный медико-стоматологический университет
Кафедра патологической физиологии, кафедра госпитальной терапевтической стоматологии, пародонтологии и гериартрической стоматологии Московского государственного медико-стоматологического университета
Кафедра госпитальной терапевтической стоматологии, пародонтологии и гериатрической стоматологии Московского государственного медико-стоматологического университета
Заживление хирургической раны слизистой оболочки полости рта под влиянием применения рекомбинантного эпидермального фактора роста в эксперименте
Журнал: Российская стоматология. 2011;4(1): 32‑37
Воложин А.И., Гемонов В.В., Кабалоева Д.В., Суражев Б.Ю. Заживление хирургической раны слизистой оболочки полости рта под влиянием применения рекомбинантного эпидермального фактора роста в эксперименте. Российская стоматология. 2011;4(1):32‑37.
Volozhin AI, Gemonov VV, Kabaloeva DV, Surazhev BIu. Healing of surgical wound in oral mucosa after the treatment with recombinant epidermal growth factor in experiment. Russian Stomatology. 2011;4(1):32‑37. (In Russ.).
Экспериментальное исследование позволило установить благоприятное влияние применения рекомбинантного эпидермального фактора роста на регенерацию при лечении ран слизистой оболочки полости рта у здоровых крыс. Анализ полученных данных показал, что преимущественное усиление репаративной регенерации было достигнуто при повышении концентрации препарата в питьевой воде до 500 мкг/мл.
Факторы роста при лечении ран
Травма слизистой оболочки полости рта является распространенной причиной обращения за стоматологической помощью. Ее возникновение обусловлено различными причинами: хирургическими вмешательствами, ожогами и повреждениями при местном применении лекарственных препаратов; нарушением целостности слизистой оболочки в период адаптации к съемным протезам; механическим воздействием на десну и слизистую оболочку во время препарирования зубов, краем искусственной коронки и др. Негативные особенности заживления подобных ран обусловлены наличием в полости рта разнообразной микробной флоры, постоянной механической и термической нагрузкой на ткани этой локализации и высокой специфичностью их гистологического строения [9]. Несмотря на различную этиологию поражений, общим принципом лечения таких пациентов в стоматологической клинике является применение средств, направленных на регенеративные процессы в тканях [3]. Учитывая, что регенерация тканей представляет собой четко регулируемый каскадный и многокомпонентный морфофункциональный процесс, обеспечиваемый сложными кооперативными межклеточными взаимодействиями, представляет интерес поиск препаратов, применение которых обеспечило бы наилучший результат регенерации слизистой оболочки полости рта [4, 7]. Получение рекомбинантного эпидермального фактора роста (РЭФР) и его экспериментальное испытание на моделях регенерации эпидермиса явилось мощным толчком к развитию этого направления. РЭФР не обладает видовой специфичностью, т.е. функционирует у животных различных видов. Эпидермальный фактор роста (ЭФР) специфически связывается с рецепторами на поверхности клеточных мембран, стимулируя тем самым пролиферацию, таксис и дифференциацию клеток, что способствует быстрому и качественному заживлению ран [5, 10]. Этот фактор управляет ростом клеток эпителия, эндотелия и фибробластов, регулирует их хемотаксис [2]. При повреждениях в полости раны количество рецепторов к ЭФР возрастает [6]. Это вызывает перемещение клеток из здоровых неповрежденных тканей в пораженные участки [1, 8]. Эффективность отечественного РЭФР для оптимизации заживления ран слизистой оболочки полости рта еще не была изучена в эксперименте. Сейчас РЭФР проходит экспериментальную проверку, по итогам которой может быть рекомендован в качестве специфического стимулятора заживления ран на слизистой оболочке полости рта.
Целью настоящей работы явилось экспериментальное обоснование применения РЭФР для оптимизации заживления повреждений слизистой оболочки полости рта.
Материал и методы
ЭФР относится к группе факторов роста (цитокины) и является полипептидом, состоящим из 53 аминокислот, его молекулярная масса 6021 Д. Фактор устойчив к действию кислот и высоких температур. Относится к наиболее стабильным из всех изученных белков. ЭФР играет значительную роль в регуляции обменных и восстановительных процессов, присутствуя в клетках всех тканей организма и регулируя рост клеток. Стимулирует таксис противовоспалительных клеток, что способствует быстрому и качественному заживлению ран.
Эксперимент выполнен на 36 белых крысах линии Вистар, массой 220-280 г. Под наркозом (Zoletil 50, «Vibrac», Франция) животным наносили круглые раны диаметром 5 мм на твердом небе до кости. Кровотечение останавливали гемостатической губкой. Животных были разделены на 3 группы по 12 крыс в каждой. В 1-й группе животные постоянно получали чистую питьевую воду; во 2-й группе животным давали воду с РЭФР в концентрации 100 мкг/мл; в 3-й группе животные получали воду с РЭФР в концентрации 500 мкг/мл. Растворы для питья готовили ежедневно, хранили при температуре -40°С. Воду с РЭФР животные 2-й и 3-й групп получали с 9 до 18 ч, в остальное время крысы пили обычную водопроводную воду, потребляли одинаковое количество жидкости, получали сбалансированный брикетированный корм. Из эксперимента животных выводили на 3, 7, 14 и 21-е сутки.
Выделяли верхнюю челюсть, фиксировали в 10% нейтральном формалине, декальцинировали в трилоне Б, заливали в целлоидин. Микропрепараты окрашивали гематоксилином и эозином, PAS-реакцией, азокармином, импрегнировали серебром. Динамику заживления ран оценивали планиметрически и патоморфологически, гистохимическую оценку репаративного процесса проводили по содержанию гликозаминогликанов, гликогена и нуклеиновых кислот.
РЭФР предоставлен ГНИИ особо чистых биопрепаратов (Санкт-Петербург). В России РЭФР синтезирован из E. сoli.
Результаты и обсуждение
В 1-й группе на 3-й день наблюдений диаметр раны у всех животных не отличался от первоначального в момент ее нанесения. Края раны ровные, на поверхности тонкий, мягкий струп из сохранивших жизнедеятельность лейкоцитов, склеенных плазмой. Центральная часть раны ограничена пластом многослойного эпителия. Дно дефекта образовано костной тканью твердого неба, покрытой утолщенной надкостницей (рис. 1). Рисунок 1. Раневой дефект на 3-и сутки (1-я группа). Костная ткань на дне дефекта. Утолщенная надкостница. Окраска гематоксилином и эозином. ×200. В самой кости и в надкостнице воспалительный процесс. Наряду с ним на границе дефекта с тканью отмечено начало репаративных процессов. На 7-е сутки область раны окружена пластом эпителия, внедряющимся под струп (рис. 2). Рисунок 2. Слизистая оболочка твердого неба на участке раны к 7-м суткам эксперимента (1-я группа). Наползающий пласт эпителия. Окраска гематоксилином и эозином. ×200. Диаметр дефекта уменьшается за счет наползания пласта эпителия под струп. Под струпом на поверхности кости располагается утолщенная надкостница с клетками фибробластического ряда. В клетках регенерирующего эпителия гранулы гликогена, заполняющие цитоплазму новообразованных клеток (рис. 3). Рисунок 3. Слизистая оболочка твердого неба на участке раны к 7-м суткам эксперимента (1-я группа). Гликоген в наползающем пласте эпителия. Окраска: PAS-реакция. ×200. По краю дефекта происходит образование грануляционной ткани, ее основная масса представлена фибробластами различной степени зрелости, макрофагами, отдельными сегментоядерными лейкоцитами и тонкими пучками коллагеновых волокон. Фибробласты заполняли саму зону дефекта, формируя поверх костной ткани грануляционную ткань, содержащую кровеносные капилляры, по которой шло напластование эпителия. На 14-е сутки сохранялся тонкий струп. Пласт эпителия продолжал свое движение к центру дефекта. В эпителии появлялись клетки с признаками паракератоза, что свидетельствует о дифференциации клеток. Гликогенсодержащие клетки располагались непосредственно на мигрирующем крае эпителиального пласта. По мере дифференциации эпителиоцитов глыбки гликогена в них исчезали. Наползание пласта эпителия шло по грануляционной ткани, в этот период отмечалось увеличение коллагеновых волокон, происходило восстановление соединительнотканной основы (рис. 4). Рисунок 4. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (1-я группа). Новообразованные пучки коллагеновых волокон (синего цвета) в зоне дефекта. Окраска азокармином. ×200. Незакрытым пластом эпителия оставался лишь центральный участок дефекта. На 21-е сутки зона дефекта во всех наблюдениях была перекрыта утолщенным эпителием с менее выраженным роговым слоем. Нижняя поверхность его имела ровную границу. Под эпителием волокнистая соединительная ткань, богатая фибробластами различной степени зрелости. Обнаруживаются кровеносные сосуды, заполненные форменными элементами. В двух случаях центр дефекта оставался незакрытым эпителием, что связано с воспалительным процессом. При этом на поверхности дефекта находился струп, и эпителизация шла под его поверхностью.
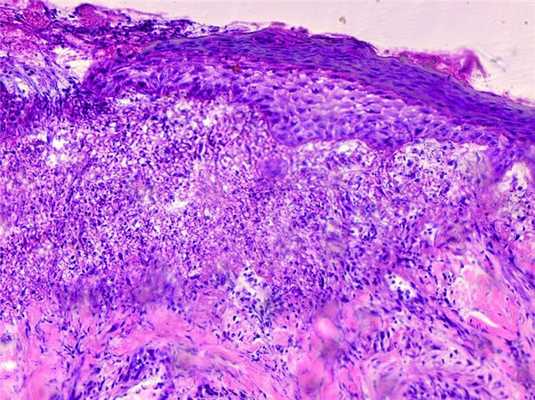
Во 2-й группе (РЭФР 100 мкг/мл) на 3-и сутки дефект покрыт эластичным струпом. Отмечается образование грануляционной ткани. По краям раны утолщенный пласт регенерирующего эпителия без ороговения, а в его клетках выявлялся гликоген (рис. 5). Рисунок 5. Слизистая оболочка твердого неба на участке раны к 3-м суткам эксперимента (2-я группа). Начало эпителизации. Наползание эпителия под струпом. В пласте эпителия содержится гликоген. Окраска: PAS-реакция. ×200. Под струпом скопление фибробластов, макрофагов, лейкоцитов. Средняя часть дефекта заполнена рыхло расположенными лейкоцитами и макрофагами, а также фибробластами различной степени зрелости. Костная ткань покрыта утолщенной надкостницей, в составе которой обнаруживались остеобласты. В некоторых случаях отмечалось образование костной ткани. На 7-е сутки эксперимента по краю раны прогрессирующая эпителизация. Эпителиальный пласт утолщен, внедряется под струп, имеет ровную нижнюю поверхность. Толщина струпа неравномерна и варьировала в широких пределах. Эпителиальные сосочки отсутствовали.
В новообразованном эпителии гликоген в виде мелких глыбок (рис. 6). Рисунок 6. Слизистая оболочка твердого неба на участке раны к 7-м суткам эксперимента (2-я группа). Пласт новообразованного эпителия внедряется под расположенный на поверхности дефекта струп. В эпителии располагается гликоген. Окраска: PAS-реакция. ×200. Под эпителием типичная грануляционная ткань с наличием капилляров и клеток: фибробластов, отдельных макрофагов, а ближе к центру дефекта располагались лейкоциты. Репаративные процессы шли от периферии к центру дефекта. Это относилось к образованию грануляционной ткани и процессу эпителизации дефекта. Сам процесс эпителизации происходил быстрее по сравнению с аналогичным сроком у животных 1-й группы. Это ускорение репаративных процессов относилось и к дифференциации новообразованного пласта эпителия. На 14-е сутки значительная часть дефекта была покрыта утолщенным пластом новообразованного эпителия. У одной из крыс отмечено полное перекрытие дефекта эпителием, характеризующимся выраженным роговым слоем (рис. 7). Рисунок 7. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (2-я группа). Большая часть дефекта закрыта эпителием с явлением ороговения. Окраска гематоксилином и эозином. ×200. Его поверхностную часть образовывали клетки с явлениями ороговения, и лишь клетки самой передней части эпителиального клина не имели признаков ороговения. В них обнаруживались скопления гликогена, которые сливались в однородную массу. Под эпителием располагалась грануляционная ткань с коллагеновыми и аргирофильными волокнами (рис. 8). Рисунок 8. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (2-я группа). Коллагеновые и аргирофильные волокна в расположенной под эпителием ткани. Окраска: импрегнация серебром. ×400. У остальных крыс большая часть дефекта покрыта новообразованным пластом эпителия. На 21-е сутки дефекты у всех крыс были эпителизированы. По краям раны структура эпителия была полностью восстановлена, сам пласт немного утолщен (рис. 9). Рисунок 9. Слизистая оболочка твердого неба на участке раны к 21-м суткам эксперимента (2-я группа). Область дефекта закрыта утолщенным пластом эпителия с наличием в клетках шиповатого слоя следов гликогена. Окраска: PAS-реакция. ×400. Струпа на поверхности раны нет. Дифференциация эпителия шла от центра дефекта к его периферии. По периферии отмечалось полное восстановление структуры эпителиального пласта. Имело место восстановление рогового слоя и соединительнотканной основы, состоявшей из пучков коллагеновых волокон. Нижняя поверхность эпителиального пласта имела на большом протяжении сосочки, их появление шло от периферии дефекта к его центру.
В 3-й группе (РЭФР 500 мкг/мл) уже на 3-и сутки было отмечено наползание эпителия с краев дефекта, на поверхности которого располагался тонкий струп (рис. 10). Рисунок 10. Слизистая оболочка твердого неба на участке раны к 3-м суткам эксперимента (3-я группа). Наползание толстого пласта новообразованного эпителия. Эпителий внедряется под струп. Окраска гематоксилином и эозином. ×400. Толщина и рост наползающего под струп новообразованного эпителия более интенсивны, чем в 1-й группе. Утолщение идет в основном за счет клеток шиповатого слоя. Под пластом новообразованного эпителия образовывалась грануляционная ткань, богатая фибробластами различной степени зрелости и макрофагами. Новообразованный эпителий имел толстый роговой слой, нижняя поверхность эпителия была неровная за счет образованных здесь эпителиальных сосочков. На 7-е сутки эпителизация дефекта в сравнении с 1-й группой была более интенсивной. Эпителий покрывал большую часть дефекта, имел довольно толстый роговой слой. Активно образовывалась волокнистая соединительная ткань. Струп большей частью отсутствовал, и в этих участках поверхность дефекта была перекрыта тонкой эластичной пленкой, состоящей из плазмы крови и отдельных лейкоцитов. Под пластом эпителия располагалась новообразованная соединительная ткань с пучками рыхло расположенных коллагеновых волокон, а также разнообразных клеточных элементов. Вся площадь дефекта заполнена волокнистой соединительной тканью, которая ниже новообразованного пласта эпителия срасталась с надкостницей. Кость имела строение, типичное для пластинчатой кости, на ее поверхности располагались остеобласты. В некоторых участках отмечались узуры, заполненные соединительной тканью. На 14-е сутки у всех крыс дефект перекрыт эпителием с выраженным роговым слоем (рис. 11). Рисунок 11. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (3-я группа). Новообразованный пласт эпителия, перекрывающий зону травмы. На поверхности пласта четко виден роговой слой. Окраска гематоксилином и эозином. ×200. На его поверхности располагались уплощенные роговые чешуйки, которые местами слущивались. Лишь в отдельных случаях в самом центре дефекта имелся утолщенный пласт эпителия. Скорость пролиферации эпителия заметно увеличивалась. Подлежащая соединительная ткань построена из волокнистых структур, изменяющих свое расположение. Часть из них располагалась параллельно пласту эпителия. Нижняя поверхность эпителия образовывала выросты или сосочки. Подлежащая костная ткань имела обычную структуру, характерную для пластинчатой кости. На 21-е сутки выявлена полная регенерация эпителия, восстановлена и структура эпителиального пласта. На всем протяжении на поверхности эпителия имело место восстановление рогового слоя (рис. 12). Рисунок 12. Слизистая оболочка твердого неба на участке раны к 21-м суткам эксперимента (3-я группа). Новообразованный утолщенный пласт эпителия с выраженным роговым слоем. Коллагеновые волокна в подлежащей соединительной ткани. Окраска азокармином. ×400. Роговые чешуйки плотно прилежат друг к другу. Сам роговой слой отличался от остальных слоев по окраске. Гликоген в новообразованном эпителии нигде не выявлялся. Нижняя поверхность эпителиального пласта имеет волнообразный вид за счет образовавшихся здесь эпителиальных сосочков. Соединительная ткань собственной пластинки слизистой оболочки содержала волокнистые структуры и клеточные элементы, главным образом фибробласты.
Таким образом, исследование установило благоприятное влияние применения РЭФР при заживлении ран слизистой оболочки полости рта. Анализ полученных данных показал, что наиболее оптимальной концентрацией препарата является 500 мкг/мл. Именно в этом случае происходит выраженное ускорение процесса эпителизации дефекта. В целом процесс репаративной регенерации осуществляется на базе одного и того же комплекса стереотипных реакций без проявления каких-либо новых их вариантов. Говоря о влиянии РЭФР, можно лишь отметить ускорение восстановительных процессов в слизистой оболочке неба у экспериментальных животных.
В целом результаты проведенного исследования показывают хорошую репаративную способность отечественного РЭФР, что может быть использовано в дальнейшем для его клинических испытаний.
Гликогеноз I типа (болезнь Гирке)
Гликогеноз типа I - заболевание, описанное Гирке в 1929 г., однако ферментный дефект был установлен Кори только в 1952 г. Гликогеноз типа I встречается у 1 из 200 000 новорожденных. Заболеваемость мальчиков и девочек одинакова. Наследование аутосомно-рецессивное. При гликогенозе I типа ( болезнь Гирке) клетки печени и извитых почечных канальцев заполнены гликогеном, однако эти запасы оказываются недоступными: об этом свидетельствует гипогликемия, а также отсутствие повышения уровня глюкозы в крови в ответ на адреналин и глюкагон. Обычно у этих больных развиваются кетоз и гиперлипемия, что вообще характерно для состояния организма при недостатке углеводов. В печени, почках и тканях кишечника активность глюкозо-6-фосфатазы либо крайне низка, либо вообще отсутствует.
Патогенез (что происходит?) во время Гликогеноза I типа (болезни Гирке):
Заболевание обусловлено дефектами ферментной системы печени, превращающей глюкозо-6-фосфат в глюкозу. Нарушается как гликогенолиз, так и глюконеогенез, что приводит к гипогликемии голодания с лактацидозом, гиперурикемии и гипертриглицеридемии. В печени накапливается избыток гликогена.
Ферментная система, превращающая глюкозо-6-фосфат в глюкозу, содержит не менее 5 субъединиц: глюкозо-6-фосфатазу (катализирует гидролиз глюкозо-6-фосфата в просвете эндоплазматического ретикулума), регуляторный Са2(+)-связывающий белок и белки-переносчики (транслоказы), T1, T2 и T3, которые обеспечивают переход глюкозо-6-фосфата, фосфата и глюкозы через мембрану эндоплазматического ретикулума.
Дефект глюкозо-6-фосфатазы (гликогеноз типа Ia) и дефект глюкозо-6-фосфат-транслоказы (гликогеноз типа Ib) проявляются сходными клиническими и биохимическими нарушениями. Чтобы подтвердить диагноз и точно установить ферментный дефект, необходима биопсия печени и исследование активности глюкозо-6-фосфатазы.
Симптомы Гликогеноза I типа (болезни Гирке):
Клинические проявления гликогеноза типа I у новорожденных, грудных детей и детей старшего возраста неодинаковы. Причина - различия рациона и режима питания в этих возрастных группах.
Иногда в первые дни и недели жизни возникает гипогликемия голодания, однако в большей части случаев болезнь протекает бессимптомно, поскольку грудной ребенок часто питается и получает достаточное количество глюкозы. Нередко болезнь диагностируют через несколько месяцев после рождения, когда у ребенка обнаруживают увеличение живота и гепатомегалию. Бывают одышка и субфебрильная температура без признаков инфекции. Одышка вызвана гипогликемией и лактацидозом из-за недостаточной продукции глюкозы. Когда интервалы между кормлениями увеличиваются и ребенок начинает спать ночью, появляются симптомы гипогликемии, особенно по утрам. Тяжесть и длительность гипогликемии постепенно увеличиваются, что приводит к системным метаболическим нарушениям.
Если лечение не проводят, изменяется внешность ребенка. Характерны гипотрофия мышц и скелета, задержка роста и физического развития, отложение жира под кожей. Ребенок становится похож на больного с синдромом Кушинга. Развитие познавательных и социальных навыков не страдает, если только повторные приступы гипогликемии не вызвали повреждения головного мозга. Если ребенок не получает достаточного количества углеводов и гипогликемия голодания сохраняется, то задержка роста и физического развития становится резко выраженной. Некоторые дети с гликогенозом типа I умирают от легочной гипертензии.
Нарушение функции тромбоцитов проявляется повторными носовыми кровотечениями или кровоточивостью после стоматологических и других хирургических вмешательств. Отмечаются нарушения адгезии и агрегации тромбоцитов; нарушено также высвобождение АДФ из тромбоцитов в ответ на адреналин и контакт с коллагеном. Тромбоцитопатия вызвана системными метаболическими нарушениями; после лечения она исчезает.
УЗИ и экскреторная урография выявляют увеличение почек. У большинства больных выраженных нарушений функции почек не бывает, отмечается лишь повышение СКФ (скорость клубочковой фильтрации) . В очень тяжелых случаях может развиться тубулопатия с глюкозурией, фосфатурией, гипокалиемией и аминоацидурией (как при синдроме Фанкони). У подростков иногда наблюдается альбуминурия, а у молодых людей часто развивается тяжелое поражение почек с протеинурией, повышением АД (артериального давления) и падением клиренса креатинина, обусловленное фокально-сегментарным гломерулосклерозом и интерстициальным фиброзом. Эти нарушения приводят к терминальной почечной недостаточности.
Селезенка не увеличена.
Без лечения резко возрастают уровни свободных жирных кислот, триглицеридов и апопротеина C-III, который участвует в транспорте триглицеридови богатых триглицеридами липопротеидов. Уровни фосфолипидов и холестерина повышаются умеренно. Очень высокий уровень триглицеридов обусловлен их чрезмерной продукцией в печени и снижением их периферического метаболизма из-за снижения активности липопротеидлипазы. При тяжелой гиперлипопротеидемии на разгибательных поверхностях конечностей и ягодицах могут появляться эруптивные ксантомы.
Отсутствие лечения или неправильное лечение приводят к задержке роста и полового развития.
Аденомы печени по неизвестным причинам возникают у многих больных, обычно в возрасте 10-30 лет. Аденомы могут малигнизироваться, возможны кровоизлияния в аденому. На сцинтиграммах печени аденомы выглядят как участки пониженного накопления изотопа. Для обнаружения аденом применяют УЗИ. При подозрении на злокачественный рост более информативны МРТ (магнитно-резонансная томография) и КТ (компьютерная томография), позволяющие проследить превращение небольшого четко отграниченного новообразования в более крупное, с размытыми краями. Рекомендуется периодически измерять уровень альфа-фетопротеина в сыворотке (это маркер печеночноклеточного рака).
С возрастом тяжесть гипогликемии голодания уменьшается. Вес тела растет быстрее, чем вес головного мозга, поэтому соотношение между скоростью продукции и утилизации глюкозы становится более выгодным. Скорость продукции глюкозы возрастает за счет активности амило-1,6-глюкозидазы в печени и мышцах. В результате уровень глюкозы натощак постепенно повышается.
Клинические проявления гликогеноза типа Iа и типа Ib одинаковы, но при гликогенозе типа Ib наблюдается постоянная или преходящая нейтропения. В тяжелых случаях развивается агранулоцитоз. Нейтропения сопровождается дисфункцией нейтрофилов и моноцитов, поэтому повышается риск стафилококковых инфекций и кандидоза. У некоторых больных возникает воспалительное заболевание кишечника , напоминающее болезнь Крона.
Диагностика Гликогеноза I типа (болезни Гирке):
При лабораторной диагностике гликогеноза типа I проводятся:
- обязательные исследования: измеряют уровни глюкозы, лактата, мочевой кислоты и активность ферментов печени натощак; у новорожденных и грудных детей с гликогенозом типа I уровень глюкозы в крови после 3-4-часового голодания падает до 2,2 ммоль/л и ниже; если продолжительность голодания превышает 4 ч, уровень глюкозы почти всегда меньше 1,1 ммоль/л; гипогликемия сопровождается значительным повышением уровня лактата и метаболическим ацидозом; сыворотка обычно мутная или похожа на молоко из-за очень высокого содержания триглицеридов и умеренно повышенного содержания холестерина; отмечаются также гиперурикемия и повышение активности АсАТ (аспартатаминотрансферазы) и АлАТ (аланинаминотрансферазы).
- провокационные пробы: чтобы отличить гликогеноз типа I от других гликогенозов и точно определить ферментный дефект, у грудных детей и детей старшего возраста измеряют уровень метаболитов (глюкозы, свободных жирных кислот, кетоновых тел, лактата и мочевой кислоты) и гормонов (инсулина , глюкагона , адреналина, кортизола и СТГ (соматотропного гормона)) натощак и после приема глюкозы; схема исследования такова: ребенку дают глюкозу внутрь в дозе 1,75 г/кг, затем каждые 1-2 ч берут кровь; в каждой пробе быстро измеряют концентрацию глюкозы; последнюю пробу берут не позже чем через 6 ч после приема глюкозы либо в тот момент, когда концентрация глюкозы снизилась до 2,2 ммоль/л;
- провокационная проба с глюкагоном: глюкагон вводят в/м или в/в струйно в дозе 30 мкг/кг (но не более 1 мг) через 4-6 ч после еды или приема глюкозы; кровь для определения глюкозы и лактата берут за 1 мин до инъекции глюкагона и через 15, 30,45, 60,90 и 120 мин после инъекции. При гликогенозе типа I глюкагон не повышает либо незначительно повышает уровень глюкозы, тогда как исходно повышенный уровень лактата продолжает нарастать;
- специальное исследование: проводят биопсию печени, исследуют гликоген; содержание гликогена сильно увеличено, но структура его нормальная;
- специальные исследования для точного установления ферментного дефекта, лежащего в основе гликогеноза типа I: измеряют активность глюкозо-6-фосфатазы в цельных и разрушенных микросомах печени (по образованию глюкозы и фосфата из глюкозо-6-фосфата); микросомы разрушают повторным замораживанием и оттаиванием биоптата; при гликогенозе типа Iа активность глюкозо-6-фосфатазы не определяется ни в цельных, ни в разрушенных микросомах; при гликогенозе типа Ib активность глюкозо-6-фосфатазы в разрушенных микросомах нормальная, а в цельных микросомах отсутствует или сильно снижена (поскольку дефектная глюкозо-6-фосфат-транслоказа не переносит глюкозо-6-фосфат через мембраны микросом);
- методы молекулярной биологии (выявление генетического дефекта путем ПЦР (полимеразной цепной реакции) и последующей гибридизации со специфическими олигонуклеотидами).
Специальные исследования и методы молекулярной биологии доступны только специализированным лабораториям; в США, к примеру, в лабораториях: Dr. Y. Т. Chen, Division of Genetics and Metabolism, Duke University Medical Center, Durham, North Carolina, U.S.A.; Dr. R. Grier, Biocemical Genetics Laboratory, Nemours Children's Clinic, Jacksonville, Florida, U.S.A.
Лечение Гликогеноза I типа (болезни Гирке):
Метаболические нарушения при гликогенозе типа I, обусловленные недостаточной продукцией глюкозы , возникают уже через несколько часов после еды, а при длительном голодании значительно усиливаются. Поэтому лечение гликогеноза типа I сводится к частому кормлению ребенка. Цель лечения - предупредить падение концентрации глюкозы в крови ниже 4,2 ммоль/л - порогового уровня, при котором происходит стимуляция секреции контринсулярных гормонов .
Если ребенок своевременно получает достаточное количество глюкозы размеры печени уменьшаются, лабораторные показатели приближаются к норме, кровоточивость исчезает, рост и психомоторное развитие нормализуются.
К каким докторам следует обращаться если у Вас Гликогеноз I типа (болезнь Гирке):
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Гликогеноза I типа (болезни Гирке), ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Влияние углеводной пищи на кариесогенную ситуацию в полости рта.
Кариесоегенная ситуация в полости рта — факторы, которые способствуют формированию кариеса.
В возникновении кариеса важнейшая роль принадлежит легкоусвояемым углеводам — сахару (сахароза), глюкозе, фруктозе и наличие микрофлоры. Известно, что для усиления активности микрофлоры, обладающей углеводрасщепляющими свойствами, достаточно даже незначительного поступления в полость рта углеводов (глюкозы, сахарозы), при их расщеплении в зубном налете создается потенциал органических кислот, под действием которых разрушается эмаль зубов.
Рост распространенности и интенсивности поражения зубов кариесом совпадает с увеличением потребления легкоусвояемых углеводов. Поэтому важным аспектом рационального питания является путь снижения кариесогенного действия этих углеводов.
Многочисленные исследования свидетельствуют о прямой зависимости между потреблением сахара и интенсивностью поражения кариесом. В полости рта человека есть все условия, а также полный набор ферментов микробного происхождения, необходимых для расщепления углеводов.
Достаточно добавить к такой среде простые углеводы, чтобы началось метаболическое расщепление.
Длительная задержка углеводов в полости рта отмечается в тех случаях, когда их принимают изолированно от другой пищи — беспорядочно, т. е. в промежутках между основными приемами пищи или как последнее блюдо (на десерт), в виде липких и вязких конфет, надолго задерживающихся в полости рта, где и осуществляется метаболизм углеводов. Особенно длительно они остаются в полости рта, если были приняты на ночь, так как ночью снижается секреция слюнных желез и замедляются процессы самоочищения полости рта.
Еще более продолжительно задерживаются углеводы в полости рта при потреблении их в виде твердых и липких веществ. Так, после выпитого стакана газированного напитка повышенное содержание глюкозы в смешанной слюне человека сохраняется в течение 15 мин, после приема карамельной конфеты оно удлиняется уже до 30 мин, после печенья — до 50 мин.
Остатки углеводов задерживаются в зубах и расщепляются микрофлорой до молочной кислоты. Снижение рН на поверхности эмали приводит к активации в ней процессов деминерализации, а подкисленная слюна приобретает декальцинирующие свойства.
Метаболизм углеводов в полости рта завершается образованием органических кислот, повышение концентрации которых небезразлично для зубов. При недостаточной устойчивости эмали она быстро разрушается.
Процесс метаболизма углеводов наиболее интенсивно протекает в мягком зубном налете, а, кроме того, в слюне и некоторых других структурах полости рта. Прием легкоусвояемых углеводов является пусковым моментом цепи реакций, которые неблагоприятны для гомеостаза полости рта. Это ведет к нарушению, местному сдвигу рН (в зубном налете), изменятся динамическое равновесие в сторону увеличения процессов разрушения эмали под зубным налетом. Поэтому в причинах возникновения кариеса углеводным компонентам пищи придается наибольшее значение.
Кариесогенный потенциал углеводов зависит не только и не столько от потребляемого их количества, сколько от частоты приема, количества сахара, остающегося в полости рта после потребления, физического вида сахара (вязкость, липкость), его концентрации и многих других факторов. Чем чаще, длительнее и в наиболее высоких концентрациях сахар задерживается в полости рта и соприкасается с зубами, тем более выражено его кариесогенное действие.
Уменьшение потребления углеводов — один из естественных путей борьбы с кариесом. Однако на практике это сделать трудно. Простые углеводы являются наиболее дешевыми продуктами, имеющими высокую энергетическую ценность, и заменить их другими пищевыми веществами сложно. Замена сахара эквивалентными сладкими веществами, требует больших затрат.
В профилактике кариеса и управлении питанием, как предрасполагающим фактором развития кариеса, необходимо не только исключать сладости и липкие продукты, но и обращать внимание на консистенцию пищи.
Рацион должен состоять преимущественно из продуктов и блюд, требующих тщательного пережевывания: свежие овощи, фрукты, отварное мясо, особенно полезна в этом плане говядина. При активном пережевывании стимулируется выработка слюны — главного защитника полости рта, также происходит стимуляция роста челюсти.
Кроме консистенции пищи необходимо обращать внимание на кратность ее приема. В идеале за день должно быть 3-5 приема пищи.
В настоящее время запрещение в широких масштабах потребления углеводов в качестве меры профилактики кариеса — задача непосильная и бесперспективная. Лишь в отдельных случаях при активном течении кариозного процесса, в период прорезывания и созревания зубов можно на определенное время исключить из пищевого рациона сахар и содержащие его продукты. Снижение частоты потребления углеводов ведет к уменьшению контакта зубов с ними. Такое направление профилактики кариеса особенно перспективно в организованных коллективах и общественном питании, где его реализация наиболее проста и доступна.
Уменьшение времени пребывания углеводов в полости рта основано на сокращении контакта углеводов с зубными тканями, в результате чего снижается их кариесогенное влияние. Доказано, что в течение 20-40 минут после приема углеводов происходит активная утилизация их остатков микрофлорой. Это самый критический период для эмали. Устранение свободных углеводов из полости рта путем их ускоренного выведения предполагает закрепить в привычку населения полоскание полости рта после каждого приема пищи, особенно углеводной. При этом за счет эвакуации углеводов исчезает субстрат для метаболизма микрофлоры и естественно падает кариесогенное воздействие. Этот способ не требует специальных затрат, прост в исполнении, может проводиться в любом помещении, в связи с чем может быть рекомендован населению.
Уход за зубами — основа профилактики. И это, пожалуй, самый мощный фактор защиты и агрессии. При соблюдении всех правил гигиены полости рта, регулярном посещении стоматолога риски развития кариеса можно свести буквально на нет. Если уход за зубами неправильный, есть погрешности и ошибки — риск развития кариеса значительно возрастает.
Все вышеперечисленные предрасполагающие факторы развития кариеса поддаются корректировке. Пациенты и стоматологи могут влиять на них, следовательно, снижать риски развития патологии в разы.
Гингивит - симптомы и лечение
Что такое гингивит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Карелина Андрея Сергеевича, стоматолога со стажем в 11 лет.
Над статьей доктора Карелина Андрея Сергеевича работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Гингивит — воспалительное заболевание дёсен, которое проявляется болезненностью, отёчностью, кровоточивостью и выделением экссудата (жидкости, которую продуцируют ткани в ответ на воспаление).
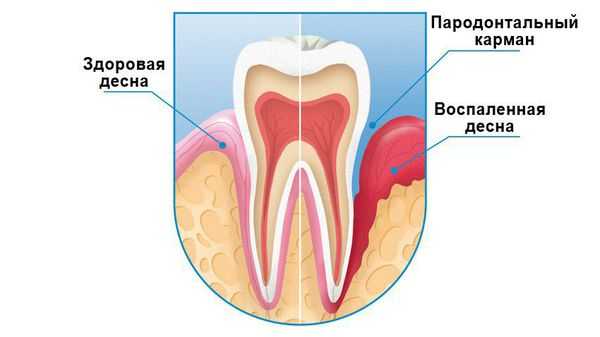
Воспалённая десна становится мягкой, шероховатой, неплотно прилегает к коронкам зубов. По данным Всемирной организации здравоохранения, более чем у 90-95 % взрослых людей присутствуют воспалительные процессы мягких тканей ротовой полости, а утрата зубов из-за воспаления дёсен и пародонта (тканей, окружающих зуб) случается в 5 раз чаще, чем от кариозных поражений [1] .
В большинстве случаев гингивит возникает из-за скопления зубного налёта в результате плохой гигиены ротовой полости. Бляшки из налёта постоянно раздражают слизистую, формируют карманы (увеличивают расстояние между зубом и мягкими тканями), в которых активно размножаются бактерии. Т. е. чаще всего причиной воспаления дёсен являются бактерии. Кроме того, гингивит может быть следствием аллергии, грибковых и вирусных инфекций.
Провоцирующие факторы в развитии воспаления дёсен:
- изменения гормонального фона;
- сахарный диабет;
- авитаминоз;
- приобретённые (ВИЧ) и врождённые иммунодефициты (синдром Ди Джорджи);
- беременность;
- лейкоз;
- недостаток витамина С;
- отягощённая наследственность (есть близкие родственники, которые страдали воспалительными заболеваниями дёсен);
- повреждение десны [1] .
Повреждения слизистой могут возникать при неправильном прикусе, стоматологических манипуляциях, воздействии агрессивных химических веществ, использовании жёсткой зубной щётки, употреблении твёрдой пищи. Даже незначительная травма эпителия — это входные ворота для инфекции.
К ятрогенным (связанным с врачебными манипуляциями) факторам, способствующим воспалению, относятся острые края зубных протезов, коронок, неотполированные пломбы, прилегающие к десне.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гингивита
На начальной стадии заболевания пациенты жалуются на дискомфорт в ротовой полости. При осмотре поражённый участок десны гиперемирован (т. е. имеется покраснение), увеличен в объёме. Возможна кровоточивость во время употребления твёрдой пищи и чистки зубов. Боли на ранней стадии заболевания, как правило, ещё нет. Многие пациенты жалуются на повышенное слюновыделение.

Воспалённая десна отстаёт от поверхности зуба, в образовавшейся полости скапливаются остатки пищи, появляется неприятный запах изо рта. Если не лечить заболевание, в кармане активно размножаются бактерии, развивается кариес шейки зуба [2] .
Со временем появляется боль в десне, которая усиливается во время приёма пищи и при стоматологическом осмотре. Особенно болевой синдром выражен при употреблении горячего, холодного и кислого. При выраженном воспалении или распространённом процессе могут появляться не только местные, но и общие симптомы: повышение температуры, слабость, повышенная утомляемость, раздражительность.
При осмотре стоматолог видит изменение цвета поражённых участков слизистой, гипертрофию (увеличение объёма) межзубных сосочков и края десны. Обычно в области воспаления присутствует зубной налёт, зубной камень и поражения кариесом. При обследовании стоматологическим инструментом десна может кровоточить. При хроническом воспалении клиническая картина стёрта, но может наблюдаться выраженная гипертрофия мягких тканей. При длительно текущем процессе разросшаяся десна может закрывать практически всю коронку зуба. При десквамативной ( с появлением пузырьков на дёснах) и язвенной форме гингивита на десне могут образовываться пузырьки и язвочки [3] .
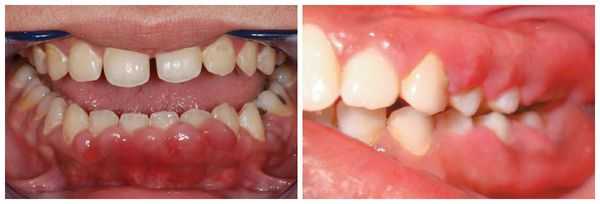
Патогенез гингивита
Развитие гингивита начинается с формирования бляшек из зубного налёта. Они образуются после отсутствия полноценной гигиены ротовой полости в течение 1-2 дней. Наиболее частые места образования бляшек — межзубные промежутки и пришеечная зона.

Из слюны и выделяемой десной жидкости формируется плёнка — пелликула. В норме она выполняет защитную функцию, но на начальных стадиях гингивита способствует адгезии (прилипанию) бактерий, которые присутствуют в ротовой полости даже у здорового человека. Обычно это аэробные кокки и палочки.
Микроорганизмы активно размножаются, в глубине их колонии образуется анаэробная (бескислородная) среда. Это создает оптимальные условия для размножения агрессивной грамотрицательной микрофлоры. Эти бактерии продуцируют токсины, которые способны проникать в ткани и разрушать слизистую оболочку, что приводит к эрозивным изменениям эпителия.
Организм пытается противостоять повреждающему действию и в ответ запускает воспалительную реакцию с целью уничтожения патогенных факторов . В некоторых случаях иммунитет самостоятельно справляется с микрофлорой, но чаще воспаление прогрессирует или приобретает хронический характер.
Разрушающее действие микроорганизмов и воспалительный процесс ведут к ухудшению микроциркуляции в десне, снижению активности антиоксидантных защитных механизмов. Это приводит к агрессивному воздействию на эпителий факторов системы комплемента (защитных белков, циркулирующих в крови), что вызывает прогрессирующее разрушение слизистой. У пациентов с дефектами иммунитета, гормональными нарушениями, болезнями крови, травматическим повреждением дёсен и истончённой слизистой мягкие ткани более уязвимы, процесс их деструкции идёт более активно.
Если патологический процесс активно развивается, в мягких тканях возрастает количество клеток иммунной системы (лимфоцитов и макрофагов). Они разрушают клетки и фибриллярные структуры цитоплазмы ( жесткие, параллельно расположенные волокна, которые определяют форму клетки) . Это приводит к расширению пространства между десной и зубом, истончению эпителиального слоя.
Воспаление может полностью пройти с наступлением выздоровления, либо перейти в хроническую форму. Во втором случае процессы регенерации нарушаются, эпителий замещается грануляционной тканью (соединительной тканью, которая образуется при заживлении тканевых дефектов), которая может сильно разрастаться, прикрывая коронку зуба [4] .
Классификация и стадии развития гингивита
Согласно Международной классификации болезней 10 пересмотра (МКБ-10), выделяют острое и хроническое течение гингивита:
- При остром течении пациент ощущает болезненность и дискомфорт, часто бывают кровотечения, мягкие ткани гиперемированы.
- Хроническое воспаление иногда вызывает дискомфорт, пациента беспокоит неприятный запах изо рта, край десны часто утолщён в виде валика. Хроническую форму гингивита делят на такие виды:
- хронический без дополнительных уточнений;
- десквамативный (с появлением пузырьков на дёснах);
- гиперпластический (проявляется разрастанием десны);
- простой маргинальный (поражающий край десны);
- язвенный [5] .
По распространённости воспалительного процесса гингивит может быть локальным либо генерализованным (распространённым). В последнем случае часто выявляются общие симптомы в виде повышения температуры и слабости.
По тяжести течения:
- Лёгкие поражения слизистой — поражаются только межзубные сосочки.
- Поражения средней тяжести — в воспалительный процесс вовлекается свободный край десны.
- Тяжёлые поражения слизистой — воспаляются мягкие ткани, прикреплённые к зубу.
По морфологическим признакам:
- Катаральный гингивит. Х арактерно выделение большого количества экссудата, выраженное покраснение слизистой, отёчность, болезненность, локальное повышение температуры.
- Гипертрофический гингивит. Сосочки между зубами увеличиваются, со временем они могут полностью закрывать коронки зубов. Десна приобретает синюшный оттенок, кровоточит во время еды, чистки зубов или при стоматологическом осмотре, формируются глубокие десневые карманы.
- Язвенный гингивит. Слизистая приобретает серый оттенок, видны очаги деструкции [6] .
На ранней стадии заболевания отмечается покраснение, припухлость, кровоточивость дёсен. Если вовремя обратиться к стоматологу, можно быстро снять воспаление и полностью восстановить мягкие ткани. Если не лечить заболевание, развиваются деструктивные процессы в десне, дефекты замещаются грануляционной тканью. Если воспаление будет прогрессировать и дальше, процесс может перейти на ткани пародонта, что может привести к утрате зубов.
Осложнения гингивита
Гингивит — это не такое безобидное заболевание, как кажется некоторым пациентам. Многие полагают, что воспаление пройдёт само, не оставив следа. Это возможно только при небольшом очаге поражения и хорошем иммунитете. Следует помнить, что воспалённая десна — это источник инфекции, которая может распространяться в ротовой полости и вызывать серьёзные последствия. Именно поэтому при первых симптомах нужно обращаться за медицинской помощью. Самые распространённые осложнения гингивита:
- язвенно-некротические изменения слизистой; (воспаление пародонта); (воспаление соединительной связки, фиксирующей зуб в кости челюсти) ;
- распространение инфекции за пределы ротовой полости.
При гингивите на слизистую полости рта действуют иммунные силы организма (лимфоциты и макрофаги) и токсины, которые выделяют бактерии. Если воспалительный процесс вовремя не купировать, эпителий начнёт разрушаться. На начальных стадиях этот процесс обратим, но при длительном течении заболевания десна гипертрофируется за счёт грануляционной ткани. В этом случае терапевтическое лечение может быть неэффективным.
Микрофлора, которая поразила десну, может распространяться на ткани пародонта. Это приводит к шаткости зубов, а со временем — к их утрате. Таким образом, вследствие заболеваний дёсен можно потерять совершенно здоровые зубы.
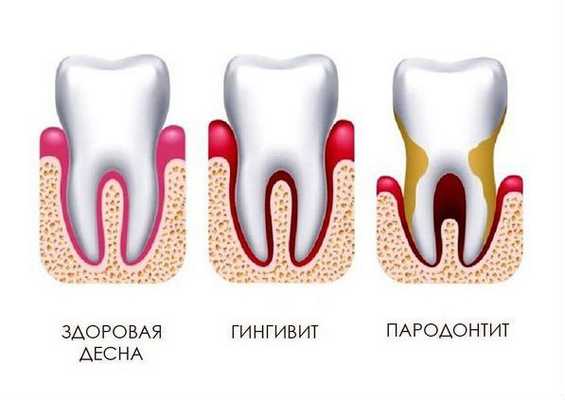
Бактерии, размножающиеся между десной и зубом, могут вызывать пришеечный кариес. Кроме того, это постоянный источник неприятного запаха изо рта, от которого не избавит даже чистка зубов и использование растворов для полоскания и освежения дыхания.
В тяжёлых случаях воспалительный процесс переходит на костную ткань челюсти. Это очень опасное осложнение, которое сложно поддаётся лечению и может привести к необратимым изменениям лицевого скелета, утрате нескольких или всех зубов. Возможно развитие остеомиелита челюсти, когда разрушается костная ткань и образуются свищи — ходы, через которые гной из области корня зуба выходит в ротовую полость. Заболевание существенно ухудшает состояние пациента, приводит к общей интоксикации: слабости, снижению работоспособности, повышению температуры тела, боли в мышцах и суставах.
Инфекция по кровеносному руслу может распространяться далеко за пределы ротовой полости. В этом случае возможно развитие воспалительных заболеваний ЛОР-органов: ангины Винсента, парафарингеального абсцесса. Воспаляться могут не только соседние органы. С током крови инфекция может попасть в любой орган. Если гингивит вызван стрептококком, у пациента может развиться миокардит (воспаление сердечной мышцы) или пиелонефрит ( воспаление ткани почек) [7] .
Диагностика гингивита
Диагностика начинается с того, что врач слушает жалобы пациента и собирает анамнез. Обычно клиническая картина довольно типична. Необходимо выяснить, как давно появились первые симптомы, проводилось ли какое-либо лечение. При сборе анамнеза нужно обратить внимание на наличие хронических заболеваний, гормональных нарушений, оценить состояние иммунитета. Эти факторы важны при выборе тактики лечения.
При осмотре стоматолог без труда выявит изменённый участок десны. Задача доктора — определить тяжесть поражения, оценить распространённость процесса, выявить, задействованы ли в воспалении ткани пародонта и периодонта. Также нужно выяснить причину гингивита и устранить её. Если десна постоянно повреждается острым краем коронки, то снятие воспаления — это временная мера. Без устранения повреждающего фактора болезнь будет рецидивировать.
Если есть подозрение на распространение процесса за пределы десны, необходимы дополнительные обследования, позволяющие оценить состояние корня зуба, костной ткани челюсти, пародонта. С этой целью широко используют рентгенографию [8] .
Если процесс генерализован (распространён по организму), пациенту необходимо сдать общий анализ крови. Он позволяет оценить ответ организма на воспаление и определить степень тяжести состояния.
Для диагностики используют и дополнительные методы:
- проба Шиллера — Писарева — определение гликогена, содержание которого резко возрастает при воспалении;
- определение индекса кровоточивости;
- проба Кулаженко — определение стойкости и проницаемости микроциркуляторного русла;
- полярография — определение уровня кислорода в тканях пародонта;
- реопародонтография — исследование функционального состояния сосудов тканей пародонта путём регистрации пульсирующего в них потока крови .
Часто гингивит выявляется во время профилактического осмотра. При этом пациенты не предъявляют жалоб, так как на ранних стадиях процесс может протекать бессимптомно. Именно поэтому важно каждые 6 месяцев посещать стоматолога.
Лечение гингивита
Для успешного лечения нужно в первую очередь устранить причину воспаления. С этой целью обязательно проводится удаление налёта и зубного камня.
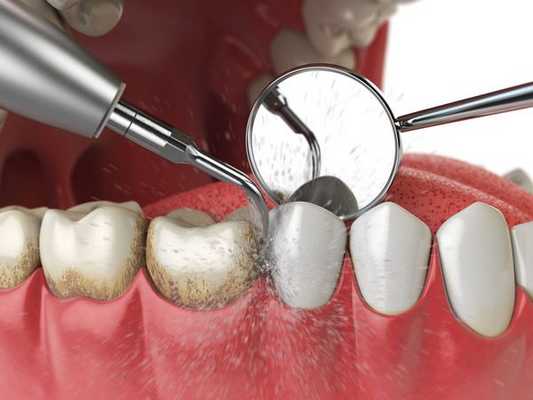
При начальных стадиях заболевания этой процедуры и использования местных антисептиков достаточно. Для снятия воспаления используется метронидазол, хлоргексидин, настои шалфея и ромашки. Для улучшения регенерации показано местное применение "Солкосерила", облепихового масла.
Если коронка, пломба или скол зуба приводят к постоянному повреждению десны, необходимо провести лечение зуба и устранить повреждающий фактор. К десне должна прилегать гладкая поверхность без шероховатостей и острых краёв.
Если воспаление имеет распространённый характер, нарушено общее самочувствие пациента, а в анализе крови есть признаки воспаления, назначают курс антибиотиков, активных в отношении грамотрицательной флоры. Также используют иммуностимуляторы и витамины [2] .
Если у пациента выражен болевой синдром, к терапии добавляют обезболивающие препараты. С этой целью используют препараты из группы НПВС (нестероидных противовоспалительных средств).
В комплексной терапии гингивита в качестве дополнительного лечения иногда используются физиотерапевтические методы лечения:
- электрофорез с алоэ, аскорбиновой кислотой;
- фонофорез с гепариновой мазью;
- облучение кварцевой лампой;
- лазеротерапия [12] ;
- дарсонвализация;
- вакуумный массаж десен [9] .
При гипертрофической форме гингивита перечисленные лечебные мероприятия могут не дать положительного результата. В таком случае для уплотнения разросшихся мягких тканей в межзубные сосочки делают инъекции склерозирующих средств. Если таким способом устранить разросшуюся грануляционную ткань не удалось, используют криодеструкцию (заморозку и удаление тканей с помощью жидкого азота), диатермокоагуляцию (иссечение слизистых тканей при помощи горячего инструмента) или удаление с помощью скальпеля — гингивэктомию [10] .

Прогноз. Профилактика
При своевременном начале лечения заболевания, особенно при катаральной форме (характеризуется покраснением и отёчностью дёсен), прогноз всегда благоприятный. Мягкие ткани полностью восстанавливаются, а при устранении причины воспаления оно не развивается снова.
При обширном поражении и разрастании десны приходится частично удалять десневые сосочки, это может привести к обнажению шеек зубов. Если таким пациентам регулярно не проводить профилактические мероприятия, быстро развивается пародонтит.
Если не пройти курс лечения, воспаление дёсен, как правило, заканчивается утратой зубов. Микрофлора поражает ткани пародонта, фиксирующие зуб, он начинает шататься и со временем выпадает.
Часто неблагоприятный прогноз при гингивите бывает у больных сахарным диабетом. Нарушение микроциркуляции, обусловленное основным заболеванием, приводит к нарушению трофики тканей, замедляет процессы регенерации. Таким пациентам необходима постоянная поддерживающая терапия, которая замедляет наступление необратимых изменений, а также контроль уровня глюкозы в крови.
Для профилактики гингивита нужно соблюдать следующие рекомендации:
- регулярно чистить зубы (2 раза в день);
- использовать щётку с мягкой щетиной;
- после еды пользоваться зубной нитью и ополаскивателем;
- каждые шесть месяцев проводить профессиональную чистку зубов у стоматолога;
- не пропускать плановые визиты к доктору;
- своевременно лечить кариес;
- если пломба или коронка травмирует десну, срочно обращаться к стоматологу;
- избегать употребления твёрдой пищи, травмирующей дёсны.
Если кровоточивость дёсен отмечается более трёх суток, не нужно заниматься самолечением, необходимо обратиться за медицинской помощью. Начальные стадии гингивита можно быстро вылечить с помощью местной терапии. Запущенное заболевание плохо поддаётся лечению и может закончиться необратимыми последствиями [11] .
Читайте также:
- Редкие нейрокожные синдромы с преимущественным поражением сосудов
- Рентгенограмма, УЗИ при зернистоклеточной опухоли пищевода
- Глаза при синдроме MORM (mental retardation, truncal obesity, retinal dystrophy, micropenis)
- Глотка. Топография глотки. Границы глотки. Строение глотки. Отделы глотки.
- Симптомы заболевания вестибулярного аппарата. Признаки поражения слуха при паротите
