Глюкокортикостероиды (ГКС): осложнения и побочные эффекты, показания к применению
Добавил пользователь Владимир З. Обновлено: 28.01.2026
В статье представлены принципы рациональной глюкокортикоидной терапии при лечении ревматических заболеваний. Они основываются на строгом соблюдении показаний к применению глюкокортикоидов, выборе способа их ведения, назначении наиболее оптимального препар
Approaches to rational glucocorticoid therapy in the treatment of rheumatic diseases I. B. Bashkova, I. V. Madyanov
The article presents the principles of rational glucocorticoid therapy in the treatment of rheumatic diseases. They are based on strict adherence to indications for the use of glucocorticoids, the choice of their method of administration, the prescription of the most optimal drug, selection of an effective dose mode, duration of treatment, dose reduction rates and timely cancellation of glucocorticoids in achieving acceptable results of treatment.
Применение глюкокортикоидов (ГК) в клинической практике стартовало в 1948 г. после успешного применения американским исследователем P. Hench кортизона при лечении ревматоидного артрита (РА). Первым пациентом, получившим данное лечение, стала Mrs. Gardner, 29-летняя женщина, страдавшая тяжелой эрозивной формой РА и вынужденная передвигаться в инвалидной коляске. Через 4 дня терапии кортизоном в дозе 100 мг в день она встала на ноги и смогла самостоятельно ходить [1]. В последующем четкое противовоспалительное действие и ряд других позитивных эффектов, свойственных ГК, нашли широкое применение не только при лечении заболеваний ревматологического, но и других профилей.
По мере накопления клинического опыта применения ГК становилось очевидным, что эти средства, наряду с положительными эффектами, способны оказывать на организм и многоплановое отрицательное действие. Балансируя между полезными и нежелательными эффектами этих препаратов, клиницисты постепенно стали формулировать рациональные подходы к применению ГК при различных заболеваниях. В полной мере это касается и ревматических заболеваний (РЗ), успешное применение ГК при которых имеет более чем 70-летнюю историю.
Первоочередное требование к назначению ГК при лечении РЗ — наличие строгих показаний к их применению (табл.), недопустимо использование этих средств в качестве терапии ex juvantibus [2].
Различают заместительную (при надпочечниковой недостаточности), супрессивную (например, при адреногенитальном синдроме) и фармакодинамическую терапию ГК. Последняя форма гормонотерапии представляет собой наиболее частый вариант применения ГК в ревматологии и, в свою очередь, делится на локальную (местную) и системную терапию. В клинической практике наиболее распространенным способом системного применения ГК является пероральный.
В зависимости от длительности действия, которое коррелирует с периодом полураспада (Т1/2) препарата, ГК подразделяются на три группы [3]:
- короткой продолжительности действия (Т1/2 — 8-12 ч) — гидрокортизон, кортизон;
- средней продолжительности действия (Т1/2 — 12-36 ч) — преднизон, преднизолон, метилпреднизолон;
- длительного действия (Т1/2 — 36-54 ч) — триамцинолон, бетаметазон, дексаметазон.
В терапии РЗ наибольшее применение находят препараты средней продолжительности действия — преднизолон и метилпреднизолон, обладающие более высокой (в 4-5 раз) глюкокортикоидной активностью по сравнению с короткодействующими аналогами, в частности, с гидрокортизоном. Системное использование препаратов длительного действия ограничено тем, что они более выраженно, в сравнении с ГК средней длительности, угнетают гипоталамо-гипофизарно-надпочечниковую (ГГН) ось. Следовательно, препараты длительного действия относительно скоро способны вызвать атрофию коры надпочечников и индуцировать надпочечниковую недостаточность, чем препараты средней длительности действия.
Существует ряд РЗ, при которых системное применение ГК нецелесообразно из-за низкой эффективности или возможности развития тяжелых осложнений. К ним относятся остеоартрит, дегенеративные поражения позвоночника, фибромиалгия, остеонекрозы, инфекционные артриты, анкилозирующий спондилит (за исключением сочетания последнего с воспалительными заболеваниями кишечника), псориатический артрит, синдром Рейно [4].
Из-за того, что при системной фармакодинамической терапии зачастую используются дозы ГК, значительно перекрывающие физиологические потребности, этому лечению всегда в той или иной мере сопутствуют нежелательные проявления. Согласно D. T. Boumpas [5], эти проявления условно можно разделить на следующие разновидности:
- характерные для инициального этапа терапии (по существу, неизбежные): бессонница, эмоциональная лабильность, повышенный аппетит и/или прибавка в массе тела;
- типичные при наличии у больных факторов риска или сопутствующем применении других лекарственных средств: артериальная гипертензия, гипергликемия (вплоть до развития сахарного диабета), ульцерогенный эффект, угревая сыпь;
- ожидаемые при применении высоких доз в течение длительного времени: кушингоидный синдром, угнетение ГГН-оси, склонность к инфекционным заболеваниям, остеонекроз, миопатия, нарушение заживления ран;
- поздние, вероятно дозозависимые: остеопороз, атрофия кожи, катаракта, атеросклероз, задержка роста у детей, жировая дистрофия печени;
- редкие и непредсказуемые: психоз, глаукома, гипертензионно-гидроцефальный синдром, эпидуральный липоматоз, панкреатит.
Важно подчеркнуть, что частота и выраженность нежелательных лекарственных реакций зависят не только от дозы и длительности приема ГК, но и от исходного состояния органов и тканей, на функцию которых они влияют.
При назначении ГК следует максимально стремиться снизить их подавляющее действие на синтез собственных гормонов, что достигается с учетом циркадных ритмов функционирования ГГН-оси.
Максимальный уровень эндогенных ГК в крови наблюдается утром в интервале от 6 до 9 ч, минимальный — в середине ночи. Таким образом, прием экзогенных ГК утром, в период максимальной секреции эндогенных стероидов, будет оказывать меньший супрессивный эффект на ГГН-ось и, соответственно, в меньшей степени способствовать развитию вторичной надпочечниковой недостаточности. Предпочтителен однократный прием всей дозы ГК в утренние часы (от 6 до 8 ч). В этом случае подавление функции коры, связанное с приемом ГК, будет совпадать с естественной реакцией ГГН-оси в утренние часы, и секреция эндогенного кортизола будет осуществляться в прежнем количестве, как только снизится концентрация циркулирующего в крови синтетического ГК [6]. В случае невозможности однократного приема ГК (например, из-за высокой дозы) допустимо деление суточной дозы на два приема, при этом 2/3 дозы назначаются в 8 ч и 1/3 — днем (около полудня). Как только станет возможным, надо стремиться перевести пациента в течение 1-2 недель на однократный утренний прием всей суточной дозы ГК [4]. При этом важно помнить, что назначение ГК в вечерние часы в наибольшей степени угнетает ГГН-ось — считается, что опаснее давать 5 мг преднизолона вечером, чем 20 мг утром. Во время так называемой физиологической секреторной паузы, длящейся в период с 20 ч до 3 ч, ГГН-ось наиболее чувствительна к стероидам, поэтому нерациональное (без учета циркадных ритмов функционирования ГГН) назначение ГК может привести к нарушению секреции эндогенного кортизола. В силу указанных причин не пригодны для циркадной терапии ГК длительного действия (бетаметазон, дексаметазон, триамцинолон), что существенно ограничивает их применение при длительной терапии РЗ.
Следует иметь в виду, что ГК, относящиеся к одной и той же по длительности действия группе, могут несколько отличаться между собой, что также необходимо учитывать при выборе препарата. Например, замечено, что среди ГК средней продолжительности действия применение преднизолона чаще ассоциируется с развитием остеопороза, асептических некрозов головок длинных трубчатых костей, повреждением слизистой оболочки верхних отделов желудочно-кишечного тракта (ЖКТ), геморрагическими высыпаниями [7]. Причем, как показано нами, такое осложнение, как асептический некроз костей, при использовании высоких доз преднизолона может возникнуть за достаточно короткое время [8]. Из препаратов этой группы чаще предпочтение отдается метилпреднизолону. По крайней мере, это средство рассматривается в качестве препарата выбора у пациентов с нестабильной психикой, избыточной массой тела, с сопутствующими заболеваниями ЖКТ, при атрофии скелетной мускулатуры [7].
Для парентерального введения (внутривенного и внутримышечного) используют только гомогенные хорошо растворимые соли ГК, к которым относятся сукцинаты (гидрокортизона натрия сукцинат, метипреднизолона натрия сукцинат), гемисукцинаты (гидрокортизона гемисукцинат), фосфаты (бетаметазона динатрия фосфат). Напротив, для внутрисуставной терапии больше подходят труднорастворимые соли ГК, в частности, ацетаты (гидрокортизона ацетат, метилпреднизолона ацетат, триамцинолона ацетат) и дипропионаты (бетаметазона дипропионат) [9].
При продолжительности приема ГК более 10 дней рекомендуется постепенное снижение дозы препарата для профилактики синдрома «отмены» и предупреждения обострения патологического процесса. Принято считать, что при достижении клинико-лабораторной ремиссии и снижении активности заболевания наиболее целесообразна «волнообразная» схема уменьшения дозы ГК. Как правило, суточную дозу уменьшают на 1/4-1/2 таблетки каждые 5-10-14 дней до достижения дозы 10 мг/сут (в пересчете на преднизолон), далее темпы снижения становятся еще более медленные (по 1/4 таблетки каждые 4-6 недель) [10]. Рекомендуется даже при небольшом ухудшении состояния на несколько дней вернуться к предыдущей дозе, а потом вновь попытаться уменьшить дозу. Особенно актуальна эта рекомендация в случае приближения к дозе, соответствующей физиологической потребности, то есть 5-7 мг/сут в пересчете на преднизолон.
При достижении эффективных поддерживающих доз ГК (после подавления воспалительной и иммунологической активности) можно предпринять попытку перехода на альтернирующий режим терапии — назначения удвоенной поддерживающей дозы ГК средней продолжительности действия однократно утром каждые 48 ч — для снижения вероятности подавления функции надпочечников и уменьшения выраженности побочных эффектов ГК. Однако следует учесть, что такая тактика может оказаться неприемлемой, вследствие ухудшения самочувствия пациентов в день отсутствия приема ГК [2, 4].
При длительной терапии ГК, а также на протяжении 1 года после отмены препаратов функциональные возможности надпочечников ограничены, что следует учитывать при стрессовых воздействиях, в том числе в случаях хирургических вмешательств [11].
Многообразие неблагоприятных эффектов ГК диктует необходимость принятия комплекса мер, направленных на их предупреждение или, по крайней мере, на «смягчение» их отрицательных воздействий на организм больного. Среди них — тщательный клинический и параклинический контроль за признаками потенциальных осложнений глюкокортикоидной терапии, а также проведение терапии «прикрытия» в группах риска развития этих осложнений [12, 13]. Эти меры должны включать следующие направления.
Наблюдение за динамикой массы тела. Следует добиваться соблюдения диеты пациентом. Важно осуществлять наблюдение за появлением периферических отеков.
Контроль артериального давления. Необходимо рекомендовать пациенту уменьшить потребление поваренной соли. Важно оптимизировать антигипертензивную терапию (назначаются блокаторы медленных кальциевых каналов, калийсберегающие диуретики, антагонисты рецепторов ангиотензина II и др.).
Контроль гликемии. ГК способствуют снижению толерантности к углеводам вплоть до развития явного сахарного диабета [14]. При стероидном диабете в большей мере подвержена увеличению постпрандиальная гликемия и гликемия во второй половине дня. Лечение стероидиндуцированного диабета проводится по тем же принципам, что и лечение обычного сахарного диабета.
Мониторинг липидограммы крови. Прием ГК часто приводит к дислипопротеидемии. В этих случаях может быть рекомендован прием статинов.
Оценка электролитов крови. В первую очередь речь идет об уровне калия в крови, который при лечении ГК склонен к снижению. Следует помнить, что риск развития гипокалиемии возрастает при сопутствующем применении диуретиков (за исключением калийсберегающих). Для профилактики гипокалиемии может быть рекомендован прием препаратов калия в прерывистом режиме.
Контроль за ульцерогенными эффектами ГК. Образование язв в ЖКТ традиционно относят к числу наиболее опасных осложнений глюкокортикоидной терапии. Показано, что развитие стероидных язв чаще наблюдается при применении преднизолона. В реальной клинической практике эффективным средством контроля за ульцерогенными эффектами ГК продолжает оставаться эзофагогастродуоденоскопия. Следует учитывать, что риск ульцерогенного повреждения ЖКТ возрастает при совместном использовании ГК и нестероидных противовоспалительных препаратов [15]. Для предупреждения язвообразования у пациентов с язвенным анамнезом и предрасположенных к нему лиц назначаются ингибиторы протонного насоса.
Оценка состояния костной системы. Прием ГК в дозе ≥ 2,5 мг/сут по преднизолону в течение 3 и более месяцев ассоциируется с развитием остеопороза [16]. В этих случаях показано назначение бисфосфонатов (алендроновой, ризедроновой или золедроновой кислоты). Требуется оптимизировать потребление кальция (1000-1200 мг/сут) и витамина D (600-800 МЕ/сут) и модифицировать стиль жизни (сбалансированная диета, регулярные физические упражнения, отказ от курения, ограничение потребления алкоголя, профилактика падений). Учитывая, что ГК способствуют нарушению метаболизма витамина D, в частности, снижению процессов гидроксилирования кальциферола, иногда представляется целесообразным использование в комплексном лечении стероидного остеопороза активных метаболитов витамина D, среди которых предпочтение нами отдается альфакальцидолу [17].
Особое внимание следует обращать на появление любых «новых» болей и скованности в тазобедренном, плечевом и коленном суставах, поскольку терапия ГК способствует развитию асептических некрозов костей. Это осложнение терапии ГК необратимо, и для его своевременной диагностики может потребоваться магнитно-резонансная томография «заинтересованного» сустава.
Контроль за состоянием скелетной мускулатуры. При терапии ГК имеется риск поражений мышц. Развитие миопатий (слабость и атрофия скелетных мышц, плечевого и тазового пояса) чаще ассоциируется с применением высоких доз ГК, в частности при использовании фторированных производных (триамцинолон, дексаметазон, бетаметазон). Для предупреждения потери мышечной массы рекомендуются неинтенсивные физические упражнения [18].
Важно подчеркнуть, что выраженные стероидиндуцированные миопатии являются показанием к прекращению терапии ГК [19].
Офтальмологический контроль. Следует учитывать возможное отрицательное влияние длительной терапии ГК на орган зрения. В частности, при этом виде терапии существует потенциальная угроза повышения внутриглазного давления и развития задней субкапсулярной катаракты. Поэтому периодическое измерение внутриглазного давления и исследование глаз с помощью щелевой лампы должны рассматриваться в качестве методов скрининга этих нарушений.
Контроль за развитием инфекционных осложнений. Известно, что ГК обладают иммуносупрессивным действием — подавляют активность нейтрофилов и моноцитов, вызывают лимфопению и приводят тем самым к снижению устойчивости организма к инфекциям. При наличии инфекционного процесса терапия ГК должна проводиться только в случае абсолютной необходимости под прикрытием адекватных и эффективных антибактериальных, противовирусных или противогрибковых препаратов. Возможна реактивация латентно протекающих заболеваний, таких как хронический пиелонефрит, остеомиелит, микозы, туберкулез, опоясывающий герпес и др.
Оценка других рисков, связанных с глюкокортикоидной терапией. Следует учитывать вероятность и других побочных эффектов ГК, которые могут проявляться у некоторых пациентов достаточно выразительно. В частности, ГК могут усилить тромбогенный потенциал крови, что важно учитывать у лиц, склонных к тромбозам. Замечено их многообразное влияние на нервно-психический статус, репродуктивную функцию. Их применение может сказаться на состоянии кожных покровов (истончение кожи, появление стрий и т. д.), что, из-за связанных с этим косметических дефектов, оказывает на психику пациента дополнительное угнетающее действие.
Словом, проведение глюкокортикоидной терапии предполагает постоянный и многоплановый контроль за ее возможными осложнениями. При этом важно иметь в виду, что эти осложнения могут протекать латентно и/или иметь отсроченный характер. Клиническая практика показывает, что соблюдение перечисленных принципов рациональной глюкокортикоидной терапии позволяет минимизировать риски этого лечения и обеспечить достаточную эффективность применения ГК у больных ревматологического профиля.
Заключение
Таким образом, глюкокортикоидная терапия — действенное средство в комплексном лечении большинства РЗ. Однако ее применение наряду с позитивными эффектами сопряжено с многочисленными рисками (нежелательными реакциями), которые возрастают при увеличении дозы ГК и длительности их применения. Принципы рациональной глюкокортикоидной терапии основываются на строгом соблюдении показаний к применению ГК, выборе способа их ведения, назначении наиболее оптимального препарата, подборе эффективного дозового режима, длительности лечения, темпах снижения дозы и своевременной отмене ГК при достижении приемлемых результатов лечения. Обязательным условием этого лечения является тщательный мониторинг потенциальных осложнений глюкокортикоидной терапии, в том числе с учетом индивидуальных рисков пациента, страдающего РЗ.
Литература
И. Б. Башкова* , 1 , кандидат медицинских наук
И. В. Мадянов**, доктор медицинских наук, профессор
* ФГБУ ФЦТОЭ МЗ РФ, Чебоксары
** ГАУ ДПО ИУВ МЗ ЧР, Чебоксары
Принципы рациональной глюкокортикоидной терапии при лечении ревматических заболеваний/ И. Б. Башкова, И. В. Мадянов
Для цитирования: Лечащий врач № 4/2019; Номера страниц в выпуске: 24-27
Теги: ревматоидный артрит, системная терапия, подагра, васкулит.
Применение глюкокортикостероидов (ГКС)
Глюкокортикостероиды (ГКС) - это вещества, сходные с естественными стероидными гормонами, которые вырабатывает организм. Их применение уменьшает боль, покраснение и отек в суставах и окружающих тканях.
ГКС назначают как внутрь, так и в виде инъекций.
Для внутрисуставных инъекций используются специальные препараты, действие которых достаточно длительно. ГКС начинают постепенно действовать в течение 24 ч, положительный эффект может сохраняться в течение многих дней и даже месяцев.
Когда делают инъекции ГКС
Курс внутрисуставных инъекций ГКС (как и любую другую терапию артритов) назначает только врач. При этом он учитывает тяжесть состояния, эффективность проводимого комплексного лечения, социальную ситуацию больного.
Как правило, вопрос о необходимости назначения таких инъекций возникает в следующих случаях:
- Когда боль в суставе или в окружающих тканях, связанная с воспалением, очень сильная • Если воспаление затронуло только несколько суставов
- Если боль в суставах сильно уменьшает подвижность
- Если другие препараты по каким-либо причинам не могут быть использованы
- Местная анестезия также может быть использована одновременно с ГКС. Ее проведение уменьшает боль, эффект длится 3-4 ч, пока ГКС не начнут действовать.
Как часто делают инъекции ГКС?
Этот вопрос в каждом индивидуальном случае решает врач.
Каковы преимущества инъекций ГКС?
- Боль и отек довольно быстро проходят
- Повышается подвижность суставов и активность больного
- Часто после действия инъекции выраженность болей уменьшается, и необходимость в других препаратах заметно снижается
- Их можно применять в сочетании с другими методами лечения, например с физиотерапией.
Процедура инъекции
Побочные эффекты
Так как ГКС вводят непосредственно в воспаленную область, очень небольшое количество препарата попадает в кровь и оказывает действие на другие органы и ткани организма, особенно по сравнению с приемом ГКС внутрь. Благодаря этому при инъекциях побочные эффекты ГКС минимальны.
Перед началом применения любого препарата посоветуйтесь со специалистом и ознакомьтесь с инструкцией по применению.
Осложнения после прекращения приема антикоагулянтов и глюкокортикоидов

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 10.08.2021
- Reading time: 4 минут чтения
Антикоагулянты, как и глюкокортикоиды активно применяются в медицине для лечения довольно сложных патологических состояний. К сожалению, и те и другие препараты дают побочные эффекты и при лечении, и при прекращении их приема.
Зачем выписывают антикоагулянты и аспирин
Главная задача антикоагулянтов — угнетение активности коагуляционного гемостаза для предотвращения образования тромбов. Антикоагулянты прямого действия, например, гепарин, снижают активность тромбина в крови, а непрямого действия, например, варфарин, препятствуют образованию протромбина в печени.
Похожий результат дает и ацетилсалициловая кислота, но это лекарство относится к другой группе препаратов, так как действует на свойства крови за счет блокирования циклооксигеназы тромбоцитов и обладает широким спектром других эффектов, например, обезболивает и снимает температуру.
Аспирин в дозе 75-100 мг / день показан для первичной профилактики заболеваний сосудов и сердца людям, старше 50 лет. Принимать лекарства может длиться до 10 лет.

Таблетка аспирина
Последствия отказа от ацетилсалициловой кислоты
Ацетилсалициловая кислота (ААС) необратимо подавляет выработку циклооксигеназы-1 (ЦОГ-1) в тромбоцитах. Это значит, что под воздействием аспирина тромбоциты больше никогда не смогут синтезировать этот фермент. ЦОГ-1 сможет производиться только новыми тромбоцитами, вырабатываемыми костным мозгом.
После однократного введения 75-300 мг аспирина возвращение полной активности COГ-1 во всех тромбоцитах занимает примерно 10 дней. На практике обычно наблюдается гораздо более быстрая нормализация функции тромбоцитов, измеряемая активностью ЦОГ-1 после прекращения приема ASA.
Это означает, что после 100% ингибирования (подавления) фермента, его активность увеличивается ежедневно на 10%, т.е. уже через 2 дня мы имеем активность около 20%. Когда активность циклооксигеназы-1 превышает 20%, тромбоциты восстанавливают свою агрегационную эффективность, то есть можно сказать, что антитромбоцитарного действия уже нет. Следовательно, разовый прием препарата неэффективен.
Помимо участия тромбоцитов в процессе свертывания крови, стоит отметить, что они могут инициировать образование атеросклеротически-тромботических бляшек. Роль тромбоцитов в формировании атеросклероза доказана и связана с активацией лейкоцитов. Поэтому эти элементы важны как при гемостазе, так и при воспалении. Известен «феномен возврата тромбоцитов», связанный с перепроизводством тромбоксана и нарушением фибринолиза.
Полезный антитромбоцитарный эффект АСК возникает при определенных дозах, тормозящих синтез тромбоксана А2. Введение ацетиллсалициловой кислоты в более высоких дозах ингибирует образование сосудорасширяющего простациклина.
«Эффект возврата» более выражен при приеме низких доз АСК, поскольку увеличивается выработка тромбоксана и снижается уровень простациклин. Прекращение приема аспирина может увеличить риск тромбоэмболических осложнений по сравнению с относительно низким риском развития кровотечения, если лечение АСК продолжается.
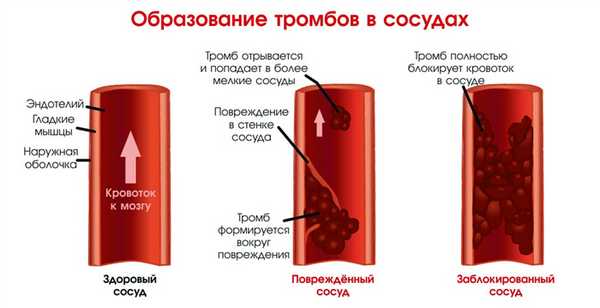
Как образуются тромбы
Последствия отказа от антитромботической терапии
Многие пациенты получают двойную антитромботическую терапию (аспирин и ингибитор P2Y12) после острых коронарных событий, что снижает риск тромбоэмболических осложнений, но связано с повышенным риском кровотечений, особенно в периоперационном периоде и в случае продления двойной терапии сверх рекомендуемого периода лечения.
Ингибиторы рецепторов P2Y12 подавляют АДФ-зависимую активацию тромбоцитов, но есть также исследования, предполагающие, что клопидогрель может ухудшать активацию тромбоцитов, связанную с арахидоновой кислотой, демонстрируя синергетические эффекты с АСК.
АДФ путем влияния фосфорилирования белка приводит к увеличению кальция в цитозоле, ингибирует образование цАМФ (циклический аденозинмоноф) и повышает концентрацию тромбоксана А2 в тромбоцитах. Выявлено, что противовоспалительные эффекты клопидогреля снижают экспрессию лиганда CD40 и CD62 P-селектина, которые присутствуют на активированных мембранах тромбоцитов.
После прекращения лечения клопидогрелем у многих пациентов отмечается чрезмерная активация тромбоцитов (в зависимости от фактора Виллебранда и т. д.) и увеличение маркеров воспаления, а также снижение ответа на АСК.
Некоторые ученые утверждали, что при прекращении приема клопидогреля «эффект возврата» особенно выражен в течение первых 90 дней и связан с потерей синергетического эффекта при АСК. Однако анализ более поздних исследований показал, что у стабильных пациентов после прекращения лечения клопидогрелем риска гиперреактивности тромбоцитов нет.
Рекомендации по прекращению приема антикоагулянтов
В клинической практике доступны более новые, более мощные ингибиторы рецепторов P2Y12: тикагрелор (обратимый) и прасугрел (необратимый), которые предпочтительнее клопидогреля, например, из-за более быстрого начала действия. Из-за необратимого действия прасугрела, возвращение активности тромбоцитов после прекращения действия происходит позже, чем после прекращения приема тикагрелора.
Применение обратимых ингибиторов связано с более быстрым возвращением гемостаза, что немаловажно в случае, например, срочной операции или внезапного кровотечения. Кроме этого, на сегодняшний день нет убедительных доказательств того, что прекращение терапии тикагрелором или прасугрелем в соответствии с руководящими принципами вызывает «эффект возврата». С другой стороны, повышенный риск сердечно-сосудистых событий в первую очередь связан с пациентами, которые преждевременно завершили терапию ингибиторами рецепторов P2Y12.
В руководящих принципах рекомендуется прекратить прием клопидогреля или тикагрелора за 5 дней до запланированного лечения, хотя эти два препарата различаются по фармакокинетике и фармакодинамике.
Зачем выписывают глюкокортикоиды
Глюкокортикоиды (ГКС) — это гормоны, вырабатываемые в естественных условиях корой надпочечников. Препараты ГКС служат важной частью фармакотерапии многих воспалительных, аллергических и иммунологических заболеваний. Вот лишь некоторые возможные эффекты глюкокортикоидов:
- снижают уровень лимфоцитов, эозинофилов, моноцитов, базофилов в крови, усиливая образование нейтрофилов;
- оказывают противошоковое действие, включая облегчение боли;
- повышают уровень глюкозы, понижают чувствительность к инсулину;
- ускоряют катаболизм белков;
- повышают ассимиляцию жиров в тканях;
- способствуют задержке Na, Cl, воды и выведению K и Ca;
- тормозят воспалительные процессы и т. д.
Такие лекарства могут назначаться на длительный период, но их постоянное применение чревато риском развития серьезных побочных эффектов. Например, может начаться остеопороз, развиться язвы слизистых ЖКТ, гипергликемия, ожирение, катаракта и др.
Последствия отказа от глюкокортикоидов
Незамещение глюкокортикоидов связано с гипоталамико-гипофизарно-надпочечниковым (HPA) ингибированием (подавлением). Экзогенные ГКС ингибируют кортикотропин-рилизинг-гормон (CRH) и кортикотропин (адренокортикотропный гормон, АКТГ) на основе отрицательной обратной связи.
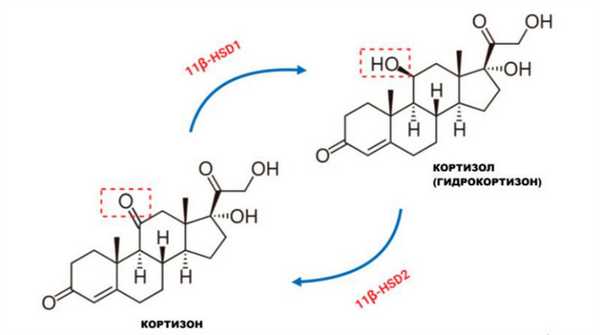
Глюкокортикоиды
АКТГ отвечает за секрецию кортизола и оказывает трофическое действие на надпочечники. Угнетение секреции АКТГ приводит к гипоплазии или даже атрофии надпочечников, что в случае внезапной отмены ГКС может спровоцировать острую надпочечниковую недостаточность.
Резкое прекращение приема ГКС может также закончиться обострением симптомов основного заболевания и появлением неспецифических симптомов отмены — анорексии, слабости, тошноты, рвоты, болей в животе, мышечно-суставной боли, лихорадки, низкого кровяного давления.
В механизме формирования этих симптомов постулируется снижение центральной трансмиссии норадреналина и дофаминергических веществ, повышение концентрации цитокинов, простагландинов, возопрессина.
Системный прием ГКС в однократной утренней дозе или иногда через день снижает риск атрофии надпочечников, но не устраняет ее полностью. Такая побочная реакция может возникать при приеме некоторых ГКС (особенно преднизолона, бетаметазона или гидрокортизона), поэтому при гастроэнтерологических условиях по определенным показаниям предпочтителен будесонид.
Считается, что длительное применение ГКС в высоких дозах связано с более высоким риском ингибирования оси HPA, но возвращение ее функции показывает большие различия. Изменения реактивности оси HPA у отдельных пациентов могут быть связаны с однонуклеотидными полиморфизмами (SFP), возникающими в минерало- или глюкокортикоидных рецепторах.
У большинства пациентов после прекращения приема длительно применяемых экзогенных ГКС функция оси HPA нормализуется в течение нескольких недель. У некоторых людей повышение АКТГ наблюдается позже (в течение 2-5 месяцев), а полная нормализация уровня кортизола происходит через 6-24 месяца, что связано с более медленным восстановлением кортикальной ткани надпочечников.
Рекомендации по прекращению приема глюкокортикоидов
Считается, что краткосрочное лечение ГКС обычно не приводит к подавлению оси HPA (гипоталамус-гипофиз-надпочечники) и постепенное снижение дозы ГКС в этом случае не является необходимым, если только оно не вызывает внезапного обострения симптомов заболевания. Однако исследования показывают, что у некоторых больных даже несколько дней лечения препаратами ГКС приводят к гистологическим изменениям в коре надпочечников (снижение массы и нарушение функции) и могут привести к индуцированному синдрому отлучения надпочечников ГКС.

Медикаментозная терапия глюкокортикоидами
С целью снижения риска острой надпочечниковой недостаточности — опасного для жизни состояния, связанного с внезапным прекращением приема ГКС, рекомендуется постепенно снижать дозы этих препаратов. Существует много режимов отлучения от ГКС в зависимости от фармакокинетических и фармакодинамических свойств, типа, дозы, силы, продолжительности действия, степени связывания белка или метаболизма ГКС. Пациенты, получавшие препарат длительного действия, на первой стадии могут заменить препарат на лекарство с более короткой продолжительностью действия, а затем постепенно снижать дозу.
В случаях сомнений выполняют тест на стимуляцию АКТГ и кортизола с использованием кортиколиберина или синтетического кортикотропина. Отсутствие или незначительное повышение уровня кортизола свидетельствует о недостаточной функции коры надпочечников. Но важно знать, что теста, позволяющего на 100% предсказать риск надпочечниковой недостаточности у пациентов, получавших ГКС, не существует.
Глюкокортикоидная терапия сегодня: эффективность и безопасность
В каких случаях проводится терапия глюкокортикоидами? Какие виды гормональной терапии используются? История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была изве
В каких случаях проводится терапия глюкокортикоидами?
Какие виды гормональной терапии используются?
История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была известна еще с 20-х годов ХХ столетия. Детальное изучение клинической значимости гормонов коры надпочечников, начатое Edward Calvin Kendall и Tadeus Reichstein, было продолжено только после того, как Philip Hench в конце 40-х годов обратил внимание на улучшение течения ревматоидного артрита при желтухе и беременности. В 1950 году всем троим была присуждена Нобелевская премия за «. открытия в отношении гормонов коры надпочечников, их структуры и биологических эффектов».
В настоящее время к ГКС относятся как естественные гормоны коры надпочечников с преимущественно глюкокортикоидной функцией — кортизон и гидрокортизон (кортизол), так и их синтезированные аналоги — преднизон, преднизолон, метилпреднизолон и др., включая галогенированные (фторированные) производные — триамцинолон, дексаметазон, бетаметазон и др. Широкий спектр физиологических и фармакологических эффектов глюкокортикоидов (адаптогенный, противовоспалительный, обезболивающий и жаропонижающий, неспецифический мембраностабилизирующий и противоотечный, противоаллергический и иммуносупрессивный, гематологический, гемодинамический и противошоковый, антитоксический, противорвотный и др.) делает эти препараты чуть ли не универсальными лекарственными средствами, и сегодня трудно найти такое патологическое состояние, при котором на том или ином этапе развития они не были бы показаны. Среди показаний в первую очередь можно выделить так называемые ревматические заболевания, болезни почек, крови, аллергические заболевания, трансплантации, ургентные состояния.
В зависимости от цели различаются три варианта терапии ГКС; при этом любая из них может быть как ургентной, так и плановой.
- Заместительная терапия, проводимая при надпочечниковой недостаточности, должна имитировать как базальную секрецию надпочечников и ее суточный ритм, так и ее усиление при стрессе; при этом используемые дозы близки к суточной секреции гормона. Здесь предпочтительнее применять естественный гормон — гидрокортизон (солу кортеф), обладающий глюкокортикоидной и определенной минералокортикоидной активностью, в дозе от 20-25 до 30-37,5 мг в сутки. При незначительном выпадении минералокортикоидной функции (небольшие потери соли) бывает достаточно его одного. При выраженной потере соли или при использовании эквивалентных доз преднизолона (от 5 до 7,5 мг), который может оказаться более эффективным, добавляется кортикостероид с выраженной минерало- и некоторой глюкокортикостероидной активностью — флудрокортизон (кортинефф, кортеф). На практике применяются те минимальные дозы, которые обеспечивают хорошее самочувствие и работоспособность, нормальный уровень АД и электролитов крови. При стрессе доза гидрокортизона может достигать 250-300 мг в сутки. Для имитации ритма секреции 2/3 дозы назначаются в 8 часов и 1/3 — в 16.
- При блокирующей (подавляющей) терапии используется эффект, чаще всего рассматриваемый как побочный, — блокада оси гипоталамус-гипофиз-кора надпочечников (ГГКН). Так, при терапии адреногенитального синдрома вводимые извне ГКС кроме заместительной выполняют и блокирующую функцию в отношении гиперсекреции АКТГ и андрогенов. ГКС подавляют и секрецию ТТГ, что наряду со снижением уровня тиреоидсвязывающего глобулина и торможением конверсии Т4 в Т3 уменьшает тиреоидную активность и используется при лечении тиреотоксических кризов. Наиболее активно ось ГГКН подавляется естественными ГКС или препаратами с длительным тканевым периодом полураспада (фторированные гормоны — дексаметазон, бетаметазон); при этом применяются как физиологические, так и более высокие (фармакодинамические) дозы.
- Большинство показаний к фармакодинамической терапии базируются на одной особенности ГКС — уникальном сочетании противовоспалительного и иммунодепрессивного эффектов. Это сочетание лежит в основе традиционных представлений о том, что так называемые ревматические болезни, где воспаление является следствием иммунопатологического процесса, служат чуть ли не абсолютным показанием к ее проведению.
В отличие от плановой терапии применение ГКС в ургентных ситуациях носит, как правило, симптоматический, реже патогенетический характер и не заменяет, а дополняет другие методы лечения. В рамках неотложной терапии ГКС применяются при острой надпочечниковой недостаточности, тиреотоксическом кризе, аллергических заболеваниях (сывороточная болезнь, анафилактический шок, бронхиальная астма, крапивница, отек Квинке), заболеваниях печени (печеночно-клеточная недостаточность), неврологических заболеваниях (туберкулезный и бактериальный менингит, некоторые формы отека мозга), различных видах шока (кроме кардиогенного).
Из-за обилия побочных эффектов терапия ГКС направлена в основном на достижение максимального эффекта при назначении минимальных доз, величина которых определяется заболеванием и не зависит от массы тела и возраста; доза корректируется в соответствии с индивидуальной реакцией. Приняты две принципиально разные схемы назначения ГКС:
- начиная с наименьшей возможной дозы, увеличивают ее при недостаточном эффекте до оптимальной; при этом возникает опасность увеличения сроков лечения, потери эффективности и развития побочного действия;
- начиная с максимальных суточных доз, их снижают после получения клинического эффекта; при этом достигается скорейший эффект, уменьшаются длительность лечения и суммарная доза ГКС.
В зависимости от суточной дозы (в пересчете на преднизолон) и длительности применения ГКС принято выделять несколько видов терапии, имеющих различные показания:
- в ситуациях, непосредственно угрожающих жизни, назначается интенсивная терапия сверхвысокими (до 500-4000 мг внутривенно) или средними/высокими (25-150 мг внутрь) дозами (пероральная доза преднизолона эквивалентна примерно 1/6 внутривенной) — такая терапия может проводиться несколько дней и не требует постепенной отмены;
- при тяжелых обострениях или при хроническом течении тяжелых заболеваний (лейкозы, некоторые коллагенозы, гемолитическая анемия, тромбоцитопении) проводится лимитированная терапия, ограниченная неделями при использовании внутрь высоких доз (80-200 мг) и неделями или месяцами в случае применения средних доз (25-60 мг); максимальные дозы, назначаемые вначале, по мере улучшения состояния ступенчато уменьшаются с последующим переходом на поддерживающие;
- при ряде хронических заболеваний (бронхиальная астма, ревматоидный артрит) проводится длительная терапия низкими дозами (до 10 мг), однако дозы менее 5 мг скорее всего являются лишь заместительными и дают клинический эффект только при атрофии коры надпочечников, индуцированной длительной глюкокортикоидной терапией.
Результат терапии ГКС зависит не только от дозы, но и от режима дозирования. Наиболее перспективными можно считать прерывистые схемы применения, когда за счет увеличения суточной дозы препарат принимается не каждый день. Самой эффективной представляется внутривенная пульс-терапия максимальными дозами, однако она оказывается и самой небезопасной. Значительно более безопасным должен быть признан режим «мини-пульс», который, однако, уступает по эффективности пульс-терапии. Столь же эффективно назначение умеренной/высокой дозы, разделенной на несколько приемов; но по безопасности этот режим уступает «мини-пульсу». Далее по эффективности следуют альтернирующий режим (через день удвоенные суточные дозы с последующим постепенным уменьшением) и режим ежедневного однократного назначения умеренной/высокой дозы; первый из них безопаснее и по этому критерию приближается к «мини-пульсу». Наиболее безопасна терапия низкими дозами, которая, однако, обеспечивает лишь поддерживающий эффект. При всех ежедневных схемах ГКС следует назначать в ранние утренние часы (между 6 и 8 часами); если же одноразовый прием невозможен из-за величины дозы, 2/3 дозы назначаются в 8 часов и 1/3 — днем (около полудня). При любом режиме дозирования по достижении планируемого эффекта доза постепенно снижается до поддерживающей или препарат отменяется вовсе.
Важной проблемой терапии ГКС является выбор препарата. Фармакокинетические и фармакодинамические свойства ГКС, включая их побочные эффекты, существенно различаются у отдельных препаратов (табл. 1, табл. 2). Приняв за единицу выраженность различных эффектов гидрокортизона, можно получить количественные характеристики активности отдельных препаратов. При сравнении ГКС чаще всего анализируется противовоспалительное действие этих препаратов, в соответствии с которым и рассчитывается эквивалентная пероральная доза, снижающаяся по мере увеличения противовоспалительной активности. Ее возрастание, параллельное увеличению длительности действия отдельных ГКС, сопровождается уменьшением минералокортикоидной активности, которой у метилпреднизолона (солу-медрола) и фторированных соединений вообще можно пренебречь.
Соотношение терапевтического и побочных эффектов позволяет утверждать, что в настоящее время препаратом выбора для длительной и пожизненной терапии является метилпреднизолон (солу-медрол). В настоящий момент солу-медрол широко используется в лечении аутоиммунных заболеваний, в трансплантологии и интенсивной терапии. Многообразие форм выпуска позволяет использовать препарат во всех возрастных категориях в оптимальных дозировках.
Вторым по эффективности препаратом остается в большинстве случаев преднизолон. Во многих же ургентных ситуациях определенными достоинствами обладают фторированные соединения: дексаметазон (дексазон, дексона) и бетаметазон (целестон, дипроспан). Однако в случае неотложной терапии, при которой противовоспалительное действие не играет ведущей роли, сравнительная оценка эффективности и безопасности различных препаратов весьма затруднительна по крайней мере по двум причинам:
- соотносить эффективность и безопасность различных препаратов можно только на основе их эквивалентных доз. Между тем, если для различных побочных эффектов отдельных ГКС имеются характеристики относительной активности, из всех лечебных эффектов сравнивается только противовоспалительный, в соответствии с которым и рассчитывается эквивалентная доза;
- о соотношении доз при пероральном и парентеральном применении конкретных препаратов отсутствуют однозначные данные даже тогда, когда речь идет о противовоспалительном эффекте, не говоря уже о других лечебных или побочных свойствах.
В связи с вышеуказанными трудностями была предложена условная эквивалентная единица (УЭЕ), за которую принимаются минимальные эффективные дозы. Показано, что выраженные в УЭЕ максимальные суточные эффективные дозы фторированных ГКС (дексаметазона и бетаметазона) в пять раз меньше, чем у негалогенированных препаратов. Это обеспечивает не только более высокую эффективность и безопасность данной группы препаратов, назначаемых в определенных ситуациях, но и их фармакоэкономические преимущества.
Как бы тщательно ни проводился выбор препарата, режима дозирования и вида терапии, полностью предотвратить развитие тех или иных побочных эффектов при применении ГКС не удается. Характер побочных реакций может зависеть от ряда причин (табл. 3).
Вероятность и выраженность подавления оси ГГКН с развитием вначале функциональной недостаточности, а позже и атрофии коры надпочечников определяются дозой и длительностью терапии. Прекращение глюкокортикоидной терапии почти всегда сопряжено с угрозой развития острой надпочечниковой недостаточности.
Частым побочным действием ГКС оказываются инфекционные осложнения, которые в этом случае протекают атипично, что связано с противовоспалительной, аналгетической и жаропонижающей активностью этих средств. Это затрудняет своевременную диагностику и требует проведения ряда профилактических мероприятий. Из-за склонности к генерализации, затяжному течению, тканевому распаду и резистентности к специфической терапии эти осложнения становятся особенно грозными. Столь же коварны и «стероидные язвы», отличающиеся бессимптомным течением и склонностью к кровотечениям и перфорациям. Между тем желудочный дискомфорт, тошнота, другие диспепсические жалобы на фоне приема ГКС чаще не связаны с поражением слизистой. Экзогенный синдром Кушинга как осложнение терапии ГКС встречается далеко не всегда, однако отдельные нарушения метаболизма, гормональной регуляции и деятельности тех или иных систем развиваются почти во всех случаях глюкокортикоидной терапии.
С сожалением приходится отметить, что утверждение Е. М. Тареева, назвавшего терапию ГКС трудной, сложной и опасной, до сих пор справедливо. Как писал Тареев, такую терапию гораздо легче начать, чем прекратить. Однако ответственный подход к лечению позволяет значительно повысить его безопасность. Это достигается благодаря строгому учету противопоказаний (абсолютных среди которых нет) и побочных эффектов ГКС (оценка отношения «ожидаемый эффект/предполагаемый риск»), а также проведению «терапии прикрытия» в группах риска (антибактериальные препараты при хронических очагах инфекции, коррекция доз сахароснижающих средств или переход на инсулин при сахарном диабете и др.). Особое место при длительном применении ГКС занимает метаболическая терапия, которая проводится в целях предупреждения и коррекции нарушений электролитного обмена и катаболических процессов в первую очередь в миокарде (дистрофия) и костной ткани (остеопороз). Однако наиболее надежным путем обеспечения безопасности терапии ГКС остается соблюдение основного принципа клинической фармакологии и фармакотерапии — назначение лечения по строгим показаниям.
В. В. Городецкий, кандидат медицинских наук
А. В. Тополянский, кандидат медицинских наук
Глюкокортикоиды: мифы и правда
Одни их боятся, другие не представляют себе жизни без них. Все это о глюкокортикостероидах. Глюкокортикостероиды (ГКС) — это стероидные гормоны, которые вырабатываются в коре надпочечников.
Контролирует выработку и уровень этих гормонов система, в которую входят структуры головного мозга: гипоталамус, гипофиз и сами надпочечники. Главным является гипоталамус, он чувствителен к количеству гидрокортизона в плазме крови и стрессу. Если уровень гидрокортизона в крови низкий или случился стресс (напряжение, повреждение, вторжение инфекции) гипоталамус вырабатывает специальное вещество, которое активирует гипофиз. Гипофиз, в свою очередь, выделяет в кровь адренокортикотропный гормон. Он уже действует на надпочечники и стимулирует их на продукцию глюкокортикостероидных гормонов. Когда уровень этих веществ в крови поднимается до нужной концентрации, гипоталамус прекращает стимулировать эту цепочку. Также работу гипофиза и надпочечников могут стимулировать провоспалительные цитокины. Наличие большого количества ГКС угнетает их производство. Так в упрощенном виде происходит взаимодействие и регуляция синтеза глюкокортикостероидов в организме. Надпочечники активно вырабатывают гормоны утром с 6-8 часов, а вечером и ночью их активность минимальна.
На клеточном уровне глюкокортикостероиды попадают в клетку и повышают скорость производства белков с противовоспалительным действием. Эффект проявляется не сразу, а через несколько часов, так как на синтез этих веществ требуется время.
Действие в организме
Противовоспалительное
Гормоны коры надпочечников оказывают противовоспалительное действие, так как влияют на многие звенья этого процесса. Они угнетают синтез веществ способствующих развитию реакции воспаления и наоборот стимулируют образование противовоспалительных элементов. Уменьшают капиллярную проницаемость, что снижает образование отека. Снижают образование рубцовой ткани в зоне воспаления. Уменьшают выраженность немедленных аллергических реакций.
Действие ГКС настолько широкое, что может использоваться при любом типе воспаления. Например, при аллергиях, травмах, инфекциях. Да, это не уберет причину проблемы, но может сдержать симптомы, иногда разрушительные для организма.
Подавление иммунитета
Четко определить черту, когда противовоспалительное действие перейдет в подавление иммунитета нельзя. Вмешательство в иммунные механизмы приводит к разрегулированности иммунитета. Какие-то процессы угнетаются, другие и вовсе блокируются. Это оказывается полезным при аутоиммунных заболеваниях, трансплантации органов и тканей.
Обмен веществ
Глюкокортикостероиды могут ускорять и замедлять образование ферментов, играющих роль в обмене веществ.
Углеводный обмен. Способствуют откладыванию гликогена в печени. Ткани становятся менее чувствительны к глюкозе отчего повышается уровень сахара в крови. Тормозится действие инсулина.
Белковый обмен. Усиливают распад белка и снижают его продукцию. Это преобладает в коже, костях, мышцах. Проявиться это может похудением, мышечной слабостью, истончением кожи, стриями, кровоизлияниями. Снижение синтеза белка становится одной из причин замедления регенеративных процессов. У детей замедляется рост.
Липидный обмен . Происходит перераспределение жировых отложений. Количество жира на руках и ногах уменьшается, а на теле (спина, плечи) и лице, наоборот, накапливается. Может нарушаться липидный профиль крови и возникать гиперхолистеринэмия.
Водно-солевой обмен. В почках задержка ионов натрия вызывает постепенное увеличение объема циркулирующей крови и повышение артериального давления. Возникает дефицит калия.
В почках задержка ионов натрия вызывает постепенное увеличение объема циркулирующей крови и повышение артериального давления.
Кальций. ГКС снижают всасывание кальция из желудочно-кишечного тракта и повышают его выведение почками, что может вызвать гипокальциемию и гиперкальциурию. При длительном назначении ГКС нарушение обмена кальция вместе с распадом белкового компонента в костной ткани приводит к развитию остеопороза.
Кровь
Применение ГКС снижает в крови количество эозинофилов, моноцитов и лимфоцитов. Содержание эритроцитов, ретикулоцитов, нейтрофилов и тромбоцитов возрастает. Так действует даже однократное введение с достижением эффекта через 4-6 часов. Восстановление исходного состояния происходит через 24 ч. При продолжительном приеме изменения в крови могут оставаться до 1-4 недель.
Угнетение гипоталамо-гипофизарно-надпочечниковой системы
Так как прием ГКС угнетает производство собственных гормонов, может развиться недостаточность функции коры надпочечников. А проявится она при резкой отмене препарата. Риск возникает уже после 2 недель приема.
Противострессовое действие
Говоря про стрессовое воздействие, имеется в виду повреждение организма (травма, инфекция), которое может нарушить его баланс. ГКС повышают устойчивость организма к стрессу. В условиях тяжелого стресса уровень кортизола может увеличиться более чем в 10 раз. Это нужно, чтобы избыточная воспалительная реакция не привела к фатальным последствиям и была под контролем. Сами цитокины, которые вырабатываются при воспалении стимулируют выработку гормонов надпочечниками, которые ограничивают степень воспаления. Так множество связанных путей регуляции помогают организму поддерживать баланс и выживать в сложных условиях.
Действие на другие гормоны
Глюкокортикостероиды могут оказывать влияние на организм, усиливая действие других гормонов. Так воздействие малых доз ГКС способствует расщеплению жира, оказывает тонизирующее действие на сердечно-сосудистую систему. В результате происходит нормализация сосудистого тонуса, повышается сократимость миокарда и уменьшается проницаемость капилляров. Наоборот, нехватка естественных ГКС характеризуется низким сердечным выбросом, расширением артериол и слабой реакцией на адреналин.
Виды препаратов
На группы эту группу гормонов можно разделить по скорости выведения из организма:
- от 8 до 12 часов, короткого действия: гидрокортизон, кортизон;
- от 18 до 36 часов, средней продолжительности: преднизолон, метилпреднизолон, триамцинолон;
- от 36 до 54 часов, длительного действия: дексаметазон, бетаметазон.
Гормоны также отличаются по выраженности глюкокортикоидных и минералкортикоидных свойств и по силе воздействия на систему регуляции гипоталамус-гипофиз-надпочечники.
Применение
Глюкокортикостероиды применяются врачами только если это необходимо.
Эти лекарства используются в анестезиологической и реаниматологической практике. Внутривенное введение ГКС во время анестезии поддерживает показатели гемодинамики. При тяжелых нарушениях кровообращения препараты способствуют увеличению тканевой перфузии и венозного оттока, нормализацию периферического сопротивления и сердечного выброса, стабилизацию клеточных и лизосомальных мембран.
При тяжелых аллергических реакциях внутривенное введение адекватных доз ГКС оказывает терапевтический эффект, однако начало действия ГКС при этом отсрочено. Так, основные эффекты гидрокортизона развиваются только спустя 2-8 ч после его введения.
Глюкокортикостероиды оказывают выраженный эффект при надпочечниковой недостаточности, развившейся до и во время оперативных вмешательств. Для проведения заместительной терапии используют гидрокортизон, кортизон и преднизолон.
Введение длительно действующих ГКС практикуется для профилактики синдрома дыхательных расстройств у недоношенных детей, что снижает риск осложнений и смерти на 40-50%.
Формы препаратов
Выпускаются различные формы гормональных препаратов. Это сделано не только для удобства применения, но и позволяет получить нужный эффект. Таблетированные формы используются для лечения системных заболеваний, аллергий.
В лечении заболеваний дыхательной системы используются ингаляционные формы ( Симбикорт , Пульмикорт , Серетид ) . Так как их применение обычно длительно, они сделаны так, чтобы оказывать минимальное системное действие.
Для лечения аутоиммунных воспалительных заболеваний суставов производят препараты для внутрисуставного введения ( Дипроспан , Кенолог ). Они высвобождаются медленно и действие 1 инъекции на сустав может быть достаточно долгим.
Мази ( Синафлан ), гели используются в дерматологии для лечения кожных заболеваний, аллергий.
Нежелательные эффекты
Нежелательные эффекты связаны с длительностью лечения и дозой. Чаще при длительном использовании более 2 недель и высоких дозах. При этом высокие дозы гормонов в течение 1-5 дней обычно не вызывают развития нежелательных явлений. Проведение заместительной терапии считается безопасным, так как используют очень низкие дозы ГКС.
Нежелательные эффекты:
1. На начальных этапах приема:
- плохой сон;
- эмоциональная возбудимость;
- избыточный аппетит, прибавка в весе.
2. При сочетании приема ГКС и других препаратов, болезней:
- гипертоническая болезнь;
- повышенный уровень сахара и риск диабета;
- язвы пищеварительной системы;
- акне.
3. Возможные при применении на длительный срок с большими дозами:
- кушингоид;
- подавление работы надпочечников;
- ослабление защиты от инфекционных заболеваний;
- остеонекроз;
- миопатия;
- плохое заживление при травмах.
4. Поздние и развивающиеся постепенно (связанные с накоплением):
- остеопороз;
- катаракта;
- атеросклероз;
- задержка роста у детей;
- жировая дистрофия печени.
Резкое прекращение краткосрочной (в течение 7-10 дней) терапии ГКС не сопровождается развитием острой надпочечниковой недостаточности, хотя некоторое подавление синтеза кортизола все же происходит. Более длительная терапия ГКС (дольше 10-14 дней) требует постепенной отмены препаратов.
Прием синтетических препаратов с длительным сроком действия вызывают нежелательные эффекты. Резкое прекращение приема гормонов может привести к острой надпочечниковой недостаточности. Восстановление работы надпочечников может занять от нескольких месяцев до полутора лет.
Противопоказания

Глюкокортикостероиды не следует применять без рекомендации врача.
Абсолютных противопоказаний нет, если польза больше, чем риск. Особенно в условиях неотложных ситуаций и краткосрочного применения. При длительном лечении относительными противопоказаниями могут быть:
- декомпенсированный сахарный диабет;
- симптомы психических заболеваний;
- обострение язвенной болезни желудка и двенадцатиперстной кишки;
- выраженный остеопороз;
- тяжелая гипертония;
- тяжелая сердечная недостаточность;
- активная форма туберкулеза;
- системные микозы и грибковые поражения кожи;
- острые вирусные инфекции;
- тяжелые бактериальные заболевания;
- первичная глаукома;
- беременность.
Без глюкокортикостероидов сегодня в медицине не обойтись. Так как действие их очень разнообразно, врач должен подобрать препарат, подходящий именно в вашем случае.
Читайте также:
