Гормоны поджелудочной железы. Островки Лангерганса. Соматостатин. Амилин. Регуляторные функции гормонов поджелудочной железы.
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Поджелудочная железа - железа со смешанной функцией. Морфологической единицей железы служат островки Лангерганса, преимущественно они расположены в хвосте железы. Бета-клетки островков вырабатывают инсулин, альфа-клетки - глюкагон, дельта-клетки - соматостатин. В экстрактах ткани поджелудочной железы обнаружены гормоны ваготонин и центропнеин.
Инсулин регулирует углеводный обмен, снижает концентрацию сахара в крови, способствует превращению глюкозы в гликоген в печени и мышцах. Он повышает проницаемость клеточных мембран для глюкозы: попадая внутрь клетки, глюкоза усваивается. Инсулин задерживает распад белков и превращение их в глюкозу, стимулирует синтез белка из аминокислот и их активный транспорт в клетку, регулирует жировой обмен путем образования высших жирных кислот из продуктов углеводного обмена, тормозит мобилизацию жира из жировой ткани.
В бета-клетках инсулин образуется из своего предшественника проинсулина. Он переносится в клеточные аппарат Гольджи, где происходят начальные стадии превращения проинсулина в инсулин.
В основе регуляции инсулина лежит нормальное содержание глюкозы в крови: гипергликемия приводит к увеличению поступления инсулина в кровь, и наоборот.
Паравентрикулярные ядра гипоталамуса повышают активность при гипергликемии, возбуждение идет в продолговатый мозг, оттуда в ганглии поджелудочной железы и к бета-клеткам, что усиливает образование инсулина и его секрецию. При гипогликемии ядра гипоталамуса снижают свою активность, и секреция инсулина уменьшается.
Гипергликемия непосредственно приводит в возбуждение рецепторный аппарат островков Лангерганса, что увеличивает секрецию инсулина. Глюкоза также непосредственно действует на бета-клетки, что ведет к высвобождению инсулина.
Глюкагон повышает количество глюкозы, что также ведет к усилению продукции инсулина. Аналогично действует гормоны надпочечников.
Вегетативная нервная система регулирует выработку инсулина посредством блуждающего и симпатического нервов. Блуждающий нерв стимулирует выделение инсулина, а симпатический тормозит.
Количество инсулина в крови определяется активностью фермента инсулиназы, который разрушает гормон. Наибольшее количество фермента находится в печени и мышцах. При однократном протекании крови через печень разрушается до 50 % находящегося в крови инсулина.
Важную роль в регуляции секреции инсулина выполняет гормон соматостатин, который образуется в ядрах гипоталамуса и дельта-клетках поджелудочной железы. Соматостатин тормозит секрецию инсулина.
Активность инсулина выражается в лабораторных и клинических единицах.
Глюкагон принимает участие в регуляции углеводного обмена, по действию на обмен углеводов он является антагонистом инсулина. Глюкагон расщепляет гликоген в печени до глюкозы, концентрация глюкозы в крови повышается. Глюкагон стимулирует расщепление жиров в жировой ткани.
Механизм действия глюкагона обусловлен его взаимодействием с особыми специфическими рецепторами, которые находятся на клеточной мембране. При связи глюкагона с ними увеличивается активность фермента аденилатциклазы и концентрации цАМФ, цАМФ способствует процессу гликогенолиза.
Регуляция секреции глюкагона. На образование глюкагона в альфа-клетках оказывает влияние уровень глюкозы в крови. При повышении глюкозы в крови происходит торможение секреции глюкагона, при понижении - увеличение. На образование глюкагона оказывает влияние и передняя доля гипофиза.
Гормон роста соматотропин повышает активность альфа-клеток. В противоположность этому гормон дельта-клетки - соматостатин тормозит образование и секрецию глюкагона, так как он блокирует вхождение в альфа-клетки ионов Ca, которые необходимы для образования и секреции глюкагона.
Физиологическое значение липокаина. Он способствует утилизации жиров за счет стимуляции образования липидов и окисления жирных кислот в печени, он предотвращает жировое перерождение печени.
Функции ваготонина - повышение тонуса блуждающих нервов, усиление их активности.
Функции центропнеина - возбуждение дыхательного центра, содействие расслаблению гладкой мускулатуры бронхов, повышение способности гемоглобина связывать кислород, улучшение транспорта кислорода.
Нарушение функции поджелудочной железы.
Уменьшение секреции инсулина приводит к развитию сахарного диабета, основными симптомами которого являются гипергликемия, глюкозурия, полиурия (до 10 л в сутки), полифагия (усиленный аппетит), полидиспепсия (повышенная жажда).
Увеличение сахара в крови у больных сахарным диабетом является результатом потери способности печени синтезировать гликоген из глюкозы, а клеток - утилизировать глюкозу. В мышцах также замедляется процесс образования и отложения гликогена.
Физиология эндокринной системы
Гормоны островков поджелудочной железы. Регуляция обмена веществ
Островки Лангерганса поджелудочной железы состоят из:
- α-клеток - продуцируют глюкагон;
- β-клеток - продуцируют инсулин;
- δ-клеток- продуцируют соматостатин и др. гормоны (см. Приложения 1 и 2).
Эти гормоны, помимо системного действия, паракринно модулируют секрецию друг друга, работая как мини-орган: инсулин подавляет продукцию глюкагона, глюкагон стимулирует продукцию инсулина и соматостатина, а соматостатин подавляет продукцию и инсулина, и глюкагона.
Основным стимулятором секреции инсулина является глюкоза, поступающая в кровь из желудочно-кишечного тракта при приеме пищи. Глюкоза стимулирует секрецию инсулина, действуя прямо на β-клетки 93 , а также, увеличивая секрецию гормонов ЖКТ, стимулирующих продукцию инсулина (глюкагона, GLP-1 94 , ГИП 95 , гастрина, секретина, холецистокинина и др.). Помимо этого, продукцию инсулина повышают СТГ, плацентарный лактоген, эстрогены и прогестины. Во время беременности продукция инсулина также растет.
Секреция инсулина снижается на фоне голодания, физической нагрузки, стресса - ситуаций, сопровождаемых увеличенной потребностью в углеводах и жирах. При этом растет продукция глюкагона α-клетками и глюкагоноподобных пептидов кишечником. Гормон жировой ткани лептин и инсулин объединены реципрокными связями: лептин снижает продукцию инсулина, а инсулин, наоборот, повышает продукцию лептина жировой тканью. К веществам, подавляющим секрецию инсулина, также относятся соматостатин и катехоламины.
Структура и механизм действия
Инсулин и несколько родственных ему сигнальных соединений объединяют в «семейство инсулина». К нему относятся:
- Инсулин.
- Релаксин.
- Инсулиноподобные факторы роста 96 (ИФР) 1 и 2.
Молекула инсулина состоит из двух аминокислотных цепей, A-цепи (21 а/к) и В-цепи (30 а/к), соединённых дисульфидными связями. В А-цепи имеется еще одна консервативная дисульфидная связь.
Рецептор инсулина относится к семейству гетеротетрамерных рецепторных тирозинкиназ. Он состоит из двух внеклеточных α-субъединиц и двух трансмембранных β-субъединиц (обладают тирозинкиназной активностью), соединенных дисульфидными связями. Связывание инсулина вызывает аутофосфорилирование рецептора по остаткам тирозина и фосфорилирование тирозиловых остатков других белков, включая белок-субстрат рецептора инсулина (IRS).
Инсулин - основной стимулятор утилизации и запасания углеводов:
- Облегчает поступление глюкозы в клетки мышечной и жировой ткани, индуцируя транслокацию GLUT4 97 из внутриклеточных везикул на ЦПМ.
- Активирует липогенез.
- Стимулирует синтез гликогена в печени и мышцах.
- Повышает экспрессию ферментов гликолиза.
- Снижает экспрессию ферментов
- глюконеогенеза и гликогенолиза - в печени;
- липолиза - в адипоцитах.
Усиление гликолиза под влиянием инсулина в скелетных мышцах и миокарде играет существенную роль в накоплении АТФ и обеспечении работоспособности миоцитов.
Биологический смысл утилизации углеводов под действием инсулина - их депонирование в форме жиров 98 . Под действием гормона синтез триглицеридов многократно ускоряется благодаря одновременной активации липогенеза и ингибированию липолиза. Активный липогенез обеспечивается увеличенным поступлением глюкозы, а медленный липолиз - подавлением ГЧ-липазы инсулином и торможением гидролиза липидов продуктами расщепления глюкозы.
Помимо этого, инсулин увеличивает поступление ЖК в клетку за счет перемещения липопротеинлипазы (их транспортера) в ЦПМ. Во время действия инсулина, накапливаемые клеткой липиды не секретируются и происходит их депонирование до прекращения действия гормона или поступления других стимулов.Выступая в качестве ростового фактора, инсулин активирует синтез белка и препятствует его деградации. Это осуществляется, главным образом, благодаря фосфорилированию/дефосфорилированию факторов трансляции и белков рибосом.
Инсулин оказывает влияние на потребление пищи, повышая продукцию лептина (гормона насыщения) и снижая продукцию грелина (гормона голода). Поэтому при его низком уровне усиливается чувство голода и пищевое поведение, стимулируемые грелином. А сниженный уровень лептина ведет к сохранению энергетических запасов.
Нарушения работы инсулиновой оси приводят к развитию диабета. Диабет I типа (инсулинозависимый диабет) - заболевание, связанное с аутоиммунным повреждением β-клеток, продуцирующих инсулин. Это приводит к абсолютному дефициту инсулина и росту контринсулярных гормонов (глюкагона, адреналина, глюкокортикоидов).
Диабет II типа («инсулинонезависимый» диабет) - заболевание, первопричиной которого является развитие инсулинорезистетности на фоне генетической предрасположенности и неадекватного потребления углеводов, липидов. В этом случае уровень инсулина в крови компенсаторно растет в связи с толерантностью к инсулину (однако впоследствии снижается ниже нормы из-за истощения синтетической активности β-клеток), а концентрация контринсулярных гормонов падает.
Гормоны поджелудочной железы
Поджелудочная железа - орган пищеварительной системы. Она выполняет внешнесекреторную (экзокринную) и внутрисекреторную (эндокринную) функции. Внешнесекреторная функция поджелудочной железы реализуется выделением панкреатического сока, который содержит ферменты, участвующие в пищеварении. Внутрисекреторная функция поджелудочной железы состоит в выработке гормонов, участвующих в регуляции углеводного, жирового и белкового обмена.
Эндокринная часть поджелудочной железы представлена панкреатическими островками, или островками Лангерганса. Островки состоят из клеток, в которых синтезируются гормоны.
- b-клетки продуцируют инсулин
- a-клетки продуцируют глюкагон
- D-клетки продуцируют соматостатин и гастрин
- РР-клетки продуцируют панкреатический полипептид.
Проинсулин - белок, который синтезируется в b-клетках островков поджелудочной железы. Он практически полностью превращается в инсулин после отщепления от него молекулы С-пептида. Небольшая его доля, которая не превратилась в инсулин, поступает в кровоток в неизмененном виде. Биологическая активность проинсулина гораздо ниже, чем инсулина. Чаще всего определение уровня проинсулина применяется в диагностике инсулино́м. Инсулино́ма - это опухоль b-клеток островков Лангерганса, бесконтрольно секретирующая инсулин.
С-пептид образуется из проинсулина. Он является показателем секреции инсулина. Период полувыведения С-пептида из кровотока 30-40 минут, что на порядок дольше, чем у инсулина, а его концентрация примерно в 5 раз больше концентрации инсулина. С-пептид полезно определять у пациентов, которые наблюдаются после удаления поджелудочной железы, для диагностики гипогликемических состояний, при подозрении на инсулино́му. Также С-пептид позволяет оценить уровень эндогенного инсулина, при приеме препаратов инсулина, или при наличии в крови антител к инсулину.
Глюкагон синтезируется a-клетками поджелудочной железы и является антагонистом инсулина. Его повышение служит сигналом для организма о необходимости повысить в крови уровень глюкозы. Это достигается путем распада гликогена до молекул глюкозы, или образование глюкозы альтернативным путём (глюконеогенез).
Гастрин стимулирует желудочную секрецию. Его концентрация изменяется в течение суток. После приема пищи концентрация гастрина увеличивается в 1,5-2 раза. Синтез гастрина стимулируется при снижении уровня соляной кислоты в желудке. Определение уровня гастрина применяется в диагностике и контроле лечения синдрома Золлингера-Эллисона, или гастриномы, при котором у 2/3 больных отмечается 10-кратное увеличение уровня гастрина в сыворотке натощак (>1000 пг/мл).
Действие соматостатина в рамках пищеварительной системы заключается в подавлении секреции гастрина, инсулина, глюкагона, пищеварительных ферментов. Он также подавляет секреторную активность других органов желудочно-кишечного тракта.
5. Поджелудочная железа
Поджелудочная железа выполняет две функции: экзокринную (синтез и секреция пищеварительных ферментов) и эндокринную (синтез и секре ция гормонов). Эндокринную функцию выполняют особые участки поджелудочной железы - островки Л ангерганса, занимающие около 1% ее объема. Эндокринные клетки островков Лангерганса секретируют в кровь:
- инсулин ( б ет а -клет ки );
- глюкагон ( а ль ф а -к лет ки );
- сомат ост ат ин (делы п а -к лет ки ).
По химической структуре эти гормоны относятся к белково-пептидным, а их основная физиологическая роль - регуляция углеводного обмена.
5.1. Гормоны поджелудочной железы
I. Инсулин — основной по количеству и значению гормон остров ков Лангерганса.
Эффекты дейст вия инсулина:
1) гипогликем ическое дейст вие: инсулин - единственный гормон, снижающий концентрацию глюкозы в крови . В частности, инсулин:
• повышает проницаемость клеточных мембран для глюкозы; инсулин регулирует поступление глюкозы во все ткани, исключая ЦНС, нейро ны которой являются инсулиннезависимыми - могут потреблять глюкозу в отсутствие инсулина;
• усиливает утилизацию глюкозы в клетках - ее превращение в гликоген и жиры;
2) анаболическое действие : инсулин стимулирует синтез и тормозит
распад гликогена, жиров и белков, РНК, ДНК (анаболический эффект).
2. Глюкагон — антагонист инсулина - повышает концентрацию глюкозы в крови, усиливая глюконеогенез и расщепление гликогена в печени. Г люкагон также стимулирует распад белков и жиров.
Регуляция секреции инсулина и глюкагона
В основном, осуществляется глюкозой по принципу отрицательной обратной связи. Увеличение концентрации глюкозы в крови приводит к увеличению секреции инсулина и снижению секреции глюкагона; наоборот, снижение концентрации глюкозы тормозит секрецию инсулина и усиливает секрецию глюкагона. Таким образом концентрация глюкозы поддерживается на постоянном уровне (рис. 11).
Рис. 11. Регуляция секреции инсулина и глюкагона.
Дополнительную петлю отрицательной обратной связи в этой cистеме образуют инсулин и глюкагон: глюкагон стимулирует секрецию инсулина, а инсулин тормозит секрецию глюкагона. Кроме того, секрецию обоих гормонов подавляет соматостатин дельта-клеток островков Лангерганса.
Следует добавить, что секрецию инсулина усиливают некоторые гормоны желудочно-кишечного тракта (гастрин, секретин и др.); 2) парасимпатические волокна блуждающего нерва (через Механорецепторы). Наоборот, секрецию инсулина угнетают 2) симпатические волокна (через арадренорецепторы).
5.2. Регуляция концентрации глюкозы в крови
Нормальная концентрация глюкозы в плазме крови (натощак) составляет 3,5-5,5 ммоль/л. В регуляции концентрации глюкозы в крови участвуют несколько гормонов.
Повышают концентрацию глюкозы несколько гормонов (их называют «контринсулярными»): глюкагон, глю кокортикоиды, адреналин, т ироидны е горм оны , соматотропный гормон. Секреция этих гормонов усиливается при гипогликемии или при стрессе. В результате, концентрация глюкозы в крови повышается за счет гликогенолиза (распада гликогена) и глюконеогенеза - синтеза глюкозы из неуглеводных соединений: жирных кислот (их концентрация увеличивается вследствие липолиза) и, в крайнем случае, аминокислот (образуются при распаде белков). Выходящая в кровь глюкоза потребляется, в первую очередь, нейронами ЦНС, которые с одной стороны, практически не имеют собственных запасов гликогена и поэтому очень чувствительны к гипогликемии, а с другой стороны, способны потреблять глюкозу в отсутствии инсулина, секреция которого при стрессе снижена.
Патология. Нарушение регуляции уровня глюкозы в крови может приводить к развитию сахарного диабета, основным признаком которого является стойкая гипергликемия (концентрация глюкозы в крови натощак превышает 7 ммоль/л). Повышается также концентрация глюкозы в первичной моче, вследствие чего замедляется реабсорбция воды в почках, и увеличивается диурез - количество вторичной мочи может превышать 5 л/сут.
Механизмы развития сахарного диабета разнообразны и могут быть объединены в две группы:
1 ) абсолютная недостаточность инсулина - снижение секреции инсулина вследствие генетических дефектов, иммунных поражений (3-клеток островков Лангерганса, заболеваний и повреждений поджелудочной железы, недостаточности питания (прежде всего белкового) и других причин;
2) относительная недостаточность инсулина - секреция инсулина в этом случае не снижается, или даже повышается; гипергликемия при этом связана со снижением чувствительности тканей к инсулину вследствие изменения рецепторов инсулина, ожирения, гиперсекреции контринсулярных г ормонов и других причин. Например, сахарный диабет может развиваться при акромегалии (гиперсекреция СТГ), синдроме Иценко-Кушинга (избыток глюкокортикоидов), гипертирозе (гиперсекреция Т3, Т4), феохромоцигоме (опухоль, продуцирующая катехоламины), глюкагономе (опухоль, продуцирующая глюкагон).
Глава 3. Эндокринная часть поджелудочной железы (островки лангерганса, гормоны, их функция, эффекты, механизм действия)
Поджелудочная железа состоит из двух функционально различных частей: экзокринной и эндокринной. В экзокринной части, которая составляет 97—98% массы железы, вырабатываются пищеварительные ферменты. Эндокринная часть представлена островками клеток, которые вкраплены в экзокринную часть. В поджелудочной железе сотни тысяч островков (2—3% общей массы железы).
Островки Лангерганса состоят из четырех видов клеток, которые вырабатывают глюкагон (А (альфа)-клетки), инсулин (В (бета)-клетки, соматостатин (D (дельта)-клетки) и панкреатический полипептид (РР) (F-клетки) (табл.1).
БИОСИНТЕЗ ИНСУЛИНА
Ген инсулина локализуется в коротком плече 11-й хромосомы. Предшественником
Рис.1Созревание молекулы инсулиниа
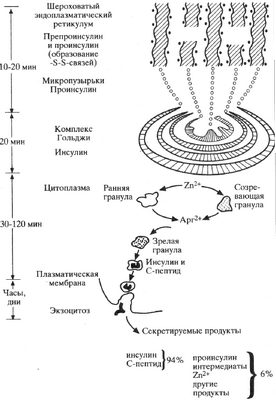
Схема 2.Схема биосинтеза инсулина и секреторного механизма бета-клеток.
молекулы инсулина является препроинсулин, который синтезируется в эндоплазматическом ретикуломе В-клеток. Сразу же, под влиянием протеолитических энзимов, препроинсулин превращается в проинсулин и транспортируется в аппарат Гольджи, где запасается в виде гранул. Там же протеолитические энзимы расщепляют проинсулин в равных количествах на инсулин и С-пептид, с остатком небольшого количества проинсулина.
Проинсулин состоит из 86 аминокислот, в виде одной цепи с молекулярным весом (MB) 9000. В него входят А- и В-цепи инсулина и соединяющий их С-пептид. Проинсулин имеет слабо выраженную биологическую активность, секретируется в кровь в небольших количествах (3—5% иммунореактивного инсулина в плазме крови). С-пептид, соединяющий А - и В-цепи инсулина в проинсулине, состоит из 31 аминокислоты в виде одной цепи. Он не обладает биологической активностью, и освобождается в кровь в равных количествах с инсулином. В связи с этим по концентрации С-пептида в плазме крови можно судить о синтетической и секреторной активности В-клеток островков. Период полураспада С-пептида в 3—4 раза длиннее, чем инсулина, так как он не катаболизируется в печени. Поэтому в базальном состоянии (натощак) концентрация С-пептида в плазме крови значительно превышает концентрацию инсулина (в 10—15 раз).
Инсулин состоит из 51 аминокислоты в виде двух цепей, соединенных двумя дисульфидными мостиками. Короткая цепь, или цепь А, состоит из 21 аминокислоты, и цепь В, или длинная цепь,— из 30 аминокислот. Один дисульфидный мостик расположен между седьмыми аминокислотами обеих цепей, другой соединяет 20-ю аминокислоту короткой цепи и 19-ю аминокислоту длинной цепи. Кроме того, в короткой цепи инсулина имеется дисульфидный мостик между 6-й и 11-й аминокислотами. Молекулярный вес человеческого инсулина 5808. У взрослого человека секретируется в кровь 30—40 ЕД инсулина в сутки. Период полураспада составляет 2—3 мин. Катаболизм происходит главным образом в печени и в почках.
Базальная секреция инсулина — это секреция его в кровь в отсутствие стимулов, т. е. натощак, при голодании и при уровне глюкозы крови 3,2—5,5 ммоль/л (54—100 мг/дл). Такая концентрация глюкозы в плазме крови не стимулирует секрецию инсулина, она необходима для поддержания базальной секреции инсулина.
Стимулированная секреция инсулина происходит в ответ на экзогенные стимулы. Наиболее мощным стимулятором секреции инсулина является глюкоза. Механизм ее действия точно не установлен. Полагают, что в В-клетках секрецию инсулина стимулируют метаболиты глюкозы, которые действуют через кальций, способствуя выходу последнего из микротрубочек клеток. Кальций стимулирует выход С-пептида и инсулина из аппарата Гольджи и секрецию их в плазму крови путем экзоцитоза. Возможно, что действие глюкозы в В-клетках на кальций связано с активацией ею циклическим аденозин монофосфатом (цАМФ).
Секрецию инсулина, но в меньшей степени, стимулируют аминокислоты, в частности лейцин, вагусные влияния, препараты сульфонилмочевины.
Стимулированную глюкозой секрецию инсулина увеличивают кишечные гормоны: холецистокинин, секретин, гастрин; аминокислота аргинин, β адренергические стимулы. Тормозят секрецию инсулина а-адренергические стимулы, катехоламины, соматостатин и некоторые лекарства: колхицин, винбластин, фенитион.
Две фазы стимулированной секреции инсулина: начальную (короткую) и медленную (длительную). Начальная фаза (следствие выхода в кровь запасенного в гранулах инсулина) продолжается в течение первых 10 мин от начала еды, затем секреция инсулина снижается и вновь медленно повышается, достигая максимума через 30—45 мин после начала стимуляции его секреции (секреция вновь синтезированного инсулина).
У здоровых лиц уровень стимулированного (постпищевого) инсулина в плазме крови редко превышает 690 пмоль/л (100 нг/мл).
Распад. Около 40% инсулина (по данным некоторых авторов, 15-20%) инактивируется почками. Гормон фильтруется в клубочках, а в проксимальных канальцах почти полностью реабсорбируется и разрушается протеолитическими ферментами.
Читайте также:
- Развитие зубов у детей и их аномалии
- Изменение болевой чувствительности. Определение чувствительности к боли
- Частота лейкозов у жителей территорий радиоактивного загрязнения
- Применение одуванчика в медицине. От чего пить сок одуванчика?
- Диагностическое заключение рентгенограммы. Рентгенологические симптомы поражения пищевода
