Гормоны в лечении остеопороза у женщин. Эстрогенотерапия
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Старение является результатом генетических, клеточных и молекулярных изменений. Большое число факторов идентифицированы как причины или следствия ассоциированного со старением снижения функциональных и репаративных процессов в организме. Состояние костной ткани во многом обусловлено указанными изменениями. Одними из главных причин потери минеральной плотности кости считаются утрата овариальной функции и дефицит женских половых гормонов.
Для устранения негативных последствий эстрогенного дефицита в период постменопаузы применяется гормональная терапия, одним из показаний к которой является остеопороз.
- КЛЮЧЕВЫЕ СЛОВА: плотность кости, остеопороз, менопауза, дидрогестерон, Эстрадиол, Фемостон
Старение - это необратимое прогрессивное снижение всех физиологических функций 1. Общее улучшение состояния здоровья населения, развитие медицинских технологий и другие положительные социальные сдвиги привели к тому, что лица старше 50 лет представляют сейчас самый быстро растущий сегмент общества [4].
Однако дегенеративные процессы, связанные со старением, становятся все большей проблемой не только отдельных людей, но и общества в целом. У лиц обоего пола с возрастом наблюдаются потеря мышечного тонуса, костной массы, снижение энергетического уровня, ослабление иммунитета, когнитивных функций, увеличение массы тела, которое приводит к повышению риска развития метаболических и сердечно-сосудистых заболеваний.
У женщин маркером старения служит прекращение овариальной функции, что сопровождается вазомоторными и психосоматическими симптомами и вносит дополнительный вклад в ухудшение сердечно-сосудистого, психического здоровья и развитие остеопороза [5].
Существует много гипотез причин старения и биологической основы постепенной утраты функций, в частности управляемые генами клеточные сценарии, хромосомные повреждения, нарушения репарации ДНК и укорочение теломеры [3, 6, 7]. К физиологическим причинам старения относят гормональный дисбаланс, избыточное потребление калорий, митохондриальную дисфункцию и окислительный стресс 8.
Рассматривая старение как мультифакторный и кумулятивный процесс, где множественные компоненты взаимодействуют друг с другом, приводя к каскаду нарушений, трудно выделить первопричину [11].
В патогенезе многих заболеваний участвуют две составляющие: генетическая предрасположенность и фенотипическая вариабельность, связанная с влияниями внешней среды. Это соответствует описанию развития менопаузального остеопороза.
Остеопороз - самая распространенная патология костей. Заболеваемость увеличивается с возрастом, в постменопаузе составляет от 13-18 до 30% случаев [12].
У каждой второй представительницы белой расы в течение жизни возникает такое осложнение остеопороза, как переломы. Риск самого серьезного исхода остеопороза - перелома шейки бедренной кости равен суммарному риску развития рака молочной железы, яичников и тела матки [13].
Остеопороз - результат воздействия предотвратимых и непредотвратимых факторов, таких как наследственность, низкая масса тела, курение, использование глюкокортикостероидов, низкая физическая активность.
Наследственные факторы являются непредотвратимыми. Они ответственны за функционирование костной и других систем организма и детерминируют более чем 60% случаев развития остеопороза. Около 40% случаев развития заболевания связаны с образом жизни и другими преходящими, предотвратимыми факторами, которые можно и нужно преодолевать [14].
Генетические факторы на 70-80% обусловливают вариабельность минеральной плотности кости (МПК) и на 50-60% риск остеопоротических переломов [15]. Перспективным подходом определения генетической предрасположенности к остеопорозу считается выявление полиморфных вариантов генов, ассоциированных с фенотипическими признаками заболевания. Так, с полиморфными вариантами гена кальцитонина (CALCA) и рецептора кальцитонина (CTR) ассоциированы уровень МПК и риск переломов [16].
Факторы внешней среды играют важную роль в развитии остеопороза, и их коррекция является мощным ресурсом для снижения частоты остеопоротических переломов. Главные среди них - низкое потребление кальция, дефицит витамина D и недостаточная физическая активность [17]. Дополнительно обсуждается негативное влияние долгосрочной диеты с низким содержанием магния [18] и избыточной калорийности пищи. Перечисленные факторы имеют качественные характеристики, за исключением дефицита витамина D, и устанавливаются в ходе опроса пациентов об образе жизни и питания.
Витамин D считается количественным маркером. Концентрация активного метаболита витамина D - 25(OH)D в крови менее 50 нмоль/л свидетельствует о повышенном риске развития остеопороза и других патологических состояний и заболеваний, в том числе ухудшении мышечной функции, развитии сердечно-сосудистых заболеваний и образовании некоторых опухолей 19.
Вопросы недостаточного и избыточного питания, взаимосвязи остеопороза и низкой массы тела, остеопороза и ожирения относятся к одним из самых обсуждаемых. Однако, если ассоциация между низкой массой тела и развитием остеопороза установлена, ассоциация между ожирением и остеопорозом вызывает сомнения. Развеять их помогают работы, посвященные изучению гормональной функции жировой ткани, прежде всего лептина.
В исследованиях in vitro установлено, что лептин стимулирует костеобразование, вероятно через воздействие на стромальные клетки и повышение дифференциации остеобластов с одновременным ингибированием дифференциации адипоцитов. Кроме того, он ингибирует остеокластогенез, уменьшая экспрессию рецептора активатора ядерного фактора κВ (RANK) и его лиганда (RANKL) и повышая продукцию остеопротегерина (OPG) [22]. Следовательно, недостаточный эффект лептина может приводить к редукции костеобразования и увеличению костной резорбции.
1. De Luca d’Alessandro E., Bonacci S., Giraldi G. Aging populations: the health and quality of life of the elderly // Clin. Ter. 2011. Vol. 162. № 1. P. e13-e18.
2. Maffucci J.A., Gore A. Chapter 2: hypothalamic neural systems controlling the female reproductive life cycle gonadotropin-releasing hormone, glutamate, and GABA // Int. Rev. Cell. Mol. Biol. 2009. Vol. 274. P. 69-127.
3. López-Otín C., Blasco M.A., Partridge L. et al. The hallmarks of aging // Cell. 2013. Vol. 153. № 6. P. 1194-1217.
4. Burch J.B., Augustine A.D., Frieden L.A. et al. Advances in geroscience: impact on healthspan and chronic disease // J. Gerontol. A Biol. Sci. Med. Sci. 2014. Vol. 69. Suppl. 1. P. S1-S3.
5. Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M. Williams Textbook of Endocrinology. 12th ed. Philadelphia, PA: Saunders Elsevier, 2013.
6. Martin G.M. The biology of aging: 1985-2010 and beyond // FASEB J. 2011. Vol. 25. № 11. P. 3756-3762.
8. Blagosklonny M.V. Answering the ultimate question ‘what is the proximal cause of aging?’ // Aging (Albany NY). 2012. Vol. 4. № 12. P. 861-877.
9. Berman A.E., Leontieva O.V., Natarajan V. et al. Recent progress in genetics of aging, senescence and longevity: focusing on cancer-related genes // Oncotarget. 2012. Vol. 3. № 12. P. 1522-1532.
10. Nicolson G.L. Mitochondrial dysfunction and chronic disease: treatment with natural supplements // Altern. Ther. Health Med. 2014. Vol. 20. Suppl. 1. P. 18-25.
11. Thorner M.O. Endocrinology of aging: the convergence of reductionist science with systems biology and integrative medicine // Front. Endocrinol. (Lausanne). 2010. Vol. 1. P. 2.
13. Johnell O., Kanis J.A. An estimate of the world-wide prevalence and disability associated with osteoporotic fractures // Osteoporos. Int. 2006. Vol. 17. № 12. P. 1726-1733.
14. Rizzoli R., Bianchi M.L., Garabedian M. et al. Maximizing bone mineral mass gain during growth for the prevention of fractures in the adolescents and the elderly // Bone. 2010. Vol. 46. № 2. P. 294-305.
15. Uitterlinden A.G., van Meurs J.B., Rivadeneira F., Pols H.A. Identifying genetic risk factors for osteoporosis // J. Musculoskelet. Neuronal Interact. 2006. Vol. 6. № 1. P. 16-26.
16. Magana J.J., Gomez R., Cisneros B. et al. Association of the CT gene (CA) polymorphism with BMD in osteoporotic Mexican women // Clin. Genet. 2006. Vol. 70. № 5. P. 402-408.
18. Kitchin B., Morgan S.L. Not just calcium and vitamin D: other nutritional considerations in osteoporosis // Curr. Rheumatol. Rep. 2007. Vol. 9. № 1. P. 85-92.
19. Bischoff-Ferrari H.A., Giovannucci E., Willett W.C. et al. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes // Am. J. Clin. Nutr. 2006. Vol. 84. № 1. P. 18-28.
20. Adami S., Giannini S., Bianchi G. et al. Vitamin D status and response to treatment in post-menopausal osteoporosis // Osteoporos. Int. 2009. Vol. 20. № 2. P. 239-244.
21. Kanis J.A., Adams J., Borgström F. et al. The cost-effectiveness of alendronate in the management of osteoporosis // Bone. 2008. Vol. 42. № 1. P. 4-15.
23. Yang Y.M., Sun T.Y., Liu X.M. The role of serum leptin and tumor necrosis factor-alpha in malnutrition of male chronic obstructive pulmonary disease patients // Chin. Med. J. (Engl.). 2006. Vol. 119. № 8. P. 628-633.
24. Aguilar-Chavez E.A., Gamez-Nava J.I., Lopez-Olivo M.A. et al. Circulating leptin and bone mineral density in rheumatoid arthritis // J. Rheumatol. 2009. Vol. 36. № 3. P. 512-516.
25. Lenora J., Lekamwasam S., Karlsson M.K. Effect of multiparity and prolonged breast-feeding on maternal bone mineral density: a community-based cross-sectional study // BMC Womens Health. 2009. Vol. 9. P. 19.
26. Сметник В.П. Постменопаузальный остеопороз // Медицина климактерия // под ред. В.П. Сметник. Ярославль: Литера, 2006. С. 656-686.
27. Cromer B.A. Menstrual cycle and bone health in adolescent // Ann. NY Acad. Sci. 2008. Vol. 1135. P. 196-203.
28. Melton L.J., Kearns A.E., Atkinson E.J. et al. Secular trends in hip fracture incidence and recurrence // Osteoporos. Int. 2009. Vol. 20. № 5. P. 687-694.
30. Civitelli R., Armamento-Villareal R., Napoli N. Bone turnover markers: understanding their value in clinical trials and clinical practice // Osteoporos. Int. 2009. Vol. 20. № 6. P. 843-851.
31. Tilg H., Moschen A.R. Adipocytokines: mediators linking adipose tissue, inflammation and immunity // Nat. Rev. Immunol. 2006. Vol. 6. № 10. P. 772-783.
32. Miura S., Nakamori M., Yagi M. et al. Daily calcium intake and physical activity status in urban women living on low incomes in Davao, Philippines: a primary study for osteoporosis prevention // J. Med. Invest. 2009. Vol. 56. № 3-4. P. 130-135.
33. Khosla S. Update on estrogens and the skeleton // J. Clin. Endocrinol. Metab. 2010. Vol. 95. № 8. P. 3569-3577.
34. Cavallini E., Dinaro E., Giocolano A. et al. Estrogen receptor (ER) and ER-related receptor expression in normal and atrophic human vagina // Maturitas. 2008. Vol. 59. № 3. P. 219-225.
35. Santen R.J., Allred D.C., Ardoin S.P. et al. Postmenopausal hormone therapy: an Endocrine Society scientific statement // J. Clin. Endocrinol. Metab. 2010. Vol. 95. № 7. Suppl. 1. P. s1-s66.
36. Cooper C., Cole Z.A., Holroyd C.R. et al. Secular trends in the incidence of hip and other osteoporotic fractures // Osteoporos. Int. 2011. Vol. 22. № 5. P. 1277-1288.
37. Hajian-Tilaki K.O., Heidari B. Prevalence of obesity, central obesity and the associated factors in urban population aged 20-70 years, in the north of Iran: a population-based study and regression approach // Obes. Rev. 2007. Vol. 8. № 1. P. 3-10.
38. North American Menopause Society. The 2012 hormone therapy position statement of The North American Menopause Society // Menopause. 2012. Vol. 19. № 3. P. 257-271.
39. Baber R.J., Panay N., Fenton A. IMS Writing Group. 2016 IMS Recommendations on women's midlife health and menopause hormone therapy // Climacteric. Vol. 19. № 2. P. 109-150.
40. Prior J.C., Tremollieres F., Forsmo S., Seifert-Klauss V. Unsuccessful attempt to demonstrate progesterone's bone formation actions // Am. J. Obstet. Gynecol. 2006. Vol. 194. № 5. P. 1502-1503.
44. Adulnour J., Doucet E., Brochu M. et al. The effect of the menopausal transition on body composition and cardiometabolic risk factors: a Montreal-Ottawa New Emerging Team group study // Menopause. 2012. Vol. 19. № 7. P. 760-767.
45. Fonken L.K., Workman J.L., Walton J.C. et al. Light at night increases body mass by shifting the time of food intake // Proc. Natl. Acad. Sci. USA. 2010. Vol. 107. № 43. P. 18664-18669.
46. Pan A., Lucas M., Sun Q. et al. Bidirectional association between depression and type 2 diabetes mellitus in women // Arch. Intern. Med. 2010. Vol. 170. № 21. P. 1884-1891.
47. Janssen I., Powel L.H., Crawford S. et al. Menopause and the metabolic syndrome: the Study of Women's Health Across the Nation // Arch. Intern. Med. 2008. Vol. 168. № 14. P. 1568-1575.
48. Ho S.C., Wu S., Chan S.G., Sham A. Menopausal transition and changes of body composition: a prospective study in Chinese perimenopausal women // Int. J. Obes. (Lond.). 2010. Vol. 34. № 8. P. 1265-1274.
49. Fournier A., Berrino F., Riboli E. et al. Breast cancer risk in relation to different types of hormone replacement therapy in the E3N-EPIC cohort // Int. J. Cancer. 2005. Vol. 114. № 3. P. 448-454.
Preservation of Bone Tissue in Pre- and Post-Menopausal Women: a Role of Hormone Therapy
First Moscow State Medical University named after I.M. Sechenov
Aging results from genetic, cellular and molecular changes. A great number of factors were identified as causes or consequences of decreased age-related functional and reparative processes in the body. State of bone tissue is mainly determined by these changes. Loss of ovarian function and deficiency of female sex hormones are considered among the main causes resulting in loss of bone mineral density.
To eliminate negative consequences of estrogen deficiency, postmenopausal women are administered with hormone therapy, for which osteoporosis is considered as one of indications.
Гормоны и остеопороз
Остеопороз и его осложнения — переломы костей — представляют значительную медико-социальную проблему. Ежегодно вследствие остеопороза возникают переломы костей у 1,3 млн американцев и у 40 тыс. канадцев. Во Франции каждая вторая, а в Австралии каждая пятая женщина в возрасте около 70 лет страдает от переломов, вызванных остеопорозом. Возникновение остеопороза в пожилом возрасте у женщин обусловлено уменьшением выработки эстрогенов. Однако снижение минеральной плотности кости происходит не только с возрастом, но еще в большей степени при всех состояниях, приводящих к изменению баланса гормонов гипоталамо-гипофизарной системы, щитовидной и паращитовидных желез, надпочечников.
В связи с изложенным целью настоящей работы явилось обобщение данных литературы о влиянии гормонов на возникновение и развитие остеопороза.
Костная ткань — это динамичная метаболически активная система. В зависимости от выполняемой функции различают кортикальную и трабекулярную кость. Первая составляет три четверти всей скелетной массы, формирует диафизы трубчатых костей, имеет малую порозность, выполняет функцию опоры для мягких тканей и передачи мышечного сокращения из одной части тела в другую. Трабекулярная костная ткань составляет одну четвертую часть массы скелета, формирует кости аксиального скелета и эпифизы трубчатых костей, имеет высокую порозность и обеспечивает нормальную жизнедеятельность костного мозга. Для этого в трабекулярных костях имеются полости размером от 500 до 1000 мкм, расположенные между костными пластинками толщиной 100—150 мкм.
Основу жизнедеятельности костной ткани составляет функционирование двух видов клеток: остеокластов, резорбирующих кость, и остеобластов, ответственных за ее образование. Родоначальники этих клеток до конца не выяснены, хотя наиболее вероятными для остеокластов считаются гемопоэтические клетки моноциты-макрофаги, а для остеобластов — клетки стромы, из которых возникают преостеобласты.
В течение жизни происходит постоянное обновление костей, проявляющееся в рассасывании отдельных, очень маленьких участков ткани, с почти одновременным формированием новой кости. Этот процесс имеет огромное эволюционное значение, так как позволяет удалять возникающие в процессе жизнедеятельности микротравмы и микротрещины костей. Ежегодно 25 % массы трабекулярных костей и лишь 2—3 % кортикальных — обновляются.
Ключевые слова
Для цитирования:
For citation:
Остеопороз и его осложнения — переломы костей — представляют значительную медико-социальную проблему. Ежегодно вследствие остеопороза возникают переломы костей у 1,3 млн американцев и у 40 тыс. канадцев [12, 37]. Во Франции каждая вторая, а в Австралии каждая пятая женщина в возрасте около 70 лет страдает от переломов, вызванных остеопорозом [2, 35]. Возникновение остеопороза в пожилом возрасте у женщин обусловлено' ■уменьшением ' выработки эстрогенов [6]. Однако снижение минеральной плотности кости происходит не только с возрастом, но еще в большей степени при всех состояниях, приводящих к изменению баланса гормонов гипоталамо-гипофизарной системы, щитовидной и паращитовидных желез, надпочечников.
Костная ткань — это динамичная метаболически активная система. В зависимости от выполняемой функции различают кортикальную и трабекулярную кость. Первая составляет три четверти всей скелетной массы, формирует диафизы трубчатых костей, имеет малую порозность, выполняет функцию опоры для мягких тканей и передачи мышечного сокращения из одной части тела в другую. Трабекулярная костная ткань составляет одну четвертую часть массы скелета, формирует кости аксиального скелета и эпифизы трубчатых костей, имеет высокую порозность и обеспечивает нормальную жизнедеятельность костного мозга. Для этого в трабекулярных костях имеются полости размером от 500 до 1000 мкм, расположенные между костными пластинками толщиной 100—150 мкм [42].
Основу жизнедеятельности костной ткани составляет функционирование двух видов клеток: остеокластов, резорбирующих кость, и остеобластов, ответственных за ее образование. Родоначальники этих клеток до конца не выяснены, хотя наиболее вероятными для остеокластов считаются гемопоэтические клетки моноциты-макрофаги, а для остеобластов — клетки стромы, из которых возникают преостеобласты [40].
В течение жизни происходит постоянное обновление костей, проявляющееся в рассасывании отдельных, очень маленьких участков ткани, с почти одновременным формированием новой кости. Этот процесс имеет огромное эволюционное значение, так как позволяет удалять возникающие в процессе жизнедеятельности микротравмы и микротрещины костей. Ежегодно 25 % массы трабекулярных костей и лишь 2—3 % кортикальных — обновляются [49].
Процесс ремоделирования кости делится на пять фаз [42]. В здоровом взрослом организме в состоянии покоя находится до 80 % трабекулярной и 95 % кортикальной костной ткани. Фаза активации, возникающая в каждом участке кости с интервалом 2—3 года, включает в себя пролиферацию и активацию предшественников остеокластов в гемопоэтической ткани, поступление и прикрепление мультиядерных остеокластов к поверхности резорбируемого участка. Следующая фаза — резорбция кости — продолжается приблизительно 1—3 нед. На клеточном уровне этот процесс заключается в расплавлении неорганического матрикса кости с последующей деградацией органического, что происходит с обязательным поступлением в участки резорбции ионов водорода и лизосомальных энзимов остеокластов [3, 56]. Переходная фаза длится 1 — 2 нед. В это время в резорбированной полости появляются остеобласты в результате как деления клеток, так и поступления из других участков. Новообразование кости начинается с откладывания остеобластами костного матрикса со скоростью 2—3 мкм в день, который через 5—10 дней минерализуется. Процесс костеобразования длится около 3 мес, а полный цикл обновления кости в каждом участке занимает 4—8 мес [22]. Следует отметить, что интимные механизмы этого процесса и его контроля остаются неизвестными.
На основании физиологических процессов костного ремоделирования было предложено несколько возможных вариантов возникновения остеопороза [13]. Во-первых, во всех обновляющихся точках кости резорбирующая активность остеокластов больше костеобразующих возможностей остеобластов; во-вторых, резкое увеличение количества обновляющихся участков по всему скелету приводит к общей резорбции кости, так как длительность фазы резорбции короче фазы формирования новой кости.
В патогенезе развития остеопороза оба этих механизма имеют место. Так, при остеопорозе, возникающем сначала в метаболически более активной трабекулярной ткани, уменьшаются количество и толщина пластинок, полости, находящиеся между пластинами, увеличиваются за счет перфораций последних. Эти изменения обусловлены нарушением баланса между глубиной резорбированных полостей и толщиной вновь возникающих пластинок [43].
Одним из наиболее активных гормонов, влияющих на процессы обновления кости, является паратиреоидный гормон (ПТГ). Основная его функция заключается в поддержании в организме гомеостаза кальция. Уменьшение концентрации кальция в плазме приводит к выбросу паращитовидными железами гормона, который, воздействуя на почки, увеличивает реабсорбцию кальция в канальцах и экскрецию фосфатов, а на уровне костной ткани вызывает ее резорбцию и выход кальция во внеклеточную жидкость [10].
Уже через 30 мин после введения ПТГ количество и активность остеокластов увеличиваются. Однако эта реакция не наблюдается при воздействии ПТГ на изолированные остеокласты, а происходит лишь при добавлении к ним остеобластов. Дальнейшие исследования показали, что остеобласты и их предшественники имеют на своей поверхностной мембране рецепторы к ПТГ [53], в то время как на остеокластах таких рецепторов не обнаружено. На основании полученных результатов было предположено [47] существование связи между ПТГ-активными остеобластами и ПТГ-нечувствитель- ными остеокластами. Оказалось, что остеобласты являются основным звеном, запускающим и контролирующим резорбцию кости. Под воздействием ПТГ наблюдается пролиферация остеобластов, морфологически они из округлой формы приобретают звездообразную, происходит деполяризация мембраны и изменяется ферментативная активность, ингибируется синтез коллагена, остеокальцина и щелочной фосфатазы, увеличивается синтез коллагеназы. С целью стимуляции остеокластов к резорбции остеобласты выделяют водорастворимый фактор размером 0,5—2,0 кД, который блокируется ингибиторами липоксигеназы [31]. Внутриклеточные механизмы влияния ПТГ на остеобласты заключаются в резком увеличении концентрации кальция внутри клеток, что в свою очередь приводит к увеличению фосфорилирования белков стимуляцией протеинкиназы С. Выявлена положительная корреляция между способностью ПТГ увеличивать концентрацию кальция в остеобластах и возможностью последних вызывать резорбцию кости [22].
Указанные изменения возникают при повышении концентрации ПТГ в плазме. В то же время практически невозможно объяснить стимулирующее действие малых доз ПТГ на костеобразование [21].
У женщин в период постменопаузы отмечается отрицательный баланс кальция, хотя его концентрация в плазме повышается и снижается до нормального уровня при заместительной гормональной терапии [41]. Противоречивые результаты получены при исследовании ПТГ в постменопаузе. В раннем периоде концентрация ПТГ несколько снижается, через 3 года после наступления не меняется или незначительно повышается, а при проведении эстрогенотерапии уровень ПТГ возвращается к исходным показателям [34]. У больных с переломами позвонков, вызванных остеопорозом, выявлено снижение концентрации ПТГ, однако при переломах шейки бедра каких-либо его изменений не обнаружено.
Антагонистом ПТГ является кальцитонин (КТ). Уже через несколько минут после добавления КТ к культуре остеокластов отмечается уменьшение количества ядер в них, а затем и общего количества, значительно снижается подвижность и их резорбционная способность, они покидают поверхность кости. Такая быстрая реакция остеокластов обусловлена тем, что они имеют на своей мембране рецепторы к КТ [38]. Молекулярные механизмы воздействия КТ на остеокласты связаны с увеличением образования циклического аденозинмонофосфата в них [39]. Кроме этого, остеокласты под воздействием КТ начинают вырабатывать пептид, называемый кальцитонин- генсвязанный пептид, который, действуя на остеобласты, заставляет их синтезировать циклический аденозинмонофосфат [32].
У здоровых людей имеется разница в концентрации КТ в плазме в зависимости от пола и возраста: у женщин эти значения ниже, чем у мужчин [54], с возрастом наблюдается уменьшение концентрации КТ в плазме. Снижение выработки половых гормонов как у мужчин, так и у женщин приводит к уменьшению секреции КТ, также обнаружена выраженная положительная корреляция между уровнем эстрогенов и КТ [46]. У женщин с остеопорозом концентрация КТ гораздо ниже, чем у женщин того же возраста, но без остеопороза. Введение КТ больным с остеопорозом способствует некоторому повышению минеральной плотности кости [33], хотя этот эффект наблюдается в течение 1 года [7]. В то же время проведение эстрогенотерапии при менопаузе приводит к повышению секреции КТ [14]. Это подтверждается и в исследованиях in vitro, в которых было показано прямое стимулирующее действие экстрогенов на выработку КТ клетками щитовидной железы [15]. Однако следует отметить, что разницы в минеральной плотности кости у больных с субтотальной тиреоидэктомией и здоровыми людьми не наблюдалось [23].
Наиболее часто остеопороз поражает женщин со сниженной гормональной функцией яичников, вне зависимости от причин, вызывающих это состояние. Позднее менархе, менопауза, аменорея у спортсменок и балетных танцоров, оперативное удаление яичников, пролактинсекретирующие опухоли, синдром Тернера приводят к деминерализации кости [28]. Чаще всего эти изменения возникают уже через год после наступления уменьшения концентрации эстрогенов в плазме. Заместительная эстрогенотерапии снижает потерю массы кости и даже приводит к ее увеличению [29].
Механизм действия эстрогенов на процессы обновления кости остается спорной проблемой. В условиях дефицита эстрогенов наблюдаются как замедление формирования новой кости, так и ускоренная костная резорбция. В последнее время
опубликованы работы, в которых показано наличие рецепторов к эстрогенам на мембране остеобластов [9, 26]. Однако до этих исследований считалось, что эстрогены дают защитный эффект от воздействия ПТГ на костную ткань, а также увеличивают продукцию эндогенного КТ [34, 51].
Уменьшение выработки андрогенов как первичного генеза, так и вторичного (вследствие гипогонадотропного гипогонадизма) приводит к остеопорозу [24]. Отмечается положительная корреляционная зависимость между уровнем тестостерона в плазме и массой кости при различных формах гипогонадизма [II]. У таких больных терапия тестостероном и его метаболитами увеличивает минерализацию кости и ее массу [17]. Несмотря на четкую связь между уровнем выработки андрогенов и состоянием костной системы, механизмы их влияния на процессы образования и обновления кости остаются мало изученными.
Роль других половых гормонов в процессах ремоделирования кости остается неизвестной, хотя имеются отдельные клинические наблюдения. Гиперпролактинемия сопровождается значительным снижением минеральной плотности кости, а терапия этого состояния способствует увеличению показателя |25]. У мужчин с гиперпролактинемией также отмечается уменьшение массы кости, а нормализация уровня тестостерона и пролактина вызывает ее увеличение (16].
Глюкокортикоиды (ГК) оказывают значительное влияние на процессы обновления кости. Считается, что 50 % больных с болезнью Иценко — Кушинга и 30—50 % больных, хронически принимающих ГК, страдают остеопорозом. Оперативное лечение детей с болезнью Иценко — Кушинга повышает минеральную плотность кости [45].
Воздействие ГК на кости обусловлено множеством факторов, среди которых основное значение имеет нарушение обмена кальция, связанное с уменьшением его абсорбции в кишечнике и увеличением экскреции с мочой, снижение выработки половых гормонов на всех уровнях и непосредственное влияние на клетки костной ткани (50].
Наиболее противоречивые данный получены при изучении прямого действия ГК на костную ткань. В физиологических дозах в первые сутки ГК усиливают функцию остеобластов и их способность синтезировать коллаген, а в последующем эта активность резко снижается [5]. ГК ингибируют превращения предшественников остеобластов, уменьшают время их активности, т. е. угнетают костеобразование. Воздействие ГК на остеокласты осуществляется, по-видимому, опосредованно через остеобласты. Несмотря на то что ГК увеличивают мобилизацию минералов кости усилением резорбции, они ингибируют созревание предшественников остеокластов и количество их снижается [52].
Одним из множества эффектов тиреоидных гормонов является их способность оказывать влияние на процессы обновления кости. В условиях гипертиреоза наблюдается повышение количества обновляющихся участков, уменьшаются как фаза резорбции, так и костеобразования, т. е. усиливается костный метаболизм [2]. Эти изменения приводят к отрицательному балансу кальция и уменьшению минеральной плотности кости, умеренной гиперкальциемии, снижению концентрации ПТГ и увеличению потери кальция и фосфора с мочой. Отрицательное действие повышения выработки тиреоидных гормонов на кости обусловлено непосредственным увеличением количества остеокластов и их активности, а также стимуляцией остеобластов [36].
В условиях гипотиреоза наблюдается уменьшение количества обновляющихся участков, резко увеличивается продолжительность всех фаз цикла ремоделирования, снижается резорбционная активность остеокластов, уменьшается способность остеобластов к формированию кости и ее минерализации [55].
Интересная особенность выявлена при лечении гипотиреоза тиреоидными препаратами. Все они вызывают остеопороз, хотя сроки его возникновения, по данным разных авторов, колеблются от 6 мес до 10 лет [12, 44]. По нашему мнению, такие разноречивые данные могут быть обусловлены различной дозировкой используемых препаратов.
Сахарный диабет (СД) наряду с метаболическими нарушениями различных органов и систем организма сопровождается изменениями в костной системе. У больных СД I типа длительностью более 5 лет отмечается уменьшение минеральной плотности кости по сравнению со здоровыми людьми того же возраста и пола [30, 57]. Особенно значительные изменения отмечаются у больных, заболевших в детском и юношеском возрасте, с большими дозами инсулина и плохим контролем. Отмечается изменение обмена кальция, проявляющееся увеличением экскреции кальция и фосфора, что приводит к уменьшению их концентраций в плазме. На этом фоне наблюдается парадоксальное уменьшение концентрации ПТГ в плазме у больных как без нарушения функции почек, так и со снижением их функционального состояния (19]. При этом уровень КТ не изменяется [48]. В патогенезе развития остеопороза у больных СД основное значение придается метаболическим и гормональным изменениям, диабетической ангиопатии [20]. Следует также отметить, что выявлены рецепторы к инсулину в остеобластах [27], в то же время механизмы его влияния на процессы обновления кости остаются неизвестными.
Гормон роста — один из важнейших гормонов при росте костей, особенно их эпифизов. Он оказывает активирующее влияние на остеобласты локальным выделением соматомеди- на С, известного как инсулиноподобный фактор роста I. Этот пептид вызывает пролиферацию остеобластов, стимулирует синтез ДНК и протеинов. С возрастом продукция гормона роста снижается, однако это уменьшение не коррелирует с возрастными изменениями костной ткани. Использование гормона роста при остеопорозе оказалось неэффективным [1].
Анализ литературных публикаций показывает, что в течение жизни происходит постоянное обновление костной ткани. Наиболее активно на этот процесс оказывают влияние ПТГ и КТ через активацию или ингибирование клеточных элементов кости. Дефицит эстрогенов одна из самых широко распространенных причин остеопороза приводит к снижению костеобразования и ускорению резорбции кости. Выявлена четкая связь между состоянием костной системы и недостатком андрогенов и инсулина, избытком глюкокортикоидов, пролактина и гормонов щитовидной железы, хотя большинство вопросов этой проблемы далеки от разрешения. Характер и интенсивность процессов ремоделирования кости в значительной степени зависят от состояния гормонального баланса организма, но многие механизмы этого взаимодействия требуют дальнейшего изучения.
Гормоны в лечении остеопороза у женщин. Эстрогенотерапия
С.С. Апетов, С.Ю. Калинченко
ГБОУ ВПО «Российский университет дружбы народов» Минобрнауки РФ, Москва
В статье проанализирована роль эстрогенов и андрогенов в метаболизме костной ткани у мужчин и женщин, а также значимость коррекции их дефицита в лечении остеопороза. Приведены данные рандомизированного исследования, в котором сравнивались эффекты монотерапии эстрогенами пациенток с остеопорозом против эстроген-андрогенной терапии. Первой группе больных были назначены имплантаты, содержавшие 50 мг эстрогена, второй - имплантаты, содержавшие 50 мг эстрогена и 100 мг тестостерона. Через 3 года терапии в первой группе не было показано никаких изменений минеральной плотности костной ткани (МПКТ), в то время как во второй группе МПКТ пястной кости увеличилась на 2 %. Вышеприведенные данные позволяют сделать вывод: применение андрогенов женщинами с целью лечения остеопороза может стать перспективным направлением и полем для дальнейших научных исследований в данной области.
Остеопороз традиционно считается болезнью постменопаузальных женщин, однако это мнение ошибочно, т. к. в группу риска входят и мужчины в возрасте старше 50 лет [1]. Развитие остеопороза также возможно у мужчин с синдромом резистентности к андрогенам [2]; при синдроме Кляйнфельтера [3] - у пациентов с сахарным диабетом 2 типа [4]; у женщин с синдромом Тернера [5] - преждевременной недостаточностью яичников и хирургической менопаузой [6], нервной анорексией [7], а также у обоих полов с гиперпролактине-мией [8].
Все эти заболевания ассоциированы с гипогонадизмом - патологическим состоянием, связанным с недостаточностью образования половых гормонов либо нарушением механизма их действия, приводящим к нарушению жирового, углеводного обмена и метаболизма костной ткани.
К сожалению, в нашей стране патологическое состояние гипогонадизма часто остается нераспознанным ввиду отсутствия четких алгоритмов и клинических рекомендаций, что в свою очередь снижает частоту выявляемости остеопороза и эффективность его лечения. Роль дефицита эстрогенов в развитии остеопороза у женщин хорошо изучена, поэтому мы решили не акцентировать на этом свое внимание в данной публикации. В этом обзоре литературы мы хотели бы проанализировать роль эстрогенов и андрогенов в метаболизме костной ткани, а также значимость коррекции их дефицита в лечении остеопороза.
Роль эстрогенов в метаболизме костной ткани у мужчин и женщин
У здоровых взрослых мужчин ежедневно вырабатывается примерно 30-50 мкг эстрадиола. Приблизительно 5-10 мкг (10-20 %) непосредственно синтезируется в яичках, а остальные 40-45 мкг (80-90 %) образуются из тестостерона в периферических тканях, богатых ароматазой (жировая и мышечная ткань, головной мозг, печень, костная ткань) [9]. Ежедневная продукция эстрогенов у здоровых взрослых мужчин поддерживает уровень эстрадиола в сыворотке в диапазоне 66-147 мкмоль/л (18-40 пг/мл) [9, 10]. Таким образом, у здоровых взрослых мужчин уровень эстрадиола в 10 раз ниже, чем у женщин аналогичного возраста, у которых он находится в диапазоне от 73 до 734 мкмоль/л (20-200 мкг/мл) [9, 10]. С возрастом у мужчин отмечается постепенное снижение всех фракций эстрогенов [11], что коррелирует с возрастным снижением тестостерона [12], однако при этом концентрация эстрадиола остается в два раза выше по сравнению с женщинами в период постменопаузы, у которых уровень эстрадиола варьируется в диапазоне от 36 до 73 пмоль/л (10-20 мкг/мл). Таким образом, относительный дефицит эстрогенов наблюдается среди здоровых пожилых мужчин в процессе старения, но в целом не бывает таким тяжелым, как у женщин в постменопаузе, поскольку продолжает синтезироваться достаточное количество андрогенов, часть из которых ароматизируется в эстрогены в периферических тканях [13], в то время как у женщин в постменопаузальном возрасте остается только очень небольшая часть андрогенов надпочечникового происхождения [14].
Ряд исследований показал, что уровень эстрадиола в сыворотке взаимосвязан со степенью выраженности остеопороза у мужчин и что минеральная плотность костной ткани (МПКТ) непосредственно связана с уровнем эстрогенов, а не тестостерона [15] как у молодых, так и у пожилых мужчин [11]. Несмотря на то что у молодых мужчин с гипогонадизмом взаимосвязь между потерей костной массы, уровнем тестостерона и эстрогенов была изучена недостаточно, дефицит эстрогенов также, вероятно, связан с прогрессивным снижением МПКТ после двусторонней орхиэктомии, выполненной в возрасте до 40 лет [16]. Темпы потери МПКТ вызваны низким индексом свободных эстрогенов. Значения МПКТ в поясничном отделе позвоночника и шейке бедренной кости были прямо пропорционально, а значения маркеров остеолиза - обратно пропорционально связаны с индексом свободных эстрогенов. В то же время снижение МПКТ и повышение маркеров остеолиза не были значимо связаны с уровнями общего и свободного тестостерона в сыворотке.
Назначение эстрогенов взрослым мужчинам с дефицитом ароматазы и, соответственно, с эстрогенной недостаточностью повышало МПКТ, даже если лечение было начато в зрелом возрасте [17]. Применение трансдермального эстрадиола в количестве 50 мкг дважды в неделю в течение 6 месяцев с последующим добавлением 25 мкг дважды в неделю в течение 9 месяцев пациентам с дефицитом ароматазы приводило к увеличению МПКТ от 25 до 37 % по сравнению с исходными данными [17], а уменьшение дозы приводило к снижению МПКТ при уровне эстрадиола в сыворотке крови ниже границ референсного интервала [17]. Костная ткань молодых мужчин с дефицитом эстрогенов, а также мужчин с гипогонадизмом имеет сходное строение, в обоих случаях снижена минерализация вследствие дефицита эстрогенов. Мужчинам с дефицитом ароматазы терапию эстрогенами необходимо назначать для завершения формирования скелета и продолжать на протяжении всей жизни, чтобы предотвратить потерю МПКТ [18].
Роль андрогенов в метаболизме костной ткани у мужчин
С учетом наличия ароматазы в костной ткани андрогены могут оказывать влияние на эстрогенные рецепторы, как ароматизируясь в эстрадиол, так и напрямую воздействуя на андрогенные рецепторы, однако этот механизм до настоящего времени изучен недостаточно [19]. Возрастной андрогенный дефицит ассоциируется с остеопенией [20], для молодых мужчин гипогонадизм является частной причиной вторичного остеопороза [21].
Эффект терапии тестостероном на МПКТ мужчин с гипогонадизмом уже достаточно изучен. В долгосрочных перспективных и ретроспективных исследованиях было показано, что заместительная терапия тестостероном может улучшать МПКТ как в поясничном отделе позвоночника, так и в шейке бедренной кости [22, 23].
В частности, тестостерон более эффективен в улучшении МПКТ, чем другие не ароматизирующиеся андрогены, такие как нандролон [24].
Помимо ароматазы в костной ткани человека экспрессируется 5α-редуктаза 1-го типа - фермент, превращающий тестостерон в его наиболее активный метаболит - дигидротестостерон, который имеет больший коэффициент связывания с андрогенным рецептором [25]. Изучение эффектов ингибиторов 5α-редуктазы может быть полезно для оценки влияния андрогенов на костную ткань мужчин. Применение финастерида (ингибитора 5α-редуктазы) мужчинами с доброкачественной гиперплазией предстательной железы не влияет на МПКТ и сывороточные маркеры метаболизма костной ткани [26]. Кроме того, добавление финастерида к терапии тестостероном мужчин с гипогонадизмом не показало значимого эффекта на МПКТ, что доказывает отсутствие влияния ингибирования дигидротестостерона на метаболизм костной ткани [27]. Андрогены, возможно, могут оказывать непосредственное влияние на костные клетки (остеобласты, остеокласты, остеоциты), все эти эффекты связаны с активацией андрогенных рецепторов (например, апоптоз, модуляция и пролиферация остеобластов и остеокластов), однако они были доказаны только в исследованиях in vitro или на животных [19].
Другое возможное опосредованное действие андрогенов на кость может быть связано со стимуляцией синтеза факторов роста, таких как инсулино-подобный фактор роста-I [19]. Несколько исследований показали, что андрогены способствуют периостальному росту кости у мужчин [28]. Этот процесс, видимо, продолжается и во взрослом состоянии, однако идет менее активно. С возрастом он более выражен у мужчин [29], однако продолжается и у женщин после менопаузы [30].
Роль андрогенов в метаболизме костной ткани женщин
Интерес к терапевтическому потенциалу андрогенов в лечении остеопороза у женщин был основан на нескольких наблюдениях: 1) у женщин репродуктивного возраста с гиперандрогенией яичникового происхождения; МПКТ достоверно выше, чем у женщин того же возраста с нормальным уровнем андрогенов [31, 32], 2) у женщин с постменопаузальным остеопорозом уровень андрогенов ниже, чем у женщин без остеопороза [33], 3) андрогены могут стимулировать рост и развитие остеобластов in vitro [33]. Применение производных андрогенов, таких как анаболические стероиды, показало увеличение плотности костей предплечья, шейки бедренной кости и поясничного отдела позвоночника.
Данные по применению андрогенов с целью лечения остеопороза ограничены. В одном рандомизированном исследовании по применению имплантатов с тестостероном сравнивались эффекты монотерапии эстрогенами против эстроген-андрогенной терапии. Пациентки были разделены на две группы: первой группе были назначены имплантаты, содержащие 50 мг, пациенткам второй группы - имплантаты, содержащие 50 мг эстрогена и 100 мг тестостерона. Через 3 года терапии в первой группе не было показано никаких изменений МПКТ, в то время как во второй группе МПКТ пястной кости увеличилась на 2 % [34]. В другом исследовании изучалась МПКТ женщин, получающих пероральную терапию эстрогенами по сравнению с подкожными имплантатами, содержащими эстрогены и тестостерон.
В группе женщин, получавших комбинированную терапию, было отмечено увеличение МПКТ поясничного отдела позвоночника на 5,7 % и на 5,2 % - в шейке бедренной кости. Плотность костной ткани женщин, получавших монотерапию эстрогенами, оставалась без изменений [35].
Заключение
Таким образом, своевременная диагностика остеопороза как у женщин, так и у мужчин с различными эндокринными заболеваниями (гиперпролактинемия, гипогонадизм, заболевания щитовидной железы и пр.) может способствовать раннему его выявлению, позволит начать своевременную терапию и снизить число переломов у таких больных. В современных условиях лечение остеопороза невозможно без коррекции гипогонадизма. Применение андрогенов женщинами с целью лечения остеопороза на данный момент хоть не имеет убедительной доказательной базы, однако может являться перспективным направлением и полем для дальнейших научных исследований в данной области.
Литература
Об авторах / Для корреспонденции
В физиологии и патофизиологии костной ткани важную роль играют системные и локальные факторы. В статье представлены сведения о роли эстрогенов в функции костной ткани. Освещены некоторые вопросы этиологии, патогенеза, принципов диагностики постменопаузального остеопороза. Профилактика и терапия остеопороза изложены с учетом современных представлений о влиянии комбинированной и монотерапии эстрогенами на минеральную плотность кости и риск переломов.
Костная система представляет собой динамическую систему, в которой постоянно происходит процесс обновления (ремоделирования), включающий резорбцию и формирование костной ткани. Данный процесс зависит от баланса между клетками костной системы (остеобластами, остеоцитами, остеокластами) и регуляторами костного обмена (цитокинами и факторами роста). При нарушении этого баланса может происходить развитие патологических состояний, одним из которых является остеопороз.
Главный показатель здоровья кости - ее плотность. Она поддерживается четким балансом между двумя процессами: образованием кости и резорбцией. Эти процессы происходят в результате активности основных клеток костной ткани: остеобластов («клеток-строителей»), остеокластов («клеток-разрушителей»), остеоцитов («клеток-интеграторов»), а также ряда клеток костного мозга. Остеоциты составляют более 90-95 % всех клеток костной ткани, тогда как остеобласты - 4-6 %, а остеокласты - 1-2 %. Остеобласты происходят из полипотентных мезенхимальных стволовых клеток, остеокласты - из мононуклеарных предшественников моноцит-макрофагальной линии [1]. Все эти клетки связаны между собой и костным мозгом благодаря дендритическим отросткам остеоцитов. Остеоциты играют важную роль в регуляции костного обмена в ответ на изменение механической нагрузки, а также регулируют фосфатный гомеостаз и могут функционировать как эндокринная железа, вырабатывая склеростин и RANKL (лиганд-рецептор, активирующий ядерный фактор NF-κB), интегрируя деятельность всех костных клеток [2]. Модулирование функций данных клеток возможно через действие на них системных (гормонов) и локальных факторов (цитокинов, факторов роста). В костной ткани существуют также необходимые ферменты для синтеза эстрогенов из андрогенов (рис. 1).
Для полноценной функции костной ткани в различные периоды жизни женщины крайне важна пиковая костная масса (ПКМ), которая достигается в пубертатном периоде. Значимое число эндогенных (генетических, гендерных, гормональных) и экзогенных факторов (питание, физическая активность, ятрогенные состояния) влияют на достижение надлежащей ПКМ. Около 40 % ПКМ достигается в период пубертата. Крайне важны также нормальный гормональный статус, своевременное менархе, регулярный менструальный цикл. Свыше 90 % ПКМ достигается девочками к 18 годам и мальчиками - к 20. ПКМ у юношей на 30 % больше, чем у молодых женщин, поэтому женщины более уязвимы, чем мужчины, в отношении развития остеопении и остеопороза. Финальное образование ПКМ происходит приблизительно к 25-30 годам [3].
Таким образом, как дефицит, так и гиперпродукция эстрогенов отражается на функции костной ткани (рис. 2). У мужчин при дефиците ароматазы и, соответственно, торможении синтезы эстрогенов из андрогенов также может отмечаться задержка закрытия зон роста и формирования ПКМ.
К системным гормонам, влияющим на костное ремоделирование, относятся эстрогены, прогестерон, андрогены, кальцитонин, тироксин, гормон роста, паратгормон, кортикостероиды, 1,25(ОН)D3.
Эстрогены играют важную роль в процессах роста скелета и костного гомеостаза как у женщин, так и у мужчин. Они являются мощными антирезорбтивными агентами, способными контролировать экспрессию ряда цитокинов, участвующих в процессах резорбции костной ткани, и предотвращать развитие остеопороза.
В 1988 г. выявлена экспрессия эстрогеновых рецепторов (ЭР) остеобластами, остеоцитами и остеокластами. Различают ЭР-α и ЭР-β. Эти рецепторы также экспрессируются в стромальных клетках костного мозга, Т-, В-клетках и во многих других клетках костного мозга. Существует прямое геномное действие эстрогенов на костные клетки через регуляцию экспрессии генов ряда цитокинов. Негеномное действие через мембранные формы ЭР; регуляторные эффекты на иммунную систему и оксидативный стресс.
Ключевыми молекулами, участвующими в процессах образования и резорбции кости, являются цитокины - представители двух больших суперсемейств - лигандов, родственных фактору некроза опухолей α (ФНО-α), и их рецепторов, к которым относятся: белок RANK (receptor activator of nuclear factor) - рецептор, активирующий ядерный фактор NF-κB, и его белковый лиганд RANKL (также называемый «лиганд остеопротегерина», или «фактор дифференцировки остеокластов»), а также молекула остеопротегерина (OPG - «osteoprotegerin») - цитокина, родственного RANK [6].
Ряд провоспалительных цитокинов необходим для дифференцировки и активации остеокластов. Среди них: интерлейкин-1 (ИЛ-1), ИЛ-6, ИЛ-7, ФНО-α, M-СSF, гранулоцит-макрофаг-колониестимулирующий фактор (GM-СSF - Granulocyte-macrophage colony-stimulating factor), простагландин E2 (PGE2) и др. Под их действием предшественники остеокластов превращаются в активные остеокласты. Вследствие этого усиливается резорбция костной ткани. Эстрогены подавляют выработку данных цитокинов, выступая в качестве антирезорбтивных агентов.
Напротив, эстрогены способны увеличивать синтез некоторых цитокинов, оказывающих защитное действие на плотность кости. К ним относятся трансформирующий фактор роста-α и остеопротегерин, действие которых приводит к уменьшению активности и усилению апоптоза в остеокластах.
Эстрадиол является одной из главных детерминант, обеспечивающих надлежащий костный обмен. Эстрадиол играет важную роль в следующих процессах 9:
- стимуляции ростовых факторов (трансформирующего фактора рос-та β, инсулиноподобного фактора роста, морфогенетического белка кости 6);
- ингибировании продукции RANKL;
- увеличении экспрессии гена остеопротегерина - ингибитора образования остеокластов;
- снижении синтеза прорезорбтивных цитокинов (ИЛ-1, -6, ФНО-α, макрофаг-колониестимулирующего фактора);
- стимуляции экспрессии рецепторов к витамину 1,25(ОН)D3, гормону роста и прогестерону.
Кроме половых гормонов, влияющих на достижение надлежащей ПКМ и костный обмен, широко обсуждается роль генетических, гендерных и экзогенных факторов (питание, физическая активность, ятрогенные состояния).
Остеопороз
Остеопороз - это заболевание скелета, для которого характерно уменьшение костной массы, плотности костей и нарушение их архитектоники, что приводит к снижению прочности костей и, следовательно, увеличению риска переломов. Остеопороз характеризуется состоянием, при котором процесс резорбции костной ткани преобладает над процессом костеобразования (рис. 4).
При остеопорозе отсутствует ранняя специфическая клиническая картина. Проявлением остеопороза являются переломы, которые чаще наблюдаются в костях с низкой МПК (минеральной плотностью кости) и происходят при низком уровне травмы (низкотравматичных переломах). Остеопороз следует подозревать, если рост снизился более чем на 2 см за год или на 4 см в течение жизни.
Диагностика остеопороза
Для диагностики остеопороза, как правило, применяют несколько методов:
- рентгенография (информативна при потере костной массы ≥ 30 %);
- одноэнергетическая рентгеновская абсорбциометрия (ОРА);
- двухэнергетическая рентгеновская абсорбциометрия (ДЭРА), включая периферическую;
- количественная компьютерная томография (ККТ), включая периферическую;
- ультразвуковая диагностика.
ДЭРА является «золотым» стандартом неинвазивной диагностики остеопороза.
По результатам данного метода исследования выделяют следующие степени снижения МПК:
Низкая костная масса (остеопения): показатели МПК находятся в пределах 1-2,5 SD (стандартного отклонения) от среднего значения ПКМ у молодых здоровых женщин.
Остеопороз: МПК ниже среднего значения ПКМ у молодых здоровых женщин более чем на 2,5 SD.
Тяжелый (развивающийся) остеопороз: МПК ниже среднего значения ПКМ у молодых здоровых женщин более чем на 2,5 SD, имеются переломы.
Определение биохимических маркеров костного ремоделирования используется не для диагностики остеопороза, а лишь для динамического наблюдения за эффективностью терапии. Маркеры резорбции кости: гидроксипролин, пиридинолин (Пид), дезоксипиридинолин, N- и С-телопептиды, кислая тартратустойчивая фосфатаза. Маркеры формирования кости: костный изофермент щелочной фосфотазы, остеокальцин.
Препараты профилактики и лечения остеопороза
Препараты профилактики и лечения остеопороза различны по своему происхождению и химической структуре, но в зависимости от их главного действия можно разделить на два основных класса: препараты антирезорбтивные и стимулирующие костеобразование.
- эстрогены;
- СЭРМ (селективные модуляторы эстрогеновых рецепторов);
- бисфосфонаты;
- деносумаб;
- кальцитонин;
- стронция ранелат.
- паратгормон;
- анаболические гормоны (андрогены);
- антитело к склеростину;
- стронция ранелат;
- витамин D.
Установлено, что в постменопаузе на фоне дефицита половых гормонов костный обмен возрастает на 20-30 %. Заместительная гормонотерапия (ЗГТ) является первой линией реальной профилактики постменопаузального остеопороза. ЗГТ помогает восстановить костный обмен до уровня пременопаузального, обеспечивая качество кости и адекватное восстановление микроповреждений. Это доказано с помощью гистоморфометрических данных. Даже длительное применение ЗГТ не оказывает отрицательного влияния на костную микроархитектуру [14, 15].
В фазе менопаузального перехода и перименопаузе:
- Климонорм - левоноргестрел + эстрадиол;
- Климен - ципротерон + эстрадиол;
- Фемостон - дидрогестерон + эстрадиол 2/10 и 1/10.
- Анжелик - дроспиренон + эстрадиол;
- Фемостон - дидрогестерон + эстрадиол 1/5.
К парентеральным эстрогенам относятся трансдермальные лекарственные формы эстрадиола в виде гелей, пластыря (Дивигель, Климара,Эстрожель).
Применение эстрогенов или СЭРМ является одним из видов профилактики и лечения остеопороза. В настоящее время мы переживаем новую эру в профилактике постменопаузального остеопороза, т. к. показано, что для его профилактики достаточны низкие и ультранизкие дозы эстрадиола [16]. Кроме того, для исключения пролиферативного влияния эстрогенов на матку и молочные железы изучается влияние СЭРМа базедоксифена в комбинации с эстрогенами [17].
Литературные данные по использованию ЗГТ в ранней постменопаузе с целью профилактики быстрых потерь МПК представлены достаточно широко. Применение ЗГТ не только предотвращает потери костной массы, но и увеличивает МПК у 95 % женщин в постменопаузе. Во всех работах отмечен прирост костной массы в поясничном отделе позвоночника от 2 до 6 % за 12 месяцев. Отмечен более слабый эффект ЗГТ на область бедра.
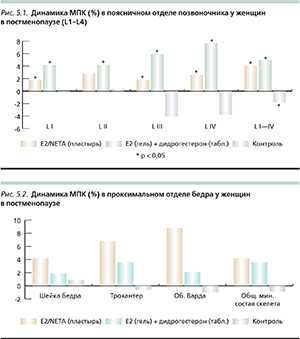
Согласно нашим собственным данным, также установлен положительный эффект различных типов пероральных и трансдермальных эстрогенов и NЕТА (norethisterone acetate) [18, 13]. Для уточнения эффективности трансдермальных форм эстрогенов и прогестагенов у женщин в постменопаузе при снижении МПК мы применили два режима ЗГТ: I - трансдермальный пластырь (Е2 50 мкг/сут) (n = 19); II - 17β-эстрадиол в виде геля 1 мг/сут + дидрогестерон 5 мг/сут (n = 18). Контрольную группу составили 18 женщин, сопоставимых по возрасту, массе тела, МПК и длительности постменопаузы. Средний возраст женщин составил 56,0 ± 5,4 года (46-67 лет). Лечение проводилось 12 месяцев. МПК оценивали методом ДЭРА. Исходно, через 3-9 месяцев определяли уровни маркеров костной резорбции (Пид, Дпид - дезоксиПид) в моче методом хроматографии высокого разрешения в перерасчете на единицу креатинина. Анализ полученных результатов позволил заключить, что ЗГТ вне зависимости от пути введения препаратов оказывает выраженное антирезорбтивное воздействие на костную ткань. ЗГТ (пероральная, трансдермальная или сочетание) способствовала значительному приросту МПК. В области L1-L4 отмечено увеличение МПК на 4,32 и 5,23 % соответственно в I и II группах, в шейке бедра— на 4,90 и 2,08 % соответственно (р < 0,05) (рис. 5.1, 5.2) [13].
Хорошо известно, что ЗГТ эффективна в профилактике остеопороза, если она назначена непосредственно в перименопаузе при наличии факторов риска либо при снижении МПК. Имеются данные, указывающие на выраженное положительное влияние ЗГТ на МПК у женщин старшего постменопаузального возрастов. По данным М. Gambacciani (2003), у женщин в поздней постменопаузе МПК в поясничном отделе за 12 месяцев увеличилась на 3-5 % [16].
Наиболее мощным рандомизированным слепым плацебо-контролируемым исследованием, изучившим влияние ЗГТ на риск развития рака молочной железы, сердечно-сосудистых заболеваний, переломов и пр., является WHI (Women's Health Initiative - Инициатива во имя здоровья женщин) - исследование, проведенное в 40 клинических центрах США в 1993-2002 гг. Были включены 16 608 постменопаузальных женщин в возрасте от 50 до 79 лет с интактной маткой. Основная группа (n = 8506) принимала комбинированную непрерывную ЗГТ: 0,625 мг конъюгированных эстроге-нов + 2,5 мг МПА (медроксипрогестерона ацетат), II группа - плацебо (n = 8102). Эта группа закончила исследование в 2002 г.
вместо планируемых 8 лет; III группа — женщины без матки (n = 10 739) - принимали только эстрогены [19].
В исследовании WHI достоверно доказано положительное влияние комбинированной ЗГТ на костную ткань женщины: относительный риск (ОР) общих переломов снизился на 23 %, переломов тел позвонков и бедра - на 34 %. Применение монотерапии эстрогенами (конъюгированные эквинэстрогены - 0,625 мг) в течение 6,8 года также показало снижение ОР общих переломов на 28 %, переломов тел позвонков и бедра - на 38 % (см. таблицу) [19].
Таким образом, ЗГТ позитивно влияет на МПК и качество органического матрикса кости у женщин в постменопаузе. ЗГТ высокоэффективна в профилактике постменопаузального остеопороза и для коррекции остеопении.
С целью лечения тяжелого остеопороза рекомендуется использование эстрогенсодержащих препаратов в сочетании с лекарственными средствами других групп (бисфосфонатов, стронция ранелата, деносумаба и др.).
ЗГТ достоверно подавляет резорбтивную активность костной ткани. Применение ЗГТ предотвращает потери костной массы, сохраняя МПК, как у здоровых женщин, так и у пациенток с остеопенией, повышая плотность костной ткани. Эффект ЗГТ коррелирует с длительностью терапии и дозами эстрогенов у женщин в ранней постменопаузе. В поздней постменопаузе достаточно эффективны низкие и ультранизкие дозы эстрогенов и прогестагенов. Эффективность ЗГТ повышается при присоединении препаратов кальция (от 800 до 1200 мг), витамина D (от 400 до 800 ME и более) и физической нагрузки. Длительное применение ЗГТ снижает риск переломов различной локализации. Форма применения эстрогенов и тип прогестагена принципиального значения для костного обмена не имеют.
Читайте также:
