Гемангиоперицитома. Ангиоперицитома детей.
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Многопрофильный медицинский центр GMS Clinic, Москва, Россия
Российский онкологический научный центр им. Н.Н. Блохина, Москва
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН, Москва
НИИ КО ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России, Москва, Россия
Редкое наблюдение злокачественной гемангиоперицитомы малого таза
Журнал: Онкология. Журнал им. П.А. Герцена. 2015;4(2): 64‑70
Алиев В.А., Мусаев Э.Р., Татаев И.Ш., Феденко А.А., Овчинникова А.И., Кочура Н.А., Давыдов М.М. Редкое наблюдение злокачественной гемангиоперицитомы малого таза. Онкология. Журнал им. П.А. Герцена. 2015;4(2):64‑70.
Aliev VA, Musaev R, Tataev ISh, Fedenko AA, Ovchinnikova AI, Kochura NA, Davydov MM. Experience in treating a patient with a malignant small pelvic hemangioperocytoma. P.A. Herzen Journal of Oncology. 2015;4(2):64‑70. (In Russ.).
Представлено редкое наблюдение успешного комплексного лечения больного с злокачественной гемангиоперицитомой малого таза. На первом этапе проведена неоадъювантная химиотерапия с последующей радикальной операцией в объеме цилиндрической брюшно-промежностной экстирпации прямой кишки. Продемонстрированы клиническая картина и особенности данного редкого заболевания, а также этапы хирургического вмешательства.
Гемангиоперицитома относится к неэпителиальным опухолям малого таза (синонимы: перицитома, перителеома, лимфангиперицитома, периваскулярная гемангиоэндотелиома). Это редкие злокачественные периваскулярные опухоли, частота которых не превышает 1% от числа сосудистых опухолей [1]. Опухоль состоит из малодифференцированных гладкомышечных клеток, прилегающих к стенкам капилляров и регулирующих их размер. Некоторые авторы рассматривают перициты как источник двух близких опухолей — гемангиоперицитомы и гломанангиомы. Как показывают ультраструктурные исследования, перициты обнаруживаются в стенках капилляров и венул. Они имеют длинные выросты, окружающие сосуд и образующие прерывистый слой между эндотелием и адвентициальной соединительной тканью. Обычно только базальная мембрана отделяет эндотелий от перицитов [2].
Возникает эта опухоль в любом возрасте — от 3 дней жизни до 92 лет, чаще у лиц в возрасте 38—58 лет, с одинаковой частотой у представителей обоих полов. Дифференциальный диагноз следует проводить с саркомой Капоши, ангиолейомиобластомой, фибросаркомой, ангиосаркомой, гломус-ангиомой Баре—Масона, сосудистой лейомиомой, саркомой Юинга [5].
Гемангиоперицитома чаще всего поражает кожу и подкожную жировую клетчатку (34,5%), скелетные мышцы нижних конечностей (24,5%), забрюшинное пространство (24%), область головы и шеи (17%). Опухоль может локализоваться всюду, где имеются капилляры, включая ротовую полость, средостение, забрюшинное пространство [6].
Обычно опухоль имеет овальные и округлые очертания, состоит из отдельных узлов плотноэластической консистенции, серовато-белого или насыщенно-синюшного цвета (в зависимости от степени васкуляризации). С течением времени узлы могут изъязвляться и легко кровоточить. Обычно гемангиоперицитома — солитарная опухоль, реже бывает множественной, сгруппированной на сравнительно небольшом участке тела. Растут опухоли обычно медленно, в редких случаях достигая большого размера, без каких-либо клинических проявлений. Клинические проявления, как правило, связаны со сдавлением опухолью прилежащих органов. В одних случаях возникают явления кишечной непроходимости, в других — дизурические расстройства. Боль возникает в случае сдавливания опухолью нервов.
Возможны эндокринные (гипогликемия) [7], неврологические нарушения, сосудистые изменения (телеангиэктазии, варикозное расширение вен прямой кишки).
Заболевание имеет относительно медленное течение (5—12 лет), но описаны случаи быстрого прогрессирования. Рецидивирование опухоли возможно через много лет после удаления опухоли.
Частота метастазирования при гемангиоперицитоме колеблется от 11,7 до 56,5%. Сроки наблюдения от начала установки диагноза и до обнаружения метастазов составляют от 1 года до 14 лет, в среднем 4,5 года. Наиболее часто опухоль метастазирует в печень, легкие, лимфатические узлы. По данным ряда авторов, летальность в сроки от 3—5 до 15—20 лет колеблется от 23 до 47,8%.
Клиническое наблюдение
Пациент М., 37 лет, обратился с жалобами на боль в малом тазу, иррадиирущую в крестец, тяжесть внизу живота.
Считает себя больным с января 2011 г., когда появились болезненные ощущения в нижних отделах живота и промежности. С марта 2011 г. стал отмечать усиление боли, по поводу чего обратился в одну из городских клиник Москвы, где выявили опухоль малого таза (рис. 1).
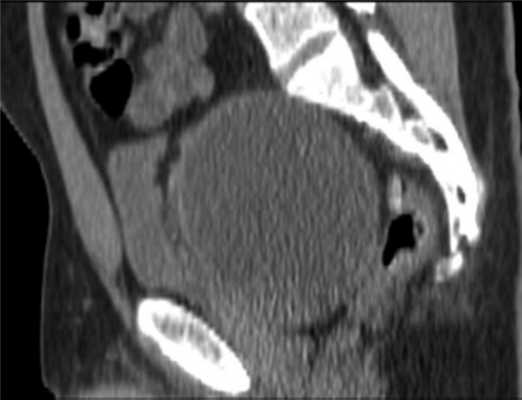
Рис. 1. МР-томограмма малого таза. Опухоль малого таза.
11.04.2011 была выполнена лечебно-диагностическая лапаротомия, удаление опухоли малого таза. При гистологическом исследовании операционного материала выявлена злокачественная шваннома.
В дальнейшем пациент находился под динамическим наблюдением по месту жительства. В январе 2012 г. появились жалобы на боль в промежности.
Больной направлен в ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН, где был диагностирован рецидив опухоли в малом тазу.
Выполнено иммуногистохимическое исследование гистологических препаратов от 11.04.2011: морфоиммуногистохимическая характеристика опухоли соответствует гемангиоперицитоме, на основании чего установлен диагноз: злокачественная гемангиоперицитома малого таза T2bN0M0 G3. Состояние после хирургического лечения от 11.04.2011 — рецидив. В январе 2012 г. прогрессирование. При поступлении состояние относительно удовлетворительное.
При пальцевом исследовании прямой кишки сразу за анусом, внекишечно, пальпируется неподвижное опухолевое образование, занимающее практически весь малый таз, прямая кишка циркулярно сужена с выраженным болевым синдромом, однако слизистая оболочка прямой кишки не изменена.
По данным магнитно-резонансной томографии (МРТ) от 10.02.2012, в полости малого таза пресакрально располагается опухоль размером 9,2×9×7 см. Верхний полюс ее на уровне тела S I позвонка, распространяется в параректальную клетчатку, тесно прилежит к прямой кишке, оттесняя ее влево (граница прослеживается). Нельзя исключить прорастание в кишку, стенки прямой кишки отечны. Опухоль прилежит к семенным пузырькам и предстательной железе (граница прослеживается); мочевой пузырь оттеснен кпереди и кверху; верхний полюс опухоли расположен между грушевидными мышцами, прилежит к передней поверхности крестца и копчика (граница прослеживается), нижний полюс опухоли расположен между волокнами мышцы, поднимающей задний проход; нижние ягодичные сосуды справа оттеснены кпереди, тесно прилежат к опухоли на протяжении 3 см (рис. 2).
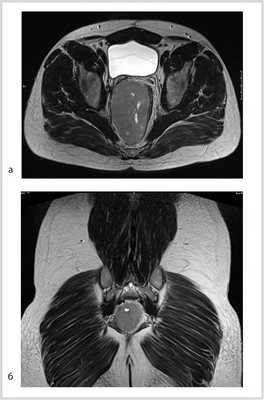
Рис. 2. МР-томограммы малого таза. Пресакрально располагается опухоль размером 9,2×9×7 см. а — сагиттальный срез; б — фронтальный срез.
Учитывая данные иммуногистохимического исследования (G3, количество митозов >30%) и местный рецидив опухоли, больной консультирован химиотерапевтом из группы лечения сарком и радиологом, после чего решено провести неоадъювантную полихимиотерапию.
Проведено 6 курсов полихимиотерапии по схеме HD AI (препараты: ифосфамид 2000 мг/м 2 в/в в 1—5-й день, СД =20 000 мг; месна 2000 мг/м 2 в/в в 1—5-й день, СД =20 000 мг; доксорубицин 60 мг/м 2 в/в в 1-й день, СД =120 мг; нейпомакс по 300 мкг п/к в 6—15-й день).
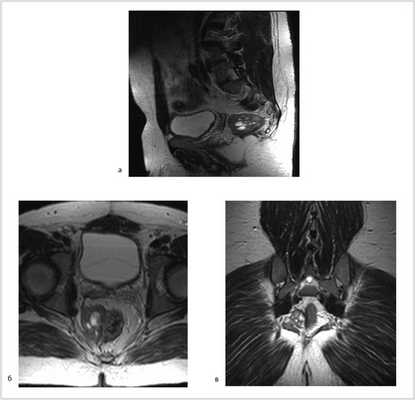
Рис. 3. МР-томограммы малого таза. Опухоль уменьшилась в размере до 5,5×3,5×4 см, однако тесно прилежит к правой стенке прямой кишки. а — аксиальный срез; б — сагиттальный срез; в — фронтальный срез.
По данным ультразвукового исследования компьютерной томографии брюшной полости и рентгенографии органов грудной клетки отдаленных метастазов не выявлено.
В отделении проведен повторный консилиум с участием химиотерапевтов саркомной группы, хирургов сакральной группы, а также сотрудников отделения онкопроктологии. Учитывая нерадикальность предыдущей операции по поводу неэпителиальной опухоли малого таза, положительную динамику на фоне полихимиотерапии в виде уменьшения размера опухоли (более чем в два раза), а также молодой возраст пациента, принято решение вторым этапом выполнить оперативное вмешательство в объеме цилиндрической (экстралеваторной) брюшно-промежностной экстирпации прямой кишки, предложенной австрийским хирургом Т. Holm в 2007 г.
07.11.2012 выполнена цилиндрическая или экстралеваторная экстирпация прямой кишки. Через тазовую брюшину в мезоректальной клетчатке справа пальпируется верхний полюс опухоли, подрастающей к стенке прямой кишки, опухоль фиксирована к правой боковой стенке таза. Отдаленных метастазов нет (рис. 4).
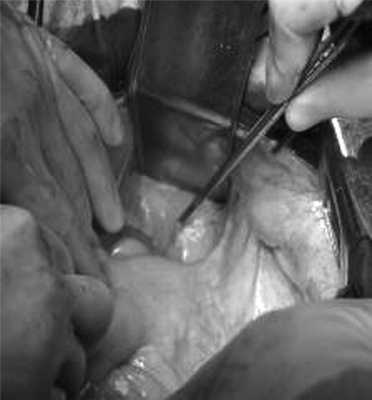
Рис. 4. Этап операции. Ревизия опухоли.
Произведена мобилизация прямой кишки по левой и задней полуокружности, а также пресакрально до мышц тазового дна с соблюдением всех онкологических правил (рис. 5). По левой боковой стенке таза опухолевая капсула интимно прилежит к внутренней подвздошной вене и артерии, острым путем последняя мобилизована от магистральных сосудов.
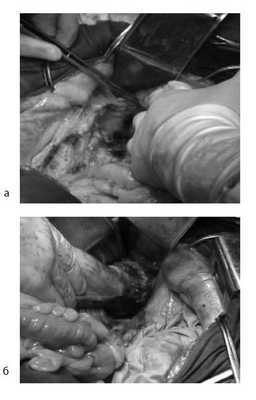
Рис. 5. Этапы операции. а — мобилизация слева; б — мобилизация справа.
Далее сигмовидная кишка пересечена на уровне ее дистальной трети, а прямая кишка погружена в малый таз, при этом тазовая брюшина ушита над заглушенной культей прямой кишки. Затем сигмовидная кишка забрюшинно выведена в левом боковом отделе живота на переднюю брюшную стенку и сформирована плоская колостома, после чего брюшная полость ушита наглухо послойно (рис. 6).
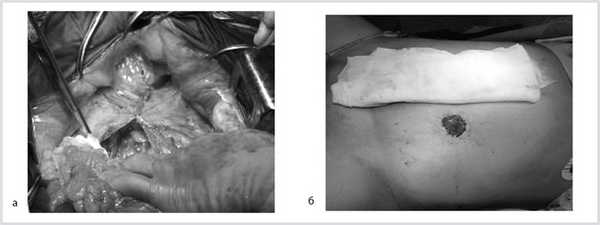
Рис. 6. Этапы операции. а — ушивание тазовой брюшины; б — сигмостома.
Далее больной перевернут на живот в положении по типу «перочинного ножа» (рис. 7).
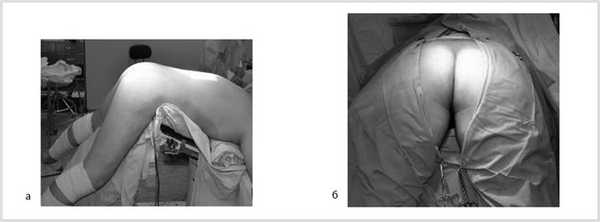
Рис. 7. Положение больного на столе (а). Вид операционного поля промежности (б).
После обработки операционного поля мобилизация прямой кишки продолжена из широкого промежностного доступа. Выполнено ушивание заднего прохода кисетным швом, намечены края резекции. В проекции крестцово-копчикового сочленения кожа и подкожная жировая клетчатка рассечены до задней крестцово-копчиковой связки. Последняя пересечена в поперечном направлении. Выполнена ампутация копчика с последовательным пересечением передней крестцово-копчиковой и крестцово-прямокишечной связок (рис. 8).
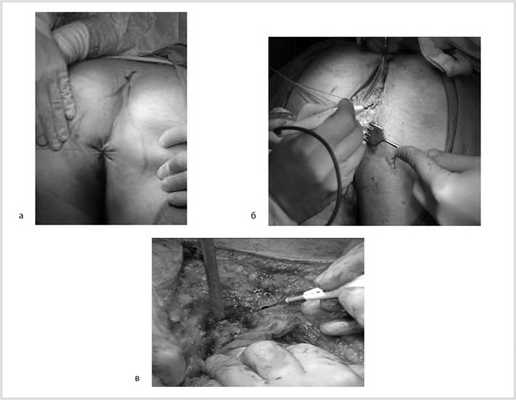
Рис. 8. Этапы операции. а — ушивание ануса; б — рассечение кожи и подкожной жировой клетчатки; в — пересечение крестцово-копчиковых связок.
Далее прямая кишка с опухолью в едином блоке мобилизована острым путем от предстательной железы и правой стенки таза, после чего выполнена цилиндрическая брюшно-промежностная экстирпация прямой кишки. Малый таз дренирован двумя силиконовыми дренажами и ушит наглухо (рис. 9).
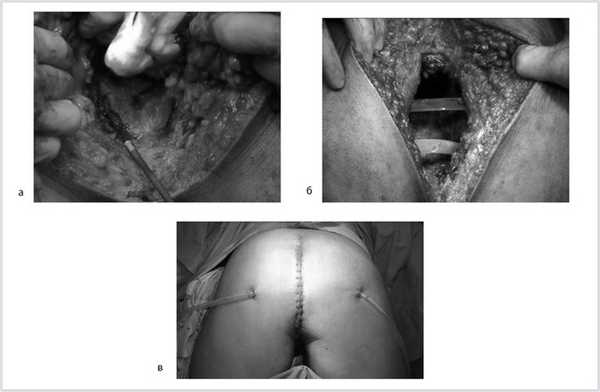
Рис. 9. Этапы операции. а — мобилизация простаты; б — дренирование малого таза; в — конечный вид раны.
Гистологическое заключение: в жировой клетчатке прямой кишки, с учетом иммуногистохимического исследования разрастания злокачественной гемангиоперицитомы с признаками лечебного патоморфоза 1-й степени (жизнеспособной опухолевой ткани более 50% по DWORAK). Опухоль не прорастает в прилежащий мышечный слой кишки. В одном лимфатическом узле прилежащей клетчатки элементов опухолевого роста нет. В краях резекции кишки без элементов опухолевого роста. Под маркировкой «латеральный край опухоли» — кусочек фиброзной ткани с очагами ксантоматоза (рис. 10).
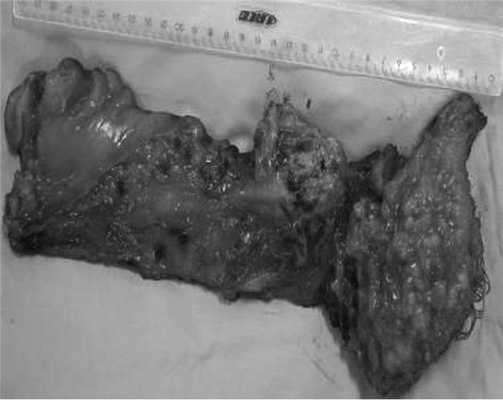
Рис. 10. Макропрепарат.
Продолжительность операции составила 3 ч 30 мин, кровопотеря — 500 мл. Интраоперационных и ранних послеоперационных осложнений не было. Пациент на 12-е сутки выписан из хирургического отделения.
Заключение
Лечение больных с опухолями малого таза представляет собой сложную задачу, ключом к решению которой является мультидисциплинарный подход. В настоящее время нет четких дифференциальных диагностических критериев гемангиоперицитом, сарком и солитарных фиброзных опухолей. Несмотря на то что данные опухоли традиционно считаются радиорезистентными, до недавнего времени при лечении сарком таза часто использовали лучевую или химиолучевую терапию. Сегодня сложно переоценить важность точной диагностики, так как правильный диагноз должен быть установлен лишь на основании иммуногистохимического исследования, которое позволяет прогнозировать ход дальнейшего лечения и прогноз заболевания. В литературе имеются лишь единичные наблюдения хирургического лечения гемангиоперицитом малого таза. На наш взгляд, радикальное хирургическое вмешательство — основной метод лечения больных с гемангиоперицитомой. Однако при местно-распространенной опухоли или в случае рецидива заболевания, при которых имеется тесная связь опухоли с прилежащими анатомическими структурами малого таза, возможность достижения свободного от опухоли латерального края резекции и радикальности операции становится обоснованно сомнительной. При повторном рецидивировании возможно использование рентгенохирургических технологий, таких как «Кибер-нож». В таких случаях коллегиальное обсуждение с участием хирургов, химиотерапевтов и лучевых терапевтов становится залогом успешного лечения больного.
В данном клиническом наблюдении продемонстрировано успешное комплексное лечение больного со столь редкой патологией. На наш взгляд, хотя проведенное предоперационное лечение было эффективным, выполнение экстралеваторной брюшно-промежностной экстирпации, явилось ключевым элементом радикального лечения больного.
Гемангиоперицитома. Ангиоперицитома детей.
Российский центр функциональной хирургической гастроэнтерологии Росздрава, кафедра хирургии №1 факультета повышения квалификации и последипломной подготовки специалистов Кубанского государственного медицинского университета, Краснодар
ФГБОУ ВО «Кубанский государственный медицинский университет» Минздрава РФ, Краснодар, Россия
ГБУЗ «Краевая клиническая больница №2», Краснодар, Россия
ГБУЗ «Краевая клиническая больница №2», Краснодар, Россия;
ФГБОУ ВО «Кубанский государственный медицинский университет», Краснодар, Россия
Удаление неорганной забрюшинной гемангиоперицитомы и резекция почки при первично-множественном синхронном раке
Представлен обзор литературы о современном состоянии проблемы первично-множественного рака с локализацией в забрюшинном пространстве и почке. Описано собственное клиническое наблюдение успешного хирургического лечения первично-множественной синхронной опухоли забрюшинного пространства (гемангиоперицитома) с органосохраняющей резекцией опухоли почки.
Под первичной множественной опухолью (ПМО) понимают развитие у пациента двух и более друг от друга независимых новообразований [1].
S. Warren и O. Gates [2] в 1932 г. опубликовали первое систематическое исследование ПМО. Они предложили считать опухоли первично-множественными в случае, если: 1) все они злокачественные; 2) каждая опухоль анатомически изолированная; 3) вторая опухоль не является рецидивом или метастазом первой. ПМО могут развиваться в одном органе (мультицентрически), в парных органах и в органах одной системы (функционально-зависимые), а также в органах и системах, не связанных функциональной зависимостью. Эти положения остаются актуальными по сей день [2].
Частота встречаемости ПМО среди всех новообразований составляет 8,1—18,4% и увеличивается во всем мире с каждым годом [3—5]. По данным отечественной статистики, также наблюдается рост числа ПМО, что связано как с общим увеличением продолжительности жизни населения, так и с совершенствованием диагностики онкопатологии. Количество впервые выявленных ПМО в России в 2000 г. составило 1,9%, в 2010 г. — 2,8%, а в 2018 г.— уже 8,8%. Чаще наблюдается сочетание двух новообразований [6].
Большинство авторов при возникновении ПМО одновременно или в сроки до 6 мес называют их синхронными. Метахронными называют ПМО, если срок между возникновением новообразований более 6 мес. По данным российской статистики [6], частота синхронных опухолей среди всех ПМО составляет 26,7%. Выживаемость пациентов с синхронными опухолями ниже, чем с метахронными [3].
Мы не обнаружили в доступной литературе описания случаев синхронной ПМО с наличием неорганной забрюшинной опухоли (НЗО) и рака почки.
НЗО — редкая группа онкологических заболеваний. Они представляют собой опухоли, локализующиеся в собственно забрюшинном пространстве, между брюшинными листками брыжжейки кишечника, подбрюшинно в полости таза и не имеющие органной принадлежности [7].
Первое описание НЗО представил A. Benivieni в 1507 г., а термин «забрюшинная саркома» был предложен в 1829 г. J. Lobstein. В России о НЗО впервые сообщили Н. Филиппов и М.В. Кузнецов в 1890 г., в последующем вышло в свет довольно много научных трудов, касающихся проблем НЗО [8]. Отдаленные результаты лечения НЗО, по данным литературы, довольно разноречивы и зависят от гистологической структуры опухоли.
Одной из редких мезенхимальных НЗО с высокой васкуляризацией является гемангиоперицитома, регистрируемая менее чем в 1% случаев сосудистых опухолей. Эти опухоли чаще встречаются у пациентов в возрасте 50—60 лет. Они могут появиться в любом месте, где есть капиллярные сосуды, но наиболее частой локализацией являются органы опорно-двигательной системы. Новообразование в 28% случаев исходит из забрюшинного пространства [9]. Опухоль происходит из плотно упакованных клеток вокруг разветвляющихся тонкостенных и эндотелиально-выстланных сосудистых каналов перицитов, представляющих собой сократительные прекапиллярные клетки, впервые идентифицированные и описанные К. Zimmerman в 1923 г. Он также определил происхождение опухоли, механизм регуляции кровотока в капиллярах и посткапиллярных венулах. Однако сам термин «гемангиоперицитома» впервые применили в 1942 г. A. Stout, M. Murray для описания забрюшинной опухоли, состоящей из пролиферирующих клеток перицитов [9].
У пациентов с гемангиоперицитомами часто отсутствуют симптомы заболевания, а опухоль впервые обнаруживают при достижении больших размеров. По мере роста она может сдавливать смежные органы, вызывая боль. Нередки случаи манифестации болезни с приступа гипогликемии, что связано в ряде случаев с продукцией опухолью инсулиноподобного фактора роста (IGF) [10]. Ультразвуковое и компьютерное томографическое сканирование имеет определяющее значение при визуализации местоположения, определении размера новообразования, а также взаимосвязи с окружающими структурами. На компьютерной томограмме опухоль представляет собой гиперваскулярную солидную массу с гиподенсными областями внутри, c некротическим и геморрагическим компонентами [10]. Однако постановка окончательного диагноза возможна только при гистологическом и иммуногистохимическом исследованиях ткани опухоли [9, 10].
Хирургический метод является основным радикальным способом лечения гемангиоперицитомы [9, 10]. В литературе [11—13] описаны успешные случаи хирургического лечения злокачественных забрюшинных гемангиоперицитом диаметром от 6 до 20 см и более и массой от 1 до 3 кг и более. L. Grille и соавт. [12] представили случай лечения гигантской ретроперитонеальной гемангиоперицитомы. Благодаря уникальному сосудистому кровоснабжению была произведена предоперационная артериальная эмболизация, что дало возможность в последующем удалить ее в полном объеме и снизить интраоперационную кровопотерю.
Прогноз заболевания очень изменчив, хотя 5-летняя безрецидивная выживаемость достигает 86% [9]. Однако опухоль имеет тенденцию к рецидивированию и метастазированию в отдаленные сроки, описаны случаи рецидива опухоли спустя 18—20 лет и более после успешного хирургического лечения [14—16].
Почечно-клеточный рак (ПКР) является одним из наиболее распространенных онкоурологических заболеваний. В мире ежегодно устанавливают около 210 000 новых случаев ПКР, что составляет примерно 2% в структуре онкозаболеваемости, причем 2/3 больных выявляют в развитых странах [17, 18]. Распространенность ПКР в России на 2018 г. составила 121,1 случая на 100 000 населения [6].
Лечение ПКР достаточно полно и информативно описано в национальных рекомендациях по лечение рака мочеполовой системы. В рамках данной статьи и последующего описания клинического случая хотелось бы акцентировать внимание на органосохраняющем варианте операции (резекция почки) при ПКР. Количество локальных рецидивов при данном виде хирургического лечения составляет 4—10%, а общая выживаемость этих больных равна таковой у пациентов со стадией T1−2N0M0, которым была выполнена радикальная нефрэктомия [19]. Поэтому органосберегающее вмешательство оправдано у пациентов не только со сниженной, но и с нормальной функцией коллатеральной почки при небольшом (до 4 см) размере опухоли [17, 19].
Приводим клиническое наблюдение
Больной М., 59 лет, проходил обследование в поликлинике по месту жительства по поводу пупочной и левосторонней паховой грыжи, в ходе которого выявлено большое объемное образование забрюшинного пространства. Пациента беспокоили тупые распирающие боли в левых отделах живота с иррадиацией в левую паховую область.
При объективном исследовании в левой боковой области живота пальпировалось опухолевидное образование размером 20×20 см. Все лабораторные показатели в пределах нормы.
При УЗИ органов брюшной полости выявлены: объемное забрюшинное образование в левых отделах забрюшинного пространства с нечеткими контурами размером 150×131×125 мм, а также новообразование в нижнемедиальном отделе правой почки с нечеткими контурами, солидной структуры размером 25×44×34 мм; кисты паренхимы правой почки и холецистолитиаз.
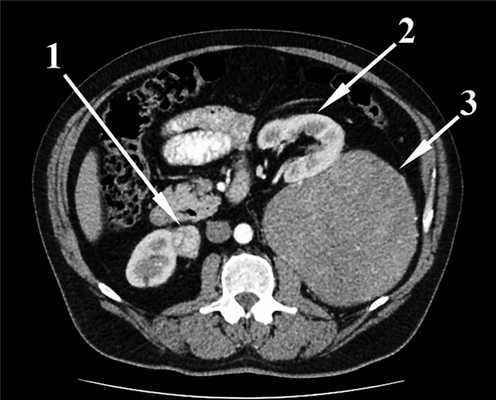
Результаты компьютерной томографии брюшной полости и забрюшинного пространства с внутривенным контрастированием подтвердили наличие неорганного объемного образования левого забрюшинного пространства, интимно прилежащего к левому надпочечнику, краниокаудальный размер которого был равен 241 мм, а максимальный поперечный размер — 143 мм. Структура образования в верхних 2/3 была относительно однородная, в нижней трети — неоднородная за счет наличия двух узлов, без контрастного усиления, что расценено как зона распада. Также визуализировано объемное образование нижнего полюса передней поверхности правой почки размером 25×27 мм с неоднородным контрастным усилением (рис. 1). Рис. 1. Компьютерная томограмма органов брюшной полости (уровень LI—II). 1 — образование нижнего полюса правой почки; 2 — левая почка; 3 — неорганная забрюшинная опухоль.
Пациенту выполнены компьютерная томография органов грудной клетки, фиброгастродуоденоскопия, колоноскопия, патологии при этих исследованиях не выявлено. При радиоизотопной сцинтиграфии получены данные о замедлении перфузии, незначительном снижении фильтрационной и умеренном уменьшении экскреторной функции в правой почке. В левой почке отмечено замедление объемной скорости кровотока, умеренное снижение фильтрационной и незначительное снижение экскреторной функции.
В ходе проведенного обследования установлен предварительный диагноз: неорганная забрюшинная опухоль; опухоль правой почки сT1аNxMо. Сопутствующий диагноз: правосторонняя вправимая паховая грыжа Р2L по классификации EHS. Вправимая пупочная грыжа. Гипертоническая болезнь II стадии, 2-й степени. Риск 2. Хронический необструктивный бронхит вне обострения.
04.04.18 пациенту выполнена симультанная операция: лапаротомия, удаление гигантской неорганной забрюшинной опухоли, резекция опухоли правой почки, закрытие дефекта правой паховой области сетчатым трансплантатом, пластика пупочного кольца местными тканями, дренирование брюшной полости.
После тотальной срединной лапаротомии в забрюшинном пространстве слева обнаружена опухоль размером 20×30 см, неотделимая от левой паранефральной клетчатки, располагающаяся от нижнего уровня левой почки и вверх до основания диафрагмы. Брыжейка и левая половина ободочной кишки смещены медиально. Поэтапно тупо и остро в пределах неизмененных тканей (макроскопически опухоль в капсуле) опухоль отделена от задней и боковой стенок живота и прилежащих органов (поджелудочная железа, левый надпочечник). Затем путем маневра Кохера выполнен доступ к правой почке. Произведена мобилизация структур ворот правой почки. Почка выделена из паранефрия. Выявлена опухоль размером 40×30 мм, расположенная на 2/3 экзофитно по переднемедиальной поверхности нижнего полюса правой почки с распространением на ее среднюю часть (рис. 2). Рис. 2. Вид после мобилизации правой почки. 1 — правая почка; 2 — новообразование нижнего полюса правой почки. С учетом данных радиоизотопной сцинтиграфии о снижении функции левой почки решено выполнить органосохраняющую операцию в виде резекции опухоли правой почки. Выполнено временное пережатие сосудов ворот правой почки. Остро опухоль по здоровой ткани иссечена. Раневая поверхность почки прошита непрерывными швами нитью PDS 5/0. Восстановлен почечный кровоток (время ишемии 20 мин). Дефект почки ушит П-образными швами на полипропиленовой сетке (рис. 3). Рис. 3. Вид после резекции опухоли и закрытия дефекта. Почка уложена в свое ложе и укрыта остатками паранефрия.
Операция прошла без осложнений. Объем кровопотери составил 800 мл. В отделении анестезиологии и реанимации пациент провел 7 сут, выписан из стационара на 12-е сутки.
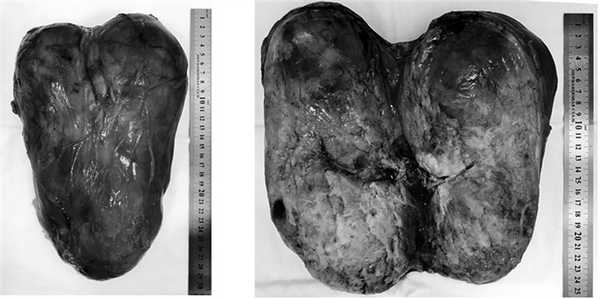
Заключение прижизненного патолого-анатомического исследования операционного материала: опухоль правой почки — светлоклеточный почечно-клеточный рак, G1, с инвазией в капсулу почки и паранефральную клетчатку, G2 по Furman; паранефральная клетчатка R0, край резекции правой почки R0. Неорганная забрюшинная опухоль — мезенхимальная опухоль забрюшинного пространства с низкой митотической активностью, с очагами некроза опухолевой ткани (рис. 4). Рис. 4. Макропрепарат удаленной гемангиоперицитомы.
При иммуногистохимическом исследовании: Vim, CD34, CD68 — положительная экспрессия в опухолевой ткани. Морфоиммуногистохимические характеристики опухоли соответствуют гемангиоперицитоме.
Заключительный диагноз: первично-множественный синхронный рак: неорганная забрюшинная опухоль. Опухоль правой почки рT1аN0M0. Правосторонняя вправимая паховая грыжа Р2L по классификации EHS. Вправимая пупочная грыжа.
Адъювантную химиолучевую терапию не проводили. При обследовании через 12 мес после операции состояние удовлетворительное. По данным УЗИ и компьютерной томографии признаков прогрессирования заболевания нет.
Представленный редкий случай ПМО (гигантская гемангиоперицитома и ранний рак почки), выявленных во время обследования пациента, обратившегося к врачу по поводу грыжевой болезни, показывает важность расширенного обследования данной категории больных. Симультанное радикальное хирургическое лечение позволяет надеяться на благоприятный отдаленный результат, однако требуется дальнейшее длительное наблюдение за пациентом.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва
ФГБНУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко», Москва, Россия
ФГУ "НКЦ оториноларингологии" ФМБА России
ФГКУ "Центральный клинический военный госпиталь" ФСБ России, Москва
Редкое наблюдение гигантской гемангиоперицитомы
Приводится пример успешного лечения больного с гигантской интракраниальной гемангиоперицитомой. Гемангиоперицитомы являются агрессивными опухолями с высокой частотой рецидивирования и отдаленного метастазирования. Хотя эти опухоли и относятся к злокачественным новообразованиям, они часто достигают больших размеров при незначительных клинических проявлениях. Хирургический метод лечения до настоящего времени остается основным в лечении данных новообразований.
Менингеальные гемангиоперицитомы (ГП) являются агрессивными опухолями с высокой частотой рецидивирования и отдаленного метастазирования. Хотя эти опухоли и относятся к злокачественным новообразованиям, они часто достигают больших размеров при незначительных клинических проявлениях. Хирургический метод лечения до настоящего времени остается основным в лечении данных новообразований.
ГП является злокачественной опухолью, происходящей из перикапиллярных клеток, или перицитов Циммермана. Эти опухоли обычно возникают в нижних конечностях, тазу и забрюшинном пространстве.
Внутричерепные ГП редки, поскольку они составляют 2-4% всех менингеальных опухолей и менее 1% всех внутричерепных опухолей.
Согласно последней международной классификации опухолей мягких тканей и костей ВОЗ 2013 г. [25, 26], ГП включены в качестве гистологического варианта в единую нозологическую форму - экстраплевральную солитарную фиброзную опухоль под названием «солитарная фиброзная опухоль с преобладанием гемангиоперицитарно подобного сосудистого компонента». Термин «гемангиоперицитома» рассматривается как устаревший синоним.
Несмотря на это, мы, учитывая локализацию процесса и основываясь на ныне действующей классификации опухолей ЦНС ВОЗ от 2007 г., анализируя ретроспективно источники литературы, посвященные опухолям, ранее диагностированным как ГП, оставляем за собой право использования этого термина в настоящей работе.
Больной П., 40 лет, поступил 13.03.09 в ФГКУ «Центральный военный клинический госпиталь» ФСБ России с жалобами на двустороннее снижение зрения, двоение, выраженную постоянную головную боль преимущественно в лобно-теменных областях.
По данным медицинских документов и со слов больного, начало заболевания с декабря 2008 г., когда появилась головная боль. В дальнейшем, в течение 1 мес развились зрительные нарушения - диплопия, концентрическое сужение полей зрения.
В январе 2009 г. при диспансеризации осмотрен офтальмологом, выявлен застой на глазном дне, направлен на стационарное лечение и обследование в лечебное учреждение по месту жительства. При обследовании диагностировано гигантское объемное образование левой гемисферы головного мозга, предположительно менингиома области переднего наклоненного отростка левого крыла основной кости. Для продолжения обследования и лечения госпитализирован в отделение нейрохирургии ЦКВГ ФСБ России, где при дообследовании диагноз подтвержден, начата противоотечная и дегидратационная терапия кортикостероидами.
При обследовании патологии внутренних органов не обнаружено. Больной в сознании, контактен. Критика к своему состоянию и к окружающему снижена. На вопросы отвечает адекватно, но периодически с элементами копролалии. Неврологический статус: не доводит глазные яблоки кнаружи влево, парез взора вверх, аккомодация отсутствует, лицо асимметричное, правый угол рта опущен. Мышечная сила в руках и ногах достаточная - 5 баллов с двух сторон. Сухожильные рефлексы повышены, анизорефлексия с повышением сухожильных рефлексов справа с расширением рефлексогенных зон. Клонусы надколенников и стоп, больше справа. Положительные симптомы Оппенгейма и Пуссепа слева. Симптом Маринеску-Радовичи с обеих сторон. Дистальный гипергидроз. Осмотр окулиста: VIS OS = 0,9, VIS OD = 1,0. Поля зрения: концентрическое сужение полей зрения до 20-30° справа от точки фиксации и до 30-40° слева от точки фиксации, абсолютные парацентральные скотомы обоих глаз. Глазное дно: диски зрительных нервов гиперемированы, отечны, границы смазаны, проминируют в стекловидное тело, перипапиллярно - отек, мелкие кровоизлияния, экссудаты, артерии резко сужены, спазмированы; вены расширены с разрывами, экссудацией. Застойные диски зрительных нервов обоих глаз.
При тотальной селективной каротидной ангиографии (КАГ) выявлено гиперваскуляризированное образование передней и средней черепной ямок слева, размером 7×7 см, питающееся ветвями левых средней мозговой артерии (СМА), наружной сонной артерии (НСА), интракраниального сегмента внутренней сонной артерии (ВСА). Венозные синусы проходимы, без признаков тромбоза (рис. 1).
Рисунок 1. Селективная КАГ(S). Гиперваскуляризированное образование передней и средней черепной ямок слева, размером 7×7 см, питающееся ветвями левых СМА, НСА, интракраниального сегмента ВСА. Венозные синусы проходимы, без признаков тромбоза.
При КТ головного мозга преимущественно в левой лобно-височно-теменной области определяется крупное объемное образование с достаточно четкими бугристыми контурами размером 78×76×64 мм, в базальных отделах прорастающее в правую лобную долю на 10-12 мм. Образование интимно прилежит к сифону левой ВАС, дну передней черепной ямки и к переднему бугорку турецкого седла, кости, образующие дно передней черепной ямки, «изъедены». Образование компримирует передние отделы левого бокового желудочка и, вероятно, распространяется в его просвет. При внутривенном контрастном усилении образование несколько неравномерно накапливает контрастный препарат (до +60 - +85 Ед. Хаунсфильда). К образованию подходит множество артериальных сосудов диаметром до 2-3 мм, преимущественно с медиальной и передней сторон образования. Определяется незначительно выраженный перифокальный отек (максимально до 7 мм у латерального края образования в левой височной области) (рис. 2).
Рисунок 2. КТ с контрастным усилением до операции. а - аксиальная проекция; б - фронтальная проекция. В левой лобно-височно-теменной области определяется крупное объемное образование с достаточно четкими бугристыми контурами размером 78×76×64 мм, в базальных отделах прорастающее в правую лобную долю на 10-12 мм. Образование компримирует передние отделы левого бокового желудочка и, вероятно, распространяется в его просвет, образование неравномерно накапливает контрастный препарат. Определяется незначительно выраженный перифокальный отек.
25.03.09 произведена операция. Осуществлен дугообразный разрез в левой лобно-теменно-височной области. Произведен расширенный птериональный доступ. Экстрадурально осуществлена резекция наружных отделов левого крыла основной кости. Твердая мозговая оболочка (ТМО) резко напряжена, выбухает, пульсация головного мозга не определяется. ТМО вскрыта по наружному краю базальных отделов левой лобной доли. Дальнейший ход операции с использованием операционного микроскопа и микрохирургического инструментария. Отведена от основания черепа лобная доля. Обнаружена ярко-розового цвета отграниченная от вещества головного мозга мелкобугристая опухоль, мягкая, легко кровоточивая - по виду больше похожа на параганглиому, чем на менингиому. Кровотечение интенсивное (алая кровь), гемостаз произведен при помощи придавливания опухоли ватниками с перекисью водорода. Возникло острое набухание и вспучивание мозга с грибовидным выбуханием его в дефект ТМО. Проведены противоотечные мероприятия. После устойчивого уменьшения напряжения и выбухания мозга возобновлены микрохирургические действия. Опухоль довольно легко фрагментировалась и удалялась обычным вакуумным отсосом. Часть опухоли отправлена на срочное гистологическое исследование, предварительный результат - менингиома смешанного строения. В основном опухоль гомогенная, кровоточивая, лишь в медиально-базальных отделах опухоль по строению напоминает бугристую с плотной стромой ячеистую менингиому, где имеет более отчетливо сформированные сосуды в строме и бо`льшую плотность. Кровоснабжение опухоли осуществлялось преимущественно из переходных пиальных сосудов, в связи с чем при удалении опухоли по границе с веществом головного мозга сопровождалось особенно интенсивным кровотечением. Матрикс опухоли обнаружен в медиальных отделах крыла основной кости на границе с передним наклоненным отростком, где стромальная структура опухоли наиболее выражена. ТМО в этой области узурирована, кровоточива, тщательно коагулирована. Опухоль удалена радикально. Визуализирована левая ВСА в супраклиноидном отделе, бифуркация ВСА, начальные сегменты СМА и передней мозговой артерии. Окончательный гемостаз аппликацией кровоостанавливающей ваты Суржицель. Появилась отчетливая пульсация мозга. Мозг расправился, частично запал. Анатомических повреждений мозгового вещества вследствие тракции мозга не произошло. ТМО без натяжения ушита непрерывным швом атравматической нитью. Костный лоскут уложен на место, фиксирован костным швом. Послойное ушивание раны. Интраоперационная кровопотеря около 3500 мл.
Гистологический диагноз: исследование, проведенное в условиях ЦКВГ ФСБ России, - менингиома смешанного строения, отмечается плотное расположение клеток, очаги некрозов и фигуры митозов не определяются.
После иммуногистохимического исследования в лаборатории нейроморфологии НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН: гемангиоперицитома, выраженная экспрессия Vim, CD 34, Factor XIII, ИМ пролиферативного маркера Ki-67 очагово более 5%, Grade III (рис. 3).
Рисунок 3. Микропрепараты опухоли. х400. а - гемангиоперицитома типичного строения с немногочисленными митозами, б - экспрессия CD 34 в клетках гемангиоперицитомы; в - ядерная экспрессия Ki-67 в опухоли. Окраска гематоксилином и эозином.
Послеоперационный период осложнился правосторонней плевропневмонией, формированием эпидуральной гидромы в области операции, сохранялся цефалгический синдром. Получал комплексную терапию: восполнение послеоперационной кровопотери (трансфузия эритроцитной массы - общий объем 1745 мл и свежезамороженной плазмы - 4900 мл), антибактериальную терапию, санационные люмбальные пункции, противоотечную терапию. Посевы ликвора - стерильны, роста нет. Рана зажила первичным натяжением. В ближайшем послеоперационном периоде отмечен регресс общемозговой и очаговой неврологической симптоматики, регресс психических нарушений.
КТ с контрастным усилением в 1-е сутки после операции не выявила участков патологического накопления контраста. Опухоль удалена радикально (рис. 4).
Рисунок 4. КТ с контрастным усилением. 1-е сутки после операции. а - аксиальная проекция; б - фронтальная проекция. Опухоль удалена радикально, геморрагических осложнений в ложе удаленной опухоли нет.
При контрольных КТ и МРТ с контрастным усилением через 5 мес после операции нет признаков рецидива (рис. 5).
Рисунок 5. КТ с контрастным усилением в аксиальной проекции (а) и МРТ с контрастным усилением в аксиальной (б) и фронтальной (в) проекциях. 5 мес после операции (признаков рецидива опухоли нет).
Однако, учитывая гистологию, радиологами НИИ нейрохирургии РАМН рекомендовано проведение по месту жительства лучевой терапии на область удаленной опухоли в суммарной очаговой дозе (СОД) 56 Гр.
Катамнез у больного прослежен в течение 5 лет. Рецидива опухоли нет.
Термин «гемангиоперицитома» впервые применили А. Stout, М. Murray [23] в 1942 г. для описания новообразования, расположенного в забрюшинном пространстве и состоящего преимущественно из пролиферирующих перицитов.
Менингеальные ГП впервые описаны в 1928 г. Р. Bailey и соавт. [2] и считались ангиобластическим вариантом менингиом. Иммуногистохимические, ультраструктурные и генетические исследования впоследствии показали полное отличие ГП от всех других типов менингиом [12, 18]. В последней классификации ВОЗ (2007) опухолей центральной нервной системы ГП отнесены к мезенхимальным неменинготелиальным опухолям и подразделяются на две степени злокачественности: II и III по пролиферативному потенциалу [14]. ГП состоит из мелких овальных клеток с большим количеством тонкостенных сосудов различного калибра, имея характерный сосудистый рисунок в виде «оленьего рога» [18]. Многие авторы указывают на наличие характерных нейрорентгенологических и ангиографических особенностей ГП. В отличие от менингиом большинство ГП имеет многодольчатое строение с нечеткими границами и инфильтрацией окружающей мозговой ткани, без гиперостоза, костных эрозий и кальцификатов. Также отмечается наличие перифокального отека. Кровоснабжение ГП осуществляется преимущественно из ветвей ВСА и задней мозговой артерии в отличие от менингиом, которые питаются в основном из оболочечных артерий НСА. Некоторые авторы [10, 16] отмечают наличие большого количества мелких штопорообразных сосудов в строме и выраженную сосудистую сеть, что является отличительной особенностью ГП.
Предоперационная эмболизация питающих сосудов опухоли, по данным литературы [11], является эффективной в уменьшении кровоснабжения, но, учитывая особенности кровоснабжения ГП, это не всегда возможно.
В настоящее время хирургия расценивается как основной метод лечения менингеальных ГП [10, 13, 15]. Частота «локальных» рецидивов высока даже после радикального удаления ГП, у некоторых авторов [15] данный показатель достигал 50%. Послеоперационная лучевая терапия уменьшает частоту рецидива ГП [19-21, 24]. В случаях труднодоступной локализации опухолей предпочтительна «щадящая» операция в комбинации с послеоперационной лучевой терапией [22]. Наиболее эффективная СОД составляла, по мнению большинства авторов [8, 9, 19, 20], 50-60 Гр.
Химиотерапия была неэффективна в лечении пациентов с менингеальными ГП [8]. По данным Е. Galanis и соавт. [8], только у 1 из 7 больных была положительная динамика при проведении химиотерапии доксорубицином. Однако некоторые авторы [1] сообщают об эффективности использования комбинации ифосфамида и эпирубицина.
Анализ настоящего клинического наблюдения и данных мировой литературы указывает на эффективность хирургического удаления менингеальных ГП как первого и основного метода лечения.
Особенностью данного клинического наблюдения является то, что опухоль достигла гигантских размеров с минимальными клиническими проявлениями. Несмотря на тщательное дообследование, крайне сложно представлялась постановка правильного клинического диагноза до операции.
Учитывая богатую васкуляризацию ГП, основным условием успешного хирургического лечения и исключения послеоперационного геморрагического осложнения является радикальное удаление опухоли. Лучевая терапия является вспомогательным методом лечения после хирургии. В сомнительных случаях установления гистологического диагноза при световой микроскопии необходимым условием для точного диагноза является проведение иммуногистохимического исследования.
Комментарий
Труднодиагностируемые и достаточно редко встречающиеся гемангиоперицитомы (ГП) головного мозга являются злокачественными опухолями, нередко напоминают по своим ocновным характеристикам церебральные менингиомы, но обладают высокой частотой рецидивирования и отдаленного метастазирования.
В данной работе приведено интересное клиническое наблюдение гигантской интракраниальной ГП в нейрохирургическом отделении госпиталя ФСБ: подробно описано клиническое наблюдение, анализированы как жалобы больного, так и динамика развития клинических проявлений, представлены данные объективного неврологического осмотра, причем клинический синдром напоминал таковой, встречающийся при базальных менингиомах с исходным ростом из области наклоненного отростка. Приведены данные объективных нейровизуализованных исследований - КТ с контрастным усилением и тотальной селективной каротидной ангиографии - все хорошо иллюстрировано фотографиями.
Далее подробнейшим образом (и это очень поучительно) представлена по этапам произведенная хирургическая операция по удалению опухоли - выбор адекватного хирургического доступа, его детали и техника выполнения, особенности вскрытия твердой мозговой оболочки (ТМО), визуализационные характеристики обнаруженной опухоли, ее структуры, неоднородной в зависимости от различных отделов опухоли. Детально описаны обнаруживаемые по ходу выполнения операции источники кровоснабжения опухоли и пути успешного гемостаза, который был тем не менее упорным, и кровопотеря составила 3 л, принципиально важно уточнено отношение опухоли к магистральным сосудам, в том числе внутренней сонной артерии (ВСА) в супраклиноидном отделе, бифуркация ВСА, системы средней и передней мозговых артерий. Все убедительно и тщательно описано, но хотелось бы видеть и наглядные интраоперационные снимки этапов проведенной операции - их в работе нет. Послеоперационный период протекал с умеренно выраженными осложнениями, которые удалось своевременно и успешно купировать.
В послеоперационном периоде выполнены контрольные исследования - КТ с контрастным усилением, которые убеждают в успешности произведенной операции. Иммуногистохимическое исследование, проведенное в условиях Института нейрохирургии, уточнило диагноз и степень злокачественности опухоли - Grade III - впоследствии проведена лучевая терапия, катамнез больного прослежен в течение 5 лет, не выявлено рецидивирования опухоли.
В конце работы приведено краткое обсуждение проблемы с анализом данных литературы в историческом аспекте. Подчеркивается, что в отличие от менингиом головного мозга основное кровоснабжение осуществляется из ветвей ВСА и задней мозговой артерии, а не менингеальных артерий. Вследствие выраженной васкуляризации ГП предоперационно по возможности следует выполнять эмболизацию питающих сосудов.
В заключение авторы подчеркивают несомненную значимость хирургического лечения данных опухолей как основы лечебного процесса, и при необходимости выполняется лучевая терапия.
Статья весьма интересная, познавательная, особенно для современных практикующих нейрохирургов. Она отражает актуальные тенденции в поисках оптимальных путей совершенствования техники микрохирургических операций по удалению таких сложных опухолей, как гемангиоперицитомы.
ГЕМАНГИОПЕРИЦИТОМА
ГЕМАНГИОПЕРИЦИТОМА (haemangiopericytoma; греч, haima кровь+ angeion сосуд + peri- возле, около + kytos сосуд, клетка + -oma) — сосудистая опухоль, образованная множеством капилляров, окруженных веретенообразными и круглыми клетками — перицитами.
Термин «Гемангиоперицитома» предложен Стаутом и Марри (А. P. Stout, М. R. Murray). Существует мнение, что Г. гистогенетически связана с хеморецепторным аппаратом, т. е. относится к нейроэктодермальным опухолям типа параганглиом (см.). Различают дифференцированную и недифференцированную Г.
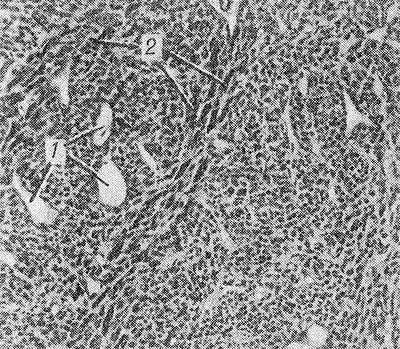
Рис. 1. Микроскопическая картина дифференцированной гемангиоперицитомы: сосуды капиллярного типа (1), окруженные веретенообразными клетками (2).
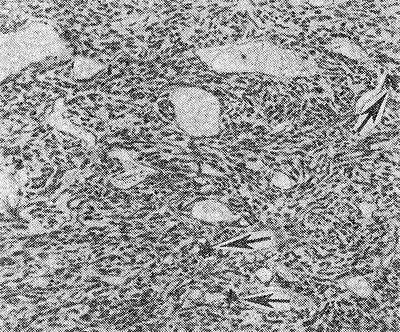
Рис. 2. Микроскопическая картина недифференцированной гемангиоперицитомы: видны фигуры деления (указаны стрелками)
Дифференцированная Г. встречается редко, может возникать в любом возрасте, часто у детей. Как правило, характеризуется медленным ростом, обычно достигает крупных размеров, сохраняя при этом четкие контуры и подвижность. Локализуется преимущественно в коже, мягких тканях туловища и конечностей, реже — в забрюшинном пространстве, средостении, сальнике, языке и внутренних органах (печень, кишечник, мозг и др.)* Макроскопическое строение — опухоль узловатой формы, на разрезе розовато-красного цвета, пористого строения, с обилием подходящих к ней сосудов. Микроскопически характеризуется большим количеством капилляров, выстланных эндотелием и окруженных округлыми, овальными или веретенообразными клетками с темными ядрами и светлой цитоплазмой (рис. 1). Клетки оплетены густой сетью аргирофильных волокон. Основным отличием Г. от капиллярной ангиомы является массивная пролиферация периваскулярных клеток, которые большинство исследователей относит к перицитам.
Дифференцированные Г., как правило, отграничены от мягких тканей слоем гиалинизированной ткани, к-рая, однако, на многих участках проращена опухолевыми клетками, что свидетельствует о местнодеструирующем росте. Дифференцированные Г. являются потенциально злокачественными опухолями, т. к. обладают высокой склонностью к рецидивам после недостаточно широкого хирургического иссечения. В редких случаях дифференцированные Г. могут давать отдаленные метастазы
Недифференцированная Г. (син.: гемангиоперицитарная саркома, перителиальная саркома, перителиома, периэндотелиома) является злокачественной опухолью. На ранней стадии развития недифференцированную Г. клинически и даже на основании морфол, исследования бывает трудно отличить от дифференцированной. Опухоль встречается редко, локализуется преимущественно в мягких тканях конечностей, реже в забрюшинной клетчатке, внутренних органах, костях. В большинстве случаев недифференцированные Г., локализующиеся в мягких тканях, сохраняют четкие контуры и только в поздних стадиях поражаются кожа, кости, сосудистонервные образования. При микроскопическом исследовании наблюдается полиморфизм клеток; среди клеток преобладают веретенообразные формы, наблюдается обилие фигур деления (рис. 2), прорастание клеток в просвет сосудов, инфильтрация окружающих тканей. Отличается агрессивным ростом, часто метастазирует (до 15% в регионарные лимфатические узлы и до 50% в легкие) и рецидивирует (в 40—50% случаев).
Лечение обеих форм хирургическое, прогноз неблагоприятный — после лечения ок. 50% больных живут до 5 лет и лишь 20% — до 10 лет.
Библиография: Клименков А. А. Отдаленные результаты лечения злокачественных опухолей мягких тканей, в кн.: Опухоли опорно-двигательного аппарата, под ред. H. Н. Трапезникова, в. 3, с. 43, М., 1971; Переслегин И. А. и др. Лучевая терапия гемангиоперицитом, Мед. радиол., т. 13, № 1, с. 15, 1968; Руководство по патологоанатомической диагностике опухолей человека, под ред. Н. А. Краевского и А. В. Смольянникова, с. 68, М., 1971.
Читайте также:
