Инфузионная терапия после нейрохирургических операций. Гемотрансфузии
Добавил пользователь Alex Обновлено: 22.01.2026
В 2012 году эксперты Европейской ассоциации интенсивистов приняли решение: синтетические коллоиды на основе гидроксиэтилкрахмала (ГЭК) и желатина не должны быть применены в повседневной медицинской практике. В 2013 Комитет по оценке рисков, связанных с безопасностью лекарств, Европейского Агентства по лекарственным средствам (PRAC ЕМА) вынес заключение, что применение растворов гидроксиэтилкрахмала в сравнении с кристаллоидами сопряжено с более высоким риском развития повреждения почек, требующего диализа, а также с риском увеличения смертельных исходов.
По этой причине Комитет принял решение рекомендовать Европейской Комиссии приостановить на территории Европейского Союза обращение данных лекарственных препаратов.
Быстро появился отечественный документ (Россия): Письмо Федеральной службы по надзору в сфере здравоохранения от 10 июля 2013 г. N 16И-746/13 "О новых данных лекарственных препаратов гидроксиэтилкрахмала". В письме приводится обновленная инструкция компании "Берлин-Хеми АГ" по производимым ими препаратам.
В документе сказано, что при критических состояниях:
- Раствор ГЭК медики могут использовать только в случае, если недостаточно применения только растворов кристаллоидов для лечения гиповолемии. После первоначальной нормализации объема плазмы возобновление применения ГЭК разрешено только при повторном появлении гиповолемии. Врач, который занимается лечением пациента, должен принимать решение об использовании ГЭК, только тщательно взвесив все за и против касательно пользы и риска при применении данного лекарства.
- ГЭК можно использовать в лечении при условии, что гиповолемия была предварительно подтверждена у больного методов положительной пробы на нагрузку жидкостью (например, пассивный подъем ног и другие виды нагрузки жидкостью). После этого назначается наименьшая возможная доза.
Инфузионные растворы ГЭК применять не рекомендуется:
- при почечной недостаточности у больного (при наличии олигурии, анурии или креатинина в плазме более 2 мг/дл (больше 177 мкмоль/л) или у пациентов, которые находятся на заместительной почечной терапии);
- у пациентов с сепсисом;
- у пациентов с тяжелым нарушением функции печени.
В письме, в отличие от Европейских рекомендаций, растворы коллоидов на основе модифицированного желатина (Гелофузин) не упомянуты. Потому на сегодня остался один «правильный» коллоид - альбумин, который медики могут назначать пациенту без риска иметь замечания от продвинутых экспертов. Стоит отметить, что у альбумина есть один очень серьезный и неустранимый недостаток - его всегда не хватает.
Возникает закономерный вопрос: если нет альбумина, стоит ли применять синтетические коллоиды. Учитывая приведенную выше информацию, многие врачи при проведении инфузионной терапии во всех случаях стали применять одни только солевые растворы. Причем, применительно к реалиям отечественной медицины, в подавляющем большинстве случаев, это означает, что лечение проводится одним 0,9% раствором натрия хлорида.
Части специалистов такой подход не представляется оптимальным. По их утверждениям, нельзя противопоставлять между собой коллоиды и кристаллоиды. Во многих клинических ситуациях их совместное применение обеспечивает лучшую долгосрочную гемодинамическую стабильность и приемлемые параметры безопасности. По утверждению этих специалистов, представляется маловероятным, что применение растворов современных синтетических коллоидов (ГЭК 130/04 или модифицированного жидкого желатина) в невысоких суточных дозах (10-15 мл на 1 кг тела человека в сутки), может ухудшить результаты терапии.
Стоит учесть такой момент: в то же время при проведении инфузионной терапии стоит полностью оказаться от назначения плазмозамещающих растворов на основе ГЭК 450/0.7, ГЭК 200/05, декстранов, многоатомных спиртов, не модифицированного желатина.
Что нужно учитывать при назначении внутривенной инфузионной терапии
У больных в периоперационном и послеоперационном периодах недостаточная инфузионная терапия вызывает снижение сердечного выброса, уменьшает доставку кислорода к поврежденным тканям и, в результате, вызывает рост осложнений после операции.
Излишнее количество жидкости в организме также может привести к различным осложнениям - нарушению коагуляции, развитию ацидоза, отеку легких. Поддержание оптимального волемического статуса - это сложнейшая задача. Если пациент не в состоянии принимать жидкость самостоятельно, или усваивать энтерально, используют ее внутривенное введение. Для более подробного ознакомления с этим вопросам лучше воспользоваться современными рекомендациями, позволяющими стандартизировать и оптимизировать этот процесс.
У пациентов, которые перенесли тяжелое повреждение тканей и органов, будь то хирургическое вмешательство, сепсис, травма, панкреатит или перитонит, резко снижается способность поддерживать оптимальную волемию и осмолярность крови. В ответ на первоначальную гиповолемию (перераспределение жидкости, кровопотеря, рвота и т.д) развиваются стандартные физиологические реакции: повышение уровня катехоламинов, вазопрессина, активация ренин-ангиотензин-альдостероновой системы. Что закономерно приводит к олигурии, задержке воды и натрия. Этому же способствует развитие системной воспалительной реакции.
Допустим, путем проведения инфузионной терапии гиповолемия была устранена. Но стрессовая реакция, обусловленная заболеванием, сохраняется. И если мы будем проводить инфузионную терапию с прежней скоростью, то будет происходить усиленная задержка воды и натрия, не будет адекватного диуреза даже при значительной гиперволемии и гипергидратации.
Стоит отметить, что олигурия в послеоперационном периоде не всегда говорит о наличии гиповолемии у пациента. Почечное повреждение, которое часто развивается при критических состояниях, может усугубить этот процесс. Гипогидратация, гиповолемия быстро переходит в гипергидратацию, в некоторых случаях в гиперволемию со всеми сопутствующими осложнениями - ухудшением газообмена, гипертензией, отеком легких и тканей. Тканевой отек усугубляется капиллярной утечкой альбумина в межклеточное пространство (18 мл на каждый грамм альбумина).
Этот феномен особенно ярко проявляется при сепсисе, когда поражение эндотелия вследствие системной воспалительной реакции носит генерализованный характер. Повышение внутрибрюшного давления вследствие отека брюшины при перитоните и панкреатите может приводить к развитию компартментсиндрома. Все пациенты - разные, и выраженность указанных нарушений сильно разоичается.
В данное время большинство докторов придерживается мнения, что гипергидратации надо избегать, а умеренный отрицательный водный баланс в раннем послеоперационном периоде после тяжелых хирургических вмешательств сопровождается меньшей летальностью. Выполнить эти рекомендации весьма непросто, даже располагая соответствующими диагностическими возможностями (инвазивный мониторинг).
Внимание. У больных с гиповолемией сразу после первичной стабилизации гемодинамики, следует снизить скорость инфузии 70-100 мл/час (25-35 мл/кг/сутки) и провести комплексную оценку волемического статуса пациента.
Выберете дальнейшую тактику лечения в зависимости от полученного результата. Инвазивные методы мониторинга гемодинамики позволяют более точно контролировать волемический статус пациента, но не заменяют данные динамического наблюдения.
Применение коллоидных растворов обеспечивает большую, по сравнению с кристаллоидами, гемодинамическую стабильность пациента в первые 12 часов после операции. Так что в случаях тяжелой гиповолемии рекомендуется сочетать введение коллоидных и кристаллоидных препаратов. Как уже было упомянуто ранее, раствор альбумина является лучшим препаратом для этих целей. Сочетание инфузии 500 мл 10% альбумина с последующим внутривенным введением фуросемида в дозе 1-2 мг/кг - весьма эффективный прием, направленный на мобилизацию тканевой жидкости, который часто применяется частью специалистов при ОРДС, олигурии, парезе кишечника.
Если гиповолемия связана с сепсисом и другими воспалительными состояниями, а также у пациентов с сердечной недостаточностью, используйте длительную инфузию альбумина - за счет снижения объема инфузии уменьшается вероятность гемодинамической перегрузки и отека легких. И чем меньше возможности отделения в проведении мониторинга и наблюдения за больным в послеоперационном периоде, тем больше показаний для выполнения этой рекомендации.
Введение значительных объемов раствора натрия хлорида 0,9% часто сопровождается развитием гиперхлоремии, которая в свою очередь вызывает сужение сосудов почек и уменьшает скорость клубочковой фильтрации, что еще больше снижает способность выводить натрий и воду. И, по сравнению с современными солевыми сбалансированными растворами, его применение в послеоперационном периоде сопровождается большим уровнем смертности. Сбалансированные солевые растворы (раствор Рингера-лактат, Хартмана, Стерофундин и др.) содержат меньше хлора, и их применение рекомендуется во всех случаях, за исключением тех, когда гиповолемия обусловлена потерей желудочного и кишечного содержимого (рвота, желудочные стоки). В этих случаях предпочтение отдается 0,9% раствору натрия хлорида. Инфузия болюсов гипертонического (по 100-200 мл 7,5-10%) раствора натрия хлорида не показала своих преимуществ у общехирургических пациентов и рекомендуется, в основном, у больных с внутричерепной гипертензией.
Рекомендуется переливание эритроцитарной массы или крови, когда уровень гемоглобина падает ниже 70 г/л в периоперационном периоде. Но если гемодинамика пациента остается нестабильной, существует риск кровотечения (или продолжающееся кровотечение), переливание крови может быть показано и при более высоких значениях гемоглобина (менее 100 г/л).
Желательно часто контролировать и поддерживать уровень калия в крови вблизи верхней границы его нормы (4,5 ммоль/л). Недостаток калия не только вызывает мышечную слабость, увеличивает вероятность аритмий и пареза кишечника, но и снижает способность почек выводить избыток натрия. Калий часто вводят с раствором глюкозы (поляризующая смесь). Но это - скорее дань традиции, чем реальная необходимость. С таким же успехом хлорид калия можно вводить в/в дозатором, или вместе с солевым раствором.
Если нет гипогликемии, в первые сутки после операции растворы глюкозы лучше не использовать, так как они могут вызвать развитие гипергликемии, гипонатриемии и гипоосмолярности. Последние два нарушения также снижают способность почек к выведению мочи и способствуют развитию синдрома неадекватной секреции антидиуретического гормона (SIADH).
Большинство авторов считает, что петлевые диуретики (обычно, фуросемид) должны использоваться только в случае выраженной гипергидратации и (или) отека легких. Перед назначением мочегонных средств гемодинамика больного должна быть в достаточной степени стабилизирована.
Внимание! При проведении инфузионной терапии требуется индивидуальный подход. Приведенные выше и ниже рекомендации - только отправные точки при выборе терапии.
Послеоперационная потребность пациентов в жидкости и электролитах
Потребность в воде (орально, или энтерально, или парентерально - 1.5-2.5 литра (худые - 40 мл/кг/сут, нормального питания - 35 мл/кг в сутки, повышенного питания и старше 60 лет - 25 мл/кг/сут. К этому добавляется перспирационные потери - 5-7 мл/кг/сут. на каждый градус выше 37°С. Суточная потребность натрия составляет 50-100 ммоль. Суточная потребность калия — 40-80 ммоль. Введение альбумина рекомендуется при снижении его концентрации в крови менее 25 г/литр, или общего белка менее 50 г/литр.
Критерии эффективности и оптимальности инфузионной терапии:
- отсутствие жажды, тошноты, одышки;
- среднее АД - 75-95 мм рт. ст;
- частота сердечных сокращений - 80-100 уд в мин;
- ЦВД 6-10 мм рт. ст. или 80-130 мм вод. ст;
- сердечный индекс - более 4,5 л/м2;
- давление заклинивания легочной артерии - 8,4-12 мм рт. ст; не менее 60 мл/час или >0,5 мл/кг/час;
- общий белок крови 55-80 г/л;
- мочевина крови 4-6 ммоль/л;
- глюкоза крови 4-10 ммоль/л;
- уровень альбумина крови 35-50 г/л;
- гематокрит 25-45%.
Диагностический тест на наличие гиповолемии
Когда диагноз гиповолемии вызывает сомнение и ЦВД не повышено, можно провести тест с быстрой инфузионной нагрузкой (внутривенно ввести за 10-15 мин 200 мл коллоида или кристаллоида). Параметры гемодинамики определяют до, и через 15 минут после, инфузии. Повышение АД, уменьшение частоты сокращений сердца, улучшение наполнения капилляров и незначительный рост ЦВД подтверждают наличие гиповолемии у пациента. При необходимости тест можно несколько раз повторить. Отсутствие дальнейшего улучшения параметров гемодинамики будет указывать, что оптимальная степень волемии достигнута.
Инфузионная терапия после нейрохирургических операций. Гемотрансфузии
Интраоперационная инфузионная терапия является неотъемлемым компонентом анестезиологического обеспечения хирургических вмешательств. Величина необходимой инфузии не может быть определена заранее как фиксированный объем растворов, она должна быть индивидуальной для каждого пациента [10]. Баланс жидкости во время оперативного вмешательства зависит от множества факторов, что крайне затрудняет его адекватную оценку. Известно, что стрессовый ответ на хирургическую операцию способствует задержке жидкости [11]. При обширных абдоминальных операциях ситуацию осложняет целый ряд дополнительных факторов: особенности предоперационной подготовки желудочно-кишечного тракта (ЖКТ), патофизиология основного заболевания, а также множество интраоперационных составляющих. Основными из них являются кровопотеря, вазодилатация, вызванная сосудорасширяющими препаратами (в частности, местными анестетиками при регионарной анестезии), и перспирация [14]. Стоит обратить внимание и на то, что стенка ЖКТ крайне плохо защищена от ишемического повреждения. Слизистая кишечника постоянно регенерирует, имеет высокую степень метаболической активности и, таким образом, является крайне уязвимой для ишемии. Так, для нарушения спланхнической перфузии достаточно 10-15% снижения внутрисосудистого объема [12]. Селективная вазоконстрикция мезентериальных артериол является одним из механизмов поддержания системного артериального давления (АД) в условиях гиповолемии, которая также может способствовать ишемическому повреждению органов ЖКТ [20].
В послеоперационном периоде дисфунция ЖКТ может проявляться различными клиническими состояниями - от угнетения перистальтики до нарушений усвоения энтерального питания. Не стоит забывать и про несостоятельность межкишечных анастомозов, которая в абдоминальной хирургии достоверно коррелирует с недостаточной доставкой кислорода [15]. Повреждение стенки ЖКТ вследствие гипоперфузии и ишемии ведет к потере ее барьерной функции с транслокацией эндотоксинов и микроорганизмов в системный кровоток, а также выделению большого количества провоспалительных медиаторов [7, 16]. Эти факторы могут вызывать развитие синдрома полиорганной недостаточности (СПОН) у пациентов, перенесших большие абдоминальные операции [17].
Гиперволемия, обусловленная недифференцированной волемической нагрузкой, также способствует повышению проницаемости капилляров и развитию отека тканей, что может послужить отправной точкой для возникновения порочного круга капиллярной утечки и СПОН [6]. Следует помнить, что сама по себе хирургическая травма сопровождается увеличением проницаемости капилляров и вызывает экстравазацию жидкости, при этом одновременная инфузионная терапия кристаллоидными растворами в объеме 5 мл/кг удваивает этот отек [3]. Реперфузионное повреждение и медиаторы воспаления также компрометируют сосудистый барьер, а ятрогенная гиперволемия способствует повреждению эндотелиального гликокаликса и вызывает массивное перемещение жидкости и белка в ткани [1, 9, 19].
Известно, что при проведении больших оперативных вмешательств на органах брюшной полости потери жидкости затрагивают преимущественно внутрисосудистый сектор, что может приводить к гиповолемии [8]. Широко применяемая эмпирическая инфузионная терапия основывается на данных рутинного мониторинга: контроля АД, частоты сердечных сокращений (ЧСС), центрального венозного давления (ЦВД), темпа диуреза. Эти параметры не являются надежными при оценке состояния волемического статуса, что затрудняет их использование для управления инфузионной терапией. При этом стратегия фиксированных объемов инфузионной терапии несет в себе риск либо перегрузки жидкостью, либо гиповолемии.
В последнее время широкое распространение получила концепция целенаправленной терапии (ЦНТ), которая позволяет индивидуализировать назначение растворов и использование вазоактивных препаратов на основании данных различных гемодинамических переменных. Установлено, что ЦНТ позволяет оптимизировать состояние внутрисосудистого сектора, тем самым поддерживая на должном уровне тканевую перфузию и оксигенацию, способствуя улучшению исходов после больших хирургических вмешательств [4, 18].
Для оценки волемического статуса у пациентов в условиях анестезии и искусственной вентиляции легких наиболее приемлемым показателем является вариабельность ударного объема (ВУО), позволяющая с хорошей чувствительностью и высокой специфичностью прогнозировать повышение сердечного выброса в ответ на инфузионную нагрузку [5]. Этот параметр может использоваться в качестве одного из основных при управлении инфузионной терапией с целью поддержания адекватного внутрисосудистого объема, что помогает обеспечивать стабильность гемодинамики, нормальную тканевую перфузию и доставку кислорода.
Наша цель - изучить влияние интраоперационной целенаправленной терапии, управляемой на основании мониторинга вариабельности ударного объема, на течение послеоперационного периода после хирургических вмешательств на органах ЖКТ.
Материал и методы
В проспективное исследование включены 28 пациентов, которым в плановом порядке были выполнены обширные оперативные вмешательства на органах ЖКТ по поводу злокачественных новообразований. Средний возраст пациентов составил 65,6±6,9 года. Состояние пациентов соответствовало II-III классам по шкале ASA. Оперативное вмешательство проводили в условиях сочетанной анестезии. Индукцию анестезии осуществляли пропофолом (1,5-2,0 мг/кг) и фентанилом (2 мкг/кг). Для миорелаксации использовали рокуроний. Анестезию поддерживали севофлюраном (минимальная альвеолярная концентрация 0,7-1,0) под контролем мониторинга глубины анестезии (биспектральный индекс в пределах 40-60) и эпидуральной аналгезией 0,2% раствором ропивакаина в сочетании с фентанилом.
При снижении САД до 60 мм рт.ст. болюсно вводили 5-10 мг эфедрина. Такие случаи расценивали как эпизоды гипотензии и подвергали анализу. Эпизоды постиндукционной гипотензии в обеих группах не учитывали, фиксировали только случаи после начала операции.
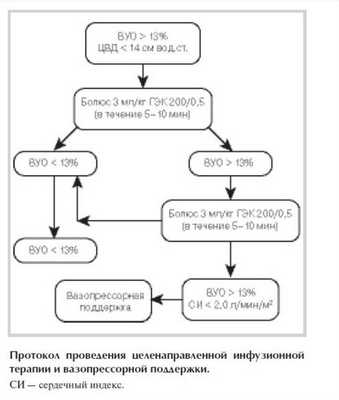
Протокол проведения инфузионной и вазопрессорной ЦНТ представлен на рисунке.
Параметры гемодинамики фиксировали на
4 этапах: I этап - до начала операции, непосредственно перед кожным разрезом, II этап - после вхождения в брюшную полость, III этап - после основного этапа операции (наложение анастомоза), IV этап - после ушивания апоневроза. Также на I и III этапах оценивали адекватность тканевой оксигенации на основании уровня лактата артериальной крови. В 1-е сутки после операции производили балльную оценку степени органной дисфункции по шкале SOFA. Дополнительно фиксировали частоту послеоперационных осложнений, сроки пребывания в отделении реанимации и интенсивной терапии (ОРИТ) и общее количество дней госпитализации, а также сроки восстановления функций ЖКТ.
До операции различий между группами по возрасту и функциональному статусу по ASA не было, объем и характер операций также не различались.
Полученные результаты обработаны статистически. Для каждого вариационного ряда рассчитывали среднюю арифметическую (М) и среднеквадратичное отклонение (σ). Достоверность различий результатов исследования оценивали с учетом t-критерия Стьюдента. Изменения считали достоверными, если величина р не превышала 0,05.
Результаты и обсуждение
Средняя продолжительность оперативного вмешательства была сопоставима в обеих группах. Объем интраоперационной кровопотери также достоверно не различался. Общий объем инфузии в пересчете на вес и длительность операции были выше у больных 1-й группы - соответственно 9,8±1,7 и 8,2±1,1 мл/кг/ч (р<0,05). Однако объем перелитых коллоидов был достоверно выше во 2-й группе - 536±74 мл против 429±63 мл в 1-й группе (р<0,05).
Параметры гемодинамики у обследованных пациентов представлены в табл. 1.
На I и II этапах исследования различий по изучаемым гемодинамическим параметрам между группами не выявили: значения ЧСС, САД и ЦВД не различались, что свидетельствовало об адекватности анестезии в условиях отсутствия значимых нарушений водного баланса. Уровень лактата на
I этапе также был сопоставим в обеих группах.
На III этапе исследования у пациентов 1-й группы отметили достоверное снижение САД по сравнению с предыдущим этапом, этот показатель также был ниже, чем у больных 2-й группы: 69,2±6,8 и 78,5±7,3 мм рт.ст. соответственно (р<0,05). На следующем этапе уровень САД возрастал, не отличался от исходных значений и не различался между обеими группами.
На III этапе исследования выявили повышение уровня ЦВД в обеих группах по сравнению с предыдущим этапом, кроме того, уровень ЦВД был достоверно выше у пациентов 2-й группы. Аналогичные различия между группами сохранялись и на IV этапе.
Уровень лактата в обеих группах находился в пределах референсных значений на всех этапах исследования. Однако в 1-й группе на III этапе значения лактата были достоверно выше, чем во 2-й, - 1,27±0,4 и 0,71±0,24 ммоль/л соответственно (р<0,05).
Различия в сроках госпитализации по группам не выявили, однако больные 1-й группы длительнее находились в ОРИТ, чем пациенты 2-й группы, - 3,2±0,9 и 1,2±0,3 дня соответственно (р<0,05).

У 7 пациентов 1-й группы и у 3 пациентов 2-й группы в 1-е сутки после операции регистрировали признаки органной дисфункции по шкале SOFA. Число больных, у которых развились осложнения, было меньше во 2-й группе - 2 против 6 в 1-й группе. Общее количество осложнений в послеоперационном периоде в 1-й группе было больше, чем во 2-й, - 10 и 2 соответственно (табл. 2 ). Это и определяло длительность их пребывания в ОРИТ.
Более низкие показатели частоты и степени органной дисфункции и меньшее количество осложнений во 2-й группе объяснялись оптимальной доставкой кислорода в интраоперационном периоде, достигнутой за счет адекватной тканевой перфузии. Об этом свидетельствует более низкий уровень лактата артериальной крови после основного (III) этапа операции во 2-й группе.
В интраоперационном периоде крайне важны момент возникновения дефицита внутрисосудистого объема, сопровождающегося гипоперфузией, и временные рамки, в которых этот дефицит удается корригировать. Без должного мониторинга подобные состояния верифицировать практически невозможно. Об этом свидетельствует тот факт, что у большинства пациентов в группе сравнения высокие показатели ВУО (что требовало болюсного введения коллоидов согласно протоколу) не сопровождались гипотензией, которая наряду с кровопотерей являлась одним из основных критериев для переливания коллоидов в контрольной группе. Соответственно в группе сравнения 11 пациентов получили инфузию коллоидов согласно протоколу ЦНТ, в то время как в контрольной группе коллоиды эмпирически использовали у 8 пациентов.
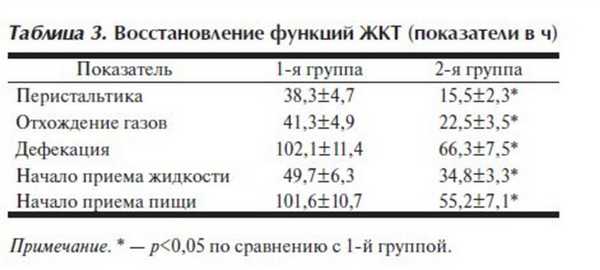
Восстановление функций ЖКТ происходило быстрее во 2-й группе (табл. 3 ). Временные интервалы до восстановления перистальтики, самостоятельного отхождения газов, самостоятельной дефекации, начала приема жидкости и перехода к полноценному питанию были существенно короче во 2-й группе. Это также объясняется более адекватной перфузией органов ЖКТ и, как следствие, оптимальной доставкой кислорода.
Таким образом, ВУО является приемлемым динамическим показателем для управления инфузионной терапией при больших абдоминальных операциях. Изменения в преднагрузке левого желудочка, вызванные колебаниями внутригрудного давления в условиях искусственной вентиляции легких, приводят к изменениям его ударного объема [2]. При гиповолемии изменения ударного объема наиболее выражены, поэтому вариабельность этого показателя - довольно чувствительный параметр для оценки состояния внутрисосудистого сектора [13]. Рутинные параметры мониторинга гемодинамики, оцененные в нашем исследовании, ожидаемо оказались малоинформативными в качестве индикатора внутрисосудистого объема, что отразилось на результатах.
ЦНТ, основанная на мониторинге ВУО, позволила оптимизировать не только количественную, но и структурную составляющие интраоперационной инфузионной терапии. При общем уменьшении объемов инфузии увеличилось количество коллоидных растворов. При этом адекватная инфузионная терапия сопровождается лучшей оксигенацией периферических тканей, о чем свидетельствует более низкий уровень лактата у больных, которым проводили ЦНТ.
Уменьшение числа послеоперационных осложнений и степени проявления органной дисфункции у пациентов 2-й группы обусловило сокращение сроков их пребывания в ОРИТ и стационаре. Восстановление нормального функционирования ЖКТ способствовало ранней активизации пациентов и более благоприятному течению послеоперационного периода.
Таким образом, целенаправленная инфузионная терапия сопровождается стабилизацией гемодинамики в интраоперационном периоде у пациентов, оперированных на органах брюшной полости.
Достижение целевых параметров гемодинамики с помощью инфузионной терапии способствует уменьшению количества осложнений в послеоперационном периоде и раннему восстановлению функции желудочно-кишечного тракта.
Современная инфузионная терапия. Достижения и возможности
Инфузионная терапия является неотъемлемой частью лечения различных категорий больных. О возможностях применения ее достижений в клинической практике рассказывает профессор-консультант Центра экстракорпоральной детоксикации (ВМедА), д-р мед. наук Альфред Львович Костюченко.
История
В начале 30-х годов XIX столетия английский врач Т. Latta в журнале "Lancet" опубликовал работу о лечении холеры внутривенным вливанием растворов соды.
10 июля 1881 года Landerer успешно провел вливание больному "физиологического раствора поваренной соли", обеспечив бессмертие этой инфузионной среде, с которой мировая медицинская практика вошла в XX век - век становления и развития инфузионной терапии.
1915 год - использован на практике кровезаменитель на основе желатины (Hogan) - первый из коллоидных кровезаменителей;
1940 год - внедрен в практику "Перистой", первый из кровезаменителей на основе синтетического коллоида поливинилпирролидона (Reppe, Weese и Несht);
1944 год - разработаны кровезаменители на основе декстрана (Gronwall и Ingelman). Последующие четверть века были эрой безраздельного господства декстрановых кровезаменителей;
1962 год - началось клиническое внедрение растворов гидроксиэтидированного крахмала (Thompson, Britton и Walton), однако настоящий расцвет эры ГЭК происходит только к концу 20-го столетия.
В 60-х годах, одновременно в США (Rabiner) и СССР в ЛИПКе (академик АН. Филатова с сотр.) ведутся работы по созданию кровезаменителей на основе очищенного от стромы человеческого гемоглобина. В результате в нашей стране создается клинически доступный препарат "Эригем", успешно использованный для кровезамещения во время операций на легких (ВМедА, академик И.С. Колесникова с сотр.).
1966 год - первые публикации по перфторуглеродам (ПФУ) как возможным искусственным переносчикам кислорода в организме человека (L.Clark, LF. Gollan).
1979 год - В СССР создан первый в мире, в последующем клинически апробированный, кровезаменитель на основе ПФУ - "Перфторан" (ГР. Граменицкий, ИЛ. Кунъянц, Ф.Ф. Белоярцев).
1992 год - введен в клиническую практику оригинальный кровезаменитель на основе полиэтиленгликоля - "Полиоксидин" (Петербургский НИИГПК, Л А Седова, ЛГ. Михайлова и др.).
1997 год - прошел клинические испытания созданный в Петербургском НИИГПК полимеризированный человеческий гемоглобин "Геленпол" (ЕА Селиванов с сотр.). Разрешен к медицинскому применению с 1998 года.
Сегодня повсеместно для лечения больных используется инфузионная терапия - вливание в организм больного больших количеств различных жидкостей в течение значительного времени.
Цели проведения инфузионной терапии разнообразны: от психологического воздействия на пациента (как же - ведь "ставится капельница!") и разведения до безопасного уровня необходимых сильнодействующих лекарственных средств до решения ряда задач реанимации и интенсивной терапии.
Именно последние - задачи реанимации и интенсивной терапии, возникающие перед врачом в конкретных клинических ситуациях - и определяют основные направления инфузионной терапии:
- волюмокоррекция - востановление адекватного объема циркулирующей крови (ОЦК) и нормализация ее состава при кровопотере;
- гемореокоррекция - нормализация гомеостатических и реологических свойств крови;
- инфузионная регидратация - поддержание нормальной микро- и макроциркуляции (в частности - при клинически отчетливой дегидратации);
- нормализация электролитного баланса и кислотно-основного равновесия;
- активная инфузионная дезинтоксикация;
- обменкорригирующие инфузии - прямое воздействие на тканевой метаболизм за счет активных компонентов кровезаменителя.
Волюмокоррекция
При кровопотере и для востановления адекватного ОЦК могут быть использованы инфузионные среды с различным волемическим эффектом.
Изотонические и изоосмотические электролитные растворы моделируют состав внеклеточной жидкости, обладают малым непосредственным волюмическим эффектом (не более 0.25 от объема введенной среды, даже при отсутствии гипопротеинемии), но являются предпочтительными при сочетании кровопотери и дегидратации.
В настоящее время из группы коллоидных кровезаменителей все большую популярность приобретают растворы гидроксиэтилкрахмала (ГЭК) - инфукол, рефортан, стабизол, ХАЭС-стерил. Они обладают высоким непосредственным волемическим эффектом (1.0 и более) и большим периодом полувыведения при относительно небольшом количестве побочных реакций.
Сохраняют свои клинические позиции волюмокорректоры на основе декстрана (полиглюкин, реополиглюкин, реоглюман, лонгастерил, реомакродекс, неорондекс) и желатины (желатиноль, модежель, гелофузин). Все больше внимания привлекает новый препарат на основе полиэтиленгликоля - полиоксидин. В интенсивной терапии для восстановления адекватного ОЦК используются препараты крови. Однако применение донорской плазмы значительно ограничено редкостью препарата, побочными реакциями, опасностью переноса вирусной инфекции. Поданным некоторых авторов, при внутривенном использовании человеческого сывороточного альбумина (ЧСА), из-за повышенной проницаемости эндотелия для альбумина, препарат быстро выходит из кровеносного русла в интерстициальное пространство, усиливая отек, в том числе в органах жизнеобеспечения (легкие, тонкая кишка).
Появляется все больше публикаций о преимуществах терапии острого дефицита ОЦК и шока так называемой низкообъемной гиперосмотичной волюмокоррекцией (НГВ). Она заключается в последовательном внутривенном введении гипертонического электролитного раствора (например, 7.5% раствора NaCl из расчета 4 мл/кг массы тела (МТ) больного) с последующей инфузией коллоидного кровезаменителя (например, 250 мл полиглюкина или рефортана) для закрепления эффекта перемещения в сосуды интерстициальной жидкости.
- рациональный доступ к сосудистой системе с помощью канюлирования или катетеризации сосудов или в целом к внутренней среде организма больного;
- техническое обеспечение - применение пассивного, гравитационного инфузионного тракта (системы) или активного - на основе насосов-инфузоров;
- медицинскими и коммерческими возможностями выбора инфузионной среды, соответствующей конкретной клинической задаче;
- контролем достигнутого эффекта с помощью клинико-лабораторных критериев, а в трудных случаях - с помощью мониторного наблюдения, позволяющего оценивать on line центральную гемодинамику, состояние жидкостных пространств организма больного, изменение микроциркуляции крови.
Вариантами подобной волюмокоррекции, кроме указанных веществ, могут быть гипертонический раствор смеси хлорида и ацетата натрия, реополиглюкин с добавлением маннитола (реоглюман) или гипертоническая плазма, донорская или аутологичная, заготовленная в ходе аппаратного плазмафереза во флаконы с лиофилизированным сорбитолом. Методами доказательной медицины установлено, что НГВ способствует:
быстрому и стойкому повышению АД и сердечного выброса на фоне шока;
Гемореокоррекция
Одновременно с волюмокоррекцией или без нее может использоваться инфузионная гемореокоррекция. В ее основе может лежать изоволемическая гемодилюция с извлечением части крови или без нее.
Для решения этой задачи ранее получили признание декстраны, особенно низкомолекулярные, а в настоящее время - растворы ГЭК. Значимые для клинического применения результаты получены при использовании кислородпереносящего кровезаменителя на основе фторированных углеродов перфторана. Его гемореокорригирующее действие определяется не только эффектом гемодилюции и повышением электрического распора между клетками крови, но и изменением вязкости крови и восстановлением микроциркуляции в отечных тканях.
Регидратация
Для инфузионной регидратации используются сбалансированные по основным электролитам и гипоосмотичные или изоосмотичные электролитные растворы: натрия хлорида, Рингера, ацесоль, лактосол и другие. При проведении регидратации можно использовать различные пути введения жидкости:
сосудистый (в условиях функциональной сохранности сердца и легких - лучше внутривенно, при перегрузке правого сердца и синдроме острого легочного повреждения (ОЛП) -предпочтительно внутриаортальный путь);
Для быстрой нормализации электролитного баланса и купирования внутриклеточных электролитных расстройств созданы специальные инфузионные среды (калия-магния аспарагинат, ионостерил, раствор Хартмана).
Для инфузионной коррекции некомпенсированных метаболических расстройств кислотно-основного равновесия применяют:
- ри ацидозе - растворы бикарбоната илилактата натрия, трисаминол, трометамоп:
- при алкалозе - разведенный на растворе глюкозы 1н. раствор HCl (например, при сочетании алкалоза и гипохпоремии), алкамин.
Детоксикация
Различают интракорпоральный способ активной детоксикации с применением инфузионной терапии и экстракорпоральный
(сорбционные и аферезные методы), который также не обходится без инфузионного сопровождения. Для интракорпоральной детоксикации используют:
- растворы глюкозы и/или кристаллоидов, обеспечивающие гемодилюцию (уменьшение повреждающего действия экзогенных и эндогенных токсических субстанций за счет их разведения) и улучшение кровоснабжения тканей и органов, что вызывает ускоренное вымывание токсических веществ;
При применении обеих групп инфузионных детоксикационных средств целесообразно использовать инфузионно-форсированный или медикаментозно-форсированный диурез, обеспечивающий высокий темп мочевыделения (оптимально 4-5 мл/кг МТ в час) на протяжении часов и суток.
Обменкорригирующая инфузия
Обменкорригирующая инфузия - прямое воздействие на тканевой метаболизм за счет активных компонентов кровезаменителя; по сути дела - направление инфузионной терапии, пограничное с медикаментозной терапией.
Первой в ряду обменкорригирующих инфузионных сред следует считать так называемую поляризующую смесь, предложенную французским патофизиологом А. Лабори как среду стрессовых ситуаций. Ее основу составлял раствор глюкозы с инсулином с добавлением солей калия и магния, что позволяло предотвращать развитие микронекрозов миокарда на фоне гиперкатехоламинемии.
Другим направлением следует считать полиионные среды, содержащие субстратные антигипоксанты - фумарат (мафусол, полиоксифумарин) и сукцинат (реамберин).
К обменкорригирующим инфузиям можно относить вливание перфторана и кислородпереносящих кровезаменителей на основе модифицированного гемоглобина - геленпола и гелевина, которые оптимизируют энергетический обмен в органах и тканях за счет повышения доставки к ним кислорода.
Благоприятная коррекция нарушенного обмена веществ достигается применением инфузионных гепатопротекторов. Они нормализуют не только метаболизм в поврежденных гепатоцитах, но и связывают маркеры летального синтеза при гепатоцеллюлярной несостоятельности, в частности, аммиак (гепастерил А). В некоторой степени к обменкорригирующим инфузиям можно отнести парентеральное искусственное питание. Купирование персистирующей белково-энергетической недостаточности и нутриционная поддержка больного достигается инфузиями специальных питательных сред.
Другие возможности
Определенное значение в интенсивной терапии имеют ситуации, в которых используют не плазмозамещающие свойства кровезаменителей. Например:
- использование перфторана для купирования ОЛП при травматической жировой эмболии или в остром периоде черепно-мозговой травмы, что позволяет уменьшить выраженность отека и набухания головного мозга;
- предотвращение капиллярной утечки внутрисосудистой жидкости при генерализованной инфекции средами на основе ГЭК;
- внутрисосудистое связывание воспалительных медиаторов и свободных радикалов (например, N0) растворами модифицированного гемоглобина.
Все это показывает, как далеко шагнула медицинская наука за 100 лет планомерного использования инфузионной терапии в клинической практике.
Тактика инфузионно-трансфузионной терапии
в ходе нейрохирургических операций у детей
Тактика инфузионной терапии в ходе нейрохирургических операций у детей основывается на том, что дефицит объема циркулирующей крови (ОЦК) имеется, как правило, у всех нейрохирургических педиатрических пациентов. Степень повреждения компенсаторных механизмов ауторегуляции ОЦК и сосудистого тонуса зависит от вовлечения в патологический процесс структур средней линии мозга, а также имеющихся исходных гемореологических нарушений [2, 5].
Идеальное интраоперационное ведение нейрохирургического больного включает:
- поддержание церебрального перфузионного давления (ЦПД);
- контроль регуляций тонуса церебральных сосудов и внутричерепного давления (ВЧД);
(В данном исследовании ВЧД контролировали путем постановки катетера в один из боковых желудочков головного мозга нейрохирургами с лечебной целью (разгрузка ликворопроводящих путей вследствие внутричерепной гипертенэии) и соединения с монитором «МХ-03» - «Салют», «Джонсон и Джонсон» - «Критикон», «Сименс» - «Кион») - электрофизиологический мониторинг;
- быстрое восстановление сознания (что необходимо для раннего неврологического осмотра).
ЦПД является важнейшим показателем адекватности перфузии мозга:
Нормальное ЦПД колеблется в пределах 90-100 мм рт. ст.
Одним из принципов волемического режима нейрохирургического больного и оптимальным интраоперационным условием является нормоволемия в сочетании с умеренной гемодилюцией. Гемотрансфузия (предпочтительно эритроцитарная масса) проводится при показателях Ht < 21. Значения нормального и допустимых колебаний гематокрита в ходе операции у детей представлены в табл. 1.
Таблица 1.
Значения нормального и допустимых колебаний гематокрита (Ht) в ходе операции у педиатрических пациентов
| Возраст | Нормальный Ht | Допустимые колебания Ht | |
| среднее значение | границы | ||
| Новорожденные | 54 | 54-65 | 30-35 |
| 3 мес. | 36 | 30-42 | 25 |
| 1 год | 38 | 34-42 | 20-25 |
| 6 лет | 38 | 35-43 | 20-25 |
Если показатель гематокрита ниже допустимого, следует решать вопрос о гемотрансфузии в ранние сроки - в начале операции [I]. (При колебаниях гематокрита ниже допустимых значений или при сопутствующих заболеваниях трансфузия эритроцитарной массы производилась и до оперативного вмешательства.)
Для расчета объема и скорости инфузионной терапии в ходе оперативного вмешательства мы пользуемся следующей формулой:
Объем жидкости (мл/ч) = 2,5 х масса тела (кг) + 10,0 + 2 мл/кг-ч - малая хирургическая процедура;
+ 4 мл/кг-ч -лапаротомия и торакотомия;
+ 6 мл/кг-ч - «большая» хирургия (нейрохирургические, торакоабдоминальные операции).
ОЦК у новорожденных составляет 90 мл/кг массы тела, у детей дошкольного возраста - 80 мл/кг, у подростков - 65 мл/кг. Расчет кровопотери базируется на показателях гематокрита.
Необходимо помнить, что у маленьких детей (до трех лет) уровень артериального давления (АД) адекватно отражает ОЦК [13]. В табл. 2 представлены расчеты восполнения ОЦК в интраоперационном периоде в зависимости от объема кровопотери.
Таблица 2.
Восполнение ОЦК в интраоперационном периоде у детей
| Кровопотеря (% от ОЦК) | Восполнение кровопотери |
| 5 | Кристаллоиды 3-4 мл/мл кровопотери |
| 5-10 | Кристаллоиды 3-4 мл/мл кровопотери + коллоиды 1 мл/мл кровопотери |
| 10-15 | Кристаллоиды 3-4 мл/мл кровопотери + коллоиды 1 мл/мл кровопотери + эритроцитарная масса |
Мы считаем целесообразным привести альтернативную схему расчета объема и скорости инфузионной терапии в ходе оперативного вмешательства у детей различных возрастных групп [4, б].
1. Первый час: кристаллоидные растворы 25 мл/кг массы + восполнение кровопотери эритроцитарной массой или кристаллоидами в соотношении 3:1. Последующие часы: базисный почасовой объем + восполнение кровопотери эритроцитарной массой или кристаллоидами в соотношении 3:1
2. Поддержание + травматичность оперативного вмешательства= базисный почасовой объем
3. Поддерживающий объем = 4 мл/кг массы тела • ч
4 мл/кг-ч + легкая травматичность оперативного вмешательства (2 мл/кг) = 6 мл/кг-ч
4 мл/кг-ч + умеренная травматичность оперативного вмешательства (4 мл/кг) = 8 мл/кг-ч
4 мл/кг-ч + высокая травматичность оперативного вмешательства (6 мл/кг) = 10 мл/кг-ч
Детям старше 4 лет:
1. Первый час: кристалоидные растворы 15 мл/кг массы + восполнение кровопотери эритроцитарной массой или кристаллоидами в соотношении 3:1. Последующие часы: базисный почасовой объем + восполнение кровопотери эритроцитарной массой или кристаллоидами в соотношении 3:1
2. Поддерживающий объем = 4 мл/кг массы тела • ч
4 мл/кг-ч + легкая травматичность оперативного вмешательства (2 мл/кг) = 6 мл/кг-ч
4 мл/кг-ч + умеренная травматичность оперативного вмешательства (4 мл/кг) = 8 мл/кг-ч
4 мл/кг-ч + высокая травматичность оперативного вмешательства (6 мл/кг) = 10 мл/кг-ч.
Следует воздерживаться от интраоперационного введения раствора глюкозы, так как это может привести к ишемическому поражению мозга [5, 7, 12]. После операции, когда опасность гипоксии и церебральной ишемии сводится к минимуму, можно проводить инфузию растворов глюкозы. [5, 9]. Из кристаллоидных растворов в ходе операции мы отдаем предпочтение физиологическому раствору (0,9% раствор натрия хлорида).
Из коллоидных плазмозамещающих растворов оптимальным для профилактики и лечения гиповолемии и поддержания адекватного ОЦК в ходе многочасовых операций, на наш взгляд, является Рефортан® 6% - гидроксиэтилкрахмал с молекулярной массой 200000Д и молекулярным замещением 0,5. Препарат нормализует и улучшает такие показатели жизнедеятельности, как объем крови (объем плазмы), уровень АД, сердечный выброс, микроциркуляцию, доставку и потребление кислорода тканям [8]. Оказывая положительный эффект на показатели системной гемодинамики, Рефортан® также улучшает перфузионное давление органов, в том числе и головного мозга. К особенностям препарата относятся: сохранение терапевтического эффекта не менее 4-6 ч при однократном введении, изоонкотическое действие и улучшение гемореологических свойств крови. Улучшение реологических свойств крови заключается в снижении гематокрита, вязкости крови, агрегационных свойств тромбоцитов, гиперкоагуляционных свойств плазмы, оптимизации макроциркуляции.
Мы применяли Рефортан® 6 % в средней дозе 6,7 мл/кг массы тела при различных нейрохирургических вмешательствах и диагностических инвазивных процедурах у 170 детей в возрасте от 4 мес. до 15 лет (табл.3).
Таблица 3.
Характеристика больных, которым вводили Рефортан®, по видам нейрохирургической патологии и хирургическому вмешательству
| Характер нейрохирургической патологии | Кол-во больных | Характер хирургического вмешательства | |
| Опухоли головного мозга | супратенториальные | 45 | Костно-пластическая трепанация черепа, удаление опухоли |
| субтенториальные | 50 | Трепанация задней черепной ямки, удаление опухоли, вентрикулоцистерностомия по Торкильдсену | |
| Артериовенозные мальформации | 27 | Ангиографическое исследование сосудов головного мозга, эндоваскулярные операции | |
| Гидроцефалия различной этиологии | 48 | Вентрикулоперитонеостомия. вентрикулоатриостомия | |
Таблица 4.
Эффективность и переносимость препарата Рефортан® у нейрохирургических педиатрических пациентов
| Группа больных | Опухоли задней черепной ямки | Опухоли хиазмально-селлярной области | Артерио-венозные мальформацни | Гидроцефалия различной этиологии |
| Количество больных | 80 | 15 | 27 | 48 |
| Цель инфузии Рефортана® | Восполнение ОЦК, улучшение микроциркуляции | Восполнение ОЦК, улучшение гемореологических показателей, удовлетворительный локальный гемостаз в ране | Восполнение ОЦК, улучшение гемореологических показателей, удовлетворительный гемостаз | Восполнение ОЦК, улучшение перфузии |
| Эффективность | Стабилизация гемодинамики, быстрый волемический эффект, «удовлетворительный» эффект во всех случаях | |||
| Переносимость | Не было признаков недостаточности кровообращения, никаких побочных, анафилактических и анафилактоидных реакций | |||
Ниже в качестве примера приведены схемы анестезиологического обеспечения нейрохирургических операций у детей с опухолями задней черепной ямки и с артериовенозными мальформациями [3, 5, 10, 11].
Опухоли задней черепной ямки
1. Операционное положение «сидя»
Дефицит ОЦК
ТВВА: диприван + фентанил-клофелиновая смесь
ИВЛ: нормовентиляция (РаСОз - 35 мм рт. ст.)
Волемический режим: гиперволемическая гемодилюция (Рефортан 6 %) 6. Интраоперационный мониторинг: ЭКГ, ЧСС, фотоплетизмография (ФПГ), SpO;, АД непрямым методом, ЦВД («Dinamap» «Criticon»)
- дети до 10 лет - 15 мл/кг массы (0,25 мл/кг мин);
- дети старше 10 лет - 20 мл/кг массы
Артериовенозные мальформации
1. Эндоваскулярные операции в условиях Rg-операционной
2. ТВВА: фентанил + дормикум
3. Анексат для проведения «диагностического» окна - оценка неврологического статуса пациента
4. Спонтанное дыхание
5. Волемический режим: нормоволемическая гемодилюция (Рефортан® 6 %)
6. Интраоперационный мониторинг: ЭКГ, ЧСС, ФПГ, SpO2, АД непрямым методом, ЦВД («Dinamap» - «Criticon»)
Рефортан® 6% доза:
Наш опыт использования Рефортана 6% позволяет сделать вывод о благоприятном клиническом прогнозе пациентов, которым для коррекции кровопотери и гиповолемии интраоперационно вводили этот коллоидный раствор, а также о положительных терапевтических эффектах, которые заключаются в снижении числа переливаний и объема гомологичной эритроцитарной массы, а также в снижении риска осложнений, связанных с гемотрансфузией.
Тактика инфузионной терапии в ходе нейрохирургических операций у детей
Д.м.н. Саввина И.А., Никитин А.А.
Российский нейрохирургический институт им. проф. А.Л. Поленова, Санкт-Петербург
Тактика инфузионной терапии в ходе нейрохирургических операций у детей основывается на том, что дефицит объема циркулирующей крови (ОЦК) имеется, как правило, у всех нейрохирургических пациентов детского возраста, степень повреждения компенсаторных механизмов ауторегуляции коррекции ОЦК и сосудистого тонуса зависит от вовлечения в патологический процесс структур средней линии мозга, а также имеются исходные гемореологические нарушения.
Идеальное интраоперационное ведение нейрохирургического больного включает:
- поддержание перфузионного давления мозга;
- контроль регуляции тонуса церебральных сосудов и внутричерепного давления (ВЧД);
- электрофизиологический мониторинг;
- быстрое востановление сознания (что необходимо для раннего неврологического осмотра).
Церебральное перфузионное давление является важнейшим показателем адекватности перфузии мозга:
Нормальное перфузионное давление мозга (ПДМ) колеблется в пределах 90-100 мм рт. ст.
Одним из принципов волемического режима нейрохирургического больного и оптимальным интраоперационным условием является нормоволемия в сочетании с умеренной гемодилюцией. Гемотрансфузия (предпочтительно эритроцитарная масса) проводится при показателях Нt
Значение нормального и допустимых колебаний гематокрита (Н t) в ходе операции у педиатрических пациентов
Если показатель гематокрита ниже допустимого (2-й столбец), следует решать вопрос о гематрансфузии в ранние сроки - в начале операции.
Для расчета объема и скорости инфузионной терапии в ходе оперативного вмешательства мы пользуемся следующей формулой:
Объем жидкости (мл/час) = 2,5 ? масса тела (кг) + 10,0
+ 2 мл/кг ч - малая хирургическая процедура;
+ 4 мл/кг ч - лапаротомия и торакотомия;
+ 6 мл/кг ч - "большая" хирургия (нейрохирургические, торакоабдоминальные операции).
Объем циркулирующей крови у новорожденных составляет 90 мл/кг массы тела, удетей дошкольного возраста - 80 мл/кг массы тела, у подростков - 65 мл/кг массы тела. Расчет кровопотери базируется на показателях гематокрита.
Необходимо помнить, что у маленьких детей (до трех лет) уровень артериального давления (АД) адекватно отражает объем циркулирующей крови.
Восполнение ОЦК в интраоперационном периоде у педиатрических пациентов
Мы считаем целесообразным привести альтернативную схему расчета объема и скорости инфузионной терапии в ходе оперативного вмешательства у детей различных возрастных групп.
Детям до 3-х лет:
Поддержание + травма = базисный почасовой объем
Поддерживающий объем = 4 мл/кг массы тела час
4 мл/кг час + легкая травма (2 мл/кг) = 6 мл/кг час
4 мл/кг час + умеренная травма (4 мл/кг) = 8 мл/кг час
4 мл/кг час + сильная травма (6 мл/кг) = 10 мл/кг час
Детям старше 4-х лет:
4 мл/кг час + сильная травма (6 мл/кг) = 10 мл/кг час.
Характеристика больных по видам нейрохирургической патологии и хирургическому вмешательству, которым применялся Refortan®
Читайте также:
- Биохимическая регуляция мозгового кровотока. Влияние углекислого газа и кислорода
- Результаты зрительных вызванных потенциалов (ЗВП) в норме
- Показания, подготовка к восстановлению сухожилия четырехглавой мышцы
- Оценка функции миокарда при пороках клапанов по тканевой допплер-эхокардиографии
- Ишемическая дисфункция правого желудочка. Функция левого предсердия
