Инструктивная функция врожденного иммунитета. Контроль за формированием адаптивного иммунитета
Добавил пользователь Владимир З. Обновлено: 22.01.2026
Первая фаза защиты человека от инфекции, называемая врожденный иммунитет, включает[89]:
Механический барьер в виде эпителиальной поверхности, защищающей человека от проникновения микроорганизмов. Бактерии, которые прошли через этот барьер, встречаются с двумя следующими линиями защиты.
Комплемент. Бактерии активируют альтернативным путем комплемент, который находится в плазме и может опсонизировать или разрушать бактерии.
Нейтрофилы. Макрофаги. Бактерии поглощаются макрофагами, имеющими на поверхности рецепторы, общие для всех бактерий (например, к липополисахариду - СД14). После связывания бактерий с рецепторами макрофагов, происходит инициирование синтеза цитокинов макрофагами, а бактерии поглощаются макрофагами и перевариваются ими.
NK-клетки. Вирусинфицированные клетки разрушаются NK-лимфоцитами (естественными киллерами).
Активация комплемента альтернативным путем и захват микроорганизмов тканевыми макрофагами имеют место в ранние часы после инфицирования. Далее включаются механизмы адаптивной защиты - гуморальный и клеточно-опосредованнный иммунный ответ.
Ранний неадаптивный ответ важен по 2-м причинам. Во-первых, дает возможность контро-лировать инфекцию до развития адаптивного ответа, он развивается быстро, так как не требует клональной селекции лимфоцитов и, следовательно, не требует латентного периода, как это происходит при пролиферации лимфоцитов и дифференцировке их в эффекторные клетки. Во-вторых, ранний ответ в дальнейшем влияет на адаптивный ответ за счет выработки цитокинов макрофагами.
Таким образом, основные отличия врожденного иммунитета от адаптивного следующие:
- начинает действовать немедленно после инфицирования; - нет иммунологической памяти; - отсутствует специфичность.
2.4.1. Основные клетки врожденного иммунитета
К основным клеткам, реализующим механизмы врожденного иммунитета, относятся макрофаги, нейтрофилы, естественные киллеры.
Макрофагипроисходят из циркулирующих в крови моноцитов. В большом количестве они находятся в соединительной ткани, селезенке, печени. Это большие фагоцитирующие клетки, которые играют ключевую роль во всех фазах защиты человека от инфекции. В отличие от моноцитов на макрофагах имеются рецепторы к маннозе, а также СД14-рецептор, который предназначен для связывания с бактериальными липополисахаридами. После связывания бактерий с рецепторами макрофагов происходит инициирование синтеза цитокинов макрофагами, а поглощенные бактерии перевариваются.
В свою очередь, медиаторы воспаления рекрутируют новые фагоцитарные клетки в места локализации инфекции. В частности, макрофаги, активированные с помощью ЛПС (липополисахариды) бактерий, после распознавания, захвата и дегрануляции Гр(-) бактерий синтезируют интерлейкины - ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12 и TNF-. Другие медиаторы, выделяемые макрофагами в ответ на инфекционные агенты, - это простагландины, оксид азота (NO), лейкотриены (в частности, LB4), PAF-фактор, активирующий пластины. В свою очередь, эти продукты активируют комплемент - С5а, С3а и в меньшей степени С4а. Один из компонентов комплемента, а именно С5а, - активирует тучные клетки, что приводит к выделению гистамина, серотонина и влиянию на эндотелиальные клетки в зоне воспаления. Все указанные факторы участвуют в воспалении.
Рассмотрим более подробно локальные и системные эффекты монокинов - цитокинов, выделяемых макрофагами (рис. 1).
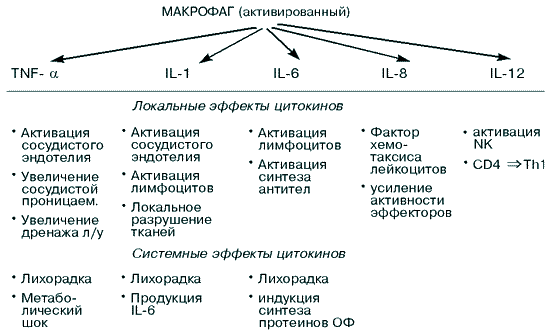
Рис. 1. Эффекты монокинов [89]
Как уже отмечалось, макрофаги поглощают и разрушают в основном Гр(-) бактерии, при этом активируются с помощью ЛПС бактерий и вследствие этого начинают секретировать монокины - интерлейкины 1, 6, 8, 12 и TNF-.
Монокины, выделяемые макрофагами в ответ на бактериальную инфекцию, вызывают следующие эффекты:
- индуцируют продукцию протеинов острой фазы печенью; - усиливают адаптивный иммунный ответ; - повышают температуру тела человека; - индуцируют воспаление, при котором изменяется проницаемость сосудистой стенки, рекрутируются фагоциты, иммунные клетки и молекулы в зону воспаления.
Помимо макрофагов, в реализации механизмов врожденного иммунитета большую роль играют нейтрофилы. Эти клетки преобладают в раннем клеточном инфильтрате в месте воспаления. Они находятся в крови и практически отсутствуют в нормальных тканях. Нейтрофилы - это коротко живущие клетки. В среднем срок их жизни равен 3-4-м дням. При реализации врожденного иммунного ответа продуцируются разные факторы, часть из которых является хемоаттрактантами для нейтрофилов и они быстро эмигрируют из крови и входят в очаг инфекции. В очаге нейтрофилы способны элиминировать многие патогены путем фагоцитоза.
Нейтрофилы способны фагоцитировать как опсонизированные бактерии, т.е. в соединении с антителами (опсонинами), так и в отсутствии антител. Таким образом, нейтрофилы осуществляют первую линию защиты. Компоненты бактериальной клетки могут быть связаны напрямую с нейтрофилами или опосредовано через липополисахариды - LPS, которые вначале связываются с протеинами сыворотки, образуя липополисахаридсвязанный протеин - LBP. Комплексы LPS и LBP затем соединяются с СД 14 на поверхности нейтрофила. Нейтрофилы могут также фагоцитировать комплексы бактерий, соединенные с С3b компонентом комплемента. Это соединение в свою очередь инициирует альтернативный путь активации комплемента.
Нейтрофилы способны элиминировать Гр(-) и Гр(+) бактерии, грибы и даже некоторые оболочечные вирусы. В то же время многие нейтрофилы погибают в очагах воспаления. Часть микроорганизмов фагоцитируется нейтрофилами, но не убивается ими. Но даже такая секвестрация микроорганизмов важна для хозяйской защиты, так как позволяет контролировать инфекцию в ранний период, а секвестрированные частицы вновь рефагоцитируются другими нейтрофилами или макрофагами, которые аккумулируются в зоне воспаления. Из сказанного следует, что нейтрофилы - это важная составная часть врожденного иммунного ответа хозяина на инфекцию.
Естественные киллеры (NK-клетки) служат в качестве самой ранней защиты против интрацеллюлярных микроорганизмов. NK-клетки были идентифицированы по их способности убивать определенные опухолевые клетки in vitro без предварительной активации. Однако известна их роль в ранней фазе защиты от инфицирования интрацеллюлярными патогенами, особенно Herpes virus и Listeria monocytogenes.
Активность естественных киллеров увеличивается в 20-100 раз, когда на них воздействуют цитокины, в частности, IFN-, IFN- или IL-12. Последний называется также NK-активирующим монокином, который продуцируется в раннюю фазу инфекции. ИЛ-12 в сочетании с TNF-a могут вызвать усиление продукции IFN- естественными киллерами.
Поскольку NK-клетки опосредуют в основном защиту человека против вирусов, они должны иметь некие механизмы для дифференцировки инфицированной и неинфицированной клетки. Окончательно этот вопрос не решен, однако установлено, что NK-клетки избирательно убивают клетки-мишени, имеющие низкий уровень молекул MHC класса 1 на своей поверхности. Это предполагает следующий механизм действия NK-клеток [89]: молекулы МНС класса 1 на нормальных клетках распознаются NK-клетками с помощью рецептора Ly49. В результате такого распознавания посылается отрицательный сигнал и происходит ингибиция активации NK-клетки. Иными словами, если рецептор Ly49 на естественных киллерах распознает молекулы МНС класса 1 на поверхности хозяйской клетки, то происходит ингибиция активации NK-клеток и последующего киллинга клетки-мишени не происходит.
Если клетки-мишени не экспрессируют молекулы МНС класса 1, то происходит киллинг их и клетка-мишень погибает. IFN- и IFN- усиливают экспрессию молекул МНС класса 1 на поверхности нормальных неинфицированных клеток, тем самым предотвращая атаку на них NK-клеток. Вирус-инфицированные клетки экспрессируют значительно меньшее количество молекул МНС класса 1, либо на их поверхности отсутствуют эти молекулы. В ряде случаев молекулы МНС класса 1 становятся измененными. В этих случаях рецептор Ly49 не распознает молекулы МНС класса 1 (НLA-B аллели) и нет подачи негативного сигнала. В результате NK-клетка активируется и убивает клетку-мишень.
Активация NK-клетки происходит через поверхностный рецептор NK R-P1 - это лектин-подобный рецептор, распознающий карбогидратные молекулы, являющийся триггером киллинга NK-клеток.
Таким образом, вирусинфицированные клетки могут быть подвергнуты киллингу с помощью NK-клеток двумя путями:
- если вирусы ингибируют весь синтез протеинов хозяина, и тогда а NK-клетки убивают клетку-мишень, т.к. нет подачи негативного сигнала через рецептор Ly49; - если вирусы могут селективно нарушать экспрессию молекул МНС-класса I на поверхность клеток, что делает их чувствительными к киллингу NK-клетками.
С другой стороны, известно, что вирус-инфицированная клетка распознается NK-клеткой даже, когда МНС экспрессия не нарушена вирусом. Люди с дефицитом NK-клеток очень чувствительны к ранней фазе герпес-инфекции [89].
Подводя итоги, следует сказать, что ранний неадаптивный ответ (врожденный иммунитет) на инфекцию вовлекает широкий круг эффекторных механизмов, направленных на разные классы патогенов. Все ответы становятся возможными благодаря рецепторам, которые являются в основном неспецифичными.
Особенности развития иммунитета у детей разного возраста
Многие родители, видящие свое любимое чадо болеющим, беспокоятся за состояние его иммунитета. Такая реакция абсолютно оправдана, ведь в современном мире негативные факторы могут сильно влиять на здоровье детей. Чтобы понять, насколько верны подобные опасения, и не упустить момент, нужно знать особенности развития иммунной системы.
Иммунитет — это способ защиты организма от агрессивной окружающей среды, содержащей множество различных чужеродных агентов, таких как: вирусы, грибки, бактерии и другие микроорганизмы. Такая способность противостоять инфекциям является результатом слаженной работы механизма иммунной системы.
Совсем недавно, в категории витаминно-минеральных комплексов для детей появилась новинка — БиоТоффи Детские витаминки. БиоТоффи содержит полный набор витаминов в соответствии с возрастными потребностями ребёнка, а также ряд минеральных веществ, дефицит которых наиболее часто обнаруживается 1. В его состав в оптимальной дозировке входят витамины группы В, А, С, D, Е, эссенциальные микроэлементы, играющие важную роль в жизнедеятельности как растущего организма, так и взрослого человека, такие как кальций, йод, железо [4, 5, 6]. Кроме того, в состав БиоТоффи Детские витаминки входят пробиотические микроорганизмы Bifidobacterium lactis, которые оказывает положительное влияние на микрофлору кишечника. Это, в свою очередь, улучшает всасывание витаминов и минералов, оказывает благоприятное действие на рост и развитие ребёнка, способствует укреплению иммунитета, правильной работе ЖКТ и хорошим достижениям в учебе и спорте. Известно, что срок хранения пробиотиков достаточно короткий. Липидная фракция масла какао в составе БиоТоффи Детские витаминки обеспечивает надежную защиту для пробиотических микроорганизмов, сохраняя их жизнеспособность и стабильность при хранении продукта и повышая устойчивость к агрессивной среде ЖКТ 10. Несомненным преимуществом, которое по достоинству будет оценено детьми, является форма выпуска данного ВМК — в виде шоколадных батончиков, что позволяет заменять более традиционные формы выпуска ВМК в виде капсул и таблеток с большей приверженностью к приему [11]. Данный ВМК рекомендован детям с 3 лет [12].

Врожденный иммунитет
Слово «врожденный» говорит само за себя. Этот иммунитет работает с момента появления ребёнка на свет.
Первая преграда, которую встречают на своем пути микробы — это кожа и слизистые оболочки. Кожа является для них полноценным барьером благодаря своей непроницаемости и кислой рН поверхности. Слизистые оболочки, контактирующие с внешней средой, обладают целым комплексом защитных свойств. Слизь, выделяемая клетками, не дает микроорганизмам прикрепиться, а движения специальных ресничек «выгоняют» их наружу. Жидкости организма (слезы, желчь, слюна и другие) обладают бактерицидным свойством, то есть способностью убивать бактерии.
Если по каким-то причинам барьер не сработал, и микроорганизм проник сквозь него, на помощь приходят клетки — фагоциты, устраняющие чужеродные агенты.
Приобретенный иммунитет
Формируется постепенно. Каждая встреча с микробом остается в «иммунологической» памяти, с помощью которой организм получает возможность противостоять повторному заражению этой инфекцией, реагировать быстрее. Такая защита обусловлена двумя звеньями приобретенного иммунитета — клеточного (Т и В лимфоциты) и гуморального (антитела). Лимфоциты запоминают микроб, а антитела его убивают. Механизм «иммунологической» памяти лежит в основе вакцинации.
Сталкиваясь в течение жизни с различными микроорганизмами, иммунная система человека развивается и накапливает «опыт», чтобы эффективно отвечать на любое вторжение. Иммунитет ребёнка несовершенен, процесс его становления длительный и имеет несколько критических периодов.

Первый критический период (до 28 дней жизни)
При рождении иммунная система целенаправленно подавлена. Происходит это потому, что в одночасье встреча с огромным количеством новых бактерий стала бы слишком серьезным испытанием для нее.
В этот период новорожденный восприимчив к окружающим его микробам, однако не беззащитен перед ними. Содержащиеся в грудном молоке матери антитела обеспечивают эффективную оборону.
Формирование нормальной иммунной системы и аллергии (как проявления неадекватного иммунного ответа) идут параллельно. Правильный баланс микрофлоры кишечника ребёнка с преобладанием бифидобактерий является фактором, защищающим от развития аллергических заболеваний. «Заселение» кишечника полезными бактериями происходит благодаря грудному вскармливанию.
Второй критический период (до 4-6 месяцев)
Количество защитных антител матери постепенно уменьшается, и примерно к 6-ти месяцам они выводятся из организма ребёнка. Этим фактом обусловлен второй критический период. Иммунная система приобретает способность самостоятельно продуцировать антитела в ответ на проникновение инфекции, однако она еще не может «запоминать» их. Именно поэтому вакцинация, проведенная в этом возрасте, требует повторения.
Местный иммунитет слизистых оболочек, контактирующих с внешней средой, очень слаб, а это означает, что они больше всего подвержены атакам микробов. Повторные ОРВИ, острые респираторные заболевания (ОРЗ) и кишечные инфекции — частая проблема. Нетипично могут протекать такие детские инфекции, как коклюш и корь, при этом не оставляя защитного иммунитета.
Аллергия в этом периоде — чаще всего пищевая (например, на белок коровьего молока) и маскируется явлениями диатеза.
Третий критический период (до 2-х лет)
Важный этап в развитии иммунной системы, на котором приобретенный иммунитет начинает формировать «иммунологическую» память к перенесенным инфекциям.
Свобода передвижения, активный контакт с другими детьми и животными — все это приводит к встрече с новыми микробами. Частота заболеваний ребёнка нарастает, одна болезнь следует за другой, но бояться этого не стоит — иммунная система активно набирается «опыта», встречаясь с различными вирусами и бактериями.
Работа системы местного иммунитета слизистых оболочек по-прежнему недостаточна. Поэтому такие заболевания органов дыхания, как ринит, синусит, фарингит, тонзиллит, ларингит, трахеит, бронхит — остаются самыми частыми. Такое состояние малыша заставляет многих родителей прибегать различным препаратам, стимулирующим иммунитет, однако это может только вмешаться в процесс формирования нормальной иммунной системы ребёнка и ослабить ее. Лучше воздержаться от подобных лекарств.
Явления аллергического диатеза (атопического дерматита) в этом возрасте могут нарастать.
Четвертый критический период (до 4-6 лет)

Наконец, концентрация защитных антител ребёнка соответствует уровню взрослого человека. Однако местный иммунитет слизистых оболочек все еще развит неполноценно, что может привести к формированию хронических заболеваний дыхательных путей.
Для детей этого возраста характерны глистные инвазии (лямблиоз).
На данном этапе к проявлениям кожной аллергии может присоединиться повышенная чувствительность к вдыхаемым из воздуха аллергенам (домашняя пыль, пыльца растений и другие) и как итог аллергический насморк (ринит) и/или бронхиальная астма.
Пятый критический период (12-13 лет у девочек и 14-15 лет у мальчиков)
Подростковый возраст. Усиленный рост ребёнка сочетается с уменьшением объёма органов иммунной системы, а бурная гормональная перестройка подавляет клеточное звено иммунитета. В этот период нарастает воздействие внешних негативных факторов, например, курения. Характерна восприимчивость к различным вирусным инфекциям.
Аллергические заболевания, такие как бронхиальная астма, могут временно ослабевать, но впоследствии вновь появляться в молодом возрасте. Контроль врача аллерголога-иммунолога обязателен.
Формирование иммунной системы ребёнка происходит активно. Родителям важно знать уязвимые периоды, быть внимательными и не допустить перехода острых инфекционных заболеваний в хронические, а также вовремя проводить профилактику развития аллергии при наличии предрасположенности к ней.
Частые заболевания ребёнка не всегда показатель слабости его иммунитета. Самостоятельный прием иммуностимулирующих препаратов может неблагоприятно сказаться на развитии иммунной системы. Ни один из них не должен применяться без предварительного исследования состояния всех компонентов иммунитета (анализ «иммунный статус») и рекомендации врача аллерголога-иммунолога.
Комментарии экспертов

Екатерина Пушкова, врач-педиатр, аллерголог-иммунолог медицинского центра «Атлас»
— Что означает «группа часто болеющих детей» и кто к ней относится?
— Термин ЧБД (часто болеющий ребёнок) — это не диагноз, а группа диспансерного наблюдения, которая крайне разнообразна по составу. В нее входят дети с хроническими очагами инфекции, эндокринологической, сердечно-сосудистой, бронхо-легочной патологией, дети с аллергическими заболеваниями (в частности с бронхиальной астмой), с врожденными пороками развития и т. д.
После определения ребёнка в группу ЧБД педиатр начинает диагностический поиск с подключением специалистов для выяснения причины рецидивирующих инфекционных заболеваний. Если есть подозрение на иммунодефицитное состояние, то в план обследования включается консультация иммунолога — аллерголога.
После полноценного обследования составляется индивидуальный план лечебных и реабилитационных мероприятий с целью стабилизации состояния и профилактики заболеваний.
— Как укрепить иммунитет ребёнка, не прибегая к различным лекарствам?
— Для повешения неспецифической реактивности организма хорошо работают простые и понятные мероприятия, такие как закаливание, режим сна и отдыха, достаточное пребывание на свежем воздухе, двигательная активность, сбалансированное питание. Для специфической реактивности — вакцинация.
![Ревенок.jpg]()
Мария Ревенок, врач-педиатр, г. Брянск
От врача-педиатра можно услышать: «Ваш ребёнок относится к группе часто болеющих детей (ЧБД)». Давайте разберем, что же это значит. Этот термин относится к острым респираторным вирусным инфекциям, которые обязательно встречаются на пути каждого ребёнка. Но вот сколько раз эта встреча произойдет и как она будет протекать — это для нас и представляет интерес.
Для разных возрастных групп свои критерии часто болеющего ребёнка. Дети до года — болеющие длительно 4 и более раз; дети младшего возраста, только начинающие посещать дошкольные учреждения — более 6 раз; далее эта цифра снижается до 4 раз в возрасте детей старше 5 лет.
Важная оговорка: болеющие не только часто, но и длительно! То есть больше важен не сам факт перенесения ребёнком вирусной инфекции, а то, как он ее переносит. Как укреплять иммунитет и закалить малыша? Мой ответ — не надо его «раскалять». Дети рождаются с удивительной способностью к приспособлению к окружающим условиям! Помещение малыша в «идеальные» оранжерейные условия (часто это очень тепло и сухо) и ограждения от каждого дуновения свежего воздуха — одна из причин, почему иммунитету не нужно начинать активно трудиться. Когда все же происходит встреча с вирусом или холодной лужей — организм просто не знает, что с этим нужно делать!
Ребёнку, который уже часто и длительно болеет важно максимально избегать контактов с новыми инфекциями для восстановления иммунитета и правильно лечить основную болезнь. Также важно научиться не прикасаться руками к лицу и не класть в рот то, что для этого не предназначено.
Вот некоторые советы, которые помогут поддержать иммунитет вашего малыша:
- необходимо отрегулировать прохладный и влажный воздух в доме, где живет ребёнок,
- совершать ежедневные прогулки на свежем воздухе при любой погоде,
- обеспечивать специально подобранное для вашего малыша питание,
- не забывать о питье чистой воды и мытье рук всем членам семьи,
- соблюдать умеренность в посещении людных мест.
Противопоказания: индивидуальная непереносимость компонентов, нарушение углеводного обмена. Перед применением необходимо проконсультироваться с врачом-педиатром, детям до 14 лет принимать БАД по согласованию и под наблюдением врача-педиатра.
Иммунная система. Врожденный и приобретенный иммунитет. Иммунный ответ.
Что такое иммунная система и иммунитет. Серологические реакции иммунитета.
Иммунной системой у животных и человека называется специализированная система органов, клеток и продуцируемых этими клетками молекул, предназначенная для защиты внутренней среды организма от попадания чужеродных органических молекул. Основное назначение иммунной системы — защита организма от биологической агрессии.
Иммунный ответ — многоэтапный процесс распознавания и разрушения патогена и повреждённых им тканей. В основе этого процесса лежит уникальное свойство иммунной системы отличать «свое» от «чужого» и применять по отношению к «чужому» механизмы нейтрализации и уничтожения, а именно — иммунные реакции.
Иммунитет (от латинского "immunitas"- освобожденный) - механизм защиты организма от живых тел и веществ, несущих на себе признаки генетической чужеродности и создающих опасность для организма. Иммунитет обеспечивает устойчивость организма к инфекционным агентам и резистентность к опухолям.
По типу механизмов иммунной защиты различают два вида иммунитета — врожденный и адаптивный (приобретенный).
Врождённый иммунитет — это генетически закреплённая способность противостоять инфекции, присущая каждому организму с рождения. Врожденный иммунитет человека поддерживается всеми элементами, с которыми он рождается. Для человека элементами врожденной системы являются наружные оболочки тела и его внутренние компоненты. Кожа и слизистые оболочки имеют ряд механизмов для уничтожения и удаления чужеродных агентов. Поэтому они представляют эффективный барьер для антигенов, в том числе для микроорганизмов.
Собственных возможностей врождённого иммунитета часто бывает недостаточно, чтобы очистить организм от проникших патогенов и сдержать развитие инфекции. Именно поэтому в процессе эволюции живых организмов, начиная с челюстных рыб, к врождённому иммунитету добавился адаптивный (приобретенный) иммунитет — специфический.
Приобретенный иммунитет имеется только у позвоночных. Сама способность запускать иммунный ответ на чужеродное вторжение — врожденная. Однако, в отличие от врожденного иммунитета, срабатывающего мгновенно или в течение первых нескольких часов после контакта с патогеном, независимого от контакта с патогенными, адаптивный иммунный ответ развивается только в ответ на контакт со вторгшимся объектом. Приобретенный иммунитет приобретается при контакте с конкретным антигеном и специфичен именно к нему; отсюда и его название — приобретенный иммунитет.
Материальные носители приобретенного иммунитета — лимфоциты. Уникальное и отличительное свойство лимфоцитов как множества клеток — способность распознавать почти неограниченное разнообразие чужеродных молекулярных объектов — антигенов.
Существуют две ветви приобретенного иммунитета, которые взаимодействуют друг с другом, чтобы устранить антиген. Одно определяется участием в основном В-клеток и циркулирующих антител, в форме так называемого гуморального иммунитета (термин «гуморальный» ранее использовали для определения жидких сред организма). Другое направление определяется участием Т-клеток, которые не синтезируют антител, но синтезируют и высвобождают различные цитокины, действующие на другие клетки. В связи с этим данный вид приобретенного иммунного ответа называется клеточным или клеточно-опосредованным иммунитетом.
Серологические реакции иммунитета - это реакции между антигеном и антителом, которые происходят в живом организме и могут быть воспроизведены в лабораторных условиях. Эти реакции названы так от латинского слова "serum" - "сыворотка", так как для их постановки используют сыворотки, содержащие антитела.
Иммунный ответ.
В ответ на попадание антигенов в организм начинается целый комплекс реакций, направленный на освобождение внутренней среды организма от продуктов чужеродной генетической информации. Такая совокупность защитных реакций иммунной системы называется иммунным ответом. Элементами иммунного ответа являются:
Инструктивная функция врожденного иммунитета. Контроль за формированием адаптивного иммунитета
Физиология:
Популярные разделы сайта:
Клетки врожденного иммунитета. Фагоциты
В реализации эффекторных механизмов врожденного иммунитета участвуют различные клетки миелоидного ряда: фагоциты, NK-клетки, NKT-лимфоциты, эозинофилы, базофилы, тучные клетки, ДК.
Основные отличия следующие:
• клетки врожденного иммунитета активируются при распознавании специальными рецепторами (PRR) не индивидуальных молекул, а их групп — РАМР;
• клетки врожденного иммунитета всегда готовы к осуществлению эффекторных функций. Для этого им не требуется пролиферации, дифференцировки и межклеточных взаимодействий, характерных дя клеток адаптивного иммунитета;
• отсутствие иммунологической памяти;
• клетки врожденного иммунитета содержат в цитоплазме широкий спектр эффекторных молекул. Действие этих молекул осуществляется внутриклеточно при фагоцитозе и вне клетки при экзоцитозе.
Фагоциты — основная группа клеток системы врожденного иммунитета. Они имеют миелоидное происхождение и обладают способностью к фагоцитозу. По морфологии и функции их разделяют на мононуклеарные клетки (моноциты/макрофаги) и нейтрофилы, что соответствует предложенному И.И. Мечниковым разделению на макро- и микрофаги. Роль фагоцитов в иммунном ответе крайне многообразна. Они выполняют ряд ключевых функций во врожденном и в адаптивном иммунитете.
Активация фагоцитов происходит через многие поверхностные рецепторы.
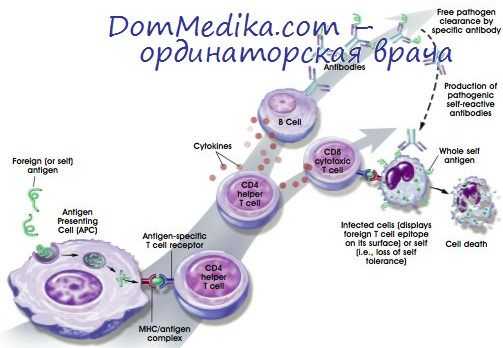
Ведущую роль в активации фагоцитов играют PRR врожденного иммунитета (например, TLR, NOD-рецепторы, маннозные рецепторы, рецепторы-«мусорщики», рецепторы комплемента и многие другие). Ответная реакция развивается быстро, не требует пролиферации и дифференцировки клеток.
Активация обычно происходит в два этапа: прайминг и собственно активация. Суть прайминга заключается в том, что предварительная обработка клеток небольшим количеством стимулятора (1-й сигнал), действие которого не вызывает прямой активации, сопровождается усилением ответа фагоцитов на второй сигнал. В результате активированные фагоциты выполняют следующие функции:
• хемотаксис;
• фагоцитоз;
• образование активных форм кислорода; • синтез оксида азота;
• синтез и секреция цитокинов и других биологически активных медиа-торных молекул (метаболиты арахидоновой кислоты, компоненты комплемента, факторы свертывания крови, белки матрикса, ферменты, противомикробные пептиды, гормоны и др.);
• бактерицидную активность;
• процессиг и презентацию антигена (профессиональные АПК — ДК, мононуклеарные фагоциты).
Основные типы клеток, участвующих в развитии воспаления — универсальной защитной реакции организма на повреждение, — нейтрофилы, моноциты, макрофаги, а также клетки эндотелия и фибробласты. Первыми в очаг воспаления мигрируют нейтрофилы (в первые часы, сутки), затем макрофаги (в течение нескольких дней) и самыми последними — лимфоциты.
При остром воспалении преобладают нейтрофилы и активированные Т-хелперы, при хроническом воспалении больше макрофагов, ЦТЛ и В-лимфоцитов. Такая периодичность миграции лейкоцитов в очаг воспаления обусловлена хемокинами и молекулами адгезии.
Immunology / Gankovskaia_L._Основы общен иммунологии
лениями об иммунной системе организма, ее структурно-функциональных особенностях. В связи с этим основное внимание уделяется изложению ключевых вопросов общей иммунологии, дающих представление о структуре и функциях иммунной системы, ее врожденном и приобретенном компонентах. Отдельные главы посвящены характеристике клеток иммунной системы, маркерам и рецепторам, процессам дифференцировки Т- и В-лимфоцитов, развитию иммунного ответа, механизмам клеточной цитотоксичности, структуре и функции антител, системе цитокинов. Рассматриваются строение и функции главного комплекса гистосовместимости человека.
Многочисленные иллюстрации и схемы способствуют лучшему представлению и восприятию процессов, происходящих в иммунной системе.
Изложение материала построено по общему принципу. В начале каждого раздела обозначены цель, краткий перечень рассматриваемых вопросов, основные понятия, затем идет изложение основного материала. В конце главы представлен перечень контрольных вопросов, а также тестовые задания для проверки усвоения материала.
Любые предложения и замечания будут с благодарностью приняты авторами данного пособия и учтены при его переиздании.
ГЛАВА 1. ИMMУНИТЕТ. ИММУННАЯ СИСТЕМА И ЕЕ СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ
ГЛАВА 1. ИММУНИТЕТ. ИММУННАЯ СИСТЕМА И ЕЕ СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ
Цель изучения темы: познакомиться с современным понятием иммунной системы и иммунитета, а также изучить основные структурно-функциональные особенности и свойства иммунной системы, получить общие представления о врожденном и адаптивном иммунитете.
Требования к уровню подготовки студентов: для успешного изучения раздела необходимо иметь основные знания по гистологии и анатомии.
Основные вопросы темы:
1. Современное определение иммунитета.
2. Структурно-функциональная организация иммунной системы.
3. Понятие о врожденном и адаптивном иммунитете.
4. Характеристика клеток иммунной системы.
4.1. Лимфоциты — клетки адаптивного иммунитета.
4.2. Клетки врожденного иммунитета.
4.3. Промежуточные клетки.
Основные понятия и термины:
Иммунитет - способ защиты организма от живых тел и веществ, несущих признаки генетически чужеродной информации (включая микроорганизмы, чужеродные клетки, ткани или генетически изменившиеся собственные клетки, в том числе опухолевые).
Иммунная система - специализированная система органов и тканей, обеспечивающая иммунитет.
1.1. Общие представления об‚иммунной системе
На заре становления иммунологии — в начале XX века — феномен иммунитета рассматривали в основном в связи с инфекционными процессами и подразумевали под этим понятием невосприимчивость организма к инфекционным заболеваниям. Однако дальнейшие исследования — с середины ХХ века — позволили по-новому взглянуть на иммунную систему. Известный австралийский ученый, Нобелевский лауреат Ф. Бернет в 50-е гг. прошлого столетия выдвинул концепцию об иммунологическом надзоре, согласно которой главная функция иммунной системы стала рассматриваться с позиции распознавания «своего» и «чужого». Эта точка зрения существенно расширила границы иммунологии и доминирует в настоящее время.
С позиции современной науки, иммунная система участвует в реализации противоопухолевого, трансплантационного иммунитета, иммунных взаимоотношений мать-плод, ликвидации пострадиационных последствий, неблагоприятных воздействий экологических факторов и многого другого.
Таким образом, уникальность иммунной системы заключается в контроле генетического постоянства организма на протяжении жизни. Все генетически чужеродное для конкретного организма элиминируется при участии его иммунной системы. Основная функция иммунной системы связана с распознаванием огромного количества разно-
ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ
образных структур (например, белковых), поступающих в организм. Естественно, что среди них преобладают структуры, так или иначе связанные с патогенными и непатогенными микроорганизмами. Все эти чужеродные по отношению к конкретному организму вещества объединены таким понятием, как антиген.
Иммунная система обладает целым рядом уникальных свойств:
высокая специфичность — проявляется избирательным связыванием антител или клеток с конкретным антигеном. Например, лимфоциты с помощью антигенспецифических рецепторов распознают антигенные молекулы, различающиеся 1-2 аминокислотными остатками, и удаляют их из организма;
высокая чувствительность — клетки иммунной системы, такие как лимфоциты, распознают антигены на уровне отдельных молекул. Взаимодействие антиген-антитело — одна из наиболее высокочувствительных биологических реакций;
иммунологическая индивидуальность — для каждого организма характерен свой генетически контролируемый тип иммунного ответа. Основной постулат иммуногенетики — конкретность иммунного ответа;
клональный принцип организации
лимфоцитов, проявляющийся в способности всех клеток в пределах отдельного клона отвечать только на один антиген (антигенную детерминанту). Согласно клонально-селекционной теории Ф. Бернета, в иммунной системе формируются клоны лимфоцитов, способные распоз-
навать огромное количество (10 9 -10 11 ) вариантов антигенных молекул, составляющих так называемый антигенный репертуар;
иммунологическая память — способность иммунной системы (клеток памяти) отвечать ускоренно и усиленно на повторное введение антигена (например, при инфекции или вакцинации);
иммунная толерантность — специфическая невосприимчивость некоторых антигенов, в том числе антигенов собственного организма (аутоантигенов). Нарушение этого свойства приводит к срыву толерантности и формированию аутоиммунной патологии;
способность клеток иммунной системы к рециркуляции — перемещение клеток через кровеносную и лимфатическую систему обеспечивает единство и целостность иммунной системы. Лимфоциты, моноциты, нейтрофилы и другие клетки способны мигрировать через эндотелий кровеносных и лимфатических сосудов в центральные и периферические органы и ткани иммунной системы, а также в другие ткани в норме и при патологии (чаще при воспалении). В циркуляции могут находиться практически все клеточные элементы иммунной системы, в том числе гемопоэтические стволовые клетки;
двойное распознавание антигена Т-лимфоцитами — уникальная способность Т-лимфоцита распознавать чужеродные антигенные пептиды в ассоциации с собственными молекулами главного комплекса гистосовместимости;
регуляторное действие на другие сис- мозге присутствуют гемопоэтические ство-
темы организма — иммунная система через прямые межклеточные контакты и, опосредованно, через огромное количество медиаторных молекул (цитокины, хемокины, гормоны тимуса и др.), оказывает регуляторное воздействие практически на все системы организма. Нарушение иммунных регуляторных механизмов лежит в основе многих заболеваний человека, часто с поражением органов и тканей, формально не включаемых в иммунную систему (например, поражение суставов, печени, кожи, ЦНС и др.). От того, насколько полноценно функционирует иммунная система, зависят многие процессы нормальной жизнедеятельности организма. Современная иммунология большое внимание уделяет изучению роли цитокинов в межсистемных регуляторных процессах.
Таким образом, наряду с нервной и эндокринной иммунная система служит одной из интегрирующих систем регуляции, действующих на уровне целого организма.
1.2. Структура иммунной системы
Иммунная система включает центральные и периферические органы.
К центральным органам относят красный костный мозг и тимус. В центральных органах иммунной системы происходят процессы антигеннезависимой дифференцировки (созревания) лимфоцитов (иммунопоэз).
Красный костный мозг , расположенный в губчатых костях и эпифизах трубчатых костей, является местом, где формируются все клетки крови (гемопоэз), в том числе клетки иммунной системы. В красном костном
ловые клетки, способные к дифференцировке в различные клеточные элементы, в том числе предшественники миелоидных и лимфоидных клеток. Все клетки иммунной системы, за исключением Т-лимфоцитов, формируются в красном костном мозге.
Тимус расположен в переднем верхнем средостении за грудиной. Часть лимфоидных предшественников на ранних этапах развития покидает красный костный мозг, мигрирует в тимус, где проходят дальнейшие этапы их дифференцировки. В результате в тимусе образуются Т-лимфоциты.
В ходе антигеннезависимой дифференцировки в тимусе и в костном мозге формируется репертуар специфических антигенраспознающих рецепторов Т- и В-лимфоцитов, соответственно, и элиминируются аутоагрессивные клоны лимфоцитов.
В периферических органах иммунной
системы (лимфатические узлы, селезенка, миндалины, пейеровы бляшки, лимфоидная ткань,ассоциированнаяскожейислизистыми оболочками, и т.д.) происходит антигензависимая дифференцировка лимфоцитов — иммунный ответ (иммуногенез). Расположение периферических органов иммунной системы отражает основные пути проникновения и распространения антигенов.
Лимфоидная ткань, ассоциированная со слизистыми оболочками, включает групповые лимфатические фолликулы (глоточные, нёбные и язычные миндалины, пейеровы бляшки, аппендикс), а также диффузно распределенные лимфоидные и миелоидные клетки. Все эти структуры являются барьером на пути экзогенного проникновения антигенов. Селезенка обеспечивает развитие иммунного
Читайте также:

