Интенсивная терапия в неврологии. Коррекция водно-солевого балланса в неврологии
Добавил пользователь Alex Обновлено: 21.01.2026
В последние десятилетия все более активно идет внедрение методов реанимации и интенсивной терапии в различные медицинские дисциплины, в том числе, в неврологию. Реаниматология и нейрореаниматология - вид врачебной деятельности, формирующий у врача новые подходы к лечению больного и особое медицинское мышление (Рябов Г.А., 1994), характеризующееся недопустимостью промедления при диагностике и терапии (Пирадов М.А., 2000). При этом нозологический принцип оказания медицинской помощи становится недостаточным и необходим синдромный подход, так как определяющим состояние больного становится комплекс синдромов нарушенного гомеостаза, требующих немедленной и максимально эффективной коррекции (Васильков Н.С., 2000).
Концепции эффективной интенсивной базисной и дифференцированной терапии рассматривают тяжелые неврологические заболевания, такие как инсульт, эпилептический статус, восходящие энцефалополинейропатии, черепно-мозговую травму как тяжелые критические состояния, характеризующиеся наличием клинических синдромокомплексов, определяющих, наряду с собственно интрацеребральным процессом, тяжесть заболевания, его исход, степень инвалидизации. Это прежде всего синдромы, связанные с гипоксическими системными и церебральными расстройствами, такие как синдромы респираторной и гемодинамиче-ской гипоксии, гипоксии малого сердечного выброса. Достаточно часто вследствие выраженных микроциркуляторных расстройств, имеющих место как на системном, так и на интрацеребральных уровнях, у больных с тяжелой неврологической патологией возникают синдромы гипоксии периферического шунтирования и, прежде всего, капиллярно-клеточная гипоксия. Например, прогрессирование гипоксии, провоцирующей нарушения функционирования эндотелиальной системы и вторичную блокаду микроциркуляции, могут лежать в основе инсультов, протекающих по типу гемореологической микроокклюзии, а также ДВС-синдрома, характерного для больных с тяжелой неврологической патологией любого генеза. Необходимо отметить, что гипоксические синдромы почти всегда имеют место у пациентов как с ишемическими, так и с геморрагическими инсультами при их тяжелом течении, т.е. в среднем у 45% больных, а прогрессирование при инсульте или другой неврологической патологии, на фоне углубления расстройств микроциркуляции и присоединения дыхательных расстройств, например при бронхообструктивном синдроме, может спровоцировать резкое нарастание тяжести очагового неврологического дефицита. Гемодинамический ишемический инсульт, вторичные ишемии при геморрагических инсультах, травме, эпистатусе почти во всех случаях являются результатом синдромов нарушения гемодинамики, таких как сердечная и сосудистая недостаточность; волемические нарушения. Неадекватные программы инфузионной коррекции, массивная терапия неосмотическими диуретиками, особенно при депрессии сознания, стволовой симптоматике, расстройствах глотания, могут усугублять у больных с интрацеребральной патологией гиповолемические синдромы, а также синдромы нарушения водно-электролитного гомеостаза, тем более, что в неврологических отделениях для терапии чаще всего используются только солевые растворы, а мониторинг осмотических и кислотно-основных свойств крови практически не проводится. Синдромы нарушения моторной функции кишечника, как и синдромы системной воспалительной реакции, возникают у больных с неврологической патологией в результате локальных и\или диффузных постгипок-сических функционально-морфологических расстройств в надсегментарных вегетативных образованиях. Нарушения сознания, считающиеся одними из ведущих клинических синдромов критических состояний, у больных с тяжелой неврологической патологией возникают как результат очаговых и\или диффузных церебральных расстройств на фоне системных расстройств гомеостаза. Таким образом, любая тяжелая неврологическая патология с полным основанием может рассматриваться как особый вид критических состояний, так как, при ее возникновении не только имеют место многие клинические синдромы нарушения витальных функций, но тяжесть ее течения и исходы могут определяться именно этими неспецифическими синдромами.
Госпитализация тяжелых неврологических больных в ОРИТ имеет медицинское и экономическое обоснование при возможности проведения мониторирования системного и церебрального гомеостаза и эффективной ранней коррекции системных расстройств с последующим или одномоментным осуществлением дфференцированной терапии.
Интенсивная терапия в неврологии. Коррекция водно-солевого балланса в неврологии
Кафедра нервных болезней Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
Военно-медицинская академия, Санкт-Петербург
Метаболическая терапия в неврологии
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2013;113(7): 37‑41
Живолупов С.А., Самарцев И.Н., Рашидов Н.А., Бодрова Т.В., Воробьева М.Н. Метаболическая терапия в неврологии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013;113(7):37‑41.
Zhivolupov SA, Samartsev IN, Rashidov NA, Bodrova TV, Vorob'eva MN. Metabolic therapy in neurology. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2013;113(7):37‑41. (In Russ.).
Оценивалась терапевтическая эффективность оригинального инфузионного препарата на основе многоатомных спиртов реосорбилакт в составе комплексной терапии пациентов с дисциркуляторной энцефалопатией (ДЭ) и диабетической полинейропатией (ДПН). Реосорбилакт вводился по 200-400 мл в сутки (из расчета 3 мл/кг) внутривенно капельно со скоростью 80 капель в минуту через день в течение 20 дней. Первичной конечной точкой исследования было улучшение качества жизни больных через 1 мес от начала лечения, оцениваемое по данным шкалы SF-36. В группе пациентов с ДЭ изучались когнитивные функции и проводилось ультразвуковое дуплексное сканирование магистральных артерий головы. У больных с ДПН анализировались выраженность болевого синдрома (опросник NRS), профиль глюкозы в плазме крови и электронейромиографические показатели нервов нижних конечностей. В обеих группах больных также оценивали ряд показателей кислотно-основного равновесия в венозной крови. Полученные данные свидетельствуют о выраженном клиническом эффекте реосорбилакта у исследуемой категории больных.
В современной неврологии широко применяется метаболическая терапия, в частности препараты с цитопротективным эффектом. Важной областью ее применения является лечение дисциркуляторной энцефалопатии (ДЭ), так как препараты, влияющие на гемодинамические параметры, эффективны для профилактики инсульта, но не защищают нейроглиальный комплекс от метаболических изменений, составляющих основу прогрессирования патологического процесса. В частности, атеросклероз приводит к гипоперфузии и развитию дисбаланса между доставкой кислорода к нейронам и потребностью в нем - формируется ишемия, изменяющая клеточный метаболизм. В основе дисфункции нейронов и клинических проявлений заболевания лежат ацидоз, локальное воспаление и пероксидация, нарушение ионного равновесия, уменьшение синтеза АТФ [3, 11, 14].
Одним из важных факторов развития тканевой гипоксии при ДЭ выступают расстройства микроциркуляции [10, 20, 21]. Повышенная вязкость крови является фактором риска развития ДЭ, транзиторных ишемических атак, предшествует инсультам [1, 6]. Существуют различные формы синдрома повышенной вязкости крови: гемоконцентрация, увеличение адгезии клеток, повышение агрегации тромбоцитов и снижение деформируемости эритроцитов, которые ведут к фибринообразованию и тромбозу [13]. Коррекция реологических свойств крови - важный элемент комплексного лечения больных с сосудистой патологией.
Выделяют три основных направления метаболической терапии в неврологии - профилактика некроза и апоптоза нейронов; оптимизация процессов образования и расхода энергии; нормализация баланса между интенсивностью свободнорадикального окисления и антиоксидантной защитой. Для этого в клинической практике назначаются антигипоксанты, оптимизирующие функции митохондрий, активирующие цикл Кребса, предотвращающие разобщение окисления и фосфорилирования [16, 18].
Спектр препаратов, способных эффективно влиять на реологические свойства крови, ограничен. С этой целью используются растворы альбумина, однако значительное число побочных эффектов ограничивает их применение [12]. Широко назначаются плазмозамещающие растворы, препараты декстрана, производные желатина, гидроксиэтилкрахмала, полиэтиленгликоля. Они оказывают нормоволемический эффект за счет поступления интерстициальной жидкости в сосудистое русло, а также антитромботическое действие [2, 15], но требуют осторожности при назначении пациентам с сердечной и дыхательной недостаточностью.
Учитывая вышеизложенное, средствами выбора для коррекции гемореологических расстройств должны являться препараты, более безопасные и эффективные. Интерес представляет оригинальный препарат, созданный на основе многоатомных спиртов, - реосорбилакт, 1 л которого содержит сорбитол - 60,0 г, натрия лактат - 19,0 г, натрия хлорид - 6,0 г, кальция хлорид - 0,1 г, калия хлорид - 0,3 г, магния хлорид - 0,2 г, воду для инъекций - до 1 л; осмолярность 900 мОсм/л; энергетическая ценность - 240 ккал/л; рН 6,0-7,6. Реосорбилакт обладает полифункциональным действием, нормализуя несколько видов нарушения гомеостаза: благодаря гиперосмолярности реосорбилакт вызывает поступление жидкости из межклеточного пространства в сосудистое русло, улучшая микроциркуляцию и перфузию тканей; сорбитол, частично метаболизируясь до фруктозы, способствует нормализации углеводного и энергетического обмена (при этом сорбитол, в отличие от глюкозы, метаболизируется без участия инсулина), что особенно благоприятно сказывается на улучшении функционального состояния нейроглии и гепатоцитов, в которых восстанавливается депо гликогена; сорбитол стимулирует окисление жирных кислот по некетогенному пути метаболизма и облегчает включение кетоновых тел в цикл Кребса; сорбитол повышает моторику кишечника за счет прямого действия на нервно-рецепторный аппарат кишечной стенки и усиление синтеза и секреции вилликинина, холецистокинина и витаминов группы В; натрия лактат способствует коррекции кислотно-основного равновесия плазмы, лактат-анион восстанавливает и стимулирует функции клеток ретикуло-эндотелиальной системы печени и почек. Эти свойства позволяют применять реосорбилакт для коррекции водно-электролитного, кислотно-щелочного и энергетического баланса, улучшения реологических свойств крови.
Цель работы - изучение возможности применения реосорбилакта в качестве средства метаболической терапии в неврологической практике.
Материал и методы
Проведено открытое клиническое исследование эффективности препарата реосорбилакт в составе комплексной терапии пациентов с ДЭ и диабетической полинейропатией (ДПН). В исследовании приняли участие 89 пациентов в возрасте от 42 до 70 лет (средний - 54,2±5,8 года).
Критериями включения пациентов в исследование были верифицированный диагноз ДЭ I-II стадии или ДПН, а также наличие информированного согласия пациента. Критериями исключения являлись алкалоз, индивидуальная непереносимость компонентов препарата, язвенная болезнь желудка, геморрагический колит, тяжелые заболевания печени, рефрактерная артериальная гипертензия и сердечная недостаточность в стадии декомпенсации.
Первую группу составили 45 больных, 25 мужчин и 20 женщин, с ДЭ, которые были рандомизированы в две подгруппы, сопоставимые по полу, возрасту и индексу массы тела. В лечении 20 пациентов подгруппы Iа использовали ноотропные, сосудистые, витаминные препараты. Комплексная терапия 25 больных подгруппы Iб, кроме того, включала введение реосорбилакта по 200-400 мл в сутки (из расчета 3 мл/кг) внутривенно капельно со скоростью 80 капель в минуту через день в течение 20 дней.
Во вторую группу вошли 44 пациента, 24 мужчины и 20 женщин, с ДПН, которые также были разделены на 2 сопоставимые подгруппы IIа и IIб по 22 больных в каждой. Комплексное лечение больных обеих подгрупп включало витаминные препараты, тиоктовую кислоту.
В подгруппе IIб, кроме того, применяли парентеральное введение реосорбилакта по приведенной выше схеме.
Исследование включало скрининговый период, период активного лечения, этап наблюдения и анализа результатов. На этапе скрининга определяли соответствие пациента критериям включения/исключения. После 20-дневного курса лечения больные оставались под наблюдением в течение еще 10 дней. Общая длительность исследования составила 30 дней.
Первичной конечной точкой исследования в обеих группах больных было улучшение качества жизни пациентов через 1 мес от начала лечения, оцениваемое по шкале SF-36. Всем пациентам 1-й группы до лечения и на 30-е сутки наблюдения, помимо неврологического осмотра [8], проводилось исследование когнитивных функций с использованием батареи тестов лобной дисфункции (FAB), краткой шкалы оценки психических функций (MMSE), а также изучались параметры кислотно-основного равновесия в венозной крови (рН и избыток оснований - ВЕ). До начала исследования и по его завершении осуществлялось ультразвуковое дуплексное сканирование (УЗДС) магистральных артерий головы на аппарате SONOLINE Elegra (Германия, СПЕКТРОМЕД) с использованием линейного датчика 7 МГц. Исследование включало определение толщины комплекса интима-медия (КИМ) сонных артерий в стандартных точках; диаметров общих (ОСА) и внутренних (ВСА) сонных артерий; степени стеноза по критерию ECST [11]. Скоростные и спектральные параметры кровотока определялись в ОСА, ВСА и позвоночных артериях (ПА) на экстракраниальном уровне. Оценивались пиковая систолическая и конечная диастолическая скорости кровотока, усредненная по времени пиковая и объемная скорость кровотока (V vol ) в каждом сосуде отдельно; также оценивали суммарную объемную скорость кровотока в ОСА (σV vol ОСА) и ПА (σV vol ПА), суммарную объемную скорость мозгового кровотока (σV vol МК).
Во 2-й группе помимо оценки качества жизни по SF-36, уровня тревоги (опросник HARS), интенсивности боли (опросник NRS) и параметров кислотно-основного состояния в венозной крови (рН и ВЕ) до лечения и на 30-е сутки исследования анализировали концентрацию глюкозы в капиллярной крови и проводили электронейромиографию (ЭНМГ) большеберцового и малоберцового нервов с помощью диагностического комплекса Nicolet Viking-IV (CША). Исследовались скорость проведения импульса по двигательным волокнам (СПИ эфф), скорость проведения импульса по чувствительным волокнам (СПИ афф), амплитуда М-ответа, латентный период вызванного потенциала. Выраженность побочных эффектов лечения оценивали с помощью шкалы оценки побочного действия UKU [17].
Статистический анализ полученных данных проводили с помощью программы Statistica 6.0 в соответствии с рекомендациями по обработке результатов медико-биологических исследований [9]. Выбор методик осуществлялся с учетом принципов системного анализа и моделирования динамических исследований. Заключение о статистической значимости давалось при уровне вероятности ошибочного заключения р
Результаты
В начальном периоде исследования у большинства пациентов c ДЭ преобладал астено-невротический синдром, в неврологическом статусе наблюдались рассеянная неврологическая симптоматика, латерализованный пирамидно-мозжечковый дефицит и легкие когнитивные расстройства (табл. 1). Анализ состояния кислотно-основного состояния крови у данной категории больных выявил дефицит оснований (ВЕ) при нормальном значении рН, что свидетельствовало о негрубом ацидозе, вероятно, развившемся из-за недостаточности энергетического обеспечения тканей при их хронической гипоперфузии. Пациенты с ДЭ отмечали снижение показателей качества жизни (по шкале SF-36) в физической и психологической сферах, что соответствовало характеру предъявляемых жалоб.
На этапе скрининга подавляющее большинство пациентов с ДПН предъявляли жалобы на онемение, парестезии в стопах, усиливающиеся в ночное время. В неврологическом статусе доминировал полиневритический синдром с поражением нижних конечностей, сопровождавшийся умеренно выраженным болевым синдромом (по данным шкалы NRS). Исследование периферической крови выявило легкую гипергликемию и метаболический ацидоз (по результатам исследования ВЕ) при нормальном показателе рН. ЭНМГ нервов нижних конечностей позволила установить значимое снижение СПИ по сенсорным и моторным нервным волокнам, снижение амплитуды М-ответа и увеличение его латентности.
Оценка метаболического эффекта реосорбилакта при ДЭ и ДПН обусловлена общностью патогенеза (нарушение микроциркуляции) этих заболеваний (ацидоз, оксидативный стресс, снижение активности митохондрий и др.). Установленная эффективность реосорбилакта в составе комплексной терапии больных с ДЭ и ДПН обусловлена метаболическим действием препарата. В частности, в ходе исследования выявлена способность реосорбилакта устранять метаболический ацидоз - наблюдалось достоверное уменьшение выраженности ацидоза крови за счет значимого восстановления ВЕ без выраженных изменений рН крови.
Показано, что присутствие сорбитола в седалищном нерве и спинном мозге [5] снижает расход витаминов в нервной системе и способствует более экономичному их использованию. Сорбитол не только снижает внутричерепное давление, но и улучшает кровообращение в головном мозге [19]. Это позволяет рекомендовать его применение при отеке мозга, субдуральной гематоме, инсульте [4, 7].
Анализ эффективности терапии больных ДПН показал, что использование реосорбилакта позволило уменьшить выраженность боли, улучшить невральную проводимость и нервно-мышечную передачу. Данное обстоятельство подчеркивает целесообразность системной терапии при ДПН. Лечение с применением реосорбилакта существенно улучшило показатели физического, психологического состояния и качества жизни больных. Таким образом, реосорбилакт обладает рядом терапевтических свойств, определяющих целесообразность его применения при различных неврологических заболеваниях.
ФГБОУ ВО «Оренбургский государственный медицинский университет» Минздрава России, 460000, Оренбург, Россия
ГБОУ ВПО «Оренбургская государственная медицинская академия», Оренбург, Россия
Алгоритмы коррекции водно-электролитных нарушений у пациентов с тяжелым ишемическим инсультом
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2017;117(3‑2): 31‑34
Цель исследования. Разработать алгоритм коррекции уровня натрия и осмолярности плазмы крови в острейшем периоде тяжелого ишемического инсульта (ИИ). Материал и методы. Обследованы 150 пациентов в возрасте от 30 до 80 лет с тяжелым кардиоэмболическим и атеротромботическим ИИ, госпитализированные в первые 12 ч от появления симптомов. Выраженность неврологического дефицита оценивали по шкале NIHSS. У всех больных мониторировали уровень натрия в плазме крови, осмолярность плазмы крови на 1-е, 3-и и 5-е сутки от начала заболевания, волемичность и объем циркулирующей крови. У пациентов с гиперосмолярным гипернатриемическим синдромом определяли уровень антидиуретического гормона (АДГ). Результаты и обсуждение. Гипонатриемия не является самостоятельным предиктором исходов ИИ, но требует диагностического поиска причины развития данного состояния с последующей коррекцией уровня натрия. Для гипернатриемии терапевтическая тактика различна в зависимости от сроков от начала ИИ. В 1-е сутки от начала ИИ допустима относительно консервативная тактика по коррекции гипернатриемии до уровня натрия плазмы крови 150 ммоль/л, начиная с 3-х суток — 155 ммоль/л; при превышении указанных значений требуется максимально быстрая коррекция гипернатриемии.
Несмотря на то что решению проблем ишемического инсульта (ИИ) уделяется пристальное внимание, инфаркт мозга остается одной из ведущих причин смертности и инвалидизации в Российской Федерации [1, 2]. Актуальность проблемы требует более глубокого изучения ведущих причин танатогенеза заболевания. Известно, что наибольшее число неблагоприятных исходов ИИ приходится на 5—7-е сутки — острейший период заболевания. В этот период большинство патологических процессов, происходящих в организме, обусловлено тяжелым повреждением головного мозга и, как следствие, утратой его регулирующих функций на все системы органов. В современной литературе широко представлено описание водно-электролитных нарушений, возникающих при поражении головного мозга [3—5]. Исследования преимущественно посвящены черепно-мозговой травме и внутричерепным кровоизлияниям [3, 5]. Имеются протоколы коррекции нарушений водно-электролитного гомеостаза при данных типах патологии [5]. Проблема водно-электролитных нарушений при ИИ остается недостаточно изученной.
Цель исследования — разработать алгоритм коррекции уровня натрия и осмолярности плазмы крови в острейшем периоде тяжелого ИИ.
Материал и методы
Обследовали 150 пациентов в возрасте от 30 до 80 лет с тяжелым кардиоэмболическим и атеротромботическим ИИ, госпитализированных в отделение для лечения больных с ОНМК в первые 12 ч от появления симптомов. Выраженность неврологического дефицита оценивали по шкале NIHSS, патогенетические подтипы ИИ определяли с учетом критериев TOAST. Диагноз И.И. устанавливали на основании клинической картины и подтверждали данными КТ головного мозга. Больным проводилась максимально унифицированная терапия, согласно стандарту Минздрава России, а также рекомендациям Европейской организации инсульта (ESO, 2008).
У всех больных мониторировался уровень натрия в плазме крови на 1-е, 3-и и 5-е сутки от начала заболевания. За нормальные значения принят интервал 235—245 ммоль/л. Также контролировалась осмолярность плазмы крови на 1-е, 3-и и 5-е сутки от начала заболевания (норма 275—295 мосмоль/л). У пациентов с гиперосмолярным гипернатриемическим синдромом определяли уровень антидиуретического гормона (АДГ), у всех больных — волемичность и объем циркулирующей крови (гематокритный метод, инвазивный мониторинг, плетизмография).
Была изучена вероятность наступления летального исхода в зависимости от уровня натрия и осмолярности плазмы крови в 1-е, 3-и и 5-е сутки заболевания методом нелинейной регрессии.
Различия между моделями рассчитывали для фиксированных отрезков исходного показателя. Применяли критерий Фишера и критерий Стьюдента. Различия признавали достоверными при р
Результаты и обсуждение
Среди обследованных пациентов 60 (40%) перенесли кардиоэмболический и 90 (60%) — атеротромботический И.И. Наблюдались следующие типы нарушений водно-электролитного гомеостаза: синдром неадекватной секреции антидиуретического гормона (СНСАДГ), центральный сольтеряющий синдром (ЦСС), синдром несахарного диабета (НСД). СНСАДГ выявили у 10 больных (6,7%): у 2 пациентов с кардиоэмболическим и у 8 (5,2%) — с атеротромботическим ИИ. ЦСС имел место у 2 больных: у одного с кардиоэмболическим и у другого с атеротромботическим ИИ. НСД выявлен у 6 (4,0%) пациентов. Всего гиперосмолярный гипернатриемический синдром обнаружили у 30 больных, при этом у 10 (6,7%) он носил гиповолемический характер, а у 20 (13,3%) имела место нормо- или гиперволемия. Во всех случаях развитие гиперосмолярного гипернатриемического синдрома было связано с дефицитом АДГ.
Результаты исследования показали, что инфаркт в бассейне кровоснабжения левой средней мозговой артерии (СМА) развился у 85 (56,7%) больных, в бассейне правой СМА — у 54 (36,8%) и в вертебрально-базилярной системе — у 11 (7,33±7,52%) больных. В 1-е сутки наиболее выраженный неврологический дефицит отмечался у пациентов с ИИ в бассейне левой СМА — 16,9 балла по шкале NIHSS. У пациентов с ИИ в вертебрально-базилярной системе и в бассейне правой СМА выраженность очаговой неврологической симптоматики в 1-е сутки была сопоставима (14,3±3,2 и 14,6±2,1 балла по шкале NIHSS соответственно). На 3-и сутки наиболее выраженный неврологический дефицит наблюдали у пациентов с вертебрально-базилярной локализацией ИИ (18,3±2,3 балла по шкале NIHSS). Наименее выраженную очаговую неврологическую симптоматику выявили у пациентов с инфарктом в бассейне левой СМА (16,5±1,9 балла по шкале NIHSS). Промежуточное место занимали пациенты с ИИ в бассейне правой СМА (16,7±3,2 балла по шкале NIHSS). На 5-е сутки ИИ сохранялась аналогичная картина: наиболее выраженный неврологический дефицит был у пациентов с вертебрально-базилярной локализацией ИИ (19,6±3,8 балла по шкале NIHSS), чуть менее выраженный — у пациентов с ИИ в бассейне кровоснабжения правой СМА (19,6±4,1 балла по шкале NIHSS), минимальный — у пациентов с левополушарной локализацией ИИ (17,6±3,9 балла по NIHSS).
Уровень летальности среди пациентов с гиповолемическими синдромами был значительно выше (70,3%), чем среди пациентов с нормо- и гиперволемическими синдромами (29,3%; р<0,05). При высокой концентрации натрия в плазме крови уровень летальности не зависел от патогенетического подтипа ИИ.
Были построены модели зависимости вероятной летальности от концентрации натрия в плазме крови, а также от уровня осмолярности плазмы крови для ИИ в 1-е, 3-и и 5-е сутки заболевания. Для построения моделей использовали модификации уравнения Бертоланфи.
На основании полученных данных разработали практический алгоритм коррекции уровня натрия плазмы крови в острейшем периоде тяжелого И.И. Установили, что незначительная гипонатриемия (до 130 ммоль/л) не является самостоятельным предиктором неблагоприятного исхода тяжелого И.И. Уровень вероятной летальности являлся минимальным в данной группе пациентов. Наличие у пациента гипонатриемии требует диагностического поиска причин данного состояния. Необходимо исключить экстрацеребральные причины снижения уровня натрия плазмы крови (опухоли легких, лекарственно-индуцированное состояние и др.), а также развитие ЦСС или СНСАДГ. Лечебная тактика в случае возникновения данных состояний различна, поскольку наличие ЦСС предполагает проведение регидратации физиологическим или гипертоническим раствором натрия хлорида, а СНСАДГ — ограничение поступления в организм жидкости, возможно использование гипертонического раствора с салуретиками.
Коррекция гипернатриемии зависит от сроков от начала заболевания. Во всех случаях гипернатриемии требуется жесткий почасовой контроль диуреза, объема и качества инфузионной терапии, температуры тела и дыхательных расстройств у пациента. Наличие у пациента полиурии, не являющейся следствием использования диуретиков, предполагает использование заместительной терапии синтетическими аналогами АДГ. Концентрация натрия в плазме крови более 150 ммоль/л и осмолярность 300 мосмоль/л являются противопоказанием для назначения осмотических диуретиков и гипертонического раствора натрия хлорида.
В 1-е сутки ИИ не требуется проведения агрессивной коррекции уровня натрия в плазме крови, если его концентрация не превышает 150 ммоль/л. В данной ситуации необходимо осуществить тщательный анализ клинической ситуации и проводимой терапии. Следует исключить ятрогенный генез гипернатриемического состояния, связанного с бесконтрольным использованием препаратов, обладающих диуретическим эффектом (наиболее часто — осмотические диуретики). У таких пациентов требуется тщательный контроль водного баланса, и при выявлении гиповолемии — ее быстрое устранение. Оптимальным способом регидратации является пероральное восполнение объема циркулирующей крови, при нарушении глотания и/или снижении уровня бодрствования его осуществляют через назогастральный (назоинтестинальный) зонд. Начиная с 3 сут ИИ подобная тактика обоснована при концентрации натрия в плазме крови не более 155 ммоль/л.
При превышении в 1-е сутки значений уровня натрия в плазме крови 150 ммоль/л, а с 3 сут — 156 ммоль/л, требуется агрессивная коррекция состояния. В этом случае после оценки волемии проводится быстрая регидратация всеми возможными способами, вплоть до использования гипотонического раствора натрия хлорида. В данной ситуации нарушения водно-электролитного баланса обусловлены дезорганизацией функции стволовых структур головного мозга, а гипернатриемия в свою очередь является самостоятельным повреждающим фактором нервной ткани, что еще более усугубляет тяжесть состояния пациента. Именно поэтому требуется тщательный мониторинг параметров водно-электролитного обмена, целью которого является предупреждение развития подобного состояния. Следует помнить, что темпы коррекции концентрации натрия в плазме крови не должны превышать 1 ммоль/ч.
Увеличение уровня натрия в плазме крови может носить компенсаторный характер и, возможно, является одним из механизмов саногенеза отека головного мозга. Как любой из патофизиологических процессов, данный феномен может проходить через стадии компенсации и декомпенсации, причем переход из одной стадии в другую может произойти при изменении концентрации натрия в плазме крови на 1 ммоль/л. В 1-е сутки ИИ происходит угнетение синтеза АДГ вследствие прямого ишемического повреждения гипоталамо-гипофизарной системы. В ответ на это компенсаторно увеличивается синтез натрийуретических факторов, что ведет к некоторой стабилизации системы. При неблагоприятном течении заболевания к 3-м суткам начинается клинически значимый отек ткани головного мозга, следствием которого является дальнейшая дисфункция гипоталамо-гипофизарной системы. Дефицит АДГ в этом случае становится критическим, а аутокомпенсация — невозможной. С этим связана схожесть моделей зависимости вероятной летальности от концентрации натрия в плазме крови для 3—5-х суток ИИ.
Таким образом, наличие у пациента гипернатриемии подразумевает строгий контроль уровня электролитов плазмы крови, водного баланса, проводимой инфузионной терапии, а также готовности к максимально быстрому изменению лечебной тактики. Гипернатриемия при тяжелом ИИ, в отличие от гипонатриемии, является самостоятельным предиктором исхода заболевания и требует диагностического поиска причины развития данного состояния с последующей коррекцией уровня натрия. Терапевтическая тактика коррекции гипернатриемии различна в зависимости от количества времени, прошедшего с момента развития ИИ. В 1-е сутки допустима консервативная тактика коррекции гипернатриемии до его концентрации в плазме не более 150 ммоль/л, начиная с 3 сут это значение составляет 155 ммоль/л; при превышении концентрации натрия в плазме крови в 1-е сутки 150 ммоль/л, а на 3-и сутки — 156 ммоль/л, требуется максимально быстрая коррекция гипернатриемии.
Водно-электролитные нарушения
Олигурия и полиурия, гипернатриемия и гипонатриемия - эти нарушения фиксируют у более чем 30% больных при тяжелых церебральных поражениях. Они имеют разное происхождение.
Значительная часть этих нарушений связана с обычными причинами водно-электролитных нарушений (ВЭН) - неадекватным приемом жидкости человеком, сверхмерной или недостаточной инфузионной терапией, использованием мочегонных препаратов, составом применяемых средств для энтерального и парентерального питания и проч.
Врачи должны попытаться устранить возникшие нарушения, проведя коррекцию инфузионной терапии, медикаментозных назначений, режима питания у больного. Если предпринятые действия не принесли ожидаемого результата, и нарушения водно-электролитного баланса всё так же отмечаются, медики могут предположить, что в их основе лежат центральные нейрогенные нарушения.
Водно-электролитные нарушения, как проявление дисфункции ЦНС, могут встречаться при поражениях мозга различной этиологии: травма, инсульт, гипоксическое и токсическое поражение мозга, воспалительные заболевания центральной нервной системы и т.д. В этой статье мы остановимся на трех, самых значимых для клинической практики и исходов, нарушениях: центральном несахарном диабете (CDI), синдроме повышенной секреции антидиуретического гормона (SIADH), синдроме церебральной потери соли (CSWS).
Центральный несахарный диабет
Центральный несахарный диабет (CDI, cranial diabetes insipidus) - это синдром, который возникает как следствие снижения уровня антидиуретического гормона (АДГ) в плазме. Появление этого синдрома связано с неблагоприятным общим исходом и смертью мозга. Его возникновение говорит о том, что в патологический процесс вовлечены глубокие структуры мозга - гипоталамус, ножки гипофиза или нейрогипофиз.
Что касается симптомов, проявляется полиурия более 200 мл/час, и гипернатриемия более 145 ммоль/л, признаки гиповолемии. Моча имеет низкий удельный вес (<1010), низкую осмолярность (< 200 мосм/л) и низкое содержание натрия (< 50 ммоль/л).
Лечение несахарного диабета
Необходимы контроль почасового диуреза и возмещение потерь жидкости 0,45% раствором натрия хлорида, 5% глюкозы, введение воды энтерально. Вводят десмопрессин (Минирин):
- интраназально по 2-4 капли (10-20 мкг) 2 раза в сутки;
- внутрь по 100-200 мкг 2 раза в сутки;
- внутривенно медленно (15-30 мин), после разведения в физиологическом растворе, в дозе 0,3 мкг/кг 2 раза в сутки.
При отсутствии десмопрессина или его недостаточном эффекте, врачи назначают гипотиазид. Он парадоксальным образом снижает диурез (механизм действия неясен). Принимают по 25-50 мг 3 раза в сутки. Карбамазепин снижает диурез и уменьшает чувство жажды у больного. Средняя доза карбамазепина для взрослых составляет 200 мг 2-3 раза в сутки. Также нужно проводить мониторинг и коррекцию электролитов плазмы.
Синдром повышенной секреции антидиуретического гормона
Синдром повышенной секреции антидиуретического гормона (SIADH-syndrome of inappropriate secretion of antidiuretic hormone). В основе этого заболевания лежит избыточная секреция антидиуретического гормона (АДГ).
При этом состоянии почки способны выводить значительно меньше воды. Осмолярность мочи, как правило, превышает осмолярность плазмы. Степень выраженности этих проявлений может быть различной. При отсутствии ограничений в приеме жидкости, в ряде случаев, гипонатриемия и гипергидратация могут быстро прогрессировать. Результатом может стать усиление отека мозга, углубление неврологической симптоматики. При выраженной гипонатриемии (110-120 ммоль/л) у больного может развиться судорожный синдром.
Лечение
Блокаторы V2-вазопрессиновых рецепторов кониваптан, толваптан эффективно устраняют задержку жидкости и приводят к быстрому восстановлению уровня натрия в крови. Кониваптан: нагрузочная доза 20 мг на протяжении 30 мин, после этого непрерывное вливание со скоростью 20 мг/сутки курсом 4 дня. Толваптан дают больному внутрь 1 раз в день в утренние часы по 15-30 мг. Пациенты, получающие эти препараты должны прекратить любое предыдущее ограничение жидкости. При необходимости, лечение ваптанами может проводиться неограниченно долго.
Стоит отметить, что стоимость этих лекарств высокая, что делает их малодоступными для широкого применения. Если ваптаны недоступны, проводят «традиционное» лечение:
- Ограничивают прием жидкости до 800-1200 мл/сутки. Отрицательный баланс жидкости приведет к увеличению концентрации натрия в крови;
- Петлевые диуретики назначают в случае небольшой задержки жидкости. Фуросемидиногда назначают перорально 80-120 мг или в/в в дозе 40-60 мг;
- При выраженной гипонатриемии, ухудшении неврологического статуса, судорогах, показано в/в введение (за 20-30 минут) 1-2 мл/кг 3% (или 0,5-1 мл/кг 7,5%) р-ра натрия хлорида;
- Если состояние пациента достаточно стабильное, проводится постепенная коррекция гипонатриемии в течение 2-3 суток путем инфузии 3% натрия хлорида со скоростью 0,25-0,5 мл/кг/час.
Нужно часто контролировать уровень натрия в крови, чтобы не появились неврологические осложнения. Быстрая коррекция гипонатриемии может привести к развитию очаговой демиелинизации мозга. При проведении лечения нужно следить, чтобы суточный прирост уровня натрия в крови не превышал 10-12 ммоль.
При использовании гипертонических растворов натрия хлорида, в результате перераспределения жидкости в сосудистое русло, существует вероятность развития отека легких. Внутривенное введение фуросемида 1 мг/кг сразу после начала инфузии натрия хлорида служит профилактикой этого осложнения. Эффект от введения гипертонического раствора натрия хлорида сохраняется не слишком долго, инфузию приходится периодически повторять. Введение менее концентрированных растворов натрия хлорида не позволяет надежно устранить гипонатриемию и усиливает задержку жидкости.
Синдром церебральной потери соли
Синдром церебральной потери соли (CSWS, cerebral salt wasting syndrome). Патофизиология этого синдрома связана с нарушением секреции предсердного натрийуретического пептида и церебрального натрийуретического фактора.
У человека проявляется высокий диурез и признаки дефицита ОЦК. Также типичен высокий удельный вес мочи, повышение уровня натрия в моче больше 50-80 ммоль/л, гипонатриемия, и повышенный или нормальный уровень мочевой кислоты в сыворотке крови. Этот синдром часто встречается у пациентов с субарахноидальным кровоизлиянием. Развивается на протяжении первой недели после церебрального повреждения. Длится до 4 недель (в среднем - 2 недели). Выраженность может быть от минимальной до очень сильной.
Лечение заключается в адекватном восполнении потерь воды и натрия. Ограничение в введении жидкости не применяют. Для восполнения потерь в большинстве случаев используют 0,9% раствор натрия хлорида. Иногда требуются очень большие объемы инфузии, достигающие 30 и более литров в сутки. Если гипонатриемия не устраняется введением 0,9% натрия хлорида, что свидетельствует о большом дефиците натрия, медики используют инфузию 1,5% раствора натрия хлорида.
Сократить объем инфузионной терапии и ускорить стабилизацию ОЦК, позволяет назначение минералокортикоидов - больному дают флудрокортизон (Кортинефф), по 0.1-0.2 мг внутрь 2 раза в сутки. Гидрокортизон эффективен в дозах 800-1200 мг/сут. Большие объемы инфузии, применение минералокортикоидных препаратов, полиурия могут привести к гипокалиемии, которая также требует своевременной коррекции.
Ноотропы в интенсивной терапии: проблемы и решения
Проф. С.А. Румянцева
Кафедра неврологии ФУВ РГМУ, Москва
1. Основными проблемами современного мира являются высокий уровень общей смертности, рост смертности от предотвратимых причин и рост инвалидизации. Основной вклад в рост инвалидизации вносят пациенты с неврологической патологией и неадекватно используемыми методами лечения. Высокий уровень инвалидизации наблюдается при церебральных поражениях любой этиологии: при экзотоксикозах, эндотоксикозах, ведущую роль среди которых играет алкоголизм, а также при соматических заболеваниях. Многие соматические заболевания приводят к вторичным морфо-функциональным изменениям вещества головного мозга. У 43% больных с тяжелой соматической патологией, находившихся в отделении, возникают тяжелые неврологические осложнения.
2. Основной медико-социальной проблемой неврологии, ведущей к росту летальности и инвалидизации является инсульт. Инсульт является острой церебро-васкулярной патологией и именно скорость развития патологического процесса определяет тяжесть морфо-функциональных изменений головного мозга и прогноз заболевания. Основными факторами повреждения мозга при инсульте являются ишемия, гипоксия и провоцируемый ими оксидантный стресс, который приводит медиаторному дисбалансу.
Функционирование нейронов обеспечивается высоким потреблением энергии. Изменения объема крови и уровня энергосубстратов являются главными факторами повреждения энергозависимых структур мозга.
Факторы повреждения мозга при инсульте
3. При церебро-васкулярной патологии крайне важен темп развития симптомов. При остром процессе (инсульте и любых критических состояниях) возникновение очаговых нарушений прямо зависит от степени морфологического поражения и уровня дисбаланса субстратов.
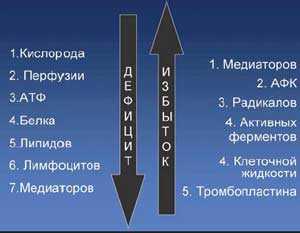
4. Эрготропные и трофотропные нейромедиаторные системы мозга существуют в состояние абсолютного динамического равновесия, что обеспечивает адекватное функционирование головного мозга. Любая патологическая ситуация, в том числе острая церебро-васкулярная недостаточность, приводит к формированию дисбаланса с избытком эрготропных нейромедиаторов и дефицитом трофотропных, в первую очередь ГАМК-эргических систем. Энергетический дефицит инициирует развитие глутаматной эксайтотоксичности..
Системы нейромедиаторов
5. Постинсультная инвалидизация составляет от 70 до 80%. Высокая неврологическая инвалидизация является результатом тяжести поражений мозга и не всегда адекватной терапии, проводимой без учета факторов патогенеза. Иногда выбор средств терапии медиаторного дисбаланса проводится вслепую.
Постинсультная инвалидизация
Гемипарезы 48%
Гемиплегия 14%
Афазия 22% Деменция 30%
Нарушения координации 12%
6. В ряде случаев активно проводимая терапия приводит к ухудшению состояния больных. На рисунке представлены результаты МРТ пациентки на 1 и 4 сут после возникновения ишемического инсульта. На фоне агрессивной антигипертензивной терапии с достижением целевого уровня АД, активной дегидратации и применения стимуляторов нейрометаболизма определяется выраженное ухудшение клиники и морфологической картины заболевания.
Динамика тяжелого инсульта при применении стимуляторов нейрометаболизма, активной дегидратации, бесконтрольном снижении АД
7. Можно ли проводить эффективную нейропротективную терапию в острой стадии инсульта? Нейропротекция - своевременное воздействие на системном и церебральном уровнях на факторы патогенеза, нарушающие нейрональный гомеостаз. Терапевтическая стратегия эффективной нейропротекции заключается в последовательной коррекции субстратной перфузии, энергетического гомеостаза и водного баланса. После решения указанных задач становится возможным проведение терапии, коррегирующей баланс медиаторов.
Воздействие на гемодинамику пациента должно осуществляется таким образом, чтобы на острой стадии инсульта стабильные уровни систолического и диастолического АД обеспечивали адекватную церебральную перфузию: САД составляло не ниже 170 мм рт.ст., ДАД - не ниже 90 мм рт.ст., церебральное перфузионное давление - не менее 80 мм рт.ст.
В основе коррекции отека головного мозга при любых церебральных катастрофах лежит обеспечение баланса вне- и внутриклеточных жидкостей. Для этого необходимо поддержание высокого уровня сатурации (Sat PO2) не ниже 94%, сохранение стабильного уровня суточной инфузии, адекватное соотношение коллоидных и кристаллоидных растворов. Средством последней линии является применение осмотических диуретиков (маннитол), которые эффективно влияют на внутричерепную гипертензию.
Поддержание энергообмена обеспечивается поддержанием высокого уровня сатурации и применением препаратов, которые повышают резистентность мозга к гипоксии и купируют оксидантный стресс.
8. Применение заместительной нейротрансмиттерной терапии необходимо начинать при условии стабилизации жизнеобеспечивающих функций организма. Основным направлением медиаторной нейропротекции является коррекция дисбаланса возбуждающих и тормозных нейротрансмиттерных систем.
Адекватную нейромедиаторную терапию получают не более 10% больных.
9. Некоторые нейропротекторы обладают трофическими и модуляторными свойствами, оказывают регенераторно-репаративное действие. Они улучшают пластичность здоровой ткани, окружающей инфаркт, активизируют образование полисинаптических связей, увеличивают плотность рецепторов, способствуют восстановлению нарушенных функций.
К 1972 г. было опубликовано 700 статей и сформирована концепция о новой категории лекарств - ноотропов - препаратов, действие которых направлено на сохранение интеллектуальной сферы человека.
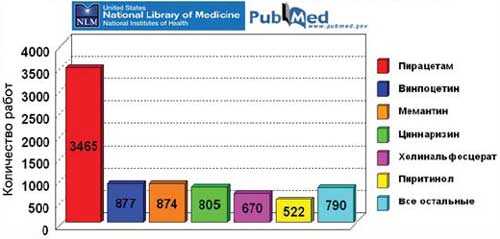
Ноотропы и доказательная медицина
Представленность исследований препаратов, обладающих ноотропным действием, в международных базах данных (по МНН)
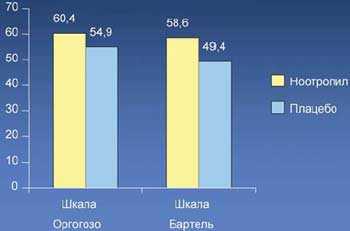
10. Изучение эффективности Ноотропила® в восстановительном периоде инсульта проводилось в европейском мультицентровом исследование PASS I (Piracetam Acute Stroke Study I). В исследовании приняли участие 927 больных с острым ишемическим инсультом, которым назначалось плацебо или пирацетам 12 г/сут внутривенно ежедневно в течение 4 нед, затем 4,8 г/сут ежедневно в течение 8 нед. Терапия проводилась в первые 7 и 12 ч после инсульта (n=452). Оценивались степень неврологического дефицита (шкала Оргогозо) через 4 нед и показатели повседневной активности (шкала Бартель) через 12 нед.
Достоверно лучшие результаты были получены в группе больных с тяжелым и среднетяжелым инсультом, получавших пирацетам в первые 7 ч после инсульта. Данные свидетельствовали о достоверном уменьшение неврологического дефицита (по шкале Оргогозо), повышении показателей повседневной бытовой активности (по шкале Бартель), а также уменьшении средней длительности госпитализации (21,8 против 30,3 дней) и стоимости лечения.
Объем нейропротективной терапии прямо зависит от степени утраты нейрональных функций. Следствием этого является необходимость использования в остром периоде высоких доз Ноотропила.
Европейское мультицентровое исследование PASS I4
11. Разнообразие форм выпуска позволяет использовать гибкие схемы приема. Наличие больших дозировок сокращает кратность приема до 1-2 раз в день. Наличие жидких форм удобно в применении у детей и у пациентов с нарушением глотания. Инъекционные формы препарата повышают эффективность использования в условиях стационара.
12. Параметры клинической активности Ноотропила® включают ноотропное, мнемотропное действие, а также влияние на состояние угнетенного сознания путем повышения уровня бодрствования и ясности сознания.
Ноотропное действие заключается во влиянии на нарушенные высшие корковые функции, повышении уровня суждений и критических возможностей, улучшении кортикального контроля субкортикальной активности, мышления, внимания, речи.
Присущий Ноотропилу мнемотропное действие отражается в улучшении процессов обучения и запоминания.
Читайте также:
- Физиология сердечно-сосудистой системы. Сосудистое дерево
- Сигнальный транспорт и неизбирательный поток белков
- Примеры опухоли трахеи и бронхов на рентгене, КТ, ПЭТ
- Связь токсичности нефтяных продуктов с их физико-химическими свойствами
- Общее строение клетки: ядро, цитоплазматическая мембрана, цитоплазма
