Интерлейкины при вирусных инфекциях легких.
Добавил пользователь Владимир З. Обновлено: 01.02.2026
Главным фактором риска развития астмы в детстве рассматривается генетическая предрасположенность к аллергии, совместно с ранним воздействием аэроаллергенов и сенсибилизацией к ним дыхательных путей. В то время как экспозиция аллергенов может действительно вызывать обострение, большинство острых атак астмы у детей, особенно раннего возраста, сочетается с респираторной вирусной инфекцией. Взаимоотношения между респираторной вирусной инфекцией и обострениями астмы являются крайне интересными и важными, так как нередко возникают сложности в диагностике астмы у детей раннего возраста и трактовке роли ОРВИ в развитии астмы и ее обострений
Иммунологические исследования показали, что в дыхательных путях существует две субпопуляции лимфоцитов-хелперов Th1 и Th2. Th1 подтип секретирует определенные цитокины, включая интерферон-гамма и интерлейкин-10, которые важны в защите от бактериальной и вирусной инфекций. Th2 подтип рассматривается как "проатопический", так как секретирует такие цитокины, как ИЛ-4 и ИЛ-5, которые способствуют пролиферации тучных клеток, продукции IgE, дифференциации, привлечению и выживанию эозинофилов. Продукция цитокинов этими двумя субтипами лимфоцитов взаимно контролируется: интерферон-гамма и ИЛ-10 ингибируют дифференцировку Th2, а ИЛ-4 - дифференцировку Th1. Снижение частоты ОРВИ в детстве таким образом гипотетически может способствовать Th2-ответу к аэроаллергенам.
Вирусы, провоцирующие обструкцию, у детей зависят от возраста. Так у детей до двух лет провоцируют обструкцию (при этом астмы может не быть) главным образом респираторно-синцитиальный вирус и вирус парагриппа.
У детей первого года жизни, не страдающих астмой, обструкцию в раннем возрасте в результате вирусной инфекции связывают с действием воспаления на мелкие дыхательные пути, имеющие анатомические особенности. У них выявляется более низкая максимальная скорость выдоха, даже когда они здоровы, по сравнению с детьми, у которых никогда не было обструкции, и это различие сохраняется в дальнейшей жизни, хотя бронхиальной гиперреактивности не наблюдается.
Когда дети становятся старше и у них есть астма, профиль вирусов существенно изменяется, доминируя риновирусная инфекция. С внедрением высокочувствительных и высокоспецифичных методов полимеразной цепной реакции для определения вирусов, показано, что более 80% обострений астмы у детей сочетается с ОРВИ, и риновирус находят более чем в 60% среди определяемых вирусов. Обструкцию у детей с астмой может также вызывать грипп и парагрипп, но в меньшей степени. Кроме того, наблюдается сезонность ОРВИ, вызывающих обструкцию. У детей с астмой нередки обострения в сентябре, после летних каникул, и ранней весной, а также в ноябре и в начале зимы, когда развивается эпидемия гриппа.
Эпидемиологические исследования детей, страдающих инфекцией нижних дыхательных путей с обструктивным синдромом, в первые 2 года жизни показали, что обструктивный синдром у детей раннего возраста не увеличивает риск развития астмы в последующие годы. Даже у большинства детей из семей с атопическим анамнезом не отмечается обструкции после 3 лет. Однако у детей и взрослых, у которых уже есть астма, наиболее частой причиной обострении являются вирусные респираторные инфекции. Многочисленные изменения в дыхательных путях во время ОРВИ могут усиливать существующее воспаление в дыхательных путях и гиперреактивность. Обследование пациентов, попадающих в отделения неотложной терапии с обострением астмы на фоне ОРВИ, показывает, что мокрота у них содержит высокую пропорцию полиморфонуклеарных лейкоцитов и высокую концентрацию нейтрофильной эластазы, альбумина, муцина, триптазы тучных клеток и ИЛ-8 и ИЛ-6. Увеличение полиморфонуклеарных лейкоцитов особенно выражено у тех больных, у которых симптомы респираторной вирусной инфекции предшествуют обострению астмы. Все это позволило установить, что механизм обострения вовлекает нормальный воспалительный ответ к вирусной инфекции.
На практике не всегда возможно определить, какой именно вирус вызвал обострение астмы и соответственно изучить его влияние на течение болезни. В экспериментальных исследованиях показано, что вирусы (особенно интенсивно риновирус) усиливают бронхиальную реактивность, ключевой признак астмы. Бронхиальная гиперреактивность после риновирусной инфекции может быть длительностью до 15 дней; риновирусная инфекция увеличивает риск развития поздних аллергических реакций и выраженность таких компонентов, как увеличение секреции тучных клеток, увеличение притока эозинофилов в бронхиальную слизистую, снижается чувствительность бета-адренергических рецепторов. Вирусы могут усиливать холинергическую активность, увеличивая ответ дыхательных путей на вагальную стимуляцию, неспецифические триггеры.
На сегодняшний день существует точка зрения, что дети, у которых риновирус вызывает обструкцию, имеют астму, и вирус вызывает проявление болезни, ухудшает ее течение. В диагностике астмы в этой группе детей помогают следующие критерии: повторение обструкции в течение года более трех раз, затяжной характер обструкции, хороший ответ на бронхолитическую терапию, нередко отягощенная по аллергическим заболеваниям наследственность, ранние аллергические проявления у ребенка.
Биопсия назальной слизистой во время ОРВИ показывает небольшие признаки повреждения эпителия или воспаления, даже когда воспалительные клетки в изобилии присутствуют в назальном секрете, однако в эксперименте показано нарушение функции циллиарных клеток. Так как эпителий существенно не нарушен, внимание переносится на роль воспалительных медиаторов, вызывающих клинические и физиологические последствия вирусной респираторной инфекции в нижних дыхательных путях. Возможную роль играют межклеточные адгезивные молекулы (IСАМ 1), которые находятся на поверхности назальных эпителиальных клеток и являются рецептором для основной группы риновирусов и цитокина ИЛ-11, который активирует В-клетки через Т-клеточнозависимый механизм.
Другой медиатор, который продуцируется эпителием, вовлекается в развитие астмы - оксид азота (NO). Оксид азота может оказывать антивирусный эффект и является частью ответа на вирусные инфекции верхних дыхательных путей. Он также является медиатором, усиливающим бронхиальный кровоток, эозинофильную инфильтрацию, повреждение дыхательного эпителия, и может ингибировать пролиферацию Th1 Т-клеток, сдвигая профиль Т-клеточных цитокинов в сторону Тh2 фенотипа. Кинины, представляющие пептидные гормоны, образующиеся в тканях и жидкостях, вовлекаются в патогенез астмы в связи с бронхоконстрикторным и провоспалительным действием. При экспериментальной риновирусной инфекции существенно повышается уровень кининов, а также общий уровень IgE в сыворотке. Повышение уровня вирус- и аллергенспецифических IgE может отражать нарушение регуляции продукции IgE.
Понимание механизмов, по которым респираторная вирусная инфекция ведет к воспалению, предполагает возможные направления терапевтических воздействий. Так как аллергическое воспаление изменяет иммунный ответ к вирусной инфекции, превентивная антивоспалительная терапия может способствовать восстановлению обычного механизма защиты против инфекций. Уменьшение интенсивности аллергического воспаления в дыхательных путях будет уменьшать также вероятность тяжелых атак астмы, связанных с инфекцией вирусами. Кроме того, интенсивность реакций на вирусы связана с интенсивностью существующей обструкции дыхательных путей у детей с астмой, т.е. при более тяжелой астме, когда наиболее выражена секреция провоспалительных цитокинов, ответ на вирусную инфекцию будет более выраженным. Важным фактором является количество эозинофилов в дыхательных путях.
Таким образом, основной путь - это уменьшение процессов воспаления в дыхательных путях. В соответствии с российской Национальной программой "Бронхиальная астма у детей. Стратегия лечения и профилактика" у детей с легкой и среднетяжелой астмой базисными противовоспалительными препаратами являются кромогликат натрия (интал) и недокромил натрия (тайлед). Длительное, не менее двух месяцев, применение этих препаратов приводит к уменьшению числа эозинофилов как в слизистой дыхательных путей, так и в сыворотке крови, уменьшению секреции цитокинов, снижению бронхиальной гиперреактивности. Соответственно уменьшаются клинические проявления бронхиальной астмы, потребность в бронхолитиках, уменьшается частота возникновения обструктивного синдрома в период присоединения респираторных вирусных инфекций.
Ингибиция продукции цитокинов может быть достигнута такими препаратами, как кортикостероиды. Ингаляционные кортикостероиды (беклометазон, флюнизолид, будесонца, флютиказон пропионат) являются препаратами первого выбора для базисной терапии астмы тяжелого течения, а также используются у детей при неэффективности нестероидных противовоспалительных препаратов. Использование ингаляционных кортикостероидов у детей с астмой при первом появлении симптомов простуды уменьшает на 90% частоту госпитализаций по поводу астмы. Использование назальных спреев нестероидных препаратов (ломузол, кромоглин) и кортикостероидных (фликсоназе, беконазе) у детей с сочетанием бронхиальной астмы и аллергического ринита уменьшает аллергическое воспаление со стороны верхних дыхательных путей, снижает ответную реакцию на вирусные инфекции.
Другой путь - это повышение неспецифической резистентности организма детей, который может быть достигнут, как использованием иммуностимулирующей терапии, так и не медикаментозными методами. В многочисленных исследованиях была доказана эффективность иммуностимулятора микробного происхождения рибомунила, объединяющего в себе свойства специфических и неспецифических иммуностимуляторов, что связано с наличием в его составе рибосом наиболее частых возбудителей инфекций дыхательных путей (диплококки пневмонии, стрептококки, клебсиелла пневмонии). Рибомунил стимулирует полинуклеары и макрофаги, способствуют выработке ИЛ-1 и ИЛ-6, увеличивает выработку специфических антител, активность естественных киллеров. Хороший эффект оказывает на заболеваемость ОРВИ у детей с бронхиальной астмой метод интервальной гипоксической тренировки с использованием ингаляций газовой смеси с пониженным содержанием кислорода. Проведение таких повторных курсов с интервалом 3-4 месяца в 2,5-3 раза снижает частоту ОРВИ и соответственно обострения бронхиальной астмы, нормализует вегетативный тонус, стимулирует функцию надпочечников. Как правило, медикаментозные и немедикаментозные методы используются в комплексе, дополняя друг друга. Врач должен провести оценку факторов внешней среды, устранить или уменьшить воздействие домашней пыли, табака, возможных провоцирующих аллергических факторов, провести санацию носоглотки при наличии хронических очагов инфекции, использовать закаливание, дозированные физические нагрузки. Дальнейшее изучение вирусиндуцированных обострений астмы, понимание механизмов, лежащих в их основе, позволит разрабатывать новые пути терапевтических вмешательств.
Интерлейкины 1, 6, 8, 10
Синонимы: Интерлейкины, ИЛ, Interleukin, IL.
Научный редактор: М. Меркушева, ПСПбГМУ им. акад. Павлова, лечебное дело.
Август, 2018г.
Общие сведения
Интерлейкины (цитокины) являются частью иммунной системы организма человека и представляют собой гормоноподобные белки, которые вырабатываются лейкоцитами, фагоцитами и другими тканевыми клетками с целью обеспечения иммунного ответа на проникновение провоцирующего агента (вируса, бактерии, микроба, паразита и пр.).
Всего существует более 20 видов интерлейкинов, отличающихся между собой по своим свойствам и функциям. Каждый из них отвечает за определенную иммунную реакцию организма (аллергия, боль, гипертермия, воспаление и т.д.), контролирует ее течение и интенсивность.
Диагностическое обследование на ИЛ позволяет установить наличие воспалительных, вирусных, бактериальных, инфекционных и паразитарных заболеваний, а также определить иммунный статус организма и скорость иммунного отклика
Интерлейкины образуют сигнальную клеточную структуру, которая передает информацию белым кровяным тельцам (лейкоциты), «оповещая» их о возникшей угрозе. После этого нужный вид лейкоцитов активируется и направляется к патологическому очагу.
Организм производит очень малое количество ИЛ, поэтому ученые научились получать их лабораторным путем. Введение извне высоких доз интерлейкинов стимулирует иммунную систему и способствует повышению ее функциональности практически в 2 раза. Поэтому заместительная терапия ИЛ активно применяется в борьбе с раковыми и аутоиммунными заболеваниями.
Иммунологический тест на интерлейкины позволяет не только определить наличие, стадию и форму заболевания, но также и решить вопрос о целесообразности назначения больному заместительной терапии ИЛ. Кроме того, обследование на ИЛ проводится и с целью оценки эффективности текущего курса лечения.
Виды интерлейкинов и их функции
Наибольшее диагностическое значение имеют 4 вида интерлейкинов: ИЛ-1, ИЛ-6, ИЛ-8 и ИЛ-10.
Интерлейкин-1 - цитокин, отвечающий за реакцию воспаления. Выделяют 2 подтипа:
В организме человека преобладает подтип 1-b.
Через 5 часов после контакта с антигеном начинается его интенсивное производство, которое может продолжаться до 2 суток. В этот период ИЛ-1 выполняет следующие функции:
- иммунологическую (передает сигнал лейкоцитам);
- кроветворную (усиливает выработку красных кровяных телец);
- защитную (обеспечивает реакцию организма на антиген);
- межсистемную (устанавливает связь между внутренними системами организма).
Интерлейкин-1 1 участвует в первичной стадии иммунного ответа:
- Активизирует лимфоциты (Т-хелперы) и способствует трансформации В-лимфоцитов в плазматические клетки, которые, в свою очередь, участвуют в образовании антител.
- Защищает кровяные клетки от воздействия радиоактивных веществ.
- Обеспечивает передачу сигналов между нервной, нейроэндокринной и иммунной системами и участвует в синтезе важнейших гормонов гипоталамуса и гипофиза, подавляет секрецию пролактина, что важно для наступления беременности.
- Регулирует поведенческие реакции человека и его сон.
- Участвует в регуляции температуры тела, его повышенная продукция приводит к развитию лихорадки.
- Вызывает продукцию белков острой фазы воспаления в печени.
Интерлейкин-6 2 является основным медиатором острых воспалительных процессов в тканях.
- Он отвечает за скорость производства и созревания антител, В-лимфоцитов и иммуноглобулинов.
- ИЛ-6 принимает активное участие в работе внутренних органов и систем организма.
- Играет важную роль при механических повреждениях тканей в результате травм, ожогов, ударов, порезов.
- Вызывает обострение хронических заболеваний и переводит острые болезни в хроническую форму.
- Сам ИЛ-6 не защищает клетки от радиации, то усиливает защитную функцию ИЛ-1.
- Регулирует эндокринную систему: подавляет выработку тиреотропного гормона и стимулирует секрецию соматотропного гормона.
Интерлейкин-8 вырабатывается в организме через 4 часа после активации других клеток иммунитета. Причиной для секреции цитокина может послужить отравление организма продуктами жизнедеятельности патогенных микроорганизмов, производство фактора некроза опухоли, а также сигнал от интерлейкина-1. ИЛ-8 также называют фактор, активирующий нейтрофилы (NAF).
ИЛ-8 выполняет следующие функции:
- участвует в регенеративных процессах (заживление ран),
- может катализировать рост и развитие опухолей,
- является маркером на аутоиммунные заболевания (ревматоидный артрит, волчанка)
На заметку: специалисты также отмечают взаимосвязь 3 между ИЛ-8 и вероятностью преждевременных родов. Как правило, у половины обследованных беременных с риском преждевременных родов концентрация интерлейкинов-1, -6 и -8 в околоплодных водах повышена.
Интерлейкин-10 4 обладает противовоспалительным, прямо противоположным действию других цитокинов, эффектом.
- Он подавляет озноб и лихорадку (синдром воспалительной реакции иммунитета).
- Может снижать производство других интерлейкинов.
- Участвует в местной иммунной и антипаразитарной защите и повышает аллергическую реактивность организма.
- Защищает клетки головного мозга от ишемического повреждения.
- В определенной дозе содержится в грудном молоке, что обеспечивает новорожденным защиту от воспаления кишечника.
Важно! Изменения концентрации ИЛ-10 возможно у пациентов с нарушениями работы почек. После пересадки этого органа уровень ИЛ-10 может снижаться, что будет свидетельствовать о возникновении реакции отторжения трансплантата.
Увеличение концентрации ИЛ-10 у онкобольных - неблагоприятный признак, характерный для усиления опухолевого роста. Количество ИЛ-10 повышается после переливания крови.
Показания для анализа
- Оценка иммунного статуса;
- Диагностика тяжелых бактериальных, инфекционных и воспалительных заболеваний.
- Бактериальные инфекции, тяжелые воспалительные состояния;
- ВИЧ, СПИД;
- Комплексное обследование онкобольных;
- Лечение пациентов с высокой сенсибилизацией (аллергическая реакция);
- Острый панкреатит (воспаление поджелудочной железы); ;
- Подозрение на бактериальный сепсис (инфицирование крови) у новорожденных.
- Оценка состояния иммунной системы пациента при острых и хронических инфекциях, злокачественных новообразованиях;
- Диагностика начальной стадии инфаркта миокарда.
- Оценка иммунного статуса организма;
- Определение успешности приживления пересаженного трансплантата (почки);
- Прогнозирование рисков развития инсульта или ишемической болезни сердца (ИБС);
- Подбор тактики и оценки эффективности лечения гепатита С;
- Обследование онкобольных.
Кто дает направление
Дают направление на интерлейкины и проводят расшифровку результатов проводят специалисты:
- иммунолог,
- инфекционист,
- нефролог,
- кардиолог,
- онколог.
Врач может поставить достоверный диагноз только при изучении других показателей крови, в том числе уровней остальных интерлейкинов.
Нормы для интерлейкинов
Референсные значения лаборатории Инвитро
| Вид интерлейкина | Концентрация, пг/мл |
| ИЛ-1 | < 5 |
| ИЛ-6 | < 7 |
| ИЛ-8 | < 62 |
| ИЛ-10 | < 9,1 |
Важно! Интерпретация результатов всегда проводится комплексно. Поставить точный диагноз на основании только одного анализа невозможно.
Повышение значений
- Бактериальные и воспалительные заболевания;
- Туберкулез, саркоидоз;
- Аутоиммунные процессы (ревматоидный артрит);
- Эндокринные заболевания (сахарный диабет 1-го типа);
- Множественные травмы в организме;
- Угроза выкидыша;
- УФ-облучение;
- Отторжение пересаженной почки;
- ВИЧ или СПИД;
- Миелолейкоз (опухолевое поражение костного мозга) в острой или хронической форме;
- Некоторые виды лейкоза.
- Острый воспалительный или инфекционный процесс; или другие аутоиммунные патологии;
- Эссенциальный тромбоцитоз (повышенный уровень тромбоцитов);
- Системные поражения почек или печени; (неинфекционное поражение кожи); ; ;
- Панкреатит в острой форме;
- Болезнь Крона (поражение органов пищеварительного тракта);
- Заболевания органов ЖКТ (язвенные поражения);
- Обширные травмы, например, в результате ДТП;
- Неспецифический язвенный колит (воспаление слизистой толстой кишки); (аллергия на глютен);
- Слизисто-кожный лимфатический синдром (острое поражение артерий);
- Гепатит вирусной этиологии (воспаление печени);
- Миксомы сердца (доброкачественные опухоли предсердия);
- Саркома Капоши (злокачественные новообразования на коже);
- Карцинома почки (злокачественное новообразование);
- Лимфома (опухоль лимфатической системы);
- Первичный билиарный цирроз печени (разрушение внутрипеченочных желчных протоков аутоиммунной природы).
- Тяжелые инфекционные и воспалительные процессы (особенно, происходящие в легких);
- Острая форма инфаркта миокарда; ; ; (воспаление слизистой оболочки кишечника);
- Септический шок (угрожающее жизни состояние, развивающееся вследствие тяжелых инфекционных заболеваний); (поражение клубочков почек);
- Злокачественные и доброкачественные новообразования;
- Гепатит (алкогольная форма).
- Гемотрансфузии (переливание крови);
- Почечная недостаточность (хроническая форма);
- Злокачественные процессы в организме;
- Положительный прогноз лечения гепатита С.
Понижение значений
- респираторные вирусные заболевания в острой форме;
- псориаз;
- онкология легких;
- прием некоторых препаратов: циклоспорина А, глюкокортикоидов и т.д.;
- атопии (склонность организма к различным аллергическим реакциям).
- отторжение трансплантата после пересадки почки;
- метаболический синдром (гормональные и метаболические нарушения) у пациенток с ожирением;
- неблагоприятный прогноз лечения инсульта.
Подготовка
- исключить из рациона жирные, острые, жареные блюда, алкоголь и кофеинсодержащие напитки;
- не париться в бане или сауне;
- избегать тяжелых физических нагрузок и эмоционального стресса.
Непосредственно перед процедурой:
- нельзя пить ничего, кроме обычной негазированной воды;
- запрещено курить, употреблять наркотические и лекарственные препараты;
- рекомендовано соблюсти режим покоя.
Обо всех текущих или недавно завершенных курсах лечения и диагностических обследованиях врача нужно предупредить заранее.
- 1.The interleukin (IL)-1 cytokine family--Balance between agonists and antagonists in inflammatory diseases//2015 Nov;76(1):25-37. doi: 10.1016/j.cyto.2015.06.017.
- 2.IL-6 in Inflammation, Immunity, and Disease//2014 Oct; 6(10): a016295.doi: 10.1101/cshperspect.a016295
- 3. В. Н. Кузьмин, Г. А. Мурриева. Значение полиморфизма и экспрессии генов цитокинов в прогнозировании риска преждевременных родов//Медицинский научно-практический портал "Лечащий врач"
- 4.Interleukin-10 paradox: A potent immunoregulatory cytokine that has been difficult to harness for immunotherapy//2015 Jul;74(1):27-34. doi: 10.1016/j.cyto.2014.10.031.
Важно! Все материалы носят справочный характер и ни в коей мере не являются альтернативой очной консультации специалиста.
Этот сайт использует cookie-файлы для идентификации посетителей сайта: Google analytics, Yandex metrika, Google Adsense. Если для вас это неприемлемо, пожалуйста, откройте эту страницу в анонимном режиме.
Интерлейкины участвующие в воспалении легких и бронхов
Интерлейкин 12 (IL-12) относится к провоспалительным цитокинам.
Основными его продуцентами являются моноциты, макрофаги, а также дендритные клетки, нейтрофилы, активированные лимфоциты.
Индукторами синтеза цитокина служат микробные компоненты и продукты.
В последние годы было показано, что IL-12 является ключевым цитокином для усиления клеточно-опосредованного иммунного ответа и инициации эффективной противоинфекционной защиты против вирусов, бактерий, грибов и простейших.
Основными клетками-мишенями IL-12 являются естественные киллеры и Т-лимфоциты. Цитокин активирует дифференцировку Т-лимфоцитов, повышает их цитотоксическую активность, усиливает пролиферацию естественных киллеров (ЕК) и Т-лимфоцитов и продукцию других цитокинов. Главный эффект — индукция синтеза IFN-y. Синтезированный при этом IFN-y начинает потенцировать индукцию синтеза IL-12 макрофагами.
Покоящиеся ЕК экспрессируют рецепторы для IL-12 и являются его мишенями, которые отвечают на действие IL-12 продукцией IFN-y, стимулирующего эффекторные функции макрофагов. Для ЕК характерен транзиторный синтез IFN-y, предназначенный для контроля развития инфекции в ранней стадии. Их связывает с макрофагами паракринная, позитивная, с обратной связью петля регуляции, которая обеспечивает функционирование важнейшего механизма противоинфекционной защиты. Другие провоспалительные цитокины, секретируемые макрофагами в ответ на индукцию микробными компонентами и продуктами (IL-1, TNF-a), являются синергистами с IL-12 в индукции синтеза IFN-y естественными киллерами.
В отличие от ЕК покоящиеся Т-хелперы-предшественники (ТНО) не экспрессируют рецепторов для IL-12. Только после распознавания ТКР комплекса антигенного пептида с молекулой главного комплекса гистосовместимости (МНС) 2 класса и связывания с костимулирующими молекулами В7 на поверхности антиген-презентирующей клетки происходит активация ТНО: инициируется синтез IL-2 и начинают экспрессироваться рецепторы для IL-12.
Один из важнейших эффектов IL-12 — способность поворачивать дифференцировку ТНО в сторону ТН1. В этом эффекте IL-12 является синергистом IFN-y, который к тому же способен селективно ингибировать экспансию ТН2 и секрецию ими цитокинов, которые могли бы ингибировать ТН1. Таким образом, создаются оптимальные условия для экспансии и дифференцировки ТН1. После дифференцировки ТН1 перестают нуждаться в IL-12 в качестве костимулирующей молекулы.
Характер течения и исход многих инфекций зависит от способности возбудителя, его компонентов и продуктов индуцировать синтез IL-12. Так, например, Candida albicans индуцирует синтез IL-12, и он способствует эффективной клеточной защите от возбудителя. Вирус иммунодефицита человека (HIV) ингибирует синтез IL-12, с чем связаны многие дефекты клеточной защиты при СПИДе. Лейшмании, способные ингибировать синтез IL-12, вызывают хроническую инфекцию. Селективная ингибиция синтеза IL-12, даже при сохранении продукции других провоспалительных цитокинов (IL-1, TNF-a), позволяет возбудителям длительно персистировать в организме хозяина.
Неконтролируемый синтез IL-12 может вызвать чрезмерную активацию клеточно-опосредованного иммунного ответа с развитием аутоиммунной патологии. Физиологическим ингибитором синтеза IL-12 является IL-10 — продукт ТН2, который является типичным противовоспалительным цитокином, ингибирующим продукцию и IFN-y, и вообще ТН1-ответ. 1
В динамике воспалительного ответа (например, при формировании грануломы) в течение первых двух суток макрофаги усиленно продуцируют IL-12. Через 4 дня продукция IL-12 начинает регулироваться в соответствии с характером иммунного ответа: поддерживается или усиливается в случае преобладания ответа ТН1 и снижается в случае преобладания ответа ТН2. Различные патогенные агенты и антигены могут индуцировать иммунный ответ с доминированием ТН1 или ТН2 в зависимости от их влияния на баланс цитокинов: IL-12/IFNy vs IL-10/IL-4.
В литературе описан семейный генетический дефект синтеза IL-12 моноцитами крови и связанный с ним дефект синтеза IFNy мононуклеарами крови в ответ на индукцию фитогемоагглютинина (ФГА). Дефект проявлялся высокой частотой развития диссеминированных инфекций, вызванных Mycobacterium avium (табл.6.21.).
Таблица 6.21. Провоспалительные цитокины
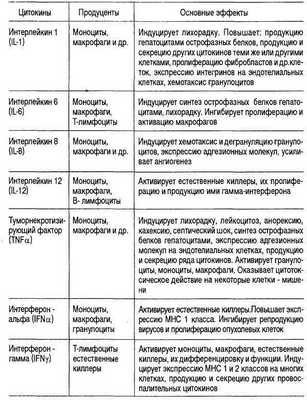
Интерлейкин 1
Под названием интерлейкин 1 (IL-1) объединены два полипептида: IL-la и IL-ip, обладающие широким спектром провоспалительной, метаболической, физиологической, гемопоэтической и иммунологической активности. Хотя две формы IL-1 являются продуктами разных генов, они взаимодействуют с общим рецептором и имеют сходные биологические свойства.
Как правило, клетки организма не способны к спонтанному синтезу IL-1, а отвечают его продукцией на инфекцию, действие микробных токсинов, воспалительных агентов, других цитокинов, активированных компонентов комплемента или системы свертывания крови. Список клеток-продуцентов IL-1 включает не только гемопоэтические клетки, но и эпителиальные, нервные и др. Столь же широк спектр клеток-мишеней этого цитокина.
Вместе с TNF-a и IL-6 IL-1 входит в группу провоспалительных цитокинов с перекрывающимися биологическими свойствами: способностью стимулировать Т- и В-лимфоциты, усиливать клеточную пролиферацию, инициировать или супрессировать экспрессию определенных генов. В качестве медиатора воспаления IL-1 способен опосредовать развитие системного острофазного ответа.
С повышенным уровнем этого цитокина в крови сопряжены лихорадка, анорексия, нейтрофилия, активация эндотелиальных клеток с повышением экспрессии на них адгезионных молекул, активация нейтрофилов, повышенный синтез острофазных белков и компонентов комплемента, синтез коллагенов и коллагеназ, активация остеобластов. IL-1 известен своей способностью активировать синтез других цитокинов: IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, TNF-a, TNF-в, IFNв, GM-CSF, G-CSF, M-CSF.
Кроме того, IL-1 может индуцировать собственный синтез и экспрессию рецепторов для IL-2. Многие провоспалительные эффекты IL-1 осуществляет в синергизме с TNF-a и IL-6: индукция лихорадки, анорексии, роль в патогенезе эндотоксического (септического) шока, влияние на гемопоэз, участие в неспецифической противоинфекционной защите.
Способность мононуклеаров крови людей и альвеолярных макрофагов к спонтанной и индуцированной стандартными индукторами (липополисахарид (ЛПС)) продукции IL-1 может быть повышена или снижена при различных заболеваниях. Повышенная продукция IL-1 описана при бактериальных инфекциях, пневмокониозе, саркоидозе, туберкулезе, респираторном дистресс-синдроме. Пониженную продукцию IL-1 наблюдали у больных с респираторными вирусными инфекциями, атопиями, раком легкого (табл.6.21.).
Интерлейкин 6
Интерлейкин 6 (IL-6) является мультифункциональным цитокином, который продуцируют как лимфоидные, так и нелимфоидные клетки и который регулирует иммунный ответ, острофазный воспалительный ответ и гемопоэз. Рецепторы для IL-6 обнаруживаются и на лимфоидных, и на нелимфоидных клетках. Одной из основных функций IL-6 является регуляция процессов созревания антителопродуцирующих клеток из В-лимфоцитов и самой продукции иммуноглобулинов. IL-6 участвует также в активации Т-лимфоцитов.
Не менее существенный вклад вносит IL-6 в регуляцию синтеза острофазных белков, сопутствующего воспалению. Биосинтез острофазных белков гепатоцитами регулируется всей группой провоспалительных цитокинов, но IL-6 отводится особая роль "гепатоцит-активирующего фактора".
IL-6 может индуцировать синтез многих острофазных белков: фибриногена, al-антихимотрипсина, al-кислого гликопротеина, гаптоглобина, сывороточного амилоида A, CRP, a 1-антитрипсина и а2-макроглобулина. Продукция альбумина при этом снижается. При развитии острой фазы воспаления уровень IL-6 в сыворотке крови коррелирует с уровнем CRP и с уровнем лихорадки у больного. Повышение уровня IL-6 в сыворотке крови может предшествовать подъему уровня CRP.
Между провоспалительными цитокинами, для которых характерны синергидные эффекты, существуют достаточно сложные взаимнорегули-рующие отношения. В частности, IL-6 ингибирует продукцию IL-1 и TNFa, которые являются оба активными индукторами синтеза IL-6. Кроме того, IL-6 через гипоталамус-гипофизарное регуляторное звено усиливает продукцию кортизола, который, в свою очередь, действует на клетки печени, усиливая индукцию IL-6 острофазных белков, но ингибирует экспрессию гена IL-6, как и генов других провоспалительных цитокинов (табл.6.21).
Интерлейкин 8 и хемокины
Все современные цитокины, основной биологической функцией которых является хемоаттрактантная активность, объединены под названием хемокины, а по структуре разделены на два семейства. Первое, с последовательностью С-Х-С, представлено прежде всего IL-8 и PF4, а также другими, менее изученными: GROa, GROp, GROy, NAP-2, ENA-78, IP-10 и GCP-2. Основными представителями второго семейства с последовательностью С-С являются МСР-1, MIP-1 и RANTES.
Источниками хемокинов являются большинство клеток периферической крови и тканей (табл.6.22).
Таблица 6.22. Клетки-продуценты хемокинов
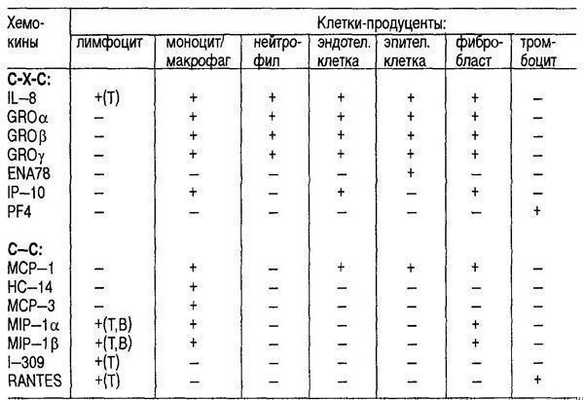
Основные биологические эффекты хемокинов связаны с их хемоаттрактантной активностью. Однако некоторые цитокины в отношении различных клеток-мишеней обладают и другими эффектами, связанными с активацией этих клеток (табл.6.23.).
Таблица 6.23. Биологические проявления активности хемокинов

Еще задолго до открытия IL-8 у альвеолярных макрофагов была обнаружена способность продуцировать хемоаттрактант для нейтрофилов. В последние годы установлено, что эти наблюдения связаны преимущественно с IL-8. Так, у больных идиопатическим фиброзом легких была обнаружена повышенная экспрессия mRNA для IL-8, что коррелировало с содержанием IL-8, числом нейтрофилов в бронхоальвеолярной жидкости (БАЖ) и с тяжестью заболевания.
Аналогичные наблюдения имеются в отношении МСР-1, который экспрессируется макрофагами, эпителиальными, эндотелиальными и гладкомышечными клетками легких. Высокий уровень IL-8 в легких обнаружен при остром воспалении. У больных респираторным дистресс-синдромом содержание IL-8, количество нейтрофилов коррелировало со смертностью.
При муковисцидозе нейтрофильная эластаза, присутствующая в БАЖ, индуцирует продукцию IL-8 эпителиальными клетками бронхов. Хемокины также являются медиаторами аллергического воспаления. У больных бронхиальной астмой (БА) наблюдается повышенная экспрессия IL-8 эпителиальными клетками бронхов, а повышенное наличие GM-CSF, IL-3 и IL-5 повышает чувствительность базофилов и эозинофилов больных БА к С-Х-С и С-С хемокинам.
Интерлейкин 10
Интерлейкин 10 (IL-10) относится к числу противовоспалительных цитокинов. Его продуцентами могут быть моноциты, макрофаги, активированные Т-хелперы. Обращает на себя внимание способность самих макрофагов продуцировать этот цитокин, являющийся для них сильнейшим ингибитором. IL-10 ингибирует продукцию IFN-y Т-лимфоцитами и ЕК, продукцию всех провоспалительных цитокинов макрофагами, экспрессию рецепторов TNF-a и IL-12 на ЕК.
Способность IL-10 ингибировать продукцию IL-1, IL-6, TNF-a макрофагами и их окислительный взрыв связана с его способностью угнетать продукцию IL-12. Как правило, макрофаги продуцируют и секретируют последовательно провоспалительные цитокины, в том числе IL-12, а затем IL-10, но с преобладанием IL-12. Однако иногда продукция IL-10 резко усиливается. Такое действие на макрофаги оказывают, например, иммунные комплексы (ИК). При этом избыток IL-10 ведет к снижению противоинфекционной защиты и развитию хронических инфекций (табл.6.24).
Интерлейкин 4
К противовоспалительным цитокинам относится интерлейкин 4 (IL-4), который продуцируется преимущественно Т-лимфоцитами, относящимися к субпопуляции ТН2. Кроме того, ограниченная способность к выработке IL-4 была обнаружена у тучных клеток, базофилов, В-лимфоцитов и стромальных клеток костного мозга. Основная функция IL-4 -это контроль пролиферации, дифференцировки и функций В-лимфоцитов, т.е. антительного ответа.
IL-4 может активировать и Т-лимфоциты, а ЕК ингибирует. В еще большей степени проявляется его ингибирую-щее действие в отношении моноцитов/макрофагов. IL-4 снижает экспрессию FcR всех трех типов, угнетая тем самым антителозависимую цитотоксичность и антителозависимый фагоцитоз. IL-4 блокирует и спонтанную, и индуцированную продукцию провоспалительных цитокинов: IL-1, IL-6, IL-8, TNF-a моноцитами и макрофагами, повышая одновременно продукцию G-CSF и M-CSF этими клетками. IL-4 блокирует продукцию супероксидных радикалов и PGE., но стимулирует продукцию PAF. Многие иммуномодулирующие эффекты IL-4 опосредованы его влиянием на продукцию других цитокинов.
Противовоспалительный потенциал этого цитокина заслуживает внимания с точки зрения возможного его лечебного применения (табл.6.24.).
Вирусная пневмония
Вирусная пневмония - это инфекционное поражение нижних отделов дыхательных путей, вызываемое респираторными вирусами (гриппа, парагриппа, аденовирусами, энтеровирусами, респираторно-синцитиальным вирусом и др.). Вирусные пневмонии протекают остро с внезапным повышением температуры тела, ознобами, интоксикационным синдромом, влажным кашлем, плевральными болями, дыхательной недостаточностью. При диагностике учитываются физикальные, рентгенологические и лабораторные данные, связь пневмонии с вирусной инфекцией. Терапия базируется на назначении противовирусных и симптоматических средств.
МКБ-10
Вирусная пневмония - острое воспаление респираторных отделов легких, вызываемое вирусными возбудителями, протекающее с синдромом интоксикации и дыхательных расстройств. В детском возрасте на долю вирусных пневмоний приходится порядка 90% всех случаев воспаления легких. В структуре взрослой заболеваемости преобладают бактериальные пневмонии, а вирусные составляют 4-39% от общего числа (чаще болеют лица старше 65 лет). Частота возникновения вирусных пневмоний тесно связана с эпидемиологическими вспышками ОРВИ - их подъем приходится на осенне-зимний период. В пульмонологии различают первичную вирусную пневмонию (интерстициальную с доброкачественным течением и геморрагическую со злокачественным течением) и вторичную (вирусно-бактериальную пневмонию - раннюю и позднюю).
Причины
Спектр возбудителей вирусной пневмонии чрезвычайно широк. Наиболее часто этиологическими агентами выступают респираторные вирусы гриппа А и В, парагриппа, аденовирус. Лица с иммунодефицитами более других подвержены вирусным пневмониям, вызванным вирусом герпеса и цитомегаловирусом. Реже диагностируются пневмонии, инициированные энтеровирусами, хантавирусом, коронавирусом, метапневмовирусом, вирусом Эпштейна-Барр. SARS-ассоциированный коронавирус является возбудителем тяжелого острого респираторного синдрома (ТОРС), более известного как атипичная пневмония. У детей младшего возраста вирусные пневмонии нередко вызываются респираторно-синцитиальным вирусом, а также вирусами кори и ветряной оспы.
Первичная вирусная пневмония манифестирует в первые 3 суток после инфицирования, а спустя 3-5 дней присоединяется бактериальная флора, и пневмония становится смешанной - вирусно-бактериальной. К числу лиц, имеющих повышенный риск заболеваемости вирусной пневмонией, относятся дети раннего возраста, пациенты старше 65 лет, лица с ослабленным иммунитетом, сердечно-легочной патологией (пороками сердца, тяжелой артериальной гипертензией, ИБС, хроническим бронхитом, бронхиальной астмой, эмфиземой легких) и другими сопутствующими хроническими заболеваниями.
Патогенез
Передача вирусов осуществляется воздушно-капельным путем при дыхании, разговоре, чиханье, кашле; возможен контактно-бытовой путь заражения через контаминированные предметы обихода. Вирусные частицы проникают в респираторные отделы дыхательных путей, где адсорбируются на клетках бронхиального и альвеолярного эпителия, вызывают его пролиферацию, инфильтрацию и утолщение межальвеолярных перегородок, круглоклеточную инфильтрацию перибронхиальной ткани. При тяжелых формах вирусной пневмонии в альвеолах обнаруживается геморрагический экссудат. Бактериальная суперинфекция значительно утяжеляет течение вирусной пневмонии.
Симптомы вирусной пневмонии
В зависимости от этиологического агента вирусные пневмонии могут протекать с различной степенью тяжести, осложнениями и исходами. Воспаление легких обычно присоединяется уже с первых дней течения ОРВИ.
Заболеваемость вирусной пневмонией на фоне гриппа значительно увеличивается в периоды эпидемий респираторной инфекции. В этом случае на фоне типичной симптоматики ОРВИ (лихорадки, резкой слабости, миалгии, явлений катара верхних дыхательных путей) появляется заметная одышка, диффузный цианоз, кашель с мокротой ржавого цвета, хрипы в легких, боль в груди при вдохе. У детей выражены общий токсикоз, беспокойство, могут возникать рвота, судороги, менингеальные знаки. Гриппозная пневмония обычно носит двусторонний характер, о чем свидетельствуют аускультативные данные и рентгенологическая картина (очаговые затемнения в обоих легких). Легкие случаи вирусной пневмонии, вызванной вирусом гриппа, характеризуются умеренно выраженной симптоматикой и заканчивается выздоровлением.
Парагриппозная пневмония чаще поражает новорожденных и детей раннего возраста. Она носит мелкоочаговый (реже сливной) характер и протекает на фоне катаральных явлений. Респираторные нарушения и интоксикационный синдром выражены умеренно, температура тела обычно не превышает субфебрильные значения. Тяжелые формы вирусной пневмонии при парагриппе у детей протекают с выраженной гипертермией, судорогами, анорексией, диареей, геморрагическим синдромом.
Особенностью респираторно-синцитиальной пневмонии служит развитие тяжелого обструктивного бронхиолита. Поражение нижних отделов респираторного тракта знаменуется повышением температуры тела до 38-39 о С, ухудшением общего состояния. Вследствие спазма и закупорки мелких бронхов слизью и десквамированным эпителием дыхание становится резко затрудненным и учащенным, развивается цианоз носогубной и периорбитальной области. Кашель частый, влажный, однако ввиду повышенной вязкости мокроты - малопродуктивный. При данной разновидности вирусной пневмонии обращает внимание несоответствие интоксикации (выражена умеренно) степени дыхательной недостаточности (крайне выражена).
Энтеровирусные пневмонии, возбудителями которых выступают вирусы Коксаки и ЕСНО, протекают со скудными физикальными и рентгенологическими данными. В клинической картине на первый план выходят сопутствующие менингеальные, кишечные, сердечно-сосудистые нарушения, затрудняющие диагностику.
Осложнения
Тяжелые формы вирусных пневмоний протекают с постоянной высокой лихорадкой, дыхательной недостаточностью, коллапсом. Среди осложнений часты гриппозный энцефалит и менингит, отит, пиелонефрит. Присоединение вторичной бактериальной инфекции нередко приводит к возникновению абсцессов легкого или эмпиемы плевры. Возможен летальный исход в течение первой недели заболевания.
Диагностика
Правильно распознать этиологическую форму пневмонии и идентифицировать возбудителя поможет тщательное изучение анамнеза, эпидемиологической обстановки, оценка физикальных и лабораторно-рентгенологических данных. Вирусные пневмонии обычно развиваются в периоды эпидемических вспышек ОРВИ, протекают на фоне катарального синдрома, сопровождаются признаками дыхательной недостаточности различной степени выраженности. Аускультативно в легких выслушиваются мелкопузырчатые хрипы.
При рентгенографии легких обнаруживается усиление интерстициального рисунка, наличие мелкоочаговых теней чаще в нижних долях. Подтвердить вирусную этиологию пневмонии помогает исследование мокроты, трахеального аспирата или промывных вод бронхов методом флуоресцирующих антител. В крови в остром периоде отмечается четырехкратное нарастание титров АТ к вирусному агенту. Всесторонняя оценка объективных данных пульмонологом позволит исключить атипичную, аспирационную пневмонию, облитерирующий бронхиолит, инфаркт-пневмонию, бронхогенный рак и др.
Лечение вирусной пневмонии
Госпитализация показана только детям до 1 года, пациентам старшей возрастной группы (от 65 лет), а также имеющим тяжелые сопутствующие заболевания (ХОБЛ, сердечную недостаточность, сахарный диабет). Больным назначается постельный режим, обильное питье, витаминизированное, высококалорийное питание.
Этиотропная терапия назначается в зависимости от вирусного возбудителя: ремантадин, осельтамивир, занамивир - при гриппозной пневмонии, ацикловир - при герпес-вирусной пневмонии, ганцикловир - при цитомегаловирусной инфекции, рибавирин - при респираторно-синцитиальной пневмонии и поражении хантавирусом и т. д. Антибактериальные средства добавляются только при смешанном характере пневмонии или развитии гнойных осложнений. В качестве симптоматического лечения применяются отхаркивающие, жаропонижающие средства. В целях облегчения отхождения мокроты проводятся лекарственные ингаляции, дренажный массаж. При выраженном токсикозе осуществляется внутривенная инфузия растворов; при развитии дыхательной недостаточности - кислородотерапия.
Прогноз и профилактика
В большинстве случаев вирусная пневмония заканчивается выздоровлением в течение 14 дней. У 30-40% пациентов отмечается затяжное течение заболевания с сохранением клинико-рентгенологических изменений на протяжении 3-4 недель с последующим развитием хронического бронхита или хронической пневмонии. Заболеваемость и смертность от вирусной пневмонии выше среди детей раннего возраста и пожилых пациентов.
Профилактика вирусной пневмонии тесно связана с иммунизацией населения, в первую очередь, профилактической сезонной вакцинацией против гриппа и наиболее опасных детских инфекций. Неспецифические меры по укреплению иммунитета включают закаливание, витаминотерапию. В периоды эпидвспышек ОРВИ необходимо соблюдать меры личной предосторожности: по возможности исключить контакты с больными респираторными инфекциями, чаще мыть руки, проветривать помещение и т. п. Особенно эти рекомендации касаются контингента повышенного риска по развитию и осложненному течению вирусной пневмонии.
1. Эпидемиология, клиника и лечение тяжелых форм вирусно-бактериальных пневмоний: учебное пособие/ Хапий Х.Х. и соавт. - 2014.
2. Внебольничная пне вмония у взрослых: практические рекомендации по диагностике, лечению и профилактике/ Пособие для врачей. - 2010.
4. Особенности клинического течения, лечения тяжелой вирусно-бактериальной пневмонии на фоне высоковирулентного гриппа A(H1N1) на Севере: Автореферат диссертации/ Савш П.А. - 2017.с
Сравнительный анализ цитокинового статуса при аденовирусной и респираторно-синцитиальной вирусной инфекциях
Аденовирусная и респираторно-синцитиальная вирусная инфекции — широко и повсеместно распространенные ОРВИ, представляющие угрозу для лиц различного возраста, а особенно — для людей группы риска (страдающих сердечно-легочными хроническими заболеваниями, им
Обследовано 64 больных аденовирусной инфекцией и 48 — респираторно-синцитиальной вирусной инфекцией. У всех больных исследовали цитокиновый статус с определением уровней сывороточного и спонтанного интерферона (ИФН), индуцированного ИФН-альфа и ИФН-гамма, уровней ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-12, ФНО-альфа в сыворотке крови, спонтанной и индуцированной продукции ИЛ-2, ИЛ-6, ИЛ-12 лейкоцитами крови обследованных. Проводили сравнительный анализ цитокинового статуса при неосложненном и осложненном течении аденовирусной и респираторно-синцитиальной вирусной инфекций. Разработаны дополнительные критерии дифференциальной диагностики исследованных инфекций: при неосложненном течении уровень сывороточного ИЛ-1 выше 12 пг/мл свидетельствует о наличии аденовирусной инфекции, при осложнении ангиной уровень сывороточного ИЛ-12 ниже 95 пг/мл и уровень индуцированной продукции лейкоцитами ИЛ-12 ниже 1800 пг/мл свидетельствуют больше в пользу аденовирусной инфекции, а уровень индуцированной продукции лейкоцитами ИЛ-6 выше 15 000 пг/мл — в пользу респираторно-синцитиальной вирусной инфекции, при осложнении бронхитом уровень спонтанной продукции ИЛ-2 ниже 650 пг/мл указывает на течение респираторно-синцитиальной вирусной инфекции, при осложнении пневмонией уровень индуцированной продукции ИЛ-6 лейкоцитами крови ниже 10 800 пг/мл с высокой долей вероятности свидетельствует в пользу аденовирусной инфекции. Рекомендовано применение Виферона для лечения аденовирусной инфекции, осложненной бронхитом, и респираторно-синцитиальной вирусной инфекции, осложненной пневмонией.
Аденовирусная и респираторно-синцитиальная вирусная инфекции — широко и повсеместно распространенные ОРВИ, представляющие угрозу для лиц различного возраста, а особенно — для людей группы риска (страдающих сердечно-легочными хроническими заболеваниями, иммунодефицитами), у которых зачастую развиваются серьезные осложнения [1, 2]. С этими заболеваниями связывают развитие в последующем хронических обструктивных заболеваний легких 3.
Пациенты и методы
В исследовании, проведенном на базе ИКБ № 1 г. Москвы, приняли участие 64 больных аденовирусной инфекцией и 48 больных респираторно-синцитиальной вирусной инфекцией Контрольная группа включала 24 донора. Диагноз был установлен на основании клинических данных, а также лабораторного подтверждения наличия соответствующего вируса в назальном содержимом методом иммунофлюоресценции или иммунохроматографическим методом (набор QuickStripe фирмы Savyon). У всех больных исследовали цитокиновый статус с определением уровней сывороточного и спонтанного ИФН, индуцированного ИФН-альфа и ИФН-гамма, уровней ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-12, ФНО-альфа в сыворотке крови, спонтанной и индуцированной продукции ИЛ-2, ИЛ-6, ИЛ-12 лейкоцитами крови обследованных. Определение интерферонов проводили в лаборатории интерферонов НИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи по методике, разработанной Соловьевым В. Д. и Бектемировым Т. А. Исследование показателей системы интерлейкинов проводили в лаборатории онтогенеза и коррекции системы интерферона ГУ НИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи под руководством проф., д.б.н. Малиновской В. В. с использованием набора реагентов для иммуноферментного определения концентраций интерлейкинов в биологических средах человека. Для лечения 31 больного аденовирусной инфекцией и 30 больных респираторно-синцитиальной вирусной инфекцией применялся препарат Виферон, суппозитории ректальные в дозировке 1 000 000 МЕ, в состав которого входит рекомбинантный ИФН-альфа2b в комплексе с мембраностабилизирующими средствами — антиоксидантами: витаминами С и Е. Назначалось по одной свече 2 раза в день с интервалом 12 часов, длительность курса составляла 5 дней. Статистическая обработка результатов проводилась непараметрическими методами с использованием критерия Манна-Уитни (пакет программ SPSS).
Результаты исследования и их обсуждение
Для проведения сопоставления цитокинового статуса при аденовирусной и респираторно-синцитиальной вирусной инфекциях был проведен дискриминантный анализ всех показателей уровней цитокинов (табл. 1).
С помощью дискриминантного анализа выявлялись наиболее информативные критерии, позволяющие дифференцировать между собой два инфекционных процесса неосложненного течения, а также осложненного ангиной, бронхитом, пневмонией. Результаты дискриминантного анализа выражали абсолютной величиной стандартизированного канонического коэффициента дискриминантной функции (СККДФ) и ранжировали в соответствии с величиной этого коэффициента.
| Рис. 1. Соотношение дискриминантных признаков в группах больных аденовирусной и респираторно-синцитиальной вирусной инфекциями неосложненного течения |
Как видно из таблицы, при неосложненном течении различия между аденовирусной и респираторно-синцитиальной вирусной инфекцией выявлялись только по содержанию в сыворотке крови ИЛ-1 и ИЛ-2, дискриминантную роль которых можно проанализировать с помощью рис. 1.
При неосложненном течении заболеваний набор отличительных признаков между группами с различными ОРВИ был минимальным, но имеющим выраженное дифференциально-диагностическое и патогенетическое значение. Для аденовирусной инфекции были характерны довольно высокие показатели уровня провоспалительного цитокина ИЛ-1 в сыворотке крови, достоверно превышающие таковые в группе сопоставления в 28 раз (p < 0,05).
Соотношение дискриминантных параметров цитокинового статуса при аденовирусной и респираторно-синцитиальной вирусной инфекциях осложненного течения нашло отражение в табл. 2 и на рис. 2, при этом на рисунке для повышения сопоставимости данных показаны коэффициенты отклонения достоверно различающихся показателей от контроля.
| Рис. 2. Соотношение уровней информационно значимых цитокинов у больных аденовирусной и респираторно-синцитиальной вирусной инфекциями при наличии осложнений |
В тех случаях, когда течение инфекционного процесса осложнялось ангиной, перечень различий включал наибольшее число показателей, но из этих 14 потенциально информативных параметров только три показывали достоверность различий между цитокиновым профилем при аденовирусной и респираторно-синцитиальной вирусной инфекциях, осложненных ангиной. К числу таких показателей относились уровень сывороточного ИЛ-12, а также уровни индуцированной секреции лейкоцитами крови ИЛ-12 и ИЛ-6. При респираторно-синцитиальной вирусной инфекции значения этих показателей превосходили таковые при аденовирусной инфекции соответственно в 2, 2,1 и 1,8 раза.
При неосложненном течении ОРВИ критериальное значение имел уровень сывороточного ИЛ-1, диапазоны индивидуальных значений которого представлены на рис. 3. Значения выше 12 пг/мл регистрируются только при аденовирусной инфекции при частоте их встречаемости в 75% случаев.
При ОРВИ, осложненном ангиной, диапазоны значений трех критериальных признаков представлены на рис. 4.
| Рис. 3. Диапазоны значений сывороточного ИЛ-1 при неосложненном течении аденовирусной и респираторно-синцитиальной вирусной инфекций |
Как следует из иллюстраций, критериальной величиной для сывороточного ИЛ-12 служит 95 пг/мл. В диапазон ниже этой величины входит 87,5% случаев аденовирусной инфекции, а в более высокий диапазон — 50% случаев респираторно-синцитиальной вирусной инфекции. Информативное значение уровня индуцированной продукции лейкоцитами ИЛ-12 несколько выше. При критериальной величине в 1800 пг/мл значения ниже этой величины наблюдаются у 87,5% больных аденовирусной инфекцией, а выше — у 62,5% больных респираторно-синцитиальной вирусной инфекцией. Что касается третьего показателя, то при критериальной величине в 15 000 пг/мл значения ниже этой величины отмечены у 70% больных аденовирусной инфекцией, а выше — у 75% больных респираторно-синцитиальной вирусной инфекцией.
Для сывороточного ИЛ-5 критериальная величина составляла 8 пг/мл, значения, равные этой величине, отмечались у 87,5% больных аденовирусной инфекцией и у 62,5% больных респираторно-синцитиальной вирусной инфекцией, то есть данный показатель критерием служить не мог, несмотря на различия по средним величинам. Критериальной для второго показателя — индуцированной продукции ИЛ-6 лейкоцитами крови — служила величина 10800 пг/мл, в диапазон значений ниже этой величины входили все 100% больных аденовирусной инфекцией, а выше — 81,3% больных респираторно-синцитиальной вирусной инфекцией.
Рис. 4. Диапазоны значений критериально значимых цитокинов при аденовирусной и респираторно-синцитиальной вирусной инфекциях, осложненных ангиной
Таким образом, как при неосложненном, так и при осложненном течении ОРВИ, вызванных аденовирусом и респираторно-синцитиальным вирусом, определение цитокинового статуса помогает не только оценить патогенетическое значение отдельных цитокинов и прогнозировать развитие осложнений, а также может способствовать дифференциальной диагностике инфекционных процессов рассматриваемой этиологии, хотя и в качестве не абсолютных, а дополнительных критериев.
Относительными дифференциальными признаками аденовирусной и респираторно-синцитиальной вирусной инфекций являются:
- при неосложненном течении уровень сывороточного ИЛ-1 выше 12 пг/мл свидетельствует о наличии аденовирусной инфекции;
- при осложнении ангиной уровень сывороточного ИЛ-12 ниже 95 пг/мл и уровень индуцированной продукции лейкоцитами ИЛ-12 ниже 1800 пг/мл свидетельствуют больше в пользу аденовирусной инфекции, а уровень индуцированной продукции лейкоцитами ИЛ-6 выше 15 000 пг/мл — в пользу респираторно-синцитиальной вирусной инфекции;
- при осложнении бронхитом уровень спонтанной продукции ИЛ-2 ниже 650 пг/мл указывает на течение респираторно-синцитиальной вирусной инфекции;
- при осложнении пневмонией уровень индуцированной продукции ИЛ-6 лейкоцитами крови ниже 10 800 пг/мл с высокой долей вероятности свидетельствует в пользу аденовирусной инфекции.
При определении целесообразности применения Виферона в комплексном лечении аденовирусной и респираторно-синцитиальной вирусной инфекций у взрослых было выявлено, что включение в схему лечения больных аденовирусной инфекцией Виферона, высокоэффективно при лечении бронхита. При применении Виферона сокращалась длительность госпитализации (р < 0,05) и длительность боли в горле при глотании (р < 0,05) на фоне снижения спонтанной продукции ИЛ-12 и ИЛ-6 лейкоцитами крови (р < 0,01). Использование Виферона в комплексной терапии аденовирусной инфекции, осложненной ангиной и пневмонией, не показано.
Применение Виферона нецелесообразно при респираторно-синцитиальной вирусной инфекции, осложненной поражением миндалин или бронхитом. При респираторно-синцитиальной вирусной инфекции, осложненной пневмонией, имеются относительные показания для назначения Виферона, поскольку имеет место достоверное повышение уровня сывороточного ИФН на фоне лечения данным препаратом (р < 0,05).
Литература
- Echavarria M. Adenoviruses in immunocompromised hosts // Clin. Microbiol. 2008. Vol. 21. № 4. P. 704-715.
- Walsh E. E., Falsey A. R., Hennessey P. A. Respiratory syncytial virus and other infections in persons with chronic cardiopulmonary disease // Am. J. Respir. Crit. Care Med. 1999. Vol. 160. P. 791-795.
- Ogawa E., Elliott W. M., Hughes F., Eichholtz T. J. et al. Latent adenoviral infection induces production of growth factors relevant to airway remodeling in COPD // Am. J. Physiol. Lung Cell Mol. Physiol. 2004. Vol. 286. № 1. P. 189-197.
- Openshaw P. J., Dean G. S., Culley F. J. Links between respiratory syncytial virus bronchiolitis and childhood asthma: clinical and research approaches // Pediatr. Infect. Dis. J. 2003. Vol. 22. P. 58-64.
- Sigurs N. RSV and RAD: possibilities for prevention? The link between respiratory syncytial virus and reactive airway disease // Respiratory Research. 2002. Vol. 3. № 1. P. 8-14.
- Fernandez J. A., Tapia L., Palomino M. A., Larranaga C. et al. Plasma interferon-gamma, interleukin-10 and soluble markers of immune activation in infants with primary adenovirus (ADV) and respiratory syncytial virus (RSV) infection // Eur. Cytokine Netw. 2005. Vol. 16. № 1. Р. 35-40.
Ю. А. Климова*,
А. К. Токмалаев*, доктор медицинских наук, профессор
И. П. Балмасова**, доктор медицинских наук, профессор
*РУДН, **Научно-исследовательский медико-стоматологический институт МГМСУ, Москва
Контактная информация об авторах для переписки: 117198, Москва, ул. Миклухо-Маклая, 8
Читайте также:
