Использование энергии клетками. Регуляция высвобождения энергии
Добавил пользователь Skiper Обновлено: 22.01.2026
Механизм создания АТФ оставался загадкой долгие годы, пока не обнаружилось, что данный процесс по сути своей является электрическим. В обоих случаях: и для дыхательной цепи (набора белков, которые осуществляют окисление субстратов кислородом) и для аналогичного фотосинтетического каскада, — генерируется ток протонов через мембрану, в которую погружены белки. Токи обеспечивают энергией синтез АТФ, а также служат источником энергии для некоторых видов работы. В современной биоэнергетике принято считать АТФ и протонный ток (точнее, протонный потенциал) альтернативными и взаимно конвертируемыми энергетическими валютами. Некоторые функции оплачиваются одной валютой, другие - второй.
К середине XX в. биохимики точно знали, что в бактериях и митохондриях электроны переходят от восстанавливаемых субстратов к кислороду через каскад электронных переносчиков, называемых дыхательной цепочкой. Загадка была в том, каким способом сопряжены перенос электрона и синтез АТФ. На протяжении 10 с лишним лет надежда открыть секрет вспыхивала и вновь угасала. Решающую роль сыграло не преодоление технических трудностей, а концептуальная разработка. Сопряжение оказалось в принципе не химическим, а электрическим. В 1961 г. английский ученый П. Митчелл опубликовал в журнале «Nature» радикальную идею для разрешения биохимической загадки века: хемиосмотическую гипотезу. Идея Митчелла была поистине революционной сменой парадигм, трансформацией концептуальной основы и поначалу вызывала бурные споры.
В 1966 г. Митчелл пишет свою первую книгу «Хемиосмотическое сопряжение в окислительном и фотосинтетическом фосфорилировании». В том же году российские ученые, биофизик Е. Либерман и биохимик В. Скулачев, придумали, как экспериментально подтвердить правоту Митчелла. С помощью синтетических ионов, проникающих через биологическую мембрану, они показали, что дыхание и фосфорилирование, действительно, связаны через протонный потенциал. Еще один серьезный шаг в поддержку Митчелла сделали биофизики биофака МГУ А. Булычев, В. Андрианов, Г. Курелла и Ф. Литвин. Используя микроэлектроды, они зарегистрировали образование трансмембранной разности электрических потенциалов при освещении крупных хлоропластов.
Еще несколько лет споров и дотошных проверок в разных лабораториях по всему свету — и идеи Митчелла, наконец, были признаны. Он был принят в Королевское общество Великобритании (и соответственно, стал сэром), получил множество престижных международных наград, а в 1978 г. был удостоен Нобелевской премии, которая, вопреки традициям, на сей раз была вручена не за открытие нового явления, а за догадку о его существовании.
Цепь переноса электрона оказалась не просто связана с мембраной, но вплетена в нее таким образом, что при движении электрона от субстрата к кислороду протоны перемещаются с внутренней поверхности наружу. Мембрана образует замкнутый пузырек, который плохо пропускает протоны, поэтому в результате «выкачивания» протонов генерируется разность потенциалов через мембрану: электрическая отрицательность внутри. Одновременно увеличивается рН: защелачивается среда внутри пузырька. Протоны снаружи оказываются под гораздо более высоким электрохимическим потенциалом, чем внутри, как бы под «давлением» со стороны и электрического потенциала и градиента рН, которые толкают протоны обратно через мембрану внутрь пузырька. Живая клетка использует энергию таких протонов для совершения разных видов работы.
Поразительные успехи рентгеноструктурного анализа белков позволили увидеть полные пространственные структуры отдельных белковых комплексов, входящих в состав дыхательной цепи. Белки цепи переноса электронов, локализованные в мембранах митохондрий, способны менять свой спектр поглощения, получая и отдавая электроны. Микроспектральные методы позволяют проследить последовательность передачи электронов по цепочке белков и выяснить, в каких именно местах часть свободной энергии электронов используется для синтеза АТФ.
Согласно идее Митчелла, для синтеза АТФ из АДФ и фосфата в мембранах митохондрий используется электрическая энергия. Следовательно, если снять разность потенциалов через мембрану, можно предположить, что синтез прекратится. Именно такой эффект был продемонстрирован в ходе экспериментов на искусственных мембранах с использованием специально синтезированных ионов, резко повышающих проводимость мембран для протонов.
Одни из первых экспериментальных доказательств верности гипотезы Митчелла были получены в нашей стране под руководством Е.А. Либермана и В.П. Скулачева. В качестве индикаторов изменений электрического поля на мембране были использованы синтетические ионы, отличающиеся по своей природе и знаку заряда, но сходные в одном: все они легко проникали через фосфолипидную пленку. После многих попыток сложилась следующая изящная экспериментальная модель.
Еще более убедительная экспериментальная модель, позволяющая проводить прямые измерения электрического тока, генерируемого клеточными органеллами и отдельными белками, была разработана и успешно использована Л.А. Драчевым, А.А. Кауленом и В.П. Скулачевым. Частицы, генерирующие электрический ток (митохондрии, хроматофоры бактерий или липидные пузырьки с встроенными в них индивидуальными белками), заставляли слипаться с плоской искусственной мембраной. После этого протонный ток, созданный молекулами-генераторами в ответ на вспышку света или добавление соответствующих химических субстратов, обнаруживался напрямую измерительными электродами по обе стороны искусственной мембраны.
В 1973 г. У. Стокениус и Д. Остерхельт из США открыли необычный светочувствительный белок в мембранах фиолетовых бактерий, обитающих в соленых озерах Калифорнийских пустынь. Этот белок, подобно зрительному пигменту глаза животных - родопсину, — содержал производное витамина А - ретиналь, за что и был назван бактериородопсином. Американские ученые Рэкер и Стокениус изящно продемонтрировали участие бактериородопсина в энергетическом сопряжении. Объединив в модельной фосфолипидной мембране только что открытый светочувствительный белок фиолетовых бактерий с АТФ-синтазой, они получили молекулярный ансамбль, способный синтезировать АТФ при включении света.
В конце 1973 г. академик Ю.А. Овчинников организовал проект «Родопсин» для сравнительного исследования животного и бактериального светочувствительных пигментов. В рамках проекта в лаборатории В.П. Скулачева в МГУ в модельных экспериментах на искусственных мембранах было доказано, что бактериородопсин - белковый генератор электрического тока. Встроенный в искусственную фосфолипидную пленку бактериородопсин направленно транспортировал протоны в ответ на вспышку света. Величина фотопотенциала на мембране превышала 0,3 В, что заведомо достаточно для энергетического обеспечения синтеза АТФ.
Бактериородопсин оказался на редкость стабильным электрическим генератором: он продолжал работать при нагревании до 100 о С и даже в 0,1 N кислоте. В ходе опытов с бактериородопсином электрическая часть хемиосмотической гипотезы получила свое окончательное подтверждение.
После множества придирчивых проверок теория П. Митчелла была признана абсолютно корректной, и ее рамки были расширены далеко за пределы сопряжения в цепях переноса электрона с синтезом АТФ. Ученому с самого начала было ясно, что циркуляция протонов может поддерживать множество видов работы при посредстве мембранных белков.
Представим себе, например, белок, транспортирующий субстрат S. Если у белка есть два функциональных места, одно для S, другое для протона, так что поток S сопряжен с потоком протона, до движущая сила для протона оказывается приложенной и к S. Тогда транспорт протона будет не только облегчать перенос S через мембрану, но и действовать как насос, аккумулирующий субстрат внутри пузырька.
У живой клетки есть не только молекулярные генераторы и насосы, но и молекулярные «моторы». Эволюция создала несколько классов белков, способных преобразовывать химическую энергию в механическое усилие. Одни из них используют в качестве топлива гидролиз нуклеотидов, другие - непосредственно ионные градиенты. Есть шаговые белковые моторы, а есть роторные.
Последнее время проблемой преобразования химической энергии в механическую работу активно занялись компьютерные биологи. Они разработали математические модели, описывающие на формальном языке разные типы молекулярных моторов. Принципиальной трудностью, которую им пришлось преодолеть, оказалась невозможность использовать подходы, разработанные ранее для макроскопических моторов, поскольку на работу молекулярных моторов сильное воздействие оказывают термические флуктуации. По этой причине теоретики окрестили белковые моторы «Броуновскими машинами». Тем не менее, в 90-х г.г. XX столетия были разработаны алгоритмы, которые позволили создать ряд имитационных моделей, в частности, мотора бактериального жгутика, механического усилия полимеризующегося волокна, вращающегося мотора АТФ-синтазы.
Главный вывод, к которому пришли исследователи: работа молекулярных моторов вряд ли основана на новых физических или химических принципах, однако, похоже, что для каждого типа белковых моторов придется создавать свое теоретическое описание.
У электрической энергетики живой клетки есть еще одно очень важное свойство. При хемиосмотическом сопряжении энергии и работы не требуется прямого контакта между специфическим белком, создающим разность потенциалов через мембрану, и белком, совершающим какой-то вид работы: поток ионов или метаболитов обеспечит сопряжение двух векторных реакций на расстоянии при условии, что они соответствующим образом ориентированы в одной и той же мембране. Данное свойство успешно используется живыми клетками в митохондриальных сетях, работающих как электрические кабели. Учеными под руководством В.П. Скулачева митохондриальные сети были выявлены у разных типов клеток и исследованы с помощью современных методов электронной микроскопии, прижизненных флуоресцентных зондов, лазерной микрохирургии.
Более того, оказалось, что принцип Митчелла используется группами живых клеток для сопряжения производства энергии одной клеткой с совершением работы в соседней. Необходимое условие такой кооперации - наличие между клетками каналов, пропускающих значительные потоки ионов и метаболитов без утечек во внешнюю среду (см. ст. «Тайны нейроспоры», «В мире науки», №9, 2004 г.).
Продукция энергии в клетке
АТФ — универсальная энергетическая «валюта» клетки. Одно из наиболее удивительных «изобретений» природы — это молекулы так называемых «макроэргических» веществ, в химической структуре которых имеется одна или несколько связей, которые выполняют функцию накопителей энергии. В живой природе найдено несколько подобных молекул, но в организме человека встречается только одна из них — аденозинтрифосфорная кислота (АТФ). Это довольно сложная органическая молекула, к которой присоединены 3 отрицательно заряженных остатка неорганической фосфорной кислоты PO4 - . Именно эти фосфорные остатки связаны с органической частью молекулы «макроэргическими» связями, легко разрушающимися при разнообразных внутриклеточных реакциях. Однако энергия этих связей не рассеивается в пространстве в виде тепла, а используется на движение или химическое взаимодействие других молекул. Именно благодаря этому свойству АТФ выполняет в клетке функцию универсального накопителя (аккумулятора) энергии, а также универсальной «валюты». Ведь почти каждое химическое превращение, происходящее в клетке, либо поглощает, либо высвобождает энергию. Согласно закону сохранения энергии, общее количество энергии, образованное в результате окислительных реакций и запасенное в виде АТФ, равно количеству энергии, которое может использовать клетка на свои синтетические процессы и выполнение любых функций. В качестве «оплаты» за возможность произвести то или иное действие клетка вынуждена расходовать свой запас АТФ. При этом следует особо подчеркнуть: молекула АТФ столь крупна, что она не способна проходить через клеточную мембрану. Поэтому АТФ, образованная в одной клетке, не может быть использована другой клеткой. Каждая клетка тела вынуждена синтезировать АТФ для своих нужд самостоятельно в тех количествах, в которых она необходима для выполнения ее функций.
Три источника ресинтеза АТФ в клетках организма человека. По-видимому, далекие предки клеток человеческого организма существовали много миллионов лет назад в окружении растительных клеток, которые в избытке снабжали их углеводами, причем кислорода было недостаточно или не было еще вовсе. Именно углеводы — наиболее употребимая для производства энергии в организме составная часть питательных веществ. И хотя большинство клеток человеческого тела приобрело способность использовать в качестве энергетического сырья также белки и жиры, некоторые (например, нервные, красные кровяные, мужские половые) клетки способны производить энергию только за счет окисления углеводов.
Процессы первичного окисления углеводов — вернее, глюкозы, которая и составляет, собственно, основной субстрат окисления в клетках, — происходят непосредственно в цитоплазме: именно там расположены ферментные комплексы, благодаря которым молекула глюкозы частично разрушается, а освободившаяся энергия запасается в виде АТФ. Этот процесс называется гликолиз, он может проходить во всех без исключения клетках организма человека. В результате этой реакции из одной 6-углеродной молекулы глюкозы образуется две 3-углеродные молекулы пировиноградной кислоты и две молекулы АТФ.
Образовавшаяся в результате гликолиза пировиноградная кислота содержит в себе еще много потенциальной химической энергии и может служить субстратом для дальнейшего окисления, но для этого нужны специальные ферменты и кислород. Этот процесс происходит во многих клетках, в которых содержатся специальные органеллы — митохондрии. Внутренняя поверхность мембран митохондрий сложена из крупных липидных и белковых молекул, среди которых большое количество окислительных ферментов. Внутрь митохондрии проникают образовавшиеся в цитоплазме 3-углеродные молекулы — обычно это бывает уксусная кислота (ацетат). Там они включаются в непрерывно идущий цикл реакций, в процессе которых от этих органических молекул поочередно отщепляются атомы углерода и водорода, которые, соединяясь с кислородом, превращаются в углекислый газ и воду. В этих реакциях выделяется большое количество энергии, которая запасается в виде АТФ. Каждая молекула пировиноградной кислоты, пройдя полный цикл окисления в митохондрии, позволяет клетке получить 17 молекул АТФ. Таким образом, полное окисление 1 молекулы глюкозы обеспечивает клетку 2 + 17 х 2 = 36 молекулами АТФ. Не менее важно, что в процесс митохондриального окисления могут включаться также жирные кислоты и аминокислоты, т. е. составляющие жиров и белков. Благодаря этой способности митохондрии делают клетку сравнительно независимой от того, какими продуктами питается организм: в любом случае необходимое количество энергии будет добыто.
Некоторая часть энергии запасается в клетке в виде более мелкой и подвижной, чем АТФ, молекулы креатинфосфата (КрФ). Именно эта маленькая молекула может быстро переместиться из одного конца клетки в другой — туда, где в данный момент более всего нужна энергия. КрФ не может сам отдавать энергию на процессы синтеза, мышечного сокращения или проведение нервного импульса: для этого требуется АТФ. Но зато КрФ легко и практически без потерь способен отдать всю заключенную в нем энергию молекуле аденазиндифосфата (АДФ), которая сразу же превращается в АТФ и готова к дальнейшим биохимическим превращениям.
Таким образом, затраченная в ходе функционирования клетки энергия, т. е. АТФ, может возобновляться за счет трех основных процессов: анаэробного (бескислородного) гликолиза, аэробного (с участием кислорода) митохондриального окисления, а также благодаря передаче фосфатной группы от КрФ к АДФ.
Креатинфосфатный источник — самый мощный, поскольку реакция КрФ с АДФ протекает очень быстро. Однако запас КрФ в клетке обычно невелик — например, мышцы могут с максимальным усилием работать за счет КрФ не более 6-7 с. Этого обычно достаточно, чтобы запустить второй по мощности — гликолитический — источник энергии. В этом случае ресурс питательных веществ во много раз больше, но по мере работы происходит все большее напряжение гомеостаза из-за образования молочной кислоты, и если такую работу выполняют крупные мышцы, она не может продолжаться более 1,5-2 мин. Зато за это время почти полностью активируются митохондрии, которые способны сжигать не только глюкозу, но также жирные кислоты, запас которых в организме почти неисчерпаем. Поэтому аэробный митохондриальный источник может работать очень долго, правда, мощность его сравнительно невелика — в 2-3 раза меньше, чем гликолитического источника, и в 5 раз меньше мощности креатинфосфатного.
Особенности организации энергопродукции в различных тканях организма. Разные ткани обладают различной насыщенностью митохондриями. Меньше всего их в костях и белом жире, больше всего — в буром жире, печени и почках. Довольно много митохондрий в нервных клетках. Мышцы не обладают высокой концентрацией митохондрий, но ввиду того, что скелетные мышцы — самая массивная ткань организма (около 40 % от массы тела взрослого человека), именно потребности мышечных клеток во многом определяют интенсивность и направленность всех процессов энергетического обмена. И.А. Аршавский называл это «энергетическим правилом скелетных мышц».
С возрастом происходит изменение сразу двух важных составляющих энергетического обмена: изменяется соотношение масс тканей, обладающих разной метаболической активностью, а также содержание в этих тканях важнейших окислительных ферментов. В результате энергетический обмен претерпевает достаточно сложные изменения, но в целом его интенсивность с возрастом снижается, причем весьма существенно.
Энергетика живой клетки
Неспособные к фотосинтезу клетки (например, человека) получают энергию из пищи, которой служит или биомасса растений, созданная в результате фотосинтеза, или биомасса других живых существ, питающихся растениями, или останки любых живых организмов.
Питательные вещества (белки, жиры и углеводы) преобразуются животной клеткой в ограниченный набор низкомолекулярных соединений - органических кислот, построенных из атомов углерода, которые с помощью специальных молекулярных механизмов окисляются до углекислоты и воды. При этом освобождается энергия, она аккумулируется в форме электрохимической разности потенциалов на мембранах и используется для синтеза АТФ или напрямую для совершения определенных видов работы.
История изучения проблем преобразования энергии в животной клетке, как и история фотосинтеза, насчитывает более двух веков.
У аэробных организмов окисление углеродных атомов органических кислот до углекислого газа и воды протекает с помощью кислорода и называется внутриклеточным дыханием, которое происходит в специализированных частицах - митохондриях. Трансформация энергии окисления осуществляется ферментами, расположенными в строгом порядке во внутренних мембранах митохондрий. Эти ферменты составляют так называемую дыхательную цепь и работают как генераторы, создавая разность электрохимических потенциалов на мембране, за счет которой синтезируется АТФ, подобно тому, как это происходит при фотосинтезе.
Основная задача и дыхания и фотосинтеза — поддерживать соотношение АТФ/АДФ на определенном уровне, далеком от термодинамического равновесия, что и позволяет АТФ служить донором энергии, смещая равновесие тех реакций, в которых он участвует.
Основными энергетическими станциями живых клеток служат митохондрии — внутриклеточные частицы размером 0,1-10μ, покрытые двумя мембранами. В митохондриях свободная энергия окисления продуктов питания превращается в свободную энергию АТФ. Когда АТФ соединяется с водой, при нормальных концентрациях реагирующих веществ, выделяется свободная энергия порядка 10 ккал/моль.
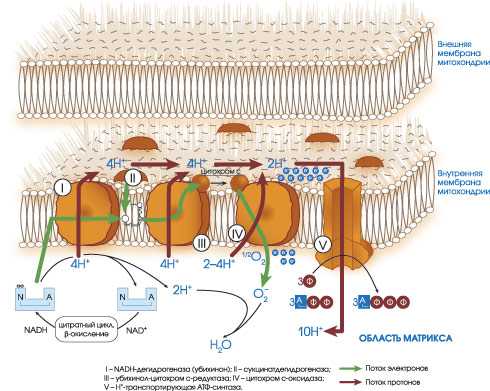
В неорганической природе смесь водорода и кислорода носит название «гремучей»: достаточно небольшой искры, чтобы произошел взрыв - мгновенное образование воды с огромным выделением энергии в виде тепла. Задача, которую выполняют ферменты дыхательной цепи: произвести «взрыв» так, чтобы освобождающаяся энергия была запасена в форме, пригодной для синтеза АТФ. Что они и делают: упорядоченно переносят электроны от одного компонента к другому (в конечном счете, на кислород), постепенно понижая потенциал водорода и запасая энергию.
О масштабах этой работы говорят следующие цифры. Митохондрии взрослого человека среднего роста и веса перекачивают через свои мембраны около 500 г ионов водорода в день, образуя мембранный потенциал. За это же время Н + -АТФ-синтаза производит около 40 кг АТФ из АДФ и фосфата, а использующие АТФ процессы гидролизуют всю массу АТФ назад в АДФ и фосфат.
Исследования показали, что митохондриальная мембрана действует как трансформатор напряжения. Если передавать электроны субстрата от НАДН прямо к кислороду сквозь мембрану, возникнет разность потенциалов около 1 В. Но биологические мембраны - двухслойные фосфолипидные пленки не выдерживают такую разность - возникает пробой. Кроме того, для производства АТФ из АДФ, фосфата и воды требуется всего 0,25 В, значит, нужен трансформатор напряжения. И задолго до появления человека клетки «изобрели» такой молекулярный прибор. Он позволяет в четыре раза увеличить ток и за счет энергии каждого передаваемого от субстрата к кислороду электрона перенести через мембрану четыре протона благодаря строго согласованной последовательности химических реакций между молекулярными компонентами дыхательной цепи.
Итак, два главных пути генерации и регенерации АТФ в живых клетках: окислительное фосфорилирование (дыхание) и фотофосфорилирование (поглощение света), — хотя и поддерживаются разными внешними источниками энергии, но оба зависят от работы цепочек каталитических ферментов, погруженных в мембраны: внутренние мембраны митохондрий, тилакоидные мембраны хлоропластов или плазматические мембраны некоторых бактерий.
2. Энергетический обмен (катаболизм, диссимиляция)
В любой клетке главным источником энергии для всех протекающих в ней процессов служит универсальное энергетическое соединение — АТФ.
АТФ образуется в результате присоединения к АДФ (аденозиндифосфату) одного остатка фосфорной кислоты. Этот процесс называется фосфорилированием :
В молекуле АТФ есть две богатые энергией химические связи. Это связи между остатками фосфорной кислоты. Такие высокоэнергетические связи называют макроэргическими . При разрыве одной макроэргической связи АТФ превращается в АДФ и выделяется около \(40\) кДж/моль энергии.
Энергетический обмен (диссимиляция, катаболизм) — это реакции расщепления и окисления органических веществ, протекающие с выделением энергии, частично расходующейся на образование АТФ.
В кислородсодержащей среде (у аэробных организмов) диссимиляция протекает в три этапа: подготовительный, бескислородный и кислородный. В результате образуются простые неорганические вещества.
В бескислородной среде (у анаэробных организмов), а также при недостатке кислорода у аэробных организмов, энергетический обмен протекает в два этапа: подготовительный и бескислородный. В этом случае количество запасённой энергии намного меньше, чем в присутствии кислорода.
На подготовительном этапе большие молекулы органических веществ распадаются до более простых: из полисахаридов образуются моносахариды, из жиров — смесь глицерина и жирных кислот, а из белков — смесь аминокислот.
На подготовительном этапе АТФ не образуется, а небольшое количество выделяющейся энергии рассеивается.
На втором этапе происходит расщепление продуктов подготовительного этапа под действием ферментов. Кислород при этом не используется.
Бескислородный этап расщепления глюкозы имеет название гликолиз. Этот процесс протекает в цитоплазме клеток.
При гликолизе происходит несколько реакций, в результате которых из молекулы глюкозы C 6 H 12 O 6 образуется \(2\) молекулы пировиноградной кислоты (ПВК) C 3 H 4 O 3 , а также \(2\) молекулы АТФ. В них запасается около \(40\) % выделившейся энергии, остальные \(60\) % рассеиваются.
Образовавшаяся пировиноградная кислота в анаэробных условиях превращается в молочную кислоту C 3 H 6 O 3 :
Такой процесс происходит в клетках животных, некоторых грибов и бактерий. Молочная кислота может образоваться и в мышцах человека при длительных нагрузках и недостатке кислорода. Тогда мышцы начинают болеть.
В растительных клетках и клетках дрожжей из пировиноградной кислоты образуется этиловый спирт C 2 H 5 OH и углекислый газ CO 2 , т. к. происходит спиртовое брожение :
C 6 H 12 O 6 + 2 H 3 PO 4 + 2 АДФ = 2 C 2 H 5 OH + 2 CO 2 + 2 АТФ + 2 H 2 O .
В кислородной среде после гликолиза протекает третий этап энергетического обмена — кислородный, или клеточное дыхание. Полное кислородное расщепление осуществляется на мембранах митохондрий.
Этот этап тоже является многостадийным. В нём выделяют два процесса — цикл Кребса и окислительное фосфорилирование .
Сущность третьего (кислородного) этап заключается в окислении ПВК до углекислого газа и воды При этом выделившаяся энергия запасается в \(36\) молекулах АТФ (\(2\) — в цикле Кребса и \(34\) — при окислительном фосфорилировании).
Так как \(2\) молекулы АТФ образуются при гликолизе, то в сумме при полном окислении одной молекулы глюкозы образуется \(38\) молекул АТФ.
C 6 H 12 O 6 + 6 O 2 = 6 CO 2 + 6 H 2 O + 38 АТФ .
В реакциях энергетического обмена используется не только глюкоза, но и липиды, белки. Но главным источником энергии в большинстве клеток являются углеводы.

Слово «энергия» прочно вошло в обиходный словарь начала XXI в. В теленовостях обсуждают цены на «энергоносители»; предприятия мечтают об «энергичном» руководителе; в кулуарах культуры модно говорить об «энергетике» выступления или картины; обывателей стращают «энергетическими вампирами».
И все же признаем, положа руку на сердце: устойчивых представлений о смысле этого слова в умах большинства людей как не было, так и нет. И неудивительно. Нашему разуму гораздо легче и проще воспринять представления о строении вещей, нежели о силах, приводящих их в движение. Однако о существовании таких таинственных сил человек, безусловно, знал еще в глубокой древности. Мифология объединила их общим понятием «Дух» и отнесла к компетенции богов. Первой попыткой человека отнять у бессмертных власть над этими силами было укрощение огня. Создание движущихся машин и механизмов позволило лучше понять природные явления, вызывающие перемещение объектов, что привело в итоге к формулированию научных концепций относительно энергии в целом, и энергетики живых организмов, в частности.
Ключевые процессы, определяющие разницу между живой и неживой природой, происходят на клеточном уровне. Решающую роль в трансформации и переносе энергии внутри живой клетки играет движение электронов. Но энергия никоим образом не зарождается внутри самих клеток: она поступает извне. Специальные молекулярные механизмы лишь замедляют ее движение в десятки тысяч раз, позволяя другим молекулам частично использовать эту энергию при выполнении полезной для клетки работы. Нерастраченная энергия уходит во внешнюю среду в виде тепла.
vlkhait 27.06.2009 17:38 Ответить
Статья касается отличия живой и неживой природы. Эту разницу автор усматривает в процессах переноса энергии внутри живой клетки. Я не подвергаю сомнению содержание высказанных автором идей с точки зрения ее стремления к истине. Я внимательно изучаю представленный автором материал, чтобы самому добраться до понимания энергетических преобразований в живом организме, несмотря на то, что у меня инженерное образование и я не имею глубоких знаний в биологии. Тем не менее, тема меня очень интересует, в следствие интереса к созданию искусственного интеллекта и искусственной жизни.
Если говорить о разнице между живой и неживой природой, то мне кажется, рассматривать в качестве ключевого момента перенос энергии в живой клетке излишне, поскольку достаточно того, что живые организмы имеют клеточное строение а неживые нет. С другой стороны подход к пониманию отличия живой и неживой природы с точки зрения внутреннего строения, мне кажется, не плодотворным и является трудным для понимания большинства людей, в том числе, и профессионалов в других областях знания. Более плодотворный подход это инженерный подход т.е. с позиции черного ящика и зависит от внешнего проявления живых и неживых объектов. Их может наблюдать любой человек и отличать между собой живые и неживые объекты. Мыслящий человек непременно обнаружит разницу, найдет и объяснит эту разницу.
Читайте также:
