Использование глицина для оценки метаболизма белков
Добавил пользователь Евгений Кузнецов Обновлено: 01.02.2026
Глицин - простейшая заменимая аминокислота, входящая в состав белков. Она отличается сладковатым вкусом, отчего и получила свое название, что в переводе с древнегреческого означает «сладкий».
То, что это соединение является заменимой аминокислотой, еще не значит, что его можно полностью заменить. Согласно последним данным, суточная потребность в глицине составляет 3 г.
Глицин и обмен веществ
Основной источник получения энергии в организме - глюкоза. Происходит этот процесс в митохондриях каждой клетки с помощью цикла Кребса. Как действует глицин в этом случае? Он оказывает влияние именно на активность всех протекающих реакций в цикле Кребса. И если в организме не хватает кислорода, благодаря глицину он будет использован максимально эффективно. То есть клетки смогут выполнять свои функции даже в условиях гипоксии.
Недостаток глицина в организме наблюдается довольно редко. Однако проблемы, возникающие из-за его нехватки, очень серьезные. В первую очередь страдают обменные процессы, протекающие особенно в коре головного мозга. Чтобы все его клетки функционировали нормально, нужно много энергии, то есть большое количество молекул АТФ.
Нервная ткань синтезирует эту аминокислоту в необходимых количествах, но при усиленных нагрузках, например при стрессе, ее выработка повышается в несколько раз. Как работает глицин в организме при стрессе? В такие моменты вовсе не помешает дополнительная доза этой аминокислоты, поскольку происходит включение процессов защитного торможения и одновременная активация клеточного дыхания. Таким образом, глицин помогает нейронам лучше работать на фоне стресса.
Как еще глицин влияет на организм? С участием этой аминокислоты происходит синтез глутатиона, являющегося мощным эндогенным антиоксидантом. Поэтому препарат Глицин часто назначают, если есть риск повреждения клеток организма свободными радикалами.
Также глицин участвует в синтезе многих соединений:
- небелковой, железосодержащей части гемоглобина, называемой гемами;
- конъюгированных желчных кислот;
- липидов;
- креатинина;
- коферментов NAD и FAD;
- пептидов.
И все же одно из главных свойств глицина, благодаря которому его широко используют в медицине, - соединение этой аминокислоты с глициновыми рецепторами, находящимися как в головном, так и в спинном мозге. Глицин снижает выработку аминокислот, которые возбуждающе влияют на организм, и в то же время стимулирует синтез ГАМК - гамма-аминомасляной кислоты, являющейся основным нейромедиатором центрального торможения в нервной системе. Таким образом, становится очевидным, что польза глицина для организма очень велика.
В чем заключается необходимость приема глицина в виде лекарственного препарата
При нормальном функционировании организма глицин вырабатывается в достаточном количестве. Однако при острой потребности в этой аминокислоте, например при стрессе или чрезмерной физической нагрузке, ее внутренние резервы быстро расходуются, а восполнить постепенно возникающий недостаток не так-то и просто. Ведь при неблагоприятных условиях в организме появляются и другие задачи. Поэтому существует риск развития дефицита глицина. В связи с этим возникает потребность в дополнительном поступлении этой аминокислоты извне. Причем компенсировать недостаток только продуктами, содержащими ее, невозможно. Для этого необходимо начинать принимать глицин в виде лекарственного препарата. И делать это следует правильно.
Наиболее совершенная форма лекарственного препарата Глицин - это таблетки для приема трансбуккально и подъязычно. Уникальность этой формы в том, что препарат создан с использованием технологии микрокапсулирования. То есть каждая молекула глицина заключена в отдельную капсулу, благодаря чему не разрушается, но в то же время сохраняет высокую биодоступность. Процесс всасывания начинается в ротовой полости, где вещество легко проникает через слизистую в ток крови и быстро разносится по организму. У человека при регулярном приеме Глицина не возникает привыкания к препарату. Кроме того, такое поступление аминокислоты извне является толчком для ее выработки собственными силами организма.
Использование глицина для оценки метаболизма белков
1. Алхазова Р.Т. Коррекция холодового спазма кровеносных сосудов при резорбтивном и местном действии нестероидных противовоспалительных средств, анестетиков и спазмолитиков миотропного действия / Р.Т. Алхазова [и др.] // Известия Дагестанского государственного педагогического университета. Естественные и точные науки. - 2013. - №3 (24). - С. 40-45.
3. Влияние дибикора и таурина на мозговой кровоток в постишемическом периоде / Абдулмаджид Али Кулейб [и др.] // Фармация. - 2009. - №1. - С. 45-47.
4. Клиническая эффективность растительного антиоксиданта «сосудистый доктор» у больных с сердечно-сосудистой патологией / В.С. Федоров [и др.] // Фармация. - 2005. - №5. - С.43-45.
5. Кодониди И.П. Компьютерное прогнозирование биомолекул / И.П. Кодониди [и др.] // Международный журнал экспериментального образования. - 2013. - №11-1. - С. 153-154.
6. Кручинина Л.Н. Изучение эффективности лечения больных язвенной болезнью желудка и двенадцатиперстной кишки в условиях санатoрия - профилактория / Л.Н. Кручинина, М.Н. Ивашев // Здравоохранение Российской Федерации. - 1981. - №4. - С. 20-22.
7. Пужалин А.Н. Воспроизводимость экспериментальной модели сахарного диабета I типа / А.Н. Пужалин [и др.] // Аллергология и иммунология. - 2007. - Т.8 - №1. - С. 214.
11. Омаров Ш.М. Апитерапия: продукты пчеловодства в мире медицины // Международный журнал прикладных и фундаментальных исследований. - 2012. - №9. - С. 36.
13. Седова Э.М. Место миокардиального цитопротектора предуктала МВ в лечении хронической сердечной недостаточности у женщин в перименопаузе // Вестник Волгоградского государственного медицинского университета. - 2008. - №1. - С.34-35.
14. Седова Э.М. Экспериментально-клиническое обоснование применения предуктала МВ и дибикора у больных женщин хронической сердечной недостаточностью в перименопаузе: дис. … канд. мед. наук. ГОУВПО «Волгоградский государственный медицинский университет». - Волгоград, 2008.
15. Сулейманов С.Ш. Инструкции по применению лекарственных препаратов: закон новый, проблемы прежние / С.Ш. Сулейманов, Я.А. Шамина // Проблемы стандартизации в здравоохранении. - 2011. - №11-12. - С.13-16.
16. Целенаправленный поиск и фармакологическая активность ГАМК-позитивных соединений / И.П. Кодониди, А.В. Арльт, Э.Т. Оганесян, М.Н. Ивашев // Государственное образовательное учреждение высшего профессионального образования «Пятигорская гос. фармацевтическая акад. Федерального агентства по здравоохранению и социальному развитию», Кафедры органической химии и фармакологии. - Пятигорск, 2011.
Терапевтическая эффективность лекарственных средств, применяемых при различных заболеваниях, зависит от их превращения в организме [1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17].
Цель исследования. Установить основные пути превращения в организме человека лекарственного средства глицин.
Материал и методы исследования
Анализ литературных данных и результатов практического применения, представленных в клинических исследованиях.
Результаты исследования их обсуждение
Аминоуксусная кислота (глицин) - это простейшая алифатическая аминокислота, единственная протеиногенная аминокислота, не имеющая оптических изомеров. Получают аминоуксусную кислоту при химической реакции аммиака и хлоруксусной кислоты. Аминоуксусная кислота вырабатывается из хрящевой ткани крупного рогатого скота. В промышленных масштабах глицин получают гидролизом соевого белка. Аминоуксусная кислота метаболизируется до воды и углекислого газа, однако, глицин участвует в метаболизме органических соединений клеток организма.
Аминоуксусная кислота вместе с цистеином и глутаминовой кислотой участвует в синтезе глутатиона. Значение глутатиона в клетке определяется его антиоксидантными свойствами. Фактически глутатион защищает клетку от таких токсичных агентов, как свободные радикалы, и активно участвует в регулировании окислительно-восстановительного потенциала клетки. В антиоксидантную систему глутатиона входят три глутатионзависимых фермента: глутатионпероксидаза, глутатионредуктаза и глутатионтрансфераза. Глутатион участвует в синтезе лейкотриенов: главная антиоксидантная роль глутатиона заключается в защите иммунных клеток, в первую очередь лимфоцитов. Этот комплекс также важен в качестве гидрофильной молекулы, которая присоединяется ферментами печени к гидрофобным токсическим веществам в процессе их биотрансформации с целью выведения из организма, как правило, через желчь. Синтезируется глутатион в каждой клетке, но больше всего в гепатоцитах. Печень обеспечивает около 90% всего циркулирующего глутатиона при физиологических условиях. Глутатион обеспечивает выработку основных детоксикационных ферментов и способствует регенерации самих клеток печени. Глутатион - соединение, защищающее сульфгидрильные группы гемоглобина и мембрану эритроцитов от окислителей.
Из аминоуксусной и янтарной кислот в клетках синтезируются порфирины. Наиболее известные биологически активные соединения на основе порфиринов в организме: гемоглобин, миоглобин, цитохромы, каталазы и др. Аминоуксусная кислота для вхождения в реакцию образования порфиринов модулируется (активируется) пиридоксальфосфатом (активированная форма пиридоксина, витамина - В-6).
В синтезе пуринового ядра в пуриновых основаниях принимают участие аминокислоты глицин, аспарагин и др. Доказано, что глицин непосредственно участвует в синтезе инозиновой кислоты, которая является предшественником пуриновых нуклеотидов в составе нуклеиновых кислот. Пуриновые нуклеотиды образуются в большинстве клеток, но главным образом в печени и затем распространяются с током крови по всему организму. Пуриновые нуклеотиды являются составной частью нуклеиновых кислот, макроэргических соединений, коферментов. Достаточный синтез пуриновых оснований лежит в основе оптимального уровня обновления нуклеиновых кислот и белков в организме, стабильности энергетического метаболизма. Ингибирование синтеза пуриновых нуклеотидов приводит к замедлению роста тканей. При нарушении распада пуриновых нуклеотидов накапливаются продукты их метаболизма, в первую очередь мочевая кислота.
Аминоуксусная кислота входит в состав многих косметологических средств, в качестве увлажняющего компонента: замедляет преждевременное старение кожи, защищает клеточные мембраны от разрушительного воздействия свободных радикалов и способствует улучшению обменных процессы в клетках. Также применяется в качестве загустителя. Глутатион применяют в качестве ингибитора меланина в косметической промышленности. В таких странах, как Япония и Филиппины, этот продукт продается в виде мыла для отбеливания кожи. Аминоуксусную кислоту также добавляют в процессе изготовления мыл взамен шелковым волокнам. Он придает гладкость, блеск и кремовый цвет, образует пену, не оказывает раздражающего действия.
Выводы
Аминоуксусная кислота участвует в процессах метаболизма белковых соединений в организме человека и этим обеспечивает фармакологический эффект при применении в профилактике и терапии заболеваний.
Алгоритм метаболизма

автор: А. Ю. Барановский, д. м. н., профессор, заведующий кафедрой гастроэнтерологии и диетологии Северо-Западного государственного медицинского университета им. И. И. Мечникова, врач высшей категории
Решение организационных вопросов питания у лиц старших возрастов, разработка и назначение индивидуализированных рационов рационального, профилактического и лечебного питания в существенной степени зависит от правильной оценки врачом нутриционного статуса пожилого человека, особенностей состояния обменных процессов. Именно поэтому профессионально грамотный клиницист, участвующий в решении проблем лечебно-профилактического питания у лиц пожилого и старческого возраста, должен быть достаточно хорошо ориентирован в области основ клинической биохимии и физиологии питания стареющего организма.
Белковый обмен
Белки — сложные азотсодержащие биополимеры, мономерами которых служат аминокислоты (органические соединения, содержащие карбоксильные и аминные группы). Их биологическая роль многообразна. Белки выполняют в организме пластические, каталитические, гормональные, транспортные и другие функции, а также обеспечивают специфичность. Значение белкового компонента питания заключается прежде всего в том, что он служит источником аминокислот.
Аминокислоты делятся на эссенциальные и неэссенциальные в зависимости от того, возможно ли их образование в организме из предшественников. К незаменимым аминокислотам относятся гистидин, лейцин, изолейцин, лизин, метионин, фенилаланин, триптофан и валин, а также цистеин и тирозин, синтезируемые соответственно из метионина и фенилаланина. Девять заменимых аминокислот (аланин, аргинин, аспарагиновая и глутамовая кислоты, глутамин, глицин, пролин и серин) могут отсутствовать в рационе, так как способны образовываться из других веществ. В организме также существуют аминокислоты, которые продуцируются путем модификации боковых цепей вышеперечисленных (например, компонент коллагена — гидроксипролин — и сократительных белков мышц — 3-метилгистидин).
Большинство аминокислот имеют изомеры (D- и L-формы), из которых только L-формы входят в состав белков человеческого организма. D-формы могут участвовать в метаболизме, превращаясь в L-формы, однако утилизируются гораздо менее эффективно.
Взаимоотношение аминокислот
По химическому строению аминокислоты делятся на двухосновные, двухкислотные и нейтральные с алифатическими и ароматическими боковыми цепями, что имеет большое значение для их транспорта, поскольку каждый класс аминокислот обладает специфическими переносчиками. Аминокислоты с аналогичным строением обычно вступают в сложные, часто конкурентные взаимоотношения.
Так, ароматические аминокислоты (фенилаланин, тирозин и триптофан) близкородственны между собой. Хотя фенилаланин является незаменимой, а тирозин — синтезируемой из него заменимой аминокислотой, наличие тирозина в рационе как будто бы «сберегает» фенилаланин. Если фенилаланина недостаточно или его метаболизм нарушен (например, при дефиците витамина С) — тирозин становится незаменимой аминокислотой. Подобные взаимоотношения характерны и для серосодержащих аминокислот: незаменимой — метионина — и образующегося из него цистеина.
Триптофан в ходе превращений, для которых необходим витамин В 6 (пиридоксин), включается в структуру НАД и НАДФ, то есть дублирует роль ниацина. Приблизительно половина обычной потребности в ниацине удовлетворяется за счет триптофана: 1 мг ниацина пищи эквивалентен 60 мг триптофана. Поэтому состояние пеллагры может развиваться не только при недостатке витамина РР в рационе, но и при нехватке триптофана или нарушении его обмена, в том числе вследствие дефицита пиридоксина.
Аминокислоты также делятся на глюкогенные и кетогенные, в зависимости от того, могут ли они при определенных условиях становиться предшественниками глюкозы или кетоновых тел (см. табл. 1).
Таблица 1. Классификация аминокислот
| Виды | Эссенциальные аминокислоты | Неэссенциальные аминокислоты |
| Алифатические | Валин (Г), лейцин (К), изолейцин (Г, К) | Глицин (Г), аланин (Г) |
| Двухосновные | Лизин (К), гистидин (Г, К)* | Аргинин (Г)* |
| Ароматические | Фенилаланин (Г, К), триптофан (Г, К) | Тирозин (Г, К)** |
| Оксиаминокислоты | Треонин (Г, К) | Серин (Г) |
| Серосодержащие | Метионин (Г, К) | Цистеин (Г)** |
| Дикарбоновые и их амиды | Глутамовая кислота (Г), глутамин (Г), аспарагиновая кислота (Г), аспарагин (Г) | |
| Иминокислоты | Пролин (Г) |
Обозначения: Г — глюкогенные, К — кетогенные аминокислоты; * — гистидин незаменим у детей до года; ** — условно-незаменимые аминокислоты (могут синтезироваться из фенилаланина и метионина).
Необходимые азотсодержащие соединения
Поступление азотсодержащих веществ с пищей происходит в основном за счет белка и в менее значимых количествах — свободных аминокислот и других соединений. В животной пище основное количество азота содержится в виде белка. В продуктах растительного происхождения большая часть азота представлена небелковыми соединениями, также в них содержится множество аминокислот, которые не встречаются в организме человека и зачастую не могут метаболизироваться им.
Синтез пуриновых оснований
Человек не нуждается в поступлении с пищей нуклеиновых кислот. Пуриновые и пиримидиновые основания синтезируются в печени из аминокислот, а избыток этих оснований, поступивших с пищей, выводится в виде мочевой кислоты.
В синтезе пиримидиновых колец принимает участие витамин B 12 , для образования пуриновых структур необходима фолиевая кислота. Именно поэтому дефицит этих нутриентов отражается прежде всего на органе с высоким уровнем пролиферации, где идет наиболее интенсивный синтез нуклеиновых кислот, — на кроветворной ткани.
Прием белка
Обычный (но не оптимальный) ежедневный прием белка у среднестатистического человека составляет приблизительно 100 г. К ним присоединяется примерно 70 г белка, секретируемого в полость желудочно-кишечного тракта. Из этого количества абсорбируется около 160 г. Самим организмом в сутки синтезируется в среднем 240-250 г белка. Такая разница между поступлением и эндогенным преобразованием свидетельствует об активности процессов обратного восстановления исходного сложного химического соединения из «осколков», образовавшихся при его метаболизме (ресинтеза белков из аминокислот, а аминокислот из аммиака и «углеродных скелетов» аминокислот).
Азотное равновесие
Для здорового человека характерно состояние азотного равновесия, когда потери белка (с мочой, калом, эпидермисом и т. п.) соответствуют его количеству, поступившему с пищей. При преобладании катаболических процессов возникает отрицательный азотный баланс, который характерен для низкого потребления азотсодержащих веществ (низкобелковых рационов, голодания, нарушения абсорбции белка) и многих патологических процессов, вызывающих интенсификацию распада (опухолей, ожоговой болезни и т. п.). При доминировании синтетических процессов количество вводимого азота преобладает над его выведением, и возникает положительный азотный баланс, характерный для детей, беременных женщин и реконвалесцентов после тяжелых заболеваний.
После прохождения энтерального барьера белки поступают в кровь в виде свободных аминокислот. Следует отметить, что клетки слизистой оболочки желудочно-кишечного тракта могут метаболизировать некоторые аминокислоты (в том числе глутамовую кислоту и аспарагиновую кислоту в аланин). Способность энтероцитов видоизменять эти аминокислоты, возможно, позволяет избежать токсического эффекта при их избыточном введении.
Аминокислоты, как поступившие в кровь при переваривании белка, так и синтезированные в клетках, в крови образуют постоянно обновляющийся свободный пул аминокислот, который составляет около 100 г.
Путь белка
75 % аминокислот, находящихся в системной циркуляции, представлены аминокислотами с ветвящимися цепями (лейцином, изолейцином и валином). Из мышечной ткани в кровоток выделяются аланин, который является основным предшественником синтеза глюкозы, и глутамин. Многие свободные аминокислоты подвергаются трансформации в печени. Часть свободного пула инкорпорируется в белки организма и при их катаболизме вновь поступает в кровоток. Другие непосредственно подвергаются катаболическим реакциям. Некоторые свободные аминокислоты используются для синтеза новых азотсодержащих соединений (пурина, креатинина, адреналина) и в дальнейшем деградируют, не возвращаясь в свободный пул, в специфичные продукты распада.
Роль печени
Постоянство содержания различных аминокислот в крови обеспечивает печень. Она утилизирует примерно ⅓ всех аминокислот, поступающих в организм, что позволяет предотвратить скачки в их концентрации в зависимости от питания.
Первостепенная роль печени в азотном и других видах обмена обеспечивается ее анатомическим расположением — продукты переваривания попадают по воротной вене непосредственно в этот орган. Кроме того, печень непосредственно связана с экскреторной системой — билиарным трактом, что позволяет выводить некоторые соединения в составе желчи. Гепатоциты — единственные клетки, обладающие полным набором ферментов, участвующих в аминокислотном обмене. Здесь выполняются все основные процессы азотного метаболизма: распад аминокислот для выработки энергии и обеспечения глюконеогенеза, образование заменимых аминокислот и нуклеиновых кислот, обезвреживание аммиака и других конечных продуктов. Печень является основным местом деградации большинства незаменимых аминокислот (за исключением аминокислот с ветвящимися цепями).
Инсулиновый ответ
Синтез азотсодержащих соединений (белка и нуклеиновых кислот) в печени весьма чувствителен к поступлению их предшественников из пищи. После каждого приема пищи наступает период повышенного внутрипеченочного синтеза белков, в том числе альбумина. Аналогичное усиление синтетических процессов происходит и в мышцах. Эти реакции связаны прежде всего с действием инсулина, который секретируется в ответ на введение аминокислот и/или глюкозы.
Некоторые аминокислоты (аргинин и аминокислоты с ветвящимися цепями) усиливают продукцию инсулина в большей степени, чем остальные. Другие (аспарагин, глицин, серин, цистеин) стимулируют секрецию глюкагона, который усиливает утилизацию аминокислот печенью и воздействует на ферменты глюконеогенеза и аминокислотного катаболизма. Благодаря этим механизмам происходит снижение уровня аминокислот в крови после поступления их с пищей. Действие инсулина наиболее выражено для аминокислот, содержащихся в кровотоке в свободном виде (аминокислот с ветвящимися цепями), и малозначимо для тех, которые транспортируются в связанном виде (триптофана). Обратное инсулину влияние на белковый метаболизм оказывают глюкокортикостероиды.
Аминокислоты на «экспорт»
Печень обладает повышенной скоростью синтеза и распада белков по сравнению с другими тканями организма (кроме поджелудочной железы). Это позволяет ей синтезировать «на экспорт», а также быстро обеспечивать лабильный резерв аминокислот в период недостаточного питания за счет распада собственных белков.
Особенность внутрипеченочного белкового синтеза заключается в том, что он усиливается под действием гормонов, которые в других тканях производят катаболический эффект. Так, при голодании белки мышц, для обеспечения организма энергией, подвергаются распаду, а в печени одновременно усиливается синтез белков, являющихся ферментами глюконеогенеза и мочевинообразования.
Избыток белка и голодание
Прием пищи, содержащей избыток белка, приводит к интенсификации синтеза в печени и в мышцах, образованию избыточных количеств альбумина и деградации излишка аминокислот до предшественников глюкозы и липидов. Глюкоза и триглицериды утилизируются как горючее или депонируются, а альбумин становится временным хранилищем аминокислот и средством их транспортировки в периферические ткани.
При голодании уровень альбумина прогрессивно снижается, а при последующей нормализации поступления белка медленно восстанавливается. Поэтому хотя альбумин и является показателем белковой недостаточности, он низкочувствителен и не реагирует оперативно на изменения в питании.
7 из 10 эссенциальных аминокислот деградируют в печени — либо образуя мочевину, либо впоследствии используясь в глюконеогенезе. Мочевина преимущественно выделяется с мочой, но часть ее поступает в просвет кишечника, где подвергается уреазному воздействию микрофлоры. Аминокислоты с ветвящимися цепями катаболизируются в основном в почках, мышцах и головном мозге.
Роль мышц
Мышцы синтезируют ежедневно 75 г белка. У среднего человека они содержат 40 % от всего белка организма. Хотя белковый метаболизм происходит здесь несколько медленнее, чем в других тканях, мышечный белок представляет собой самый большой эндогенный аминокислотный резерв, который при голодании может использоваться для глюконеогенеза.
Мышцы являются основной мишенью воздействия инсулина: здесь под его влиянием усиливается поступление аминокислот, увеличивается синтез мышечного белка и снижается распад.
В процессе превращений в мышцах образуются аланин и глутамин, их условно можно считать транспортными формами азота. Аланин непосредственно из мышц попадает в печень, а глутамин вначале поступает в кишечник, где частично превращается в аланин. Поскольку в печени из аланина происходит синтез глюкозы, частично обеспечивающий мышцу энергией, получающийся круго- оборот получил название глюкозо- аланинового цикла.
К азотсодержащим веществам мышц также относятся высокоэнергетичный креатин-фосфат и продукт его деградации креатинин. Экскреция креатинина обычно рассматривается как мера мышечной массы. Однако это соединение может поступать в организм с высокобелковой пищей и влиять на результаты исследования содержания его в моче. Продукт распада миофибриллярных белков — 3-метилгистидин — экскретируется с мочой в течение короткого времени и является достаточно точным показателем скорости распада в мышцах — при мышечном истощении скорость его выхода пропорционально снижается.
Механизм голодания
В отсутствие пищи синтез альбумина и мышечного белка замедляется, но продолжается деградация аминокислот. Поэтому на начальном этапе голодания мышцы теряют аминокислоты, которые идут на энергетические нужды. В дальнейшем организм адаптируется к отсутствию новых поступлений аминокислот (снижается потребность в зависящем от белка глюконеогенезе за счет использования энергетического потенциала кетоновых тел) и потеря белка мускулатуры уменьшается.
Хотите больше информации по вопросам диетологии?
Приобретите информационно-практический журнал «Практическая диетология» в электронном или печатном формате! 6 , который является кофактором ферментов трансаминирования, обеспечивающих синтез заменимых и первый этап катаболизма всех аминокислот. Поэтому повышенный уровень потребления белка требует адекватного повышения количества пиридоксина.
Современные рекомендации по обеспечению пожилых людей и стариков основными питательными веществами, в первую очередь белками, свидетельствуют о целесообразном некотором снижении суточного количества белковых продуктов в пищевом рационе до 0,75-0,8 г/кг веса. Это связано с тем, что интенсивность основных физиологических функций с каждым десятилетием жизни человека после 50 лет снижается почти на 10 % (Rogers J., Jensen G., 2004), потребность белка уменьшается за счет инволюции синтетических и пластических процессов и ферментообразования, продукции гормонов, ряда биологически активных веществ, обеспечения мышечной деятельности и т. д.
Рекомендуемые нормы потребления для белка с учетом приведенных выше показателей составляют 55-62 г/сут (для мужчины весом 77 кг в возрасте 60-70 лет) и 45-52 г/сут (для женщины весом 65 кг в возрасте 60-70 лет) по выводам IV Американского национального исследования по оценке здоровья и питания (2006).
Вместе с тем установлено, что при сохранении физической активности пожилых людей (профессиональной физической нагрузки, занятий физкультурой, работы на дачном участке и т. п.) для поддержания азотного равновесия организма требуется повышение белкового обеспечения пожилого человека в количестве 1-1,25 г/кг в день. Эта же квота пищевого белка полностью обеспечит потребности пожилого человека, находящегося в состоянии стресса, болезни или ранения (Lowenthal D. T., 1990).
Рис. 1. Влияние пищевых веществ на развитие болезней избыточного питания (по А. А. Покровскому)
Дефицит белка = старение
Важно отметить, что организм пожилого человека очень чувствителен как к дефициту экзогенно поступающих белков, так и к их избытку. В условиях белкового дефицита прогрессирующе развиваются процессы дистрофии и атрофии клеточных структур, в первую очередь мышечной ткани, слизистых оболочек (желудочно-кишечного тракта, дыхательной системы и др.), паренхиматозных органов (поджелудочной железы, печени, эндокринных желез и др.), структур иммунной системы. Белковый дефицит питания активизирует процессы старения организма.
Механизмы патологического действия на организм пожилого и старого человека пищевой белковой перегрузки связаны в первую очередь с белковой «агрессией» печени и связанной с этим несостоятельностью ферментных систем, неполной деполимеризацией всех фракций белка, накоплением в крови токсических продуктов незавершенных окислительно-восстановительных реакций и т. д.
Белковая перегрузка
Интоксикационный процесс метаболического генеза при избыточном белковом питании пожилых и старых людей многократно усиливается по причине развития процессов гнилостной кишечной диспепсии в условиях относительной ферментной недостаточности желудка, поджелудочной железы, тонкой кишки и развития синдромов мальдигестии и мальабсорбции, а также кишечного дисбиоза (Барановский А. Ю., Кондрашина Э. А., 2008).
Белковая пищевая перегрузка в рамках интоксикационного синдрома способствует перевозбуждению центральной нервной системы, иногда — состояниям, близким к неврозам. При этом наблюдается повышенный расход витаминов в организме с формированием витаминной недостаточности.
При длительном высокобелковом питании вначале наблюдается компенсаторное усиление, а затем угнетение секреторной функции желудка и поджелудочной железы, повышается риск развития таких заболеваний, как подагра, мочекаменная болезнь.
В следующем выпуске журнала «Практическая диетология» мы продолжим рассказ о геронтологических особенностях основных видов обмена веществ пациентов пожилого и старческого возраста — углеводном и жировом обмене.
Аминокислотный синтез
Аминокислоты — органические биологически важные соединения, в молекуле которых одновременно содержатся карбоксильные (-СООН) и аминные группы (-NH2) , и имеющие боковую цепь, специфичную для каждой аминокислоты. Ключевые элементы аминокислот - углерод (C), водород (H), кислород (O) и азот (N). Прочие элементы находятся в боковой цепи определенных аминокислот.
Как известно, пробиотические микроорганизмы (бактерии) синтезируют различные биологически активные вещества: ранее проведенными исследованиями было установлено, что в микробной биомассе пробиотических культур (бифидобактерий и пропионовокислых бактерий), а также в отработанной культуральной жидкости содержатся антимутагенные вещества , ферменты, витамины группы В , короткоцепочечные жирные кислоты и аминокислоты. Отмечено, например, что пропионовокислые бактерии характеризуются очень хорошо развитой биосинтетической способностью и как представители прокариот способны синтезировать все аминокислоты, входящие в состав клеточных белков.
Одной из важнейших функций аминокислот является их участие в синтезе белков, выполняющих каталитические, регуляторные, запасные, структурные, транспортные, защитные и другие функции. Иными словами, пробиотические микроорганизмы играют огромную роль в процессах белкового синтеза и потому являются весьма ценными источиками аминокислот, ферментов и т.п. К слову, природные аминокислоты являются, как правило, оптически активными L - и D формами, которые трудно разделить, вот почему микробный синтез является ныне основным и экономически выгодным в промышленности.
ПОЛУЧЕНИЕ АМИНОКИСЛОТ . Существует четыре промышленных метода получения аминокислот: 1) экстракция из гидролизата белка; 2) химический синтез; 3) биотрансформация соединений-предшественников в ферментере или клеточном реакторе; 4) микробная ферментация.
Успех промышленного получения аминокислот объясняется тем, что химический синтез соединений-предшественников относительно дешев. Кроме того, для производства практически всех протеиногенных аминокислот разработаны методы ферментации, и имеются штаммы, позволяющие получать большие количества продукта. Во многих случаях такой подход экономически оправдан. Широко используются штаммы, усовершенствованные методами генетической инженерии. К настоящему времени закончено секвенирование генома Corynebacterium glutamicum. Полученная генетическая информация поможет ускорить создание новых высокопродуктивных штаммов. Во многих случаях уже клонированы целые опероны, ответственные за биосинтез аминокислот. Изучаются возможности управления обменом веществ клетки методами так называемой метаболической инженерии.
Для более детального рассмотрения темы промышленного интеза аминокислот следует перейти по кнопке-ссылке:
Стоит особенно отметить, что пропионовокислые бактерии могут синтезировать все аминокислоты за счет ассимиляции азота (NH4)2SO4. Б ифидобактерии , также отличаются образованием данных органических соедиинений. В частности, бифидобактерии выделяются синтезом триптофана, который является биологическим прекурсором серотонина (из которого затем может синтезироваться мелатонин) и ниацина (витамина PP или B3) — водорастворимого витамина, участвующего во многих окислительно-восстановительных реакциях, образовании ферментов, обмене липидов и углеводов в живых клетках.
Одним из примеров практического использования способности пробиотических бактерий к аминокислотному (белковому) синтезу , является использование их заквасок в пищевой промышленности, что позволяет получать продукты сбалансированные по аминокислотному составу. Например, при использовании бифидо- и пропионовокислых бактерий в производстве сырокопченых колбас , происходит значительное накопление в продуктах свободных аминокислот, а сумма незаменимых аминокислот становится выше на 29%. Преимущественное накопление глицина, глютаминовой кислоты, валина, фенилаланина, тирозина, лейцина, изолейцина отражает специфическое совместное воздействие на белки и пептиды тканевых эндопептидаз и экзопептидаз, а также биосинтез белков пропионовокислыми бактериями.
Нашли свое применение пробиоти ки и в сельском хозяйстве. Использование бактерий в качестве продуцента белкового корма является более эффективным, так как бактерии образуют до 75% белка по массе, в то время как дрожжи - не более 60%. Например, использование штаммов Propionibacterium freudenreichii subsp. shermanii, для приготовления белкового корма не требует расхода воздуха и энергозатрат на его подачу, так как данные штаммы пропионовокислых бактерий являются анаэробами. Штаммы обладают широким спектром антимикробного действия, что исключает развитие посторонней микрофлоры в процессе биосинтеза и поэтому не требуется наличие специального оборудования для соблюдения условий стерильности. Возможность утилизации разнообразных отходов отраслей промышленности, использующих природное сырье, при наращивании биомассы штаммов ПКБ с целью приготовления белкового корма решает также экологические проблемы предприятий.
АМИНОКИСЛОТЫ, СИНТЕЗИРУЕМЫЕ БИФИДОБАКТЕРИЯМИ И ПРОПИОНОВОКИСЛЫМИ БАКТИЕРИЯМИ
БИФИДОБАКТЕРИИ
также образуют из неорганических азотистых соединений незаменимые аминокислоты, в частности - аланин , валин , аспарагин , синтезируют триптофан .
ПИЩЕВАЯ ЦЕННОСТЬ АМИНОКИСЛОТ
Все эти биосинтезирующие функции бактерий открывают огромные возможности в сфере создания продуктов функционального питания. В современных условиях неблагоприятной экологии и снижения качества питания, с пособность бактерий к синтезу практически важных веществ (аминокислот, различных белковых соединений, витаминов, короткоцепочечных жирных кислот, полисахаридов и т.п.), является одним из перспективных инструментов в решени вопросов профилактики и лечения алиментарных заболеваний.
Известно более 200 природных аминокислот, из них только 20 входят в состав белков. Эти аминокислоты называют протеиногенными — строящими белки. В организме человека наряду с протеиногенными аминокислотами можно найти и другие, которые играют иную роль, например, орнитин, β-аланин, таурин и др. Но в данном разделе мы рассмотрим лишь свойства 20-ти стандартных (протеиногенных заменимых и незаменимых аминокислот), участвующих в биосинтезе белка , а также некоторых других, синтезируемых указанными выше пробиотическими микроорганизмами. Как известно, в виде белков аминокислоты являются вторым (после воды) компонентом мышц, клеток и других тканей человеческого организма. Аминокислоты играют решающую роль в таких процессах, как транспорт нейротрансмиттеров и биосинтезе.
Для тех кто хочет получить общее представление или освежить память об основных понятиях, касающихся аминокислот и синтезе белка из аминокислот, а также о роли аминокислот в питании человека, предлагаем перейти по ссылкам:
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ ПО ЗАМЕНИМЫМ И НЕЗАМЕНИМЫМ
Заменимые аминокислоты - это аминокислоты, поступающие в организм человека с белковой пищей, либо образующиеся в организме из иных аминокислот.
Незаменимые аминокислоты - это аминокислоты, которые не могут быть получены в организме человека с помощью биосинтеза, поэтому должны постоянно поступать в виде пищевых белков. Их отсутствие в организме приводит к явлениям, угрожающим жизни.
Незаменимыми аминокислотами для взрослого здорового человека являются аминокислоты фенилаланин , триптофан , треонин , метионин , лизин , лейцин , изолейцин и валин ; Для детей, дополнительно, гистидин и аргинин .
Классификация аминокислот на заменимые и незаменимые содержит ряд исключений:
- Заменимый гистидин, синтезирующийся в организме человека, должен поступать с белковой пищей, так как его производство недостаточно для нормального поддержания здоровья;
- Заменимый аргинин вследствие ряда особенностей его метаболизма, при некоторых физиологических состояниях организма может быть приравнен к незаменимым;
- Тирозин можно считать заменимой аминокислотой лишь при условии достаточного поступления фенилаланина. У больных фенилкетонурией тирозин становится незаменимой аминокислотой.
Потребность в аминокислотах и белке
Потребность в незаменимых аминокислотах
Существуют стандарты сбалансированности незаменимых аминокислот (НАК), разработанные с учетом возрастных данных. Для взрослого человека (г/сутки): триптофана - 1, лейцина 4—6, изолейцина 3—4, валина 3—4, треонина 2—3, лизина 3—5, метионина 2—4, фенилаланина 2—4, гистидина 1,5—2.
Таблица 1. Международные рекомендации по суточной потребности детей в аминокислотах*
О чем расскажет анализ на аминокислоты?
Анализ на аминокислоты — основный метод оценки степени усвоения пищевого белка, а также метаболического дисбаланса. Это исследование дает возможность своевременно выявить и скорректировать наследственные или приобретенные нарушения.
Значение аминокислот для нашего организма
Аминокислоты необходимы для синтеза гормонов и других биологически активных веществ, для образования клеток иммунной системы, транспортных молекул. Без аминокислот невозможны все виды окислительно-восстановительных реакций и другие биохимические процессы. Аминокислоты обеспечивают жизнедеятельность на клеточном уровне, от которой зависит состояние всего организма в целом.
Источниками свободных аминокислот в организме являются белки пищи, собственные белки тканей и синтез из углеводов и жиров. Аминокислоты, в отличие от жиров и глюкозы, не запасаются, поэтому в экстренных для организма ситуациях распадаются белки мышц, печени и плазмы крови, которые выполняют важные функции. Именно поэтому белковое голодание или дефицит отдельных аминокислот так опасны для здоровья.
Полученные с пищей белки подвергаются полному распаду до аминокислот в ЖКТ, через кишечную стенку аминокислоты всасываются и с током крови распространяются по всему организму, где из них синтезируются белки. При распаде белков и аминокислот азот выводится мочой в форме мочевины, а оставшаяся углеродная часть используется для синтеза углеводов, липидов или окисляется до аденозинтрифосфорной кислоты (АТФ) - основного источника энергии для клеток и организма в целом.
Какие заболевания поможет диагностировать исследование до появления первых клинических симптомов?
Повышение общего уровня аминокислот в крови может говорить о следующих заболеваниях или отклонениях от нормы:
- сахарный диабет;
- печеночная недостаточность с энцефалопатией;
- почечная недостаточность;
- эклампсия в период беременности;
- заболевания, сопровождающиеся распадом белка;
- контроль усвоения белковосодержащих нутриентов;
- дефицит и нарушения в транспортных белках;
- высокая интенсивность физических нагрузок или травма.
Снижение общего уровня аминокислот в крови может говорить о следующих заболеваниях или отклонениях от нормы:
- воспалительные процессы организма, сопровождающиеся субфебрильной лихорадкой;
- заболевания почек;
- ревматоидный артрит;
- недостаточное питание;
- воспалительные заболевания ЖКТ, сопровождающехся нарушением всасывания питательных веществ;
- избыточный синтез гормонов коры надпочечников;
- ослабление иммунитета.
Чем поможет анализ на аминокислоты?
С момента введения теста наша лаборатория выполнила более 12 000 исследований на определение общего уровня аминокислот.
Выявлены основные клинические моменты:
- У 8 000 пациентов мы определили дефицит незаменимых аминокислот;
- У 4 000 пациентов обнаружены нарушения в белковом и жировом обмене;
- У большинства пациентов после перенесенного COVID-19 (SARS-CoV-2) обнаружен дисбаланс нутриентов с накоплением промежуточных продуктов метаболизма.
У вас есть прекрасная возможность воспользоваться специальным предложением. До 27.11.21 действует акция «Сдайте аминокислоты в крови (13 показателей) и получите ацилкарнитины в подарок» для участия необходимо сдать анализ аминокислоты в крови (13 показателей) (код исследования N23) на сумму 3 199 рублей и вы получаете в подарок анализ на ацилкарнитины в крови (код исследования N21), стоимость которых без акции составляет 6 240 руб.
Определение концентраций аминокислот вместе с оценкой концентраций ацилкарнитинов покажет:
- Полноценную картину жирового и белкового обмена в организме;
- Наличие или отсутствие митохондриальной недостаточности;
- Полноценную оценку особенностей метаболизма при планировании и беременности, особенно у пациентов с хроническими заболеваниями.
Что вы найдете в нашем бланке после исследования?
Интерпретация заменимых, незаменимых аминокислот и ацилкарнитинов
Заменимые аминокислоты - это аминокислоты, поступающие в организм человека с белковой пищей, либо образующиеся в организме из других аминокислот.
Незаменимые аминокислоты - это аминокислоты, которые не могут быть получены в организме человека с помощью биосинтеза, поэтому должны постоянно поступать в виде пищевых белков.
Каждая аминокислота, помимо общих функций, обладает какими-либо специфическими особенностями.
Аргинин (Arg)(заменимая) — способствует укреплению иммунитета, регенерации тканей, улучшает кровоток в капиллярах, борется с атеросклерозом, является ключевым метаболитом в процессах азотистого обмена.
Валин (Val) (незаменимая) — отвечает за восстановление мышечной и нервной тканей, защищает миелиновую оболочку, окружающую нервные волокна в головном и спинном мозге, способствует поддержанию азотистого баланса, препятствует снижению уровня серотонина, понижает чувствительность организма к боли, холоду, жаре.
Лейцин (Leu) (незаменимая) — отвечает за оптимальный уровень глюкозы в крови, структуру мышечной ткани, укрепляет иммунную систему.
Метионин (Met) (незаменимая) — снижает содержание холестерина, увеличивает содержание антиоксиданта глютатиона, способствует выводу тяжелых металлов и токсинов из организма, восстановлению тканей внутренних органов, регуляции содержания аммиака.
Фенилаланин (Phe) (незаменимая) — обеспечивает оптимальный уровень серотонина, участвует в работе нервной системы, играет важную роль в синтезе гормона инсулина, тироксина, меланина.
Аланин (Ala) (заменимая) — участвует в укреплении мышечной ткани и способствует повышению выносливости организма, регулирует уровень сахара в крови.
Аспарагиновая кислота (Asp) (заменимая) — необходима для нормальной работы иммунной системы, синтеза ДНК и РНК, для аппарата наследственности, клеточного роста, процесса деления клеток.
Глицин (Gly) (заменимая) — улучшает метаболические процессы в тканях мозга, также необходим для синтеза креатина, участвующего в расщеплении аденозинтрифосфорной кислоты (АТФ) для получения энергии для работы мышц и всех тканей, и органов.
Глутаминовая кислота (Glu) (заменимая) — играет основную роль в азотистом обмене, в деятельности скелетной мускулатуры, участвует в белковом и углеводном обмене, способствует синтезу аденозинтрифосфорной кислоты (АТФ), обезвреживанию и выведению из организма аммиака, повышает устойчивость организма к гипоксии.
Пролин (Pro) (заменимая) - участвует в синтезе коллагена и соединительной ткани, способствует поддержанию тонуса кожи, мышц, стенок сосудов, способствует заживлению ран.
Тирозин (Tyr) (заменимая) - участвует в работе центральной нервной системы и осуществлении высшей нервной деятельности, участвует в выработке гормона щитовидной железы — тироксина, участвует в процессах обмена белков, жиров и углеводов, участвует в выработке нейромедиаторов допамина и норэпинефрина, способствует выработке мелатонина и улучшает функцию надпочечников, подавляет аппетит, способствует уменьшению отложения жиров.
Орнитин (Orn) (заменимая) —снижает концентрацию аммиака в плазме крови, способствует нормализации кислотно-щелочного состояния организма и выработке инсулина и соматотропного гормона. Улучшает белковый обмен при заболеваниях, требующих парентерального питания.
Цитруллин (Cit) (заменимая) —участвует в метаболизме мочевины, является промежуточным метаболитом в утилизации токсичного вещества - аммиака.
В информативном бланке результата исследования на Аминокислоты в плазме крови (13 показателей) вы увидете референсное значение каждого маркера:
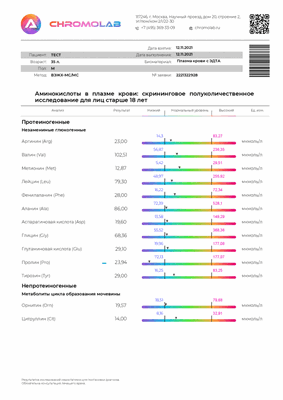
Ацилкарнитины - производные L-карнитинов. Это временные соединения, образующиеся с целью транспортировки жирных кислот через мембрану митохондрий для дальнейшего их окисления. Определение этих соединений позволяет диагностировать недостаточность различных ферментов, принимающих участие в метаболизме жирных кислот. Кроме того, это маркёр различных заболеваний сердечно-сосудистой системы, головного мозга, печени.
Определение концентраций ацилкарнитинов совместно с определением уровня аминокислот используется для оценки метаболизма карнитина и нарушений обмена жирных кислот, органических кислот и белкового обмена, для оценки риска развития сердечно-сосудистых заболеваний, патологий печени, головного мозга, для выявления митохондриальной дисфункции и дисбаланса в обмене нутриентов.
Анализ рекомендуется для адекватной коррекции диеты и мониторинга эффективности лечения различных заболеваний, связанных с обменом жирных кислот в организме.
Результаты исследования на Ацилкарнитины в плазме крови подробно описаны в бланке результата по всем маркерам:
Читайте также:
- Причины низкого сердечного выброса. Факторы влияющие на сердечный выброс
- Как отличить хроническую усталость от зимней? Лечение хронической усталости
- Хроническая пневмония. Поликистозное легкое
- Судорожный синдром. Судороги. Причины судорог. Патогенез судорог. Механизм судорожного синдрома.
- Патологическая анатомия рака легких. Гистология рака легкого
