История слуховой стволовой имплантации
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
С внедрением метода кохлеарной имплантации в корне изменились подходы к лечению сенсоневральной глухоты. Менее чем за четыре десятилетия кохлеарные импланты прошли путь от первых попыток прямой электрической стимуляции слухового нерва до коммерческих устройств, обеспечивающих восстановление слуха сотням тысяч пациентов. Некоторые аспекты в истории кохлеарной имплантации могут быть отнесены к развитию и других нейропротезов. Прежде всего, это относится к междисциплинарному подходу в развитии кохлеарной имплантации. Значительный вклад в решение проблемы был внесен инженерами, отологами, аудиологами, нейрофизиологами, психоакустиками и представителями индустрии. Не всегда взаимодействие между этими специалистами было гармоничным, однако в спорах и соперничестве рождалась истина. Безусловное значение для прогресса в кохлеарной имплантации имела готовность нескольких клиницистов с риском для своей репутации выступить против существующих в то время научных догм во имя прогресса в области лечения больных с тугоухостью и глухотой. И, наконец, успеху способствовали и сами пациенты, готовые принять участие в экспериментальных операциях.
История кохлеарной имплантации может быть подразделена на несколько периодов. Первый период начался в 1957 и продолжался до 1960-х годов. Это был период открытий и экспериментов. Второй период (70-е годы) характеризовался как период изучения осуществимости проектов и был посвящен определению безопасности стимуляции слухового проводящего пути и обеспечению достаточного слуха имплантом. Третий период завершился созданием коммерческих многоканальных имплантов.
В 1800 г. Alessandro Volta первым описал возможность вызывать электрическим током слуховые ощущения [ 1 ]. Аналогичные попытки проводились в течение последующих 150 лет, однако ни в одной из них не было дано объяснения механизмам действия электрического тока.
В 1930 г. Гершуни Г.В. и Волоховым А.А. в Ленинградской Военно-медицинской академии были проведены эксперименты, позволившие уточнить механизмы «электрического» слуха. Ими было показано, что возникавшие слуховые ощущения при электрической стимуляции через электроды, расположенные в среднем ухе, не отличались у пациентов с интактным средним ухом и отсутствием структур среднего уха. Таким образом, ими была исключена возможность участия среднего уха в электрической стимуляции [ 24 ]. Более сложной задачей было отдифференцировать, является ли слуховое ощущение результатом механического ответа органа Корти или результатом непосредственной стимуляции волокон слухового нерва.
Ряд открытий, сделанных в первой половине 20-го века, не были напрямую связаны с электрической стимуляцией слухового нерва, но оказали существенное влияние на разработку кохлеарных имплантов. Прежде всего, это относится к работе Dudley, посвященной синтезу речи и «вокодерам», а также открытию Wever микрофонного потенциала и Stevens с соавт. — «электрофонического» слуха.
В 1930 г. Stevens с соавт. описали механизм возникновения слухового ощущения при электрической стимуляции структур улитки, который был назван ими «электрофоническим слухом». Сегодня мы знаем, что «электрофонический» слух является результатом механических осцилляций основной мембраны в ответ на изменение напряжения. Основным условием для реализации их концепции была интактность улитки [ 6 ].
В 1935 г. Андреев А.М., Гершуни Г.В. и Волохов А.А. продемонстрировали, что частота стимуляции от сотен герц до 6000 Гц вызывает одни и те же слуховые ощущения, что свидетельствовало о непосредственной стимуляции волокон слухового нерва. Иными словами, слуховые ощущения были результатом не «электрофонического» слуха, а стимуляции волокон слухового нерва. Однако должные выводы авторами сделаны не были [ 7 ].
В 1939 г. Dudley описал и продемонстрировал синтезатор голоса, функционирующий в реальном времени и продуцирующий понятную речь. В основу действия устройства, получившего название вокодер, была положена схема, обеспечивающая выделение основной частоты речи и интенсивности ее спектральных компонентов. Спектральные компоненты выделялись при помощи набора 10-полосных фильтров, покрывающих частотный диапазон речи. Принцип действия вокодера, заключающийся в разделении речи на ее основные компоненты, явился основой для первых схем обработки речи в многоканальных кохлеарных имплантах [ 8 ].
До 1957 года все попытки электрической стимуляции проводились на лицах с частично функционирующей улиткой. Поэтому у этих субъектов ответ мог являться результатом «электрофонического» слуха, а не результатом непосредственной стимуляции волокон слухового нерва.
Несмотря на то, что в течение последних столетий предпринимались многочисленные попытки лечения глухоты электрическим током, первой публикацией о непосредственной стимуляции слухового нерва с целью генерирования слуховых ощущений, являются работы André Djourno и Charles Eyriès. И, хотя кохлеарный имплант имел революционное значение для развития науки о слухе, исследование французских ученых не получило должной оценки.
Одним из направлений работы Djourno явилась разработка имплантируемой индукционной катушки, предназначенной для телестимуляции или стимуляции через индуктивную связь [ 9 ]. Вначале имплантируемая катушка использовалась для стимуляции седалищного нерва, и стимуляция была чрескожной, а не подкожной. Параллельно изучалась биосовместимость устройства. Проводя эксперименты по изучению влияния частоты стимуляции, Djourno определил, что оптимальной частотой для сокращения мышц является частота 400-500 Гц, после чего для стимуляции он стал использовать собственный голос в качестве аналогового стимулирующего сигнала. Это явилось основанием для возникновения идеи о стимулировании слухового нерва с целью восстановления слуха [ 10 ].
В феврале 1957 г. Eyriès во время операции по восстановлению лицевого нерва у больного после правосторонней резекции височной кости по поводу двусторонней гигантской холестеатомы с двусторонней глухотой (левосторонняя резекция была выполнена несколькими годами ранее) использовал устройство Djourno, расположив активный электрод в культе слухового нерва, а индукционную катушку — в височной мышце. При внутриоперационном тестировании использовались посылки импульсов частотой 100 Гц, предъявляемые 15-20 раз в минуту, низкочастотный переменный ток, а также слова, преобразованные в аналоговые сигналы на выходе микрофона. Пациентом было отмечено возникновение слухового ощущения. При количественной оценке было выявлено хорошее различение интенсивности, плохое частотное различение и отсутствие разборчивости речи. Результатом интенсивной послеоперационной реабилитации явилось улучшение частотного различения (высоких и низких частот), различение окружающего шума и некоторых слов, однако разборчивость и понимание речи отсутствовали. Несколькими месяцами позже имплант повредился, а повторная операция не дала результатов. Операция у второй больной также была безуспешной [ 11 ].
Следующий этап начинается с работ Claude-Henri Chouard, который будучи студентом в лаборатории Eyriès занимался лицевым нервом. Ему принадлежит приоритет в разработке одного из первых функциональных многоканальных кохлеарных имплантов [ 12 ].
В США приоритет в разработке кохлеарного импланта принадлежит W. House [ 14 ]. В 1959 он впервые ознакомился с работой Djourno и Eyriès. В это время House активно занимался разработкой подхода к внутреннему слуховому проходу через среднюю черепную ямку [ 15 ]. Совместно с нейрохирургом Doyle им была произведена попытка зарегистрировать ответы от слухового нерва, выделенного через среднюю черепную ямку для вестибулярной нейроэктомии с целью лечения болезни Меньера. И, хотя они преследовали цель зарегистрировать потенциалы, связанные с ушным шумом, которая оказалась несостоятельной, сама возможность регистрации слуховых вызванных потенциалов привела их к мысли о возможности стимуляции аналогичными по форме сигналами с целью восстановления слуха [ 16 ]. Первые попытки электрической стимуляции с целью вызывания слуховых ощущений осуществлялись ими при хирургическом вмешательстве на стремени при установке игольчатого электрода на промонториальной стенке или в открытом окне преддверия. При стимуляции прямоугольными импульсами у пациента вызывались слуховые ощущения, не сопровождающиеся дискомфортом, головокружением или стимуляцией лицевого нерва. Это послужило основанием для проведения в 1961 г. имплантации пациенту (добровольцу) с выраженным отосклеротическим поражением и глухотой. Ему постаурикулярным подходом был введен электрод в окно улитки. Пациент отмечал слуховые ощущения, однако из-за непереносимости громких звуков имплант был вскоре удален. Вторая пациентка была также проимплантирована в 1961 г. При вестибулярной нейроэктомии подходом через среднюю черепную ямку электрод был введен в барабанную лестницу базальной части улитки. Пациентка отмечала слуховые ощущения, однако через несколько дней интенсивность тока, необходимая для вызывания ответа, возросла, и имплант был удален [ 17 ].
Учитывая обнадеживающие результаты, полученные у первого пациента, и рассчитывая на дискриминацию высоких частот, House и Doyle решили реимплантировать пациента пятиэлектродной решеткой, которая была установлена через промонторий и круглое окно. Однако через несколько недель в связи с необходимостью в увеличении интенсивности и с воспалением кожи в позадиушной области имплант был удален.
Результаты этих операций попали в прессу, что явилось важным стимулом в развитии метода кохлеарной имплантации [ 19 , 20 ].
В 1964 г. Blair Simmons имплантировал электрод в модиолюс глухого пациента, однако результаты также не были обнадеживающими [ 21 , 22 ]. В 1971 г. Robin Michelson проимплантировал нескольких пациентов одноканальными полностью имплантируемыми имплантами. Результаты операций получили освещение на национальном уровне [ 23 ].
Начало 70-х годов принесло больше разочарований, чем положительных результатов. Большинство ученых, занимающихся фундаментальной наукой, выступали против кохлеарной имплантации, основываясь на имевшихся на тот момент знаниях о физиологии слуха [ 2427 ].
Переломным моментом в развития кохлеарной имплантации явился 1975 год, когда Национальные институты здоровья США (NIH) спонсировали обследование пациентов, ранее имплантированных одноканальными кохлеарными имплантами Michelson и House. Расширенное психоакустическое, аудиологическое и вестибулологическое исследование были проведены в Питсбурге Robert Bilger. Было сделано заключение о том, что одноканальные импланты не обеспечивают разборчивого восприятия речи, однако продукция речи, считывание с губ, равно как и качество жизни, существенно повысились [ 28 ].
В конце 70-х исследования в области кохлеарной имплантации стали легитимными, что сопровождалось выделением средств на новые эксперименты. Merzenich и Schindler провели исследования по изучению возможности и безопасности длительной электрической стимуляции слухового нерва у кошек и подтвердили, что при атравматичном введении электрода в барабанную лестницу возможно проведение хронической электрической стимуляции волокон слухового нерва, не сопровождающейся выраженными дегенеративными изменениями нервных волокон [ 29 ].
Параллельно фундаментальным исследованиям две группы ученых (Merzenich и Schindler — в Калифорнийском Университете и Graham Clark — в Мельбурнском Университете) проводили работы по разработке многоканальных систем кохлеарной имплантации. Результатом этих работ явилась разработка кохлеарных имплантов Nucleus Cochlear Corporation и Clarion Advanced Bionics [ 30 , 31 ].
В 1969 г. Clark продемонстрировал ограниченные возможности одноканального импланта и приступил к разработке многоканальных систем [ 32 ]. Его исследования включали разработку стратегий кодирования речи, надежного имплантируемого приемника-стимулятора, оптимизацию электродной решетки. Clark с коллегами продемонстрировали, что антероградное введение электродной решетки через одну кохлеостому в барабанную лестницу является менее травматичным по сравнению с введением через множество кохлеостом. Использование же платиновых электродов исключало возможность их повреждения и обеспечивало безопасную длительную электрическую стимуляцию [ 3335 ]. Первый пациент был прооперирован ими в 1978 г., а уже в 1981 г. было отмечено, что пациенты понимают речь без считывания с губ [ 36 ]. Для того, чтобы отдельные электроды могли бы эффективно вызывать различные частотные ответы, пространственное распределение стимулов также должно было быть различным. Было показано, что выраженное взаимодействие между электродами являлось результатом одновременной стимуляции множества электродов. Для минимизации отмеченного взаимодействия между электродами было предложено использование смещенного неодновременного паттерна стимуляции. Также было показано, что использование скоростей стимуляции выше 1 кГц обеспечивало улучшение разборчивости речи. Данная концепция была запатентована как стратегия CIS [ 37 ]. В течение последующих лет продолжались разработки в области совершенствования самого импланта, а также стратегий кодирования речи.
Многоканальные кохлеарные импланты были внедрены в 1984 г., что сопровождалось вытеснением одноканальных систем. В 1985 г. имплантация была разрешена FDA взрослым, а в 1990 г. — детям старше 2 лет [ 38 ].
Следующим аспектом, требующим решения, было обеспечение улучшенной разборчивости речи, что нашло реализацию в высокоскоростной перемежающейся стимуляции. Многоканальная стимуляция основывалась на принципах кодирования по месту вдоль улитки.
В СССР в 80-х годах под руководством проф. М.Р.Богомильского были начаты работы по созданию отечественного кохлеарного импланта. И, хотя был изготовлен опытный образец одноканального импланта и проведены операции двум пациентам, промышленного производства налажено не было 39-41].
Начало многоканальной кохлеарной имплантации в СССР было положено в 1991 году, когда после регистрации кохлеарного импланта Nucleus CI22 австралийской фирмы «Cochlear» сотрудниками Всесоюзного научного центра аудиологии и слухопротезирования при активном содействии и непосредственном участии проф. Эрнста Ленхардта и доктора Моники Ленхардт, были произведены две первые кохлеарные имплантации.
В 1997 г. к программе кохлеарной имплантации подключился Санкт-Петербургский НИИ уха, горла, носа и речи, в 2005 г. — Научно-клинический центр оториноларингологии (Москва), а в 2009 г. — Клиническая больница №122 им. Л. Г. Соколова ФМБА России (Санкт-Петербург). На сегодняшний день в стране кохлеарные импланты используют более 8000 пациентов.
История слуховой стволовой имплантации
ФГБУ «Санкт-Петербургский НИИ уха, горла, носа и речи» Минздрава России; ФГБОУ ВПО «Российский государственный педагогический университет им. А.И. Герцена», Санкт- Петербург
ФГБУ «Санкт-Петербургский НИИ уха, горла, носа и речи» Минздрава России;ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России, Санкт-Петербург
Пациенты с глухотой, которым не показана операция кохлеарной имплантации, раньше оставались глухими на всю жизнь. Это пациенты с ретрокохлеарной патологией и аномалиями развития улитки. Для помощи этой группе пациентов была создана система стволомозговой имплантации (СМИ). Она представляет собой модифицированный кохлеарный имплантат, который устанавливается при помощи хирургической операции в ствол головного мозга на поверхность улиткового ядра.
Цель исследования: оценить эффективность применения метода слуховой стволомозговой имплантации у пациентов с глухотой.
Материал и методы: отобрано 3 пациента: 2 взрослых пациента с нейрофиброматозом 2-го типа и один ребенок в возрасте 2-х лет с двусторонней аплазией улиток.
Результаты: у пациентов со СМИ после подключения речевого процессора порог слуха составлял 50-60 дБ в частотном диапазоне 500-4000 Гц. В конце первой реабилитации порог слуха составил 45-50 дБ. Взрослые воспринимали разные звуки, различали слова с опорой на длительность и слоговую структуру. Через 6 мес. после подключения речевого процессора у пациентов наблюдалась положительная динамика развития этих навыков. Ребенок хорошо реагировал на звуки разной частоты. Появились предречевые и речевые вокализации. Через 2 года после операции взрослые пациенты различали слова из закрытого выбора. У ребенка пассивный словарь составлял около 200 слов.
Выводы: метод слуховой СМИ является методом выбора реабилитации пациентов с глухотой, у которых невозможно или нецелесообразно проведение кохлеарной имплантации. После выполнения СМИ взрослые пациенты отмечают улучшение качества жизни. Разборчивость речи у этой группы пациентов составляет 30-70%.
Ключевые слова: слуховая стволомозговая имплантация, мостомозжечковый угол, имплантат, желудочек, стволомозговая имплантация, слухоречевая реабилитация глухих, глухота, кохлеарная имплантация.
New technologies in otorhinolaryngology: brainstem implantation
Janov Yu.K. 1 , Kuzovkov V.E. 1 , Koroleva I.V. 1,2, Levin S.V. 1,4 , Behr R. 3 , Levina E.A. 1 , Sugarova S.B. 1 , Lilenko A.S. 1
1 St.Petersburg Research Institute of Ear, Nose, Throat and Speech
2 Russian State Pedagogical University named after A.I. Herzen, St.Petersburg
3 Fulda Clinic, Germany
4 North-Western State Medical University named after I.I. Mechnikov, St.Petersburg
Patients with deafness who have no surgical indications to the operation of cochlear implantation used to remain deaf for life.These are patients with retrochlear pathology and impaired cochlea development. To help this group of patients, a system of brainstem implantation was created. It is a modified cochlear implant that is installed by surgical operation in the brain stem on the surface of the cochlear nucleus.
Aim: to evaluate the effectiveness of the auditory brainstem implantation method in deaf patients.
Patients and Methods. 3 patients were selected. Two adult patients with type 2 neurofibromatosis and one child aged 2 years with bilateral cochlear aplasia.
Results: In patients with the brainstem implantation, after connection of the speech processor, the hearing thresholds ranged from 50 to 60 dB in the frequency range from 500 Hz to 4,000 Hz. At the end of the first rehabilitation, the hearing thresholds were 45-50 dB. Adults perceived different sounds, distinguished words based on duration and syllabic structure. Six months after the connection, the patients showed a positive development of these skills. The child responded well to sounds of different frequencies. Pre-speech and speech vocalizations appeared. In 2 years after the operation, adult patients distinguished the words from the closed selection. The child had a passive vocabulary of about 200 words.
Conclusions: auditory brainstem implantation is a method of choice for the rehabilitation of deaf patients in which it is impossible or impractical to conduct a cochlear implantation. Adult patients note an improvement in the quality of their life. Speech intelligibility in this group of patients varies from 30% to 70%.
Key words: auditory brainstem implantation, cerebellopontine angle, implant, ventricle, brainstem implantation, auditory rehabilitation of deaf patients, deafness, cochlear implantation.
For citation: Janov Yu.K., Kuzovkov V.E., Koroleva I.V. et al. New technologies in otorhinolaryngology: brainstem implantation // RMJ. 2017. № 23. P. 1695-1698.
Для цитирования: Новые технологии в оториноларингологии: стволомозговая имплантация. РМЖ. 2017;23:1695-1698.
Статья посвящена стволомозговой имплантации, которая является методом выбора реабилитации пациентов с глухотой и невозможностью проведения кохлеарной имплантации. Оценена эффективность применения метода слуховой стволомозговой имплантации у 3-х пациентов с глухотой.
В настоящее время в мире существует множество методов восстановления слуха у человека. Не все методы эффективны при тугоухости высокой степени или глухоте. У пациентов с большой степенью снижения слуха наиболее эффективным методом лечения является операция кохлеарной имплантации [1, 2]. Проведение этой операции возможно при сохранении анатомии внутреннего уха и проводимости слухового нерва. Но есть группа пациентов, которым эта операция не показана [3]. У них пострадали не внутренние волосковые клетки Кортиева органа, как при сенсоневральной тугоухости, а анатомия улитки и слухового нерва. При ретрокохлеарной патологии или невозможности установки электрода в улитку операция кохлеарной имплантации будет неэффективна. Помочь может метод стволомозговой имплантации (СМИ) - установка электродной решетки имплантата выше места повреждения, в центральные отделы слуховой системы [4, 5]. В Российской Федерации первый опыт проведения СМИ состоялся в декабре 2014 г., при тесном сотрудничестве НИИ уха, горла, носа и речи, Российского научно-исследовательского нейрохирургического института им. проф. А.Л. Поленова и клиники Fulda (Германия). В ходе данной операции электродная решетка СМИ устанавливается в IV желудочек головного мозга, на проекцию улиткового ядра. В этом случае звуковая информация попадает в обход периферического отдела слуховой системы и слухового нерва сразу в центральный отдел слуховой системы. Эта более сложная по сравнению с кохлеарной имплантацией операция требует от нейрохирурга большого опыта операций на стволе головного мозга. Через месяц после установки стволомозгового имплантата пациенту выполняется подключение наружной части системы СМИ - речевого процессора и проводится длительная слухоречевая реабилитация.
Система слуховой СМИ (ABI, auditory brainstem implant) состоит из 2-х частей и представляет собой модифицированный кохлеарный имплантат, предназначенный для электрической стимуляции кохлеарных ядер ствола мозга в обход улитки, и речевой процессор (рис. 1, 2) [6].
Показаниями для операции слуховой СМИ является сенсоневральная тугоухость IV степени, вызванная ретрокохлеарной патологией, либо прогнозируемая глухота после нейрохирургической операции [7]. Основными причинами, наиболее часто вызывающими двустороннее поражение корешков VIII нерва, является нейрофиброматоз 2-го типа, травматическое повреждение волокон слухового нерва, вызванное переломом основания черепа, хирургическими операциями и т. д., или врожденное отсутствие слуховых нервов - аплазия с двух сторон [8]. Нейрофиброматоз 2-го типа - это наследственное заболевание, представляющее собой множественные, обычно доброкачественные опухоли оболочки нервной ткани [9, 10]. В процессе развития заболевания у пациентов могут возникать двусторонние невриномы слухового нерва. Это доброкачественные опухоли, растущие из швановских оболочек слухового нерва [11, 12]. Другим показанием к слуховой СМИ является полная облитерация или аплазия улиток височных костей с двух сторон. В этом случае невозможно выполнить кохлеарную имплантацию, т. к. нет возможности установить электрод в каналы улитки.
Цель нашего исследования: оценить эффективность применения метода слуховой стволомозговой имплантации у пациентов с глухотой.
Материал и методы
Результаты и обсуждение
Подключение процессора слухового СМИ проводилось через 1,5-2,5 мес. после операции. У взрослых пациентов настройка параметров электрической стимуляции проводилась по субъективным ощущениям, а также с учетом реакций пациента на звуки и наблюдений сурдопедагога [17]. В связи с особенностью локализации электрода слухового СМИ у всех пациентов были не только слуховые, но и неслуховые ощущения. При определении порогов комфортных уровней на каждом электроде одномоментно оценивалась слуховая и неслуховая стимуляция по аналоговым шкалам интенсивности. У ребенка во время стимуляции электродов № 7 и 10 возникало ощущение покалывания в той же половине тела (side effect). При подаче импульсов с электродов № 7, 9-12 проявлялась стимуляция вестибулярных ядер - резкое головокружение во время подачи стимула (рис. 4). В процессе настройки электроды, вызывающие преимущественно неслуховую стимуляцию, были отключены (табл. 1).
У всех пациентов, во время первого подключения непрерывно оценивались ощущения при стимуляции разных электродов имплантата. В процессе ежедневных настроечных сессий были определены электроды, вызывающие слуховые ощущения, и электроды, дающие побочные эффекты. Важным этапом для взрослых пациентов было определение восприятия частоты на каждом электроде. Так как кохлеарный имплантат позволяет перераспределять электроды на разные частотные каналы СМИ, нами был определен порядок электродов, вызывающих повышение воспринимаемой частоты тонов (рис. 5).
В результате такой настройки пациенты отмечали лучшее различение звуков по частоте, т. к. низкочастотные звуки попадали в области ствола мозга, отвечающие преимущественно за низкие частоты, звуки средней частоты - в области, отвечающие за средние частоты, и звуки высокой частоты - в области, отвечающие за высокие частоты (см. табл. 1).
Как показано в таблице, ежедневно менялись комфортные уровни стимуляции на разных электродах, менялось ощущение воспринимаемой частоты стимуляции электродов. По ощущениям пациента проводились коррекции настройки речевого процессора. Электроды со стойкими неслуховыми ощущениями были в процессе настройки отключены. В результате у пациента В. были активны 9 электродов, у пациента К. - 6 электродов, и у пациента Г. - 7 электродов. У ребенка не проверялось восприятие частоты по причине возраста. За счет пластичности головного мозга у него произойдет самостоятельная адаптация ядра к данной стимуляции. У взрослых пациентов этот тест был обязательным, т.к. в ядрах ствола тонотопика очень отличается от тонотопики улитки.
Оценка результатов работы процессора слухового стволового имплантата показала, что у всех пациентов улучшилось качество жизни. Уже на первой реабилитации пациенты узнавали некоторые звуки на слух, слышали голоса людей и узнавали собственное имя, стали чувствовать себя увереннее. Порог слуха достигал 45-55 Дб.
Результаты тестирования ребенка с двусторонней аплазией улиток и слуховых нервов после слуховой СМИ представлены на рис. 6.
Видно, что за 5 мес. работы речевого процессора достигнута заметная динамика слухоречевого развития.
Выводы
1. После подключения и первых настроек речевого процессора возможно возникновение неслуховых ощущений при использовании стволомозгового имплантата. Если операция проведена успешно, эти побочные эффекты можно устранить при настройке речевого процессора.
2. Для данной группы пациентов требуется более продолжительная реабилитация. Пациенты после первого подключения только на второй неделе настроек отмечали стабильные слуховые ощущения.
3. При настройке речевого процессора стволомозгового имплантата уровни максимальной комфортной громкости могут достигать больших значений, чем при настройке системы кохлеарной имплантации.
4. В ходе настройки речевого процессора стволомозгового имплантата при обнаружении неслуховой стимуляции может быть отключено большее количество электродов в 1-ю сессию настройки, чем при кохлеарной имплантации.
Заключение
Безусловно, метод слуховой стволовой имплантации является прорывом в реабилитации пациентов с глухотой. Стало возможным проведение реабилитационных мероприятий даже в случаях двусторонней аплазии и гипоплазии слухового нерва и улитки, полной облитерации улитки после перенесенного менингита, травмы ствола слухового нерва, опухолевых процессов внутреннего слухового прохода и мостомозжечкового угла. По данным зарубежной литературы, 80-90% пациентов получают возможность не только воспринимать тональные сигналы, но и разбирать речь. После проведения реабилитационных мероприятий разборчивость речи достигает 30-70%. Однако в период отбора пациентов необходимо учитывать сложность нейрохирургического вмешательства, сопровождающегося трепанацией черепа, и доступа к стволу головного мозга. В 10% случаев возможно отсутствие слуховых ощущений после операции, например в связи со смещением электрода в послеоперационном периоде.
В статье освещаются основные этапы развития кохлеарной имплантации и определяются основные аспекты создания кохлеарных имплантатов. В 1977 г. фирма MED-EL положила начало мировой истории многоканальной кохлеарной имплантации. В ходе многолетней работы сформировались основные аспекты создания и развития кохлеарных имплантатов: создание имплантата, который бы не налагал ограничений на сигнал, используемый для стимуляции, чтобы интеллект системы заключался в компоненте, находящемся вне организма, и мог быть легко усовершенствован; бережное отношение к чувствительным структурам внутри улитки; использование для стимуляции всей длины улитки, в т. ч. апикальной области, что должно привести к широчайшему диапазону слуховых ощущений по высоте, включая очень низкий тон, сокращению процесса адаптации, длительность которого обусловлена неоднократным картированием воспринимаемого диапазона высоты тона; эргономика, которая при повседневном применении устройства пользователями имеет важнейшее значение для принятия и распространения имплантатов. В числе прочего постоянная работа над снижением энергопотребления вывела фирму MED-EL на путь создания заушных и носимых отдельно беспроводных аудиопроцессоров вместо нательных, а в конечном итоге будут разработаны полностью имплантируемые системы.
Ключевые слова: кохлеарная имплантация, многоканальный кохлеарный имплантат, глухота, аспекты создания кохлеарных имплантатов.
The history of multichannel cochlear implantation
Kuzovkov V.E., Pudov V.I., Kliachko D.S.
St.Petersburg Research Institute of Ear, Throat, Nose and Speech
The article highlights the main stages of cochlear implantation (CI) development and defines the main aspects of the cochlear implants creation. Since 1977 the company "MED-EL" began the world history of multi-channel CI. In the course of many years of work, the main aspects of the creation and development of cochlear implants have been formed: the creation of an implant that does not impose restrictions on the signal used for stimulation, so that the intelligence of the system lies in a component that is outside the body and can be easily improved; careful attitude towards the sensitive structures inside the cochlea; use of the entire length of the cochlea, including the apical region, for stimulation, which should lead to the widest range of auditory sensations in height, including a very low tone, and helps to avoid a long adaptation process caused by remapping of the perceived pitch range; ergonomics in the daily use of the device by the recipients is essential for the acceptance and distribution of the implants. Among other things, constant struggle for power reduction has led MED-EL to the path from the body-worn to behind-the-ear and portable wireless audio processors, and ultimately, fully implantable systems will be developed.
Key words: cochlear implantation, multichannel cochlear implant, deafness, aspects of cochlear implant creation.
For citation: Kuzovkov V.E., Pudov V.I., Kliachko D.S. The history of multichannel cochlear implantation // RMJ. 2017. № 23. P. 1720-1724.
В статье освещаются основные этапы развития кохлеарной имплантации и определяются основные аспекты создания кохлеарных имплантатов для пациентов с глухотой.

Цель данной статьи: освещение основных этапов развития кохлеарной имплантации и определение основных аспектов создания кохлеарных имплантатов.
Путь от первых попыток Ингеборги и Эрвина Хохмайеров, основателей фирмы MED-EL, по созданию многоканального кохлеарного имплантата в 1975 г. до коммерческого жизнеспособного устройства был отнюдь не прост. Они начали исследование кохлеарных имплантатов в то время, когда одноканальное устройство Уильяма Хауса уже было успешно имплантировано. Их цель состояла в том, чтобы спроектировать электронный имплантат, который позволил бы пользователю не только слышать звуки, но и понимать речь. Читая литературу, они пришли к выводу, что, несмотря на многие неясности, существующих знаний [1] достаточно для разработки многоканального кохлеарного имплантата. Было известно, что высота тональных ощущений зависит от расположения стимулируемых нервных волокон внутри улитки (высота зависит от расположения) и от временной структуры возбуждающего сигнала (высота зависит от периодичности). Чтобы использовать обе возможности, нужна была стимуляция слухового нерва в нескольких местах при помощи сигнала, который также достаточно подробно представлял бы временную форму речевой волны с достаточной детализацией.
Первой попыткой была обработка речи по типу вокодера. Аудиосигнал приходилось делить на ряд частотных диапазонов, а выходной сигнал каким-то образом нужно было преобразовать в данные для стимулирующих импульсов, прилагаемых к многоканальному электроду, введенному в барабанную лестницу внутреннего уха.
Восьмиканальный имплантат для импульсной стимуляции с максимальной частотой 10 000 импульсов в секунду на канал был компромиссом между технической осуществимостью и требованиями к обработке речи [2]. Электронная схема состояла из устройств низкой мощности со стандартными микросхемами, иные из которых при помощи определенных хитростей также выполняли аналоговые функции; например, 8 независимых источников тока питали электродные контакты. Они были установлены на тонкослойную стеклянную подложку и размещены в герметичном корпусе. Использовались разделительные конденсаторы на всех каналах для предотвращения любого непосредственного повреждения нерва. Данные по стимуляции и питание передавались чрескожно через неповрежденную кожу при помощи индукционной связи от внешнего высокочастотного генератора.
Разработка многоканального интракохлеарного электрода практически не вызвала затруднений. Электрод был разработан для введения в улитку через круглое окно на глубину 22-25 мм; он состоял из двух рядов очень тонкой изолированной тефлоном проволоки, заключенной в силиконовый корпус, с шарообразными стимулирующими контактами. Проводки имели форму волны для большей гибкости и мягкости, а также для того, чтобы выдерживать напряжение при растяжении. Механическая конструкция была такова, что электрод сгибался в предпочтительной плоскости для облегчения введения. Имплантат был собран лично Ингеборгой и Эрвином Хохмайерами в Лаборатории гибридных схем Технического университета Вены. Все материалы, контактирующие с тканями, были биосовместимыми. Примечательно, что концепция дизайна данного имплантата предвосхищала современные устройства: она хорошо подошла бы для стратегии непрерывной чередующейся выборки (CIS), разработанной Блейком Уилсоном (см. пояснение далее), если бы на тот момент была известна.
После относительно короткого периода разработки в течение двух лет 16 декабря 1977 г. и в марте 1978 г. устройство было имплантировано хирургом Куртом Бурианом в Вене (рис. 1). Когда пациенты впервые пришли в лабораторию для подключения к испытательной системе, Хохмайеры были очень взволнованы. Несмотря на некоторый имеющийся тиннитус (ушной шум), удалось продемонстрировать различение высоты тона в зависимости от расположения, а второй пациент был способен уверенно различать и определять каналы стимуляции.
Анализируемые результаты привели к выводу, что на данной стадии и при отсутствии веры в оправданность чрескожного соединения необходимо было удостовериться в том, что стимулирующий сигнал не был ограничен имплантированными металлоизделиями или чрескожной передачей сигнала. Это также позволило бы в большей степени получать высоту звука в зависимости от периодичности. Был разработан ряд простых пассивных имплантатов с питанием через кожу, и в ближайшие годы четырехканальный имплантат получил широкое распространение. Четыре канала можно было стимулировать одновременно. В более ранних устройствах можно было переключаться между несколькими конфигурациями электродов, и после испытаний на пациентах было принято решение в пользу менее энергоемкой монополярной стимуляции - концепции, которая сейчас используется почти всеми разработчиками.
Небольшой нательный аудиопроцессор для повседневного использования был настроен на канал, дающий наилучшие результаты. Первые несколько процессоров генерировали амплитудно-модулированный сигнал для импульсной стимуляции. С этим сигналом удалось показать некоторое понимание речи в ситуации открытого выбора без чтения по губам.
Эти имплантаты были очень простыми в сборке. В первые годы схемы были погружены в эпоксидную смолу, используемую в кардиостимуляторах; позднее начали применяться герметичные керамические корпуса. За несколько лет было имплантировано около 500 устройств взрослым и детям.
В 1979 г. И. и Э. Хохмайеры провели полгода в Стэнфордском университете и познакомились с Блэром Симмонсом и другими пионерами в области кохлеарной имплантации. Курсировали слухи о пациенте, который мог слышать неразборчивую речь и немного понимать ее без чтения по губам при помощи аналоговой стимуляции через чрескожное соединение [3]. Поскольку имплантаты фирмы MED-EL прекрасно подходили для данного типа сигнала, то в том же самом году было продемонстрировано некоторое понимание речи в ситуации открытого выбора в лаборатории путем широкополосной аналоговой стимуляции.
Еще в 1979 г. 2 пациента получили соответствующую модификацию небольшого процессора для домашнего пользования, который позволил им в определенной степени понимать речь без чтения по губам в повседневной жизни всего через один канал четырехканального имплантата (рис. 2) [4].
В связи с очень низким энергопотреблением имплантата и внешней обработкой был разработан первый заушный процессор для кохлеарного имплантата COMFORT (рис. 3).
Результаты, полученные в 1980 г. при использовании метода стимуляции, известного как одноканальная широкополосная аналоговая стратегия, были гораздо лучше, чем при использовании имплантата House; фактически результаты были не хуже, чем при использовании любого другого имплантата того времени, несмотря на то что в них не использовалась высота тона в зависимости от места расположения. Глубинной причиной успеха этих имплантатов, вероятнее всего, была высокая гибкость и длина электрода, позволяющие довольно глубоко вводить электроды, так что самые глубокие каналы могли достигать волокон апикальной области улитки [5].
В начале 1990-х годов логичным казалось обогатить информацию о периодичности низкочастотного аналогового канала информацией о высоте в зависимости от расположения на дополнительных каналах. В 1991 г. пациенту хирургическим путем был установлен одобренный комбинированный аналогово-импульсный восьмиканальный имплантат [6]. Первые результаты не показали существенного улучшения.
В это время Блейк Уилсон только что опубликовал работу, в которой предлагалась новая стратегия кодирования под названием CIS (непрерывная чередующаяся выборка). Развивая гибкий подход, был предложен имплантат (позднее названный COMBI 40), специально разработанный для надежного применения быстрой стратегии CIS [7]. Это было предложено на 3-й Международной конференции по кохлеарной имплантации, которая была организована в Инсбруке в апреле 1993 г. Эта конференция также обозначила конец эры широкополосных аналоговых кохлеарных имплантатов.
Восьмиканальная система COMBI 40 была впервые имплантирована в январе 1994 г. Таким образом, развитие прошло полный цикл от раннего восьмиканального имплантата через широкополосные аналоговые устройства до новой многоканальной системы, хотя и на гораздо более сложном уровне. Разработка нового имплантата оказалась хорошей идеей, как показали отличные результаты многоцентрового клинического исследования. Система генерировала 1500 импульсов в секунду на канал (всего 12 000 импульсов в секунду) и приводила в действие электрод длиной 30 мм (рис. 4) [8].
В начале 1990-х годов системы кохлеарной имплантации, сходные с описанной выше, были готовы к глобальному распространению среди взрослых и детей. Лишь четырем из множества ранних исследовательских групп на базе университета удалось разработать коммерчески реализуемые устройства. С тех пор сфера кохлеарной имплантации бурно развивается, ей посвящено множество публикаций, клинических исследований, фундаментальных исследований, попыток реабилитации, продолжается прогресс в хирургии и усовершенствуются устройства (рис. 5).
В 1997 г. в Санкт-Петербургском НИИ уха, горла, носа и речи начались операции по установке многоканальных систем кохлеарной имплантации. На сегодняшний день более 4000 успешных операций проведено в стенах ФГБУ СПб НИИ ЛОР Минздрава России.
Показания к применению существенно расширились. Сегодня пользователем кохлеарного имплантата может быть ребенок в возрасте нескольких месяцев и взрослый; человек с билатеральными имплантатами; пациент с частичной глухотой, использующий одновременно электрическую и акустическую стимуляцию, или человек с нормальным и неслышащим ухом (односторонней глухотой). Кроме этого были разработаны слуховые стволомозговые имплантаты для лиц, не имеющих функционального слухового нерва или улитки.
Обратим еще раз внимание на основные аспекты создания и развития кохлеарных имплантатов.
I. Создание имплантата, который не налагал бы ограничений на сигнал, используемый для стимуляции, чтобы интеллект системы заключался в компоненте, находящемся вне организма, и мог быть легко усовершенствован. Имплантат должен использовать стимулирующий сигнал, содержащий большое количество информации, тогда как извлечение звуковой информации должен выполнять мозг пациента, а не устройство. По нашему мнению, мозг выделяет речь из сигнала намного надежнее, чем любая электронная схема. Насколько известно, определение отличительных характеристик речи в самих кохлеарных имплантатах больше не используется.
II. Бережное отношение к чувствительным структурам внутри улитки. Разрабатываемые фирмой MED-EL электроды с самого начала были мягкими и гибкими. Уже самому первому пациенту имплантировали тонкие проводки волнообразной формы.
III. Использование всей длины улитки, в т. ч. ee апикальной области, для стимуляции должно привести к широчайшему диапазону слуховых ощущений по высоте, включая очень низкий тон, и позволить избежать длительного процесса адаптации, обусловленного неоднократным картированием воспринимаемого диапазона высоты тона.
IV. Эргономика при повседневном применении устройства пользователями имеет важнейшее значение для принятия и распространения имплантатов. В числе прочего постоянная работа над снижением энергопотребления вывела фирму MED-EL на путь создания заушных и носимых отдельно беспроводных аудиопроцессоров вместо нательных, а в конечном итоге будут разработаны полностью имплантируемые системы.
Список литературы Свернуть Развернуть
1. Kiang N.Y.S., Moxon E.C. Physiological consider¬ations in artificial stimulation of the inner ear // Ann. Otol. Rhinol. Laryngol. 1972. Vol. 81. P. 714-730.
2. Desoyer I., Hochmair E. Implantable eight-channel stimulator for the deaf // Proc. Eur. Solid State Circuits Conference. 1977. P. 87-89.
3. Michelson R.P., Schindler R.A. Multichannel cochlear implant. Preliminary results in man // Laryngoscope. 1981. Vol. 91. P. 38-42.
4. Hochmair-Desoyer I.J., Hochmair E.S., Burian K., Fischer R.E. Four years of experience with cochlear prostheses // Med. Prog. Technol. 1981. Vol. 8. P. 107-119.
5. Tyler R.S. Open-set word recognition with the 3M/Vienna single-channel cochlear implant // Arch. Otolaryngol. Head Neck Surg. 1988. Vol. 114. P. 1123-1126.
6. Hochmair-Desoyer I.J., Zierhofer C., Hochmair E.S. New hardware for analog and combined analog and pulsatile sound-encoding strategies // Prog. Brain Res. 1993. Vol 97. P. 291-300.
7. Helms J. et al. Evaluation of performance with the COMBI40 cochlear implant in adults: a multicentric clinical study // ORL J. Otorhinolaryngol. Relat. Spec. 1997. Vol. 59. P. 23-35.
8. Hochmair I. et al. Deep electrode insertion in cochlear implants: apical morphology, electrodes and speech perception results // Acta Otolaryngol. 2003. Vol. 123. P. 612-617.
9. Schoen F., Mueller J., Helms J., Nopp P. Sound localization and sensitivity to interaural cues in bilateral users of the Med-El Combi 40/40+ cochlear implant system // Otol. Neurotol. 2005. Vol. 26. P. 429-437.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
В статье анализируются проблемы организации реабилитации глухих пациентов после кохлеарной и стволомозговой имплантации. Определены условия, необходимые для обеспечения высокого эффекта кохлеарной имплантации как высокотехнологичного метода восстановления слуховой функции. Приводятся 3 уровня взаимодействия в процессе организации реабилитации пациентов: 1) макроуровень (правительство, включая министерства здравоохранения, образования и соцзащиты); 2) мезоуровень (центры кохлеарной имплантации, медицинские и педагогические университеты); 3) микроуровень (сурдологические и реабилитационные центры, образовательные учреждения). Определяются 2 блока организации слухоречевой реабилитации детей с кохлеарными имплантатами как многолетнего процесса: территориальные медицинские центры осуществляют техническое и медицинское сопровождение пациента со слуховыми имплантатами на протяжении всей его жизни. Констатируется последовательность политики Правительства РФ и Министерства здравоохранения в области внедрения современных технологий лечения и реабилитации глухих детей и взрослых. Делается вывод, что важным условием повышения эффективности слуховой имплантации как медицинской технологии является развитие системы психолого-сурдопедагогической поддержки детей с кохлеарными и стволомозговыми имплантатами на базе центров кохлеарной имплантации и региональных сурдологических центров.
Ключевые слова: глухота, кохлеарная имплантация, стволомозговая слуховая имплантация, организация реабилитации пациентов после кохлеарной имплантации.
Organization of postoperative rehabilitation of deaf patients after cochlear and stembrain implantation
Koroleva I.V., Kuzovkov V.E., Yanov Yu.K.
Saint Petersburg Research Institute of Ear, Throat, Nose and Speech
The article analyzes the problems of organization of rehabilitation of deaf patients after cochlear and stembrain implantation. The authors determine the conditions necessary to ensure a high effect of cochlear implantation as a high-tech method for the restoration of auditory function. There are 3 levels of interaction in the process of organization of the patient’s rehabilitation: 1) the macro level (government, including ministries of health, education and social protection), 2) meso level (cochlear implantation centers, medical and pedagogical universities), 3) microlevel (surdological / rehabilitation centers, educational institutions ). Two steps of the organization of auditory rehabilitation of children with cochlear implants are shown as a long-term process. Local medical centers provide technical and medical support to a patient with auditory implants during his life. The present policy of the Government of the Russian Federation and Ministry of Health in the field of promotion of modern technologies of treatment and rehabilitation of deaf children and adults is consecutive. It is concluded that an important condition for increasing the effectiveness of auditory implantation as a medical technology is the development of a system of psychological and pedagogical support for children with cochlear and brainstem implants on the basis of the centers of cochlear implantation and regional surdological centers.
Key words: deafness, cochlear implantation, auditory brainstem implantation, organization of rehabilitation of the patients after cochlear implantation.
For citation: Koroleva I.V., Kuzovkov V.E., Yanov Yu.K. Organization of postoperative rehabilitation of deaf patients after cochlear and stembrain implantation // RMJ. 2017. № 23. P. 1684-1686.
Для цитирования: Организация послеоперационной реабилитации глухих пациентов после кохлеарной и стволомозговой имплантации. РМЖ. 2017;23:1684-1686.
В статье освещены проблемы организации реабилитации глухих пациентов после кохлеарной и стволомозговой имплантации. Определены условия, необходимые для обеспечения высокого эффекта кохлеарной имплантации. Приводятся уровни взаимодействия в процессе организации реабилитации пациентов, определяются необходимые условия для организации слухоречевой реабилитации детей с кохлеарными имплантатами.
Введение
В настоящее время кохлеарная имплантация является самым эффективным методом лечения двухсторонней глухоты врожденного и приобретенного генеза, обусловленной повреждением слуховых рецепторов улитки [1, 2]. Для лечения пациентов, глухота которых вызвана повреждением слуховых нервов или аномалией/оссификацией улитки, используется имплантация слухового имплантата в кохлеарные ядра ствола мозга (стволомозговая слуховая имплантация) [1].
Кохлеарная и стволомозговая имплантация как медико-технико-педагогические методы лечения включает 3 составляющих:
1) предоперационное диагностическое обследование и отбор пациентов (длительность 3-5 дней);
2) хирургическую операцию (длительность операции кохлеарной имплантации - 1-1,5 ч, стволомозговой имплантации - 5-8 ч);
3) послеоперационную слухоречевую реабилитацию (длительность от 1 мес. до 5 лет).
Цели слуховой имплантации как медико-технико-педагогического метода реабилитации глухих детей и взрослых
• Для позднооглохших взрослых - восстановление с помощью кохлеарного имплантата (КИ) восприятия речи на слух до уровня, близкого к уровню до потери слуха, восстановление трудоспособности пациента, способности к нормальной жизни, улучшение качества жизни.
• Для ранооглохших детей - научить глухого ребенка с помощью КИ слышать, понимать речь и говорить, так чтобы речь стала для него средством общения и овладения знаниями. Обеспечить ребенку возможность учиться, получить профессию, полноценно интегрироваться в общество слышащих.
• Для части ранооглохших детей (с комплексными нарушениями, при позднем возрасте имплантации, пациентов со стволомозговым имплантатом (СМСИ)) - максимально возможное для данного пациента развитие слуха и речи с КИ/СМСИ, улучшение качества жизни пациента и его семьи [3].
Для успешной слуховой имплантации необходимы следующие условия:
• максимально ранняя диагностика нарушения слуха и проведение мероприятий, предшествующих решению о проведении кохлеарной имплантации (раннее слухопротезирование, ранняя психолого-педагогическая абилитация, диагностическое обследование для отбора на кохлеарную имплантацию);
• качественная система КИ/СМСИ, включая организацию ее технического обслуживания, обеспечивающую работоспособность на протяжении всей жизни пациента;
• высокопрофессиональная работа хирурга, сурдолога-аудиолога, сурдопедагога и других специалистов, участвующих в реабилитации;
• эффективное взаимодействие многих специалистов на разных этапах КИ (отбор, хирургическая операция, реабилитация);
• организация многолетней слухоречевой реабилитации ребенка с КИ/СМСИ адекватными современными методами;
• активное участие в реабилитации близких пациента и их профессиональная поддержка;
• социальная поддержка пациента, обеспечивающая возможность использования КИ/СМСИ в течение всей жизни и условия для продолжительной слухоречевой и социальной реабилитации.
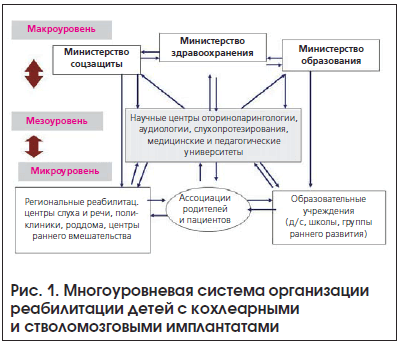
Многокомпонентность и многоэтапность слуховой имплантации как медико-технико-педагогического метода реабилитации, участие в ней специалистов разного профиля, работающих в разных учреждениях, относящихся к разным ведомствам, большая длительность послеоперационной реабилитации ранооглохших детей создают особые проблемы в организации реабилитации. Опыт СПб НИИ ЛОР, а также международный опыт свидетельствует, что в организации реабилитации пациентов с КИ/СМСИ можно выделить 3 уровня (рис.1):
1) макроуровень (правительство);
2) мезоуровень (центры кохлеарной имплантации, университеты);
3) микроуровень (местные сурдологические и реабилитационные центры, образовательные учреждения, подразделения медико-социальной экспертизы, общественные организации самих пациентов).
Макроуровень. На этом уровне определяются общие цели политики правительства по реабилитации детей и взрослых с нарушениями слуха и ее финансированию. В решение задач вовлечено не только министерство здравоохранения, но и министерства соцобеспечения и образования.
К задачам макроуровня относятся:
• проведение аудиологического скрининга новорожденных (обеспечивает раннее выявление нарушения слуха, а значит, потенциальную возможность провести кохлеарную имплантацию ребенку в очень раннем возрасте, если он в ней нуждается);
• выделение средств на закупку слуховых аппаратов и систем КИ/СМСИ, организация кабинетов и центров ранней абилитации детей с нарушениями слуха, хирургическое лечение, оснащение сурдоцентров, послеоперационная реабилитация, обучение специалистов, организация специальных образовательных учреждений и инклюзивного обучения;
• законодательные акты, обеспечивающие последовательную политику в области реабилитации и др.
Мезоуровень. В центрах кохлеарной имплантации реализуются основные этапы и научно-методическое обеспечение кохлеарной имплантации. В университетах (педагогических, медицинских) разрабатываются методы реабилитации, методы коррекционной работы и обучения детей с КИ/СМСИ.
К задачам мезоуровня относятся:
• отбор пациентов на операцию, хирургическая операция, начальный период реабилитации, включая программирование/настройку процессора и первичную реабилитацию;
• научно-организационное и методическое обеспечение процесса реабилитации детей/взрослых с КИ/СМСИ, оценка ее эффективности, включая комплекс диагностических методов оценки слухового и речевого развития детей [1, 3];
• контроль эффективности реабилитации;
• разработка методов коррекционно-развивающей работы и методов обучения детей с КИ/СМСИ;
• поддержка и развитие местных центров реабилитации;
• обучение специалистов Министерства здравоохранения и Министерства образования;
• инициация организационных и законодательных мероприятий в министерствах здравоохранения, соцобеспечения и образования, необходимых для успешной реализации программы кохлеарной имплантации в стране.
Микроуровень. Именно на этом уровне осуществляется основная часть послеоперационной реабилитации детей (и взрослых) после кохлеарной имплантации. Чтобы обеспечить эффективность этого высокотехнологичного метода лечения, в территориальных медицинских и образовательных учреждениях должны быть созданы оптимальные условия для реабилитации и развития ребенка после слуховой имплантации.
На этом уровне должны решаться следующие задачи:
• техническая поддержка пользователей КИ/СМСИ (коррекция настройки процессора, замена поврежденных деталей и процессора, плановая замена процессора);
• разработка индивидуальной программы реабилитации ребенка и условий ее реализации;
• проведение сурдопедагогических занятий по развитию слуха, языковой системы, речи, коммуникативных навыков;
• оценка динамики развития слуха, языковой системы, речи и пр.;
• обучение ребенка с КИ/СМСИ;
• профессиональная помощь ребенку при инклюзивном обучении;
• психологическая поддержка ребенка и его семьи;
• взаимодействие с центрами кохлеарной имплантации по вопросам, связанным с реабилитацией;
• обучение специалистов.
Особую роль в организации реабилитации пациентов с КИ, особенно детей, на местах играют общественные организации, образуемые пользователями КИ и родителями детей с КИ. Эти организации защищают права детей и взрослых с КИ, помогают решать проблемы, связанные с организацией реабилитации и обучения детей с КИ, выходят с законодательными инициативами в поддержку пользователей КИ в административные и правительственные институты. В России в разных городах родители детей с КИ создали ассоциации родителей детей с нарушением слуха, помогая, таким образом, всем детям со слуховыми расстройствами, а не только детям с КИ. Существует также общественная организация «Я слышу мир!», объединяющая родителей и детей с КИ, а также детей со слуховыми аппаратами из разных регионов России.
При организации слухоречевой реабилитации детей с КИ как многолетнего процесса, включающего в т.ч. обучение (образование) ребенка, целесообразно выделить 2 блока [1]:
1-й блок включает 2 года после имплантации.
В этот период поддерживается слуховая имплантация как медицинская технология, а именно: настройка процессора КИ; занятия по развитию слуха у ребенка с КИ как средства развития речи для коммуникации; оценка эффективности медицинского метода реабилитации. Подключение процессора КИ и первичную реабилитацию пациентов проводит центр кохлеарной имплантации. Дальнейшая реабилитация осуществляется, прежде всего, в территориальных сурдологических центрах. Центры и территориальные учреждения нуждаются в реорганизации для решения этих задач.
2-й блок включает дальнейший период после первых 2-х лет наблюдения после имплантации.
Этот период посвящен развитию и обучению ребенка с уже сформированными слуховыми и, частично, речевыми навыками. Программа развития и обучения реализуется в образовательных учреждениях (коррекционных и массовых), которые нуждаются в настоящее время в изменениях, чтобы обеспечить оптимальные условия для развития и обучения ребенка. За территориальными медицинскими центрами сохраняются функции технического (коррекция настройки и замена процессора, замена поврежденных деталей и пр.) и медицинского сопровождения пациентов с КИ/СМСИ на протяжении всей их жизни.
Следует отметить последовательность политики Правительства РФ и Министерства здравоохранения в области развития современных технологий лечения и реабилитации глухих детей и взрослых:
• в 1991 г. проведены первые операции кохлеарной имплантации за счет средств спонсоров;
• с 2005 г. осуществляется регулярное ограниченное бюджетное финансирование операций кохлеарной имплантации;
• с 2010 г. ежегодно проводится 1000-1200 операций КИ, что в целом удовлетворяет ежегодные потребности в этом методе лечения;
• в 2014 г. утвержден стандарт по проведению слухоречевой реабилитации детей с КИ;
• в 2015 г. утвержден порядок замены процессоров КИ.
Важными правительственными решениями, способствующими развитию современной системы медицинской помощи глухим детям, являются также аудиологический скрининг новорожденных в роддомах (с 1998 г. - с использованием поведенческих методов, с 2008 г. - с использованием объективных методов) и финансирование бинаурального слухопротезирования детей с 2-х месяцев.
Однако следует отметить, что в РФ из-за отсутствия условий для послеоперационной реабилитации по месту жительства у значительной части детей кохлеарная имплантация не достигает своей эффективности. Основными причинами являются: 1) отсутствие сурдопедагогов по месту жительства ребенка; 2) использование сурдопедагогами устаревших методов коррекционной работы, не связанных с развитием слуха как основы для овладения речью и вовлечением родителей; 3) отсутствие системы обучения и профессиональной поддержки родителей; 4) отсутствие контроля результатов имплантации на всех этапах реабилитации и пр.
В связи с этим очевидно, что развитие системы сурдопедагогической поддержки детей с КИ/СМСИ на базе центров кохлеарной имплантации и региональных сурдологических центров является настоятельной необходимостью в целях повышения эффективности кохлеарной и стволомозговой имплантации как медицинской технологии.
Читайте также:
- Преимущества протеза на аттачменах при IB классе. Кламмерный протез при IB классе
- Диагностика эпендимальной кисты по КТ, МРТ
- Синдром Фанкони-Альбертини-Целльвегера (Fanconi-Albertini-Zellweger)
- Артериальная гипертензия среди афроамериканцев. Факторы риска развития артериальной гипертензии
- Диагностика дисфункции левого желудочка. Выявление ишемии на фоне дисфункции миокарда
