Изменчивость количественных параметров морфологии и функции левого желудочка
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
В.П. Седов, M.H. Алехин, A.M. Божьев
Sedov V.P., Alekhin M.N., Bozhyev A.M.
Медицинский центр Управления делами Президента Российской Федерации, Москва
Presidential Medical Center, Moscow
Представлены результаты определения скорости изменения объема левого желудочка методом автоматического количественного акустического анализа в реальном масштабе времени у 29 здоровых лиц и 10 больных артериальной гипертонией с признаками диастолической дисфункции левого желудочка. Определены пределы колебаний и средние значения максимальных скоростей увеличения и уменьшения объемов ЛЖ и времени достижения максимальной скорости увеличения объема ЛЖ у здоровых лиц. Установлены корреляционные связи между максимальной объемной скоростью наполнения левого желудочка и временем ее достижения с допплерэхокардиографическими показателями трансмитрального кровотока, характеризующими раннее наполнение левого желудочка. У больных с признаками диастоличсской дисфункции левого желудочка выявлено статистически достоверное уменьшение максимальной объемной скорости наполнения левого желудочка и увеличение времени ее достижения по сравнению со здоровыми.
Automatic real-time acoustic quantification was used to evaluate the rate of changes in left ventricle volume in 29 normal subjects and 10 patients suffering from arterial hypertension with the signs of left ventricle diastolic dysfunction. The range of fluctuations and the mean values of the peak filling rate and the time to the peak filling rate in normal subjects were established. The correlations between the peak filling rate and Doppler indices of transmitral blood flow that mark the early left ventricle filling were delineated. As compared to the normal subjects, the patients with the dias-tolic dysfunction showed a significant decrease in the peak filling rate and a rise in the time to the peak filling rate. ("Визуализация в клинике", 2000, 16:31-34)
Ключевые слова: эхокардиография, количественный акустический анализ, левый желудочек, диастолическая функция.
Key words: echocardiography, acoustic quantification, left ventricle, diastolic function.
Метод автоматического количественного акустического анализа (Acoustic Quantification) позволяет оценивать функцию сердца в реальном масштабе времени. Он основан на автоматическом определении границы между кровью и эндокардом. На основе этого ультразвуковая система обеспечивает автоматический расчет площадей и фракции их изменения или объемов и фракции выброса в каждом сердечном сокращении в реальном масштабе времени. По графику первой производной изменения площадей и объемов в реальном масштабе времени производится расчет максимальных скоростей увеличения и уменьшения площадей и объемов, а также времени достижения максимальной скорости увеличения площади или объема. Скорость максимального увеличения объема левого желудочка (ЛЖ) или наполнения и время достижения максимальной скорости наполнения ЛЖ характеризуют диастолическую функцию ЛЖ и используются при радионуклидной вентрикулографии и вентрикулоангиографии. В эхокардиографической практике для оценки диастолической функции ЛЖ широко применяется допплеровское исследование трансмитрального кровотока. При этом регистрируются линейные скорости диастолического наполнения ЛЖ. Метод автоматического количественного акустического анализа позволяет оценивать объемные скорости наполнения и опорожнения ЛЖ в реальном масштабе времени.
В ряде работ метод автоматического количественного акустического анализа сопоставлялся с допплерэхокардиографической оценкой диастолической функции ЛЖ 5 и с радионуклидной вентрикулографией [8]. Однако в доступной нам литературе мы не нашли нормальных значений максимальных скоростей изменения объема ЛЖ и времени достижения максимальной скорости увеличения объема ЛЖ, а также пределов их колебаний.
Целью данной работы явилось определение пределов колебаний и средних значений максимальных скоростей увеличения и уменьшения объемов ЛЖ и времени достижения максимальной скорости увеличения объема ЛЖ у здоровых лиц и их сопоставление с соответствующими показателями у больных с диастолической дисфункцией ЛЖ.
Материал и методы
В исследование включено 39 человек. Из них 29 обследованных (20 мужчин и 9 женщин) в возрасте от 16 до 54 лет (средний возраст 38.4+/-2.2 лет) не предъявляли жалоб, и у них не было выявлено патологии со стороны сердечно-сосудистой системы, в том числе при двухмерной и допплерэхокардиографии. Остальные 10 пациентов (7 мужчин и 3 женщины) в возрасте от 30 до 71 года (средний возраст 59.3+/-3.0 лет) страдали артериальной гипертонией и имели диастолическую дисфункцию ЛЖ по результатам допплерэхокардиографического исследования трансмитрального кровотока (отношение максимальной скорости раннего наполнения к максимальной скорости позднего наполнения у всех больных было менее 1). Больные с неоптимальной визуализацией сердца при эхокардиографическом исследовании, нарушениями локальной и глобальной сократимости ЛЖ, с нарушениями ритма (мерцательная аритмия, частая экстрасистолия, атрио-вентрикулярные блокады II-III степени, выраженная синусовая аритмия) в исследование не включались.
Всем больным проводилось трансторакальное эхокардиографическое исследование на аппарате "Sonos 2500" фирмы Hewlett Packard (США), оснащенном датчиками с переменной частотой 2.0-2.5 и 2.7-3.5 МГц. Наряду с общепринятыми методиками - одномерной, секторальной эхокардиографией, импульсной, цветовой и постоянноволновой допплерэхокардиографией [2] - проводилось секторальное исследование в режиме автоматического акустического анализа в масштабе реального времени [Intelligent Acoustic Quantification системы "Sonos 2500" фирмы Hewlett Packard (AQi)].
Все параметры наполнения и изгнания ЛЖ определяли с помощью опции автоматического акустического анализа в масштабе реального времени в двухмерном режиме из верхушечного доступа в четырехкамерной позиции. Метод автоматического акустического анализа самостоятельно определяет границы между кровью и тканью в сердце, позволяя вычислять объемы по заданному алгоритму в пределах выбранной исследователем зоны интереса (в данном случае полость ЛЖ). На основе этих данных система позволяет осуществлять мониторинг изменений объема ЛЖ в масштабе реального времени в последовательных сердечных сокращениях, построение кривой изменения объема с расчетом конечных диастолического и систолического объемов и фракции выброса в каждом сердечном сокращении (рис.). Объемы ЛЖ вычислялись методом дисков для одноплановой модели ЛЖ в четырехкамерной проекции [7].
Одновременно проводилось мониторирование первой производной изменения объема ЛЖ с расчетом максимальных скоростей его наполнения (МСН) и изгнания (МСИ), нормализованных по отношению к конечному диастолическому объему ЛЖ, и времени достижения максимальной скорости наполнения (ВМСН). Анализировались средние значения параметров наполнения и изгнания ЛЖ, вычисленные в трех-пяти последовательных сердечных сокращениях.
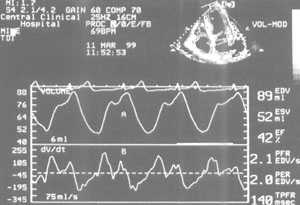
Рис. Пример определения показателей систолической и диастолической функций левого желудочка методом автоматического акустического количественного анализа в четырехкамерной позиции из верхушечного доступа. А - кривая изменения объема левого желудочка, В - первая производная кривой изменения объема. EDV - конечный диасталический объем, ESV - конечный систолический объем, EF - фракция выброса, PFR - максимальная скорость наполнения, PER - максимальная скорость изгнания, TPFR - время достижения максимальной скорости наполнения.
Fig. Automatic acoustic quantification of left ventricle systolic and diastolic function. Apical four-chamber view. A - left ventricle volume waveform, В - left ventricle dV/dt waveform. EDV - end diastolic volume, ESV - end systolic volume, EF - ejection fraction, PFR - peak filling rate, PER - peak ejection rate, TPFR - time to peak filling rate.
Для исключения влияния ЧСС и условий нагрузки на максимум скорости заполнения использовалось соотношение МСН/МСИ [1]. Время достижения максимальной скорости наполнения соотносилось с продолжительностью сердечного цикла (BMCH/RR) и выражалось в процентах.
Для оценки характера диастолического наполнения ЛЖ у всех обследованных проводилось импульсноволновое допплерэхокардиографическое исследование трансмитрального кровотока в четырехкамерной позиции сердца из верхушечного доступа с положением контрольного объема на уровне концов створок митрального клапана. Определяли следующие параметры диастолической функции ЛЖ: максимальные скорости раннего (Е), позднего (А) наполнения, интеграл скорости раннего (Ei), позднего (Ai) наполнения ЛЖ, время замедления максимальной скорости раннего наполнения (ВЗ). Рассчитывались следующие показатели: отношение максимальной скорости раннего наполнения к максимальной скорости позднего наполнения ЛЖ (Е/А), нормализованная максимальная скорость раннего наполнения (Eн) по формуле: Eн = Е / (Ei+Ai),
фракция позднего наполнения (ФПН) по формуле: ФПН = Е / (Ei+Ai) x 100%,
скорость уменьшения максимальной скорости раннего наполнения как отношение Е/ВЗ.
Статистическую обработку результатов производили с помощью электронных таблиц Excel 7.0 и пакета статистических программ Statistica 4.0. Достоверность различий определяли по критерию t Стьюдента. При корреляционно-регрессионном анализе использовали коэффициент линейной корреляции Пирсона (r).
Результаты и их обсуждение
Пределы колебаний и средние значения показателей изменения объема ЛЖ у здоровых мужчин и женщин, вычисленные методом автоматического акустического анализа, представлены в табл. 1. Ранее приводились только показатели изменения площадей ЛЖ у здоровых лиц, вычисленные методом автоматического акустического анализа [5].
При корреляционном анализе установлена статистически значимая связь между МСН ЛЖ и площадью поверхности тела (r=-0.53), а также нормализованной максимальной скоростью раннего наполнения ЛЖ (r=0.53). Статистически значимая связь была обнаружена между ВМСН и максимальной скоростью раннего наполнения (r= -0.42), а также скоростью уменьшения максимальной скорости раннего наполнения (r=-0.39). Время достижения максимальной скорости наполнения ЛЖ нормализованное к продолжительности сердечного цикла, статистически достоверно коррелировало с интегралом скорости раннего наполнения (Ei) ЛЖ (r=-0.37). Статистически значимых связей между показателями изменения объема ЛЖ в диастолу, полученными методом автоматического акустического анализа, и допплерэхокардиографическими показателями, характеризующими позднее наполнение ЛЖ (А, Аi, Е/А, ФПН), обнаружено нe было. Аналогичные данные приводят N. Angomachalelis et аl. [3] для показателей изменения площади ЛЖ в диастолу, согласно которым максимальная скорость увеличения площади ЛЖ хорошо коррелирует с допплерэхокардиографическим пиком E трансмитрального кровотока (r=0.59).
Таблица 1. Параметры изменения объема левого желудочка, рассчитанные методом автоматического количественного акустического анализа, у здоровых лиц (М+/-m)
| Показатель | Мужчины (n=20) | Женщины (n=9) | р |
| МСН, с -1 разброс значений | 3.68+/-0.14 (2.7-4.9) | 4.25+/-0.17 (3.4-4.7) | |
| МСИ, с -1 разброс значений | 3.20+/-0.01 (2.5-3.9) | 3.56+/-0.19 (2.6-4.6) | нд |
| ВМСН, мсек разброс значений | 110.6+/-10.2 (54-216) | 129.3+/-12.8 (50-171) | нд |
| BMCH/RR,% разброс значений | 11.85+/-1.17 (4-22) | 16.00+/-1.9 (6-25) | нд |
| МСН/МСИ разброс значений | 1.15+/-0.08 (0.84-1.59) | 1.11+/-0.11 (0.97-1.5) | нд |
Таблица 2. Параметры изменения объема левого желудочка, рассчитанные методом автоматического количественного акустического анализа, в группе здоровых лиц и у больных с диастолической дисфункцией левого желудочка (М+/-m)
Показатели изменения объема ЛЖ, вычисленные методом автоматического акустического анализа, сравнивались в группах здоровых лиц и больных артериальной гипертонией с признаками диастолической дисфункции ЛЖ и представлены в табл. 2.
| Показатель | Здоровые (n=29) | Больные с диастолической дисфункцией ЛЖ (n=10) | p |
| МСН, с -1 | 3.85+/-0.12 | 3.23+/-0.13 | |
| МСИ, с -1 | 3.32+/-0.09 | 3.32+/-0.18 | нд |
| ВМСН, мсек | 116.4+/-8.1 | 179.9+/-26.7 | |
| BMCH/RR,% | 13.1+1.0 | 18.3+/-2.9 | |
| МСН/МСИ | 1.14+/-0.06 | 0.99+/-0.01 |
Полученные в нашей работе данные о том, что показатели диастолического наполнения ЛЖ, определенные методом автоматического количественного акустического анализа, коррелируют с допплерэхокардиографическими показателями трансмитрального кровотока и позволяют дифференцировать диастолическую дисфункцию ЛЖ, согласуются с мнением большинства исследователей 3. По данным A. Vitarelli et аl. [8], наблюдается высокая корреляция между МСН ЛЖ (r=0.87) и ВМСН ЛЖ (r=0.90), определенными методом автоматического количественного акустического анализа и радио-нуклидной вентрикулографией.
Таким образом, автоматический акустический количественный анализ представляется ценным методом исследования не только у больных с систолической, но и с диастолической дисфункцией ЛЖ, позволяющим неинвазивно в масштабе реального времени определять объемные показатели диастолического наполнения, что было доступно ранее только при применении сложных и дорогостоящих методов исследования.
Выводы
1. Метод автоматического акустического анализа позволяет неинвазивно рассчитывать показатели изменения объема левого желудочка в масштабе реального времени.
2. Максимальная скорость наполнения левого желудочка и время ее достижения коррелируют с допплерэхокардиографическими показателями трансмитрального кровотока, характеризующими раннее наполнение левого желудочка.
3. У больных с признаками диастолической дисфункции левого желудочка наблюдается уменьшение максимальной скорости наполнения левого желудочка и увеличение времени ее достижения.
Литература
Изменчивость количественных параметров морфологии и функции левого желудочка
Е.Н. Бурдина, А.Н. Шопин, А.В. Соболев, Я.Б. Ховаева, Б.В. Головской, М.Д. Берг, В.В. Бурдин, А.А. Баталова
В работе представлен анализ структурно-геометрических особенностей левого желудочка у практически здоровых лиц. С помощью кластерного анализа было выявлено 4 геометрических типа левого желудочка, два из которых связаны с относительным увеличением индекса массы миокарда. Оптимизация геометрической формы левого желудочка у здоровых лиц связана с особенностями энергообеспечения работы сердца, обусловленными конституциональными характеристиками и состоянием сосудистой гемодинамики.
К основным эхокардиографическим показателям геометрии левого желудочка относят индекс сферичности, массу миокарда левого желудочка и индекс относительной толщины стенки левого желудочка [1]. Их изменения отражают процесс ремоделирования левого желудочка [11], который является характерным признаком патологического процесса и ассоциируется с нарушениями систолической и диастолической функций сердца и увеличением сердечно-сосудистого риска [2]. Каждый из перечисленных выше параметров и степень его нарушения подробно изучены у лиц с патологией сердца. У здоровых лиц имеется довольно широкий размах нормальных значений массы миокарда левого желудочка (ММЛЖ), которые в сочетании с различными значениями индекса сферичности и относительной толщины стенки левого желудочка обусловливают множество индивидуальных комбинаций. Это обстоятельство сильно затрудняет как раздельную, так и групповую оценку значимости показателей геометрии левого желудочка для выявления начального этапа процесса ремоделирования левого желудочка, определения направленности гипертрофического процесса и последующего прогноза у здоровых лиц.
Цель исследования
Изучение структурно-геометрических особенностей левого желудочка и анализ их возможных комбинаций у здоровых лиц для выявления геометрических моделей левого желудочка и гемодинамических причин, детерминирующих в последующем ремоделирование левого желудочка.
Материалы и методы
Обследовано 264 практически здоровых лица. Из них 130 мужчин в возрасте от 17 до 55 лет, средний возраст составил 39,58±0,94 лет, и 134 женщины в возрасте от 18 до 59, средний возраст которых составил 38,08±0,85 лет. Критериями включения в исследование явилось отсутствие артериальной гипертензии, сахарного диабета, нормальные показатели ОАК и 12-канальной ЭКГ. Все обследованные лица на момент обследования не предъявляли каких-либо жалоб. Всем обследованным рассчитывали индекс массы тела (индекс Кетле) и площадь поверхности тела (ППТ). ЭхоКГ-исследование проводили на аппарате Aloka 5000 (Япония) с измерением структурных и допплерографических параметров сердца по общепринятой методике [7]. Для характеристики геометрической формы левого желудочка (ЛЖ) использовали следующие показатели: конечные диастолический размер (КДРлж), продольный размер ЛЖ в диастолу (Длж) и диастолический индекс сферичности (ИСд), который рассчитывали как отношение КДР к Длж. Относительную толщину стенок ЛЖ (ОТСлж) рассчитывали по формуле: ОТСлж=ТЗСлжд + ТМЖПд/ КДРлж. Массу миокарда ЛЖ (ММЛЖ) рассчитывали по формуле Devereux R.B. ММЛЖ=1,04·((ТМЖПд+ТЗСлжд+КДР) 3 -КДР 3 )-13,6 и индексировали к площади поверхности тела. Значения иММЛЖ более 130 г/м 2 у мужчин и более 110 г/м 2 у женщин рассматривались как признаки гипертрофии левого желудочка. Систолическую функцию оценивали в М-режиме по величине фракции выброса (ФВ) и ударного объема (УО Рассчитывали работу сердца (А, Дж) и мощность (М, Дж/с) по формулам: А= АДср·133·УО·10 -6 , где АДср - среднее артериальное давлении, 133 - коэффициент для пересчета давления в ед. СИ, УО - ударный объем, 10 -6 - коэффициент для пересчета ударного объема в массу ударного объема; М=А/ЕТ, где ЕТ - продолжительность систолы [9]. При оценке состояния центральной и периферической гемодинамики учитывали также значения минутного объема кровотока (МО), минутной преднагрузки (произведение конечно-диастолического объема на частоту сердечных сокращений) и общее периферическое сопротивление (ОПС), рассчитанное по формуле Франка-Пуазейля: ОПСС (дин/см/сек -5 ) = АДср. х 1332 х 60:МО [4]. Напряжение стенки левого желудочка рассчитывали по формуле: систолическое напряжение (г/см 2 ) = 0,334Pd/(h(1+(h/d))), где Р - систолическое давление, d - КСР, h - толщина задней стенки левого желудочка в систолу (ТЗСлжс) [8]. Диастолическую функцию левого желудочка изучали по временным и скоростным параметрам трансмитрального диастолического потока. При статистической обработке данных использована программа «Statistica 6.0» c применением t -критерия Стьюдента для сравнения двух групп, удовлетворяющих критериям применимости параметрических методов исследования, и u-критерия Манна-Уитни для групп, не имеющих нормального распределения. Данные представлены в виде среднего ± ошибка среднего. В качестве многомерных методов исследования использовался кластерный анализ с предварительным нормированием исходных данных. Применялся метод одиночной связи и метод K-средних с последующим анализом суммы квадратов отклонения объектов от центров кластеров и суммы квадратов отклонений между центрами кластеров, значений F-статистики и уровня значимости р [5а].
Обследуемая группа здоровых лиц была гетерогенна как по антропометрическим данным, так и показателям геометрии левого желудочка. Так, рост обследуемых был от 150 см до 196 см и в среднем составил 168 ± 0,82 см, вес - от 48 кг до 99 кг и в среднем составил 73,4±0,86 кг, индекс Кетле - от 19,8 кг/м2 до 29,3 кг/ м 2 , в среднем составил 24,4±0,19кг/м 2 , площадь поверхности тела - от 1,4 м2 до 2,1м 2 и в среднем составила 1,7±0,01м 2 . Показатели геометрии левого желудочка: иММЛЖ был представлен значениями от 41,80 г/м 2 до 125 г/м 2 , в среднем - 91,9 г/м 2 , ИСд - от 0,45 до 0,83, в среднем 0,6, ОТСлж - от 0,23 до 0,64, в среднем - 0,40. Корреляционный анализ не выявил достоверной линейной зависимости между антропометрическими данными и основными показателями геометрии левого желудочка.
Чтобы систематизировать и классифицировать по однородности имеющееся внутригрупповое разнообразие геометрических форм левого желудочка, мы использовали кластерный анализ, который показал, что все обследованные лица могут быть объединены в 4 кластера, в каждом из которых представленные лица группируются по наиболее схожим значениям группирующих признаков, таких, как иММЛЖ, ОТС и ИСлж (рисунок. 1).
Такая внутрикластерная однородность и межкластерная достоверность различий показателей, характеризующих геометрию левого желудочка, позволяет говорить о четырех геометрических моделях левого желудочка, которые характеризуют сердце здоровых лиц (табл.1).
Графики нормализованных средних значений показателей геометрии левого желудочка в 4-х кластерах, выявляемых в группе здоровых лиц
Таблица 1. Абсолютные значения средних для показателей геометрии левого желудочка в образованных кластерах
Раздельная кластеризация мужчин и женщин показала, что для обоих полов, так же как и в общем случае, можно выделить по 4 основных кластера со схожими графиками средних значений группирующих признаков.
Увеличение иММЛЖ является самостоятельным независимым предиктором сердечно-сосудистого риска [6]. Поэтому, для понимания механизма его увеличения наибольший интерес представляет сопоставление показателей, характеризующих функцию сердца, в кластерах с наибольшим значением иММЛЖ, т.е. в первом и третьем.
Обращает на себя внимание, что при существенных различиях иОТС и ИСд показатель иММЛЖ в сравниваемых кластерах мужчин и женщин имеет сопоставимые значения (табл.2).
Таблица 2. Эхокардиографические параметры левого желудочка в 1-м и 3-м кластерах
Изменения миокарда левого желудочка
Левый желудочек - это сердечная камера, из которой начинается большой круг циркуляции крови. В результате воздействия определенных факторов могут проявляться изменения этой камеры сердца. Что являют собой изменения миокарда левого желудочка? В норме он претерпевает модификации на протяжении всей жизни. У новорожденного его объем 5,5-10см 3 , а к 18 годам размер левого желудочка достигает 130-210см 3 . По причине развития патологий сердечно-сосудистой системы может происходить диффузное, метаболическое, очаговое нарушения в сердечной мышце.
Описание патологии
Изменение миокарда левого желудочка может спровоцировать различные заболевания или же нарушения обменных процессов в сердечной мышце. Умеренные нарушения функционирования сердца могут быть диффузными или очаговыми. Первый тип характеризуется сбоем миоцитов левого желудочка, в результате чего они неправильно сокращаются. То есть, по этим клеткам неправильно проводится электрический импульс.
Второй тип - это очаговые изменения. При этом на стенке левого желудочка образуются рубцы. Они состоят из соединительной ткани, которая не способна проводить электрические импульсы.
Умеренные нарушения метаболического типа могут сами собой прийти в норму, но если такие сбои происходят часто, то миокард не может восстановиться.
Таким образом, изменения могут трансформироваться в необратимые. В процессе усугубления ситуации они способны спровоцировать сердечные патологии.
Когда есть несоответствие между расходом энергии и поступлении ее в миокард, то последствием будут дистрофические изменения. Но даже дистрофия не всегда проявляет себя, а если и есть симптомы, то зачастую это повышенная утомляемость, на которую не всегда обращают внимание.
Гипертрофия левого желудочка - это состояние, которое организм активирует для компенсации процесса кровоснабжения. Особенно часто это происходит, если есть недостаточность митрального клапана. Гипертрофия отражается на состоянии стенок левого желудочка, они теряют эластичность. Также это касается и перегородки между желудочками.
При гипертрофии также происходит утолщение стенок. Оно не всегда равномерное, это может происходить по очаговому принципу, то есть только на определенном участке данной полости. А дистрофия миокарда приводит к тому, что стенка левого желудочка значительно истончается, а полость камеры растягивается.
Причины
Изменения миокарда возникают по многим причинам, и очень важно их правильно диагностировать. Некоторые из-них являются заболеваниями, которые могут даже угрожать жизни.
Причинами и результатом нарушений миокарда являются:
- фибрилляция предсердий;
- стеаноз сердечного клапана (аорты);
- мышечная дистрофия.
Патологические изменения в миокарде левого желудочка могут возникать по причине воспалительных заболеваний. Это миокардит, который провоцирует и диффузные, и очаговые нарушения. А он, в свою очередь, вызывается такими патологиями как ревматизм, грипп, корь, краснуха. Еще провоцируют изменения в миокарде разные аутоиммунные заболевания.
Для организма очень важно, чтобы обменные процессы нормально функционировали, в ином случае происходят дистрофические изменения, вследствие которых меняются миоциты. Нарушение обмена веществ чревато тем, что сердечная мышца не получает достаточного количества полезных веществ и кислорода. Еще это состояние называют кардиодистрофией.
Кадиодистрофия может возникать вследствие:
- Почечной и печеночной недостаточности.
- Сахарного диабета.
- Нарушения работы щитовидной железы, а именно ее гиперфункции.
- Анемии.
- Инфекционных заболеваний как острого, так и хронического характера, самыми популярными являются грипп, туберкулез.
- Интоксикации организма - алкогольная, наркотическая, отравление лекарственными препаратами и другими химическими веществами.
Дополнительно, причинами кардиодистрофии могут быть чрезмерные физические нагрузки, эмоциональные потрясения, стрессовые ситуации. Все эти факторы приводят к хроническому переутомлению. Еще нарушения обмена веществ провоцирует голодание или скудное питание.
У детей также может проявиться изменение миокарда левого желудочка, и причиной этого состояния стает кардиодистрофия. Факторами, спровоцировавшими ее проявление у ребенка, могут стать умственные перенагрузки, снижение двигательной активности.
Метаболические нарушения в миокарде могут возникать из-за сбоя процесса реполяризации. При этом нарушены процессы обмена калия и натрия на внутриклеточном уровне. А также метаболические нарушения возникают вследствие таких факторов:
- переохлаждение;
- повышенная нагрузка как эмоциональная, так и физическая;
- ожирение;
- хронические заболевания.
Кроме того, изменения миокарда ЛЖ возникают в результате прогрессирования атеросклероза, ишемии, гипертонической болезни, аритмии. Это серьезные заболевания, которые провоцируют гипертрофию миокарда.
Симптомы
Довольно часто данные изменения протекают бессимптомно по нескольку лет, или же проявляются незначительно.
Одним из самых распространенных признаков наличия патологических перемен в сердечной мышце является стенокардия. Так как когда стенка левого желудочка утолщается, происходит сжатие сосудов, которые питают мышцу.
Мерцательная аритмия и фибрилляция желудочков могут быть причинами развития изменений миокарда, а также и быть их следствием.
Еще одним симптомом возникновения изменений миокарда является «замирание сердца». При этом человек ощущает, что сердце несколько секунд не бьется. В результате он может потерять сознание.
Дополнительно могут возникать такие признаки:
- стойкое повышение артериального давления, частые его перепады;
- головная боль;
- боль в области сердца;
- слабость, быстрая утомляемость;
- нарушения сна.
Диффузные изменения
Что такое «изменения миокарда левого желудочка диффузного типа»? Данный вид является наиболее распространенным. При этом поражен не только левый желудочек, но и весь миокард, так как диффузные изменения характеризуются именно равномерным поражением.
Диффузные нарушения проявляются как при умеренных патологических процессах, так и при острых ситуациях, как например, инфаркт миокарда. В последнем случае есть и перемены в структуре тканей, и нарушение обменных процессов. Диффузные изменения - это скопление в левом желудочке миоцитов, которые, под влиянием определенных факторов, изменились, и не проводят импульсы.
При диффузных нарушениях миокарда левого желудочка, к общей симптоматике добавляется еще отечность ног, тахикардия, и даже скопление жидкости в легких.
Диффузные изменения миокарда левого желудочка могут спровоцировать ухудшение процесса кровообращения, гипоксии миокарда и возникновению некротических очагов. Самым опасным последствием этих нарушений является инфаркт миокарда.
Неспецифические аномалии
Данные нарушения регистрируются на ЭКГ. Звучит диагноз как «умеренные неспецифические изменения миокарда». Они имеют прямую связь с процессами реполяризации. Такое патологическое состояние влияет на процесс восстановления миоцитов после того, как через них прошел импульс.
Как правило, такие нарушения не опасны, и, при принятии необходимых мер, вполне обратимы, так как их провоцируют различные перенесенные заболевания, гормональные сбои, нарушенные метаболические процессы.
Осложнениями могут быть стенокардия, сердечная недостаточность, а даже инфаркт миокарда.
Изменения миокарда левого желудочка могут быть неопасными для здоровья человека. Довольно часто их диагностируют при плановых обследованиях, то есть случайно. Это значит, что характерных симптомов почти нет. Но не стоит и недооценивать такое состояние - если не принять необходимые меры, то состояние может ухудшиться. Обычно, при умеренных изменениях, врачи рекомендуют поменять рацион питания, отказаться от вредных привычек, наладить психоэмоциональное состояние.
Для подготовки материала использовались следующие источники информации.
Эхокардиографические признаки нарушения диастолической функции левого желудочка при гипертонической болезни
Нормальная диастолическая функция сердца подразумевает способность левого желудочка принимать в диастолу количество крови, необходимое для поддержания сердечного выброса, заключается в способности ее расслабления после этапа изгнания крови.
Под диастолической дисфункцией (ДД) понимают невозможность левого желудочка принимать кровь под низким давлением и наполняться без компенсаторного повышения давления в левом предсердии вследствие структурной и функциональной перестройки миокарда.
Диастолическая дисфункция левого желудочка является достаточно распространенным явлением. Нарушение диастолических свойств негипертрофированного миокарда, возможно, обусловлено развитием в нем интерстициального фиброза и наблюдается после 45 лет, как вариант возрастной нормы.
Этот тип изменения диастолы характерен для стареющего сердца (даже при отсутствии какого-либо сердечнососудистого заболевания) в связи с закономерно возникающими при нормальном старении нарушениями растяжимости, жесткости и податливости миокарда левого желудочка, обусловленными изменениями, происходящими в тканях (прежде всего увеличением содержания коллагена), пониженной рецепторной функцией, эндотелиальной дисфункцией и пр.
Для эхографической оценки диастолической функции левого желудочка применяют импульсное допплеровское исследование трансмитрального кровотока и тканевое допплеровское исследование диастолического подъема основания левого желудочка.
По данным трансмитрального кровотока исследуют максимальную скорость раннего диастолического наполнения левого желудочка (Е), максимальную скорость наполнения левого желудочка в систолу предсердия (А).
Методом тканевой допплерографии измеряют максимальную скорость диастолических волн, соответствующие раннему (е`) и позднему (а`) наполнению левого желудочка.
Метод тканевой допплерэхокардиографии относится к наиболее информативным способам диагностики диастолических нарушений ЛЖ и позволяет регистрировать раннюю диастолическую дисфункцию левого желудочка у всех больных гипертонической болезнью 1-2 ст.
При гипертонической болезни развитие диастолической дисфункции ассоциировано с увеличением тяжести гипертензии: умеренные нарушения диастолической функции наблюдаются уже при I стадии артериальной гипертензии.
Общепринято определять наличие диастолической дисфункции левого желудочка методом эхокардиографии, при этом используется комбинированная оценка трансмитрального диастолического потока и скорости движения митрального кольца.
Выделяют три типа наполнения левого желудочка: с замедленной релаксацией, псевдонормальный и рестриктивный, которые соответствуют незначительной, умеренной и тяжелой диастолической дисфункции.
Выделяют следующие типы диастолической дисфункции
- нарушение релаксации, псевдонормальный и рестриктивный тип. Первые два могут не сопровождаться симптомами, в то время как последний тип соответствует тяжелой степени ХСН с выраженными симптомами.
Диастолическая дисфункция левого желудочка по 1 типу - релаксационному типу характеризуется нарушением способности миокарда левого желудочка расслабиться для полноценного заполнения кровью.
Рабочей группой Европейского общества кардиологов разработаны ультразвуковые диагностические нормативы определения диастолической дисфункции.
Первый тип соответствует начальному нарушению диастолического наполнения, он характеризуется удлинением изоволюмического расслабления левого желудочка, снижением скорости и объема раннего диастолического наполнения, увеличением кровотока во время систолы предсердий. Другими словами, происходит перераспределение трансмитрального кровотока: большая часть крови поступает в желудочек в систолу предсердий. Заметим, что диастолическое давление в левом желудочке при этом может оставаться на нормальном уровне. Сейчас такой тип диастолической дисфункции принято называть Замедленным расслаблением левого желудочка.
Одной из причин ДДЛЖ является Гипертоническая болезнь - при которой нарушается активное расслабление и податливость, увеличение массы и жесткость миокарда, увеличение массы желудочков за счет утолщения их стенки,
Факторы, приводящие к развитию диастолической дисфункции, ухудшают процесс расслабления, уменьшают эластичность стенок левого желудочка, главным образом, вследствие развития гипертрофии (утолщения) миокарда.
При артериальной гипертонии нарушение релаксации выявляется у 90% больных с гипертрофией левого желудочка и у 25% - без таковой. Значительная диастолическая дисфункция иногда наблюдается у больных с весьма умеренным и локализованным утолщением стенки желудочка и без обструкции.
Диастолическое наполнение левого желудочка в норме и при патологии определяется двумя основными факторами — расслаблением миокарда и податливостью (или жесткостью) камеры желудочка
Нарушение диастолического расслабления миокарда. Уменьшению скорости и полноты активного диастолического расслабления принадлежит ведущая роль в патогенезе диастолической дисфункции
Расслабление миокарда представляет сложный энергозависимый процесс, который, согласно современным представлениям, регулируется следующими основными факторами: 1) нагрузкой на миокард во время его сокращения и 2) расслабления, 3) полнотой разъединения акто-миозиновых мостиков в результате обратного захвата ионов кальция саркоплазматическим ретикулумом и 4) равномерностью распределения нагрузки на миокард и разъединения акто-миозиновых мостиков в пространстве и времени. Нагрузка на миокард во время расслабления, в свою очередь, определяется: 1) конечно-систолическим стеночным напряжением в период быстрого наполнения, 2) стеночным напряжением, 3) наполнением венечных артерий в период изоволюмического расслабления и 4) энергией конечно-систолической деформации желудочка (D. Brutsaert с соавт., 1984).
Для раннего выявления диастолической дисфункции левого желудочка у больных гипертонической болезнью необходимо выполнение эхокардиографическое исследование включая проведение тканевого допплеровского исследования
Исследование функции левого желудочка «в покое» включает как определение его глобальной сократимости, так и оценку диастолического наполнения, характеризуемого по трансмитральному кровотоку. Особо подчеркнем целесообразность оценки диастолической функции, так как убедительно доказано, что диастолическая функция левого желудочка изменяется уже на ранних стадиях артериальной гипертензии тесно связана со степенью его гипертрофии. В связи с этим необходимо определять количественные показатели трансмитрального кровотока и тип нарушения (если он имеется) диастолы - нарушение релаксации, псевдонормальный, рестриктивный. На основании этих данных лечащий врач будет в дальнейшем производить дифференциальную диагностику между нарушением релаксации, диастолической дисфункцией левого желудочка и диастолической недостаточностью.
Нарушения диастолической функции левого желудочка часто выявляются у больных с гипертонической болезнью даже при отсутствии гипертрофии левого желудочка. Метод тканевой допплерэхокардиографии в импульсно-волновом режиме является хорошим дополнением к обычной допплерэхокардиографии трансмитрального потока в ранней диагностике диастолической дисфункции левого желудочка, в отсутствие выраженных изменений его геометрии, так как результаты, полученные с помощью данного метода не зависят от гемодинамических условий.
Хроническая перегрузка сердца давлением сопровождается комплексом структурных изменений, включающих диастолическую дисфункцию (ДД) левого желудочка, увеличение массы его миокарда.
Заведующая функциональной и ультразвуковой диагностикой Чибрикова Лилия Медихатовна и врач функциональной диагностики Лютков Евгений Степанович.
Клинико-генетические аспекты развития гипертрофии миокарда левого желудочка
Проблема гипертрофии миокарда левого желудочка находится в центре внимания ученых различных стран уже в течение многих лет. Крупные эпидемиологические исследования убедительно продемонстрировали, что гипертрофия левого желудочка является независимым фактором риска развития сердечно-сосудистых осложнений, своеобразным маркером повышенной летальности. Развитие ГЛЖ сопровождается морфологическими, структурно-функциональными и цито-биохимическими изменениями в миокарде [1]. Гипертрофия миокарда левого желудочка, нарушающая его диастолическую функцию, а, в конечном счете, и систолическую, является грозным предвестником множества осложнений. Ригидность мышечной стенки приводит к таким исходам, как гипертоническое сердце, представляющee угрозу инфаркта миокарда или сердечной недостаточности при артериальной гипертонии, и как внезапная смерть, особенно у молодых, даже без обструкции путей оттока, при гипертрофической кардиомиопатии [2, 3, 4].
Гипертрофическая кардиомиопатия (ГКМП), относится к недостаточно изученным первичным заболеваниям сердца неизвестной этиологии, характеризующимся гипертрофией стенок левого желудочка без расширения его полости, усилением систолической и нарушением диастолической функций. В общей популяции ГКМП составляет 0,2% или 1 случай на 500 человек. ГКМП входит в число самых распространенных наследственных заболеваний сердечно-сосудистой системы [5]. Наряду с длительным стабильным состоянием, гипертрофическая кардиомиопатия может осложняться внезапной смертью, острой и хронической сердечной недостаточностью, жизнеопасными расстройствами сердечного ритма [3].
Гипертрофия левого желудочка выявляется примерно у половины больных с артериальной гипертонией. Термин “гипертоническое сердце” определяет все многообразие функциональных и морфологических изменений в сердце как органе-мишени. Являясь самостоятельным фактором риска развития сердечно-сосудистых осложнений, ГЛЖ значительно ухудшает прогноз у больных артериальной гипертонией. Риск развития инфаркта миокарда и внезапной смерти, возникновение аритмии и сердечной недостаточности увеличивается в 6-8 раз [4].
Данные о роли ГЛЖ в патогенезе и прогнозе развития ГБ, с одной стороны, и современные представления об этиопатогенезе наиболее частой формы кардиомиопатии — гипертрофической, с другой, а также противоречивость мнений и многообразие механизмов развития ГЛЖ при ГБ и ГКМП, позволяют предположить, что патогенетическая основа этих двух патологических состояний отчасти может быть общей [6]. Особое внимание в последние годы уделяется генетической детерминации идентичных, на первый взгляд, нарушений, имеюших различную нозологическую принадлежность. Последнее время стремление многих исследователей направлено на поиск общих этиопатогенетических механизмов в развитии ГЛЖ при ЭГ и ГКМП [7, 8]. В качестве одной из таких попыток следует указать на разработку общей теории патологии сердца. В отечественной литературе эта теория наиболее полно представлена работами П.Ф. Литвицкого. Заслуживает внимания тот факт, что генетическая основа этих двух, казалось бы, различных форм сердечно-сосудистой патологии, в силу множественных эффектов отдельных, имеющих отношение к последней, генов, может быть общей. Надо отметить, что для эссенциальной гипертензии уже сейчас активно исследуется ее генетическая основа, чего нельзя сказать о гипертрофичекой кардимиопатии. Подобные сведения носят единичный характер [8].
В последние годы в рамках активно развивающегося направления «генетической кардиологии» накоплены данные, касающиеся изучения полиморфных локусов кандидатных генов с клиническими проявлениями эссенциальной гипертензии (ЭГ). При ГКМП такие кандидатные гены рассматриваются как гены-модификаторы. Они определяют клинический полиморфизм заболевания, в основе которого лежит мутация конкретного участка ДНК (эффект главных генов) [8]. Тем не менее, результаты, полученные на этом пути исследований, носят противоречивый характер, Многие клинико-генетические связи детально не изучены.
Особый интерес представляют исследования в области генетического картирования, при которых установлена связь между изменениями в тяжелых цепях миозина и Т — тропонтина и гипертрофической кардиомиопатией, а также изменениях в генах, кодирующих ренин-ангиотензиновую систему и отвечающих за фенотипическое разнообразие данного заболевания [9].
Кардиомиопатии представляют собой клинически и генетически гетерогенную группу заболеваний миокарда. Выделяют три основных клинических формы кардиомиопатий: гипертрофическую, дилатационую и рестрективную. Наиболее высока роль наследственных факторов в этиологии гипертрофической кардиомиопатии. Доля семейных случаев оценивается в 20%. В большей части семей с кардиомиопатией прослеживается аутосомно-доминантный тип наследования. Аутосомно-рецессивные и Х-сцепленные формы наследования редки. Обнаружены кардиомипатии, наследуемые только по материнской линии, что предполагает участие митохондриального генома [10]. Современные методы генетического картирования позволили прояснить природу некоторых форм кардиомиопатии и идентифицировать несколько генов (тяжелая цепь бета-миозина, альфа-тропомиозина, сердечного тропонина Т и миозинсвязывающего белка С), кодирующих белки саркомера [12]. Наследуемые по материнской линии формы гипертрофической кардиомипатии связаны с мутациями в генах транспортных РНК митохондрий. Дискутируется связь полиморфизма генов РАС с подверженностью развития ГЛЖ при ГКМП и ЭГ [7,8,9]. Эссенциальная гипертония (ЭГ), составляющая 95% всех артериальных гипертензий у человека, до сих пор остается недостаточно изученной, по сравнению с симптоматическими артериальными гипертензиями. Для всех форм артериальной гипертонии, как и вообще болезней человека, характерно участие наследственных и внешнесредовых факторов в этиопатогенезе, поскольку фенотип есть результат взаимодействия генотипа и среды [12]. В отношении ЭГ до сих пор ведутся дискуссии: одни рассматривают ее как простой менделевский доминантный признак, другие обосновывают мультифакториальный характер наследования. В связи с предположением о существовании большого числа генов подверженности к ЭГ, широко начаты исследования по идендификации некоторых специфических генов.
Исследуются и другие участки ДНК, с которыми можно связать регуляцию АД. Среди них — гипотетичный ген SCL. Из известных, как минимум, семи электрохимических каналов для катионов, перемещающихся через клеточную мембрану, для двух доказано существование трех генов, детерминирующих этот процесс. Для Na-гены SCNN1B и SCNN1G, для Na/H — ген APNH. Эти ионы могут иметь отношение к формированию ЭГ [7,8,13].
Из известных картированных кандидатных генов ЭГ привлекают внимание гены ангиотензин I — конвертирующего фермента, ангиотензиногена, эндотелиальной синтазы окиси азота.
Генангиотензин-превращающего фермента (АСЕ) был найден и клонирован на 17 хромосоме человека. Его полиморфизм представлен присутствием (I-инсерция) или отсутствием (D-делеция) 287 пар нуклеотидных оснований фрагмента ДНК. Обнаружена ассоциации полиморфной вставки Аlu- повтора (I/D-полиморфизма) в 16 интроне гена АСЕ с уровнем АПФ в плазме. Этот полиморфизм детерминирует примерно 47% изменчивости уровня АПФ в плазме и ассоциирован проявлениями ЭГ, ГКМП, ИБС [7,14].
Ангиотензиноген (АGТ) остается малоизученным. Он локализован на хромосоме 1 (1q42-43). К настоящему времени для АGТ описано более 15 различных полиморфных участков. Основной интерес представляют 2 точечные мутации в кодирующей области гена АGТ, приводящие к замене аминокислоты метионина на треонин в положении 235 (полиморфизм М235Т) и треонина на метионин в положении 174 (полиморфизм Т174М) аминокислотной последовательности белкового продукта этого гена [9,11].
Показано, что некоторые полиморфизмы гена АGТ ассоцировались с повышенным АД и, как следствие этой связи, с ГЛЖ и ИБС [10].
Необходимо отметить, что не существует единого мнения при оценке связи между полиморфными вариантами гена АGТ и ГКМП. Выявлена ассоциация аллеля Т174М с уровнем систолического кровяного давления, тогда как в других исследованиях ассоциации этого аллеля с гипертонией и инфарктом не наблюдалось. Противоречивость результатов полученных при изучении связи данного полиморфизма гена АТ с заболеваниями сердечно-сосудистой системы, может быть обусловлена тем, что исследуемая ассоциация с АГ, инфарктом миокарда относится к сложному многокомплексному фенотипу — болезни в целом [10,12].
Ген эндотелиальной синтазы окиси азота (NOS3) определяет уровень окиси азота в стенке кровеносных сосудов. Выявлено три изоформы синтазы окиси азота: индуцибельная, невральная и эндотелиальная. Последняя из указанных форм связана с ЭГ, ИБС, курением, однако данных, указывающих на связь изоформ NOS3 с ГЛЖ, в том числе с ГКМП, очень мало или они обнаруживаются только в экспериментальных исследованиях. Важно отметить, что полиморфизм генов может иметь межпопуляционные и межэтнические различия [8,15].
Большинство многоцентровых клинических исследований, как правило, не принимают во внимание популяционный и этнический принцип отбора клинического материала. Это может приводить к противоречивым результатам, вследствие этнического разнообразия и высокой миграции лиц с различными формами артериальной гипертонии. Поэтому исследование группы больных в отдельно взятой популяции, вероятно, приведет к более достоверным результатам и обоснованным выводам.
Основные патогенетические механизмы эссенциальной гипертонии - такие, как вазоконстрикция, пролиферация гладкомышечных клеток артериальной стенки, ремоделирование левого желудочка, не являются специфичными для этого заболевания. По всей видимости, мы имеем дело с первичными нейрогуморальными нарушениями, вероятнее всего, имеющими под собой генетическую основу [16,17]. Эти нарушения первичны по отношению к гипертонии — значит, генетические изменения в клетках органов-мишеней нельзя назвать ее следствием. Все эти процессы протекают параллельно и необязательно одновременно. Одни и те же триггеры могут запускать каскад событий, ведущий, в итоге, к развитию различных нозологий: гипертонической болезни с гипертрофированным или интактным миокардом — в одном случае, и гипертрофической кардиомиопатией - в другом. Нельзя исключить, что речь идет о едином заболевании, при котором на передний план могут выходить различные проявления: либо АГ, либо ГЛЖ, либо сочетание этих двух симптомокомплексов [18]. В этом плане особый интерес представляют случаи, при которых выраженная гипертрофия миокарда предшествует формированию высокой артериальной гипертензии с характерными изменениями сосудов глазного дна у больных ГКМП с транзиторными подъемами АД. Что заставляет события развиваться по тому или иному сценарию в каждом конкретном случае — неизвестно. С другой стороны, различные первопричины, запуская биомолекулярные и генетические механизмы, приводят к одним и тем же изменениям. Так, например, альдостерон и АТ II вызывают гиперпродукцию коллагена в миокарде, катехоламины и АТ II-вазоконстрикцию. Это и позволяет иногда говорить о гипертонической болезни не как о единой нозологии, а как о целой группе различных заболеваний. То же положение применимо и к гипертрофии миокарда левого желудочка в случае с гипертрофической кардиомиопатией. Клиническая и патогенетическая неоднородность не допускает возможности универсальной терапии. Кроме того, на разных этапах заболевания превалируют различные патогенетические механизмы, что также должно находить свое отражение в терапевтическом подходе [16].
По-видимому, природа формирования гипертрофии миокарда левого желудочка носит мультифакториальный характер [7,9,15,19,20]. В определенной степени пониманию механизмов формирования гипертрофии миокарда левого желудочка может способствовать параллельное клинико-генетическое исследование больных гипертонической болезнью с ГЛЖ и гипертрофической кардиомиопатией.
Литература
1. Kannel W.B. Left ventricular hypertrophy as a risk factor in arterial hypertension // Eur. Heart. J. 1996; 13: Suppl D:82-88
2. Сидоренко Б.А., Преображенский Д.В. Гипертрофия миокарда левого желудочка: патогенез, диагностика и возможносчть обратного развития под влиянием гипертензивной терапии // Кардиология. 1998; 5:80-85.
3. Arnold L. Изменение массы миокарда левого желудочка может служить важным показателем прогноза. Международные направления в исследовании артериальной гипертензии. Выпуск 12, 2000.
4. Кобалава Ж.Д., Котовская Ю.В. Артериальная гипертония 2000. М. 2001.
5. Yu B., French J. Counselling issues in familial hypertrophic cardiomyopathy // J. Med. Genet. 1998; 35: 183-188.
6. Brugada R., Kelsey W. Role of candidate modifier genes on the phenotypic expression of patient with hypertrophic cardiomyopathy// J. Invest. Med. 1997; 45:9:542-551
8. Карпов Р.С., Пузырев К.В. Молекулярно-генетический анализ гипертрофии миокарда левого желудочка// Кардиология. 2001;6:25-30.
9. Furruck S., Malik M. Renin-angiotensin system: genes to bedside // Am. Heart. J. 1997; 134:3:514-527.
10. Tingleff J., Munch M. Prevalence of left ventricular hypertropty in hypertensive population // Eur. Heart. J. 1996;17:143-149.
11. Jeunemaitre X., Charru A. M235T variant of the human angiotensinogen gene in unselected hypertensive patients // J. Hypertens. 1993;11:80-81.
12. Jeunemaitre X., Inoue I. Haplotypes of angiotensinogen in essential hypertension // Am. J. Hum. Genet 1997;60:6:144801460.
13. Devereux R.B., Okin P.M., Roman M.J. Left ventricular hypertrophy as a surrogate end-point in hypertension// Clin. Exp. Hypertens. 1999; 21: 83-89.
14. Schelling P., Fisher H., Ganten D. Angiotensin and cell growth: a link to cardiovascular hypertrophy? // Am. J. Hypertens. 1991; 9: 3-15.
15. Nadaut S., Soubrier F., Seances C.R. Molecular biology and genetics of ON synthases // Soc. Biol. Fil. 1995;189:6:1025-1038.
16. Шляхто Е.В., Кондри А.О. Структурно-функциональные изменения миокарда у больных гипертонической болезнью // Кардиология. 1999; 2: 49-55
18. Tamargo J., Delpon E., Valenzuela C. Treatment of left ventricular hypertrophy in hypertensive patients // Eur. Heart J. 1993; 14: 102-106.
19. Никитин О.П., Малютина С.К. Гипертрофия левого желудочка: популяционо-генетическое исследование // Кардиология. 1999; 6:27-32.
20. Целуйко .И., Максимова Н.А. Генетический аспект гипертрофической кардиомиопатии // Кардиология. 1998; 6: 63-65.
Читайте также:
- Болезнь Розаи-Дорфмана глазницы (синусный гистиоцитоз с массивной лимфаденопатией): признаки, гистология, лечение, прогноз
- Управление автомобилем пациентами с имплантируемым кардиовертером-дефибриллятором (ИКД)
- Геморрагический синдром. Клиника и пример геморрагического синдрома
- Сравнение преимуществ и рисков использования лекарственных препаратов
- Прогноз при нарушении слуха у ребенка
