Канцерогенез рака толстой кишки - этапы, элементы
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026

Поделитесь информацией с друзьями
Основа колоректального рака была определена из клинических и доклинических исследований. Они показали, что никакая другая злокачественная опухоль не показывает такого обилия предопухолевых и/или предраковых поражений. Кроме того, эти повреждения в толстой кишке человека могут быть найдены и удалены довольно легко, и положение дел значительно отличается от большинства злокачественных новообразований, поражающих человека. Колоректальный рак, таким образом, можно предотвратить, вмешиваясь в процесс онкогенеза, который начинается с неконтролируемого роста инициированных клеток крипт, продолжается с образованием аденоматозного полипа или дисплазии и, в конечном счете, через много лет развивается в эпителиальную злокачественность. Даже в этой фазе онкогенеза есть время для вмешательства, потому что локализованные повреждения излечимы хирургическим путем в подавляющем большинстве случаев и/или предотвратимы химиопрофилактикой. К сожалению, многие люди по-прежнему умирают от колоректального рака, что может быть связано с отсутствием соответствующих симптомов и нежеланием людей проходить скрининг. Колоректальный рак может быть предотвращен и побежден, если население в целом осознает важность скрининга ранних поражений (аденоматозный полип и/или дисплазия), и их удаления.
Колоректальный рак естественно развивается от нормальных крипт через аденому (доброкачественное эпителиальное новообразование) к явной аденокарциноме (злокачественное эпителиальное новообразование) в среднем в течение 10-20 лет, тем самым обеспечивая окно возможностей для эффективного вмешательства и профилактики. Канцерогенез толстой кишки происходит посредством многостадийного процесса, характеризующегося молекулярными и клеточными изменениями. Некоторые из этих изменений включают изменения в онкогенах, потерю генов-супрессоров опухоли и аномалии в генах, участвующих в репарации ДНК; эти молекулярные изменения приводят к идентифицируемым предопухолевым поражениям, таким как ACF*, BCAC**, MDF*** и аденоматозный полипы.
*ACF (Aberrant crypt foci) очаги аберратных крипт - это ранние очаги поражения, распознаваемые на поверхности просвета толстой кишки у крыс, обработанных специфическими для толстой кишки канцерогенами. Эти очаги характеризуются криптами с (1) измененными просветами устьев, (2) утолщенным эпителием и (3) большими, чем нормальные соседние, криптами. Количество ACF увеличивается со временем после воздействия канцерогена, но есть только слабые доказательства корреляции развития опухоли с выраженностью ACF. Скорее, ACF может использоваться в качестве конечной точки в развитии колоректального рака, потому что аберрантные крипты постулируются как самые ранние идентифицируемые потенциальные предшественники колоректального рака у грызунов и людей. Анализ ACF может способствовать изучению ранних патологических и молекулярных изменений, предшествующих развитию аденомы до колоректального. Таким образом, ACF может в конечном итоге эволюционировать в полипы и позже в колоректальный рак в случае последовательности “аденома-карцинома”.
**BCAC (Beta-Catenin-AccumulatedCrypts) крипты, накапливающие бета-катенин. У крыс или мышей с предрасположенностью к развитию колоректального рака гистологические срезы (горизонтальные срезы) выявляют диспластические крипты с избыточным накоплением β-катенина, называемые BCAC. Эти процессы нарушают морфологию клетки и увеличиваются со временем после обработки карциногеном. BCAC не проявляются внешним видом, как ACF, и, как правило, не заметны на поверхности слизистой оболочки. BCAC имеют большую дисплазию, чем ACF, и связаны с клетками Панета, как и колоректальный рак, в противоположность нормальному эпителию толстой кишки. Однако неясно, представляет ли BCAC подгруппу ACF или может быть четко очерчена как отдельная сущность. Эти очаги рассеяны по нескольким криптам, возможно, из-за сегментирования крипты или миграцией клеток. Очевидно, что не все эти клетки являются злокачественными, так как количество колоректальных раков меньше, чем количество очагов BCAC.
*** MDF (Mucin Depleted Foci) фокусы, обедненные муцином. MDF может быть предраковым поражением, которое лучше предсказывает канцерогенез толстой кишки, чем ACF. Мутации присутствуют в MDF с частотой, аналогичной частоте опухолей, что усиливает доказательства того, что этот феномен является предраковым поражением.
Вполне вероятно, что MDF, BCAC и ACF являются тремя видами одной и той же группы поражений, не идентичными, но в значительной степени перекрывающими друг друга, потому что (1) недостаток/отсутствие продукции муцина MDF также обычно имеет место и при BCAC, и при ACF, (2) бета-катенин накапливается в клетках MDF, BCAC и ACF, и (3) диапазон мутаций также наблюдается во всем этих феноменах.
Takuji Tanaka. Colorectal carcinogenesis: Review of human and experimental animal studies. J Carcinog. 2009; 8: 5. doi: 10.4103/1477-3163.49014 PMCID: PMC2678864 PMID: 19332896
Аденокарцинома кишки - симптомы и лечение
Что такое аденокарцинома кишки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Мешечкиной Виктории Геннадьевны, онколога со стажем в 9 лет.
Над статьей доктора Мешечкиной Виктории Геннадьевны работали литературный редактор Вера Васина , научный редактор Вячеслав Михайличенко и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Аденокарцинома толстой кишки — это самая распространённая форма рака прямой кишки, опухоль развивается в толстой кишке и может метастазировать, как и большинство злокачественных новообразований.
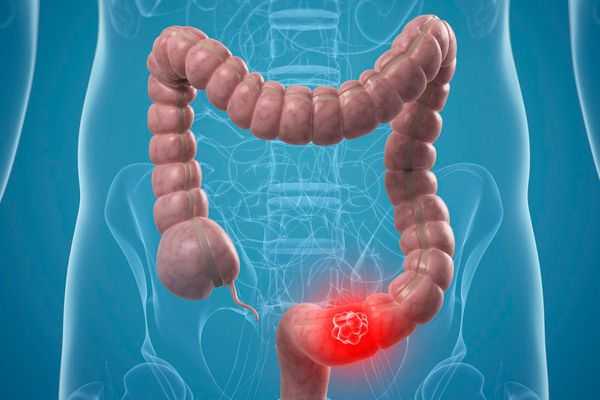
Распространённость аденокарциномы толстой кишки
Аденокарцинома толстой кишки составляет около 95 % от всех случаев колоректального рака, который считается третьим по распространённости среди различных видов рака [19] . Риск развития рака толстой кишки в популяции достигает 5-6 % [1] . Каждый год в мире диагностируется около миллиона новых случаев.
Пятилетняя выживаемость для этого типа опухоли составляет около 60 % и зависит в первую очередь от степени распространения опухоли и уровня злокачественности [1] .
Факторы риска
Основной фактор риска аденокарциномы толстой кишки — возраст старше 65 лет. Риск развития аденокарциномы толстой кишки также возрастает при наличии некоторых наследственных синдромов:
- MutYH-ассоциированный полипоз (вызванный мутациями в гене MutYH);
- семейный аденоматоз толстой кишки;
- синдром Линча.
Благоприятным фоном для злокачественного перерождения клеток являются единичные или множественные полипы толстой кишки. Высокий риск перерождения в раковую опухоль имеют аденоматозные полипы. Отказ от их удаления может привести к развитию аденокарциномы.
Хронические воспалительные заболевания толстой кишки, такие как неспецифический язвенный колит и болезнь Крона, также повышают риск развития аденокарциномы.
К дополнительным факторам риска относят:
- высокое содержание в рационе красного мяса; ;
- сахарный диабет 1-го и 2-го типа; ;
- гиподинамию.
Радиационный фон и работа с химическими реагентами к развитию этого вида рака не приводят [1] [2] [3] [4] [6] [9] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы аденокарциномы кишки
Клинические проявления аденокарциномы толстой кишки зависят от расположения опухоли, её типа, темпа роста и наличия сопутствующей патологии. Ранние формы рака являются случайной находкой, так как могут никак себя не проявлять. Их выявляют при эндоскопическом исследовании кишечника по поводу других заболеваний (например, колита, дивертикулита, холецистита, гастрита и др.) или при полостных или гинекологических операциях — аппендэктомии, миомэктомии и кесаревом сечении.
Наиболее частые симптомы аденокарциномы толстой кишки:
- кровь в стуле;
- запоры или поносы;
- постоянные умеренные боли в животе;
- слабость;

Опухоли левого фланка (сигмовидной и прямой кишки, селезёночного угла, нисходящего отдела) чаще манифестируют с запоров, примеси прозрачной или розоватой слизи и тёмной крови в кале, болезненных позывов, отдающих в промежность.
Опухоли правого фланка (слепой кишки, восходящего отдела и печёночного угла) выявляют позднее, так как первые симптомы проявляются не сразу, а при обширном распространении опухоли, и носят общий характер: слабость, снижение аппетита, похудение, анемия, субфебрильная температура (37,1—38,0 °C). В некоторых случаях пациент самостоятельно обнаруживает плотное образование в животе, справа от пупка [12] .
Поиск причины анемии невыясненной этиологии часто приводит к обнаружению рака правой половины толстой кишки.
Патогенез аденокарциномы кишки
Аденокарцинома — это злокачественная опухоль, возникающая из железистых клеток и способная образовывать метастазы (вторичные очаги опухолевого роста). Чаще всего заболевание развивается на фоне длительно существующих полипов, или разрастаний слизистой.
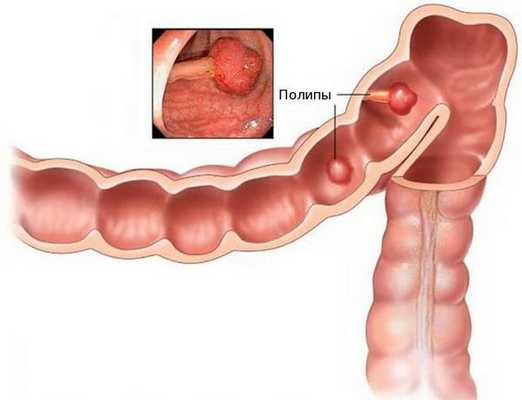
При хроническом повреждении полипов плотными каловыми массами и воспалении развивается дисплазия эпителия (нарушение деления и дифференцировки клеток), переходящая в рак. У кого-то этот процесс может занять десятки лет, у других развивается за два-три года.
Среди пациентов с раком проксимальных отделов толстой кишки преобладают женщины — вероятно, это связано с наличием гормональных рецепторов эстрогенов в этих отделах. Дистальный рак толстой кишки более характерен для мужчин.
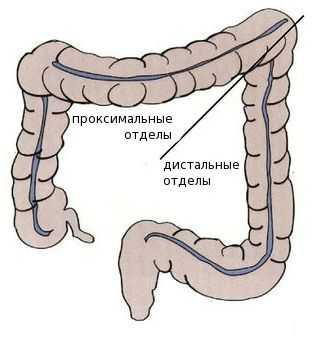
В отличии от опухолей правого фланка, для которых нехарактерны генетические мутации, левосторонним локализациям присущи комплексные хромосомные аномалии, например множественные мутации в генах системы исправления повреждений ДНК. Эти особенности важны при подборе лечения и режима химио-, таргетной (целенаправленно воздействующей на специфические мишени в опухолевых клетках) или иммунотерапии [1] [5] [6] [7] [8] .
Классификация и стадии развития аденокарциномы кишки
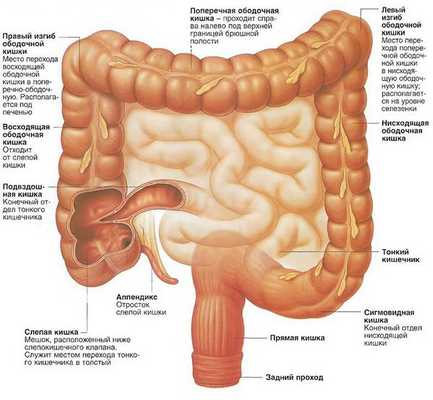
Виды аденокарциномы толстой кишки в зависимости от локализации:
- рак слепой кишки;
- рак восходящей ободочной кишки;
- рак поперечной ободочной кишки;
- рак печеночного изгиба ободочной кишки;
- рак селезеночного изгиба ободочной кишки;
- рак нисходящей ободочной кишки;
- рак червеобразного отростка;
- рак сигмовидной кишки;
- рак ректосигмоидного отдела толстой кишки;
- рак прямой кишки.
Согласно последней классификации ВОЗ, гистологически выделяют две степени злокачественности аденокарциномы толстой кишки, опираясь на долю железистых структур в составе опухоли: высокую и низкую.
Стадирование новообразований толстой кишки по системе TNM-8 (2017 г.) представлено схемой:
Исходя из этих данных, опухоли присваивают определенную стадию, и далее она уже не меняется. Дальнейшее распространение процесса обозначается как прогрессирование.
- I и II стадия — опухоль ограничена толстой кишкой;
- III стадия - наличие метастазов в лимфоузлах;
- IV стадия - наличие отдалённых метастазов [13][14] .
Осложнения аденокарциномы кишки
Наиболее частым осложнением аденокарциномы толстой кишки является обтурационная толстокишечная непроходимость. Она развивается у 26-69 % пациентов. Это осложнение наиболее характерно для опухолей левых отделов толстой кишки [15] . Поэтому перед началом лечения для минимизации рисков кишечной непроходимости пациентам рекомендуется формирование колостомы — специального отверстия, выводящего край кишки на переднюю брюшную стенку до опухолевого сужения. Решение о формировании колостомы принимается по данным колоноскопии.
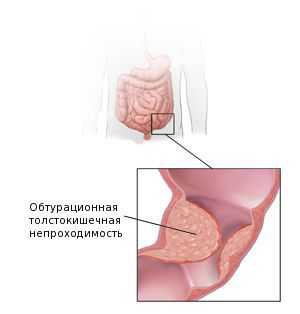
Также среди частых причин осложнений выделяют перфорацию и кровотечение из повреждённой опухоли. Это может явиться первым симптомом заболевания. Часто таких пациентов экстренно оперируют в условиях многопрофильного стационара, а не специализированного учреждения, и только при обследовании органов брюшной полости становится понятна причина перфорации.
При нарушении питания опухолевого узла и развитии его ишемии возможно воспаление в зоне роста опухоли, что тоже требует неотложной хирургической помощи [15] [16] [17] . Воспаление сопровождается общей слабостью и повышенной температурой тела.
Диагностика аденокарциномы кишки
Сбор анамнеза
Помимо описанных выше жалоб, с которыми первично обращаются пациенты, важны данные анамнеза. На первичном осмотре терапевту или онкологу следует отметить наличие наследственных синдромов, ассоциированных с раком толстой кишки, и хронических неспецифических воспалительных процессов толстой кишки, например неспецифического язвенного колита или болезни Крона.
Физикальное обследование
При физикальном обследовании, помимо общего осмотра и пальпации брюшной полости, обязательно проведение ректального пальцевого исследования, выявляющего изменения в области прямой кишки. Это один из самых простых диагностических приёмов, не требующий дополнительной подготовки и оборудования.
Лабораторная диагностика
Лабораторная диагностика включает:
- развёрнутый клинический и биохимический анализы венозной крови;
- коагулограмму (исследование белков системы свёртывания крови);
- анализ мочи.
Это анализы необходимы для исключения возможной сопутствующей патологии.
Биопсия
После общеклинического обследования проводят уточняющее исследование (биопсию) для определения гистологической структуры опухоли. Чаще всего биопсия выполняется во время колоноскопии — процедуры, при которой врач с помощи эндоскопа осматривает внутреннюю поверхность толстой кишки.
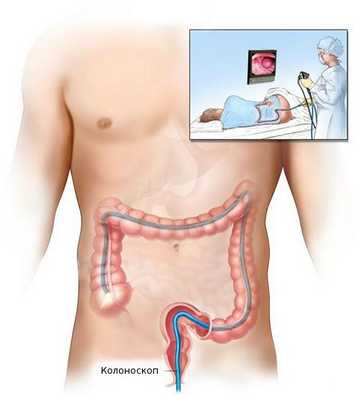
Ирригоскопия и КТ-колонография
При невозможности проведения колоноскопии врач может назначить ирригоскопию или КТ-колонографию.
Ирригоскопия — это рентгенологический метод обследования толстого кишечника с помощью контрастного вещества, вводимого через прямую кишку.
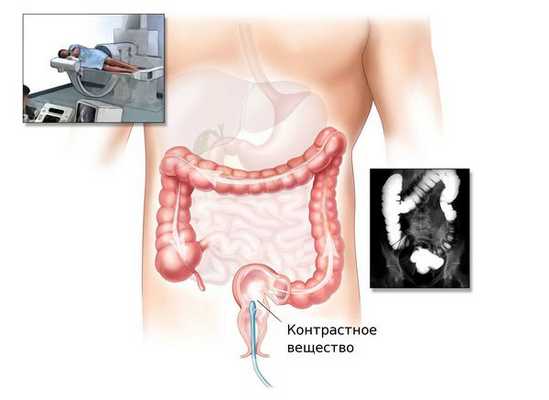
КТ-колонография — разновидность компьютерной томографии, проводимая при помощи компьютерного томографа.
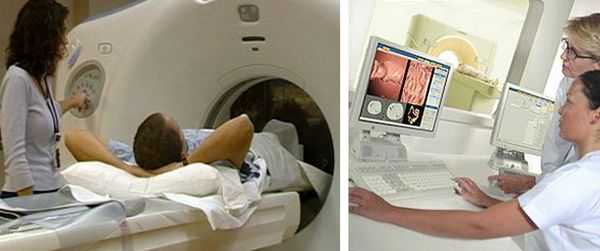
Компьютерная томография (КТ)
КТ органов грудной клетки и брюшной полости с контрастом — стандарт обследования при раке ободочной кишки. Компьютерную томографию проводят для исключения метастазов в лёгких, лимфоузлах средостения, брюшной полости, канцероматоза (переноса раковых клеток из первичного очага), асцита (скопления жидкости в брюшной полости) и вторичного поражения печени.
Магнитно-резонансная томография (МРТ)
МРТ органов брюшной полости с внутривенным контрастированием применяют для планирования операции на печени при её вторичном поражении.
Для точной оценки размеров опухоли перед операцией и правильного стадирования по TNM проводится МРТ малого таза c применением контраста.
Дополнительно, при наличии болевого синдрома или изменений по КТ, проводится остеосцинтиграфия (ОСГ) — исследование состояния костей скелета.
При подозрении на вторичное поражение головного мозга (исходя из жалоб, осмотра и анамнеза) назначается МРТ головного мозга с внутривенным контрастированием.
Позитронно-эмиссионная томография, совмещённая с компьютерной томографией (ПЭТ/КТ)
ПЭТ-КТ не применяется как рутинный метод при первичной диагностике. Обследование проводят при подозрении на вторичные изменения по данным КТ или МРТ для получения дополнительных данных.
Обязательным этапом планирования лечения является пересмотр биопсийного или операционного материала на наличие MSI (микросателитной нестабильности, нарушении системы восстановления ДНК) и мутации генов семейства BRAF и RAS [18] .
Лечение аденокарциномы кишки
Выбор метода лечения аденокарциномы толстой кишки обусловлен стадией онкологического процесса и наличием или отсутствием соматической патологии.
0-I стадия
На ранних стадиях рака ободочной кишки проводятся органосохраняющие операции, например эндоскопическую резекцию слизистой с удалением в подслизистом слое. При поражении краёв резекции, сосудистой, лимфатической или периневральной инвазии (проникновении раковых клеток в периневрий — слои соединительной ткани, образующие оболочку вокруг пучков нервных волокон), как факторах неблагоприятного прогноза, рекомендуется проведение расширенной операции — повторной резекции краёв.
II-III стадия
При резектабельном (c возможностью удаления) локализованном и местнораспространённом раке ободочной кишки II-III стадий на первом этапе предпочтительно оперативное лечение. Объём хирургического вмешательства определяется индивидуально.
Химиотерапия проводится при поражении лимфатических узлов, прорастании опухолью серозной оболочки и соседних органов, наличии факторов риска.
При нерезектабельном раке ободочной кишки на первом этапе рекомендуется сформировать обходные анастомозы , колостому (выведение участка толстой кишки) или илеостому (выведение участка тонкой кишки). Эти методы снижают вероятность развития кишечной непроходимости на фоне предоперационной химиолучевой и химиотерапии.
При распространённом раке ободочной кишки с резектабельными или потенциально резектабельными синхронными метастазами в печени или лёгких выполняют R0-резекцию (в пределах здоровых тканей).
Радиочастотная абляция и стереотаксическая лучевая терапия применяются как дополнительные методы к резекции печени и как самостоятельные методы лечения. Действие радиочастотной абляции основано на нагревании с помощью радиоволн поражённых тканей до высоких температур (90-100 °С).
Стереотаксическая лучевая терапия — это один из видов радиохирургии, который состоит в применении высокоточного излучения, воздействующего на опухоли.
При резектабельных очагах рекомендуется их одномоментное хирургическое удаление.
На послеоперационном этапе при резектабельных метастатических очагах показано проведение адъювантной (следующей за операцией) химиотерапии. Также возможно проведение дооперационной химиотерапии до шести циклов, удаление метастазов и первичной опухоли с дальнейшим продолжением химиотерапии до достижения шестимесячной суммарной продолжительности лечения.
IV стадия
Основная цель лечения на IV стадии заболевания — перевод при помощи химиотерапии нерезектабельных метастазов в резектабельные. Хороший эффект даёт добавление к основному лечению таргетной терапии ( целенаправленно воздействующей на специфические мишени в опухолевых клетках) и иммунотерапии.
При проведении нерадикальной резекции возможно продолжение терапии предоперационной комбинацией химиопрепаратов и моноклональных антител (препаратов, избирательно воздействующих на определённую молекулу, от которой зависит развитие болезни ) до достижения суммарной шестимесячной продолжительности лечения.
При генерализованном раке ободочной кишки с нерезектабельными метастазами применяют комбинацию химиопрепаратов. Возможно добавление таргетных препаратов. Цель лечения — максимально долго контролировать развитие заболевания при сохранении качества жизни.
При проведении химиотерапии каждые 1,5-2 месяца оценивают резектабельность опухоли (по данным КТ, МРТ). При преобладании метастатического поражения печени проводят:
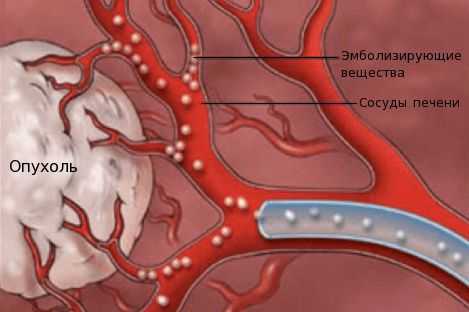
- химиоэмболизацию — введение в просвет сосудов, питающих опухоль, эмболов (специальных мелких частиц) для прекращения кровоснабжения новообразования;
- химиоинфузию в сосуды печени — установка катетера в сосуде, питающем опухоль, с последующим введением химиопрепаратов.
При наличии тяжёлой сопутствующей патологии, препятствующей проведению радикального лечения, рекомендуется проведение симптоматической терапии, паллиативной химиотерапии или химиолучевой терапии [1] [10] [18] .
Прогноз. Профилактика
Пятилетняя выживаемость при раке толстой кишки составляет 63 % [20] . Высокие показатели смертности связаны с поздней диагностикой заболевания. При развитии болезни метастазы чаще всего выявляются в печени, что обусловлено особенностями венозного оттока от кишечника через систему воротной вены печени.
Другой частой локализацией аденокарциномы толстой кишки является брюшина. Опухоль брюшины выявляется примерно у 10 % первичных пациентов. Вторичные метастазы брюшины выявляются примерно в 60 % случаев [10] .
Пятилетняя выживаемость у пациентов с метастазами рака толстой кишки в печень на симптоматической терапии не превышает 2 %. Медиана выживаемости (промежуток времени с момента постановки диагноза, в течение которого половина пациентов остаются живы) составляет 6—10 месяцев [10] .
Канцеропревенция толстой кишки

Ведение здорового образа жизни от рождения до смерти
Без автора
Канцеропревенция - это комплекс профилактически мер, направленных на системное предотвращение риска и частоты возникновения злокачественных поражений. Первичная - это предотвращение развития аденом и воспалительных заболеваний кишки. Вторичная - предотвращение рецидива развития аденомы или аденокарциномы той же или иной локализации после удаления. Канцеропревенция толстой кишки - комплекс мер, направленных на предотвращение рака именно в толстой кишке.
Профилактический комплекс
- Понижает риск развития рака толстой кишки употребление клетчатки в пищу. Большое количество клетчатки в овощах, фруктах, крупах и злаках. Снижение канцерогенеза связано с наличием в клетчатке витамина С, флавоноидов, каратиноидов, пищевых волокон.
- Ежедневная аэробная физическая активность умеренной интенсивности (в течение 15-20 мин) понижает риск развития рака толстой кишки на 25%.
- При употреблении фолиевой кислоты, аспирина, НПВП, нутрицетивных продуктов (куркумин, омега-3 жирные кислоты) выявлено снижение риска канцерогенеза в толстой кишке.
- Пробиотики являются первичной профилактикой рака толстой кишки. Например, Лактобактерии и Бифидумбактерии оказывают тормозящий эффект на опухолевые клетки. Другие бактерии блокируют пути, инициирующие рост опухоли. Другие активируют местный иммунитет и защищают специфическими белками от опухолевого роста. При раке нарастают колонии микроорганизмов Эшерихий, Псевдомонад, Клибсиелл, Шигелл, Протеобактеров.
- Повышает риск развития рака толстой кишки употребление в пищу красного мяса (говядина, баранина, свинина). В 22 исследованиях установлено, что ежедневное включение в рацион более чем 50 г красного мяса, увеличивает риск развития рака ободочной кишки в 1,21 раза, НО НЕ УВЕЛИЧИВАЕТ развития рака прямой кишки. Включение в рацион красного мяса более одного раза в день увеличивает риск развития рака ободочной кишки в 1,37 раза, а рака прямой кишки в 1,43%.
- Повышает риск развития рака толстой кишки курение алкоголь, избыток веса. При повышении массы тела более 1 кг в год увеличивает риск развития рака толстой кишки более чем в 2 раза (2,05 раза).
- Повышение риска канцерогенеза в толстой кишке связано с приемом витамина Д и повышением его уровням концентрации в организме.
- Хронические заболевания кишечника, имеющие вялотекущий характер, также ведут к увеличению риска развития онкологических процессов в толстой кишке.
Специфическими причинами появления низкодифференцированной аденокарциномы (это наиболее злокачественный процесс) толстой кишки являются:
Молекулярно-генетические аспекты канцерогенеза в толстой кишке

Колоректальный рак (КРР), или карцинома толстой кишки (ТК), — это злокачественная опухоль, состоящая из эпителиальной ткани и поражающая слепую, ободочную и/или прямую кишку, включая ее анальный отдел [1].
Данная форма рака наиболее часто встречается в развитых странах, занимая в структуре онкологической заболеваемости третье место у мужчин и второе — у женщин [2]. Опухоли толстой и прямой кишки по своей распространённости уступают лишь раку легкого. Ежегодно в мире диагностируется более 1 млн. 200 тыс. карцином толстой кишки и отмечается около 700 тыс. смертей от данной патологии. При этом в Германии ежегодно диагностируют 50 тыс. первично обнаруженных заболеваний КРР. Много таких больных в Дании, Ирландии и Нидерландах: 40-61 случай на 100 тыс. В России за последние 50 лет (с 1960 по 2010 г.) количество первичных заболеваний КРР выросло в 7 раз. За 10 лет число больных увеличилось на 22 % и достигло 46 тыс. в год. В США ежегодно выявляют 150 тыс. новых случаев КРР, из них 55-60 тыс. заканчиваются смертельным исходом [1].
Таким образом, проблема КРР стала в последнее время одной из наиболее актуальных медико-социальных проблем, требующей самого пристального внимания исследователей.
Эпидемиологическими исследованиями в большинстве развитых стран была установлена тесная корреляционная связь увеличения заболеваемости с тремя основными факторами [3]:
‒ увеличением потребления в пищу животных жиров и белков. Известно, что продукты распада белков могут быть материалом для кишечного синтеза N-нитрозаминов и других метаболитов, которые обладают канцерогенной активностью;
‒ снижением потребления в пищу волокнистой клетчатки. Чрезмерная очистка углеводов приводит к снижению массы невсасываемой целлюлозы, являющейся своего рода адсорбентом для экзогенных и эндогенных канцерогенов. Также удлиняется время пассажа по кишечнику;
‒ наличие кишечном содержимом эндогенных канцерогенов: индола, скатола, гуанидина, метаболитов стероидных гормонов;
‒ менее подвижным образом жизни современного человека, что также ведёт к замедлению пассажа по кишечнику.
Также факторами риска являются ожирение, возраст старше 50 лет, гипотония и атония кишечника (приводит к хроническим запорам и воздействию на слизистую толстой кишки канцерогенов в условиях длительного застоя каловых масс, и как следствие, её травматизация в местах физиологических изгибов) [3].
Существует 4 класса генов, которые задействованы в процессе канцерогенеза [1]:
1) протоонкогены — это нормальные гены клеток, участвующие в регуляции процессов их роста и дифференцировки. В зрелых тканях они, как правило, неактивны. Активация протоонкогенов и превращение их в клеточные онкогены происходят при опухолевом росте и в ходе эмбриогенеза. Некоторые клеточные онкогены активируются также при пролиферации и дифференцировке клеток в очагах репаративной регенерации;
2) гены-супрессоры опухолей (антионкогены), ингибирующие пролиферацию клеток;
3) гены, участвующие в гибели клеток путем апоптоза. Известно, что апоптоз — генетически запрограммированная смерть клеток в живом организме. Основная биологическая роль апоптоза в норме — установление нужного равновесия между процессами пролиферации и гибели клеток;
4) гены, отвечающие за процессы репарации ДНК.
В соответствии с наличием или отсутствием наследственной предрасположенности к КРР выделяют 3 его формы:
‒ наследственный семейный неполипозный КРР (синдром Линча);
‒ наследственный КРР при семейном аденоматозе;
‒ спорадический (ненаследственный) КРР.
На долю наследственных форм КРР приходится не более 4-6 %, а спорадического КРР — 94-96 % [1].
Наследственный неполипозный КРР (Hereditary Nonpolyposis Colorectal Cancer — HNPCC) составляет около 2-3 % всех случаев КРР, происходит вследствие мутации в одном из нескольких генов, участвующих в репарации ДНК, а это в 50 % случаев обусловливает риск развития КРР. HNPCC-синдрому присуще существование фенокопий, т. е. наличие нескольких генов (hMLH1, hMSH2, hMSH3, hMSH6, hPMS2), мутация в которых вызывает идентичные фенотипические отклонения наследственного неполипозного рака ТК. Все перечисленные гены отвечают за репарацию непарных оснований ДНК (mismatch repair). Их инактивация характеризуется картиной так называемой «микросателлитной нестабильности» (MSI — microsatellite instability) [1].
Семейный аденоматозный полипоз (FAP — familial adenomatous polyposis) — аутосомно-доминантное заболевание со 100 % риском возникновения КРР. Он проявляется возникновением сотен полипов ТК, некоторые из которых неминуемо трансформируются в злокачественную опухоль. У 5 % больных озлокачествление полипов происходит уже к 20-летнему возрасту. Встречаемость FAP в популяции составляет приблизительно 1 на 8 тыс. FAP-синдром чаще всего связан с инактивирующей мутацией в гене опухолевой супрессии АРС (adenomatous polyposis coli), хотя сходные по клиничecкoй картине проявления могут вызываться повреждением и других генов, в частности гена MYH — MUTY-гомолога. FAP-синдром составляет менее 1 % всех случаев КРР [1].
Что касается спорадического КРР, выделяют два основных пути развития рака. Один из них «канонический», или супрессорный, путь, который сопровождается хромосомной нестабильностью (CIN — chromosomal instability). Супрессорный путь присутствует в 80-85 % случаев колоректальных карцином. В данном случае развитию карциномы предшествует аденома. Патогенез КРР включает как активацию онкогенов, так и инактивацию супрессорных генов. Данный вариант характеризуется потерей аллельных локусов в хромосомах 5q (APC), 17p (p53) и 18q (DCC/SMAD4) и мутацией в гене KRAS.
В “классической” модели прогрессии колоректального рака исходным событием является инактивация гена АРС (ген аденоматозного полипоза толстой кишки), который в норме является опухолевым супрессором. Молекулярно-генетические исследования выявили делецию в длинном плече 5-й хромосомы, затрагивающую ген APC, как в опухолевых, так и в нормальных клетках. Полагают, что эта делеция приводит к потере генов-супрессоров опухолевого роста, а, следовательно, и кодируемых ими белков, которые в норме подавляют рост опухоли. Ген APC контролирует специфическое сцепление клеток эпителия кишечника, нарушение которого необходимо для возникновения полипа, но недостаточно для возникновения клона раковой опухоли. APC содействует деградации β‑катенина, что ограничивает транскрипцию генов, участвующих в регуляции клеточного цикла. Этот путь является неотъемлемой частью патогенеза рака толстой кишки [4].
KRAS — представитель белков семейства Ras, которые кодируют малые G-белки (малые ГТФазы). Белки семейства Ras являются мембраносвязанными и участвуют в передаче сигнала. В норме белки семейства Ras существуют в неактивной форме. Они активируются, когда находящийся рядом трансмембранный рецептор (например, EGRF, Toll-рецептор, G-белок) связывается с соответствующим лигандом. Дальнейший внутриклеточный сигнальный каскад включает в себя переход ГДФ в ГТФ. После активации RAS происходит поток активации широкого круга эффекторов, включая серин/треонин киназы, ГТФ-активирующий белков (GAPs), фосфоинозитид 3-киназы (PI3K), и GEFs. Ras отключаются, когда молекула ГТФ обратно преобразуется в молекулу ГДФ. В случае мутации, они остаются в состоянии ГТФ. Ошибки в регуляции KRAS могут привести к росту опухоли и метастазированию [5]. Таким образом, в опухолях с мутированным типом гена KRAS белок постоянно находится во «включенном» состоянии даже без активации восходящим сигналом от EGFR. В результате продолжается стимуляция находящихся ниже по сигнальной цепи эффектов, ведущих к росту и распространению опухоли.
В опухолях выявляют разные типы гена KRAS, которые кодируют “нормальный”, не мутированный белок KRAS (дикий тип), или патологический мутантный KRAS. «Статус» KRAS (дикий или мутантный тип) может указывать на прогноз заболевания и позволяет предсказать ответ опухоли на некоторые препараты [6]. Мутации в кодоне 12 фиксируются у 27.7 % больных, в кодоне 13 — у 6.6 %. Реже встречаются мутации в 61, 117, 146 и других кодонах. Самое распространённое изменение в 12 кодоне — замена глицина на аспартат и глицина на валин. Замена глицина на валин отрицательно влияет на патогенез, течение КРР и общую структуру выживаемости пациентов. Помимо вышесказанного, мутации KRAS связаны с более быстрым и агрессивным развитием метастазов в печень. Было доказано, что эти мутации вместе с высокой экспрессией маркера клеточной пролиферации Ki-67 ассоциированы с множественными метастазами печени, лёгких, более короткими интервалами их обнаружения и плохой выживаемостью больных после резекции ободочной кишки.
BRAF представляет собой RAS-регулируемую серин/треонин киназу, которая наряду с KRAS является еще одним участником сигнального пути, контролирующего клеточную пролиферацию, дифференцировку и апоптоз [5]. Мутации в гене BRAF часто обнаруживаются в злокачественных опухолях человека, таких как метастатический колоректальный рак, немелкоклеточный рак легких, меланомы и папиллярный рак щитовидной железы.
Малигнизация полипа связана с делецией генов в ножке хромосомы 18q, в частности SMAD2 и SMAD4. Каждый рецептор взаимодействует со своим собственным членом семейства ростовых факторов TGFбета. И таким образом внутри клетки возникает специфический для данного ростового фактора отклик. Разные SMAD после активации связываются и образуют гетеродимерные комплексы с одной и той же медиаторной молекулой, известной как SMAD4.Белок SMAD4 принадлежит к супрессорам опухолеобразования. Этот комплекс транслоцируется в ядро, где он прямо или в комплексе с другими компонентами аппарата транскрипции регулирует (активирует или репрессирует) экспрессию определенных генов.
Ген p53 является одним из ключевых генов-супрессоров опухолевого роста, функция которого направлена на ограничение вероятности возникновения генетически нестабильных клеток. Белок р53 контролирует состояние генома и устраняет потенциально опасные в плане злокачественной трансформации клетки [4].
Таким образом, канцерогенез в толстой кишке представляет собой последовательную цепь генетических изменений, включающих активацию нескольких онкогенов и потерю двух или более опухолевых супрессорных генов. Эти процессы отражаются в морфологически распознаваемых стадиях: толстокишечная эпителиальная гиперплазия, эпителиальная дисплазия с формированием аденом различной степени с последующим прогрессивным увеличением и злокачественных трансформаций.
Схему канцерогенеза в толстой кишке можно представить как последовательность «аденома-карцинома»: первоначально инактивируется APC, затем активируется онкоген KRAS, далее происходит потеря генов на 18q (SMAD2 и SMAD4) и в конечном итоге происходит потеря гена Ps34 TGF рецепторов II генов [4].
При выборе тактики лечения пациентов с КРР особое значение имеет ген KRAS [7]. Помимо хирургического лечения, пациентам обычно назначается химиотерапия или радиотерапия в сочетании с таргетными препаратами. Наиболее перспективными мишенями представляются рецепторы ростовых факторов — эпидермального фактора роста (EGFR). Моноклональные антитела специфически нацелены и связываются с EGFR. В случае мутации KRAS, имеющей место у приблизительно 40 % больных колоректальным раком (КРР), этот ген способен самостоятельно продуцировать активирующие ростовые сигналы, и мутированный КRAS находится в состоянии постоянной активации вне зависимости от статуса EGFR. Блокада EGFR в этой ситуации неэффективна. Таргетная терапия антиEGFR также неэффективна при лечении опухоли с мутантным BRAF [8].
Таким образом, в настоящее время накоплено достаточно знаний о генетических изменениях, сопровождающих КРР. Однако исследования в этом направлении продолжаются. Конечная цель данных исследований — разработка новых методов профилактики и лечения КРР, направленных на замещение или подавление мутированных генов.
Основные термины (генерируются автоматически): KRAS, APC, EGFR, ген, BRAF, толстая кишка, FAP, мутация, опухолевый рост, злокачественная опухоль.
Рак толстой кишки ( Колоректальный рак )
Рак толстой кишки - это злокачественная опухоль различных отделов толстого кишечника (слепой, ободочной, сигмовидной, прямой кишки), происходящая из эпителия кишечной стенки. Симптоматика при раке толстой кишки включает абдоминальные боли, метеоризм, кишечные расстройства, нарушение кишечной проходимости, патологические примеси в каловых массах, слабость, исхудание. Рак толстой кишки может определяться при пальпации живота; для подтверждающей диагностики проводится колоноскопия с биопсией, ультрасонография, ирригоскопия, КТ, ЯМР, ПЭТ. Радикальными методами лечения являются одномоментные или поэтапные резекционные вмешательства.
МКБ-10

Общие сведения
Рак толстой кишки (колоректальный рак) - злокачественное новообразование, развивающееся из эпителиальной выстилки стенки толстого кишечника. Статистика по заболеваемости неутешительна: ежегодно в мире выявляется свыше 500 тыс. новых случаев колоректального рака, причем большая часть из них приходится на индустриально развитые страны - США, Канаду, страны Западной Европы, Россию. В структуре женской онкопатологии рак толстой кишки занимает 2-ое место после рака молочной железы, а у мужчин по частоте уступает лишь раку предстательной железы и раку легкого. Большинство случаев заболевания колоректальным раком приходится на лиц старше 50 лет; мужчины болеют в 1,5 раза чаще женщин. Тревожным фактором является поздняя выявляемость: у 60-70% больных рак толстой кишки обнаруживается на III-IV стадии.
Причины
Многолетнее изучение и анализ проблемы позволили назвать наиболее значимые этиологические факторы, способствующие повышению риска развития рака толстой кишки, - это семейно-наследственные и алиментарные факторы, а также предраковые заболевания. В числе генетически детерминированных причин наибольшее значение имеет семейный полипоз, который практически в 100% случаев приводит к развитию рака толстой кишки. Кроме этого, повышенный риск развития колоректального рака имеют пациенты с синдромом Линча - в этом случае опухолевое поражение обычно развивается у лиц моложе 45 лет и локализуется в правых отделах ободочной кишки.
Исследуя зависимость частоты рака толстой кишки от характера питания и образа жизни, можно констатировать, что возникновению онкопатологии способствует преобладание в пищевом в рационе животных белков, жиров и рафинированных углеводов при дефиците растительной клетчатки; ожирение и метаболические нарушения, гипокинезия. Мутагенным и канцерогенным действием на клетки кишечного эпителия обладают различные химические соединения (ароматические углеводороды и амины, нитросоединения, производные триптофана и тирозина, стероидные гормоны и их метаболиты и др.).
Вероятность колоректального рака прогрессивно возрастает в условиях хронических запоров, длительного стажа курения, хронических заболеваний кишечника. В частности, к предраковым заболеваниям в колопроктологии отнесены: хронические колиты (НЯК, болезнь Крона), дивертикулярная болезнь толстого кишечника, одиночные полипы толстой кишки (аденоматозные и ворсинчатые полипы диаметром более 2 см озлокачествляются в 45-50% случаев).
Классификация
Рак толстой кишки может возникать в различных анатомических отделах толстого кишечника, однако частота их поражения неодинакова. По наблюдениям специалистов в сфере абдоминальной онкохирургии, преобладающей локализацией является нисходящая ободочная и сигмовидная кишка (36%); далее следует слепая и восходящая ободочная кишка (27%), прямая кишка и анальный канал (19 %), поперечная ободочная кишка (10%) и др.
По характеру роста опухоли толстой кишки подразделяются на экзофитные (растущие в просвет кишки), эндофитные (распространяющиеся в толщу кишечной стенки) и смешанные (опухоли-язвы, сочетающие экзо- и эндофитную форму роста). С учетом гистологического строения рак ободочной кишки может быть представлен аденокарциномой различного уровня дифференцировки (более 80%), слизистой аденокарциномой (мукоидный рак), мукоцеллюлярным (перстневидноклеточным) раком, недифференцированным и неклассифицируемым раком; рак прямой кишки и анального канала дополнительно - плоскоклеточным, базальноклеточным и железисто-плоскоклеточным раком.
В соответствии с международной системой TNM, на основании критериев глубины инвазии первичной опухоли, регионарного и отдаленного метастазирования, выделяют стадии:
- Тх - данных для оценки первичной опухоли недостаточно
- Тis - определяется опухоль с интраэпителиальным ростом или инвазией слизистой оболочки
- Т1 - инфильтрация опухолью слизистого и подслизистого слоя толстой кишки
- Т2 - инфильтрация опухолью мышечного слоя толстой кишки; подвижность кишечной стенки не ограничена
- Т3 - прорастание опухолью всех слоев кишечной стенки
- Т4 - прорастание опухолью серозной оболочки или распространение на соседние анатомические образования.
С учетом наличия или отсутствия метастазов в регионарных лимфоузлах различают следующие степени рака толстой кишки: N0 (лимфатические узлы не поражены), N1 (метастазами поражено от 1 до 3 лимфатических узлов), N2 (метастазами поражены 4 и более лимфатических узла). Отсутствие отдаленных метастазов обозначается символом М0; их наличие - M1. Метастазирование рака толстой кишки может осуществляться лимфогенным путем (в регионарные лимфатические узлы), гематогенным путем (в печень, кости, легкие и др.) и имплантационным/контактным путем с развитием карциноматоза брюшины и ракового асцита.
Симптомы рака
Клинические признаки рака толстой кишки представлены 5 ведущими синдромами: болевым, кишечными расстройствами, нарушением кишечной проходимости, патологическими выделениями, ухудшением общего состояния больных. Абдоминальные боли являются наиболее ранним и постоянным признаком рака толстой кишки. В зависимости от локализации опухоли и стадии злокачественного процесса они могут быть различными по характеру и интенсивности. Пациенты могут характеризовать боли в животе, как давящие, ноющие, схваткообразные. При выраженной болезненности в правом подреберье необходимо исключить у больного холецистит и язвенную болезнь 12-перстной кишки; в случае локализации боли в правой подвздошной области дифференциальный диагноз проводится с острым аппендицитом.
Уже в начальных стадиях рака толстой кишки отмечаются симптомы кишечного дискомфорта, включающие отрыжку, тошноту, рвоту, потерю аппетита, ощущение тяжести и переполнения желудка. Одновременно развиваются кишечные расстройства, свидетельствующие о нарушении моторики кишечника и пассажа кишечного содержимого: диарея, запоры (или их чередование), урчание в животе, метеоризм. При экзофитно растущем раке толстой кишки (чаще всего левосторонней локализации) в конечном итоге может развиться частичная или полная обтурационная кишечная непроходимость.
О развитии рака дистальных отделов сигмовидной и прямой кишки может свидетельствовать появление в испражнениях патологических примесей (крови, слизи, гноя). Обильные кишечные кровотечения возникают редко, однако длительная кровопотеря приводит к развитию хронической постгеморрагической анемии. Нарушение общего самочувствия при раке толстой кишки связано с интоксикацией, вызванной распадом раковой опухоли и застоем кишечного содержимого. Больные обычно жалуются на недомогание, утомляемость, субфебрилитет, слабость, исхудание. Иногда первым симптомом рака толстой кишки становится наличие пальпаторно определяемого образования в животе.
В зависимости от клинического течения выделяют следующие формы рака толстой кишки:
- токсико-анемическую - в клинике преобладают общие симптомы (лихорадка, прогрессирующая гипохромная анемия).
- энтероколитическую - основные проявления связаны с кишечными расстройствами, что требует дифференциации рака толстой кишки с энтеритом, колитом, энтероколитом, дизентерией.
- диспепсическую - симптомокомплекс представлен желудочно-кишечным дискомфортом, напоминающим клинику гастрита, язвенной болезни желудка, холецистита.
- обтурационную - сопровождается прогрессирующей кишечной непроходимостью.
- псевдовоспалительную - характеризуется признаками воспалительного процесса в брюшной полости, протекающего с повышением температуры, абдоминальными болями, лейкоцитозом и пр. Данная форма рака толстой кишки может маскироваться под аднексит, аппендикулярный инфильтрат, пиелонефрит.
- атипичную (опухолевую) - опухоль в брюшной полости выявляется пальпаторно на фоне видимого клинического благополучия.
Диагностика
Целенаправленный диагностический поиск при подозрении на рак толстой кишки включает клиническое, рентгенологическое, эндоскопическое и лабораторное обследование. Ценные сведения могут быть получены при объективном осмотре, пальпации живота, перкуссии брюшной полости, пальцевом исследовании прямой кишки, гинекологическом исследовании.
Рентгенологическая диагностика предполагает обзорную рентгенографию брюшной полости, ирригоскопию с применением контрастного вещества. С целью визуализации опухоли, взятия биопсии и мазков для цитологического и гистологического исследования проводится ректосигмоскопия и колоноскопия. К числу информативных методов топической диагностики принадлежат ультрасонография толстого кишечника, позитронно-эмиссионная томография.
Лабораторная диагностика рака толстой кишки предусматривает исследование общего анализа крови, кала на скрытую кровь, определение раково-эмбрионального антигена (РЭА). С целью оценки распространенности злокачественного процесса выполняется УЗИ печени, МСКТ брюшной полости, УЗИ малого таза, рентгенография грудной клетки, по показаниям - диагностическая лапароскопия или эксплоративная лапаротомия.

Рак толстой кишки требует дифференциации со многими заболеваниями самого кишечника и смежных с ним органов, в первую очередь, - хроническим колитом, неспецифическим язвенным колитом, болезнью Крона, актиномикозом и туберкулезом толстой кишки, доброкачественными опухолями толстой кишки, полипозом, дивертикулитом, кистами и опухолями яичников.
Лечение рака толстой кишки
Радикальный способ лечения патологии предполагает проведение резекционных вмешательств на ободочной, сигмовидной или прямой кишке. Характер операции и объем резекции зависит от локализации и распространенности опухолевой инвазии. При раке толстой кишки возможно проведение как одномоментных, так и поэтапных оперативных вмешательств, включающих резекцию кишки и наложение колостомы с последующей реконструктивной операцией и закрытием кишечной стомы. Так, при поражении слепой и восходящего отдела ободочной кишки показана правосторонняя гемиколэктомия; при раке поперечно-ободочной кишки - ее резекция, при опухоли нисходящего отдела - левосторонняя гемиколэктомия, при раке сигмовидной кишки - сигмоидэктомия.
Хирургический этап лечения рака толстой кишки дополняется послеоперационной химиотерапией. В запущенных неоперабельных случаях производится паллиативная операция (наложение обходного кишечного анастомоза или кишечной стомы), химиотерапевтическое и симптоматическое лечение.
Прогноз
Прогноз рака толстой кишки зависит от стадии, на которой был диагностирован опухолевый процесс. При выявлении онкопатологии на стадии Т1 отдаленные результаты лечения удовлетворительные, 5-летняя выживаемость составляет 90-100 %; на стадии Т2 - 70%, Т3N1-2 - около 30%. Профилактика рака толстой кишки предполагает диспансерное наблюдение групп риска, лечение предраковых и фоновых заболеваний, нормализацию питания и образа жизни, проведение скрининговых исследований (кала на скрытую кровь и колоноскопии) лицам старше 50 лет. Пациенты, оперированные по поводу колоректального рака, для своевременной диагностики рецидива рака толстого кишечника в первый год каждые 3 месяца должны проходить осмотры у онколога, включающие пальцевое исследование прямой кишки, ректороманоскопию, колоно- или ирригоскопию.
3. Современное лечение колоректального рака / Цивенко А. И., Томин М. С. // Вестник Харьковского национального университета имени В.Н. Каразина. Серия «Медицина» - 2004 - №6
Читайте также:
- Общий артериальный ствол. Признаки и диагностика общего артериального ствола.
- Роль горизонтальной иммерсии при физической нагрузке. Газообмен при горизонтальной иммерсии
- Психопатология самосознания. Дистурбация и типы отношения к психозу
- КТ, ангиография при тромбозе верхней брыжеечной артерии (ВБА)
- Фотохимия зрения. Родопсин и его распад под действием света
