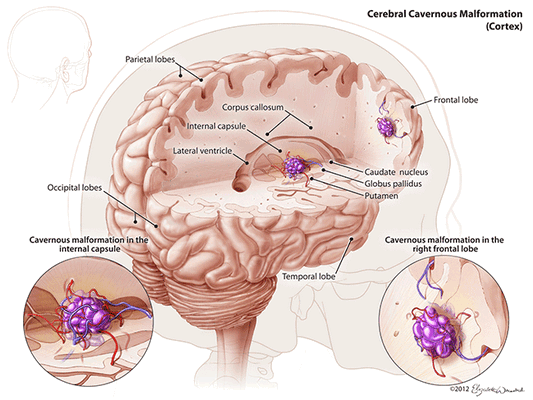
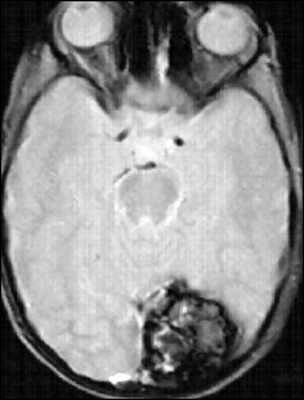
Кавернозная мальформация головного мозга на КТ, МРТ
Добавил пользователь Владимир З. Обновлено: 22.01.2026
Артериовенозная мальформация головного мозга (или более точно - пиальные АВМ) - аномальные связи между артериями и венами, которые приводят к артериовенозному сбросу крови и недостатку кровоснабжения паренхимы ГМ в результате недостаточно развитой капиллярной сети. Переход от артерии к вены может происходить через клубок патологических сосудов (очаг, нидус), расположенных в паренхиме мозга, либо напрямую - в этом случае АВМ обычно называется артериовенозной фистулой.
Эпидемиология
Несмотря на то, что АВМ является врожденной патологией, большинство пациентов обращаются к врачу во взрослом возрасте.
Классификация
По локализации
- супратенториально — 85%
- поверхностная —67%
- глубокая —33%
Количество очагов
- единичная АВМ — 98%
- множественные АВМ — 2%
Градация по Шпетцеру-Мартину
- размер очага
- малые (
- средние (3-6см)
- большие (> 6 см)
- есть
- нет
- в поверхностные вены мозга
- в глубокие вены мозга
Клиническая картина
Клинические проявления зависят от локализации и размеров АВМ. Чаще всего АВМ впервые выявляется между 2-й и 3-й декадами жизни. К 50 годам симптоматика наблюдается у 80-90% пациентов. Примерно в половине случаев возникает инсульт. К другим симптомам относятся судорожные припадки 20%, головная боль.
Диагностика
АВМ имеет вид «клубка червей». Характерные признаки АВМ очагового типа согласуются с ее определением. К диагностическим критериям относятся (а) наличие очага, внедренного в паренхиму головного мозга и идентифицированного при помощи МРТ, КТ или обычной ангиографии; а также (B) ранний венозный дренаж, который лучше всего можно увидеть в динамических исследованиях, при этом эталоном является традиционная катетерная ангиография. Ранний венозный дренаж определяется в том случае, если вены видны в «артериальную» фазу, что можно визуализировать с помощью МР-ангиографии и КТ-ангиографии при условии, что шунтирующие объем и дренирующие вены достаточно большие. Вышеуказанные методы визуализации все чаще используются для обнаружения раннего дренажа при меньших размерах поражения и, следовательно, для установления более точного диагноза, поскольку вышеупомянутые критерии важны для дифференциации АВМ ГМ от других сосудистых заболеваний ГМ.
Если имеется очаг, могут встречаться два подтипа аномальных сетей сосудов. Типичным типом является клубочковый или компактный очаг, который состоит из аномальных сосудов без какого-либо включения нормальной ткани головного мозга. Более редким является второй тип - это так называемый диффузный или пролиферативный тип очага, при котором паренхима ГМ включена в область клубка. Если имеется подобная находка, то в дифдиагноз должны быть включены пролиферативная ангиопатия или черепно-лицевой артериовенозный метамерный синдром, поскольку могут отличаться от истинной АВМ отсутствием раннего венозного дренажа (характерно для пролиферативной ангиопатии) и комбинацией с лицевыми АВМ (характерно для черепно-лицевого артериовенозного метамерного синдрома).
Артериальный приток и венозный дренаж ГМ будет зависеть от локализации нидуса. При глубоком и вентрикулярном расположении приток будет осуществляться через перфорирующие и хороидальные артерии, а венозный дренаж - через глубокие вены. При более поверхностном или кортикальном расположении приток осуществляют пиальные артерии, а венозный дренаж через кортикальные вены. Отсутствие кортикального венозного дренажа в поверхностно расположенной АВМ может указывать на тромбоз поверхностных путей оттока с последующим перенаправлением в глубокие вены.
- изо- или слабо гипердснснвyое образование при нативном сканировании
- кальцификаты определяются в 25-30% случаев
- атрофия прилежащего вещества головного мозга
- при в/в контрастировании — гиперденсивные извитые сосуды
- Т1 и Т2
- извитые сосуды - в виде выпадения сигнала
- осложнения в виде кровоизлияний и отеков
Ангиография
Золотой стандарт в диагностике АВМ любой локализации. Позволяется выявлять характер дренажа. На ангиограмме визуализируется плотная масса внутри которой определяются расширенные сосуды, составляющие очаг (нидус). Вены при АВМ контрастируются в артериальную фазу.
Лечение
зависит от возраста и общего состояния здоровья пациента. При лечении ABM применяют эндоваскулярную эмболизацию, оперативное вмешательство, стереотаксическую лучевую терапию и комбинацию этих методов.
Артериовенозные мальформации головного мозга ( Церебральные АВМ )
Артериовенозные мальформации головного мозга — врожденные аномалии церебральных сосудов, характеризующиеся образованием локального сосудистого конгломерата, в котором отсутствуют капиллярные сосуды, а артерии напрямую переходят в вены. Артериовенозные мальформации головного мозга проявляются упорными головными болями, эпилептическим синдромом, интракраниальным кровотечением при разрыве сосудов мальформации. Диагностика осуществляется при помощи КТ и МРТ сосудов головного мозга. Лечение хирургическое: транскраниальное иссечение, радиохирургическое вмешательство, эндоваскулярная эмболизация или комбинация этих методик.
МКБ-10
![Артериовенозные мальформации головного мозга]()
![МРТ головного мозга. Артерио-венозная мальформация в затылочной доле слева]()
Общие сведения
Артериовенозные мальформации головного мозга (церебральные АВМ) — измененные участки церебральной сосудистой сети, на которых вместо капилляров имеются многочисленные разветвления извитых артерий и вен, формирующих единый сосудистый конгломерат, или клубок. АВМ относятся к сосудистым аномалиям развития головного мозга. Встречаются у 2 человек из 100 тыс. населения. В большинстве случаев клинически дебютируют в период от 20 до 40 лет, в отдельных случаях — у лиц старше 50 лет. Артерии, формирующие АВМ, имеют истонченные стенки с недоразвитым мышечным слоем. Это обуславливает главную опасность сосудистых мальформаций — возможность их разрыва.
При наличии АВМ головного мозга риск ее разрыва оценивается примерно 2-4% в год. Если кровоизлияние уже имело место, то вероятность его повтора составляет 6-18%. Смертность при внутричерепном кровоизлиянии из АВМ наблюдается в 10% случаев, а стойкая инвалидизация отмечается у половины пациентов. Из-за истончения артериальной стенки на участке АВМ может сформироваться выпячивание сосуда — аневризма. Летальность при разрыве аневризмы сосудов головного мозга намного выше, чем при АВМ, и составляет около 50%. Поскольку АВМ опасны внутричерепным кровоизлиянием в молодом возрасте с последующей летальностью или инвалидизацией, их своевременная диагностика и лечение являются актуальными проблемами современной нейрохирургии и неврологии.
![Артериовенозные мальформации головного мозга]()
Причины АВМ головного мозга
Артериовенозные мальформации головного мозга возникают в результате внутриутробных локальных нарушений формирования церебральной сосудистой сети. Причинами таких нарушений являются различные вредоносные факторы, влияющие на плод в течение антенатального периода: повышенный радиоактивный фон, внутриутробные инфекции, заболевания беременной (сахарный диабет, хронический гломерулонефрит, бронхиальная астма и др.), интоксикации, вредные привычки беременной (наркомания, курение, алкоголизм), прием во время беременности фармпрепаратов, имеющих тератогенный эффект.
Церебральные артериовенозные мальформации могут располагаться в любом месте головного мозга: как на его поверхности, так и в глубине. В месте локализации АВМ отсутствует капиллярная сеть, циркулирование крови происходит из артерий в вены напрямую, что обуславливает повышенное давление и расширение вен. При этом сброс крови в обход капиллярной сети может повлечь за собой ухудшение кровоснабжения церебральных тканей в месте расположения АВМ, приводя к хронической локальной ишемии мозга.
Классификация АВМ головного мозга
По своему типу мальформации церебральных сосудов классифицируются на артериовенозные, артериальные и венозные. Артериовенозные мальформации состоят из приводящей артерии, дренирующей вены и расположенного между ними конгломерата измененных сосудов. Выделяют фистулезную АВМ, рацинозную АВМ и микромальформацию. Около 75% случаев занимают рацинозные АВМ. Изолированные артериальные или венозные мальформации, при которых наблюдается извитость соответственно только артерии или только вены, встречаются достаточно редко.
По размеру церебральные АВМ подразделяются на малые (диаметром менее 3 см), средние (от 3 до 6 см) и большие (свыше 6 см). По характеру дренирования АВМ классифицируют на имеющие и не имеющие глубокие дренирующие вены, т. е. вены, впадающие в прямой синус или систему большой церебральной вены. Различают также АВМ, локализующиеся в или за пределами функционально значимых областей. К последним относят сенсомоторную кору, мозговой ствол, таламус, глубинные зоны височной доли, сенсорную речевую область (зону Ве́рнике), центр Брока, затылочные доли.
В нейрохирургической практике для определения риска оперативного вмешательства по поводу церебральных сосудистых мальформаций используется градация АВМ в зависимости от совокупности баллов. Каждому из признаков (размер, тип дренирования и локализация по отношению к функциональным зонам) присуждается определенное количество баллов от 0 до 3. В зависимости от набранных балов АВМ классифицируется от имеющей незначительный операционный риск (1 балл) до связанной с высоким операционным риском из-за технической сложности ее ликвидации, большого риска смертельного исхода и инвалидности (5 баллов).
Симптомы АВМ головного мозга
В клинике церебральных АВМ выделяют геморрагический и торпидный варианты течения. По различным сведениям, геморрагический вариант составляет от 50% до 70% случаев АВМ. Он типичен для АВМ небольшого размера, имеющих дренирующие вены, а также для АВМ, располагающихся в задней черепной ямки. Как правило, в таких случаях у пациентов наблюдается артериальная гипертензия. В зависимости от локализации АВМ возможно субарахноидальное кровоизлияние, которое занимает около 52% от всех случаев разрыва АВМ. Остальные 48% приходится на осложненные кровоизлияния: паренхиматозные с формированием внутримозговой гематомы, оболочечные с образованием субдуральной гематомы и смешанные. В ряде случаев осложненные кровоизлияния сопровождаются кровоизлиянием в желудочки головного мозга.
Клиника разрыва АВМ зависит от ее локализации и скорости истечения крови. В большинстве случаев наблюдается резкое ухудшение состояния, нарастающая головная боль, расстройство сознания (от спутанности до комы). Паренхиматозные и смешанные кровоизлияния наряду с этим проявляются очаговой неврологической симптоматикой: нарушениями слуха, зрительными расстройствами, парезами и параличами, выпадением чувствительности, моторной афазией или дизартрией.
Торпидный вариант течения более типичен для церебральных АВМ среднего и большого размера, располагающихся в мозговой коре. Для него характерны кластерные цефалгии — следующие друг за другом пароксизмы головной боли, длящиеся не дольше 3 часов. Цефалгия не носит такого интенсивного характера как при разрыве АВМ, но является регулярной. На фоне цефалгий у ряда пациентов возникают судорожные приступы, которые зачастую имеют генерализованный характер. В других случаях торпидная церебральная АВМ может имитировать симптомы внутримозговой опухоли или другого объемного образования. В таком случае наблюдается появление и постепенное нарастание очагового неврологического дефицита.
В детском возрасте встречается отдельный вид церебральной сосудистой мальформации — АВМ вены Галена. Патология является врожденной и заключается в наличии АВМ в области большой вены мозга. АВМ вены Галена занимают около трети всех случаев сосудистых церебральных мальформаций, встречающихся в педиатрии. Характеризуются высокой летальностью (до 90%). Наиболее эффективным считается хирургическое лечение, проведенное на первом году жизни.
Диагностика АВМ головного мозга
Поводом для обращения к неврологу до разрыва АВМ могут быть упорные головные боли, впервые возникший эпиприступ, появление очаговой симптоматики. Пациенту проводится плановое обследование, включающее ЭЭГ, Эхо-ЭГ и РЭГ. При разрыве АВМ диагностика осуществляется в экстренном порядке. Наиболее информативны в диагностике сосудистых мальформаций томографические методы. Компьютерная томография и магнитно-резонансная томография могут быть использованы как для визуализации тканей мозга, так и для исследования сосудов. В случае разрыва АВМ МРТ головного мозга более информативно, чем КТ. Она дает возможность выявить локализацию и размер кровоизлияния, отдифференцировать его от других объемных интракраниальных образований (хронической гематомы, опухоли, абсцесса головного мозга, церебральной кисты).
![МРТ головного мозга. Артерио-венозная мальформация в затылочной доле слева]()
При торпидном течении АВМ МРТ и КТ головного мозга могут оставаться в норме. Обнаружить сосудистую мальформацию в таких случаях позволяет лишь церебральная ангиография и ее современные аналоги — КТ сосудов и МР-ангиография. Исследования церебральных сосудов проводятся с использованием контрастных веществ. Диагностика осуществляется нейрохирургом, который также оценивает операционный риск и целесообразность хирургического лечения АВМ. При этом следует учитывать, что при разрыве, в связи с компрессией сосудов в условиях гематомы и отека мозга, томографический размер АВМ может быть существенно меньше реального.
Лечение АВМ головного мозга
Артериовенозные мальформации головного мозга при их разрыве или при опасности такого осложнения подлежат удалению. Предпочтительно плановое оперативное лечение АВМ. В случае разрыва оно проводится после ликвидации острого периода кровоизлияния и рассасывания гематомы. В остром периоде по показаниям возможно хирургическое удаление образовавшейся гематомы. Одновременная ликвидация и гематомы, и АВМ проводится лишь при лобарной локализации сосудистой мальформации и ее небольшом диаметре. При кровоизлиянии в желудочки в первую очередь показано наружное вентрикулярное дренирование.
Классическое хирургическое удаление АВМ осуществляется путем трепанации черепа. Производится коагуляция приводящих сосудов, выделение АВМ, перевязка отходящих от мальформации сосудов и иссечение АВМ. Такое радикальное транскраниальное удаление АВМ осуществимо при ее объеме не более 100 мл и расположении вне функционально значимых зон. При большом размере АВМ зачастую прибегают к комбинированному лечению.
Когда транскраниальное удаление АВМ затруднительно из-за ее расположения в функционально значимых областях мозга и глубинных структурах, проводится радиохирургическое удаление АВМ. Однако этот метод эффективен лишь для мальформаций размером не более 3 см. Если размер АВМ не превышает 1 см, то ее полная облитерация происходит в 90% случаев, а при размерах свыше 3 см — в 30%. К недостатком метода относится длительный период (от 1 до 3 лет), необходимый для полной облитерации АВМ. В ряде случаев требуется поэтапное облучение мальформации в течение ряда лет.
К способам ликвидации церебральных АВМ относится также рентгеноэндоваскулярная эмболизация приводящих к АВМ артерий. Ее проведение возможно, когда имеются доступные для катетеризации приводящие сосуды. Эмболизация проводится поэтапно, и ее объем зависит от сосудистого строения АВМ. Полной эмболизации удается достигнуть только у 30% пациентов. Субтотальная эмболизация получается еще у 30%. В остальных случаях эмболизация удается лишь частично.
Комбинированное этапное лечение АВМ заключается в стадийном использовании нескольких перечисленных выше методов. Например, при неполной эмболизации АВМ следующим этапом проводится транскраниальное иссечение ее оставшейся части. В случаях, когда не удается полное удаление АВМ, дополнительно применяется радиохирургическое лечение. Такой мультимодальный подход к лечению церебральных сосудистых мальформаций показал себя как наиболее эффективный и оправданный в отношении АВМ большого размера.
Кавернома головного мозга
Кавернома головного мозга — это церебральная сосудистая мальформация, состоящая из заполненных кровью полостей. Клинически проявляется менее чем в половине случаев. Основные симптомы включают цефалгию, судорожные пароксизмы, кровоизлияния в головной мозг. Диагностика осуществляется с применением электроэнцефалографии, церебральной МРТ, ангиографии. Консервативное лечение проводится с назначением противосудорожным препаратов. Хирургическая тактика заключается в полном иссечении каверномы. При глубинном расположении мальформации возможно использование радиохирургии или лазерной облитерации.
![Кавернома головного мозга]()
![Судороги при каверноме головного мозга]()
![Методы визуализации каверномы головного мозга]()
Согласно классификации сосудистых мальформаций, кавернома относится к кавернозной форме гемангиом. Ранее была отнесена к новообразованиям. В настоящее время считается аномалией развития сосудов. На долю каверномы головного мозга приходится около 10-15% всех мальформаций сосудов ЦНС. Более 70% имеют супратенториальную локализацию. Распространенность каверном среди населения не превышает 0,5%. Клинически проявленные случаи заболевания наблюдается у 40-45% пациентов, остальные являются бессимптомными носителями аномалии. Выявляемость патологии значительно улучшилась с внедрением в медицинскую практику методов нейровизуализации.
![Кавернома головного мозга]()
Причины
Около 50% каверном головного мозга носят наследственный характер, что доказано обнаружением патологии при проведении МРТ ближайшим родственникам. В семейных случаях прослеживается аутосомно-доминантный тип наследования. Выявлено, что к образованию церебральной каверномы приводят мутации генов CCM1 и ССМ2, расположенных на 7-й хромосоме, и гена ССМ3, локализованного на 3-й хромосоме. Продолжаются исследования роли гена ССМ4, предположительно также участвующего в ангиогенезе.
Этиология спорадических случаев остается неясной. Считается, что спорадическая кавернома формируется в результате нарушений церебрального ангиогенеза, происходящего на 3-8 неделях внутриутробного развития. Триггерами аномалии выступают любые мутагенные факторы, действующие на организм беременной в этот период. Основными мутагенами являются: интоксикации, вирусные заболевания, прием медикаментов с тератогенным эффектом. Доказан радиоиндуцированный механизм возникновения каверном.
Патогенез
Гены ССМ1, ССМ2, ССМ3 кодируют синтез протеинового комплекса, необходимого для нормального морфогенеза эндотелиального слоя сосудистой стенки. Мутации указанных генов приводят к нарушению образования и миграции эндотелиоцитов с формированием каверн. Очевидно, подобные изменения эмбриогенеза возникают и под действием мутагенных факторов. Считается, что кавернома головного мозга имеет врожденный характер, однако она редко выявляется у детей до года, что связано с ее первоначально малыми размерами.
Точно не изучен механизм возникновения кавернозных гемангиом под воздействием радиоактивного излучения. Известны случаи их появления после лучевой терапии по поводу новообразования головного мозга, особенно у детей до 10 лет. Остается открытым вопрос, являются ли они результатом стимуляции роста имеющейся аномалии или образуются de novo.
Морфологически кавернома головного мозга представляет собой конгломерат высланных эндотелием полостей, разделенных соединительнотканными перегородками. Полости содержат кровь и тромботические массы, находящиеся в различной стадии формирования. Размер образования варьирует от 1-2 мм до 9 см. В стенке каверны отсутствуют типичные для нормального сосуда гладкомышечные элементы и эластические волокна.
Классификация
По этиологии каверномы головного мозга классифицируются на семейные и спорадические. По локализации в пределах головного мозга выделяют супра- и субтенториальные формы, по количественной характеристике — единичные и множественные. Микроскопическое изучение позволило выделить 3 базовых гистологических типа кавернозных гемангиом:
- Классический (I тип) — составляет 94% всех каверном. Образование состоит из каверн, разделенных соединительной тканью. Церебральное вещество между кавернами не определяется.
- Смешанный (II тип) — встречается у 5% пациентов. Характеризуется наличием между полостями прослоек мозгового вещества. Местами определяются слабо дифференцированные сосудистые элементы.
- Пролиферативный (III тип) — наиболее редкий. Наряду с типичной тканью кавернома содержит участки пролиферации эндотелия. По своему строению последний тип имеет сходство с морфологией капиллярных телеангиоэктазий.
![Судороги при каверноме головного мозга]()
Симптомы
Более половины выявленных каверном имеют асимптомное течение. Манифестация симптоматически проявленной каверномы возможна в любом возрасте. Клиническая картина зависит от локализации и размеров сосудистой аномалии. Наиболее типичным проявлением является судорожный синдром, наблюдающийся в 63% случаев супратенториальной формы. При локализации в неокортексе эпиприступы имеются у 90% больных.
Эпилептические пароксизмы варьируют от генерализованных до простых парциальных. Характерным является их достаточно редкое возникновение. Генерализованные эпиприступы типичны для лобной локализации, парциальные припадки — для каверномы височной доли головного мозга. В 34% случаев прослеживается тенденция к генерализации и учащению эпиприступов с течением заболевания, несмотря на проводимую противосудорожную терапию. Резистентность к антиконвульсантам наиболее характерна для мальформаций височной локализации.
У ряда больных на первый план выходит общемозговая симптоматика в виде цефалгий различной интенсивности. Возможны нарушения функции отдельных черепных нервов. При локализации каверномы вблизи ликворных путей наблюдается интенсивная головная боль, сопровождающаяся такими симптомами повышенного интракраниального давления, как тошнота, давление на глазные яблоки, рвота.
Расположение каверномы в глубинных отделах полушарий головного мозга проявляется очаговыми симптомами: парезами, сенсорным дефицитом, глобальной афазией. Мозжечковый синдром в виде дизартрии, грубых нарушений координации, походки характерен для кавернозной гемангиомы мозжечка. Наиболее тяжело протекает кавернома ствола головного мозга. Она проявляется альтернирующим синдромом, глазодвигательными расстройствами, бульбарными симптомами.
Осложнения
Наиболее часто кавернома головного мозга осложняется кровоизлиянием. Возможно субарахноидальное кровотечение, формирование внутримозговой гематомы. Кровоизлияние манифестирует внезапным появлением и быстрым прогрессированием очаговых симптомов. В ряде случаев наблюдается серия эпиприступов, переходящая в эпилептический статус. Повторные кровоизлияния приводят к формированию стойких неврологических нарушений. Кровоизлияния в ствол мозга могут иметь летальный исход в связи с параличом сосудистого или дыхательного центра.
Диагностика
Асимптомная кавернома головного мозга диагностируется врачом-неврологом при прохождении МРТ по поводу другого заболевания или в связи с наличием диагноза у родственника. При симптомном течении в неврологическом статусе возможно выявление очаговых расстройств, нарушений речи и координации. Среди инструментальных методов исследования для диагностики каверном в современной неврологии применяются:
- Электроэнцефалография (ЭЭГ). В обязательном порядке проводится пациентам с эпилептическими пароксизмами. Возможно выявление типичных форм эпиактивности, высокоамплитудных вспышек, гиперсинхронности альфа и бета ритмов.
- КТ головного мозга. Диагностирует наличие объемного округлого образования с четкими границами. Неоднородность структуры свидетельствует о наличие петрификатов в стенках каверн. Позволяет диагностировать гематому, субарахноидальное кровоизлияние. Малоинформативно в отношении каверном среднего и малого размера.
- МРТ головного мозга. Наиболее информативный метод диагностики каверномы. Визуализирует мальформацию с 98% специфичностью. На снимках наблюдается наличие гетерогенного образования с четкими контурами с типичным ободком сигнала низкой интенсивности в режиме Т2 за счет отложений гемосидерина.
- Ангиография. В большинстве случаев не фиксирует патологические изменения. Иногда визуализирует каверному как бессосудистую область. Ангиография применяется для исключения артериовенозной мальформации, сосудистой опухоли, аневризмы.
- Гистологическое исследование. Проводится на материале, полученном при проведении операции. Выявляет наличие характерных полостей, в ряде случаев — кальцификацию, кровоизлияния. Позволяет точно верифицировать морфологический тип мальформации.
Дифференциальная диагностика
Каверному головного мозга необходимо дифференцировать от интракраниальной опухоли, аневризмы, артериовенозной мальформации (АВМ). Церебральное новообразование отличается неуклонным нарастанием клинической симптоматики, при прорастании в окружающие ткани ‒ нечеткими границами образования, по данным МРТ. В отличие от каверномы, аневризмы и АВМ остаются включенными в кровоток, поэтому визуализируются при ангиографическом исследовании.
![Методы визуализации каверномы головного мозга]()
Лечение каверномы головного мозга
Консервативная терапия
Медикаментозное лечение направлено на купирование основных проявлений заболевания. Проводится при расположении мальформации в функционально значимой зоне головного мозга, при отсутствии очагового дефицита, у пациентов с редкими эпилептическими пароксизмами. Консервативная терапия показана после первичного кровоизлияния из каверномы функционально важной области при условии полного восстановления неврологических функций.
Основу фармакотерапии у больных с судорожными приступами составляют антиконвульсанты. Препарат подбирается индивидуально, его дозировка регулируется в зависимости от частоты приступа. Лечение осуществляется длительно, поскольку его прекращение ведет к возобновлению или учащению пароксизмов.
Хирургическое лечение
Показанием к операции являются проявившиеся кровоизлиянием каверномы головного мозга, локализующиеся за пределами функционально значимых областей. При расположении каверномы в значимой зоне хирургическое вмешательство рекомендовано в случае тяжелого эписиндрома, повторных кровоизлияний, прогрессирования неврологического дефицита, нарастающих признаков поражения ствола. Основными методиками хирургического лечения выступают:
- Хирургическая резекция. Является золотым стандартом лечения. Операция проводится с применением микрохирургической техники для полного удаления конгломерата каверн. При неполном удалении оставшиеся патологические ткани служат источником кровоизлияний и триггером эпилептической активности.
- Стереотаксическая радиохирургия. Показана при глубинном расположении каверномы с опасностью повреждения функциональных зон. Операция позволяет существенно снизить частоту кровоизлияний.
- Стереотаксическая лазерная абляция. Относительно новый метод лечения с малым количеством клинических наблюдений. Сообщается об эффективности данной методики в отношении каверном, расположенных в хирургически недоступных зонах.
Прогноз и профилактика
В целом наблюдается доброкачественное течение каверномы головного мозга. Возникающий при первичном кровоизлиянии очаговый дефицит обычно имеет тенденцию к полному регрессу. Повторные кровотечения из каверномы влекут инвалидизацию больного. Полное иссечение мальформации в ходе операции гарантированно предотвращает появление кровоизлияний, в 60% случаев приводит к полному прекращению эпиприступов, в 20% ‒ к уменьшению их частоты.
Специфические меры профилактики каверномы головного мозга не разработаны. Для предотвращения спорадических мутаций необходимо соблюдение охранительного режима в период беременности.
1. Кавернозные ангиомы ствола головного мозга. Клинические проявления, диагностика и результаты лечения/ Коновалов А.Н., Гаврюшин А.В., Хухлаева Е.А.// Вопросы нейрохирургии» имени Н.Н. Бурденко. - 2020. - 84(2).
2. Наследственные каверномы головного мозга: анализ 12 семей/ Белоусова О.Б., Коновалов А.Н., Окишев Д.Н., Сазонова О.Б., Шамов А.Ю.// Вопросы нейрохирургии. - 2011. - №4.
3. Современные подходы к хирургическому лечению кавернозных ангиом головного мозга/ Родич А., Смеянович А., Сидорович Р., Шанько Ю., Капацевич С., Щемелев А., Сусленков П. // Наука и инновации. - 2018. - №188.
4. Characteristics of cavernomas of the brain and spine/ J. Kivelev, M. Niemelä, J. Hernesniemi// Journal of Clinical Neuroscience. - 2012. -19(5).
Кавернозная ангиома головного мозга лечение и диагностика
![]()
Кавернозные ангиомы (каверномы, кавернозные мальформации) принадлежат к группе внутричерепных сосудистых аномалий развития, представляющих собой нарушения формирования сосудистой сети, возникающих во время внутриутробного развития. Эти врожденные патологические сосудистые образования склонны к разрастанию с течением времени. Часто данная патология возникает у родственников, что говорит о генетической предрасположенности.
Симптомы кавернозной ангиомы
У пациента могут отсутствовать какие-либо симптомы, хотя часто отмечаются головные боли, судорожные припадки или другие очаговые симптомы — например, нарушения двигательных или чувствительных функций. Чаще всего возникновение симптомов связано в кровоизлияниями, которые могут происходить как внутри кавернозной ангиомы, так и в окружающей ее мозговой ткани. В зависимости от степени выраженности кровоизлияния применяют консервативное лечение или оперативное вмешательство, о котором будет рассказано ниже.
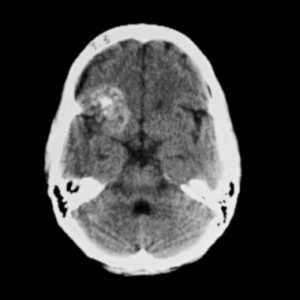
![кавернозная ангиома КТ]()
Кавернозная ангиома правой лобной доли. На компьютерной томограмме без контрастного усиления видно крупное неоднородное образование в лобной доле справа. Образование характеризуется высокой рентгеновской плотностью в своей центральной части и диффузно повышенной плотностью на периферии вследствие наличия в образовании кальцификатов и мелких кровоизлияний.
Сосудистые мальформации головного мозга
Типы сосудистых мальформаций различаются между собой на основе их макро- и микроскопических характеристик. Обычно внутричерепные сосудистые мальформации делят на следующие 4 группы:
- Капиллярные мальформации (или телеангиоэктазии)
- Кавернозные мальформации (кавернозные ангиомы/гемангиомы)
- Венозные мальформации
- Мальформации с артериовенозными шунтами
По более новой классификации добавлены еще 2 категории: артериальные мальформации (без формирования артерио-венозного шунта) и смешанные мальформации.
Каверномы могут быть обнаружены в любой области головного мозга, поскольку они могут возникать в любом месте на протяжении сосудистого русла. Иногда встречаются внутричерепные экстрацеребральные кавернозные ангиомы, но они довольно редки. Кавернозные ангиомы также иногда обнаруживаются в спинном мозге, чаще всего в сочетании с множественными сосудистыми поражениями головного мозга.
Кавернозная ангиома головного мозга: лечение
Большинство каверном не требуют активного лечения. Необходимо лишь динамическое наблюдение в течение длительного времени. Хирургическое вмешательство может потребоваться в случае возникновения симптомов, которые, как правило, обсуловлены кровоизлияниями в окружающую каверномы мозговую ткань. В случае повторных кровоизлияний, обнаруживаемых на КТ или МРТ, необходима госпитализация в нейрохирургический стационар с дальнейшим принятием решения об оперативном вмешательстве.
Операция при кавернозной ангиоме
Поскольку каверномы четко отграничены от окружающих тканей и окружены глией, их хирургическое удаление является относительно несложной задачей. Контроль кровопотери также довольно упрощен, поскольку кровоток в патологических сосудах замедлен по сравнению с тем, что обычно ожидается при иссечении хорошо кровоснабжаемых тканей.
Выявление кавернозных ангиом
Несмотря на то, что кавернозные ангиомы визуализируются при помощи компьютерной томографии (КТ), этот метод не является методом выбора: дело в том, что выявленные признаки при КТ-исследовании могут соответствовать не только кавернозной ангиоме, но также, среди других возможных вариантов, и низкодифференцированной опухоли.
Чувствительность магнитно-резонансной томографии (МРТ) значительно выше, что объясняется более высоким контрастным разрешением, а также большей способностью отображать текущую кровь и продукты ее распада. Сочетание различных импульсных последовательностей МРТ в значительной мере решило проблему ошибочных диагнозов или недостаточного выявления кавернозных ангиом, поскольку эти образования обладают довольно специфичными признаками на МРТ.
Сделать МРТ головного мозга в Санкт-Петербурге
КТ и МРТ могут быть использованы для динамического наблюдения пациентов с уже диагностированными кавернозными ангиомами, особенно в тех случаях, когда имеется риск кровоизлияния. Хотя МР-картина кавернозных ангиом не позволяет предсказать возникновение кровотечения, МРТ является методом выбора для длительного наблюдения пациентов с кавернозными ангиомами, а также для обследования членов семьи пациента, у которых имеется риск наличия подобных мальформаций. Кроме этого, МРТ крайне полезна при планировании хирургического вмешательства, поскольку позволяет оценить размер образования, его границы, и определить, таким образом, тип операции и хирургический доступ.
При классической ангиографии большинство кавернозных мальформаций не визуализируются, и даже в случае выявления признаков они крайне неспецифичны. Если образование развивается в сочетании с другими сосудистыми мальформациями, что происходит у примерно 30% пациентов с венозными мальформациями, то его МР-характеристики сильно усложняются и становятся менее специфичными. У таких пациентов ангиография может оказаться полезной для дальнейшего уточнения диагноза.
Кавернозная ангиома или опухоль?
Сканирование головного мозга с помощью КТ и МРТ в большинстве случаев позволяет четко отличить каверному от других образований мозга, в том числе опухолей разной степени злокачественности. Тем не менее, в ряде случаев дифференцирование этих образований представляет собой диагностическую проблему, для решения которой необходим большой опыт. В связи с этим критически важным является возможность привлечения высококвалифицированного диагноста. Кроме того, качественная расшифровка КТ и МРТ-изображений обеспечивает решение других диагностических задач: исключение окружающего отека мозга, выявление степени выраженности кровоизлияния, описание деталей, влияющих на операбельность каверномы. При сомнениях в диагнозе необходимо получить консультацию радиолога из ведущего центра, специализирующегося на патологии головного мозга. Второе мнение такого диагноста может быть весьма ценным в дифференциальной диагностике ангиом и других патологических состояний.
Кавернозные ангиомы на КТ
При использовании визуализационных методов полезным оказывается разделение каверном на 3 компонента. К ним относится (1) периферическая псевдокапсула, состоящая из глиальной ткани, пропитанной гемосидерином, (2) нерегулярного строения промежуточная соединительная ткань, разделяющая между собой каверны и (3) центральная сосудистая часть, состоящая из сосудистых каверн с замедленным кровотоком.
На КТ-снимках без контрастного усиления кавернома выглядит как очаговое образование овальной или узловой формы, характеризующееся слабо или умеренно повышенной рентгеновской плотностью и не оказывающее объемного воздействия на окружающую паренхиму. Участки кальцификации и отложения гемосидерина в стенках фиброзных перегородок, наряду с застоем крови в кавернах, способствуют повышению рентгеновской плотности на изображениях без контрастного усиления. На КТ-снимках кальцификаты обнаруживаются примерно в 33% всех каверном. Если образование застарелое, то в нем могут содержаться центральные неконтрастируемые участки пониженной плотности, что соответствует кистам от резорбированных гематом.
Контрастное усиление может быть как минимальным, так и максимальным, хотя 70-94% кавернозных мальформаций после внутривенного введения контрастного вещества контрастируются слабо или умеренно. В большинстве случаев, хорошая контрастируемость является результатом повышенного кровотока в сосудистом компоненте образования. Гетерогенное «крапчатое» контрастирование обусловлено внутрисосудистыми фиброзными перегородками, а ободок низкой плотности по периферии — псевдокапсулой из глиальной ткани, окружающей образование.
Масс-эффект для каверном не характерен, за исключением тех случаев, когда они ассоциированы с недавним кровоизлиянием. На КТ-снимках без контрастного усиления каверномы могут не определяться вообще. В кровоизлияния и формирования внутримозговой гематомы каверномы визуализируются в виде участков очагового усиления сигнала в прилежащей к гематоме области.
Любое обнаруженное на КТ кровоизлияние у относительно молодого пациента должно быть тщательно исследовано, и кавернозная ангиома должна всегда рассматриваться в качестве возможной причины. При обследовании пациента с судорожным синдромом кавернозная ангиома также должна рассматриваться как вероятный этиологический фактор, особенно если пациенту от 20 до 40 лет.
Определяемые по КТ кавернозные мальформации могут включать также и другие редкие сосудистые мальформации (тромбоз артерио-венозной мальформации, капиллярная телеангиэктазия), глиому (низко-дифференцированная астроцитома или олигодендроглиома) и метастатическую меланому.
Кавернозные ангиомы на МРТ
Кавернозные ангиомы представляют собой около 1% всех внутричерепных сосудистых поражений и 15% церебро-васкулярных мальформаций. С развитием и внедрением МРТ кавернозные ангиомы стали наиболее часто обнаруживаемыми сосудистыми мальформациями головного мозга. В ранних исследованиях по аутопсийному материалу частота их встречаемости составляла 0,02-0,53%. С использованием МРТ частота встречаемости образований, похожих на кавернозные гемангиомы, составила 0,39-0,9%, а обнаружение при помощи МРТ ранее не идентифицированных бессимптомных образований подняло их частоту до 0,45-0,9%.
На МРТ паренхиматозные кавернозные ангиомы представлены характерным образованием по типу «попкорна», четко очерченным, с ровной границей. Внутренняя часть представлена множественными очагами сигнала различной интенсивности, которые соответствуют кровоизлияниям на разных стадиях разрешения.
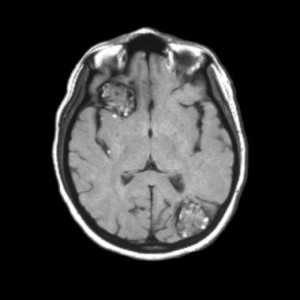
![кавернозная ангиома мрт]()
МРТ-признаки кавернозной ангиомы. Крупные кавернозные ангиомы правой лобной доли и левой затылочной доли на Т1-взвешенном аксиальном срезе. У этих двух гетерогенных объемных образований отмечается сетчатая структура центральной части с чередованием участков высокой и низкой интенсивности сигнала, окруженная гипоинтенсивным ободком из гемосидерина.
Свежая гематома, содержащая дезоксигемоглобин, изоинтенсивна на Т1-взвешенных изображениях и значимо гипоинтенсивна на Т2-взвешенных изображениях. Подострая гематома, содержащая внеклеточный метгемоглобин, гиперинтенсивна как на Т1-, так и на Т2-взвешенных изображениях вследствие парамагнетического эффекта, оказываемого метгемоглобином.
Промежуточные фиброзные элементы характеризуются слабо гипоинтенсивным сигналом на Т1- и Т2-взвешенных изображениях, поскольку содержат кальцификаты и гемосидерин. Гетерогенная внутренняя часть образования окружена гемосидериновым ободком, обладающим низкой интенсивностью на Т1-взвешенных изображениях. Гипоинтенсивность этого ободка становится более выраженной, напоминающей ореол, на Т2-взвешенных изображениях и изображениях в режиме градиентного эха благодаря более высокой чувствительности этих последовательностей к изменениям магнитного поля.
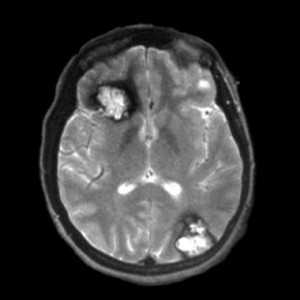
![кавернома мрт]()
Аксиальные МРТ-изображения в режиме градиентного эхо позволяют достичь лучшей визуализации крупных кавернозных ангиом в правой лобной и левой затылочной долях. Гемосидериновый ободок представлен в виде ореола вследствие повышенной магнитной восприимчивости гемосидерина.
Более мелкие каверномы выглядят на Т1- и Т2-взвешенных изображениях как узелковые очаги низкой интенсивности.
Образования небольшого размера лучше визуализируются на изображениях в режиме градиентного эхо благодаря повышенной чувствительности к изменениям магнитного поля, которая свойственна таким импульсным последовательностям. Также было показано, что на последовательных снимках в режиме градиентного эхо мелкие точечные образования лучше визуализируются при удлинении времени эхо; эти данные позволяют предположить, что такие образования содержат парамагнетические вещества.
![множественные каверномы]()
На МР-изображении в режиме градиентного эхо визуализируются множественные двусторонние мелкие точечные и округлые очаги низкой интенсивности в перивентрикулярном и субкортикальном белом веществе. Самый крупный очаг визуализируется в перивентрикулярном белом веществе лобной доли кпереди от переднего (лобного) рога левого бокового желудочка около колена мозолистого тела. Кпереди и кзади от него видны множественные очаги более мелкого размера.
На изображениях, полученных при помощи время-пролетной ангиографии, метгемоглобин в центре кавернозной мальформации может напоминать движущуюся кровь. Впрочем, на последующей фазово-контрастной МР-ангиограмме, полученной при установке малой скорости кровотока при кодировании (10-20 см/с), ток крови или патологическая васкуляризация не визуализируются, что позволяет исключить сосудистое поражение.
Обычно кавернозные ангиомы не оказывают объемного воздействия на прилежащие ткани и не вызывают отека, а также им не свойственно наличие питающей артерии или дренирующей вены, за исключением тех случаев, когда они ассоциированы с другими подобными сосудистыми мальформациями. Кавернозные ангиомы часто ассоциированы с венозными мальформациями, для которых характерно наличие дренирующей вены. В таких смешанных случаях может быть полезным проведение стандартной ангиографии.
![кавернома ствола]()
Т2-взвешенное изображение каверномы варолиева моста.
К кавернозным мальформациям, обнаруживаемым на МРТ, относят и другие скрытые сосудистые мальформации (тромбоз АВМ/аневризмы, капиллярная телеангиэктазия), кровоизлияния в первичной или вторичной опухоли (метастазы меланомы, хориокарциномы, рака щитовидной железы или почки), амилоидная ангиопатия, леченая или первичная инфекция (токсоплазмоз или цистицеркоз), ассоциированные с поражением системы крови множественные геморрагии (диссеминированное внутрисосудистое свертывание, лейкоз), а также последствия диффузного аксонального повреждения.
Ангиография при кавернозных ангиомах
В целом, считается, что кавернозные мальформации не видны при ангиографии, а если и визуализируются, то их признаки весьма неспецифичны. В диагностике каверном МРТ полностью вытеснила стандартную ангиографию. Впрочем, если образование ассоциировано с другими типами сосудистых мальформаций, что наблюдается у 30% пациентов с венозными ангиомами, его МР-характеристики усложняются и становятся менее специфичными. У таких пациентов ангиография оказывается полезной для более детального уточнения характера образования.
Большинство кавернозных мальформаций (37-48%) выглядят на стандартных ангиограммах как бессосудистые образования. По причине крайне низкого тока крови внутри мальформаций, результаты артериографии зачастую могут соответствовать норме. Если образование достаточно велико по размеру или ассоциировано с гематомой, может отмечаться объемное воздействие (масс-эффект) на прилежащие сосуды. Бессосудистый вид мальформации на ангиограмме обусловлен пережатием или разрушением сосудов вследствие кровоизлияния, тромбоза, а также малым размером сосудов, соединяющих синусоидные каверны с периферическими нормальными сосудами паренхимы, что обеспечивает в целом низкий уровень кровотока. Если размер образования маленький, и если оно не ассоциировано с гематомой, то 20-27% таких ангиограмм будет соответствовать норме. При первой инъекции контрастного вещества расширение капилляров может не визуализироваться; если инъекция контраста произведена повторно, большего объема, и ангиограмма оценена после выжидания большего времени, то расширение капилляров визуализируется лучше. В любом случае, это является неспецифичным радиологическим феноменом, которое может быть свойственно множеству других состояний.
Лучевая диагностика кавернозных мальформаций головного мозга
![Обложка]()
Кавернозные мальформации головного мозга в настоящее время являются достаточно распространённой сосудистой патологией: число выявляемых случаев в последние годы резко возросло. Это связано с внедрением в клиническую практику и повсеместным распространением современных методов нейровизуализации, таких как компьютерная (КТ) и магнитно-резонансная (МРТ) томография. До появления КТ и МРТ диагностировать данную патологию было весьма трудно, и диагноз чаще всего устанавливался интраоперационно или по данным аутопсии. Обзор литературы посвящён лучевой диагностике кавернозных мальформаций (КМ) головного мозга. Проанализировано значение методов нейровизуализации для диагностики кавернозных мальформаций, а также применение МРТ для визуализации КМ. Выявлены преимущества МРТ перед другими методами нейровизуализации данной патологии. Охарактеризованы импульсные последовательности МРТ и сигнальные характеристики очагов различных типов в зависимости от морфологического субстрата. Проанализировано значение последовательности SWI (susceptibility weighted imaging) для обнаружения многоочаговых поражений в случаях семейных форм КМ. Изучение основных импульсных последовательностей МРТ для визуализации кавернозных мальформаций позволит оптимизировать алгоритм протокола для своевременной диагностики данной патологии и выбора тактики лечения.
Ключевые слова
Полный текст
ВВЕДЕНИЕ
Кавернозные мальформации (КМ) представляют собой сосудистые образования головного и спинного мозга с низким уровнем кровотока, состоящие из каверн с эндотелиальной выстилкой 4. Они известны также как кавернозные ангиомы, кавернозные гемангиомы, скрытые сосудистые мальформации или каверномы. КМ обнаруживаются как в супра-, так и в инфратенториальной областях головного мозга, реже в спинном мозге 7. Данные образования являются вторыми по распространённости сосудистыми мальформациями в центральной нервной системе после аномалий венозного развития (венозных аномалий, ВA) 11. Точная частота и распространённость заболевания неизвестны, поскольку КМ в большинстве случаев клинически не проявляются, а диагностика требует методов нейровизуализации, которые, как правило, используются при наличии показаний. Тем не менее, несмотря на относительно доброкачественное течение болезни, КМ могут быть причиной эпилептических приступов и серьёзного неврологического дефицита.
РАЗВИТИЕ МЕТОДОВ НЕЙРОВИЗУАЛИЗАЦИИ ДЛЯ ДИАГНОСТИКИ КАВЕРНОЗНЫХ МАЛЬФОРМАЦИЙ
В настоящее время общепризнанно, что решающую роль в диагностике, мониторинге и оценке результатов лечения КМ играют современные методы нейровизуализации. До появления компьютерной (КТ) и магнитно-резонансной (МРТ) томографии обнаружить КМ было достаточно сложно, поэтому патологию чаще диагностировали при выполнении хирургического вмешательства. Рентгенологическое исследование черепа и радионуклидное сканирование не являлись чувствительными и специфичными методами в отношении выявления КМ.
Значительное повышение чувствительности диагностики с развитием КТ способствовало первым успехам в оценке уровня заболеваемости КМ [13]. В ранних исследованиях сообщалось о 100% выявлении КМ при использовании КТ [14, 15]. Тем не менее уровни разрешения сканеров того времени были ограниченными для обнаружения очагов как малых, так и относительно больших размеров [16].
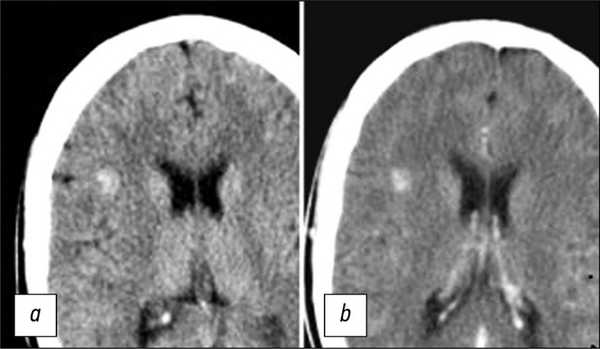
Использование КТ как единственного метода обнаружения КМ позволяет диагностировать очаги только в 30-50% случаев. Изображения, полученные при выполнении КТ, обычно демонстрируют наличие гиперденсных очагов, реже ― смешанных гипер- и изоденсных образований (рис. 1) [17]. КТ позволяет также выявлять признаки кальцификации очагов.
![]()
Рис. 1. КТ-срезы головного мозга в аксиальной плоскости, выполненные до- (a) и после введения контрастного препарата (b). На изображениях определяется гиперденсный очаг в правой лобной доле, без четких контуров, не накапливающий контрастный препарат.
Введение контрастного препарата способствовало улучшению определения границ КМ и повышению чувствительности в отношении выявления изоденсных очагов. Некоторые исследователи [18] предложили следующие признаки наличия КМ по результатам КТ: округлая форма, чётко определяемый край, неравномерная плотность, отсутствие окружающего отёка и эффекта массы (при отсутствии внутримозгового кровоизлияния). Тем не менее результаты КТ при диагностике КМ являются неспецифичными. Так, существенной проблемой является дифференциация КМ и частично кальцинированных аваскулярных глиом.
В целом частота выявления КМ после внедрения КТ существенно повысилась, вследствие чего был поставлен фундаментальный вопрос о тактике лечения выявленного образования.
Церебральная ангиография с целью выявления КМ остаётся сложной задачей: считается, что применение метода позволяет выявить наличие питающих сосудов малых размеров, снижение скорости циркуляции крови, а также наличие тромбов в сосудистых пространствах КМ. Первый случай выявления КМ как ангиографической аномалии был представлен A. Jonutis и соавт. [19].
С внедрением в клиническую практику МРТ частота выявления этой патологии значительно увеличилась, что вызвало необходимость углублённого понимания различных аспектов естественного течения КМ для выработки представлений по оптимальной тактике и сроках лечения таких поражений.
Следует учитывать также, что МРТ, являясь чувствительным методом для выявления КМ, менее специфична в диагностике сосудистых мальформаций центральной нервной системы. В таких случаях полезно использование ангиографии для исключения других поражений, в частности артериовенозных и венозных мальформаций.
ПРИМЕНЕНИЕ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ ДЛЯ ВИЗУАЛИЗАЦИИ КАВЕРНОЗНОЙ МАЛЬФОРМАЦИИ
В 1987 г. D. Rigamonti и соавт. [16] продемонстрировали, что МРТ при уровне магнитного поля 1,5 Тл является наиболее чувствительным и специфичным методом в отношении выявления КМ. Эти исследования положили начало использованию данного метода для диагностики КМ. Было установлено, что визуализация с использованием T2-взвешенных изображений (T2-ВИ) чувствительна на 100% в отношении КМ, тогда как чувствительность T1-взвешенных изображений (T1-ВИ) значительно ниже.
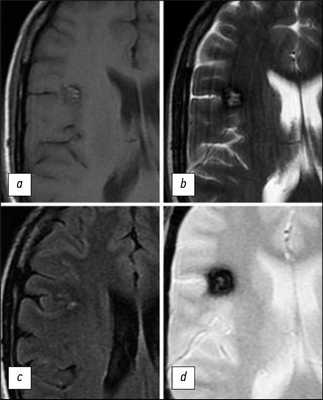
Отложения гемосидерина внутри и вокруг КМ, которые считаются типичным признаком повторных субклинических кровоизлияний или лизиса эритроцитов, обеспечивают магнитную восприимчивость этого патологического образования, особенно при высокой напряжённости магнитного поля. Неоднородность магнитного поля в присутствии гемосидерина также способствует дифференциации кровотока и эффектов гемосидерина в КМ (рис. 2) [16, 17].
![]()
Рис. 2. МР-томограммы головного мозга в аксиальной плоскости, выполненные в режимах Т1-ВИ (a,c), Т2-ВИ (b), T2*GRE (d), демонстрируют более детальную визуализацию структуры КМ (тот же случай, что и на рис. 1). На изображениях визуализируется очаговое образование характерной ячеистой структуры с гипоинтенсивным периферическим сигналом на Т2-ВИ. Последовательность T2*GRE подчеркивает «цветущий» эффект гемосидерина.
Было выдвинуто предположение, что данные МРТ соответствуют гистологически подтверждённым результатам изучения КМ с приемлемой достоверностью. Со временем МРТ стала рассматриваться в качестве метода выбора диагностики в плане идентификации и характеристики КМ.
В целом комбинация ободка пониженного сигнала с сетчатым ядром смешанной гипер- и гипоинтенсивности на T2-ВИ с высокой вероятностью является диагностическим признаком наличия КМ. Для очагов КМ меньших размеров вместо этого оценивается точечная область гипоинтенсивности на Т2-ВИ. Сопровождающий образование вазогенный отёк в перифокальных отделах, который проявляется повышенной интенсивностью сигнала на T2-ВИ, а также эффект массы обычно не проявляются даже при достаточно больших размерах очага, если не было относительно недавних кровоизлияний (рис. 3) [17, 22].
![]()
Рис. 3. T2*GRE изображение в аксиальной плоскости демонстрирует больших размеров кавернозную ангиому в левой затылочной доле. Несмотря на внушительные размеры образования, перифокального отека и масс-эффекта на окружающие структуры не обнаруживается.
Позже при КМ был описан признак гиперинтенсивного сигнала вокруг очага на T1-изображениях. В своих исследованиях T.J. Yun и соавт. [23] полагают, что этот вариант сигнала связан с выходом эритроцитов и плазмы в периваскулярное пространство при формировании отёка. Указывается, что гиперинтенсивный сигнал вокруг очага на Т1-ВИ чаще встречается в КМ, связанных с недавним клинически значимым кровоизлиянием: в подобных случаях этот признак является высокоспецифичным и прогностически значимым для диагностики КМ.
- J. Zabramski и соавт. [25] предложили систему классификации, предусматривающую 4 различных категории КМ, основанную на корреляции результатов МРТ с применением последовательностей SE (spin echo ― спиновое эхо) и GRE (gradient echo ― градиентное эхо) с данными гистопатологического исследования.
Согласно этой классификации:
- очаги I типа характеризуются гиперинтенсивным ядром на T1-взвешенных изображениях и гипо- или гиперинтенсивным ядром на T2-взвешенных изображениях, зависящих от внутриклеточной или внеклеточной стадии метгемоглобина, и характеризуют КM, осложнённые острыми и подострыми кровоизлияниями;
- очаги II типа характеризуются проявлениями, которые в настоящее время рассматриваются как патогномоничные МРТ-признаки КМ и имеют сетчатое ядро со смешанной интенсивностью сигнала на Т2-ВИ с окружающим гипоинтенсивным кольцом, которые, как считается, коррелируют с областями продолжающихся тромбозов и наличием кровоизлияний различной давности;
- очаги III типа характеризуются выраженной гипоинтенсивностью на T2-ВИ и увеличением степени гипоинтенсивности при использовании GRE-последовательностей, с изо- или гипоинтенсивностью, наблюдаемой на T1-ВИ, и отражают признаки хронического кровоизлияния с остаточным гемосидерином, находящимся внутри и вокруг очага поражения;
- очаги IV типа являются менее охарактеризованными в настоящее время, не совсем понятно их происхождение, они не визуализируются при использовании обычных последовательностей SE. Эти очаги выглядят как точечные гипоинтенсивные поражения при использовании GRE-последовательностей и, как считается, отражают небольшие отложения гемосидерина, либо в малых по размеру КМ, либо, возможно, в капиллярных телеангиэктазиях.
Клиническая значимость МР-классификации этих поражений остаётся дискутабельной, хотя J. Zabramski и соавт. [25] считают, что выраженность проявлений КМ может быть связана с их отражением на МРТ. У пациентов с признаками КМ I или II типа заболевание практически всегда сопровождается ухудшением состояния, тогда как при наличии очагов III или IV типов симптомы проявляются только у 1/3 больных. Обострение симптомов КМ чаще ассоциируется с очагами I типа.
В 1999 г. M. Essig и соавт. [26] предложили метод МРТ с использованием трёхмерной GRE, известной как визуализация со взвешиванием по чувствительности (susceptibility weighted imaging, SWI). Использование этого вида последовательностей позволяет обнаруживать очаги КМ на основании зависимых от уровня кислорода в крови фазовых эффектов между венозной кровью и окружающей паренхимой мозга. Эти характеристики позволяют выявлять венозные сосуды малых размеров с низкой скоростью кровотока при субмиллиметровом разрешении и, таким образом, осуществлять дифференцировку КМ, капиллярных телеангиэктазий и венозных аномалий без необходимости использования контрастного усиления.
В исследовании B. Lee и соавт. [27] в 2 из 10 случаев были выявлены дополнительные очаги при использовании SWI, которые не были очевидны на T2*GRE-изображениях.
Последующие исследования также продемонстрировали более высокую чувствительность SWI при обнаружении мультифокальных семейных КМ по сравнению с T2*GRE 29.
Превосходство SWI над T2*GRE-изображениями в выявлении спорадических КM менее очевидно. N.M. de Champfleur и соавт. [31] по результатам исследования сообщили об отсутствии различий в чувствительности при использовании этих последовательностей для диагностики КМ. H.T. Bulut и соавт. [30] предложили включить очаги V типа в классификацию J. Zabramski и соавт. [25] для характеристики поражений, обнаруживаемых с помощью SWI-изображений, но не T2*GRE.
В целом считают, что преимущество SWI заключается в обнаружении КM и телеангиэктазий в отсутствие признаков явного кровоизлияния [32]. Однако вследствие значительного артефакта восприимчивости в присутствии парамагнитного гемосидерина при хроническом стазе или предшествующих кровотечениях при анализе SWI-изображений размеры очагов нередко переоцениваются [31].
Таким образом, корреляция с обычными последовательностями SE может использоваться для более точного разграничения анатомических деталей на получаемых изображениях. K. Pinker и соавт. [33] продемонстрировали возможности использования SWI с высоким разрешением при 3 Тл, что позволило выявить внутриочаговые трубчатые структуры КМ, которые соответствовали гиалиновым коллагеновым сосудистым каналам, выявляемым при патологоанатомическом исследовании.
Последовательности SWI также могут быть полезны в отношении определения динамики возникновения КM, оценки того, увеличиваются ли их количество и размеры, либо выявляемые новые очаги представляют собой последующие кровоизлияния из ранее нераспознанных небольших КМ.
В целом следует отметить, что использование последовательностей T2*GRE даёт возможность выявить «цветущий» эффект гемосидерина и повысить чувствительность обнаружения КМ. Применение последовательностей SWI, особенно при использовании уровня магнитного поля 3 Тл, позволяет выявлять многоочаговые поражения в случае семейных КМ, которые не могут быть установлены при использовании изображений T2*GRE (рис. 4) [27]. Применение таких подходов значительно повышает диагностические возможности МРТ.
![]()
Рис. 4. МР-томограммы головного мозга в аксиальной плоскости, выполненные в режимах T2*GRE (a) и SWI (b). Изображения в режиме SWI позволяют выявить дополнительные очаги КМ, не визуализируемые в режиме T2*GRE.
В свою очередь, повышение чувствительности метода также позволяет проводить дифференциальную диагностику КМ с геморрагической микроангиопатией или церебральными микрокровоизлияниями, особенно при наличии возрастных изменений головного мозга, а в отдельных случаях ― при метастазах злокачественных опухолей. МРТ позволяет осуществлять функциональную визуализацию первичных сенсомоторных, речевых и зрительных областей коры, а также оценивать состояние структур головного мозга с помощью технологий диффузионно-тензорной визуализации, что в свою очередь улучшает планирование хирургических вмешательств [34].
В последние годы были предложены новые варианты МРТ для выполнения количественного картирования чувствительности (quantitative susceptibility mapping) и количественной перфузии с динамическим контрастированием (dynamic contrast enhanced quantitative perfusion), которые были разработаны для измерения отложений железа и проницаемости сосудов при КМ. Последние показатели рассматриваются в качестве потенциальных биомаркеров активности заболевания.
ЗАКЛЮЧЕНИЕ
Таким образом, КМ представляют собой сосудистые новообразования головного мозга, в основе механизма развития которых лежат процессы сосудистой пролиферации, дисморфизма и геморрагической ангиопатии. Заболевание характеризуется отложениями железа в структуре каверномы и перифокальном веществе головного мозга, что часто приводит к проявлениям эпилептогенеза в очагах поражения. Совершенствование методов диагностики и лечения данной патологии является мультидисциплинарной проблемой.
Проведённый анализ данных литературы свидетельствует, что МРТ является методом выбора в диагностике КМ, обладающим высокой чувствительностью и специфичностью. В то же время следует отметить недостаточную обоснованность применения МРТ для оценки результатов современных методов лечения КМ, таких как стереотаксическое радиохирургическое лечение, протонная терапия. В доступной литературе практически отсутствуют результаты исследований, в которых бы приводились диагностические характеристики используемых протоколов МРТ при лечении КМ; отсутствует общепринятый алгоритм использования протоколов МРТ для оценки результатов в различные сроки после стереотаксического радиохирургического лечения КМ.
Углубленное изучение этого вопроса и внедрение в практику оптимального протокола МРТ позволит выявить радиологические особенности облученных КМ, что в свою очередь может положительно повлиять на выбор тактики лечения пациентов с КМ головного мозга.
ДОПОЛНИТЕЛЬНО
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: Е.Н. Гиря — поиск публикаций по теме, анализ литературы, написание текста; А.С. Токарев — определение основной направленности обзора, экспертная оценка обзора литературы, обработка полученных результатов; В.Е. Синицын — экспертная оценка обзора литературы, обработка полученных результатов, систематизация и финальное редактирование обзора.
Funding source. This study was not supported by any external sources of funding.
Competing interests. The authors declare that they have no competing interests.
Authors contribution. E.N. Girya ― search for publications on the topic, analysis of literature, text writing; A.S. Tokarev ― determination of the main focus of the review, expert assessment of the literature review, processing of the results obtained; V.E. Sinitsyn ― expert assessment of the literature review, processing of the obtained results, systematization and final editing of the review. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
Читайте также: