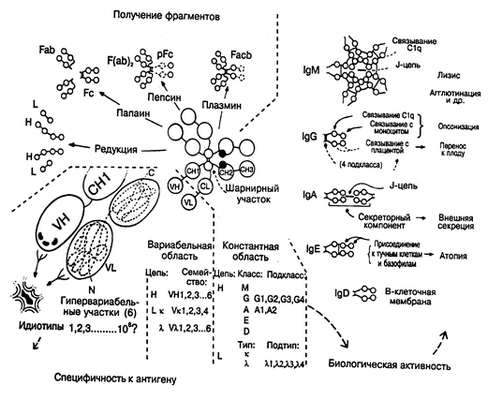
Классы иммуноглобулинов. Структура цепей иммуноглобулинов
Добавил пользователь Евгений Кузнецов Обновлено: 08.01.2026
1. Структура иммуноглобулинов
Антитела (иммуноглобулины) - это белки, которые синтезируются под влиянием антигена и специфически с ним реагируют.
Они состоят из полипептидных цепей. В молекуле иммуноглобулина различают четыре структуры:
1) первичную - это последовательность определенных аминокислот. Она строится из нуклеотидных триплетов, генетически детерминируется и определяет основные последующие структурные особенности;
2) вторичную (определяется конформацией полипептидных цепей);
3) третичную (определяет характер расположения отдельных участков цепи, создающих пространственную картину);
4) четвертичную. Из четырех полипептидных цепей возникает биологически активный комплекс. Цепи попарно имеют одинаковую структуру.
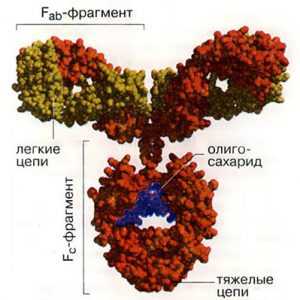
Большинство молекул иммуноглобулинов составлено из двух тяжелых (H) цепей и двух легких (L) цепей, соединенных дисульфидными связями. Легкие цепи состоят или из двух k-цепей, или из двух l-цепей. Тяжелые цепи могут быть одного из пяти классов (IgA, IgG, IgM, IgD и IgE).
Каждая цепь имеет два участка:
1) постоянный. Остается постоянным в последовательности аминокислот и антигенности в пределах данного класса иммуноглобулинов;
2) вариабельный. Характеризуется большой непостоянностью последовательности аминокислот; в этой части цепи происходит реакция соединения с антигеном.
Каждая молекула IgG состоит из двух соединенных цепей, концы которых формируют два антигенсвязывающих участка. На вариабельном участке каждой цепи имеются гипервариабельные участки: три в легких цепях и четыре в тяжелых. Разновидности последовательности аминокислот в этих гипервариабельных участках определяют специфичность антитела. При определенных условиях эти гипервариабельные области могут также выступать в роли антигенов (идиотипов).
В молекуле иммуноглобулина меньше двух антигенсвязывающих центров быть не может, но один может быть завернут внутрь молекулы - это неполное антитело. Оно блокирует антиген, и тот не может связаться с полными антителами.
При энзиматическом расщеплении иммуноглобулинов образуются следующие фрагменты:
1) Fc-фрагмент содержит участки обеих постоянных частей; не обладает свойством антитела, но имеет сродство с комплементом;
2) Fab-фрагмент содержит легкую и часть тяжелой цепи с одним антигенсвязывающим участком; обладает свойством антитела;
3) F(ab)Т2-фрагмент состоит из двух связанных между собой Fab-фрагментов.
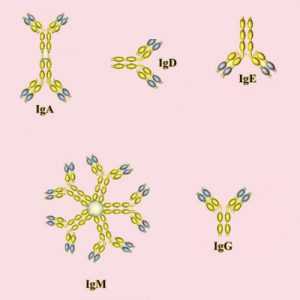
Другие классы иммуноглобулинов имеют такую же основную структуру. Исключение - IgM: является пентамером (состоит из пяти основных единиц, связанных в области Fc-концов), а IgA - димер.
2. Классы иммуноглобулинов и их свойства
Существует пять классов иммуноглобулинов у человека.
1. Иммуноглобулины G - это мономеры, включающие в себя четыре субкласса (IgG1; IgG2; IgG3; IgG4), которые отличаются друг от друга по аминокислотному составу и антигенным свойствам. Антитела субклассов IgG1 и IgG4 специфически связываются через Fc-фрагменты с возбудителем (иммунное опсонирование), а благодаря Fc-фрагментам взаимодействуют с Fc-рецепторами фагоцитов, способствуя фагоцитозу возбудителя. IgG4 участвует в аллергических реакциях и неспособен фиксировать комплемент.
Свойства иммуноглобулинов G:
1) играют основополагающую роль в гуморальном иммунитете при инфекционных заболеваниях;
2) проникают через плаценту и формируют антиинфекционный иммунитет у новорожденных;
3) способны нейтрализовать бактериальные экзотоксины, связывать комплемент, участвовать в реакции преципитации.
2. Иммуноглобулины М включают в себя два субкласса: IgM1 и IgM2.
Свойства иммуноглобулинов М:
1) не проникают через плаценту;
2) появляются у плода и участвуют в антиинфекционной защите;
3) способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент;
4) играют важную роль в элиминации возбудителя из кровеносного русла, активации фагоцитоза;
5) образуются на ранних сроках инфекционного процесса;
6) отличаются высокой активностью в реакциях агглютинации, лизиса и связывания эндотоксинов грамотрицательных бактерий.
3. Иммуноглобулины А - это секреторные иммуноглобулины, включающие в себя два субкласса: IgA1 и IgA2. В состав IgA входит секреторный компонент, состоящий из нескольких полипептидов, который повышает устойчивость IgA к действию ферментов.
Свойства иммуноглобулинов А:
1) содержатся в молоке, молозиве, слюне, слезном, бронхиальном и желудочно-кишечном секрете, желчи, моче;
2) участвуют в местном иммунитете;
3) препятствуют прикреплению бактерий к слизистой;
4) нейтрализуют энтеротоксин, активируют фагоцитоз и комплемент.
4. Иммуноглобулины Е - это мономеры, содержание которых в сыворотке крови ничтожно мало. К этому классу относится основная масса аллергических антител - реагинов. Уровень IgE значительно повышается у людей, страдающих аллергией и зараженных гельминтами. IgE связывается с Fc-рецепторами тучных клеток и базофилов.
Свойства иммуноглобулинов Е: при контакте с аллергеном образуются мостики, что сопровождается выделением БАВ, вызывающих аллергические реакции немедленного типа.
5. Иммуноглобулины D - это мономеры. Функционируют в основном в качестве мембранных рецепторов для антигена. Плазматические клетки, секретирующие IgD, локализуются преимущественно в миндалинах и аденоидной ткани.
Свойства иммуноглобулинов D:
1) участвуют в развитии местного иммунитета;
2) обладают антивирусной активностью;
3) активируют комплемент (в редких случаях);
4) участвуют в дифференцировке В-клеток, способствуют развитию антиидиотипического ответа;
Строение иммуноглобулинов
Антитела - это иммунные белки, образующиеся в организме в ответ на поступление антигена и обладающие способностью специфически взаимодействовать с ним. В физико-химическом отношении антитела представляют собой гаммаглобулины (гликопротеиновые молекулы.
Суммарное содержание иммуноглобулинов в сыворотке крови составляет около 2,5% сухого остатка, т.е. более 1/3 всех белков крови.
Антитела (иммуноглобулины) вырабатываются В-лимфо-цитами (плазмоцитами) в лимфоидных органах и местах скопления лимфоидной ткани, циркулируют в крови и жидкостях организма (лимфе, тканевой жидкости), а также содержатся в различных секретах организма (материнском молоке, слезе, слюне и др.).
Строение иммуноглобулинов.
Все иммуноглобулины человека построены однотипно и состоят из двух идентичных тяжелых полипептидных цепей (Н-цепей, Heavy chains) и двух идентичных легких полипептидных цепей (L-цепей, Light chains), которые связаны между собой посредством ковалентных дисульфидных мостиков (-S-S-) (Рис. 5-1.).
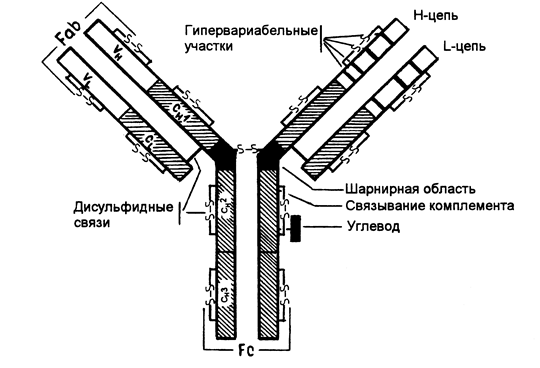 |
Р и с. 5-1. Структура IgG.
Молекулярная масса Н-цепи -50 000 - 70 000,L-цепи - 20000-25000.
Существует 5 типов Н-цепей, которые получили название g (гамма), a (альфа), m (мю), e (эпсилон), d (дельта) и два типа L-цепей k (каппа) и l (лямбда).
Н-цепи, независимо от класса иммуноглобулинов, могут быть связаны либо с каппа-, либо с лямбда-типом L-цепи. В соответствии с типом Н-цепи (g, a, m, d, e), существует пять классов иммуноглобулинов: Ig G, Ig M, Ig A, Ig D, Ig E. Каждый класс иммуноглобулинов обладает особыми свойствами и биологической активностью.
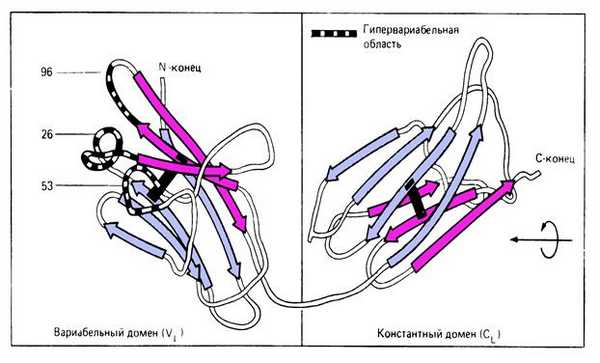
Каждая полипептидная L- и Н-цепь состоит из вариабельной области (V-области, VL и VH) и константной области (С-области, CL и СH) (Рис. 5-1).У каждой легкой цепи имеется одна V-область и одна С-область. У каждой тяжелой цепи имеется одна V-область и 3 или 4 гомологичные константные области. IgG, IgD, IgA имеют три константные области, Ig М, Ig E - 4 константные области.
Тяжелая цепь IgG, IgD, IgA состоит из 450 аминокислотных остатков. V-область этих иммуноглобулинов образована 116 аминокислотными остатками, С-область включает около 334 аминокислотных остатков, ее гомологичные участки СН1, СН2, СНЗ состоят примерно из 100-110 аминокислотных остатков.
Работы Портера, Ниссонова (1959-1963) выявили в молекуле иммуноглобулина несколько функционально активных сегментов (Рис. 5-3.). Так, обработка IgG папаином выявила, что антитело состоит из трех функциональных фрагментов: двух Fab-фрагментов (Fragment antigen binding) и одного Fc-фрагмента (Fragment crystalline). Fab-фрагмент имеет молекулярную массу 50 000, структурно и функционально моновалентен, способен связывать антиген. Fc-фрагмент имеет мол. массу 60 000, состоит из двух Н-цепей (Сg2, СgЗ доменов), связанных между собой дисульфидными связями. Fc-фрагмент обладает способностью связывать комплемент, а также взаимодействовать с иммунокомпетентными клетками, связывая с ними антитела. При расщеплении молекулы иммуноглобулина пепсином образуется 2 функциональных фрагмента: F(ab)2-фрагмент и pFc 1 -фрагмент. F(аb)2-фрагмент состоит из двух Fab-фрагментов связанных между собой дисульфидными мостиками. F(аb)2-фрагмент имеет молекулярную массу 100 000, двухвалентен, обладает во многом свойствами антитела (способен взаимодействовать с антигеном и преципитировать его); pFc 1 -фрагмент представляет собой С-концевую область Fc-фрагмента, состоит из С-концевых областей двух Н-цепей, которые соединены между собой нековалентными связями.
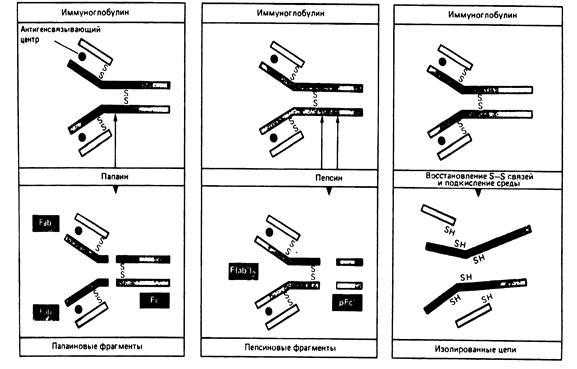
Р и с. 5-3. Расщепление молекулы иммуноглобулина на отдельные пептидные цепи и протеолитические фрагменты.
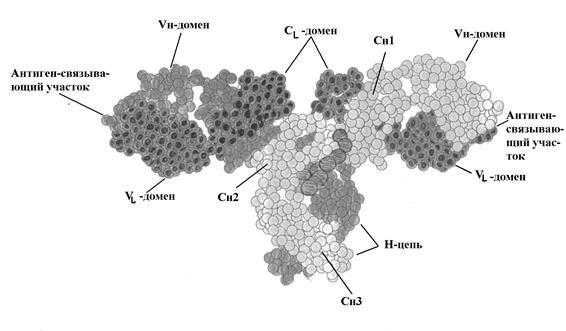
Р и с. 5-4. Трехмерная структура IgG человека.
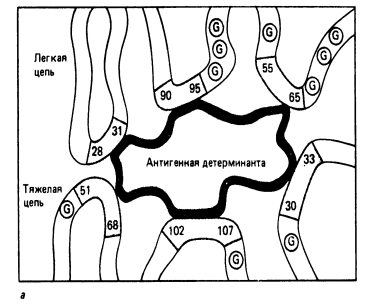
Р и с. 5-5. Упрощенное двухмерное изображение антигенсвязывающего центра.
Активный центр антитела. Важным свойством антитела является способность распознавать и специфически взаимодействовать с антигеном. Активный центр антитела образован V-доменами Н- и L-цепей. (Рис. 5-3; 5-5). Изучение активного центра антитела показало, что он может быть образован 4-8 аминокислотными остатками гипервариабельных областей V-доменов Н- и L-цепей (Рис. 5-5.).
Большинство антител имеет два и более активных центра. Такие антитела называются полными.
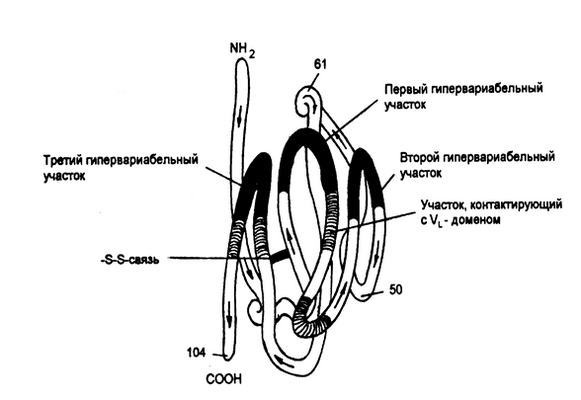
Р и с. 5-6. Пространственное объединение гипервариабелъных участков V-доменов тяжелой цепи IgG человека
Способность антитела связывать определенное количество антигенных детерминант определяется понятием валентность. Валентность антитела, как правило соответствует числу активных центров AT. Молекула иммуноглобулина, связывающая две антигенные детерминанты - двухвалентна, молекула иммуноглобулина, связывающая 5 антигенных детерминант - пятивалентна. Часть иммуноглобулинов имеют один активный центр и способны связывать одну антигенную детерминанту. Такие моновалентные антитела называются неполными антителами
Ри с. 5-7. Структура глобулярных доменов легкой цепи по данным рентген-структурного анализа.
Это важно знать:
Недостатки речного транспорта РЕЧНОЙ ТРАНСПОРТ Речной транспорт (внутренний водный транспорт) — транспорт.
Виды организационных структур В зависимости от характера связей между различными подразделениями различают следующие основные виды организационных структур.
Трудовой договор: понятие и содержание. Порядок заключения и расторжения Трудовой договор - это соглашение между работодателем и работником.
Административное право Предмет административного права. Следовательно, предметом административного права является совокупность общественных отношений.
Алгоритм транспортировки тяжелобольного внутри учреждения на каталке (носилках) I. Подготовка к транспортировке: 1. Представиться пациенту, объяснить, как себя вести при транспортировке (если пациент без сознания.
Разнообразие иммуноглобулинов
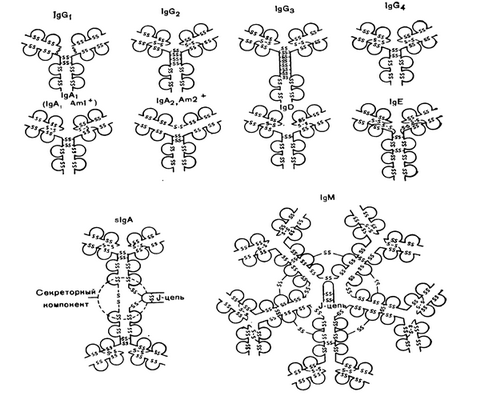
Иммуноглобулины в любом организме представлены чрезвычайно разнообразными по структуре, специфичности и функциям макромолекулами. Физические, антигенные и функциональные различия между константными областями тяжелых цепей определяют у всех млекопитающих и человека наличие 5 классов иммуноглобулинов: IgG, IgM, IgA, IgD, IgE (Рис. 5-9; 5-10). Небольшие вариации в С-областях молекул одного класса определяют подклассы антител. У человека известно 4 подкласса IgG: IgG1, IgG2, IgG3, IgG4 и 2 подкласса IgA: IgA1 и IgA2. Подклассы IgG различаются между собой числом дисульфидных мостиков, соединяющих Н- и L-цепи и аминокислотной последовательностью в шарнирных участках иммуноглобулинов. Различия между подклассами IgA сводятся к числу и расположению дисульфидных мостиков и к взаимному расположению Н- и L-цепей. Изучение иммуноглобулинов показало, что отдельные классы и подклассы антител несут характерные только для данного класса или подкласса антигенные детерминанты, получившие название изоти-пических детерминант (Рис.5-11). Наличие изотипических детерминант позволяет иммунологически отличать классы и подклассы иммуноглобулинов друг от друга.
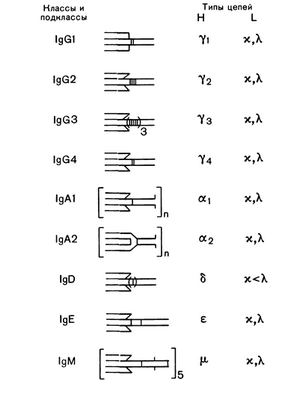
Р и с. 5-9. Классы и подклассы иммуноглобулилов человека.
Кроме изотипических детерминант иммуноглобулиновые молекулы несут аллотипические детерминанты (Рис.5-11). Аллотипические маркеры (ангигенные детерминанты) позволяют иммуноглобулины одного человека (например IgG) отличить от иммуноглобулинов другого человека (IgG).
Иммуноглобулиновые молекулы также чрезвычайно разнообразны по строению их антигенсвязывающей области (V-региону), которая определяет специфичность антитела. Разнообразие антител по специфичности превышает 10 8 . В антигенсвязывающей области антитела располагаются как паратопы, так и идиотопы (Рис. 5-11а).
Р и с. 5-10. Структура иммуноглобулинов.
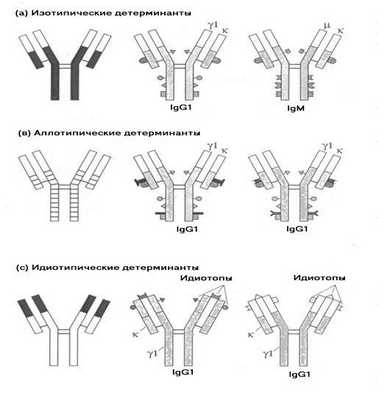
Р и с. 5-11. Антигенные детерминанты иммуноглобулинов.

Р и с. 5-11а. Идиотипы антиген-распознающих молекул.
Функциональная н физико-химическая характеристика отдельных классов иммуноглобулинов
Основные физико-химические и биологические свойства иммуноглобулинов человека представлены в табл. 5-1.
Т а б л и ц а 5-1. Основные характеристики иммуноглобулинов человека.
| Свойство | IgM | IgG | IgA | IgD | IgE |
| Молекулярная форма | пентамер | мономер | мономер, димер, и т.д. | мономер | мономер |
| Обозначения: | |||||
| Н-цепи | m | g | a | d | e |
| L-цепи | k или l | k или l | k или l | k или l | k или l |
| Молекулярная формула | (k2m2)5 (l2m2)5 | k2g2 l2g2 | (k2a2)n (l2a2)n | k2d2 l2d2 | k2e2 l2e2 |
| Дополнительные цепи | J-цепь | - | J-цепь, секреторный компонент | - | - |
| Подклассы | IgGl,IgG2, IgG3, IgG4 | IgAl, IgA2 | |||
| Подклассы Н-цепей | - | gl, g2,g3,g4 | a1, a2 | - | - |
| Аллотипы Н-цепей | Мm(2) | Gm (ок. 20) | Аm(2) | - | - |
| Количество доменов Н-цепи | |||||
| Молекулярная массса | 950 000 | 150 000 | 160 000 | 175 000 | 190 000 |
| Валентность антител | 5 или 10 | ? | ? | ||
| Коэффициент седиментации (S) | 19S | 6,6S | 7S, 9S, 11S, 14S | 7S | 8S |
| Содержание углеводов (%) | |||||
| Концентрация в сыворотке, г/л | 0,5 - 2,0 | 12,0 - 14,0 | 1,8 - 2,1 | 0,4 | 0,0025 |
| Процент от общего количества | 5-10 | 75-85 | 7-15 | 0,3 | 0,003 |
| Период полураспада (дни) | 5,1 | 5,8 | 2,8 | 2,5 | |
| Скорость синтеза (мг/кг в день) | 6,7 | 0,4 | 0,016 | ||
| Парапротеинемия | макрогло- булинемия | миелома | миелома | миелома | миелома |
Продолжение таблицы 5-1.
| Свойство | IgM | IgG | IgA | IgD | IgE |
| Агглютинирующая активность | - | - | - | ||
| Фиксация комплемента | + | +(IgGl, 2,3) | - | - | - |
| Активация комплемента(альтернативный путь) | - | +(IgG4) | +(IgAl,2) | + | - |
| Цитофильность к: | |||||
| макрофагам, | - | + | - | - | - |
| лимфоцитам, | - | + | - | - | + |
| К-клеткам, | + | + | - | - | - |
| нейтрофилам, | - | + | + | - | - |
| Моноцитам | - | + | - | - | - |
| Тучным клеткам | - | + | - | - | + |
| Другие биологические свойства | первичный иммунный ответ | вторичный иммунный ответ; перенос через плаценту | характерные антитела в секретах | основная молекула поверхности лимфоцитов | гомоцито-тропные антитела; анафилаксия; аллергия |
IgG представляют собой мономер, имеет у-образную форму, мол. массу 150 000, двухвалентен. Концентрация его в сыворотке здоровых людей составляет в среднем 12,0 г/л.
Молекулы IgG свободно диффундируют из крови в тканевую жидкость; здесь находится почти половина (48,2%) имеющегося в организме IgG. В тканевой жидкости IgG наиболее значим среди других классов иммуноглобулинов в нейтрализации бактериальных токсинов и связывании микроорганизмов. IgG, связываясь с бактериями, активирует комплемент по классическому пути, вызывает хемотаксис полиморфноядерных лейкоцитов.
Скорость биосинтеза IgG составляет 33 мг/кг массы в день, период полураспада - 23 дня (IgG3 - 7-9 дней).
IgM представляет собой пентамер, имеет мол. массу 950 000, валентность - 10 (Рис. 5-13). Концентрация IgM в сыворотке крови составляет 0,5-2 г/л. Этот иммуноглобулин обладает выраженной способностью преципитировать, агглютинировать антигены и лизировать микроорганизмы при участии комплемента. Среди всех иммуноглобулинов IgM проявляет наибольшую способность к связыванию комплемента.

Р и с. 5-13. Структура IgM.
Скорость биосинтеза IgM составляет 6,7 мг/кг массы в день, период полураспада - 5,1 дня. IgM синтезируется на ранних стадиях иммунного ответа, обеспечивая первую линию обороны при бактериемии.
IgA содержится в сыворотке и секретах организма. Сывороточный IgA представлен мономерной формой, двухвалентен, имеет мол. массу 160 000. Концентрация его в сыворотке в среднем составляет 2 г/л. IgA не обладает способностью связывать комплемент, не способен преципитировать растворимые и агглютини-ровать корпускулярные антигены, лизировать микроорганизмы.
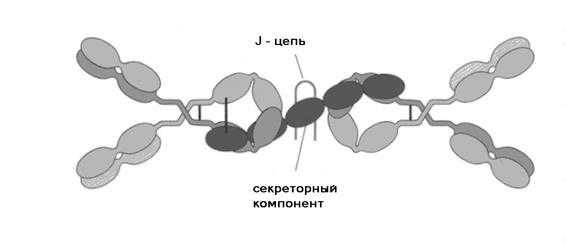
Р и с. 5-14. Строение секреторного иммуноглобулина А
Секреторный IgA состоит из двух IgA-молекул, которые ковалентно связаны J-цепью и с секреторным компонентом (SC). Секреторный компонент представляет собой полимерную иммуноглобулиновую молекулу, состоящую из пяти Ig- подобных доменов. С помощью дисульфидных мостиков SC связан с димером IgA
Секреторный IgA содержится в слюне, слезной жидкости, носовых выделениях, поте, секретах бронхов, легких, слизистых оболочек желудочно-кишечного тракта и мочеполовых путей. Секреторный IgA обеспечивает защиту слизистых оболочек от микроорганизмов, является основным фактором местного иммунитета. Секреторный IgA существует в основном в форме димера, четырехвалентен (Рис 5-14). Синтезируется иммуноглобулин плазматическими клетками лимфоидных скоплений слизистых оболочек в виде мономеров, которые внутри клетки димеризуются при участии J-цепи (Рис. 5-15). В слизистой к димеру IgA присоединяется секреторный компонент (SC - secretory component), продуцируемый эпителиоцитами слизистых оболочек. Секреторный компонент (SC) предохраняет молекулу антитела от действия многочисленных ферментов, находящихся в составе секретов слизистых оболочек.
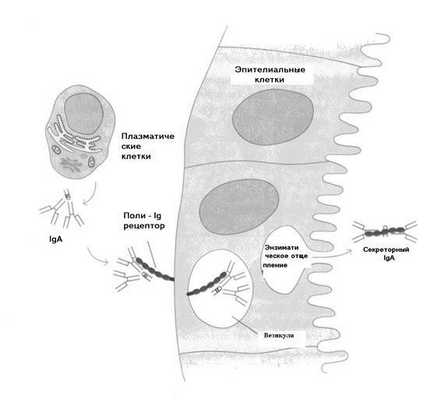
Р и с. 5-15. Транспорт IgA в секреторную жидкость.
Секреторный IgA формируется как единая молекулярная структура в процессе транспорта димера IgA через слизистую. Продуцируемый в подслизистом слое плазматическими клетками, димер IgA связывается поли-Ig-рецепторами (полимерными иммуноглобулиновыми молекулами) эпителиальных клеток слизистого слоя, расположенных на базолатеральной мембране. Образовавшийся комплекс рецептор-IgA затем транспортируется с помощью механизма эндоцитоза внутрь эпителиальной клетки с образованием в ней везикулы, в составе которой этот комплекс далее транспортируется к ее наружной мембране. После слияния везикулы с плазматической мембраной клетки поли-Ig-рецептор энзиматически отщепляется от стенок везикулы и, став свободным (несвязанным с ней), уже в качестве секреторного компонента окончательно встраивается в структуру димера IgA. Путем экзоцитоза, сформированный таким образом sIgA, высвобождается в слизистый секрет.
IgD представляет собой мономер, имеет мол. массу 175000, двухвалентен. Его концентрация в сыворотке составляет до 0,4 мг/мл. Скорость его биосинтеза составляет 0,4 мг/кг массы в день, период полураспада - 2,8 дня. Биологическая функция сывороточного IgD не выяснена.
IgE, по строению мономер, имеет мол. массу 190000, двухвалентен. Концентрация в сыворотке составляет 0,25 мг/л. Скорость биосинтеза IgE составляет 0,02 мг/кг массы в день, период полураспада - 2,5 дня. IgE не обладает способностью связывать комплемент, но прочно и быстро связывается с клетками, в частности, с тучными клетками и базофилами. Взаимодействие IgE с антигеном на поверхности тучных клеток приводит к их дегрануляции и высвобождению вазоактивных аминов, обусловливающих симптомы аллергических реакций. Основная физиологическая функция IgE заключается в защите слизистых оболочек от инфекций. В общем виде структура и функция антител представлена на рис.5-16.
Р и с. 5-16. Структура и функции антител.
Найдите 2 минуты и прочитайте про:
Методы сестринского обследования пациента I этап сестринского процесса - ОБСЛЕДОВАНИЕ Этапы сестринского процесса Сестринский процесс включает в себя 5 последовательных.
Средства физического воспитания Для достижения цели физического воспитания применяются следующие группы средств.
Основные этапы развития астрономии Предмет и задачи астрономии. Разделы астрономии.Классические и современные методы астрономических исследований. Предмет и задачи.
ОСНОВНЫЕ НАПРАВЛЕНИЯ В ИСКУССТВЕ 19 ВЕКА (РОМАНТИЗМ, РЕАЛИЗМ, СИМВОЛИЗМ, ИМПРЕССИОНИЗМ, НАТУРАЛИЗМ) 1. Романтизм (Romanticism), идейное и художественное направление, возникшее в европейской и американской культуре конца 18 века -.
Составными компонентами психологической готовности выступают: (выберите лишний) а) интеллектуальная готовность б) личностная готовность в) социально-психологическая готовность г) поведенческая.
Что такое иммуноглобулины и зачем они нужны
зложена на разныеЧеловеческий иммунитет - это сложная многоступенчатая система защиты организма от вредоносного воздействия извне (вирусов, бактерий, аллергенов, грибков). Не существует одного органа, который бы отвечал за иммунную защиту. Эта функция возложена на разные органы иммунной системы: начиная с лимфатических узлов до кишечника и заканчивая белковыми веществами - иммуноглобулинами.
Общая характеристика иммуноглобулинов
Иммуноглобулины (Ig), или антитела, представляют собой гликопротеины, имеющие в своем составе центры специфического нековалентного связывания антигена, основанного на принципе комплементарности. Существуют растворимые формы иммуноглобулинов, которые и называют антителами, и мембранные формы иммуноглобулинов, составляющие основу В-клеточных рецепторов на поверхности В-лимфоцитов. Иммуноглобулины содержатся в крови и в некоторых секреторных жидкостях и вырабатываются как ответ на контакт с антигенами, например, бактериями или вирусами. Иногда иммуноглобулины продуцируются после контакта с собственными тканями организма, называемыми аутоантигенами.
Дефицит или избыток антител может быть признаком различных патологий, поэтому определение их количества в крови является важной частью при диагностике многих заболеваний. Кроме того, современные достижения в биомедицине позволяют использовать синтетические антитела в лечении некоторых заболеваний.
Структура антител
Иммуноглобулины - это симметричные Y-образные молекулы, состоящие из двух тяжелых длинных (Н) и двух коротких легких (L). цепей, которые соединены друг с другом либо дисульфидными (SS), либо водородными связями. Каждая молекула иммуноглобулина содержит не менее двух идентичных Н-цепей. Тяжелые цепи иммуноглобулинов разных классов состоят из четырех или пяти доменов и обозначаются буквами греческого алфавита соответственно латинской аббревиатуре класса. Принадлежность антитела к конкретному классу и подклассу называют изотипом, который обозначается по типу тяжелой цепи.
Легкие цепи построены из двух доменов. В их составе обязательно находится два вида доменов - вариабельный (V - variable) и константный (С-coпstaпt). Иммуноглобулины, продуцируемые разными клонами плазматических клеток, имеют разные по аминокислотной последовательности вариабельные домены. Константные домены сходны или очень близки для каждого изотипа иммуноглобулина. Вариабельные домены являются N-концевыми. В составе легкой цепи N-концевой домен является вариабельным (VL), С-концевой домен - константным (CL). Тяжелые цепи имеют один вариабельный (N-концевой) домен (Vн) и несколько константных доменов. Легкие и тяжелые цепи иммуноглобулинов гликозилированы.
Иными словами, каждое антитело подходит к антигену по принципу ключа и замка, а при соединении образуют иммунные комплексы. Но также антитела способны проявлять гибкость чужеродных агентов, благодаря чему с легкостью адаптироваться к различным антигенам. Однако эта способность иммуноглобулинов иногда провоцирует у человека перекрестные аллергические реакции - когда иммунитет человека с аллергией не может различать аллергены. Например, человек с аллергией на цветочную пыльцу вследствие “ошибки” иммуноглобулинов может также реагировать на сырые фрукты и овощи.
Разновидности иммуноглобулинов
В человеческом организме иммуноглобулины представлены в двух формах:
- растворимые (продуцируются плазматическими клетками);
- связанные с наружной мембраной B-лимфоцитов, они же - рецепторные антитела.
Кроме того, существуют разные классы и подклассы (изотопы) иммуноглобулинов. Они различаются по своим биологическим особенностям, структуре и нацеленности на «мишени». На основе различий в структуре тяжелых цепей было выделено несколько классов антител. Каждый из них отличается функциями и ответными реакциями.
Кроме основных классов иммуноглобулинов существует несколько подклассов. Разница между ними основана на незначительных отличиях в типе тяжелых цепей каждого класса. В человеческом организме встречаются 4 подкласса антител. Нумерация соответствует порядку уменьшения их концентрации в сыворотке. Так, антитела IgG и IgA дополнительно группируют на подклассы IgG1, IgG2, IgG3, IgG4, а также IgA1 и IgA2.
Большинство антител (IgG, IgD, IgE) в организме представлены в форме мономера (одной молекулы). Исключение составляет антитела класса А, которые также встречается в форме димера, и IgМ, образующий форму снежинки (пентамер).
Характеристика разных классов иммуноглобулинов
Класс IgA
Около 15% антител, содержащихся в организме здорового человека, это иммуноглобулины класса IgA, которые разделяются на два подкласса IgA - IgA1 и IgA2. Они различаются молекулярной массой тяжелых цепей и концентрацией в сыворотке, где IgA представлен в основном как мономер, с молекулярной массой 160 кДа. В секреторных жидкостях иммуноглобулины присутствуют в виде димера, образованных двумя мономерами, их содержание составляет 10-15% от общего количества сывороточных иммуноглобулинов. Димерные иммуноглобулины присутствуют в большинстве секреторных жидкостей, включая слизистые оболочки дыхательных и мочеполовых путей, ЖКТ, а также слюну, слезы, молозиво и молоко у женщин. Поскольку IgA присутствует на слизистых оболочках пищеварительной системы, где он может подвергаться воздействию ферментов, в его составе есть специальный компонент, который защищает молекулу от преждевременного разрушения.
Иммуноглобулины класса A, как правило, не являются специфическими с точки зрения «подстраивания» под специфический антиген. Обычно антитела из этой группы присутствуют в уязвимых местах организма или на участках, где микробы могут легко проникнуть внутрь. Иммуноглобулины класса A обеспечивают местный гуморальный иммунитет. Это связано с их свойствами предотвращать проникновение патогенов через эпителиальные поверхности, благодаря присутствию IgA в секрете слизистых оболочек (слюна, слезы) он защищает организм от некоторых локальных инфекций.
Основная функция иммуноглобулинов этого класса состоит не в разрушении антигенов, а в предотвращении проникновения инфекционных агентов в систему кровообращения. Сами по себе IgA не способны самостоятельно разрушать бактерии, поэтому они всегда работают вместе с лизоцимами - ферментами, которые также присутствуют в секреторных жидкостях и могут разрушать бактерии.
Нарушения концентрации иммуноглобулинов класса IgA в организме способствуют его восприимчивости к инфекционным заболеваниям дыхательных путей и мочеполовой системы, в том числе нефропатии. Лица, с недостаточностью IgA, более склонны к аутоиммунным расстройствам, таким как ревматоидный артрит, волчанка, аллергия и астма.
К снижению содержания IgA могут привести разные заболевания, среди которых - гонорея. Бактерии, вызывающие гонорею, продуцируют фермент, который расщепляет IgA на две части: Fc и Fab фрагменты. Что интересно, Fab все еще может находить опасные для организма бактерии, но без взаимодействия с Fc он не способен противостоять им.
Класс IgD
Иммуноглобулины класса D в организме человека представлены в очень маленьком количестве и составляют примерно 0,2% от всех антител. Известно, что IgD прикрепляется к поверхности некоторых В-лимфоцитов как рецептор В-клеток. Тем не менее его функции в человеческом организме на сегодня до конца еще не изучены. Предполагается, что именно IgD является причиной аллергии на пенициллин, а также он может участвовать в запуске аутоиммунных реакций.
Класс IgE
Иммуноглобулин IgE в норме составляет не более 0.1% от общего количества сывороточных иммуноглобулинов. Более 90% синтезируемого плазматическими клетками IgE секретируется в слизистых экзосекретах желудочно-кишечного тракта. Биологическая функция заключается в защите от внеклеточных паразитов, хотя она полностью не выяснена, и резкое увеличение количества IgE является патогенетическим признаком при аллергических реакциях.
Иммуноглобулины этой группы связываются с поверхностью базофилов и тучных клеток. Дальше к ним присоединяется антиген, что в свою очередь ведет к выбросу в кровоток вазоактивных аминов и развитию IgE-зависимой аллергической реакции по следующему механизму.
Различные антигены, такие как пыльца, ядовитые вещества, споры грибов, пылевые клещи или перхоть домашних животных связываются с IgE и запускают высвобождение гепарина, гистамина, протеолитических ферментов, лейкотриенов и цитокинов. Это ведет к расширению сосудов и повышению их проницаемости, что способствует проникновению чужеродных агентов в капилляры, а затем и в ближайшие ткани, вследствие чего развиваются характерные для аллергической реакции симптомы. Однако, большинство типичных аллергических реакций в виде чихания, кашля, слезотечения и повышенного выделения слизи способствует выведению из организма оставшихся аллергенов.
Исследования показали, что такие расстройства, как астма, ринит, экзема, крапивница и дерматит вызывают повышение уровня IgE. Антитела Е-типа также активно продуцируются в ответ на присутствие в организме гельминтов, персистирующих инфекций (герпесвирусы, атипичные микроорганизмы) и некоторых членистоногих (например, вшей). Кроме того, IgE играет косвенную роль в иммунном ответе, стимулируя другие иммунные компоненты. Также он может защищать поверхности слизистых оболочек, вызывая, в случае опасности, воспалительные реакции.
Патологически низкий уровень антител класса IgE может возникать на фоне редкого генетического заболевания, сопровождающегося нарушением координации мышц (атаксия телеангиэктазия).
Класс IgG
Иммуноглобулины класса G являются доминирующими в человеческом организме. На их долю приходится 75% всех антител. Частично это связано с длительным периодом полураспада: от 7 до 23 дней (зависимо от подкласса). Кроме того, они могут сохраняться в крови в течение нескольких десятков лет после контакта с антигеном.
Существуют 4 подкласса IgG:
- IgG1 составляет от 60 до 65% от общего количества иммуноглобулина этого класса. Его дефицит обычно является признаком гипогаммаглобулинемии (дефицит плазматических клеток).
- IgG2 - второй по распространенности изотоп, составляет 20-25% от общего количества IgG. «Взрослые» концентрации антитела обычно появляются к 6-7-летнему возрасту. Дефицит IgG2 связывают с рецидивирующими инфекциями дыхательных путей.
- IgG3 занимает от 5 до 10% от общего IgG. Играет основную роль в иммунных реакциях против белковых или полипептидных антигенов.
- IgG4 составляет до 4% в общей доле IgG. Раньше IgG4 связывали только с пищевой аллергией, но недавние исследования показали, что повышение IgG4 в сыворотке отмечается у пациентов, страдающих склерозирующим панкреатитом, холангитом и интерстициальной пневмонией. Тем не менее точная роль IgG4 до сих пор неизвестна.
IgG играет ключевую роль в гуморальном иммунном ответе. Это основной иммуноглобулин, содержащийся в крови, а также в лимфатической, спинномозговой и брюшной жидкостях. Способность оставаться в организме в течение длительного времени делает его наиболее полезным антителом для пассивной иммунизации. Это единственное антитело, способное проникать через плаценту матери и попадать в кровообращение плода, обеспечивая послеродовую защиту новорожденного в течение первых месяцев его жизни.
Главные функции IgG:
- усиление фагоцитоза в макрофагах и нейтрофилах;
- нейтрализация токсинов;
- инактивация вирусов;
- уничтожение бактерий.
Класс IgM
IgM - это самый важный представитель семейства человеческих иммуноглобулинов, хотя он и отличается весьма коротким периодом полураспада - около 5 дней.
Иммуноглобулины класса IgM в общей доле сывороточных антител в человеческом организме составляют примерно 10-13%. Они участвуют в первичных иммунных реакциях и обладает выраженной антибактериальной активностью, способностью связывать комплемент, не проникают через плацентарный барьер. Первыми синтезируются в ответ на антигенную стимуляцию организма. Наиболее ранние антитела относятся к иммуноглобулинам класса М, что нередко используется в диагностике инфекционных заболеваний. Они же первыми появляются в процессе онтогенеза и филогенеза.
Повышение уровня IgM можно расценивать как признак недавно перенесенной инфекции или присутствия в организме антигена. На мембране В-лимфоцитов присутствует мономерная форма IgM, выполняющая функцию основной составляющей В-клеточного рецептора.
Роль иммуноглобулинов в организме
Антитела являются частью гуморального иммунного ответа и действуют очень специфично, так как всегда направлены против определенного антигена.
Задача любого антитела в организме человека - участвовать в иммунных реакциях. Иммуноглобулины обладают способностью образовывать иммунные комплексы с молекулами антигена, активировать систему комплемента (комплекс белков, содержащихся в крови, необходимых для защиты организма от чужеродных агентов) и вызывать воспаления. Все эти действия направлены на нейтрализацию антигена и безопасное удаление его из организма.
Вследствие различных структурных свойств разные классы антител могут выполнять специализированные функции:
- нейтрализовать паразитов (IgE);
- нейтрализовать микроорганизмы (IgM, IgG);
- защищать от повторных заболеваний, таких как эпидемический паротит (IgG);
- защищать слизистые оболочки (IgA);
- участвовать в синтезе лимфоцитов (IgD);
- защищать плод (IgG) и новорожденного малыша (IgA).
Антитела и иммунологическая память
Иммунный ответ делится на первичный и вторичный. Первичный ответ проявляется во время первого контакта с антигеном, после чего организм сначала вырабатывает иммуноглобулины класса IgM, которые затем замещаются более специфическими и стабильными антителами IgG.
Вторичный иммунный ответ возникает при повторном контакте с тем же антигеном. Он интенсивнее первичного, концентрация антител достигает более высоких уровней, чем в первый раз.
Такой эффект обусловлен иммунологической памятью, которая опосредована В-имфоцитами. Это долгоживущие клетки которые вступают в контакт с антигеном, начинают очень интенсивно делиться и продуцировать специфические антитела.
Как определяется количество антител
Антитела составляют от 12% до 18% сывороточных белков. Количества отдельных белковых фракций, в лабораторных условиях определяется на основании протеинограмм.
Тест на антитела методом иммуноферментного анализа (ИФА), как правило, проводится с венозной кровью (позволяет определить количество иммуноглобулинов класса IgM, IgG, IgE, IgA). Кроме того, определить количество антитела класса IgA можно путем биохимического исследования слюны или кала человека - методом полимеразной цепной реакции (ПЦР). В отдельных ситуациях тест может быть проведен с использованием другого материала, например спинномозговой жидкости.
Если в крови пациента диагностировано критическое повышение некоторых иммуноглобулинов, говорят о гипергаммаглобулинемии. Как правило, у таких пациентов чрезмерно повышаются антитела класса IgM, при этом остальные остаются в дефиците.
На фоне патологического повышения некоторых антител могут развиваться разные заболевания, в том числе:
- острые и хронические воспаления;
- паразитарные, бактериальные, вирусные или грибковые заболевания;
- аутоиммунные болезни;
- цирроз печени;
- саркоидоз; .
Патологически низкое количество антител в сыворотке может возникать на фоне:
- врожденных генетически расстройств;
- приема некоторых противомалярийных, цитостатических, глюкокортикоидных препаратов;
- недоедания;
- инфекции, в том числе ВИЧ;
- онкологических заболеваний;
- нефротического синдрома;
- обширных ожогов;
- тяжелой диареи.
Иммуноглобулины и вакцинация
Антитела играют ключевую роль в развитии иммунитета после вакцинации. В результате контакта с антигеном, содержащимся в вакцине, иммунная система вырабатывает антитела. Сначала менее стойкий и специфический IgM, а затем более стойкий IgG. Например, во время вакцинации против вируса гепатита В, вакцину вводят трижды с определенным интервалом между прививками. Это позволяет создать стойкий иммунитет к болезни. Эффективность такой вакцинации определяется изменением в организме количества антител IgG.
Антитела в медицине
Благодаря развитию биохимии, молекулярной биологии и медицины, в наше время стало возможным синтезировать иммуноглобулины в лабораторных условиях (как правило, антитела класса IgG). Такие антитела называются моноклональными, так как они происходят из клона одной клетки и работают против определенного антигена.
Сегодня моноклональные иммуноглобулины используют для лечения разных заболеваний. Впервые эта методика была применена в 1981 году для лечения лимфомы. А уже в 1984 году изобретатели моноклональных антигенов - немецкий биолог Георг Келер и британский иммунолог Сезар Мильштейн - получили Нобелевскую премию.
В современной медицине моноклональные антитела применяют для:
- уничтожения раковых клеток;
- ингибирования отдельных клеток иммунной системы после трансплантации органов (позволяет предотвратить отторжение пересаженного органа);
- подавления иммунных реакций при аутоиммунных заболеваниях.
Иммунный ответ на каждый отдельный антиген включает продукцию множества молекул антител, синтезируемых разными плазматическими клетками, и имеющих разное строение активного центра и изотип. Вследствие различий в строении активных центров образующиеся антитела имеют различную специфичность и аффинность.
Специальность: врач педиатр, инфекционист, аллерголог-иммунолог .
ИММУНОГЛОБУЛИ́Н
ИММУНОГЛОБУЛИ́Н (Ig), сложный глобулярный белок позвоночных животных (начиная с хрящевых рыб) и человека, обладающий активностью антитела, т. е. способностью специфически взаимодействовать с антигеном (см. Антиген - антитело реакция ). И. присутствует либо в свободном виде в крови и др. жидкостях организма, либо в виде рецепторов на поверхности клеточных мембран. У каждого индивидуума существует громадное разнообразие молекул И., различающихся по специфичности. Они синтезируются плазматич. клетками, дифференцировка которых инициируется взаимодействием В-лимфоцитов иммунной системы (имеющих рецептор нужной специфичности) с антигенами при участии ряда медиаторов (напр., интерлейкинов). Уникальная специфичность И. и высокое сродство к «своему» антигену обеспечивается комплементарностью активного центра И. к участку молекулы антигена (эпитопу). Одновременно И. могут связываться с рецепторами лейкоцитов (т. н. Fc-рецепторами) или белками системы комплемента , в результате чего включается цепь последовательных реакций иммунной системы организма, приводящих к удалению чужеродного агента (защитная функция иммуноглобулина).
Читайте также:
- Грациозная растяжка всего за неделю. Эффективные упражнения для растяжки
- Дренирование каверн при туберкулезе. Обоснование дренирования каверны легкого
- Компоненты вмешательства при алкоголизме. Методы изменения поведения
- Огнестрельные и проникающие ранения черепа, головного мозга на КТ
- Антенатальная диагностика аномалий почек и мочевыводящих путей. Рекомендации
