Клеточная терапия опухолевых заболеваний. Противоинфекционная активность дендритных клеток
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Ирина Балдуева, доктор медицинских наук,
Татьяна Нехаева, кандидат медицинских наук,
Алексей Новик, кандидат медицинских наук,
Анна Данилова, кандидат биологических наук,
Нино Пипиа,
Александр Щербаков, доктор медицинских наук,
Алексей Беляев, доктор медицинских наук,
НМИЦ онкологии им. Н. Н. Петрова МЗ РФ (Санкт-Петербург, Россия)
«Природа» №6, 2018
Полтора столетия назад немецкий гистолог П. Лангерганс (P. Langerhans), будучи студентом, изучал иннервацию кожи и обнаружил необычные клетки, которые из-за длинных отростков ошибочно принял за нервные. Их связь с иммунной системой выяснилась спустя 105 лет, в 1973 г., когда американский иммунолог Р. Штайнман (R. Steinman) нашел в лимфоидных органах мышей этот тип клеток, назвав их дендритными (ДК). Впоследствии оказалось, что они относятся к «профессиональным» антигенпредставляющим клеткам. Это означает, что ДК активируются при встрече с потенциально опасными для организма антигенами (включая опухолевые), захватывают их путем фагоцитоза, перемещаются в лимфатические узлы, при этом расщепляют антиген на пептиды, которые связываются с молекулами главного комплекса гистосовместимости HLA (от англ. Human Leukocyte Antigen), расположенными на клеточной мембране ДК, и представляют их другим клеткам иммунной системы (Т- и В-лимфоцитам) * . Стало ясно, что ДК — природные усилители иммунного ответа (естественных адъювантов) — играют важную роль в поддержании врожденных и приобретенных иммунных реакций, взаимодействуют с различными лимфоидными и миелоидными клетками в физиологических и патофизиологических условиях.
В 1990-е годы, когда ДК, полученные из различных тканей человека и экспериментальных животных, научились выращивать в больших количествах в лабораторных условиях, появилась возможность изучать эти клетки на моделях [1]. В результате было описано несколько подтипов ДК с уникальными и специфическими функциями, морфологией и локализацией 5. Особый интерес представляют те из них, которые участвуют в иммунных реакциях, направленных на разрушение опухолевых клеток, определяют интенсивность таких реакций и отвечают за формирование опухолевого микроокружения (рис. 1) [6, 7]. Такими свойствами обладают миелоидные ДК, которые происходят из костномозговых гемопоэтических клеток-предшественников, при этом их можно получить из моноцитов периферической крови в специальных лабораторных условиях.
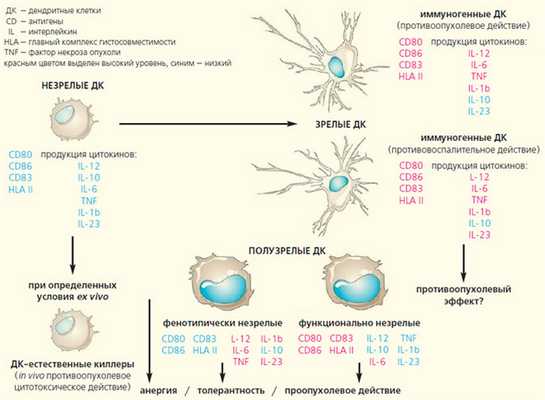

Рис. 1. Фенотипические и функциональные характеристики миелоидных костномозговых дендритных клеток
Для клинического применения могут быть пригодны различные типы миелоидных ДК: выделенные из периферической крови, дифференцированные ex vivo (вне организма) из костномозговых предшественников, полученные из моноцитов периферической крови, а также зрелые и незрелые ДК [8]. Под типом подразумевается стадия созревания гемопоэтической клетки за пределами костного мозга, в которой важная роль отводится типу антигенной стимуляции. Она связана с синтезом внутриклеточных и поверхностных молекул для передачи их сигналов лимфоцитам, во многом зависит от микроокружения и может быть заблокирована или поляризована факторами, приводящими к образованию семейства дендритных клеток с толерантной и/или иммуносупрессивной (подавляющей) функцией [9].
Незрелые и полузрелые (фенотипически или функционально) ДК встречаются в нелимфоидных органах и тканях, но способны мигрировать в лимфатические узлы [10]. Однако незрелые клетки содержат низкий уровень молекул HLA I класса и ко-стимулирующих молекул CD80 и CD86 (CD — от англ. Cluster of Differentiation) и не могут эффективно активировать Т-лимфоциты. Так, введение незрелых ДК периферической крови в лимфатические узлы вызывало у пациентов с опухолью слабый антиген-специфический иммунный ответ, а у здоровых добровольцев подавляло активность цитотоксических Т-лимфоцитов CD8 + , действие которых направлено на вирусные пептиды, и стимулировало образование пептид-специфических Т-клеток, продуцирующих иммуносупрессирующий интерлейкин-10 или аутореактивные Т-клетки. В противоположность этому зрелые ДК вызывают образование CD8 + Т-лимфоцитов и способствуют продукции γ-интерферона CD4 + Т-клетками [11].
Таким образом, степень зрелости — ключевая характеристика ДК при использовании их для вакцинотерапии. В связи с этим важно выявить факторы, способствующие созреванию различных субпопуляций ДК. В настоящее время такие факторы исследуются в контексте изучения лигандов к Toll-подобным рецепторам, принимающим участие в мимикрии «природного» патоген-индуцированного пути созревания ДК. Этот подход одновременно с Т-клеточными сигналами, передаваемыми через CD40-рецептор, может оказаться оптимальным для индукции созревания ДК.
Кроме созревания необходимо исследовать пути миграции активированных ДК из места их введения в качестве вакцинного препарата. Например, важной характеристикой эффективности дендритноклеточной вакцины может оказаться экспрессия CCR7-рецептора на созревающих ДК и их способность отвечать на взаимодействие с соответствующими лигандами (CCL19 и CCL21). В результате рецепторный аппарат, обеспечивающий миграцию клеток, меняется на новый спектр мембранных молекул, способных реализовать их проникновение в лимфатические узлы [12].
По данным одного из авторов этой статьи (Т. Л. Нехаевой), созревание ДК характеризуется высокой экспрессией маркера дифференцировки CD83 и утратой CD1a антигена, а также статистически достоверным усилением выработки костимулирующих молекул CD80 [13]. Высокий уровень синтеза молекул хемокинового рецептора CCR7, обеспечивающего миграцию созревающих ДК в лимфатические узлы, и белков, участвующих в презентации антигена HLA-DR на седьмой и девятый дни культивирования, говорит о зрелости ДК и оптимальной функциональной активности. Этому свидетельствует повышение продукции ко-стимулирующих молекул CD80, CD86, молекул адгезии CD209, а также антигена CD83, характерного для терминальной степени созревания ДК (рис. 2).
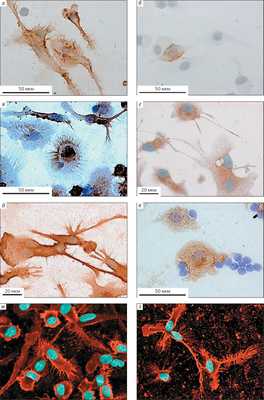

Рис. 2. Микрофотографии зрелых вакцинных дендритных клеток, нагруженных высокоиммуногенными опухолевыми антигенами, сделанные с помощью светового микроскопа Carl Zeiss (а-е) и клеточного анализатора Yokogawa (ж, з; увел. ×400). Иммунофенотипы: а — CD1a, б, ж — CD11c, в — HLA-DR, г — CD80, д — CD83, е, з — CD86
Недавно установлено, что качество иммунного ответа также зависит от способа введения дендритноклеточной вакцины [14]. Хотя нагруженные антигеном ДК могут активировать Т-лимфоциты непосредственно в местах их введения, необходимо принимать во внимание, что при внутрикожном и внутрилимфатическом введении происходит индукция Т-хелперов 1-го типа, при внутривенном — Т-хелперов 2-го типа. Эти активированные эффекторные клетки — продуценты антител — мигрируют из места введения вакцины в рядом расположенные скопления лимфоидной ткани, лимфатические узлы, и запускают тканеспецифический иммунитет. Внутривенное введение дендритноклеточной вакцины, например, при меланоме кожи, исключает индукцию и миграцию эффекторных клеток кожи, тем самым обедняя противоопухолевый иммунный ответ. Кроме того, при внутривенном введении ДК оседают в легочной ткани, печени, селезенке и не определяются в опухоли и лимфатических узлах.
В прошлом году вышла статья наших немецких коллег, которые добились обнадеживающих результатов вакцинации зрелыми ДК больных меланомой IV стадии (с метастазами в другие органы): 19% неоперабельных пациентов продолжают жить уже 11 лет [15]. Тем не менее вакцинотерапия этими клетками может оказаться неэффективной из-за узкой специфичности иммунизирующих эпитопов (части антигена, которые распознают антитела, В- и Т-клетки). Лучше контролировать заболевание и предотвращать уклонение опухоли от иммунобиологического надзора могут помочь вакцины со сложными комплексами опухолевых антигенов. И такие работы уже ведутся разными способами и с разными антигенными нагрузками. Для этого используют рекомбинантные белки, экзосомы и вирусные векторы, плазмидные ДНК и трансфецированные РНК, иммунные комплексы и антитела к поверхностным молекулам ДК. Разрабатывается совместная презентация иммуногенных пептидов с молекулами HLA I и II класса, полученными в процессе фагоцитоза. Используются аллогенные клеточные линии меланомы кожи человека или рака предстательной железы для создания ДК, которые после фагоцитоза приобрели способность активировать иммунологически «наивные» CD8 + цитотоксические Т-лимфоциты. Получают гибридные ДК-опухолевые клетки и гибридные ДК-фибробласты, трансфецированные ДНК опухолевых клеток. Активно развивается направление, в котором «высокопрофессиональные» костномозговые ДК фагоцитируют нежизнеспособные опухолевые клетки или их лизат и активируют иммунологически «наивные» Т-клетки и Т-клетки памяти с большим опухолеассоциированным репертуаром Т-клеточных рецепторов.
Одновременно установлено, что выбор типа ДК для клинического применения зависит от типа антигена. Незрелые ДК, которые активно используют эндоцитоз и эффективно захватывают экзосомы, могут быть наиболее подходящими для доставки иммуногенного белка или антигенных комплексов. Зрелые ДК с высокой экспрессией HLA-молекул больше подходят для использования пептидов. Короткие пептиды (от 8 до 10 аминокислотных остатков) могут напрямую связываться с HLA-молекулами на поверхности ДК и не нуждаются в захвате антигена и его расщеплении.
Хотя во взаимоотношениях иммунной системы организма с опухолями все еще много неясного, очевидно, что весьма значимые достижения фундаментальной онкоиммунологии способствуют прогрессу клинической онкологии [22, 23]. В последние годы противоопухолевые вакцины на основе дендритных клеток — природных усилителей иммунного ответа (естественных адъювантов) — привлекают внимание компаний, занимающихся исследованиями и разработками лекарственных препаратов для лечения рака. В отчете Global Dendritic Cell Cancer Vaccine Market Dosage Price & Clinical Trials Outlook 2024 указывается, что в настоящее время в онкологических центрах мира создано более 60 дендритноклеточных вакцин против рака, большинство из которых проходят доклинические или клинические испытания [17].
* Подробнее см.: Недоспасов С. А. Лауреаты Нобелевской премии 2011 года. По физиологии или медицине — Ж. Хоффманн, Б. Бойтлер, Р. Штайнман // Природа. 2012. № 1. С. 114-117. — Примеч. ред.
Клеточные технологии в иммунотерапии злокачественных новообразований: дендритные клетки

Изучение механизмов иммунного ускользания опухоли показало, что рост, метастазирование и прогноз злокачественного новообразования зависят от функционирования иммунной системы пациента [1]. В настоящее время ведутся интенсивные работы по разработке и внедрению методов лечения, которые основаны на активации компонентов клеточного и гуморального противоопухолевого иммунитета. Одним из наиболее изученных и клинически эффективных методов является вакцинация с помощью дендритных клеток.
Дендритные клетки (ДК) — компонент клеточного звена врожденного иммунитета, выполняют антигенпрезентирующую и регуляторную функцию [2].
В организме человека ДК представлены гетерогенной популяцией, не имеющей одного общего антигенного маркера. Выделяют два основных типа ДК, которые в отечественной литературе называются миелоидными ДК (мДК) и плазмоцитоидными ДК (пДК), в зависимости от клетки-предшественницы (Рис. 1) [3].

Рисунок 1 | Образование и дифференцировка подтипов ДК (подробности в тексте) [3].
MDP — общий предшественник клеток миелопоэза; LMPP — общий предшественник лимфопоэза; pDC — пДК; conventional dendritic cells — мДК; monocyte derived cells — ДК, дифференцирующиеся из моноцитов.
Большинство ДК образуются из клетки-предшественника миелопоэза и представляют собой мДК, поэтому в зарубежной литературе для них введено понятие «конвенциональные ДК» (conventional DC). Часть ДК образуются из клетки-предшественницы лимфопоэза — это пДК [3]. Кроме того, было показано, что моноциты при определенных условиях могут трансформироваться в дендритные клетки [4], а также неопределенной остается классификационное положение резидуальных тканевых моноцитов (например, клеток Лангханса) [2].
После завершения дифференцировки ДК покидают костный мозг и с током крови достигают периферических органов и лимфатических узлов [3]. По некоторым данным, период полужизни ДК составляет от 5 до 7 дней в селезенке, лимфатических узлах, печени и почках, но может достигать и 25 дней (например, в легких) [5,6].
В отсутствие специфических медиаторов воспаления, фрагментов микробных клеток или других активаторов, дендритные клетки находятся в «спящем» состоянии (толерогенная форма), что выражается в продукции ими иммуносупрессорных молекул и индукции Treg лимфоцитов. В случае попадания в межклеточную среду активаторов ДК превращаются в зрелую форму и модулируют компоненты врожденного и адаптивного иммунитета, а также выполняют антигенпрезентирующую функцию (Рис. 2). При этом ДК мигрируют с периферии в регионарные лимфатические узлы [7].

Рисунок 2 | Две основных формы существования дендритных клеток: «спящая»/толерогенная и активная/зрелая форма (пояснения в тексте).
Зрелые ДК могут иметь разнообразный набор антигенов, но важнейшим является наличие молекул главного комплекса гистосовместимости II класса (MHC-II), с помощью которых ДК могут активировать CD8+ и CD4+ лимфоциты, запуская адаптивный иммунный ответ. Для модуляции работы клеток иммунной системы на поверхности ДК имеются различные рецепторы и костимуляторы, представленные на рисунке 3.
Рисунок 3 | Основные рецепторы зрелой ДК.
CD86, CD80 — костимуляторы передачи сигнала Т-лимфоцитам;
CD40 — стимулирует продукцию ИЛ-12 и ИФН-γ Т-хелперами;
А — молекулы межклеточной адгезии;
TLR — toll-like рецепторы, необходимы для захвата антигенов;
К — рецепторы к компонентам комплемента;
Кроме стандартного для антигенпрезентирующих клеток (АПК) представления антигена через MHC-II, ДК способны встраивать захваченный антиген в MHC-I, напрямую активируя CD8+ лимфоциты [7].
Рисунок 4 | Взаимодействие ДК с Т-лимфоцитами. Комплексы антиген+MHC-I и MHC-II распознаются рецепторами Т-лимфоцитов (TCR), при этом ДК выделяет медиаторы, способствующие дифференцировки CD4+ клеток либо в Th1, либо в Th2.
ДК участвуют во всех типах специфических иммунных реакций, в том числе и в противоопухолевом иммунитете [8]. Способность активировать клеточное звено иммунитета и высокая эффективность передачи антигена позволяет выделить ДК среди других АПК в качестве потенциальной мишени для противоопухолевой терапии.
Терапия с использованием ДК получила название «вакцинация дендритными клетками». Суть метода заключается в создании искусственного активного специфического иммунитета в отношении опухоли, однако для большей эффективности вводятся не сами антигены злокачественных клеток, а индуцированные ДК [9]. При этом ДК не просто выполняют роль АПК, а еще и выделяют ряд цитокинов (ИЛ-12, ИЛ-6, ИФН-γ, ФНО-α), которые потенцируют пролиферацию и созревание иммунокомпетентных клеток [8, 9]. Протокол иммунотерапии ДК включает следующие этапы: забор ДК или их предшественников у пациента; индукцию их превращения в незрелые ДК; стимуляцию «созревания ДК»; введение клеток в организм пациента (Рис. 5) [9, 10]
Рисунок 5 | Этапы иммунотерапии с использованием ДК (подробности в тексте) [9].
Небольшое количество ДК можно получить непосредственным выделением из периферической крови пациента, однако их количество и фенотип могут быть неподходящими для эффективной иммунотерапии [11, 12]. Кроме того, ДК могут быть получены из клеток-предшественников, экспрессирующих CD34+, которые изолируют из костного мозга, периферической или пуповинной крови [13, 14]. Однако стандартным и наиболее эффективным методом является получение ДК из моноцитов периферической крови пациента, в связи с простотой метода и большим количеством получаемых клеток [9, 10]. Ряд исследований показал высокую эффективность ДК, полученных из моноцитов при иммунотерапии злокачественных опухолей 16.
Для превращения моноцитов в незрелые дендритные клетки их инкубируют со смесью цитокинов, которая содержит гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) и один из цитокинов, ИЛ-4, ФНО-α или ИФН-α. ГМ-КСФ поддерживает пролиферацию и жизнеспособность клеток миелоидного ростка, а дополнительные цитокины способствуют дифференцировке в незрелые ДК. Незрелые ДК «нагружают» опухолевыми антигенами — инкубируют в среде, содержащей опухоль-специфичные пептиды, нуклеиновые кислоты, лизаты опухолевых клеток. В настоящее время вопрос оптимального варианта антигенной «нагрузки» ДК остается открытым. Активно изучается и показал хорошие результаты метод с использованием цельных опухолевых клеток и совместного культивирования ДК и опухоли [18, 19].После этого начинается «созревание» ДК. Этот этап необходим для экспрессии ДК рецепторов, необходимых для выполнения антигенпрезентирующей функции, кроме того, зрелые ДК начинают секретировать регуляторные цитокины. Для индукции созревания обычно используются различные комбинации ФНО-α с цитокинами, такими как ИЛ-1β, ИЛ-6, PGE2, ИЛ-18, интерфероны и лиганды TLR [9].
Зрелые ДК вводят в организм пациента внутрикожно, внутривенно, в лимфатические узлы или напрямую в опухолевый очаг [10].
Внедрение вакцин на основе ДК в клиническую практику началось в середине 90-х годов. Это были вакцины на основе ДК моноцитарного происхождения, культивированных со специфичными антигенами меланомы, такими как MART-1/Melan A и gp100 20. Кроме того, испытывались вакцины против В-клеточной лимфомы, миеломы, острого миелобластного лейкоза, рака предстательной железы и гепатоцеллюлярной карциномы (ГЦК) [20, 23-27]. Результаты исследований показали безопасность и иммуногенность вакцин на основе ДК. В случае ГЦК и меланомы удалось добиться активации CD8+-лимфоцитов не позднее 7 дня от начала терапии. В большинстве исследований принимали участие пациенты на поздних стадиях опухолевого процесса, однако у 10 % удалось добиться стойкой ремиссии заболевания. Кроме моноцитарных ДК, клинические испытания прошли вакцины на основе ДК, полученных из CD34+-клеток, а также плазмоцитоидные ДК. В обоих случаях вакцины обладали клинической эффективностью и были безопасны [28, 29].
В последнее время идет работа в области повышения эффективности доставки ДК в лимфатические узлы с помощью инъекций напрямую в лимфатические сосуды [30], а также в области сочетания вакцин из ДК и других вариантов иммунотерапии, например, блокады иммунологических контрольных «точек» (checkpoint blockade) [31].
Клеточная терапия опухолевых заболеваний. Противоинфекционная активность дендритных клеток
Онкоиммунология является достаточно новым и перспективным направлением в лечении рака. В клинике онкоиммунологии в НМИЦ им. Н.Н. Петрова в рамках этого направления успешно применяется инновационная методика - вакцинотерапия дендритными клетками. Вот уже полтора десятка лет она показывает хорошие результаты лечения при таких видах онкологических заболеваний, как кожная меланома, саркома мягких тканей, рак кишечника, а также рак почки. С 2010 года коллективом специалистов научного отдела онкоиммунологии проведено более 1580-и лечебных циклов для 203-х больных. Результаты впечатляют. Поэтому именно сейчас пришло время для определения путей более широкого использования методики и расширения спектра заболеваний, в борьбе с которыми она может применяться.
Центр развивает онкоиммунологию с 1998 года
Онкоиммунология преодолевает трудности лечения рака
Многие опухоли сложны в лечении именно потому, что они способны маскироваться от иммунных клеток, а порой и инактивировать их. Поэтому стандартные методы лечения рака, применяемые в клиниках: хирургия, химиотерапия, лучевая терапия, гормональная терапия - остаются без поддержки со стороны иммунной системы пациента. Однако в лаборатории онкоиммунологии был найден способ «перезапустить» иммунитет пациента, предварительно настроив его на конкретную опухоль. Для этого используются дендритные клетки из костного мозга (они всегда присутствуют в крови наряду с лейкоцитами, лимфоцитами и прочими клетками), задача которых предъявить основным защитным клеткам организма - Т-лимфоцитам - белковые молекулы, характерные для опухоли (антигены).
Создание вакцины из дендритных клеток
Процесс проходит в специальном сосуде, куда помещается подготовленная кровь, ранее взятая у пациента, а также «обломки» опухоли, выделенной из его же организма, либо антигены похожей опухоли, имеющиеся в банке НМИЦ. Дендритные клетки оседают на стенках сосуда и начинают активно поглощать (фагоцитировать) опухолевые частицы, формируя на своей поверхности специфический «обучающий сигнал». С последующим введением содержащей такие дендритные клетки суспензии в организм, Т-лимфоциты получают возможность «узнать» опухоль и начать атаковать её.
Детям - бесплатное лечение
Отзывы пациентов
Лечение индивидуальной противоопухолевой вакциной на основе дендритных клеток пациента в клинике онкоиммунологии в Санкт-Петербурге может быть назначено пациентам, соответствующим определенным критериям включения и исключения, как взрослым, так и детям.
Хотим предупредить Вас, что, к сожалению, вакцинотерапия это не панацея. Она применяется при сОлидных опухолях (опухолях органов), в комплексе с другими методами лечения. Эффективность вакцин - стойкая ремиссия, зафиксирована у 46% пациентов, которые получали этот вид терапии.
Для того, чтобы определить возможность прохождения вакцинотерапии необходимо:
- Записаться на первичный бесплатный прием онколога НИИ онкологии им. Н.Н. Петрова.
- Врач соберет анамнез, уточнит, какие обследования необходимо сделать. Даст направление на иммунологическое и иные исследования, с результатами которых нужно записаться на прием онкоиммунолога НИИ.

В зависимости от заболевания врач первичного приема может отменить то или иное исследование из п. 1-3 стандартного списка, а также уточнить параметры исследования 4. Стандартный список см. ниже.
Обследования, результаты которых необходимо иметь на руках во время первичного приема онкоиммунолога (должны быть выполнены в течение последних 30 дней):
- МРТ головного мозга, брюшной полости и малого таза с контрастированием.
- КТ органов грудной клетки с контрастированием.
- Остеосцинтиграфия.
- Биохимический анализ крови: АлТ, АсТ, ГГТ, билирубин общий, общий кальций, мочевина, мочевая кислота, креатинин, общий белок, глюкоза, железо, СРБ, ЛДГ.
Срок выполнения: 1-2 рабочих дня. - Расширенный иммунный статус 9 параметров.
Срок выполнения: 5-14 рабочих дней. Материал: кровь. - Клинический анализ крови развернутый (с подсчетом лейкоцитарной формулы, подсчетом тромбоцитов, описанием морфологии клеток).
Срок выполнения: 1-2 рабочих дня. - Во время приема онкоиммунолог, как правило, назначает пациенту молекулярно-генетическое исследование. Его стоимость варьируется в зависимости от диагноза и показателей, которые надо проанализировать.
Срок выполнения от 14 до 30 рабочих дней. Материал: блоки, стекла (предварительно пересмотренные в лаборатории НМИЦ онкологии им. Н.Н. Петрова).
МРТ и КТ выполняются с промежутком 1 день.
Обследования после остеосцинтиграфии проводятся через 3 дня (начиная с дня, следующего за днем проведения этого обследования).
Рекомендуем Вам выполнить исследования 4 и 6 в лаборатории НМИЦ онкологии.
Внимание!! Мы ждем Вас на консультации в клинике онкоиммунологии со всеми имеющимися медицинскими документами и их ксерокопиями: эпикризами, результатами обследований и анализов за прошедшие периоды (чтобы врач мог проанализировать динамику) и пр. Обязательно возьмите с собой свою гистологию: блоки и стекла.
Дендритные клетки: профессиональные разведчики в «Опухолевой войне»
Обзор
коллаж автора статьи
Автор
Редакторы
Статья на конкурс «био/мол/текст»: «Рак» — как много тревожных мыслей вызывает это слово! Около 7 миллионов человек в год умирают от рака. Трудно переоценить опасность подобных заболеваний, именно поэтому ученые заняты поисками действенного метода лечения различных типов злокачественных опухолей. Существуют некоторые виды терапии онкологических заболеваний, но достаточно ли они эффективны?
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Что не так с этими опухолевыми клетками?
В человеческом организме происходит постоянное обновление клеточной структуры, старые клетки умирают, новые рождаются. Но наряду со здоровыми клетками, в результате мутаций (то есть изменений набора наследственной информации под действием внешних или внутренних сил) образуются нетипичные клетки. Такие «эксцентрики» чаще всего не могут правильно выполнять свои функции, и при неблагоприятном сценарии их появление приводит к образованию злокачественной опухоли.
В норме такие атипичные клетки уничтожает иммунная система, которая является своеобразной армией, противостоящей врагам организма. Но особенность злокачественных клеток в их способности «ускользать» от иммунного контроля. Делают это они очень изощренно и крайне эффективно, так, что иммунные молекулы-разведчики часто не могут обнаружить их (рис. 1), а клетки-киллеры деактивируются из-за экспрессии опухолевыми клетками блокирующих факторов.
Рисунок 1. Умелая маскировка опухолевых клеток.
Дополнительным фоном для развития опухолевых клеток является ослабление иммунитета в результате болезней, стрессов, неправильного образа жизни. В результате опухолевые клетки становятся «особенными» в организме, они игнорируют «антиростовые» стимулы, сигналы запуска клеточной гибели и т.п. Особенности опухолевых клеток можно соотнести с поведением психопата-эгоиста, эти клетки мало того, что не выполняют надлежащих им функций, так еще и бесконтрольно делятся и распространяются по всему организму, в сумасшедших количествах потребляют питательные вещества, которые потом тратят на создание таких же «психопатов» (рис. 2) [1]. Следовательно, нарушается метаболизм и функционирование тканей организма, что чаще всего приводит к плачевным последствиям.
Рисунок 2. Что умеют раковые клетки.
Почему же так трудно лечить рак?
Заранее стоит заметить, что под понятием «рак» скрывается целая совокупность огромного количества типов злокачественных опухолей. Некоторые из них настолько сильно различаются, что найти что-то общее у них крайне трудно. Более того, не все типы опухолевых заболеваний корректно называть раковыми: рак — лишь частный случай онкологии, изучающей как злокачественные, так и доброкачественные опухоли. Именно поэтому, скорее всего, мы не увидим на полках аптек универсального лекарства от рака. Вследствие такого разнообразия онкологических заболеваний каждый пациент нуждается в персональном подходе к лечению. Но даже это персональное лечение в нынешней практике часто не эффективно. Самыми распространенными методами являются химиотерапия, хирургический метод (когда это возможно) и лучевая терапия. Но, к сожалению, эти методы тоже не всегда результативны и зачастую несут с собой колоссальные побочные эффекты, иногда не совместимые с жизнью.
В настоящий момент множество групп ученых работает над повышением эффективности традиционных методов лечения опухолевых заболеваний. Все же существенно повысить выживаемость онкобольных, применяя только стандартную терапию, становится уже практически нереальным, особенно на последних стадиях, а своевременная диагностика зачастую невозможна из-за позднего обращения пациентов за помощью. Так или иначе, рано вешать нос.
Иммунотерапия
Достижения в иммунологии за последние несколько десятков лет привели к созданию совершенно новых подходов к лечению онкологических заболеваний. Результаты исследований уже дали право на существование многим иммунологическим методам [2]. Ведь хорошая же идея — заставить сам организм бороться с опухолью! Иммунотерапия заключается в воздействии на иммунную систему для повышения эффективности ее противостояния раковым клеткам [3]. Для этого в кровь пациента вводят вещества, в той или иной степени представляющие собой опухолевые антигены (молекулы, которые организм рассматривает как чужеродные и опасные и запускает против них иммунный ответ), способствующие размножению специальных иммунных клеток-убийц, которые будут препятствовать развитию опухоли и разрушать ее.
Важным преимуществом иммунотерапии является то, что, в силу своей специфической направленности, она почти не повреждает здоровые ткани. Данный метод более эффективен для лечения последних стадий онкологических заболеваний по сравнению с традиционными подходами. Кроме того, иммунотерапию можно использовать для снижения побочных эффектов лучевой терапии и химиотерапии.
Однако все не так радужно, как могло показаться. Иммунотерапия была крайне неэффективна при лечении некоторых типов опухолевых заболеваний, например предстательной железы [4]. Проблема, опять же, заключалась в недостаточной направленности препаратов.
Но я, мечту свою лелея, решил проблему гениально.
Благодаря интенсивным исследованиям в области иммунологии открыто множество факторов, влияющих на осуществление иммунного ответа [5]. Стало ясно, что одну из ключевых ролей в спектакле «Иммунный ответ» играют особые отростчатые клетки — дендритные (ДК). Открыл их в 1868 году немецкий ученый Пауль Лангерганс, который ошибочно принял эти клетки за нервные окончания с подобными отростками. ДК вновь описал в 1973 году Ральф Стайнман, он же установил их принадлежность к иммунной системе [6]. Лишь через 38 лет он был посмертно удостоен Нобелевской премии за проделанную работу.
В последние десятилетия развивалась тенденция по внедрению дендритных клеток в качестве вспомогательных средств для лечения различных типов рака. По мнению ученых, их систематическое применение в иммунотерапии позволит добиться от нее максимального эффекта.
Дендритные клетки — популяция особых клеток, функция которых заключается в презентации «вражеских» антигенов другим клеткам иммунной системы. Таким способом они активируют адаптивный иммунитет [6]. По научному, такие клетки-посредники называются антигенпрезентирующими (АПК). Свое название ДК получили благодаря разветвленным отросткам мембраны, напоминающим дендриты нервных клеток, которые вырастают у них на определенных этапах развития. ДК располагаются, в основном, в крови и тканях, которые соприкасаются с внешней средой. Эти клетки обладают специальными механизмами распознания «врагов». В периферических тканях ДК захватывают антигены через несколько дополнительных механизмов [7]. Проще говоря, они способны к поглощению инородцев, то есть фагоцитозу и пиноцитозу антигенов, выпячивая клеточную мембрану и захватывая вражескую частицу.
После «трапезы» с током крови или по лимфатическим сосудам они перемещаются в лимфатические узлы [8]. Между тем, в ДК происходит преобразование (процессинг) белковых антигенов и расщепление их на кусочки-пептиды, которые в конечном итоге связываются с молекулами главного комплекса гистосовместимости (major histocompatibility complex, MHC), расположенными на поверхности ДК [9]. После этого ДК достигает полной зрелости и при помощи молекул MHC презентует вражеский антиген другим клеткам иммунной системы.
В качестве этих «других клеток» выступают «армейские новобранцы», еще не обученные Т-клетки, ранее не сталкивавшиеся с противником-антигеном. После столкновения Т-клетки начинают активно делиться и дифференцироваться в войска спецназа, или антиген-специфические эффекторные Т-клетки. Особые подразделения спецназа — CD4+ T-клетки — становятся незаменимыми помощниками или T-хелперами (рис. 3). Они стимулируют солдат химических войск — В-лимфоцитов, которые производят антитела. Это специальные белковые молекулы, которые, как противоядия, идут на борьбу с конкретными чужеродными частицами [10]. Такая химическая защита или иммунный ответ с участием антител относится к гуморальному иммунитету.
Рисунок 3. Иммунная армия.
Кроме того, необученные T-клетки и Т-хелперы посредством выделения активирующего вещества интерлейкина-2 (IL-2), привлекают на помощь снайперов Т-киллеров, которые в дальнейшем уничтожают зараженные клетки, ведя обстрел ядовитыми цитотоксинами. Таким образом работает клеточный иммунитет.
Некоторая часть «обученных» Т-клеток становится клетками памяти, они живут в организме годами. Всякий раз, когда они встречают старого знакомого врага, то очень быстро запускают иммунный ответ.
Дендритные клетки в иммунотерапии
Поскольку опухолевые клетки великолепно владеют искусством маскировки, иммунной системе очень сложно распознать антигены на их поверхности. Встает вопрос о том, как можно создать действительно мощный иммунный ответ, направленный на их уничтожение.
На мышиных моделях показано, что ДК могут захватывать антигены, которые высвобождаются из опухолевых клеток, и представлять их Т-клеткам в лимфоузлах. Это приводит к активации опухолеспецифических Т-клеток и последующему отторжению опухоли [12], [13]. По сравнению с другими АПК, такими как макрофаги, дендритные клетки чрезвычайно эффективны при представлении антигена, тем самым объясняя свое прозвище «профессиональных АПК». Это говорит о том, что ДК можно использовать для терапевтических вмешательств при онкопатологии.
В настоящее время развивают две темы исследований: как опухолевые клетки изменяют физиологию ДК, и как мы можем опираться на мощные свойства ДК при создании новых методов иммунотерапии рака.
Опухолевые клетки так просто не сдаются!
Дендритные клетки обнаруживают в большинстве опухолей. ДК отбирают образцы опухолевых антигенов путем захвата умирающих клеток или буквальным откусыванием частей живых [14]. В свою очередь опухоли могут препятствовать представлению и созданию иммунных реакций с помощью различных механизмов. В пример можно привести такие антигены опухолей, как раково-эмбриональный антиген (РЭА) и муцин-1, которые, попав в ДК, могут быть ограничены ранними эндосомами, то есть плазматической мембраной, что предотвращает эффективную обработку и презентацию антигена Т-клеткам [15].
Также опухоли могут мешать созреванию ДК. Во-первых, они могут блокировать, то есть ингибировать, созревание ДК путем выделения особого белка IL-10, который приводит к полному отсутствию реакции (антиген-специфической анергии) [16], [17]. Во-вторых, факторы, выделяемые опухолью, могут изменять созревание ДК, вызывая образование клеток-предателей, которые косвенно способствуют росту этой опухоли («проопухолевые» дендритные клетки) [18]. Поэтому понимание функций ДК в онкологических процессах представляет собой обширную область для исследований. В конечном счете, «перевоспитание» проопухолевых ДК в противоопухолевые может вести к зарождению нового подхода в иммунотерапии.
Вакцина на основе дендритных клеток
ДК могут быть получены из кровяных клеток-предков (моноцитов) пациента, которые загружают антигенами ex vivo, то есть знакомят с врагом вне организма в стерильных лабораторных условиях. Затем эти моноциты надлежащим образом созревают и вводятся обратно пациенту при вакцинации. Теоретически это должно давать целый набор дендритных клеток, запускающих иммунные войны.
В последнее десятилетие значительные экспериментальные и клинические ресурсы были отданы на разработку противораковых вакцин на основе ДК [19], [20]. Это привело к созданию многочисленных типов вакцин, которые различаются протоколами загрузки ДК антигенами или биохимическим манипулированием клетками. Например, один из типов вакцин подразумевает введение антигенов опухоли и их прямую доставку в ДК непосредственно в организме пациента.
Еще одна стратегия вакцинации, которая совсем недавно начала привлекать внимание, связана с естественными подмножествами дендритных клеток, которые могут быть выделены с помощью высокоэффективных магнитных гранул, покрытых антителами [21], [22]. Накопленные клинические данные говорят о том, что такие вакцины достигают многообещающей эффективности у пациентов с меланомой — долгосрочной выживаемости без прогрессирования (1-3 года) у 28% пациентов [22]. Те или иные разновидности вакцин применяют в зависимости от типа опухолевого заболевания и его стадии.
В целом эффективность вакцинации на основе ДК зависит от множества различных факторов, включая характер и источники антигенов, иммунологический статус пациента, тип вовлеченных рецепторов на ДК и подмножества специфических ДК, на которые осуществляется воздействие 24.
Важно отметить факт, что на май 2017 года только одна клеточная терапия с участием ДК лицензирована для лечения людей, а именно Sipulteucel-T (Provenge, США). C 2010 года Sipulteucel-T одобрен для лечения бессимптомного и минимально-симптоматического метастатического рака, а также рака предстательной железы 31.
Безопасность — наше все!
Безопасность противоопухолевых вакцин на основе ДК подтверждена и хорошо документирована во многих клинических исследованиях [32]. Местные реакции в виде зуда, сыпи или боли обычно мягкие и самоограничивающиеся. Они характерны и для других лечебных процедур. Случаются и системные побочные эффекты, связанные с заболеванием гриппом или другими инфекциями вследствие переброса защитных сил на опухолевый фронт.
Одной из особых проблем иммунотерапии является возможность развития аутоиммунитета. Это состояние, при котором иммунная система принимает собственные здоровые клетки организма за чужеродные и атакует их [33]. Однако стратегии противоопухолевой вакцинации дендритными клетками редко ассоциируются с тяжелой иммунной токсичностью. Ожидается, что иммунотерапия на основе ДК сохранит качество жизни пациентов с онкозаболеваниями на более высоком уровне.
Качество жизни является важным показателем при оценке новых противоопухолевых средств. Например, в работе Николая Леонарцбергера у всех 55 пациентов с таким типом рака, как карцинома почек, при иммунотерапии на основе ДК не было выявлено отрицательного влияния на качество жизни. Это выгодно отличается от других существующих методов лечения, вызывающих существенное токсическое действие [34].
Вместе с тем, отчетов о результатах изменения качества жизни пациентов после дендритной клеточной иммунотерапии недостаточно, что требует дальнейших исследований.
Перспективы
Разработка вакцин на основе дендритных клеток — весьма «горячая тема». Большинство исследователей используют ДК, подверженные воздействию опухолевой РНК, лизатов и антигенов опухолевых клеток. При этом многие научные работы проверяют введение вакцин на основе ДК в сочетании со стандартной химиотерапией или лучевой терапией [35]. В некоторых испытаниях тестируют комбинации вакцин и противовоспалительных препаратов.
Это позволяет надеяться на скорейшее внедрение новых эффективных методик иммунотерапии онкозаболеваний, которые позволят успешно бороться с различными типами рака.
Заключение
Ученые все чаще приходят к выводу о том, что иммунотерапия на основе дендритных клеток является достойным, безопасным и хорошо переносимым иммунотерапевтическим методом, который может вызывать иммунные реакции даже у пациентов с раком последней стадии. В последнее время разработано множество стратегий использования противоопухолевой активности ДК. Существует реальная необходимость в клинических исследованиях, демонстрирующих, что вакцины на основе дендритных клеток могут вызывать долговременные объективные ответы и улучшать долгосрочную выживаемость пациентов.
Общее развитие вакцин с ДК постоянно сталкивается со множеством препятствий. Помимо проблем с эффективностью вакцин, разработка терапии для клинического применения является финансово затратной, требует хорошо оснащенных современных лабораторий и наличия высококвалифицированных научных кадров, что позволило бы проводить многоцентровые клинические испытания последних фаз с участием большого количества пациентов.
В заключение хочется сказать, что иммунотерапия весьма перспективна и требует дальнейшего раскрытия своего потенциала. Речь идет не только о вакцинах на основе ДК, но и о многочисленных специфичных антителах и т.п. Онкология не обойдется без комбинирования различных методов терапии, традиционных и инновационных. С другой стороны, встает вопрос о доступности этих инновационных методик конкретно на местах лечения онкобольных.
В России сегодня иммунотерапия слабо развита, она не преобладает над стратегиями лучевой терапии и химиотерапии. В то же время в США и Израиле иммунотерапия развивается быстрее и уже активно используется в онкоцентрах как в качестве профилактических вакцин, так и для продления жизни тяжелобольных пациентов [37]. Иммунотерапия на основе дендритных клеток только начинает свою историю, в которую еще предстоит вписать лучшие страницы.
Дендритно-клеточная иммунотерапия в сочетании с фотодинамической терапией и циклофосфамидом у больных диссеминированной меланомой кожи, резистентных к стандартным методам лечения
- КЛЮЧЕВЫЕ СЛОВА: меланома, ипилимумаб, тремелимумаб
Таблица 2. Клиническая эффективность иммунотерапии ДК-ФДТ у больных диссеминированной меланомой с исчерпанными возможностями лекарственного лечения, абс. (%)
Рис. 1. Кривые выживаемости без прогрессирования опухолевого процесса у больных диссеминированной меланомой, получавших иммунотеарпию ДК-ФДТ
Рис. 2. Кривая общей выживаемости больных диссеминированной меланомой, получавших иммунотерапию ДК-ФДТ
Рис. 3. Выявление маркеров апоптоза в клетках опухолевого очага после сеанса ФДТ у больной К. 54 лет (А - иммуногистохимическое выявление каспазы-3, Б - CD95, 400-кратное увеличение)
Рис. 4. Инфильтрация лимфоцитами опухолевого очага больной К. 54 лет после двух циклов иммунотерапии ДК-ФДТ (А - окрашивание гематоксилин-эозином, Б - иммуногистохимическое окрашивание на общий лейкоцитарный антиген (200-кратное увеличение), В - выявление
Таблица 3. Анализ субпопуляций лимфоцитов периферической крови больных диссеминированной меланомой в процессе иммунотерапии ДК-ФДТ
Рис. 5. Динамика количественного содержания ЦТЛ в периферической крови больных диссеминированной меланомой с различным клиническим эффектом и регуляторного индекса, выражающегося в отношении количества CD4+- и CD8+-лимфоцитов (различия достоверны, 0,0001
Рис. 6. Динамика абсолютного содержания цитотоксических Т-лимфоцитов и активированных цитотоксических Т-лимфоцитов (HLA-DR+) в периферической крови больных диссеминированной меланомой с различным клиническим эффектом в процессе иммунотерапии ДК-ФДТ
Рис. 7. Динамика абсолютного содержания Т-хелперов и активированных Т-хелперов (HLA-DR+) в периферической крови больных диссеминированной меланомой с различным клиническим эффектом в процессе иммунотерапии ДК-ФДТ
Фотодинамическая терапия (ФДТ) уже давно используется для лечения неопластических поражений, при этом остается объектом исследований в целях повышения эффективности и расширения возможностей применения 1. В отличие от радиотерапии и химиотерапии действие ФДТ на опухолевую клетку выражается в цитотоксических внеядерных повреждениях белковых компонентов опухолевых клеток, индуцированных фотоокислительными реакциями, запуске каскадных реакций, приводящих к ускоренной гибели клеток и увеличению числа апоптотических и некротических клеток, выходу в микроокружение мембраносвязанных и растворимых факторов, молекулярных паттернов, таких как DAMPs, привлекающих и активирующих клетки иммунной системы [4]. Кроме того, в предклинических исследованиях применение ФДТ способствовало не только образованию апоптотических и некротических опухолевых клеток, но и модификации микроoкружения злокачественного новообразования за счет высвобождения провоспалительных цитокинов, таких как фактор некроза опухоли альфа, интерлейкины (ИЛ) 1 и 6 [5]. В этом контексте введение в опухолевый очаг, подвергшийся фотодинамическому воздействию, ДК, представляющих собой «высокопрофессиональные» антигенпрезентирующие клетки, способствует модуляции противоопухолевого иммунного ответа, изменяя соотношение сил в системе «опухоль - организм хозяина» в пользу последнего. Так реализуется фактор успешной противоопухолевой иммунотерапии, который зависит от способа введения дендритно-клеточной вакцины (ДКВ) и определяет качественные характеристики иммунного ответа 7.
Исследования М. Korbelik и соавт. (2006, 2007 гг.) [3, 11] продемонстрировали эффективность вакцинации культурой клеток плоскоклеточного рака SCCVII, подвергнутой фотодинамическому воздействию с целью индукции апоптоза, у мышей C3Н/НеN. Такая иммунотерапия вакциной, содержащей 40-50% апоптотических и 10% некротических опухолевых клеток, способствовала активации цитотоксических Т-лимфоцитов и регрессу опухоли. Кроме того, повторная имплантация живых цельных опухолевых клеток иммунизированным таким образом животным не была успешной. На модели аденокарциномы мыши С-26 инъекция незрелых ДК после фотодинамического воздействия на опухолевый очаг приводила к активации CD8 + -цитотоксических Т-лимфоцитов, NK-клеток. Был достигнут полный регресс у большинства экспериментальных животных.
Таким образом, ДК, полученные из костномозговых предшественников и сенсибилизированные фотомодифицированными опухолевыми клетками в иммуногенной апоптотической и/или некротической форме непосредственно в опухолевом очаге, могут считаться перспективными кандидатами для активной специфической иммунотерапии у пациентов с диссеминированной меланомой кожи, резистентных к стандартному лекарственному лечению.
Материал и методы
В исследовании проанализированы результаты лечения 27 больных (семь (25,9%) мужчин и 20 (74,1%) женщин), получавших лечение в Национальном медицинском исследовательском центре онкологии им. Н.Н. Петрова с 2007 по 2017 г. Средний возраст пациентов составил 48,9 года (от 25 до 74 лет). Обязательным условием участия в исследовании было подписание добровольного информированного согласия. Критерии включения: возраст старше 18 лет, общее удовлетворительное состояние (ECOG 9 и более клеток с жизнеспособностью не менее 98% и иммунофенотипом CD34 - /CD14 - /CD1a + /CD83 - /CD80 -/+ /CD86 -/+ /HLA DR + .
Процесс созревания/дифференцировки вакцинных ДК оценивали по экспрессии ими дифференцировочных антигенов иммуноцитохимически и методом проточной цитометрии.
Технология применения ДК-ФДТ заключалась в следующем. При введении в ФДТ-облученный опухолевый очаг ДК ресуспендировались в 1,0-4,5 мл 0,9%-ного раствора NaCl, содержавшего альбумин человека (конечная концентрация 2%). Разовую дозу ДК (1,0 × 10 6 клеток/кг массы тела больного (7-10 × 10 7 клеток)) вводили по периферии ФДТ-модифицированного опухолевого очага - в общей сложности в девять точек по 0,5 мл. В очаг вводили не менее 1 мл вакцинного препарата на 1 см опухолевого очага.
Остальные ДК помещали в криосреду (90% аутологичной плазмы и 10% диметилсульфоксида) (Sigma, США) и индивидуальные маркированные криопробирки (NuncCryoTube, США). Подготовленные таким образом образцы немедленно подвергали криоконсервации с помощью программного замораживателя Ice-Cube 14S (Австрия) с контролируемой скоростью охлаждения -1 о С/мин в диапазоне от +4 до -4 о С и -5 о С/мин в диапазоне от -40 до -12 о С. После этого образцы помещали в жидкий азот (-196 о С), где хранили до использования.
Иммунотерапия ДКВ осуществлялась в режиме 21-дневных циклов. В нулевой день пациенты получали 300 мг циклофосфамида внутримышечно с целью элиминации Т-лимфоцитов с иммуносупрессирующей активностью. На четвертый день 21-дневного цикла вводили соли хлорина в дозе 1 мг/кг массы тела, облучали опухолевой очаг красным светом с длиной волны 662 нм в дозе 400 Дж через два часа после введения фотосенсибилизатора. Через шесть часов свежие или размороженные ДК вводили в ФДТ-облученный опухолевый очаг. Введение продолжали ежедневно с четвертого по восьмой день 21-дневного цикла иммунотерапии ДК-ФДТ.
Токсичность оценивали по шкале NCI CTC AE v.3, эффективность лечения - по критериям RECIST. Выживаемость без прогрессирования определяли как период времени от первого введения лекарственных средств в первом цикле (начало лечения) до выявления признаков прогрессирования заболевания, общую выживаемость - от начала лечения до смерти больного от любой причины. В отсутствие данных о прогрессировании на момент смерти наблюдение оставалось неполным (цензурированным).
Иммунологические показатели оценивали перед каждым циклом иммунотерапии с использованием современных технологий:
- иммуноцитохимии;
- проточной цитометрии;
- ELISpot-анализа;
- иммуноферментного анализа;
- определения реакции гиперчувствительности замедленного типа через 24 и 48 часов после внутрикожной инъекции пула стандартизированных раково-тестикулярных антигенов собственного производства.
Иммуногистохимические исследования включали:
- оценку эффективности фотодинамического воздействия в опухолевых очагах на основе результатов иммуногистохимического анализа биопсийного материала;
- изучение отдаленных метастатических очагов, не подвергавшихся воздействию ДК-ФДТ-вакцины, доступных для забора гистологического материала, с применением CD95 (маркеры ранних стадий апоптоза), моноклональных антител к каспазе-3, общему лейкоцитарному антигену, рецептору цитотоксических Т-лимфоцитов CD8 (Novocastra, UK).
Статистическую обработку осуществляли с помощью пакета программ SPSS 18. Для анализа использовали описательные статистики, точный критерий Фишера, метод Каплана - Мейера и метод пропорциональных рисков Кокса.
Результаты и обсуждение
Применение иммунотерапии ДК-ФДК способствовало достижению клинического эффекта у 37% больных и объективного ответа у 7,4% пациентов. Клиническая эффективность иммунотерапии ДК-ФДТ отражена в табл. 2.
Как видим, в целом по двум группам больных (пациенты первой группы получали один-два цикла иммунотерапии, пациенты второй - три цикла и более) медиана выживаемости без прогрессирования составила 2,5 месяца (1,7 и 4,0 месяца соответственно; р = 0,001). Медиана общей выживаемости для всех больных и по группам составила 8,4, 4,83 и 10,6 месяца соответственно (р = 0,034) (рис. 1 и 2). На наш взгляд, важно, что именно количество циклов терапии, а не наличие или отсутствие эффекта от лечения и его качество служили независимым благоприятным фактором прогноза общей выживаемости в многофакторном анализе. Каждый следующий цикл терапии снижал относительный риск смерти на 30% в модели пропорциональных рисков Кокса (р = 0,006).
Необходимо отметить, что массивное предшествующее лечение пациентов предполагало наличие у них более резистентных форм заболевания.
Среди нежелательных явлений иммунотерапии ДК-ФДТ чаще регистрировали гриппоподобный синдром 1-2-й степени - 54% случаев. У 4% больных отмечались лейкоцитоз или лихорадка 3-й степени, болезненность в месте введения, которая купировалась слабыми опиатами. Ни в одном случае не зафиксировано нежелательных явлений 4-5-й степени, связанных с терапией и требовавших ее отмены. В большинстве случаев иммунотерапия ДК-ФДТ переносилась удовлетворительно.
Наблюдение за пациентами, получавшими иммунотерапию ДК-ФДТ, продолжалось по завершении курса лечения.
Мониторинг изменений в опухолевых очагах, следующих за фотодинамическим воздействием, показал появление клеток, вступающих в апоптоз, о чем свидетельствовало наличие экспрессии каспазы-3 и CD95, «рецептора смерти» FAS/APO-1 (рис. 3).
На сегодняшний день в доступной литературе отсутствуют сведения об аналогичных клинических исследованиях с использованием незрелых костномозговых ДК. Однако полученные нами данные о клинической эффективности иммунотерапии ДК-ФДТ полностью согласуются с результатами работ, основанных на применении дендритно-клеточных технологий с использованием полиэпитопных антигенов и зрелых ДК.
R. Trepiakas и соавт. (2010 г.) [17] представили результаты клинических исследований I/II фаз, в которых пациенты с диссеминированной меланомой получали иммунотерапию аутологичными зрелыми ДК, нагруженными комплексом опухолевых антигенов (р53, сурвивин и др.). Стабилизация заболевания зафиксирована у 24% пациентов, медиана общей выживаемости составила девять месяцев. При этом у больных со стабилизацией процесса она была существенно выше (18,4 месяца).
Аналогичные результаты были получены A. Ribas и соавт. (2010 г.): у 27% больных с помощью иммунотерапии удалось добиться контроля роста опухоли [18]. В этом исследовании для нагрузки ДК использовали лизат из аллогенных опухолевых клеток трех линий меланомы. В одном (3%) из 33 случаев достигнут полный ответ, в двух (6%) - частичный, в шести (18%) - стабилизация процесса продолжительностью свыше восьми недель.
Наши данные свидетельствуют о схожей эффективности подобных вакцин. У пациентов с диссеминированной меланомой, получавших ДКВ на основе зрелых ДК, нагруженных раково-тестикулярными антигенами, частота объективного ответа составила 4%, клиническая эффективность - 38% при медиане общей выживаемости 11,5 месяца [19].
Из этого ряда выпадает исследование R.O. Dillman и соавт. (2016 г.) [20]. Авторы использовали облученные аутологичные опухолевые клетки для нагрузки ДК у пациентов с метастатической формой меланомы. 24% больных имели четвертую стадию заболевания, при этом медиана общей выживаемости достигла 18,8 месяца. Пятилетняя выживаемость составила 54% при медиане наблюдения 4,5 года.
Во всех приведенных исследованиях зафиксирована высокая безопасность применения аутологичных ДКВ. Среди нежелательных явлений чаще отмечались местное покраснение и зуд. В редких случаях имели место лихорадка и гриппоподобный синдром. Ни в одном случае названные нежелательные явления не потребовали отмены терапии.
В настоящее время наметился существенный прорыв в лечении диссеминированной меланомы благодаря новым лекарственным препаратам - ингибиторам иммунологического синапса. Так, эффективность ингибиторов PD1 при использовании во второй и последующих линиях терапии приближается к 26-32%. Медиана общей выживаемости превышает 24 месяца 23. Однако возможность терапии ингибиторами контрольных точек не делает менее значимой описываемую нами технологию с принципиально иным механизмом действия. Этот механизм выражается в стимулировании образования выраженной лимфоидной инфильтрации с наличием значительного количества CD8 + Т-лимфоцитов в отдаленных, не подвергнутых облучению опухолевых очагах (рис. 4). Именно такая лимфоидная инфильтрация является необходимым условием для достижения эффекта ингибиторов
PD1 [17].
Вероятность отсроченного эффекта вакцинотерапии и его влияние на результат последующего лечения подтверждаются в работе R. Ridolfi и соавт. (2010 г.) [21]. 24 пациента с метастатической меланомой получали ДКВ, активированную лизатом аутологичных опухолевых клеток. 11 больных впоследствии получили химиотерапию. Эффективность подобной комбинации составила 63,6%, при этом у двух пациентов отмечался полный ответ, у пяти - частичный. Медиана общей выживаемости составила 34 месяца (16-61 месяца).
Анализ результатов лабораторного иммунологического обследования показал различную динамику иммунологических показателей у больных с положительным клиническим эффектом (частичный регресс или стабилизация процесса) и прогрессированием заболевания, получивших два и более цикла иммунотерапии. В процессе лечения выявлены отличия в количественном содержании Т-хелперов (CD3 + CD4 + ) и цитотоксических Т-лимфоцитов (ЦТЛ) (CD3 + CD8 + ) у пациентов с клиническим эффектом и прогрессированием заболевания, что выражалось в изменении иммунорегуляторного индекса (ИРИ) (табл. 3, рис. 5). У больных с клиническим эффектом ИРИ на протяжении нескольких циклов вакцинотерапии был достоверно ниже, чем у пациентов с прогрессированием заболевания, что свидетельствовало о преобладании субпопуляции ЦТЛ у больных с положительной клинической динамикой. При этом у пациентов с клиническим эффектом на протяжении трех циклов вакцинотерапии абсолютное содержание активированных ЦТЛ (CD3 + CD8 + HLA-DR + ) было существенно выше, чем у больных с прогрессированием заболевания. Впоследствии этот показатель снизился, что скорее всего было обусловлено вероятной миграцией активированных ЦТЛ в тканевые структуры опухоли (рис. 6).
В нашем исследовании получены убедительные данные о корреляции между изменением абсолютного содержания в периферической крови активированных Т-хелперов, экспрессирующих на своей поверхности антигены HLA-DR (CD3 + CD4 + HLA-DR + ), и эффективностью проводимого лечения. Количество этих клеток увеличивалось у пациентов с клиническим эффектом к завершению иммунотерапии ДК-ФДТ и снижалось у больных c прогрессированием заболевания (рис. 7).
Кроме того, наблюдалось достоверное увеличение абсолютного содержания NKT-клеток (CD3 + CD16 + CD56 + ), в том числе у больных с прогрессированием заболевания до начала лечения. В ходе иммунотерапии ДК-ФДТ их количество снижалось и сохранялось на определенном уровне, причем у больных с клиническим эффектом их содержание было более низким (табл. 3).
З.Г. Кадагидзе и соавт. (2011 г.) [24] указали на неоднородность популяции NKT-клеток: наличие клеток I типа с противоопухолевой активностью и клеток II типа, оказывающих иммуносупрессорное действие. Данные клинических наблюдений позволяют рассматривать увеличение количества этих клеток как неблагоприятный прогностический фактор.
В настоящее время единого мнения о роли NKT-клеток в противоопухолевом иммунитете нет. В связи с этим необходимо дальнейшее изучение субпопуляционных маркеров NKT-лимфоцитов для выявления корреляции с эффективностью проводимого лечения.
Что касается естественных киллерных клеток (CD3 + CD16 + CD56 + ), их абсолютное количество у пациентов с клиническим эффектом достоверно не изменялось в процессе иммунотерапии ДК-ФДТ. У больных с прогрессированием заболевания их число было достоверно выше до начала лечения и в ходе терапии существенно снижалось. Учитывая, что NK-клетки играют важную роль в индукции противоопухолевого иммунного ответа, можно считать тенденцию снижения численности этой популяции клеток у больных с прогрессированием заболевания как неблагоприятную [25].
О влиянии вводимой дозы циклофосфамида в обеих группах пациентов говорит низкая численность субпопуляций регуляторных Т-лимфоцитов, определяемых триадой антигенов CD4 + CD25 bright CD127 low , количество которых не превышало референсных значений. У пациентов с клиническим эффектом наблюдалась более выраженная тенденция к снижению абсолютного содержания этих клеток иммунной системы в периферической крови.
Таким образом, отсутствие нежелательных явлений 3-5-й степени свидетельствует о безопасности применения иммунотерапии ДК-ФДТ у больных с диссеминированной меланомой кожи. Неоднозначной на первый взгляд кажется направленность изменений клинических и иммунологических параметров. Однако в целом можно говорить об усилении опухолеспецифического иммунного ответа и его корреляции с клинической эффективностью.
Прогрессу в терапии пациентов с диссеминированной меланомой будут способствовать дальнейшие исследования молекулярно-генетических особенностей формирования противоопухолевого иммунного ответа у таких больных.
Полученные результаты позволяют сделать следующие выводы.
Во-первых, у больных диссеминированной меланомой активная специфическая иммунотерапия на основе аутологичных незрелых ДК, полученных из костномозговых предшественников, в сочетании с ФДТ и низкими дозами циклофосфамида представляется действенным методом лечения и оказывает клинически значимый противоопухолевый эффект. В нашем исследовании он выражался в виде частичного регресса у 7,4% больных, стабилизации опухолевого процесса у 37% пациентов.
В-третьих, введение циклофосфамида с иммуномодулирующей целью перед каждым 21-дневным циклом иммунотерапии аутологичными незрелыми ДК, полученными из костномозговых предшественников, в дополнение к иммуномодулирующему действию ФДТ способствует повышению эффективности лечебных мероприятий. Клинического эффекта удалось достичь в 37% случаев (95% ДИ 14-61). Медиана общей выживаемости у больных с диссеминированным процессом и исчерпанными возможностями стандартного лечения достигла 8,4 месяца.
Читайте также:
