Комбинированные операции на веке при эндокринной офтальмопатии
Добавил пользователь Alex Обновлено: 01.02.2026
предоставляем актуальную медицинскую информацию от ведущих специалистов, помогая врачам в ежедневной работе
Для цитирования: Аутоиммунная эндокринная офтальмопатия при эутиреоидной болезни Грейвса. Клиническая офтальмология. 2014;15(1):15.
Резюме Описан клинический анализ случая диагностики и лечения эндокринной офтальмопатии с благоприятным исходом. Выставлен диагноз: аутоиммунная эндокринная офтальмопатия при эутиреозе, отечный экзофтальм слева, стадия субкомпенсации. Назначены системная и местная терапия кортикостероидами, цитостатиками, дегидратация.
Описан клинический анализ случая диагностики и лечения эндокринной офтальмопатии с благоприятным исходом. Выставлен диагноз: аутоиммунная эндокринная офтальмопатия при эутиреозе, отечный экзофтальм слева, стадия субкомпенсации. Назначены системная и местная терапия кортикостероидами, цитостатиками, дегидратация.
Данный клинический случай эндокринной офтальмопатии при эутиреоидной болезни Грейвса представляет практический интерес в связи c трудностью выявления основной причины экзофтальма.
Ключевые слова: экзофтальм, эндокринная офтальмопатия, эутиреоз, болезнь Грейвса.
Abstract
Autoimmune Endocrine Ophthalmopathy at Euthyroid Graves’s Disease
Savchenko N.V., Zhirov A.L., Pihovskaya I.G.
Khabarovsk Department of FGBU MNTK Eye Microsurgery
named after acad. Fyodorov S.N.
The clinical analysis of a case of diagnostics and treatment of an endocrine ophthalmopathy with a favorable outcome is described.
The diagnosis: an autoimmune endocrine ophthalmopathy in euthyroidism, edematous exophthalmos of the left eye, stage of subcompensation. Systemic and topical corticosteroids, cytostatics, dehydration treatment were prescribed.
The described clinical case of the endocrine ophthalmopathy in euthyroid Graves’s disease is of practical interest because of the difficulty of identification of the main cause of exophthalmos.
Key words: exophthalmos, endocrine ophthalmopathy, euthyroidism, Graves’s disease.
Актуальность. В структуре эндокринной патологии достаточно важное место занимают заболевания щитовидной железы. По частоте встречаемости они уступают только сахарному диабету. Эндокринная офтальмопатия имеет место у 40-78% больных с гиперфункцией щитовидной железы [2].
Но в последние несколько десятилетий отмечается возможность возникновения поражений глаза и его придатков на фоне эутиреоидного состояния щитовидной железы [1], т. е. когда концентрация в крови свободных Т3, Т4 находится в пределах нормы. Это так называемая аутоиммунная эндокринная офтальмопатия при эутиреозе, или эутиреоидная болезнь Грейвса. Частота ее возникновения составляет от 0,7 до 18% [3]. Возникающий при этом экзофтальм обусловлен увеличением объема экстраокулярных мышц и орбитальной клетчатки вследствие клеточной инфильтрации (лимфоцитами, макрофагами, плазматическими клетками).
Как показывает практика, выявление и дифференциальная диагностика эндокринной офтальмопатии на фоне отсутствия других клинических проявлений поражения щитовидной железы без соответствующего опыта представляют определенную трудность при диагностике для практикующих офтальмологов.
Целью работы является клинический разбор случая диагностики и лечения эндокринной офтальмопатии с благоприятным исходом.
Методы. В диагностическое отделение ХФ ФГБУ «МНТК «Микрохирургия глаза» им. академика С.Н. Федорова» Минздравсоцразвития России обратилась пациентка П., 49 лет, с жалобами на выпячивание левого глаза, слезотечение и незначительный отек верхнего и нижнего век, чувство «распирания» глазного яблока в течение 3 нед. Назначенные районным офтальмологом инстилляции кортикостероидов и кромоглициевой кислоты (Лекролин) (по поводу аллергического конъюнктивита) облегчения не принесли. В течение 2 лет пациентка страдает артериальной гипертонией I степени.
Проведенное диагностическое обследование в условиях районной поликлиники - рентгенография придаточных пазух носа с последующей консультацией ЛОР-врача не обнаружило какой-либо патологии носоглотки и придаточных пазух.
При первичном осмотре: острота зрения обоих глаз составила 1,0 без коррекции. Визуально определяются левосторонний умеренно выраженный экзофтальм, легкая асимметрия положения обоих глазных яблок в орбите. При исследовании экзофтальмометром Гертеля: ОД - 15 мм, ОС - 19 мм. Глазная щель слева расширена за счет ретракции верхнего века (симптом Дальримпля) и составляет 16 мм, определяется умеренная отечность обоих век. На правом глазу подобных изменений не обнаружено. Ширина глазной щели - 10 мм. Имеет место усиление «блеска» обоих глаз. Левое глазное яблоко при пальпации безболезненно, репозиция его в орбиту ограничена незначительно, движения сохранены в полном объеме, девиация взора отсутствует.
Ультразвуковое В-сканирование обеих орбит выявило удлинение пространства ретробульбарной зоны на 2 мм слева, утолщение всех экстраокулярных мышц на 1,5-2,5 мм (B-scan Accutome Plus 4.00.00, 25 мГц датчик производства США).
Передние отрезки обоих глаз - без особенностей, оптические среды прозрачные. На глазном дне обоих глаз отмечалось умеренное сужение артерий. Вены были слегка расширены, извиты. Макулярная, экваториальная зоны и периферия сетчатки, диски зрительных нервов не изменены. Уровень внутриглазного давления (ВГД) - в пределах возрастной нормы: правый глаз - 22 мм рт. ст., левый - 21 мм рт. ст.
В связи с выявленными признаками экзофтальма пациентке назначено обследование для исключения его наиболее вероятных причин. Проведенное ультразвуковое В-сканирование щитовидной железы не выявило патологии ни ее размеров, ни степени эхогенности. Биохимическое исследование содержания в крови свободных гормонов щитовидной железы Т3, Т4, ТТГ также не выявило отклонений от нормы. Так, содержание ТТГ составило 2,33 мМЕ/мл при норме 0,2-3,2; Т3 - 1,73 нмоль/л при норме 1,0-2,8; Т4 - 96 нмоль/л при норме 54-156.
На основании данных обследования эндокринолог сделал заключение, что имеющийся односторонний экзофтальм никак не связан с поражением щитовидной железы. Для выяснения его причины пациентка была направлена нами на спиральную компьютерную томографию головного мозга с внутривенным контрастным усилением. Мы руководствовались задачей исключения объемного образования в полости черепа. Данное исследование не выявило ни объемных образований, ни другой какой-либо патологии головного мозга, орбиты, околоносовых пазух и клеток решетчатой кости. Хотя при этом было отмечено достоверное увеличение отека всех групп глазодвигательных мышц, уплотнения ретробульбарной клетчатки и оболочек зрительного нерва с обеих сторон, несколько более выраженные слева.
По совокупности выявленных глазных симптомов, а также данных нейрорадиологического и ультразвукового исследования орбит и головного мозга, жалоб и анамнеза заболевания нами был выставлен клинический диагноз: аутоиммунная эндокринная офтальмопатия при эутиреозе (эутиреоидная болезнь Грейвса), отечный экзофтальм слева, стадия субкомпенсации.
Пациентка была госпитализирована в отделение консервативного лечения нашей клиники. Ей была назначена системная и местная терапия кортикостероидов, цитостатиков, дегидратация. Она включала: 0,4 г раствора дексаметазона в/в по 1 мл 1 р./сут. - 3 дня; фуросемид внутрь по 0,04 г 1 р./сут. в течение 3 дней подряд; параокулярные инъекции 0,2 г раствора дексаметазона с 0,25 г циклофосфана в левый глаз парабульбарно № 10. С 5-го дня добавлена метаболическая поддерживающая терапия: антиоксиданты - в/в инфузии 5% раствора мексидола капельно 2,0 на физрастворе № 5, солкосерила 4,25% по 4,0 в/в № 10, 1% раствор эмоксипина под кожу висков с двух сторон № 1; курс витаминов В1, В6 в/м.
Лечение пациентка переносила хорошо. Она была повторно проконсультирована эндокринологом, который на этот раз подтвердил наличие патологии щитовидной железы как причины поражения органа зрения, даже при наличии эутиреоза. Больной были рекомендованы дальнейшее наблюдение у эндокринолога по месту жительства и обязательный динамический контроль уровня гормонов щитовидной железы в крови.
Уже на 5-й день лечения пациентка отметила уменьшение, а затем и исчезновение светобоязни, исчезновение чувства «распирания» глазного яблока, уменьшение отека век. Объективно отмечалось легкое уменьшение степени экзофтальма слева, ретракции верхнего века (до 17 мм). Сохранялось усиление «блеска» глаз.
К моменту ее выписки на 10 сут. сохранялось лишь незначительное выпячивание левого глазного яблока (экзофтальмометрия правого глаза составила 15 мм, левого - 17 мм). При контрольном В-сканировании орбит отмечалось уменьшение объема ретробульбарной зоны и толщины экстраокулярных мышц. Острота зрения обоих глаз составила 1,0 без коррекции. ВГД правого глаза - 23 мм рт. ст., левого - 21 мм рт. ст.
Для амбулаторного долечивания были назначены инстилляции в конъюнктивальную полость 0,1% раствора дексаметазона короткими курсами - 2-кратно в течение 5 дней с повторением через 10 дней в течение 2 мес.
Спустя 3 мес. жалобы отсутствовали. Положение глаз в орбите было правильным, симметричным. Признаки левостороннего экзофтальма минимальные: ширина глазной щели превышала таковую на парном глазу на 2 мм. Движения глазных яблок обоих глаз - в полном объеме. Показатели экзофтальмометрии правого глаза - 15 мм рт. ст., левого - 16 мм рт. ст. Острота зрения обоих глаз без коррекции составила 1,0. Оптические среды прозрачные, сетчатка и диск зрительного нерва не изменены.
Почти полное исчезновение проявлений данного заболевания и заметная положительная динамика со стороны офтальмологического статуса свидетельствовали о переходе заболевания из острой фазы в фазу реконвалесценции.
Таким образом, описанный нами клинический случай эндокринной офтальмопатии при эутиреоидной болезни Грейвса представляет практический интерес в связи с трудностью выявления основной причины экзофтальма - при отсутствии нарушения функций щитовидной железы как основного пускового механизма этой патологии. В подобных ситуациях клиницистам следует иметь настороженность в плане патологии щитовидной железы, поскольку некоторые географические регионы, такие, в частности, как Дальний Восток, являются эндемичными по этому заболеванию. Своевременная ранняя диагностика заболевания является залогом успешного лечения эутиреоидной болезни Грейвса. Но эти пациенты должны длительное время наблюдаться у эндокринолога, поскольку впоследствии у половины из них повышается риск развития диффузно-токсического зоба.
Литература
1. Бровкина А.Ф. Болезни орбиты: руководство для врачей. 2-е изд. М.: ООО «Медицинское информационное агентство», 2008. 256 с.
2. Калинин А.П., Можеренков В.П., Прокофьева Г.Л. Офтальмоэндокринология. М.: Медицина, 1998. 159 с.
3. Бровкина А.Ф., Толстухина Т.Л., Александрова Г.Ф., Котова Г.А. Эутиреоидная болезнь Грейвса (проблемы диагностики и лечения) // Вестник офтальмологии. 2001. № 4. С. 34-36.
Комбинированные операции на веке при эндокринной офтальмопатии
НИИ глазных болезней РАМН, Москва
ФГБУ "НИИ глазных болезней" РАМН, Москва;
ГБОУ ВПО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Минздрава РФ
кафедра глазных болезней ГОУ ВПО «Первый МГМУ И.М. Сеченова» Минздрава России, ул. Трубецкая, 8, стр. 2, Москва, Российская Федерация, 119991
Основные принципы лечения поражений роговицы при эндокринной офтальмопатии
Журнал: Вестник офтальмологии. 2016;132(5): 35‑38
Цель — разработка тактики лечения и изучение эффективности комбинированного лечения пациентов с поражением роговицы при эндокринной офтальмопатии (ЭОП). Материал и методы. Пациенты (44 человека, 52 глаза) были разделены на 2 группы в зависимости от тяжести поражения роговицы. При тяжелом поражении роговицы (18 пациентов, 21 глаз) комбинированное лечение включало сочетание местной терапии, патогенетически ориентированного лечения (пульс-терапия глюкокортикоидами, лучевая терапия) и хирургические вмешательства (декомпрессию орбиты, операции на веках и роговице). Результаты. У всех пациентов в результате лечения было достигнуто снижение активности орбитального воспалительного процесса и значительное улучшение состояния роговицы. Заключение. Таким образом, лечение пациентов с поражением роговицы при ЭОП может быть различным и его необходимо проводить, учитывая множество факторов. Выбор лечебных мероприятий зависит прежде всего от активности орбитального воспаления и степени выраженности изменений роговицы. Кроме того, учитывая потенциальную тяжесть вовлечения роговицы в патологический процесс при ЭОП, необходимо выявлять факторы риска на ранних этапах и проводить мероприятия, направленные на их коррекцию.
Лечение поражений роговицы при эндокринной офтальмопатии (ЭОП) представляет сложную задачу для офтальмолога, поскольку стандартные подходы к лечению язв роговицы в данной ситуации зачастую оказываются малоэффективными. Это связано с тем, что поражение роговицы при ЭОП обусловлено многими причинами, приобретая особо тяжелое течение при воздействии нескольких факторов одновременно. Было показано, что ведущими причинами, обусловливающими поражение роговицы при ЭОП, являются активность воспалительного процесса в орбите, величина экзофтальма, лагофтальма и глазной щели, ретракция нижнего века, синдром сухого глаза (ССГ) и уменьшение чувствительности роговицы [1—7]. Кроме того, имеются данные, что значение также имеют и факторы врожденного иммунитета, такие как β-дефенсин-2, снижение экспрессии гена которого ассоциировано с более тяжелым поражением роговицы при ЭОП [1]. Исходя из этого, можно предположить, что лечение данной патологии должно быть комплексным и направленным на устранение всех перечисленных факторов [8]. Соответственно, оно должно быть медикаментозным (патогенетически ориентированным) и хирургическим, включающим декомпрессию орбиты, операции на веках, а также реконструктивные операции на роговице. Однако далеко не всегда проведение всех этих вмешательств необходимо, и задача специалиста заключается в определении правильной тактики лечения пациента в зависимости от наличия тех или иных факторов, требующих коррекции.
Цель данного исследования — разработка тактики лечения пациентов с поражением роговицы при ЭОП.
Материал и методы
В исследование включены 44 пациента (52 глаза) с поражением роговицы при ЭОП, проходившие обследование и лечение в ФГБНУ «НИИ глазных болезней». У всех пациентов на момент начала лечения уровень тиреоидных гормонов был в пределах нормы. Среди больных было 27 женщин и 17 мужчин в возрасте от 18 до 76 лет (в среднем 53,5±13,7 года). Сроки наблюдения составляли от 6 до 65 мес (в среднем 36,5±23,8 мес).
В зависимости от тяжести поражения роговицы пациенты были разделены на 2 группы. В 1-ю группу вошли 26 пациентов (31 глаз) с эпителиопатией различной степени выраженности, в среднем 7,11±2,03 балла при окраске флюоресцеином (по шкале NationalEyeInstitute). Во 2-ю группу включены 18 пациентов (21 глаз) со стромальным дефектом роговицы, наличие которого вне зависимости от размера и состояния остальной части роговицы оценивалось в 15 баллов.
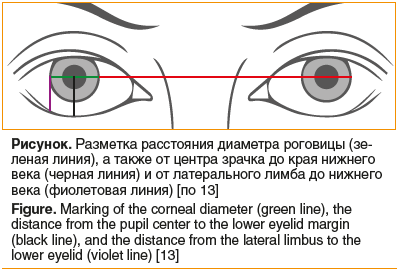
Больным проводили стандартное офтальмологическое обследование (наружный осмотр, визометрию, тонометрию, компьютерную периметрию, биомикроскопию, офтальмоскопию), а также использовали дополнительные методы: экзофтальмометрию, орбитометрию, биометрические измерения (ширина глазной щели — PF, расстояние от рефлекса роговицы до края верхнего века — MRD1, расстояние от рефлекса роговицы до края нижнего века — MRD2, расстояние от лимба до края верхнего века — MLD1, расстояние от лимба до края нижнего века — MLD2, величина лагофтальма), тест Ширмера I, окраску витальными красителями, определение чувствительности роговицы. Для оценки степени повреждения глазной поверхности использовали шкалу Национального Института Глаза (NationalEyeInstituteWorkshopgradingsystem). Согласно этой системе, степень кератопатии определяют по площади и интенсивности окрашивания роговицы флюоресцеином: роговицу делят на 5 сегментов (верхний, нижний, латеральный, медиальный и центральный), в каждом из которых оценивают степень окраски по 3-балльной шкале в зависимости от интенсивности окрашивания, где 0 баллов — отсутствие окрашивания, 1 балл — слабое окрашивание, 2 балла — умеренное, 3 балла — выраженное. Из лучевых методов диагностики применяли компьютерную томографию (КТ) орбит и/или ультразвуковое исследование (УЗИ).
Лечение зависело от стадии, активности и степени компенсации заболевания. Пульс-терапию метилпреднизолоном по схеме А.Ф. Бровкиной проводили всем пациентам в активной фазе орбитального воспалительного процесса. При недостаточной эффективности пульс-терапии, стероид-резистентных формах и невозможности длительного применения глюкокортикоидов проводили курс дистанционной γ-терапии (ДГТ) в суммарной дозе 15—20 Гр.
Все пациенты получали местное симптоматическое лечение, включавшее слезозаменители, корнеопротекторы, препараты на основе витамина, А и антибиотики. Кроме того, при лагофтальме заклеивали глаз на время сна или постоянно. При обширных дефектах эпителия и/или дефектах стромы роговицы к вышеперечисленным препаратам добавляли антибактериальные капли широкого спектра действия.
Хирургическое лечение проводили по показаниям, оно включало одно или несколько из следующих вмешательств: костную декомпрессию наружной (методика Дж. Роуза или Р. Голдберга), внутренней и в ряде случаев части нижней стенки орбиты, жировую декомпрессию орбиты, тарзорафию, устранение ретракции век (отсечение сухожилия верхней тарзальной мышцы, блефаротомию, пластику нижнего века мукопериостальным лоскутом и постановку других спейсеров). При длительно не заживающих дефектах стромы роговицы производили следующие хирургические вмешательства: биопокрытие амнионом, аутоконъюнктивой, корнеосклеральным лоскутом или аллосклерой, сквозную или послойную кератопластику (лечение в отделе роговицы ФГБНУ «НИИ глазных болезней»).
При выраженном ССГ производили окклюзию нижних слезных точек следующими способами: использовали силиконовые окклюдеры (временная окклюзия), радиохирургическую коагуляцию слезной точки и окклюзию конъюнктивальным трансплантатом (постоянная окклюзия).
Кроме хирургических методов коррекции ретракции век и лагофтальма, использовали инъекции геля на основе стабилизированной гиалуроновой кислоты (Restilane) по ранее описанной методике [9]. Для этих же целей вводили препарат ботулотоксина типа, А в леватор верхнего века.
Результаты и обсуждение
Тактика лечения пациентов зависела от активности и степени компенсации орбитального воспалительного процесса, состояния роговицы и зрительного нерва. Показаниями для внутривенного введения высоких доз глюкокортикоидов были высокая активность заболевания (7 баллов и более по CAS), тяжелое поражение роговицы, оптическая нейропатия в результате сдавления зрительного нерва увеличенными экстраокулярными мышцами.
Курс ДГТ проведен 7 пациентам (суммарная доза облучения 15—20 Гр на обе орбиты).
В 1-й группе при кератопатии пульс-терапия метилпреднизолоном была проведена 14 пациентам, ДГТ — 2 пациентам. Хирургическое лечение в этой группе включало костную декомпрессию орбиты (17 глаз), коррекцию ретракции верхнего века (11 блефаротомий, 6 отсечений сухожилия верхней тарзальной мышцы), частичную тарзорафию (3 глаза). В результате лечения у всех пациентов было отмечено улучшение состояния роговицы, степень окрашивания флюоресцеином в среднем составила 1,6±1,1 балла. Разница этого показателя до и после лечения была статистически достоверна (р
Во 2-й группе 18 пациентам (21 глаз) с тяжелым поражением роговицы проводили комбинированное патогенетически ориентированное и хирургическое лечение, 14 больным проводили пульс-терапию метилпреднизолоном и 5 — ДГТ. Оперативное лечение включало: 16 декомпрессий орбиты, 17 тарзорафий (4 полные, 13 частичных), 3 блефаротомии, 5 пластик нижнего века мукопериостальным лоскутом и 6 операций на верхней тарзальной мышце. На роговице было выполнено 14 хирургических вмешательств (хирурги проф. А.А. Каспаров, С.А. Маложен): 3 биопокрытия амнионом, 4 — аутоконъюнктивой, 1 — корнеосклеральным лоскутом, 3 — аллосклерой, 2 сквозные и 1 послойная кератопластика. Повторные операции на роговице проводили 5 пациентам, во всех этих случаях это было связано с лизисом биопокрытия или отторжением трансплантата, причем подобные осложнения отмечались в случае, если одновременно не была произведена тарзорафия. Во время повторных вмешательств обязательно производили частичную или полную тарзорафию, после чего лизиса биопокрытия не происходило.
Эффективность лечения оценивали по нескольким параметрам: остроте зрения, состоянию роговицы, выстоянию глазного яблока, величине лагофтальма, ширине глазной щели, ретракции верхнего и нижнего век. В результате было показано, что по всем этим параметрам после лечения отмечалась выраженная положительная динамика (см. таблицу), во всех случаях различие показателей было статистически достоверным.
Результаты лечения пациентов 2-й группы Примечание. * — критерий Уилкоксона.
Эффект лечения был стойкий и сохранялся на протяжении всего периода наблюдения (в среднем 36,5±23,8 года).
Поражение роговицы, наряду с оптической нейропатией, является наиболее опасным, угрожающим зрению осложнением ЭОП, которое при отсутствии своевременного лечения может привести к стойкому снижению зрительных функций или потере глаза.
Лечение больных с патологией роговицы при ЭОП всегда должно быть комбинированным и включать этиологическое, патогенетическое и симптоматическое. Нормализация гормонального статуса является обязательным условием успеха всех вмешательств. Поражение роговицы при ЭОП можно условно разделить на 2 подтипа: первый связан с высокой активностью воспалительного процесса в орбите и его последствиями (экзофтальм, лагофтальм, хемоз, нарушение иннервации и др.), при втором варианте патология роговицы развивается на фоне фиброзных изменений в орбите вследствие ранее перенесенного активного воспаления и обусловлена остаточными явлениями, такими как экзофтальм, лагофтальм, ретракция век, снижение чувствительности и др. [1] Лечение в этих двух случаях различается. Так, при высокой активности орбитального воспаления необходимо проведение мероприятий, направленных на подавление аутоиммунного процесса: назначение глюкокортикоидов в высоких дозах, при недостаточной эффективности пульс-терапии — лучевая терапия [10]. В стадии фиброза применение этих методов лечения не приведет к улучшению, поскольку активное воспаление уже отсутствует. Слезозаместительную терапию необходимо проводить на любой стадии при наличии жалоб на жжение, покраснение, светобоязнь, а также при экзофтальме, лагофтальме и сухости глазной поверхности (по данным витального окрашивания).
Дальнейшее лечение зависит от степени поражения роговицы и стадии воспалительного процесса. При поверхностной кератопатии и/или эпителиальных дефектах в активной стадии ЭОП экзофтальм и лагофтальм могут уменьшиться в результате системного применения кортикостероидов, поэтому хирургическую коррекцию этих состояний можно оставить на случай отсутствия должного ответа на консервативное лечение. В стадии фиброза целесообразно проводить исключительно хирургическое лечение, направленное на уменьшение экспозиции роговицы. При этом необходимо четко соблюдать последовательность оперативных вмешательств, поскольку результаты каждого вмешательства могут непосредственно влиять на исход последующих процедур. Общепринятой является следующая последовательность: декомпрессия орбиты при необходимости операции на экстраокулярных мышцах и хирургические вмешательства на веках. Такой порядок вмешательств обусловлен тем, что декомпрессия орбиты приводит к изменению положения глаза и век [11, 12]. Кроме того, существуют сложности в оценке истинной степени ретракции век при выраженном выстоянии глазного яблока, хемозе или смещении глаза в горизонтальном или вертикальном направлении. Любой из перечисленных этапов можно опустить при отсутствии показаний, однако при выполнении каждого из них необходимо соблюдать вышеизложенную последовательность.
Выбор одного или нескольких методов зависит от преобладающего симптома: так, при выраженном экзофтальме в качестве первого этапа оправдано проведение декомпрессии орбиты, в результате которой возможно не только уменьшение выстояния глазного яблока, но и коррекция ретракции век и лагофтальма. При незначительном экзофтальме, ретракции век и лагофтальме возможно, минуя этап орбитальной хирургии, проводить операции на веках. Существует множество способов хирургической коррекции лагофтальма. Обычно применяется некровавая блефарорафия или различные методики перманентных тарзорафий. При ЭОП лагофтальм обусловлен сразу несколькими факторами, поэтому величина несмыкания век может быть значительной. Часто при этом недостаточно одного оперативного вмешательства и возникает необходимость в этапном хирургическом лечении, включая орбитальную хирургию.
При тяжелом поражении роговицы с вовлечением стромы, выраженным экзофтальмом, лагофтальмом, хемозом и высокой активностью орбитального воспаления необходимо проводить комбинированное лечение, включающее как медикаментозные и лучевые методы, так и хирургические. В этом случае оправданы хирургические вмешательства, направленные на уменьшение экзофтальма (декомпрессии орбиты), коррекцию ретракции век и лагофтальма (отсечение сухожилия верхней тарзальной мышцы, блефаротомия, пересадка мукопериостального лоскута, тарзорафия), на защиту роговицы (биопокрытие).
В данной работе для лечения тяжелого поражения роговицы у 17 пациентов (24 глаза) мы использовали комбинированное лечение, включавшее сочетание местной терапии, патогенетически ориентированного лечения ЭОП (пульс-терапия ГК, лучевая терапия) и хирургические вмешательства (декомпрессию орбиты, операции на веках и роговице). У всех пациентов в результате лечения было достигнуто снижение активности орбитального воспалительного процесса и значительное улучшение состояния роговицы.
Таким образом, лечение поражений роговицы при ЭОП может быть различным и его необходимо проводить, учитывая множество факторов. Выбор лечебных мероприятий зависит прежде всего от активности орбитального воспаления, величины экзофтальма и степени выраженности изменений роговицы. Кроме того, учитывая потенциальную тяжесть вовлечения роговицы в патологический процесс при ЭОП, необходимо выявлять факторы риска на ранних этапах и проводить мероприятия, направленные на их коррекцию.
Возможности хирургического лечении эндокринной офтальмопатии. Взгляд оториноларинголога
Актуальность. Лечение эндокринной офтальмопатии (ЭОП) является одной из чрезвычайно актуальных на сегодняшний день мультидисциплинарных проблем. Хирургическая помощь пациентам с ЭОП недостаточна именно вследствие недостаточного взаимодействия офтальмологов, эндокринологов и оториноларингологов. Возможности использования эндоназальной эндоскопической хирургии в смежных анатомических областях чрезвычайно актуальны в настоящее время. И приоритетной задачей оториноларингологов на сегодняшний день является изучение и разработка техники трансназальных, трансэтмоидальных, транссфеноидальных эндоскопических хирургических вмешательств на структурах основания черепа и орбиты с целью минимизации инвазивности и повышения эффективности лечения ряда патологий, в том числе эндокринной офтальмопатии.
Цель. Оценить возможности хирургического лечения эндокринной офтальмопатии - трансэтмоидальной декомпрессии орбиты в отношении коррекции экзофтальма.
Методы. В исследование были включены 64 пациента с эндокринной офтальмопатией при неэффективности медикаментозного лечения, хирургическое лечение которых было проведено с 2006 по 2016 год. Прооперировано 90 орбит. Пациентам выполнялась трансэтмоидальная декомпрессия орбиты (ТЭДО).
Результаты. У всех пациентов в послеоперационном периоде отмечена стойкая положительная динамика, выражавшаяся в уменьшении экзофтальма, и улучшении качества жизни в связи с исчезновением косметического дефекта, однако у всех пациентов мы наблюдали разной степени выраженности транзиторную или стойкую послеоперационную диплопию. Ни у кого из пациентов не отмечено орбитальных инфекционных осложнений или других клинически значимых инфекций полости носа и околоносовых пазух.
Заключение. В представленном нами исследовании продемонстрирована высокая клиническая эффективность ТЭДО в отношении регресса экзофтальма. Экзофтальм в среднем уменьшился у всех пациентов на 5,1 мм, а уровень послеоперационной диплопии составил менее чем 20% случаев.
Ключевые слова
Для цитирования:
For citation:
Обоснование
На сегодняшний день эндокринная офтальмопатия (ЭОП) остается заболеванием, хирургические методы лечения которого нуждаются в развитии и совершенствовании. Большинство пациентов с ЭОП успешно отвечают на медикаментозную терапию, в результате которой удается подавить воспаление в орбите. Однако остается довольно большая группа пациентов, у которых, несмотря на успешную терапию, сохраняется выраженный одно- или двусторонний экзофтальм.
Лечение ЭОП остается одной из чрезвычайно актуальных на сегодняшний день мультидисциплинарных проблем. Во многом в настоящее время помощь больным с данной патологией малоэффективна именно вследствие недостаточного взаимодействия офтальмологов, эндокринологов и оториноларингологов.
Эндоскопическая хирургия околоносовых пазух (FESS) широко применяется в оториноларингологии. Хирургические вмешательства с успехом выполняются не только на структурах полости носа, но и на основании черепа, гипофизе и других смежных структурах. В нашей клинике успешно применяются эндоназальныеэндоскопические доступы к структурам орбиты. ЭОП - прогрессирующее заболевание, характеризующееся гиперплазией орбитальной клетчатки и глазных мышц, приводящее не только к эстетическим нарушениям, таким как экзофтальм и косоглазие [1], но и к полной потере зрения вследствие компрессии гиперплазированнымиглазными мышцами зрительного нерва [2]. Несмотря на успешность терапии и достижение полной ремиссии, у пациентов может наблюдаться экзофтальм, значительно снижающий качество их жизни. Это требует проведения хирургического вмешательства.
С нашей точки зрения, хирургический доступ к орбите должен отвечать нескольким требованиям: минимальная инвазивность, возможность формирования широкого костного окна в орбитальной стенке, малотравматичный доступ к вершине орбиты, минимальный риск развития послеоперационных зрительных осложнений, таких как диплопия и косоглазие, а также более серьезных послеоперационных гнойно-воспалительных поражений мозговых оболочек и образования ликворных фистул. С этой точки зрения наиболее оптимальной хирургической методикой при ЭОП нам представляется трансэтмоидальная эндоскопическая декомпрессия орбиты (ТЭДО). Метод имеет как преимущества, так и недостатки. К преимуществам следует отнести малую инвазивность, внутренний (эндоназальный) подход к орбите, что исключает разрезы кожи и последующие рубцовые изменения и обеспечивает выраженный регресс экзофтальма до 6 мм 4. К недостаткам относят высокий процент развития послеоперационной диплопии и косоглазия, которые встречаются с частотой до 40% случаев 9.
Таким образом, проблема возможностей применения эндоназальной эндоскопической хирургии в смежных с ринологией областях чрезвычайно актуальна в настоящее время. И приоритетной задачей оториноларингологов является изучение и разработка техники трансназальных, трансэтмоидальных, транссфеноидальныхэндоскопических хирургических вмешательств на структурах основания черепа и орбиты с целью минимизации инвазивности и повышения эффективности лечения ряда патологий, в том числе эндокринной офтальмопатии. Некоторые данные по ТЭДО были представлены нами в 2010 г. на основе проведения вмешательства у 9 пациентов [12], однако данная публикация рассматривала проблему с точки зрения клинических наблюдений, включающих в том числе пациентов с уже имеющимися диплопией и признаками оптической нейропатии до операции. В данном материале мы представляем собственные результаты хирургических вмешательств по коррекции неосложненного экзофтальма у 64 пациентов в рамках оригинального исследования.
Оценить возможности хирургического лечения эндокринной офтальмопатии - трансэтмоидальной декомпрессии орбиты в отношении коррекции экзофтальма.
Методы
Дизайн исследования
Проведено открытое проспективное одноцентровое экспериментальное неконтролируемое исследование с участием пациентов с клинически диагностированной эндокринной офтальмопатией в стадии ремиссии.
Критерии соответствия
Критерии включения в исследование: пациенты с клинически верифицированным диагнозом эндокринной офтальмопатии в стадии ремиссии и медикаментозной компенсации (ТТГ - 1,9 ± 0,8 мЕ/л, CAS = 0-2), имеющие стойкий одно- или двусторонний экзофтальм, обусловленный ЭОП.
Критерии исключения из исследования: наличие у пациента острых или обострения хронических соматических заболеваний, инфекционно-воспалительных заболеваний структур полости носа и околоносовых пазух, полипозного риносинусита, беременности, онкологической патологии, аномалий развития структур полости носа и околоносовых пазух (дисплазия или агенезия околоносовых пазух, расщелины твердого неба), наличие в анамнезе хирургических вмешательств на структурах орбиты, диплопии, возраст менее 16 лет.
Условия проведения
Исследование проводилось на базе клиники болезней уха, горла и носа ФГАОУ ВО Первый МГМУ им. И.М. Сеченова. Все хирургические вмешательства выполнены одним хирургом.
Продолжительность исследования
В исследование включены пациенты, оперированные с 2006 по 2017 г. Стационарное лечение не превышало 10 дней. После выписки пациентов обоих групп консультировали через 1 нед, 1, 3, 6 и 12 мес.
Описание медицинского вмешательства
Всем пациентам до операции проводился оториноларингологический осмотр, включающий эндоскопию полости носа и носоглотки, фарингоскопию. Оценивались результаты компьютерной томографии (КТ) околоносовых пазух, при которой анализировали особенности развития параназальных синусов, степень проходимости носовых ходов, степень пневматизации пазух, наличие тех или иных анатомических аномалий развития внутриносовых структур. Дополнительно выполнялась КТ орбит, при которой оценивалось состояние орбитальных стенок, глазных мышц и степень гиперплазии орбитальной клетчатки. Дополнительно выполнялось офтальмологическое обследование, включающее наружный осмотр, тонометрию, офтальмоскопию и экзофтальмометрию. Активность ЭОП оценивали по шкале CAS (Clinical Activity Score), при этом наличие каждого из признаков оценивали в 1 балл, при сумме баллов 4 и более процесс считали активным. Отсутствие активности ЭОП подтверждалось на основании осмотра эндокринологом и офтальмологом.
Подготовка к хирургическому вмешательству включала стандартное общеклиническое обследование перед плановой операцией.
Всем пациентам проведена трансназальная трансэтмоидальная эндоскопическая декомпрессия орбиты с резекцией костного остова ее медиальной стенки. Хирургические вмешательства проводили под общим обезболиванием.
Объем выполняемого хирургического вмешательства определялся с учетом особенностей строения полости носа и внутриносовых структур, таких как искривление носовой перегородки, буллезная гипертрофия средних раковин и др. При их наличии первоначально выполняли септопластику и резекцию латеральных сегментов булл средних раковин. Доступ к медиальной стенке орбиты предполагал проведение расширенной полисинусотомии, объем которой определялся особенностями строения решетчатого лабиринта и других областей. Под контролем прямой и боковой оптики выполняли тотальную резекцию крючковидного отростка. Соустье верхнечелюстной пазухи расширяли максимально, для чего резецировали заднюю фонтанеллу. Далее выполняли тотальную этмоидэктомию, в ходе которой обнажали медиальную стенку орбиты и основание черепа.
Трансэтмоидально выполняли вскрытие клиновидной пазухи (сфенотомию), для чего перфорировали переднюю стенку клиновидной пазухи и резецировали ее латеральные две трети для максимального открытия синуса. Ревизовали и оценивали проходимость соустья лобной пазухи. Далее выполняли резекцию костного остова медиальной орбитальной стенки от проекции слезного мешка до клиновидной пазухи. Дополнительно резецировали медиальную треть нижней стенки орбиты доступом через расширенное соустье верхнечелюстной пазухи. Далее выполняли вскрытие периорбитальной фасции, рассекали фиброзные перемычки между дольками экстраконально расположенного орбитального жира. Удаление последнего не проводили.
Интраоперационно внутривенно вводили 1 мг амоксициллина/клавуланата для профилактики гнойно-воспалительных осложнений. Операцию завершали проведением гемостаза и тампонадой общих носовых ходов эластичными тампонами на одни сутки. На область оперированной орбиты накладывали давящую асептическую повязку для профилактики орбитальных гематом.
В послеоперационном периоде проводили местную, противовоспалительную, антибактериальную и симптоматическую терапию в течение 5 сут. Срок наблюдения в стационаре не превышал 10 сут.
Основной исход исследования
Оценивали наличие или отсутствие экзофтальма, при его наличии оценивали степень его выраженности в мм.
Дополнительный исход исследования
Оценивали наличие или отсутствие диплопии в послеоперационном периоде. При ее наличии оценивали ее продолжительность и стойкость (транзиторная или стойкая послеоперационная диплопия). Оценивали послеоперационные изменения полости носа и внутриносовых структур у пациентов в послеоперационном периоде на основании предъявляемых ими жалоб.
Методы регистрации исходов
При контрольных осмотрах проводили переднюю риноскопию и эндоскопию полости носа. Контрольную КТ выполняли через 3 мес после выписки из стационара. На всех визитах выполнялась экзофтальмометрия.
Этическая экспертиза
Все пациенты добровольно подписали информированное письменное согласие на участие в исследовании. Исследование было одобрено локальным комитетом по этике ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава РФ. Постановление: одобрить исследование в рамках диссертационной работы “Трансназальныехирургические вмешательства при эндокринной офтальмопатии” (исполнитель - Кочетков П.А.), протокол заседания № 05-13 от 15.05.2013. У пациентов, участвующих в исследовании, получено согласие на публикацию эндофотографий результатов выполненного им хирургического вмешательства, компьютерных томограмм и фотографий до и после хирургических вмешательств. Форма информированного согласия одобрена указанным этическим комитетом.
Статистический анализ
Результаты
Объекты (участники) исследования
Все пациенты были прооперированы в ЛОР-клинике Первого МГМУ им. И.М. Сеченова в период с 2006 по 2017 г. ТЭДО проведена у 22 пациентов с односторонним процессом и у 34 - с двусторонним экзофтальмом (всего оперировано 90 орбит).
Основные результаты исследования
У всех пациентов в послеоперационном периоде отмечена стойкая положительная динамика, выражавшаяся в уменьшении экзофтальма и улучшении качества жизни в связи с исчезновением косметического дефекта, однако у всех пациентов мы наблюдали разной степени выраженности транзиторную или стойкую послеоперационную диплопию.
У пациентов регресс экзофтальма после ТЭДО составил от 3,5 до 6,5 мм (рис. 1). При исходных средних 25,4 мм экзофтальм уменьшился в среднем на 5,1 мм, что составило в среднем 18,8 мм (р < 0,05). МСКТ-исследование демонстрировало пролабирование мягких тканей орбиты в сформированное костное окно (рис. 2).
Рис. 1. Пациентка до (а) и после (б) ТЭДО: регресс экзофтальма. Отчетливо прослеживается уменьшение выступания верхнего века и обзорность спинки носа и переносицы после ТЭДО.
Рис. 2. Компьютерная томография пациентки после ТЭДО. Аксиальный срез. Отмечены границы наложенного костного окна (1, 2); пролабирование орбитальных тканей в сформированное костное окно (3).
Ни у кого из пациентов не отмечено орбитальных инфекционных осложнений или других клинически значимых инфекций полости носа и околоносовых пазух.
Нежелательные явления
Все жалобы, предъявляемые пациентами в послеоперационном периоде, выявлялись уже на первом месяце послеоперационного наблюдения. Среди жалоб были одно- или двустороннее затруднение носового дыхания (33%), образование корок и сухость в носу (47%), выделения из носа слизистого характера (15%), головная боль, боль и дискомфорт в верхней челюсти (2%), односторонняя боль в области лба и носовое кровотечение (2%).
Резюме основного результата исследования
Результат успешной коррекции экзофтальма, на наш взгляд, объясняется следующим. Уже интраоперационно, при проведении визуальной оценки степени достигнутой декомпрессии орбиты, нами отмечено, что сформированная после резекции структур решетчатого лабиринта (этмоидэктомии) полость имела достаточный и даже резервный объем для пролабирования декомпрессированной от костного остова орбитальной клетчатки. Данный эффект декомпрессии дополнялся пролапсом мягких тканей орбиты в верхнемедиальные отделы верхнечелюстной пазухи, что клинически приводило к более выраженному регрессу экзофтальма и позволяло занять глазному яблоку максимально приближенное к физиологическому положение.
Ограничения исследования
Повлиять на результаты исследования могли некоторые неучтенные и малоизученные факторы, свидетельствующие об активности основного заболевания. В данном случае результаты по регрессу экзофтальма после ТЭДО могли быть менее значимыми. Результаты коррекции экзофтальма у пациентов с активной ЭОП требуют дополнительных исследований. Дополнительно оказать влияние на результат могли особенности и технические сложности в ходе выполнения хирургических вмешательств, такие как интраоперационная повышенная кровоточивость тканей.
Заключение
В представленном нами исследовании продемонстрирована высокая клиническая эффективность ТЭДО в отношении регресса экзофтальма. Экзофтальм в среднем уменьшился у всех пациентов на 5,1 мм, а послеоперационная диплопия отмечена менее чем в 20% случаев. Это, с одной стороны, позволяет рекомендовать ТЭДО как метод, повышающий качество лечения пациентов с ЭОП; с другой - определяет необходимость дальнейшего совершенствования данного хирургического подхода и поиска путей для снижения риска послеоперационных осложнений. При достаточной квалификации ЛОР-хирурга и соответствующей технической оснащенности ТЭДО может выполняться в условиях оториноларингологических стационаров, однако офтальмологический контроль состояния глаза и эндокринологический контроль состояния активности ЭОП обязательны. Это подчеркивает необходимость детального предоперационного обследования. В нашем исследовании были прооперированы пациенты именно с эндокринной офтальмопатией в стадии ремиссии или медикаментозной компенсации. В этом случае можно рассчитывать на положительный результат в отношении регресса экзофтальма и улучшения качества жизни пациентов. Полученные в ходе исследования результаты позволяют говорить о социальной значимости метода, поскольку пациенты, избавляясь в результате ТЭДО от эстетического дефекта со стороны глаз, отмечают значительное улучшение качества жизни.
Дополнительная информация
Источник финансирования. Исследование проведено при поддержке ФГАОУ ВО Первый МГМУ им. И.М. Сеченова и на личные средства автора.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Благодарности. Авторы выражают признательность коллегам за помощь в проведении исследования и подготовке статьи: Груше Ярославу Олеговичу, Исмаиловой Диляре Муратовне, Мейтель Ирине Юрьевне.
Эндокринная офтальмопатия ( Аутоиммунная офтальмопатия , Офтальмопатия Грейвса , Тиреоидная офтальмопатия )
Эндокринная офтальмопатия - это органоспецифическое прогрессирующее поражение мягких тканей орбиты и глаза, развивающееся на фоне аутоиммунной патологии щитовидной железы. Течение эндокринной офтальмопатии характеризуется экзофтальмом, диплопией, отечностью и воспалением тканей глаза, ограничением подвижности глазных яблок, изменениями роговицы, ДЗН, внутриглазной гипертензией. Диагностика эндокринной офтальмопатии требует проведения офтальмологического обследования (экзофтальмометрии, биомикроскопии, КТ орбиты); исследования состояния иммунной системы (определение уровня Ig, Ат к ТГ, Ат к ТПО, антиядерных антител и др.), эндокринологического обследования (Т4 св., Т3 св., УЗИ щитовидной железы, пункционной биопсии). Лечение эндокринной офтальмопатии направлено на достижение эутиреоидного состояния; может включать медикаментозную терапию или удаление щитовидной железы.
МКБ-10
Общие сведения
Эндокринная офтальмопатия (тиреоидная офтальмопатия, офтальмопатия Грейвса, аутоиммунная офтальмопатия) - аутоиммунный процесс, протекающий со специфическим поражением ретробульбарных тканей и сопровождающийся экзофтальмом и офтальмоплегией различной степени выраженности. Впервые заболевание было подробно описано К. Грейвсом в 1776 г.
Эндокринная офтальмопатия - проблема, представляющая клинический интерес для эндокринологии и офтальмологии. Эндокринной офтальмопатией страдает примерно 2 % всего населения, при этом среди женщин заболевание развивается в 5-8 раз чаще, чем среди мужчин. Возрастная динамика характеризуется двумя пиками манифестации офтальмопатии Грейвса - в 40-45 лет и 60-65 лет. Эндокринная офтальмопатия также может развиваться в детском возрасте, чаще у девочек первого и второго десятилетия жизни.
Причины
Факторы, инициирующие эндокринную офтальмопатию, до сих пор окончательно не выяснены. В роли пусковых механизмов могут выступать:
- респираторные инфекции,
- малые дозы радиации,
- инсоляция,
- курение,
- соли тяжелых металлов,
- стресс,
- аутоиммунные заболевания (сахарный диабет и пр.), вызывающие специфический иммунный ответ.
Отмечена ассоциация эндокринной офтальмопатии с некоторыми антигенами HLA-системы: HLA-DR3, HLA-DR4, HLA-B8. Мягкие формы эндокринной офтальмопатии чаще встречаются среди лиц молодого возраста, тяжелые формы заболевания характерны для пожилых людей.
Патогенез
Предполагается, что вследствие спонтанной мутации Т-лимфоциты начинают взаимодействовать с рецепторами мембран клеток глазных мышц и вызывают в них специфические изменения. Аутоиммунная реакция Т-лимфоцитов и клеток-мишеней сопровождается высвобождением цитокинов (интерлейкина, фактора некроза опухолей, γ-интерферона, трансформирующего фактора роста b, фактора роста тромбоцитов, инсулиноподобного фактора роста 1), которые индуцируют пролиферацию фибробластов, образование коллагена и выработку гликозаминогликанов. Последние, в свою очередь, способствуют связыванию воды, развитию отека и увеличению объема ретробульбарной клетчатки. Отек и инфильтрация тканей орбиты со временем сменяются фиброзированием, в результате чего экзофтальм становится необратимым.
Классификация
В развитии эндокринной офтальмопатии выделяют фазу воспалительной экссудации, фазу инфильтрации, которая сменяется фазой пролиферации и фиброза. С учетом выраженности глазной симптоматики выделяют три формы эндокринной офтальмопатии:
- Тиреотоксический зкзофтальм. Характеризуется незначительной истинной или ложной протрузией глазных яблок, ретракцией верхнего века, отставанием века при опускании глаз, тремором закрытых век, блеском глаз, недостаточностью конвергенции.
- Отечный экзофтальм. Об отечном экзофтальме говорят при выстоянии глазных яблок на 25-30 мм, выраженном двустороннем отеке периорбитальных тканей, диплопии, резкой ограниченности подвижности глазных яблок. Дальнейшее прогрессирование эндокринной офтальмопатии сопровождается полной офтальмоплегией, несмыканием глазных щелей, хемозом конъюнктивы, язвами роговицы, застойными явлениями на глазном дне, болями в орбите, венозным стазом. В клиническом течении отечного экзофтальма выделяют фазы компенсации, субкомпенсации и декомпенсации.
- Эндокринную миопатию. При эндокринной миопатии имеет место слабость чаще прямых глазодвигательных мышц, приводящая к диплопии, невозможности отведения глаз кнаружи и кверху, косоглазию, отклонению глазного яблока книзу. Вследствие гипертрофии глазодвигательных мышц прогрессирующе нарастает их коллагеновая дегенерация.
Для обозначения выраженности эндокринной офтальмопатии в России обычно используются классификация В. Г. Баранова, согласно которой выделяют 3 степени эндокринной офтальмопатии.
- Критериями эндокринной офтальмопатии 1 степени служат: невыраженный экзофтальм (15,9 мм), умеренная отечность век. Ткани конъюнктивы при этом интактны, функция глазодвигательных мышц не нарушена.
- Эндокринная офтальмопатия 2 степени характеризуется умеренно выраженным экзофтальмом (17,9 мм), значительным отеком век, выраженным отеком конъюнктивы, периодическим двоением.
- При эндокринной офтальмопатии 3 степени выявляются выраженные признаки экзофтальма (20,8 мм и более), диплопия стойкого характера, невозможность полного смыкания век, изъязвление роговицы, явления атрофии зрительного нерва.
Симптомы эндокринной офтальмопатии
К ранним клиническим проявлениям эндокринной офтальмопатии относятся преходящие ощущения «песка» и давления в глазах, слезотечение либо сухость глаз, светобоязнь, отечность периорбитальной области. В дальнейшем развивается экзофтальм, который вначале носит асимметричный или односторонний характер.
На стадии развернутых клинических проявлений названные симптомы эндокринной офтальмопатии становятся постоянными; к ним добавляется заметное увеличение выстояния глазных яблок, инъекция конъюнктивы и склеры, припухлость век, диплопия, головные боли. Невозможность полного смыкания век приводит к образованию язв роговицы, развитию конъюнктивита и иридоциклита. Воспалительная инфильтрация слезной железы усугубляется синдромом сухого глаза.
Осложнения
При выраженном экзофтальме может возникать компрессия зрительного нерва, приводящая к его последующей атрофии. Механическое ограничение подвижности глазных яблок приводит к увеличению внутриглазного давления и развитию, так называемой, псевдоглаукомы; в некоторых случаях развивается окклюзия вен сетчатки. Вовлечение глазных мышц нередко сопровождается развитием косоглазия.
Диагностика
Диагностический алгоритм при эндокринной офтальмопатии предполагает обследование пациента эндокринологом и офтальмологом с выполнением комплекса инструментальных и лабораторных процедур.
1. Эндокринологическое обследование направлено на уточнение функции щитовидной железы и включает исследование тиреоидных гормонов (свободных Т4 и Т3), антител к ткани щитовидной железы (Ат к тиреоглобулину и Ат к тиреопероксидазе), проведение УЗИ щитовидной железы. В случае выявления узлов щитовидной железы диаметром более 1 см, показано выполнение пункционной биопсии.
2. Функциональное офтальмологическое обследование при эндокринной офтальмопатии преследует цель уточнения зрительной функции. Функциональный блок включает:
- визометрию
- периметрию
- исследование конвергенции
- электрофизиологические исследования
- биометрические исследования глаза (экзофтальмометрия, измерение угла косоглазия) - позволяют определить высоту выстояния и степень отклонения глазных яблок
3. Методы визуализации направлены на морфлогическую оценку структур глаза. Включают следующие исследования:
- осмотр глазного дна (офтальмоскопия) производится для исключения развития нейропатии зрительного нерва
- биомикроскопия - с целью оценки состояния структур глаза
- тонометрия - выполняется для выявления внутриглазной гипертензии
- УЗИ, МРТ, КТ орбит) позволяют дифференцировать эндокринную офтальмопатию от опухолей ретробульбарной клетчатки.
4. Иммунологическое обследование. При эндокринной офтальмопатии чрезвычайно важным представляется обследование иммунной системы больного. Изменения клеточного и гуморального иммунитета при эндокринной офтальмопатии характеризуется снижением числа CD3+ T-лимфоцитов, изменением соотношения CD3+ и лимфоцитов, уменьшением количества CD8+T-cynpeccopoв; возрастанием уровня IgG, антиядерных антител; повышением титра Ат к ТГ, ТПО, АМАb (глазным мышцам), второму коллоидному антигену. По показаниям выполняется биопсия пораженных глазодвигательных мышц.
Экзофтальм при эндокринной офтальмопатии следует дифференцировать с псевдоэкзофтальмом, наблюдаемым при высокой степени близорукости, орбитальном целлюлите (флегмоне глазницы), опухолях (гемангиомах и саркомах орбиты, менингиомах и др.).
Лечение эндокринной офтальмопатии
Патогенетическая терапия
Лечебная тактика определяется стадией эндокринной офтальмопатии, степенью нарушения функции щитовидной железы и обратимостью патологических изменений. Все варианты лечения направлены на достижение эутиреоидного состояния.
- Иммуносупрессивная терапия. Включает назначение глюкокортикоидов (преднизолон), оказывающих противоотечное, противовоспалительное и иммуносупрессивное действие. Кортикостероиды применяются внутрь и в виде ретробульбарных инъекций. При угрозе потери зрения проводится пульс-терапия метилпреднизолоном, рентгенотерапия орбит. Использование глюкокортикоидов противопоказано при язвенной болезни желудка или двенадцатиперстной кишки, панкреатите, тромбофлебитах, артериальной гипертензии, нарушении свертываемости крови, психических и онкологических заболеваниях.
- Экстракорпоральная гемокоррекция. Методами, дополняющими иммуносупрессивную терапию, служат плазмаферез, гемосорбция, иммуносорбция, криоаферез.
- Коррекция функции ЩЖ. При наличии нарушений функции щитовидной железы проводится ее коррекция тиростатиками (при тиреотоксикозе) или тиреоидными гормонами (при гипотиреозе).
- Хирургическая тактика. При невозможности стабилизации функции щитовидной железы может потребоваться выполнение тиреоидэктомии с последующей ЗГТ.
Офтальмологическое лечение
Симптоматическая терапия при эндокринной офтальмопатии направлена на нормализацию метаболических процессов в тканях и нервно-мышечной передачи. В этих целях назначаются инъекции актовегина, прозерина, инстилляции капель, закладывание мазей и гелей, прием витаминов А и Е. Из методов физиотерапии при эндокринной офтальмопатии используется электрофорез с лидазой или алоэ, магнитотерапия на область орбит.
Возможное хирургическое лечение эндокринной офтальмопатии включает три типа офтальмологических операций:
- Декомпрессия орбиты. Направлена на увеличение объема глазницы и показана при прогрессирующей нейропатии зрительного нерва, выраженном экзофтальме, изъязвлениях роговицы, подвывихе глазного яблока и др. ситуациях. Декомпрессия орбиты (орбитотомия) достигается путем резекции одной или нескольких ее стенок, удаления ретробульбарной клетчатки.
- Операции на глазодвигательных мышцах. Показаны при развитии стойкой болезненной диплопии, паралитического косоглазия, если его не удается скорригировать призматическими очками.
- Операции на веках. Представляют большую группу разнообразных пластических и функциональных вмешательств, выбор которых диктуется развившимся нарушением (ретракцией, спастическим заворотом, лагофтальмом, пролапсом слезной железы, грыжей с выпадением орбитальной клетчатки и пр.).
Прогноз
В 1-2 % случаев наблюдается особо тяжелое течение эндокринной офтальмопатии, приводящее к тяжелым зрительным осложнениям или остаточным явлениям. Своевременное медицинское вмешательство позволяет добиться индуцированной ремиссии и избежать тяжелых последствий заболевания. Результатом терапии у 30% больных служит клиническое улучшение, у 60% - стабилизация течения эндокринной офтальмопатии, у 10% - дальнейшее прогрессирование заболевания.
Читайте также:
