Компенсаторная эмфизема при синдроме средней доли. Средостение при синдроме средней доли
Добавил пользователь Валентин П. Обновлено: 28.01.2026
СРЕДНЕЙ ДОЛИ СИНДРОМ — термин, принятый для обозначения изолированных поражений средней доли правого легкого различной этиологии, характеризующихся своеобразной рентгенологической симптоматикой.
В подавляющем большинстве случаев (ок. 98%) синдром средней доли развивается в связи с нарушением проходимости среднедолевого бронха при хронических воспалительных процессах или вследствие сдавления его увеличенными лимф, узлами, в частности при туберкулезном бронхадените (см.). Средней доли синдром не включает поражения средней доли, обусловленные развитием злокачественной опухоли.
Возникновение изолированных поражений средней доли правого легкого связано с ее анатомо-физиологическими особенностями: относительно небольшим диаметром среднедолевого бронха (см. Бронхи), своеобразным расположением многочисленных лимф, узлов вокруг его устья, сравнительно малым воздухонаполнением паренхимы доли. Этими особенностями объясняются трудности при откашливании содержимого или инородных тел, находящихся в среднедолевом бронхе, и частота нарушений вентиляционно-дренажной функции этого бронха.
Патоморфологически Средней доли синдром проявляется пневмонитом (см. Пневмонит), характеризующимся сочетанием ателектатических, экссудативно-пролиферативных, деструктивных, воспалительных и рубцовых процессов; при этом преобладает поражение интерстициальной ткани.
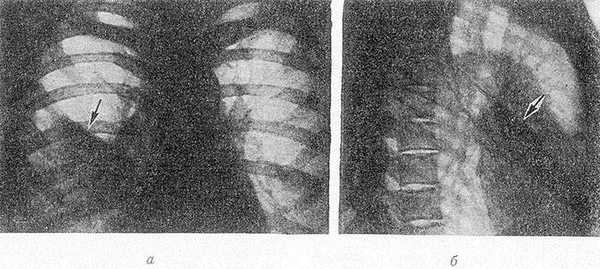
Рис. 1. Рентгенограммы грудной клетки в прямой (а) и правой боковой (б) проекциях при синдроме средней доли: тень пораженной средней доли указана стрелкой.
Рентгенологическое исследование — основной способ распознавания и дифференциальной диагностики изолированных поражений средней доли легкого. При С. д. с. на рентгенограмме грудной клетки в прямой проекции справа от IV ребра и спереди до диафрагмы обычно располагается неправильной формы затемнение с хорошо обозначенной верхней границей (рис. 1, а). На боковой рентгенограмме тень пораженной доли обычно имеет треугольную форму. Границы ее образованы междолевыми щелями; вершина тени направлена к корню легкого, а ее основание — к передней грудной стенке (рис. 1, б). При наличии бронхоэктазов (см.) или полостей распада в легочной ткани (см. Легкие) структура затемнения неоднородна, при цирротических изменениях форма его приближается к клиновидной или лентовидной. В экссудативно-инфильтративной фазе воспалительного процесса, в т. ч. и туберкулезной этиологии, тень пораженной доли обычно сохраняет гомогенный характер и правильную треугольную форму. Томография (см.) лучше, чем обычное рентгенол. исследование, позволяет установить форму тени, определить особенности ее контуров и структуру патологического очага. Послойное рентгенол. исследование наиболее информативно при наличии увеличенных лимф, узлов, участков деструкции, бронхоэктазов, обтурации среднедолевого бронха.
Для выявления патол. изменений в бронхиальном дереве при С. д. с. используют преимущественно бронхографию (см.). Результаты томографии и бронхографии в большинстве случаев позволяют дифференцировать разнообразные хронические воспалительные изменения в средней доле: бронхоэктазы, обострения пневмонита, фиброателектаз, хроническую пневмонию.
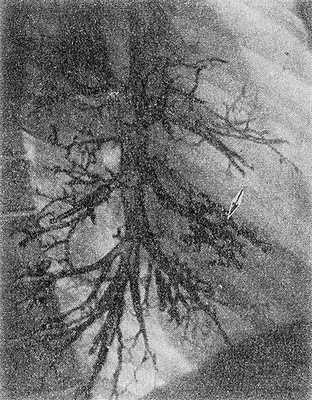
Рис. 2. Правосторонняя бронхограмма при синдроме средней доли (боковая проекция): бронхи средней доли (указаны стрелкой) сближены, деформированы, цилиндрически расширены но типу бронхоэктазов.
С. д. с., обусловленный изолированно развивающимся хроническим воспалительным процессом в средней доле, имеет следующие дифференциально-диагностические признаки: неоднородный, ячеистый характер тени, имеющей треугольную форму, смещение и деформация бронхиальных ветвей по типу хронического деформирующего бронхита (см.) и бронхоэктазов (рис. 2). На основании этих признаков его можно отличить от рака легкого. Стеноз среднедолевого бронха воспалительного характера, выявляемый с помощью направленной бронхографии, как правило, располагается на расстоянии 15—20 мм от начала бронха; это отличает его от стеноза, обусловленного бронхогенным раком, к-рый располагается почти у самого основания среднедолевого бронха. При бронхогенном раке отмечаются также бугристость, неровность контуров промежуточного и нижнедолевого бронхов, что подтверждается результатами бронхоскопии. Бронхоскопию (см.) необходимо проводить при подозрении на рак среднедолевого бронха. Последний встречается примерно у 3% всех больных раком легкого и у 17 —18% лиц с изолированным поражением средней доли.
В дифференциальной диагностике поражений средней доли и осумкованных междолевых плевритов решающее значение имеют данные бронхографии: при осумкованном плеврите (см.) контрастируются, как правило, неизмененный среднедолевой бронх с его сегментарными ветвями. Кроме того, на томограммах тень при междолевом плеврите имеет однородный характер, в то время как при острой или затянувшейся пневмонии (см.) на томограммах в боковой проекции видны просветы бронхиальных ветвлений.
Диагноз туберкулеза средней доли легкого (см. Туберкулез органов дыхания) может быть обоснован рентгенологически только в тех случаях, когда в паренхиме доли обнаруживаются очаговые тени, а в прилежащих отделах легкого — признаки диссеминации процесса.
Во всех диагностически неясных случаях показана бронхоскопия с биопсией.
Лечение и прогноз изолированного поражения средней доли легкого определяются обусловившим их заболеванием.
Библиография: Бессонова Г. С. Клинико-рентгенологические особенности среднедолевых и язычковых поражений легких, Врач, дело, № 10, с. 76, 1971; Иткина Р. Е. Синдром средней доли, Пробл. туб., № 11, с. 47, 1969; Коробов В. И. и Киприянова Н. В. О дифференциальной диагностике центрального рака и воспалительных поражений средней доли правого легкого, Вопр. онкол.,т. 16, № 5, с. 3,1970;
Розенштраух Л. С., Рыбакова Н. И. и Виннер М. Г. Рентгенодиагностика заболеваний органов дыхания, М., 1978; Шехтер А. И. Материалы к изучению изолированных поражений средней доли правого легкого, Вестн. рентгенол. и радиол., № 2, с. 34, 1963.
Синдром Маклеода ( Односторонняя легочная эмфизема , Сверхпрозрачное легкое , Синдром Свайра-Джеймса , Синдром Януса )
Синдром Маклеода - это хроническая патология с прогрессирующей гипоплазией и снижением плотности одного легкого или его доли, редукцией артериол, облитерацией мелких бронхов и буллезным изменением альвеол. Течение синдрома Маклеода сопровождается нарастающей экспираторной одышкой, устойчивым кашлем с непостоянной скудной мокротой, диффузными болями в груди, асимметрией грудной клетки, дыхательной недостаточностью. Диагностика синдрома Маклеода включает рентгенографию и КТ легких, бронхографию, сцинтиграфию легких, исследование ФВД. Для устранения патологического симптомокомплекса выполняется лобэктомия или пневмонэктомия.
МКБ-10
Общие сведения
Синдром Маклеода (синдром Свайра-Джеймса, синдром Януса, «сверхпрозрачное» легкое, односторонняя легочная эмфизема) - клинико-рентгенологический синдром, сопровождающийся уменьшением и прогрессирующими эмфизематозными изменениями доли или легкого целиком, поражением легочных артериол и бронхиол. В 1953 г. синдром был описан Swyer и James; в 1954 г. британский пульмонолог Macleod подробно нарисовал патогенез заболевания, а французский рентгенолог Janus представил рентгенологические признаки аномалии. Синдром Маклеода считается относительно редкой патологией (на 1966 г. было известно о 100 случаях заболевания), более часто выявляется у пациентов мужского пола. По комплексу проявлений синдром Маклеода входит в группу хронических обструктивных болезней легких (ХОБЛ). Изучение данной патологии находится в области интересов пульмонологии.
Причины
К формированию синдрома Маклеода приводят неоднократно перенесенные в раннем детстве (в первые 8 лет жизни) бронхолегочные заболевания, рецидивирующие тяжелые бронхиты и пневмонии, осложняющиеся постинфекционным облитерирующим бронхиолитом. Наиболее опасными в плане исхода в синдром Маклеода являются бронхиолиты, вызываемые РСВ, ЦМВ, аденовирусом, вирусом гриппа, парагриппа, микоплазмой, легионеллой, пневмоцистой. Наслоившаяся при этом вторичная инфекция провоцирует развитие бронхоэктазов.
Постинфекционные бронхиолиты в раннем детском возрасте протекают на фоне интенсивного развития альвеол из зародышевых терминальных и респираторных бронхиол, что способствует нарушению формирования паренхимы легких.
Патогенез
При синдроме Маклеода гистологически определяется повреждение бронхиолярных стенок, включающее гипертрофию желез, некробиоз слизистого эпителия, разрастание грануляций и подслизистого слоя с образованием микрополипов, а также перибронхиальный фиброз; разрывы альвеолярных перегородок, утолщение стенок ветвей легочной артерии и редукцию капиллярной сети. Иногда может иметь место картина панацинарной эмфиземы с отдельными субплевральными буллами, обструкцией артериол, расширением мелких бронхов с гипоплазией их стенок. Сохранить воздушность легкому помогает коллатеральная вентиляция через неповрежденные респираторные пути и поступление воздуха через поры Кона.
В большинстве случаев эмфизематозный процесс локализуется в левом легком; может охватывать весь орган или преимущественно поражать одну долю. Деформированное легкое практически не функционирует, резко уменьшается в объеме, теряет эластические свойства. Возникающее при этом смещение средостения приводит к значительному нарушению легочной циркуляции и вентиляции в здоровом легком, обеспечивающем основной газообмен.
Классификация
По этиопатогенетическим критериям различают циркуляционную, вентиляционную и циркуляционно-вентиляционную формы синдрома Маклеода.
- Циркуляционная форма обусловлена наличием односторонней сосудистой аномалии легких. Это может быть врожденное отсутствие (агенезия/аплазия) одной легочной артерии с компенсацией легочного кровообращения за счет системного кровообращения бронхов. Возможна также приобретенная патология легочной артерии вследствие ее острой эмболии и ишемии, постоперационного тромбоза, а также внешней компрессии сосуда внутригрудными лимфоузлами при туберкулезе.
- Вентиляционная форма синдрома Маклеода обусловлена наличием врожденных пороков развития респираторных отделов бронхиального дерева (гигантской обширной эмфиземы с бронхомаляцией, врожденных бронхоэктазий с дисгенезией дыхательных путей) или приобретенной бронхолегочной патологии (вторичной обструктивной эмфиземы в результате неполной закупорки крупного бронха опухолью или инородным телом; постинфекционной или компенсаторной эмфиземы; прогрессивной легочной дистрофии с деструкцией).
Развитие циркуляционно-вентиляционной формы синдрома Маклеода вызвано гипоплазией одной из легочных артерий. Это состояние наблюдается редко, имеет обычно длительное скрытое течение.
Симптомы
Заболевание протекает в хронической форме. Может иметь место бессимптомное или слабовыраженное течение. Проявления синдрома Маклеода неспецифичны, сходны с симптомами бронхита и БЭБ. Без видимых причин появляется экспираторная одышка, которая постепенно прогрессирует. Часто наблюдается устойчивый кашель с непостоянной скудной мокротой и диффузные боли в груди, заметна асимметрия грудной клетки. Выделение обильной мокроты гнойного характера указывает на вторичное инфицирование. Могут отмечаться периодические (связанные с ОРВИ) фебрильные эпизоды с усилением бронхиальных явлений и обструкции.
При врожденной артериовенозной мальформации и туберкулезе синдром Маклеода может сопровождаться кровохарканьем, приступами пароксизмального кашля, истерической одышкой с резко учащенным дыханием, риском асфиксии. Синдром Маклеода осложняется дыхательной недостаточностью, бронхиальной обструкцией различной выраженности, развитием бронхиальной астмы и декомпенсированного легочного сердца.
Диагностика
Диагностика синдрома Маклеода включает сбор анамнеза, осмотр, рентгенографию и КТ легких, бронхографию, радиоизотопное сканирование, исследование внешнего дыхания. В анамнезе больных синдромом Маклеода присутствуют частые случаи тяжелых бронхолегочных заболеваний. Визуально отмечается деформация грудной клетки с уменьшением объема на стороне поражения, перкуторно - смещение средостения в противоположную сторону, коробочный оттенок звука; аускультативно - асимметричное дыхание с ослаблением в области пораженного легкого, сухие рассеянные хрипы, кратковременные крепитирующие шумы, удлинение выдоха.
При проведении рентгенографии легких заметно выраженное одностороннее увеличение прозрачности («сверхпрозрачность») ткани легких и обедненный легочный рисунок с зонами, лишенными его целиком (крупные буллы). Точной идентификации тонкостенных буллезных формирований при синдроме Маклеода помогает инспираторная и экспираторная КТ легких. Исследование на выдохе показывает усиление выраженности изменений на этих участках - симптом «воздушной ловушки». Тень средостения на высоте вдоха отклоняется в сторону здорового легкого.
Бронхографически в эмфизематозном легком определяются признаки сужения периферических бронхов, свидетельствующие о деформирующем бронхите. Данные ангиопульмонографии указывают на одностороннее уменьшение диаметра ствола и ветвей легочной артерии, увеличение углов их расхождения, аплазию капиллярной сети.
Сцинтиграфия легких выявляет отсутствие абсорбции радиоизотопа пораженным легким. Исследование ФВД определяет специфические эмфизематозные изменения (увеличение OEЛ, уменьшение ЖЕЛ), признаки бронхиальной обструкции, дыхательной недостаточности по экспираторному типу. Дифференциальную диагностику синдрома Маклеода проводят с простой гипоплазией или эмфиземой легкого, бронхиальной астмой, ХОБЛ, осложненными спонтанным пневмотораксом.
Лечение синдрома Маклеода
Лечение определяется степенью клинических проявлений и темпами прогрессирования патологии. Для купирования дыхательной недостаточности и ассоциированных заболеваний показана госпитализация и симптоматическая терапия. При наслоении респираторных гнойно-воспалительных процессов используются антибиотики. Дополнительно проводятся кислородотерапия, ЛФК.
Оперативное вмешательство выполняется в случае резкого нарушения эмфизематозным легким газообменной функции здорового легкого или частых инфекционных осложнениях. Объем резекции сводится к лобэктомии или пневмонэктомии. Прогноз синдрома Маклеода определяется частотой бронхолегочных инфекций и уровнем развития дыхательной недостаточности, обычно считается неопределенным или неблагоприятным.
1. Синдром Свайра-Джеймса (синдром Маклеода)/ Беленокая О.И., Афанасьева Н.И., Юдина А.Л.// Радиология - практика. - 2009- №3.
2. Синдром Маклеода/ Павлович А.И., Джаппуев А.Д., Султанов И.Я., Завадская О.М.// Вестник Российского университета дружбы народов. Серия: Медицина. - 2001.
3. Adult diagnosis of Swyer-James-MacLeod syndrome: a case report/ C. Capela, P. Gouveia, M. Sousa, M. J. Regadas// Journal of Medical Case Reports. - 2011.
Синдром средней доли ( Среднедолевой синдром )
Синдром средней доли - это различные патологические процессы, приводящие к стенозу среднедолевого бронха и вторичным изменениям легочной ткани средней доли правого легкого. Синдром средней доли может протекать бессимптомно или сопровождаться субфебрилитетом, кашлем с небольшим количеством мокроты, кровохарканьем, болями в грудной клетке на стороне поражения. Решающее значение в диагностике синдрома средней доли имеют рентгенологические данные и эндоскопическая картина. В зависимости от причины среднедолевого синдрома и характера изменения легочной паренхимы может проводиться консервативное или хирургическое лечение.

Синдром средней доли - термин, употребляемый в практической пульмонологии для обозначения ряда патологических состояний, сопровождающихся ателектазом и уменьшением объема средней доли правого легкого. По данным различных авторов, среднедолевой синдром встречается у 0,33-6 % легочных больных, примерно в 2 раза чаще он обнаруживается у мужчин. Синдром средней доли является предварительным клинико-рентгенологическим диагнозом, требующим дальнейшего уточнения причин данного патологического процесса. Некоторые пульмонологи предлагают исключить из этого понятия случаи ателектаза, вызванные опухолевой обтурацией среднедолевого бронха. Между тем, на практике до проведения дифференциальной диагностики и определения этиологии изменений средней доли за данным термином может скрываться, в том числе и бронхогенный рак.
Выделение данного синдрома обусловлено относительно высокой частотой поражения этого участка правого легкого, что в свою очередь связано с анатомическими особенностями средней доли. По сравнению с другими долевыми бронхами, среднедолевой бронх имеет самый узкий диаметр и наибольшую длину, кроме этого при отхождении от промежуточного бронха он образует острый угол (примерно 30°). Также в непосредственной близости от среднедолевого бронха расположено большое количество бронхопульмональных лимфоузлов, при гиперплазии которых происходит его сдавление извне. Ввиду названных особенностей в средней доле легче всего происходит нарушение легочной вентиляции и бронхиальной проходимости.
Непосредственными причинами, приводящими к возникновению синдрома средней доли, могут служить острая или хроническая пневмония, абсцесс легких, деформирующий бронхит, брохоэктазы, бронхолитиаз, инородное тело бронха, туберкулез, саркоидоз легких, лимфогрануломатоз и др. Механизм развития синдрома средней доли обусловлен гиповентиляцией участка легочной ткани с последующим присоединением вялотекущего инфекционного процесса. Сужение просвета среднедолевого бронха, вызванное компрессией или воспалительным отеком, способствует частичному или полному ателектазу доли.
Симптомы среднедолевого синдрома
Клиническая картина зависит от характера патологических изменений средней доли. Последние могут быть представлены бронхоэктазами, обструктивным пневмонитом, пневмосклерозом и циррозом, фиброателектазом или гнойно-деструктивными процессами.
При наличии бронхоэктазий синдром средней доли протекает в форме гнойного бронхита. В периоды обострений повышается температура тела, усиливается кашель, увеличивается количество гнойной мокроты, иногда отмечается кровохарканье. При обзорной рентгенографии легких определяется усиление и деформация легочного рисунка, в нижних отделах легкого выявляются участки эмфиземы. При проведении бронхографии обнаруживаются мешотчатые или смешанные бронхоэктазы.
Клиника среднедолевого синдрома, протекающего по типу обструктивного пневмонита, напоминает таковую при пневмонии: лихорадка, сильная потливость, головная и мышечная боль, тахипноэ, кашель с рыжеватой мокротой, выраженная слабость. В целях дифференциальной диагностики необходимо выполнение томограмм и определение причины синдрома средней доли. В этом случае чаще всего ей оказывается бронхиолит или инородное тело бронха.
Пневмосклероз и цирроз средней доли обычно являются исходом ранее перенесенной пневмонии или туберкулеза. Данная форма синдрома средней доли чаще встречается у пожилых пациентов. Клиника вариабельна; большую часть больных беспокоят боли в грудной клетке, кашель с небольшим количеством мокроты, периодический субфебрилитет. На рентгенограммах средняя доля значительно уменьшена в объеме и определяется в виде неоднородного затемнения.
Фиброателектаз, как разновидность синдрома средней доли, встречается достаточно редко. Обычно диагноз устанавливается на основании рентгенологических данных. Характерный признак - симптом «ампутации» среднедолевого бронха, хорошо различимый на бронхограммах.
Гнойно-деструктивные процессы в средней доле правого легкого могут быть представлены хронической пневмонией или хроническим абсцессом. Течение такой формы синдрома средней доли сопровождается гипертермией, ознобом, кашлем с гнойной, иногда зловонной мокротой, воспалительными изменениями крови. Рентгенологически на фоне неоднородного затемнения доли определяется одна или несколько полостей.
Решающая роль в диагностике синдрома средней доли отводится рентгенологическим исследованиям (рентгенографии в 2-х проекциях, МРТ легких, бронхографии, КТ легких) и бронхоскопии. Рентгенологическим критерием служит уменьшение объема средней доли - она определяется в виде полоски шириной 2-3 см, тянущейся от корня легкого к реберно-диафрагмальному синусу. При проведении бронхоскопии удается выявить причину нарушения бронхиальной проходимости (внутрибронхиальную обструкцию или сдавление извне), обнаружить слизисто-гнойный или гнойный секрет в устье среднедолевого бронха, произвести биопсию и получить гистологическое подтверждение предположительного диагноза.
Различные варианты синдрома средней доли следует дифференцировать от центрального рака легкого, туберкулеза, междолевого плеврита. Реже возникает необходимость исключить целомическую кисту перикарда и абдомино-медиастинальную липому.
Лечение среднедолевого синдрома
Консервативное лечение синдрома средней доли возможно в случае клинически незначимых изменений, а также у пожилых пациентов или при наличии тяжелой сопутствующей патологии. В таких ситуациях в периоды обострения проводится антибиотикотерапия, лечебные бронхоскопии или санация трахеобронхиального дерева через трахеостому, лекарственные ингаляции, массаж грудной клетки.
При частых обострениях, неэффективности повторной консервативной терапии и выраженных изменениях средней доли (циррозе, деструктивных процессах и пр.) ставится вопрос о хирургическом лечении. Объем оперативного вмешательства зависит от характера поражения и может варьироваться от прецизионной резекции и лобэктомии до пневмонэктомии. Профилактика синдрома средней доли заключается в предупреждении и своевременном лечении первичного заболевания.
1. Синдром средней доли у ребенка/ Крючкова Т.А., Романова Т.А., Гудова И.В.// Научные ведомости. Серия Медицина. Фармация. - 2012 - №16(135).
Компенсаторная эмфизема при синдроме средней доли. Средостение при синдроме средней доли
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва
НИИ СП им. Н.В. Склифосовского
Спонтанная эмфизема средостения
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2010;(2): 47‑50
Абакумов М.М., Шамба Х.Л., Даниелян Ш.Н. Спонтанная эмфизема средостения. Хирургия. Журнал им. Н.И. Пирогова. 2010;(2):47‑50.
Abakumov MM, Shamba KhL, Danielian ShN. Spontaneous mediastinal emphysema. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2010;(2):47‑50. (In Russ.).
Эмфизема средостения, или пневмомедиастинум, - это патологическое состояние, заключающееся в инфильтрации воздухом клетчатки средостения [4].
Считается, что спонтанная эмфизема средостения (СЭС) - редкое, самостоятельное заболевание, характеризующееся доброкачественным течением и возникающее без определенных причин, оно поражает в основном мужчин молодого возраста [9, 19, 23, 36].
Первое упоминание о СЭС датировано 1617 г., когда акушерка королевы Франции Louise Bourgeois в своих воспоминаниях описала внезапно возникшую у нее при родах одутловатость шеи [12]. Данное патологическое состояние впервые описал Rene Laennec в 1819 г. в трактате «О выслушивании стетоскопом» [24]. О СЭС как о самостоятельном заболевании первым сообщил Louis Hamman [5, 10, 19, 23, 25] в 1939 г. Он описал грубую крепитацию, синхронную с сердечными сокращениями, которая аускультативно выслушивается вдоль левого края грудины в третьем-шестом межреберьях, не исключая и другие зоны, в положении сидя. Этот клинический симптом получил название симптома Хэммана.
Патофизиологию данного заболевания на основании экспериментов на лабораторных животных описали в 1944 г. M. Macklin и С. Macklin [5, 10, 23, 25]. В эксперименте на животных они показали, что СЭС возникает в результате резкого понижения градиента давления между альвеолами и межуточной тканью легких, что приводит к разрыву альвеол. Описанный механизм в сочетании с патологическими изменениями альвеоляро-капиллярной мембраны и/или интерстициальной ткани легких может привести к прорыву альвеолы в межуточное пространство [31]. Прорыв альвеолы в легочный интерстиций ведет к накоплению в нем воздуха, который распространяется вдоль градиента давления, периваскулярно и перибронхиально, центростремительно к воротам легких, а затем в средостение (эффект Macklin) [20]. Это происходит потому, что давление в средостении ниже, чем на периферии легких. Большинство авторов сходятся во мнении, что заболевание возникает в результате разрыва терминальных альвеол, расположенных в корне сегмента (доли) легкого и прилежащих к рыхлой клетчатке, окружающей сосуды и бронхи [5, 16, 23]. Оказавшись в средостении, воздух может распространяться на клетчаточные пространства шеи, мягких тканей грудной клетки, в полость сердечной сорочки и даже (в зависимости от количества) в забрюшинное клетчаточное пространство [8].
Частота СЭС у госпитализированных больных варьирует, по различным данным, от 1:3578 [16] до 1:44 511[25].
Существуют разные триггерные механизмы или факторы, способствующие возникновению СЭС. I. Macia и соавт. [25] считают целесообразным разделять эти факторы на: предрасполагающие - вредные привычки и/или заболевания в анамнезе, которые создают благоприятные для развития заболевания условия, и провоцирующие - состояния, которые непосредственно предшествуют возникновению СЭС.
К предрасполагающим факторам многие авторы относят такие легочные заболевания, как бронхиальная астма [5, 9, 16, 19, 25, 29], воспалительные заболевания верхних дыхательных путей [5, 19], идиопатические фиброзирующие заболевания легких [9], хронические обструктивные заболевания легких [9]. Из перечисленных выше заболеваний, согласно публикациям в мировой литературе, только бронхиальная астма рассматривается как предрасполагающий фактор в развитии СЭС практически всеми авторами [5, 9, 16, 19, 25, 29, 35, 36]. J. Chapdelaine и соавт. [11] установили это заболевание в анамнезе почти у 50% больных, A. Newcomb и C. Clarke [29] - у 39% пациентов с СЭС. Нужно отметить, что в мировой литературе авторы редко связывают развитие СЭС с буллезной эмфиземой легких. А.Г. Высоцкий [2] описал 4 наблюдения пневмомедиастинума как осложнения локальной буллезной эмфиземы легких. И.И. Платов и В.С. Моисеев [4] считают, что развитие СЭС связано с теми же причинами, которые приводят к развитию спонтанного пневмоторакса, а именно с буллезной болезнью, кистозными образованиями легких врожденного генеза, респираторными воспалительными заболеваниями.
Некоторые авторы полагают, что курение является предрасполагающим фактором в развитии заболевания [9, 25]. J. Macia и соавт. [25] сравнили количество курильщиков, больных СЭС, с количеством курильщиков среди населения Каталонии (Испания), что составило 34,1 и 37,5%, соответственно. I. Abolnik и соавт. [6] отметили, что количество курильщиков среди больных СЭС незначительно отличалось от таковых в общей популяции.
Описано много провоцирующих факторов, которые непосредственно могут вызвать развитие заболевания. Следует выделить пробу Вальсальвы, интенсивный кашель, чихание, сильную рвоту, истерический крик, роды, акт дефекации, физическую нагрузку, бронхоспазм, спирометрию, игру на духовых инструментах, надувание шаров, употребление ингаляционных наркотических веществ [1, 5, 9, 10, 18, 23, 25, 26, 28, 32].
Однако не всегда удается выявить предрасполагающие и/или провоцирующие факторы, СЭС нередко возникает в покое [9].
О разнообразии симптомов клинической манифестации СЭС сообщалось многими авторами [25, 36]. Чаще всего отмечается триада клинических симптомов - загрудинная боль (являющаяся самым частым и постоянным симптомом), затруднение дыхания, одутловатость шеи [1, 5, 15, 16, 19, 25, 29, 35, 36]. I. Abolnik и соавт. [6] отмечали наличие боли за грудиной у 88% больных СЭС, I. Macia и соавт. [25] - у 85%, M. Gerazounis и соавт. [16] - у 72,7%, G. Koullias и соавт. [23] - у 66,6%, M. Caceres и соавт. [9] - у 54% больных. Пациент также может предъявлять жалобы на боль в горле, спине, плече, пояснице, слабость, дисфагию, одинофагию, ринофонию, изменение тембра голоса. Некоторые авторы к симптомам заболевания относят и кашель, хотя он еще является и провоцирующим возникновение СЭС фактором [23]. М. Caceres и соавт. и G. Koullias и соавт. выделяли кашель как один из симптомов заболевания, он отмечался в 41 и 32% собственных наблюдений СЭС и являлся соответственно вторым и третьим по частоте симптомом после загрудинной боли [9, 23].
Симптом Хэммана нельзя назвать специфичным для СЭС, так как, по утверждению Ю.В. Халева [5], подобная крепитация может выслушиваться и при левостороннем пневмотораксе без медиастинальной эмфиземы, а также при буллезной эмфиземе язычковых сегментов, пневмоперитонеуме с высоким стоянием диафрагмы, расширении желудка. Распространенность симптома Хэммана у больных СЭС, по данным разных источников, варьирует от 0 до 56% [6, 9, 10, 15, 23, 25, 29, 36].
При пневмомедиастинуме у больных также могут иметь место уменьшение сердечной тупости, глухость сердечных тонов при аускультации. I. Abolnik и соавт. [6] у 2 больных СЭС отмечали наличие парадоксального пульса. У большинства больных может быть один или несколько симптомов, но иногда при объективном исследовании не удается выявить ни одного симптома [5].
Основными методами диагностики СЭС являются рентгенография груди в прямой и боковых проекциях, КТ груди и рентгеноконтрастное исследование пищевода.
A. Yellin и соавт. [36] указали на необходимость выполнения рентгенографии (как рутинного метода первичной диагностики) всем пациентам молодого возраста с болью в груди неясного генеза и затруднением дыхания. По данным многих авторов, этот метод исследования оказался информативным у абсолютного большинства больных СЭС [6, 16, 23, 36], при этом они подчеркивают необходимость выполнения исследования в двух проекциях - прямой и боковой, потому что при небольшом скоплении газа в средостении при обзорной рентгенографии груди в прямой проекции пневмомедиастинум может быть не выявлен [23, 25].
При возникновении пневмомедиастинума на рентгеновском снимке обнаруживаются полосы просветления или пузырьки газа, окружающие органы средостения, приподнимающие медиастинальную плевру и часто распространяющиеся на шею и/или грудную стенку [14].
S. Bejvan и J. Godwin [8] сообщают, что при рентгенографии в прямой проекции свободный газ в средостении часто выявляется по левому контуру сердца и покрывает внутреннюю поверхность медиастинальной плевры, создавая хорошо заметную плевральную линию латеральнее легочного ствола и дуги аорты. На рентгенограммах в боковой проекции свободный газ образует линии просветления вдоль контуров восходящей аорты, дуги аорты и ее ветвей, легочных артерий и трахеи с главными бронхами [8]. Газ также локализуется вдоль линии прикрепления диафрагмы к грудине, вдоль вилочковой железы и плечеголовных вен [13].
Полипозиционная рентгенография - основной и очень эффективный метод исследования при данном заболевании, но если имеется инфильтрация газом мягких тканей грудной стенки, то его информативность сводится практически к нулю. В таких ситуациях, а также в случае настороженности по отношению к заболеваниям с похожей клинической картиной и при необходимости установления причины заболевания, если рентгенологический метод недостаточен, целесообразно выполнение КТ груди [30]. T. Kaneki и соавт. [20] отметили, что у 30% пациентов с СЭС при рентгенографии не удалось выявить пневмомедиастинум, окончательный диагноз был установлен при КТ груди. G. Koullias и соавт. [23] выполняли КТ после первичного рентгенологического исследования всем 25 больным, хотя и считали рентгенографию «золотым стандартом» диагностики СЭС, так как оба этих диагностических метода в 100% наблюдений оказались информативными в отношении пневмомедиастинума. КТ, несомненно, наиболее эффективный метод диагностики пневмомедиастинума [20], так как с его помощью легко выявляется наличие газа в средостении и при поперечных сечениях хорошо определяется его анатомическая локализация. Однако следует отметить, что по простоте выполнения и лучевой нагрузке на пациента этот метод проигрывает рентгенографии, также не стоит забывать об экономическом аспекте. A. Newcomb и C. Clarke [29] считают, что если пневмомедиастинум определяется с помощью рентгенографии и нет подозрения на присутствие какого-либо грозного заболевания как причины этого патологического состояния, то можно ограничиться только этим методом диагностики.
В некоторых наблюдениях СЭС, приведенных в мировой литературе, выполнялось рентгеноконтрастное исследование пищевода. Этот дополнительный метод диагностики применялся в тех ситуациях, когда необходимо было исключить наличие такого опасного состояния, как разрыв пищевода. Используется водорастворимый контрастный препарат и/или взвесь бария сульфата [15, 16, 19, 36]. D. Weissberg [35] пользовался этим методом исследования с целью исключения разрыва пищевода, если возникновению СЭС предшествовала рвота.
В число дополнительных методов исследования при данном заболевании входят эзофагоскопия, бронхоскопия и электрокардиография. Эти методы являются вспомогательными и применяются для подтверждения диагноза СЭС в сомнительных ситуациях.
Дифференциальная диагностика СЭС проводится с заболеваниями сердечно-сосудистой (острый коронарный синдром, перикардит), дыхательной (спонтанный пневмоторакс, эмболия легочной артерии, перфорация трахеобронхеального дерева) и пищеварительной (спонтанный разрыв пищевода) систем [32].
По мнению зарубежных авторов [15, 25, 29, 35, 36] оптимальные сроки стационарного наблюдения и лечения больных СЭС составляют от 2 до 5 дней.
Описаны единичные наблюдения рецидива СЭС [16, 25]. Первыми в литературе рецидив заболевания описали A. Yellin и соавт. [36], они наблюдали пациентов в течение 52 мес после выписки из стационара, повторное возникновение эмфиземы средостения у одного пациента произошло через 14 мес после первого эпизода без предрасполагающих причин.
Таким образом, спонтанная эмфизема средостения является заболеванием, поражающим чаще молодых мужчин трудоспособного возраста. Ее возникновение требует дифференциальной диагностики с рядом серьезных патологических состояний. В редких ситуациях напряженная эмфизема средостения может привести к гемодинамическим и дыхательным нарушениям.
Клинические проявления эмфиземы средостения наблюдаются при самых различных патологических состояниях, таких как острый коронарный синдром, эмболия легочной артерии, спонтанный пневмоторакс, перфорация пищевода и трахеобронхиального дерева, синдром Boerhaave (спонтанный разрыв пищевода) [10]. Поздняя диагностика и позднее лечение этих заболеваний может привести к развитию серьезных осложнений и смерти пациентов.
Цель публикации - анализ клинической картины, диагностики и лечения спонтанной эмфиземы средостения.
Материал и методы
В отделении неотложной торакоабдоминальной хирургии НИИ СП им. Н.В. Склифосовского с марта 1993 г. по февраль 2010 г. проходили лечение 104 пациента СЭС, в среднем поступали 6 пациентов в год. Мужчин было 77 (74%), женщин - 27 (26%). Средний возраст больных составил 26,8 года (от 15 до 73 лет). В возрасте до 25 лет включительно было 65 (62,5%) больных.
Из других лечебных учреждений были переведены 54 (52%) пациента, 33 (31,7%) пациента доставлены бригадой скорой медицинской помощи (СМП), 17 (16,3%) обратились самостоятельно. Время от появления клинических симптомов до поступления пациентов в стационар варьировало от 2 ч до 4 сут (в среднем 21 ч). У одного пациента, доставленного бригадой СМП с подозрением на желудочно-кишечное кровотечение, СЭС возникла в ходе выполнения фиброэзофагогастродуоденоскопии (ФЭГДС).
Результаты и обсуждение
Наблюдавшиеся нами больные чаще всего предъявляли жалобы на боль в груди - 45 (43,3%), боль в области шеи, в том числе боль и чувство распирания в глотке при глотании, - 44 (42,3%). На затруднение дыхания и одышку жаловались 32 (30,8%), на кашель - 13 (12,5%) больных.
При физикальном обследовании почти у всех больных отмечалась подкожная эмфизема на шее (96,2%), только у 4 больных она отсутствовала. Распространение подкожной эмфиземы на грудную стенку, в основном ее верхние отделы, отмечалось у 39 (37,5%) пациентов. Обширная эмфизема с распространением на несколько анатомических областей (брюшную стенку, верхние и нижние конечности, лицо) наблюдалась у 3 пациентов. Частым симптомом заболевания оказалась гнусавость или осиплость голоса, которая встретилась у 34 (32,7%) пациентов.
Повышенная температура тела в первые сутки госпитализации была у 52 (50%) больных, в абсолютном большинстве наблюдений она носила субфебрильный характер. У 12 пациентов отмечалась гипертермия выше 38° С, что было связано с сопутствующей пневмонией (6 пациентов), обострением хронического бронхита (3), плевритом на фоне двустороннего спонтанного пневмоторакса (1). У 2 пациенток повышение температуры тела наблюдали после гинекологической операции и родов.
Изменений в клиническом и биохимическом анализах крови не было, за исключением повышения количества нейтрофилов у 24 (23%) из 104 пациентов.
Трудности дифференциальной диагностики клинических проявлений СЭС с наиболее опасными заболеваниями и повреждениями (в первую очередь с инструментальными и спонтанными разрывами пищевода) заключаются в том, что как у больных с СЭС, так и у больных с разрывами пищевода провоцирующие факторы являются одинаковыми. Так, послервотный разрыв пищевода (postemetic esophageal rupture), который некоторые авторы причисляют к разновидности спонтанного разрыва, возникает после рвоты, и одним из его признаков является эмфизема мягких тканей шеи и средостения [3]. Провоцирующими факторами спонтанных разрывов пищевода, также как и СЭС, являются кашель, физическое напряжение [8].
Особо следует подчеркнуть сложность, а порой и невозможность клинической дифференциальной диагностики СЭС с разрывом трахеи и пищевода как осложнений эндотрахеальной интубации и фиброэзофагоскопии. Как известно, при выполнении этих инструментальных манипуляций без достаточной премедикации и обезболивания у больного может наблюдаться физическое сопротивление, которое приводит к разрыву буллезно-измененной легочной ткани и возникновению СЭС. Но для того, чтобы прийти к такому заключению, врач обязан в первую очередь исключить более опасное и более частое осложнение - ятрогенное повреждение трахеи, глотки или пищевода (см. рисунок). Рисунок 1. Рентгенограмма больного с инструментальным разрывом пищевода (а). Рисунок 1. Рентгенограмма больного с спонтанной эмфиземой средостения (б).
Всем больным при поступлении в приемное отделение выполняли рентгенографию груди, у 99 (95,2%) больных отмечалась рентгенологическая картина эмфиземы мягких тканей шеи и грудной стенки разной степени выраженности, при этом эмфизема средостения была выявлена у 81 из 99 пациентов, что составило около 80%. Трудности рентгенодиагностики эмфиземы средостения у 18 пациентов были связаны с наличием обширной эмфиземы мягких тканей грудной стенки, экранирующей средостение. У 5 пациентов, поступивших более чем через сутки от начала заболевания, рентгенологических признаков эмфиземы не было выявлено. Диагноз установлен при последующей компьютерной томографии (КТ).
Рентгеноконтрастное исследование пищевода с целью исключения его повреждения выполнено 98 (94,2%) больным, при этом данных о наличии травмы пищевода не получено (см. рис. 1, б).
КТ груди выполнена 41 (39,4%) пациенту в сроки 1-7 сут от начала заболевания, при этом чувствительность метода составила 100%. У 2 пациентов с рентгенологически подтвержденным диагнозом СЭС к моменту КТ-исследования, которое выполнялось для исключения заболеваний легких (позже 10 сут), пневмомедиастинум уже не был обнаружен. Следует подчеркнуть, что буллезные изменения легких при КТ выявлены лишь у 4 (9,7%) из числа обследованных пациентов с СЭС. Возможно, разрешающая способность КТ не позволила обнаружить буллезные изменения диаметром менее 5 мм. У 3 больных при первичной КТ высказано подозрение на дефект стенки трахеи, который был исключен при повторном исследовании. У одного больного в области верхушек легких выявлены утолщение плевры и плевродиафрагмальные спайки с обеих сторон.
ФЭГДС для исключения повреждения пищевода выполнена 12 (11,5%) пациентам. Подозрение на травму трахеи явилось показанием к диагностической фибротрахеобронхоскопии у 8 (7,7%) больных. Во всех наблюдениях диагноз травмы пищевода и трахеи был отвергнут.
При анализе причин возникновения СЭС мы выделили: 1) предрасполагающие факторы (предсуществующие заболевания легких, на фоне которых возникла СЭС); 2) провоцирующие факторы (явившиеся непосредственной причиной развития данного синдрома).
Сопутствующие заболевания легких диагностированы у 35 (33,6%) пациентов. Чаще всего предрасполагающими факторами, на фоне которых возникла СЭС, являлись бронхиальная астма - у 13 (12,5%) больных и хронический бронхит - у 12 (11,5%), пневмония имелась в 6 наблюдениях, буллезная эмфизема легких - в 4, пневмосклероз - в 2, ожог дыхательных путей - в 1 и идиопатический фиброзирующий альвеолит - в 1 наблюдении. У 4 больных имело место сочетание двух заболеваний.
Провоцирующие факторы определены у 68 (65,4%) пациентов: кашель - у 22 (32,3%), рвота - у 17 (25%), приступ бронхиальной астмы - у 9 (13,2%), физическая нагрузка - у 6, интубация трахеи - у 5, ФЭГДС - у 4, прием пищи - у 4, роды - у 1.
Всем больным после обследования была назначена консервативная терапия, которая оказалась эффективной в 100 (96,2%) наблюдениях. Консервативные методы лечения включали постельный режим, обезболивающие, нестероидные противовоспалительные препараты. Антибактериальную терапию (в основном препаратами пенициллинового или цефалоспоринового ряда, таких как ампициллин, оксациллин, ампиокс, цефазолин) проводили 60 (57,7%) пациентам с первых часов госпитализации до подтверждения диагноза СЭС, после чего она была отменена у всех больных, за исключением тех, у которых имелись воспалительные явления в легких.
Сроки разрешения эмфиземы средостения рентгенологически установлены у 46 (44,2%) больных и составили в среднем 5,6 дня (от 1 до 12 дней), 36 (34,6%) больных выписаны с остаточной эмфиземой средостения и/или мягких тканей шеи при отсутствии клинических признаков заболевания и с положительной рентгенологической динамикой. Данное исследование за период госпитализации выполнялось в среднем 3 раза.
Присоединение к СЭС пневмоторакса в 3 наблюдениях и неэффективность консервативной терапии в 1 явились показанием к дренированию плевральных полостей и средостения (что составило 3,8% наблюдений). Следует отметить, что в этих наблюдениях СЭС развилась у больных без спаечного процесса в плевральных полостях, что обусловило одновременное возникновение СЭС и спонтанного пневмоторакса. При этом у 3 больных спонтанный пневмоторакс был двусторонним, что потребовало экстренного дренирования обеих плевральных полостей. У четвертого пациента наличие выраженных легочных изменений, правостороннего пневмоторакса и прогрессивно нарастающей массивной эмфиземы средостения, мягких тканей шеи, груди и живота явилось показанием к дренированию правой плевральной полости и переднего средостения. Этот пациент умер, несмотря на интенсивное лечение.
Больной С., 22 лет, переведен 30.03.02 из терапевтического отделения одной из больниц Москвы, где он проходил лечение по поводу ангионевротического отека, хронической обструктивной болезни легких, инфекционно-аллергической формы бронхиальной астмы. На догоспитальном этапе за медицинской помощью не обращался, лечился самостоятельно бесконтрольным приемом нестероидных противовоспалительных препаратов, β-блокаторов. В городской больнице в течение суток проводилась интенсивная терапия, однако в связи с резким ухудшением состояния и появлением подкожной эмфиземы мягких тканей шеи, груди и живота, эмфиземы средостения, установленной при рентгенологическом обследовании, переведен в НИИ СП им. Н.В. Склифосовского с подозрением на спонтанный разрыв пищевода. При поступлении состояние крайне тяжелое. Отмечена выраженная эмфизема шеи, лица, груди, верхних конечностей с нарастающей дыхательной недостаточностью. При рентгенографии груди обнаружена обширная эмфизема мягких тканей, данных о наличии пневмогидроторакса нет. Рентгеноконтрастное исследование пищевода: повреждений нет. КТ груди: эмфизема мягких тканей шеи, груди, пневмомедиастинум (объемом 225 см 3 ), минимальный правосторонний пневмоторакс (объемом 160 см 3 ), правосторонний гидроторакс (16 см 3 ), буллезные изменения верхушки правого легкого. При фибробронхоскопии эвакуировано большое количество вязкой гнойной мокроты. В связи с нарастанием дыхательной недостаточности выполнена интубация трахеи, больной переведен на искусственную вентиляцию легких (ИВЛ). Несмотря на проведение бронхолитической, антибактериальной терапии, введение глюкокортикостероидов и ингаляцию увлажненного кислорода, состояние больного прогрессивно ухудшалось (рО2 13,3 мм рт.ст., рСО2 111,2 мм рт.ст.). В связи с невозможностью исключить экстраперикардиальную тампонаду сердца выполнено дренирование переднего средостения и правой плевральной полости, после чего состояние пациента улучшилось (ЧД 20 в 1 мин, ЧСС 120 в 1 мин, АД 140/80 мм рт.ст., рО2 87 мм рт.ст., рСО2 66,8 мм рт.ст.). ИВЛ продолжалась в течение 5 сут, проводилась инфузионная, бронхолитическая, глюкокортикостероидная, антибактериальная, оксигенотерапия, санационные фибробронхоскопии. Постепенно эмфизема средостения и мягких тканей практически исчезла, дренажи из средостения и плевральной полости удалены. Больной переведен на спонтанное дыхание через интубационную трубку на 5-е сутки, однако к этому времени стали нарастать клинико-рентгенологические признаки двусторонней пневмонии. Отмечалось прогрессирование дыхательной недостаточности, что потребовало повторного перевода его на ИВЛ, развилась абсцедирующая пневмония. Смерть больного наступила 16.04 от интоксикации на фоне сердечно-легочной недостаточности. На аутопсии: бронхиальная инфекционно-аллергическая гормонально-зависимая астма, хронический обструктивный гнойный бронхит в стадии обострения, диффузный сетчатый пневмосклероз, хроническая диффузная обструктивная эмфизема с формированием булл по передним краям легких, множественные бронхиолоэктазы в нижних долях легких с формированием абсцессов, крупноочаговая сливная двусторонняя пневмония, «хроническое легочное сердце», выраженная дистрофия миокарда, общее венозное полнокровие, жировая дистрофия печени, отек легких, головного мозга. Таким образом, причиной смерти больного был комплекс тяжелых заболеваний легких, на фоне которых спонтанная эмфизема средостения не играла ведущей роли, но ее возникновение создало дополнительные трудности в диагностике и лечении основного заболевания.
Продолжительность пребывания больных в стационаре варьировала от 1 до 44 сут и в среднем составляла 9 койко-дней. Один пациент провел в институте 105 дней. Течение заболевания у него характеризовалось быстрым прогрессированием двусторонней пневмонии и развитием дыхательной недостаточности, несмотря на проводимую интенсивную терапию, в связи с чем были выполнены оротрахеальная интубация и перевод больного на ИВЛ. На этом фоне возникла массивная эмфизема средостения, осложненная двусторонним пневмотораксом, что явилось показанием к дренированию обеих плевральных полостей. После дренирования плевральных полостей эмфизема средостения и мягких тканей разрешилась, однако отмечалось прогрессирование пневмонии с формированием множественных внутрилегочных воздушных полостей, развитие рецидивирующего двустороннего пневмоторакса, осложненного правосторонней эмпиемой плевры с бронхоплевральным свищом, сепсиса. В комплексе интенсивного лечения проводилась антибактериальная терапия с учетом чувствительности микроорганизмов, выделенных при посевах крови (золотистый стафилококк, кандиды), мокроты, отделяемого по дренажам, выполнялось многократное дренирование плевральных полостей, аспирационно-промывное лечение эмпиемы плевры. В первые дни заболевания было проведено обследование на вирусы гриппа А и В - результат отрицательный. После длительного комплексного интенсивного лечения пневмония, эмпиема плевры купированы, признаки дыхательной недостаточности регрессировали, посевы крови стерильные. Больной выписан в удовлетворительном состоянии с остаточными пневматоцеле.
Клинические сроки разрешения эмфиземы средостения установлены у 76 (73%) пациентов и составили в среднем 6,2 сут (от 2 до 15 сут). Рецидивирующий характер течения заболевания отмечен у 2 больных: один из них дважды в течение 8 мес проходил лечение в Институте, у другого в анамнезе за 15 мес до поступления имелись схожие симптомы, он лечился амбулаторно.
Таким образом, спонтанная эмфизема средостения чаще всего встречается у мужчин в возрасте до 30 лет, страдающих бронхиальной астмой и хроническим бронхитом. Провоцирующим фактором спонтанной эмфиземы средостения является физическое напряжение во время кашля, рвоты или инструментального исследования. Диагностика спонтанной эмфиземы средостения основана на исключении инструментального разрыва трахеи и бронхов, инструментального или спонтанного разрыва пищевода. Показания к хирургическому лечению при спонтанной эмфиземе средостения возникают не более чем в 4% наблюдений и заключаются в адекватном дренировании средостения и (по показаниям) плевральных полостей.
Читайте также:
