Комплемент. Воздействие токсинов на систему комплемента
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Краткое описание исследования «Компоненты системы комплемента С3, С4»
Система комплемента (от лат. Complementum - дополнение) термин, введённый в 1899 П. Эрлихом и Ю. Моргенротом.
С3 - центральный компонент системы комплемента, белок острой фазы воспаления. Это важнейшая часть защитной системы против инфекций. Он образуется в печени, макрофагах, фибробластах, лимфоидной ткани и коже. Поэтому нарушение их нормального состояния существенно влияет на этот комплемент. С3 составляет около 70% всех белков системы комплемента. Молекулярная масса около 180 000 Да. С3 компонент комплемента участвует как в классическом, так и в альтернативном пути активации системы комплемента. В классическом пути его образование активируется IgG и IgM, в альтернативном пути токсинами, включая эндотоксин, и IgA. Скорость синтеза приблизительно 1 мг/кг массы тела за один час. Скорость катаболизма составляет примерно 2% всего его объёма в плазме за один час, полупериод жизни 60-80 часов. Активация С3 способствует выделению гистамина из тучных клеток и тромбоцитов, поддерживает фагоцитоз, усиливает проницаемость стенок сосудов, усиливает сокращение гладкой мускулатуры, хемотаксис лейкоцитов и соединение антител с антигеном; играет важную роль в развитии аутоиммунных заболеваний. Содержание С3 снижается вследствие его потребления при классическом и альтернативном пути активации системы комплемента. С4 - гликопротеин с молекулярной массой 205 000 Да. Синтезируется в лёгких и в костях. Участвует только в классическом пути активации системы комплемента.
С4 поддерживает фагоцитоз, увеличивает проницаемость стенки сосудов, участвует в нейтрализации вирусов. Его снижение в крови наблюдается при активном потреблении, связанном с классическим путём активации системы комплемента.
С какой целью определяют уровень С3 и С4 компонентов системы комплемента в крови
Данное исследование проводят при диагностике аутоиммунных заболеваний, повторных бактериальных инфекций. Тест можно также использовать для динамического наблюдения пациентов с системными аутоиммунными заболеваниями (снижение концентрации компонентов комплемента коррелирует с активностью процесса).
Иммунная система Часть 7 Антитела, комплемент
Иммунная система работает, чтобы уничтожить антигены, используя иммунные клетки и особые молекулы. Завершение иммунного ответа происходит, когда антиген изолирован или уничтожен. Память о нем сохраняется для быстрой реакции при новой встрече.
Антитела
Антитела - главный молекулярный компонент гуморального иммунного ответа. Они секретируются плазматическими клетками, образованными из В-лимфоцитов. Распознают последовательности белков, полисахаридов и других структур конкретного антигена, точно соединяются с ним по поверхностным свойствам, подходя как ключ к замку. Благодаря наличию сходных структур, один и тот же вид антител перекрестно реагирует на разные антигены. По строению антитела представляют собой иммуноглобулины Ig нескольких классов.
Иммуноглобулин М IgM - первый вид антител, который формируется после встречи с новым антигеном. Циркулируя по крови, он связывает антиген и активирует комплемент, облегчая фагоцитоз. Каждый IgM связывает много антигенов, но эти связи непрочные. Он неидеально подходит к замку и больше похож на грубую заготовку ключа, поэтому часто бывают перекрестные реакции с другими антигенами.
Иммуноглобулин G IgG является наиболее распространенным иммуноглобулином в крови, но обнаруживается и в тканях. Это единственный иммуноглобулин, который проходит через плацентарный барьер во время беременности, обеспечивая иммунную защиту новорожденного в первые месяцы жизни. Для его формирования в первичном иммунном ответе требуется несколько дней и активная поддержка Т-лимфоцитов. Этот ключик более отточенный, причем чем больше проходит времени, тем идеальнее он подходит к замку. Свойство «идеальности» связывания с антигеном называется авидность. Именно поэтому при повторной встрече, высокоавидные IgG действуют более эффективно и быстро.
Иммуноглобулин А IgA присутствует в небольшом количестве в крови, но работает преимущественно в виде секреторного sIgA на поверхностях слизистых оболочек и в секретах (слюна, слезная жидкость, молозиво).
Иммуноглобулин D IgD связан с IgM на поверхности молодых В-лимфоцитов. Его уровни в крови очень низкие, а функция не известна.
Иммуноглобулин Е IgE присутствует в крови, на слизистых оболочках дыхательных путей и желудочно-кишечного тракта в небольшом количестве. Он обладает высоким сродством к рецепторам тучных клеток и базофилов. Если антиген взаимодействует с IgE на поверхности этих клеток, происходит их дегрануляция. Это выход содержимого гранул клеток, вызывающих острую аллергическую воспалительную реакцию.
Система комплемента
Система комплемента - это особый тип молекул (белки, ферменты и их предшественники), которые помогают в иммунном ответе. Система комплемента связывает врожденный и приобретенный иммунитет, т.к. участвует в фагоцитозе, выработке антител, уничтожении чужеродных клеток.
Компоненты системы комплемента выполняют множество функций: стимулируют хемотаксис (направленное движения лейкоцитов к антигенам), запускают дегрануляцию тучных клеток независимо от связывания антигена с IgE, помогают фагоцитирующим клеткам связывать антигены (опсонизация) и многое другое. Компоненты комплимента обозначаются буквой С и цифрой, обозначающей очередность их открытия (от С1 до С9), просто буквами (фактор B, фактор D) или имеют название (пропердин).
Активация комплимента происходит под действием иммунных комплексов, образованных связками антиген-антитело, либо же в ответ на крупные антигены и белки острой фазы.
Врожденный и приобретенный дефицит компонентов комплемента существенно снижает устойчивость организма к инфекционным агентам.
Белки воспаления
Воспаление - это местная и общая реакция организма в ответ на раздражитель. Его цель устранить причину повреждения и восстановить ткань в месте повреждения. Раздражители бывают механическими (травма), химическими (ожог, кислоты), инфекционными (бактерии, вирусы и их токсины), иммунными (комплексы антиген-антитело, комплемент).
Белки острой фазы - белки плазмы, уровень которых резко повышается или, в некоторых случаях, понижается при ответе на поражение тканей. Образуются они преимущественно в печени под действием высоких уровней ИЛ-1, ИЛ-6, ФНО-альфа в крови. Наиболее резко повышаются уровни:
Альфа-1 кислого гликопротеина
Сывороточного Р-компонента амилоида
Они повышаются через несколько часов после начала воспаления, способствуют активации комплемента, облегчают фагоцитоз, помогают ограничивать повреждение тканей, повышают сопротивляемость организма к инфекциям, способствуют заживлению тканей и прекращению воспаления. Альфа-1-кислый гликопротеин также является транспортным белком.
К белкам острой фазы воспаления относят фибриноген, ферритин, гаптоглобин, церулоплазмин и другие белки. Например, фибиронген помимо основной функции формирования тромба и остановки кровотечения, которые способствуют заживлению тканей, способен также усиливать фагоцитоз. Уровни фибриногена увеличиваются при воспалении и являются основной причиной повышения скорости оседания эритроцитов (СОЭ) в анализах.
Измерение уровней белков острой фазы указывают на воспаление, инфекцию или травму, но не помогают определить причину их возникновения.
В крови содержится еще много других молекулярных компонентов, которые участвуют так или иначе в воспалении и иммунном ответе. Дисбаланс их работы способствует либо чрезмерному ответу с поражением собственных тканей, развитием аутоиммунной патологии, либо наоборот, слабому ответу с развитием хронического воспалительного процесса.
Система комплемента: молекулярные основы и клиническое значение

Система комплемента — комплекс белков, постоянно присутствующих в крови, которые выполняют ряд важнейших функций. На данный момент комплекс насчитывает более трех десятков белковых молекул, среди которых основные белки — С1, С2, …, С9, а также ряд белков-регуляторов. Комплемент принято относить к факторам врожденного иммунитета, выполняющим защитную функцию, однако при определенных обстоятельствах сбой работы системы комплемента может стать звеном патогенеза некоторых заболеваний.
Вначале разберем механизмы работы системы комплемента, после чего рассмотрим их клиническое значение.
Активация системы комплемента
Существует три пути активации данной системы: классический, альтернативный и лектиновый. Все они приводят к ключевому событию: формированию С3-конвертазы.
В классическом варианте комплемент активируется через IgG и IgM, которые формируют иммунные комплексы с антигенами. Комплекс С1 (состоящий из q, r и s субъединиц) связывается с Fc-фрагментом иммуноглобулина. Происходит активация C1, комплекс приобретает протеолитическую активность и активирует C4 и C2. Последние формируют ключевой ферментативный комплекс — С3-конвертазу.
При альтернативном пути активация комплемента происходит без участия антител. Инициируют его поверхностные молекулы микробов и их внеклеточные структуры — например, углеводороды, полисахариды и т. д. С3 в клетках постоянно (даже когда нет активации системы комплемента) претерпевает диссоциацию на С3а и С3b, но в очень малых количествах.
Когда в клетке появляется инициирующий фактор (предположим, это бактерия), С3b связывается с ее поверхностными молекулами. К этому комплексу присоединяются другие молекулы-регуляторы: фактор В, фактор D, пропердин. Так появляется еще одна форма С3-конвертазы.
Лектиновый путь активируется через лектин, связывающий маннозу (фактор врожденного иммунитета — MBL) или группу лектинов Ficolin, которые связывают молекулы на поверхности патогенов — дрожжей, бактерий, паразитов и вирусов. MBL и Ficolin постоянно циркулируют в крови в виде MBL-ассоциированного комплекса (MASP). Когда MASP связывается с вышеназванными молекулами, комплекс претерпевает изменения конформации и активирует уже знакомый путь C4 и C2, что приводит к формированию С3-конвертазы, как и в классическом случае.
Итак, вне зависимости от пути активации различия оканчиваются на формировании ключевого фермента — С3-конвертазы. Последняя расщепляет С3 на два фрагмента: С3а и С3b. Отметим, что С3b выполняет функцию опсонина, С3а — анафилотоксин, способный воздействовать на тучные клетки с высвобождением гистамина.
Однако С3b также способен присоединиться к С3-конвертазе и модифицировать ее, превратив в С5-конвертазу. Этот фермент проделывает то же самое с С5, образуя С5а и С5b. По аналогии, С5а — анафилотоксин, С5b — опсонин.
И снова С5b присоединяется к С5-конвертазе, вовлекая в каскад С6-С9 с формированием т. н. мембраноатакующего комплекса (MAC) [1].
.
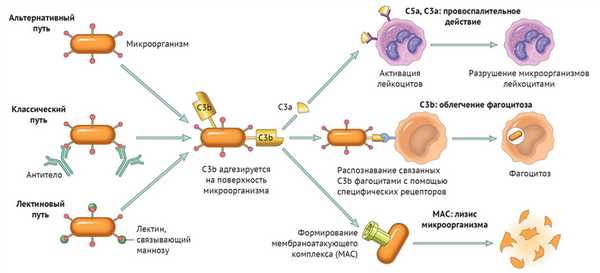
Любой из трех путей активации системы комплемента приводит к формированию С3-конвертазы, которая расщепляет С3-компонент на С3а и С3b. Последний участвует в опсонизации патогенов и облегчает таким образом фагоцитоз, а также инициирует каскад формирования МАС. С3а вместе с С5а (и в меньшей степени С4а) — побочные продукты реакций, которые обладают провоспалительным действием («Robbins Basic Pathology», 10nd ed — 2018, p 76).
Таким образом, систему комплемента можно разделить на три функциональные группы: анафилотоксины, опсонины и мембраноатакующий комплекс — МАС.
.

Анафилотоксины
К ним относятся С3а, С4а и С5а. В целом, их роль сводится к провоспалительному действию, что выражается в повышении проницаемости сосудов микроциркуляторного русла (МЦР), вазоконстрикции. В нейтрофилах, эозинофилах и макрофагах анафилотоксины инициируют респираторный взрыв, в базофилах и тучных клетках — высвобождение гистамина. Кроме того, анафилотоксины регулируют синтез эозинофильного катионного белка, адгезию и хемотаксис эозинофилов [2].
В здоровом организме роль анафилотоксинов по большому счету этим и ограничивается. Однако в случае реакций гиперчувствительности данные молекулы могут стать ключевым звеном патогенеза. Одним из наиболее ярких примеров является бронхиальная астма.
Эпителий и гладкомышечные клетки дыхательных путей содержат рецепторы к анафилотоксинам — C3aR и C5aR. При аллергических реакциях происходит активация системы комплемента, который в свою очередь активирует иммунокомпетентные клетки (ИКК), среди которых — нейтрофилы, эозинофилы, макрофаги, дендритные клетки. Последние под влиянием стимула (например, аллергена) способны в свою очередь вновь активировать комплемент — так замыкается порочный круг.
Помимо поддержания системного воспаления, анафилотоксины ответственны и за ремоделирование дыхательных путей. Под их влиянием происходит гиперплазия мерцательного эпителия и гладкомышечных клеток, неоваскуляризация и фиброзирование паренхимы [3,4].
Также анафилотоксины играют важную роль в патогенезе синдрома системного воспалительного ответа (SIRS). При сепсисе, когда микробы в больших количествах попадают в кровоток, происходит системная активация цитокинов, хемокинов и, конечно, системы комплемента. Повышение концентрации анафилотоксинов при сепсисе, к слову, считается неблагоприятным прогностическим фактором [5].
В случае с сепсисом и SIRS анафилотоксины становятся звеном патогенеза. Наибольшая роль в данной ситуации принадлежит С5а. Предположительно, избыточный синтез этого белка приводит к дисфункции нейтрофилов, апоптозу лимфоидных клеток, способствует развитию кардиомиопатий, ДВС-синдрома и полиорганной недостаточности.
В связи с этим постепенно разрабатываются препараты, ингибирующие синтез С5а. На биологических моделях было показано, что блокада данного фактора действительно улучшает прогноз при сепсисе и SIRS [6].
МАС
Данный комплекс может формироваться на поверхности грамотрицательных бактерий и напрямую участвовать в их уничтожении (более всего действие МАС направлено против Neisseria). Описаны также случаи образования МАС на поверхности грамположительных бактерий, паразитов и мембране собственных клеток. Состоит он из последних 5 белков комплемента: С5 — С9.
Специфического рецептора, инициирующего образование комплекса, нет. Белки комплемента адгезируются на наружной поверхности клеточной стенки бактерии, после чего комплекс приобретает ферментативную активность и перфорирует мембрану. Нарушается концентрация ионов и воды — клетка погибает [7].
Недавние исследования показывают, что у МАС имеется и провоспалительное — «сублитическое» — действие. При образовании комплекса на поверхности нейтрофилов или макрофагов происходит локальная утечка провоспалительных медиаторов, а в случае атаки мезангиальных клеток и микроглии — высвобождение цитокинов. Также МАС вызывает образование инфламмасомы путем активации Nod-подобного рецептора [8].
Не допустить образование МАС на собственных клетках помогает рецептор CD59. Генетический дефект CD59 приводит к появлению пароксизмальной ночной гемоглобинурии [7]. А поскольку МАС способен поддерживать системное воспаление, он также вовлекается в патогенез различных воспалительных заболеваний (см. ниже).
Возрастная макулярная дегенерация
Возрастная макулярная дегенерация (ВМД) — основная причина слепоты у пациентов старше 50 лет в цивилизованных странах. В макуле (как и во всей сетчатке) происходят дистрофически-дегенеративные процессы, вследствие чего нарушается способность фокусировать свет в определенной точке, в результате исчезает ясность и четкость зрения. Существует две формы ВМД: влажная (быстро прогрессирующая, экссудативная) и сухая (атрофическая форма). Иногда выделяют рубцовую форму, которая скорее является завершающей стадией заболевания.
Одним из ключевых звеньев этиопатогенеза ВМД является дефект фактора комплемента H — одного из основных регуляторов системы комплемента. Функция его заключается в ингибировании С3-конвертазы (если точнее — является кофактором для протеазы, которая осуществляет катализ С3-конвертазы). Существует несколько форм гена фактора Н, один из наиболее известных — Y402H, который существенно повышает риск развития ВМД. Есть и другие, более редкие варианты [9].
В случае влажной формы ВМД происходит неоваскуляризация сетчатки — аномальное разрастание сосудов под действием VEGF (фактор роста эндотелия сосудов). В опытах было показано, что высвобождение VEGF и неоваскуляризация невозможны без действия MAC [10].
Также в обоих вариантах ВМД важная роль приписывается локальному хроническому воспалению под воздействием системы комплемента. Установлена взаимосвязь между активацией комплемента (особенно по альтернативному пути) и риском развития ВМД [10].
Разумеется, эти данные невозможно было проигнорировать, вследствие чего начали разрабатывать ингибиторы факторов системы комплемента для предотвращения ВМД. На данный момент существуют и моноклональные антитела (анти-фактор D, Экулизумаб), и рекомбинантный фактор Н, и антагонисты различных белков системы комплемента, но пока ни один из них не рекомендован для лечения ВМД [10].
Болезнь Альцгеймера
Воспалительный процесс в нервной ткани сегодня рассматривается как основное патогенетическое звено в развитии БА и других нейродегенеративных заболеваний. Также существуют данные, что прием противовоспалительных препаратов (НПВС) существенно снижает риск развития БА [11].
Однако помимо воспалительных цитокинов, важная роль в развитии локального воспаления принадлежит и системе комплемента. В ликворе пациентов с болезнью Альцгеймера обнаруживается повышенная концентрация С3 в сравнении со здоровыми пациентами. Также активность системы комплемента у пациентов с БА существенно выше [12].
Наследственный ангионевротический отек
НАО — редкое и потенциально фатальное заболевание, этиологическим фактором которого является генетический дефект (НАО 1 типа) или дисфункция (НАО 2 типа) ингибитора С1-компонента комплемента (iС1). В норме iС1 — регулятор, который блокирует весь путь активации системы комплемента. При его дефиците происходит гиперактивация начальных компонентов комплемента, следствием чего является повышение проницаемости сосудов, что приводит к различным отекам.
Проявляется НАО в основном в возрасте после 20 лет отеками конечностей, реже — шеи и лица, которые длятся 1-3, максимум — 7 дней, после чего самостоятельно проходят. Сначала пациент может их даже не замечать, однако со временем частота и выраженность отеков нарастают, может происходить отек слизистой ЖКТ, что проявляется болью, тошнотой, иногда — клиникой острого живота. Наиболее опасен отек гортани, который может сопровождаться асфиксией.
Но ситуация с лечением не так уж и плоха. Ингибитор С1 можно вводить внутривенно для профилактики приступов, для купирования — подкожно [13,14].
Пароксизмальная ночная гемоглобинурия
ПНГ — редкое заболевание, в основе которого лежит клональная экспансия гемопоэтических клеток с мутацией PIGA. Результатом данной мутации является недостаточность ГФИ-заякоренных белков, а именно — CD55 и CD59 (гликозилфосфатидилинозитол или ГФИ-якорь — гликопептид, присоединяющийся к белкам в процессе посттрансляционных модификаций).
Проявляется заболевание гемолитической анемией, костномозговой недостаточностью, тромбофилией.
В норме CD55 ингибирует С9-компонент и предотвращает формирование МАС, а CD59 — ингибирует образование С3-конвертазы и предотвращает протеолиз С3-компонента.
Патогенез начинается с внутрисосудистого гемолиза, который происходит ввиду дефицита CD55. На поверхности эритроцитов с мутацией формируется С3-конвертаза, которая запускает дальнейший синтез МАС. Образование последнего ничего не сдерживает из-за дефекта CD59. МАС перфорирует мембрану эритроцита, и клетка погибает.
Все клинические проявления — гемоглобинурия, анемия (апластическая), тромбоз/эмболия, гастроинтестинальные и неврологические симптомы, так или иначе, являются следствием данного механизма [15,16].
В качестве лечения используется трансплантация гемопоэтических клеток, гемотрансфузии, симптоматическая и поддерживающая терапия. Также достаточно перспективным является использование ингибиторов системы комплемента, например, Экулизумаба (Солириса), который, по данным некоторых публикаций, устраняет все значимые симптомы заболевания [15].
Однако по данным Кохрейна, доказательную базу Экулизумаба нельзя назвать достаточной [17].
Атипичный гемолитико-уремический синдром
Для АГУС характерными симптомами являются гемолитическая анемия, тромбоцитопения и почечная недостаточность с уремией. Этиологией данного заболевания могут быть различные генетические дефекты регуляторов системы комплемента.
Зачастую это мутация CFH, отвечающего за экспрессию уже знакомого читателю фактора Н. Таких мутаций существует более 80, они могут быть наследственными или спорадическими. Также встречаются мутации генов, ответственных за фактор В, С3-компонент комплемента, тромбомодулин и др. [18].
В лечении АГУС также может быть использован экулизумаб [19], однако и здесь ощущается нехватка доказательной базы. В основном же терапия АГУС осуществляется с помощью гемотрансфузий/плазмообмена, диализа, почечной трансплантации — и снова ни одна из названных процедур не способна избавить пациента от болезни [18]. Таким образом, наиболее перспективна разработка ингибиторов системы комплемента и проведение РКИ с их участием.
Помимо перечисленных заболеваний, система комплемента принимает непосредственное участие в патогенезе аутоиммунных кожных заболеваний [20], воспалительных заболеваний почек [21], разнообразных аллергических и аутоиммунных заболеваний.
Разработка ингибиторов комплемента уже сегодня является перспективным направлением, а некоторые препараты данной группы (экулизумаб) уже могут применяться в ряде случаев.
К неспецифическим факторам резистентности относится система комплемента — сложный комплекс сывороточных белков (около 20 белков). Термин «комплемент» (С) предложил Борклет (Bordet).
Комплемент представляет собой систему каскадно действующих высокоэффективных протеаз, которые последовательно активируются за счет отщепления или присоединения пептидных фрагментов, что в конечном итоге приводит к бактериолизису или цитолизу. В филогенезе система комплемента появилась раньше иммунной системы. Так, установлено, что уже на 6-й неделе плод способен синтезировать отдельные компоненты системы, а с 10-й — все, хотя в меньших количествах. Из общего количества сывороточных белков на систему комплемента приходится 10%. Она является основой защитных сил организма [3, 7].
Комплемент активирует фагоцитоз, осуществляя прямую или опосредованную через антитела опсонизацию микробов. Компоненты комплемента обладают хемотаксической активностью, участвуют в регуляции иммунного ответа и регуляции гуморального звена иммунитета.
Образование компонентов комплемента происходит преимущественно в печени, костном мозге и селезенке, а С1, очевидно, образуется в эпителии тонкого кишечника. Определенную роль в синтезе компонентов комплемента играют макрофаги, что отражает тесную связь между двумя этими системами. Синтез идет с большой скоростью (например, СЗ синтезируется со скоростью 0,5—1 мг белка/кг массы тела за час).
Выделяют три механизма активации системы комплемента:
- 1) классический, начинающийся с С1;
- 2) альтернативный, начинающийся с СЗ;
- 3) неспецифическая активация комплемента с образованием различных продуктов расщепления.
Классический путь активации комплемента инициируется антителами, т. е. это иммунологически обусловленный процесс. В нем выделяют следующие этапы.
- 1. Распознавание иммунных комплексов и активация первого компонента комплемента (С1) осуществляется благодаря взаимодействию рецептора первого компонента комплемента с Fc-фрагментами антител. Наиболее важными активаторами С1 являются иммунные комплексы, содержащие IgM и IgG.
- 2. Второй этап включает образование СЗ-конвертазы и С5-конвертазы путем отщепления от гамма-цепи С4 фрагмента С4а. Образовавшийся фрагмент С4Ь может непосредственно присоединяться к мембране клетки-мишени или антителу. К этим связанным компонентам комплемента С4Ь в присутствии ионов Mg присоединяются С2а-фрагменты, образовавшиеся из С1, комплекс С4Ь—С2а представляет собой СЗ-конвертазу и вся дальнейшая активация комплемента определяется СЗ-конвертазой.
Классический и альтернативный пути активации комплемента взаимно влияют друг на друга через СЗ. СЗ-конвертаза отщепляет от СЗ фрагмент СЗа, обладающий свойствами анафилотоксина и хемотак- сина. За счет отщепления СЗа от СЗ на оставшемся фрагменте СЗЬ открывается группировка, способная образовывать эфирную связь с ОН-группами клеточной мембраны, с помощью которой СЗЬ фиксируется на мембране клетки, бактерии. Связанная с мембраной клетка формы СЗЬ обладает аффинностью к поверхности макрофагов, нейтрофилов, В- и Т-лимфоцитов и может соединяться с С5 и оптимизировать образовавшийся комплекс для действия С5-конвертазы. С5-конвертазной активностью обладает комплекс С4Ь,2а,ЗЬ классического пути активации [18].
Возникающий по классическому пути СЗа вместе с факторами В, D и Р (это активаторы альтернативного пути активации комплемента: В — проактиватор СЗ по альтернативному пути; D — сериновая про- теиназа, разрушающая фактор В после его соединения с СЗЬ; Р — про- пердин) стимулирует дальнейшее расщепление СЗ и приобретает при этом активность С5-конвертазы. Оба типа активаторов: 1) СЗа и 2) В, D и Р — действуют совместно.
Образовавшаяся С5-конвертаза расщепляет С5 на С5а (эффективный анафилотоксин и хемотаксин) и С5Ь. С5Ь крайне лабилен и стабилизируется только при связывании с С6 и С7. Комплекс С5Ь,6,7 может существовать в растворенной форме, а может связываться с мембраной клетки-мишени (он также обладает и свойствами хемотаксина). Связанный с мембраной комплекс С5Ь,6,7 присоединяет к себе одну молекулу С8 и три молекулы С9, образуя С5Ь—С9-комплекс, который повреждает мембрану — в итоге наступает осмотический гемолиз, если речь идет об эритроцитах, или лизис бактерий, если речь идет о бактериях.
Среди бактерий имеются виды, устойчивые к действию комплемента. В этом случае решающим оказывается эффект опсонизации макрофагов с последующим фагоцитозом. Определенную роль при атаке комплементом грамотрицательных бактерий играет лизоцим.
Агрегированные иммуноглобулины активируют комплемент по классическому пути, что может привести к образованию большого количества анафилотоксинов с развитием анафилактического шока. Присоединение к растворимым иммунным комплексам (к Fc-фрагменту Ig, входящий в иммунный комплекс; Fc-фрагмент для фиксации на клеточной мембране) С5Ь,6,7 приводит к их отложению на клетках эндотелия и ассоциации с клетками крови, обусловливая целый ряд системных поражений. Такие иммунокомплексные механизмы создают основу для аллергических реакций III типа, каскада реакций активации комплемента, лавинообразному вовлечению в реакцию компонентов комплемента с нарастанием количества активных фрагментов комплемента (рис. 4.2).
3. Альтернативный путь активации комплемента начинается с расщепления СЗ на фрагменты СЗа и СЗЬ. При альтернативном пути в реакции не участвуют факторы Cl, С4 и С2. Дальнейшее течение процесса идентично классическому пути.
В качестве активаторов могут выступать полисахариды, инулин, высокомолекулярный декстран, бактериальные токсины, агрегированные IgG4, IgA, IgE, иммунные комплексы с F(ab) 2-фрагментами, протеазы (плазмин, трипсин), яд кобры, СЗЬ. При этом пути активации действует две СЗ-конвертазы: 1) СЗВЬ обладает незначительной активностью и появляется при взаимодействии СЗ с В, D и Р (пропердином);
2) высокоактивной СЗ-конвертазы — СЗЬВЬ, результатом действия которой является СЗЬ.
Определяющим этапом в альтернативном пути активации является образование СЗЬ, который переносится на активированную поверхность. Процесс начинается со связывания СЗЬ с В в присутствии ионов Mg 2+ ; образовавшийся СЗЬВ превращается при участии D в комплекс СЗЬВЬ.
Цитолитическая активность альтернативного пути полностью определяется свойствами оболочки микроорганизма и клеточной мембраны. Устойчивость мембране придают гликопротеины и гликолипиды, содержащие остатки сиаловой кислоты. Сиаловые кислоты играют важную роль в резистентности микроорганизмов. Большинство видов бактерий не содержит в составе оболочки сиаловых кислот, но многие патогенные виды их имеют. Однако антитела могут изменять свойства оболочки микроба и таким образом повышать их чувствительность к комплементу [25].
Важным этапом в активации поверхности является связывание про- пердина — в результате возникает высокоаффинный рецептор для СЗЬ и одновременно образуется стабильный комплекс СЗВЬ (слабоактивная конвертаза). В связи с этим различают два вида активаторов альтернативного пути:
Рис. 4.2. Система комплемента (Dale Male, Jonathan Brostoff, David В. Roth and Ivan Roitt)
- • пропердинзависимые активаторы: эндотоксины, полисахариды, антитела;
- • пропердиннезависимые активаторы: протеазы, яд кобры.
Альтернативная активация комплемента — очень важный компонент неспецифической резистентности к бактериям, вирусам и одноклеточным микроорганизмам. В качестве патогенетического звена альтернативная активация комплемента участвует во многих заболеваниях:
- • мембранопролиферативные нефриты с гипокомплементемией;
- • острый гломерулонефрит после стрептококковой инфекции;
- • нефриты при системной красной волчанке;
- • грибковые инфекции;
- • септицемия с шоком, обусловленным эндотоксинами и др.
- 4. Неспецифическая активация комплемента может осуществляться протеазами (трипсин, плазмин, калликреин, лизосомальные протеазы и бактериальные ферменты) на каждой стадии от С1 до С5. Возникают анафилотоксины, которые, кроме гемолитического действия, дают полную картину шока при тяжелых инфекциях и панкреатите. Неспецифическая активация является одним из компонентов острого воспаления [5].
Биологические эффекты системы комплемента.
- 1. Цитолиз и бактерицидность. Они могут быть индуцированы следующими путями:
- • прямой активацией пропердина через альтернативный путь активации комплемента клетками и бактериями;
- • побочными эффектами при реакциях иммунных комплексов;
- • участием активированных фагоцитов;
- • цитолитическим действием иммунных комплексов, содержащих IgG, IgM, имеющих рецептор к комплементу.
Сочетание рецепции СЗЬ и С4Ь с рецепцией Fc-фрагментов антител обеспечивает удаление микроорганизмов, недоступных действию комплементзависимого лизиса. Эритроциты, сорбируя на свою мембрану частицы, нагруженные СЗЬ, и подвергаясь затем фагоцитозу макрофагами печени, селезенки, удаляют таким образом инородные частицы (бактерии). Одной из важных функций комплемента является удаление путем фагоцитоза растворимых иммунных комплексов, содержащих IgM (на фагоцитах отсутствуют рецепторы для Fc-фрагмента IgM).
- 5. Комплемент участвует в конглютинации — агглютинации частиц, нагруженных СЗ-компонентом комплемента (например, бактерий, клеток) в присутствии сывороточного белка конглютинина. Конглюти- нины агглютинируют нагруженные комплементом (СЗ) эритроциты, частицы, бактерии и тем самым участвуют в механизмах повышения резистентности организма.
- 6. Система комплемента представляет собой важный фактор естественной резистентности против вирусной инфекции. Некоторые РНК- содержащие вирусы способны непосредственно связывать Clq, классически активируя комплемент, что приводит к лизису инфекционного агента. Другие вирусы могут взаимодействовать с комплементом через С-реактивный белок.
Далее, комплемент способен инактивировать вирус, находящийся в растворимом иммунном комплексе, что приводит к его опсониза- ции и способствует прилипанию вирусов, бактерий и корпускулярных антигенов к фагоцитам и стимулирует затем процесс фагоцитоза. К опсонинам относятся компоненты комплементов (СЗ), антитела IgGl и IgG3 человека. Таким образом, опсонизация может быть иммунной (осуществляется при участии антител) и неиммунной (при участии комплемента).
Противовирусное действие комплемента обусловлено:
- • лизисом вируса за счет фрагментов комплемента от С1 до С9;
- • агрегацией вируса за счет иммунных конглютининов;
- • опсонизацией и фагоцитозом;
- • блокадой вирусных лиганд для соответствующих рецепторов клеточной мембраны;
- • блокадой пенетрации вируса в клетку.
Однако сам по себе комплемент не способен инактивировать пораженную вирусом клетку.
- 7. Комплемент участвует в разрушении иммунных комплексов. Активированные компоненты комплемента связываются с IgG или IgM, входящими в иммунные комплексы, препятствуя образованию крупных агрегатов и способствуя разрыхлению и расщеплению активированными протеазами (собственно и активация комплемента связана с появлением активных протеаз) образовавшихся агрегатов. Удаление продуктов распада из кровотока осуществляется благодаря опсониза- ции и фагоцитозу этих фрагментов. Отложившиеся в тканях иммунные комплексы удаляются также путем фагоцитоза, однако существенную роль в этом процессе играют плазмин и лизосомальные ферменты.
- 8. Участие комплемента в механизмах неспецифической резистентности опосредуется благодаря наличию рецепторов на мембране к таким компонентам комплемента, как Clq, СЗ и С5. Рецепторы к Clq имеются на фагоцитах, В-лимфоцитах и субпопуляции «нулевых» лимфоцитов. Эти рецепторы связывают коллагеноподобные участки молекулы Clq.
Рецепторы СЗ представлены четырьмя видами:
- • CR1 — рецептор СЗЬ имеется на В-лимфоцитах и эритроцитах;
- • CR2 — рецептор C3d находится на В-лимфоцитах;
- • CR3 — рецептор СЗЫ находится на фагоцитах, тучных клетках и части В-лимфоцитов;
- • CR4 — рецептор СЗа находится на тучных клетках, фагоцитах и клетках гладкой мускулатуры.
СЗЬ- и СЗЫ-рецепторы на фагоцитах опосредуют иммунную адгезию и иммунофагоцитоз, а на В-лимфоцитах они стимулируют синтез иммуноглобулинов, преимущественно классов IgG и IgA. Причиной такой стимуляции может быть образование кооперации между В-клеткой и макрофагом за счет опсонизированного иммунного комплекса. Одной из основных функций этих рецепторов является усиление антителозависимой клеточной цитотоксичности, обусловленной лимфоцитами и фагоцитами. C3d представляет собой также фактор роста для В-лимфоцитов. С5а-рецепторы имеются на тучных клетках и фагоцитах. Они соответствуют рецептору анафилотоксина и хемотаксина на тучных клетках. Их связывание с лигандом приводит к активации обмена веществ в клетке, генерации свободных радикалов и секреции содержимого лизосом [3, 6].
9. Система комплемента тесно связана с системой свертывания крови и системой кининов. Это отчетливо прослеживается при индукции эндотоксином реакции Санарелли — Шварцмана и состояниях, обусловленных иммунными комплексами. Калликреин, плазмин и тромбин активируют С1 и расщепляют СЗ, С5 и фактор В. Фактор ХНА (активированный фактор Хагемана) также может активировать С1, причем С1 сначала расщепляется плазмином, а затем продукты расщепления используются калликреином и фактором ХПА.
Активация тромбоцитов осуществляется через взаимодействие СЗ, фактора В, пропердина, фибриногена и тромбина. Активированные макрофаги и фагоциты — источник тканевых протеаз из тромбопла- стина при всех видах воспаления. Активация всех трех систем происходит через активацию фактора XII. Таким образом, система, включающая комплемент, кинины, факторы свертывания, может выполнять как защитные функции, повышая неспецифическую резистентность организма, так и участвовать в патологических процессах.
10. Система комплемента оказывает через СЗ, фактор В и (31-Н регуляторное действие на Т-систему и В-лимфоциты, повышая цитолитиче- скую активность лимфоцитов.
Компоненты системы комплемента С3, С4 (Complement components C3, C4)
Читайте также:
- Синдром Волавсека (Volavsek)
- Расстройство циклических действий, сфокусированных на теле
- Определение ушных шумов по Левандо, Белоголовову. Различия шума и тона
- Разномодальные агрессивно-оборонительные реакции. Механизмы аффективной и холодной атаки
- Чудо-кефир. О полезных свойствах кефира и его использовании в уходе за собой
