Концентрация кислорода в артериальной крови. Транспорт кислорода
Добавил пользователь Евгений Кузнецов Обновлено: 01.02.2026
Транспорт кислорода кровью
Транспорт кислорода осуществляется в основном эритроцитами. Из 19 об.% кислорода, извлекаемого из артериальной крови, только 0,3 об.% растворены в плазме, остальное же количество О2 содержится в эритроцитах и находится в химической связи с гемоглобином. Гемоглобин (Нb) образует с кислородом непрочное, легко диссоциирующее соединение — оксигемоглобин (НbO02). Связывание кислорода гемоглобином зависит от напряжения кислорода и является легко обратимым процессом. При понижении напряжения кислорода оксигемоглобин отдает кислород.
Кривые диссоциации оксигемоглобнна . Если отложить по оси абсцисс парциальные давления кислорода, а но оси ординат — процент насыщения гемоглобина кислородом, т. е. процент гемоглобина, перешедшего в оксигемоглобин, то мы получим кривую диссоциации оксигемоглобина. Эта кривая ( рис. 55, А ) имеет форму гиперболы и показывает, чте между парциальным давлением кислорода и количеством образующегося оксигемоглобина нет прямой пропорциональной зависимости. Левая часть кривой круто поднимается кверху. Правая же часть кривой имеет почти горизонтальное направление.
Рис. 55. Кривые диссоциации оксигемоглобина в водном растворе (А) и в крови (Б) при напряжении углекислого газа 40 мм рт. ст. (по Баркрофту).
То, что связывание гемоглобином кислорода дает такую кривую, имеет важное физиологическое значение. В зоне относительно высокого парциального давления кислорода, соответствующего давлению его в альвеолах легких, изменение давления кислорода в пределах 100—60 мм рт. ст. почти не оказывает влияния на горизонтальный ход кривой, т. е. почти не изменяет количества образовавшегося оксигемоглобина.
Приведенная на рис. 55 кривая А получается при исследовании растворов чистого гемоглобина в дистиллированной воде. В естественных же условиях плазма крови содержит различные соли и углекислоту, которые несколько изменяют кривую диссоциации оксигемоглобина. Левая часть кривой приобретает изгиб и вся кривая напоминает букву S. Из рис. 55 (кривая В) видно, что средняя часть кривой направляется круто книзу, а нижняя приближается к горизонтальному направлению.
Следует отметить, что нижняя часть кривой характеризует свойства гемоглобина в зоне низких парциальных давлений кислорода , которые близки к имеющимся в тканях. Средняя же часть кривой дает представление о свойствах гемоглобина при тех величинах напряжения кислорода, которые имеются в артериальной и венозной крови
Изменения диссоциации оксигемоглобина в зависимости от концентрации водородных ионов и температуры. При увеличении концентрации водородных ионов в крови, т. е. при снижении рН, сродство гемоглобина к кислороду уменьшается. Поэтому при повышении напряжения углекислого газа меньше образуется оксигемоглобина при одном и том же парциальном давлении кислорода ( рис. 56 ). Это явление было впервые подмечено Б. Ф. Вериго и подробно проанализировано Хр. Бором.
Рис. 56. Кривые диссоциации оксигемоглобина в зависимости от напряжения углекислого газа.
Резкое снижение способности гемоглобина связывать кислород в присутствии углекислого газа отмечается прп парциальном давлении кислорода, равном 40 мл рт. ст., т. е. при том его напряжении, которое имеется в венозной крови. Это свойство гемоглобина имеет важное значение для организма. В капиллярах тканей напряжение углекислого газа в крови увеличивается и потому уменьшается способность гемоглобина связывать кислород, что облегчает отдачу кислорода тканям. В альвеолах легких, где часть углекислого газа переходит в альвеолярный воздух, сродство гемоглобина к кислороду возрастает, что облегчает образование оксигемоглобина.
Особенно резкое снижение способности гемоглобина связывать кислород отмечается в крови мышечных капилляров во время интенсивной мышечной работы, когда в кровь поступают кислые продукты обмена веществ, в частности молочная кислота. Это способствует отдаче большого количества кислорода мышцам.
Способность гемоглобина связывать и отдавать кислород изменяется также в зависимости от температуры. Оксигемоглобин при одном и том же парциальном давлении кислорода в окружающей среде отдает больше кислорода при температуре тела человека (37—38°), чем при более низкой температуре.
Концентрация кислорода в артериальной крови. Транспорт кислорода
4.1. Транспорт кислорода
В сложных механизмах транспорта газов кровью и газообмена в тканях важная роль отводится эритроцитам, ответственным за доставку О2 к различным органам и удаление образующегося в процессе метаболизма СО2.
Эритроцит - безъядерная клетка, лишенная митохондрий, основным источником энергии для эритроцита служит глюкоза, метаболизируемая в гексозомонофосфатном шунте или цикле Эмбдена-Мейергофа. Транспорт О2 обеспечивается в значительной мере гемоглобином, состоящим из белка глобина и гема. Последний представляет собой комплексное соединение железа и порфирина. Глобин представляет собой тетрамер полипептидной цепи. Hb A (HbA) - основной гемоглобин взрослых содержит 2 - альфа и 2 - бета - цепи, Hb A2 - содержит две альфа и две дельта цепи.
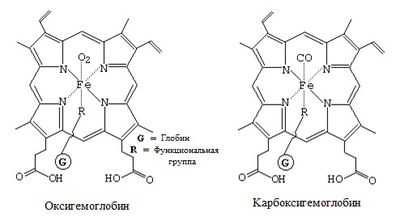
Гем состоит из иона железа, встроенного в порфириновое кольцо. Ион железа гема обратимо связывает одну молекулу О2. С одной молекулой Hb максимально связываются 4 молекулы О2 с образованием оксигемоглобина.
Гем может подвергаться не только оксигенации, но и истинному окислению, когда железо становится из двухвалентного трехвалентным. Окисленный гем носит название гематина, а молекула гемоглобина становится метгемоглобином. В крови человека метгемоглобин находится в незначительных количествах, его уровень резко возрастает при отравлениях. Метгемоглобин не способен отдавать кислород тканям.
В норме метгемоглобин составляет менее 3% общего Hb крови. Основная форма транспорта О2 - в виде оксигемоглобина. Кислород транспортируется артериальной кровью не только в связи с гемоглобином, но и в растворенном виде. Принимая во внимание тот факт, что 1 г Hb может связать 1,34 мл О2, кислородная емкость крови в среднем у взрослого человека составляет около 200 мл/л крови. Одним из показателей кислородного транспорта является насыщение артериальной крови О2(Sa O2), равного отношению О2, связанного с Hb, к кислородной емкости крови:
SaO2=O2, связанного с Hb/O2 емкость крови* 100%.
В соответствии с кривой диссоциации оксигемоглобина насыщение артериальной крови кислородом в среднем составляет 97%, в венозной крови - 75%.
PaO2 в артериальной крови около 100 мм. рт. ст., а в венозной - около 40 мм. рт. ст.
Количество растворенного кислорода в крови пропорционально парциальному давлению О2 и коэффициэнту его растворимости.
Последний для О2 составляет 0,0031/100 мл крови/ 1 мм. рт. ст.. Таким образом, 100 мл крови при PaO2, равном 100 мм. рт. ст., содержит менее 0,31 мл O2.
Диссоциация оксигемоглобина в тканях обусловлена главным образом химическими свойствами гемоглобина, а также рядом других факторов - температурой тела, рН среды, р СО2.
При понижении температуры тела наклон кривой диссоциации оксигемоглобина возрастает, а при ее повышении - снижается, и соответственно снижается сродство Hb к О2.
При снижении рН, т.е. при закислении среды, сродство гемоглобина к О2 уменьшается. Увеличение напряжения в крови СО2 также сопровождается снижением сродства Hb к О2 и уплощением кривой диссоциации оксигемоглобина.
Известно, что степень диссоциации оксигемоглобина определяется содержанием в эритроцитах некоторых фосфорорганических соединений, главным из которых является 2,3 - ДФГ (2,3 дифосфоглицерат), а также содержанием в эритроцитах катионов. В случаях развития алкалозов, поглощение О2 в легких увеличивается, но в то же время затрудняется отдача кислорода тканями. При ацидозах наблюдается обратная картина.
4.2.Утилизация кислорода тканями
Тканевое или клеточное дыхание включает три стадии. На первой стадии пируват, аминокислоты и жирные кислоты окисляются до двухуглеродных фрагментов ацетильных групп, входящих в состав ацетилкофермента А. Последние на втором этапе окисления включаются в цикл лимонной кислоты, где происходит образование высокоэнергетических атомов водорода и высвобождение СО2 - конечного продукта окисления органических субстратов. На третьей стадии клеточного дыхания атомы водорода делятся на протоны (Н+) и «высокоэнергетические» электроны, передающиеся по дыхательной цепи на молекулярный О2 и восстанавливающие его до НО2. Перенос электронов сопряжен с запасом энергии в форме АТФ, т.е. с окислительным фосфорилированием (рис.6).
Касаясь патогенеза метаболических сдвигов, свойственных гипоксическим состояниям, следует отметить, что в организме человека более 90% всего потребляемого кислорода восстанавливается с участием цитохромоксидазы митохондрий, и лишь около 10% кислорода метаболизируется в тканях с участием оксигеназ: диоксигеназы и монооксигеназы.
Рис.6. Схема тканевого дыхания. Конечные продукты каждой стадии даны в рамке (Ленинджер А., 1999)
Наиболее многочисленны и сложны монооксигеназные реакции, протекающие в эндоплазматическом ретикулуме клеток при участии цитохрома Р-450 и обеспечивающие гидроксилирование субстрата (стероидных гормонов, лекарственных препаратов и различных др. соединений) и, как правило, его инактивацию.
Диоксигеназы катализируют реакции, в которых в молекулу органического субстрата включаются оба атома молекулы кислорода (например, реакция окисления катехола молекулярным кислородом с раскрытием кольца).
В реакциях, связанных с переносом электронов, т.е. в реакциях окисления-восстановления, где, как указывалось выше, используется более 90% потребляемого кислорода, атомы водорода, отщепленные дегидрогеназами от субстратов в цикле лимонной кислоты, передают свои электроны в цепь переноса электронов и превращаются также в Н +. Как известно, помимо 4 пар атомов водорода, поставляемых каждым оборотом цикла лимонной кислоты, образуются и другие атомы водорода, отщепленные дегидрогеназами от пирувата, жирных кислот и аминокислот в процессе их расщепления до Ацетил-СоА и других продуктов.
Таким образом, все атомы водорода, отщепляемые дегидрогеназами от субстратов, передают свои электроны в дыхательную цепь к конечному акцептору электронов - кислороду.
Касаясь последовательности транспорта электронов в окислительно-восстановительных реакциях, протекающих на внутренней мембране митохондрий, прежде всего, следует отметить, что от всех НАД - зависимых реакций дегидрирования восстановленные эквиваленты переходят к митохондриальной НАДН - дегидрогеназе, затем через ряд железосерных ферментов передаются на убихинон М цитохрому b. Далее электроны переходят последовательно на цитохромы С1 и С, затем на цитохромы аа 3 (цитохромоксидазу - медьсодержащий фермент). В свою очередь цитохромоксидаза передает электроны на кислород. Для того, чтобы полностью восстановить кислород с образованием 2-х молекул воды требуется 4 электрона и четыре Н+ .
Скорость утилизации О2 в различных тканях различна. В среднем взрослый человек потребляет 250 мл О2 в 1 мин. Максимальное извлечение О2 из притекающей артериальной крови свойственно миокарду.
Кислород используется в клетках, в основном в метаболизме белков, жиров, углеводов, ксенобиотиков, в окислительно-восстановительных реакциях в различных субклеточных фракциях: в митохондриях, в эндоплазматическом ретикулуме, в реакциях липопероксидации, а также в межклеточном матриксе и в биологических жидкостях.
Коэффициент утилизации О2 в тканях равен отношению потребления О2 к интенсивности его доставки, широко варьирует в различных органах и тканях.
В условиях нормы минимальную потребность в О2 проявляют почки и селезенка, а максимальную потребность - кора головного мозга, миокард и скелетные мышцы, где коэффициент утилизации О2 колеблется от 0,4 до 0,6, а в миокарде до 0,7. При крайне интенсивной физической работе коэффициент утилизации О2 мышцами и миокардом может возрастать до 0,9.
Обмен дыхательных газов в тканях происходит в процессе свободной и облегченной диффузии. При этом О2 переносится по градиенту напряжения газа из эритроцитов и плазмы крови в окружающие ткани.
Одновременно происходит диффузия СО2 из тканей в кровь. На выход О2 из крови в ткани влияет диссоциация оксигемоглобина в эритроцитах, что обеспечивает так называемую облегченную диффузию О2. Интенсивность диффузионного потока О2 и СО2 определяется градиентом их напряжения между кровью и тканями, а также площадью газообмена, плотностью капилляров, распределением кровотока в микроциркуляторном русле. Интенсивность окислительных процессов в тканях определяется величиной критического напряжения О2 в митохондриях, которое в условиях нормы должно превосходить 0,1-1 мм рт. ст.
Соответствие доставки О2 к органам и тканям, возросшим потребностям в оксигенации обеспечивается на клеточном, органном уровнях за счет образования метаболитов изнашивания, а также при участии нервных, гормональных и гуморальных влияний.
Основная масса углекислого газа (СО2) образуется в организме как конечный продукт различных метаболических реакций и транспортируется к легким с кровью. Вдыхаемый воздух содержит лишь незначительное количество СО2.
Транспорт СО2 кровью осуществляется в 3-х состояниях: в виде аниона бикарбоната, в растворенной форме и в виде карбаминовых соединений.
СО2 хорошо растворяется в плазме крови и в артериальной крови, около 5% от общей двуокиси углерода содержится в крови в растворенной форме.
Анион бикарбоната составляет около 90% от общего содержания СО2 в артериальной крови: СО2+Н2О - Н++НСО-3.
Эта реакция медленно протекает в плазме крови, но чрезвычайно интенсивно происходит в эритроцитах при участии фермента карбоангидразы. Мембрана эритроцита относительно непроницаема для Н+, как и вообще для катионов, но в тоже время, проницаема для ионов НСО-3, выход которых из эритроцитов в плазму обеспечивается притоком Cl- из плазмы в эритроциты. Часть Н+ забуферивается гемоглобином с образованием восстановленного гемоглобина.
Третьей формой транспорта СО2 кровью являются карбаминовые соединения, образованные взаимодействием СО2 с концевыми группами белков крови преимущественно с гемоглобином:
Hb NH2 + CO2 - Hb NH COOH > Hb NH COO + Н+
Карбаминовые соединения составляют около 5% от общего количества СО2, транспортируемого кровью.
В оксигенированной артериальной крови напряжение СО2 составляет 40 мм. рт. ст., а в венозной крови Рv СО2 равно 46 мм. рт. ст.
4.4.Связывание гемоглобина с окисью углерода
Угарный газ (СО) - окись углерода обладает значительно большим сродством к гемоглобину, чем О2, с последующим образованием карбоксигемоглобина. СО входит в состав бытового газа, а также выделяется при работе двигателей внутреннего сгорания. При концентрации СО во вдыхаемом воздухе всего в количестве 7*10- 4 около 50% гемоглобина превращается в карбоксигемоглобин. В норме в крови содержится около 1% HbCO, у курильщиков - 3% . В крови водителей такси концентрация карбоксигемоглобина достигает 20%. Карбоксигемоглобин диссоциирует с отдачей О2 в 200 раз медленней оксигемоглобина и в то же время препятствует его диссоциации в тканях.
Гиперкапния и гипоксемия: признаки, возникновение, диагностика, как лечить
Много раз мы слышали, как вредно находиться в помещении с повышенным уровнем углекислого газа и как важно нормальное содержание кислорода в воздухе, которым мы дышим. Вместе с тем, всем известно, что кислород в организм должен попадать бесперебойно и в достаточном количестве, в противном случае снижение кислорода в крови (гипоксемия) и накопление углекислого газа (гиперкапния) приводят к развитию состояния, называемого гипоксией. И коль гипоксия имеет место, то уже ясно, что без гиперкапнии и гипоксемии тоже не обошлось, поэтому их считают универсальными симптомами дыхательной недостаточности (ДН).
Различают две формы острой дыхательной недостаточности: гиперкапническую, обусловленную повышенным уровнем углекислого газа, и гипоксемическую форму ОДН, когда проблемы возникают вследствие низкой оксигенации артериальной крови. Для острой дыхательной недостаточности характерно и то, и другое: и повышенная концентрация углекислого газа, и низкое содержание кислорода, то есть, и гиперкапния, и гипоксемия, но все же их нужно отделять друг от друга и разграничивать при выборе методов лечения, которые хоть, в принципе, и похожи, но могут иметь свои особенности.
Свято место пусто не бывает
Гиперкапния - повышение уровня углекислого газа (СО2) в крови, гипоксемия - снижение содержания кислорода (О2) там же. Как и почему это происходит?
Известно, что транспорт кислорода из легких с артериальной кровью осуществляют красные кровяные тельца (эритроциты), где кислород находится в связанном (но не очень прочно) с хромопротеином (гемоглобином) состоянии. Гемоглобин (Hb), несущий кислород к тканям (оксигемоглобин), по прибытию на место назначения отдает О2 и становится восстановленным гемоглобином (дезоксигемоглобин), способным присоединять к себе тот же кислород, углекислый газ, воду. Но так как в тканях его уже ждет углекислый газ, который нужно с венозной кровью доставить в легкие для выведения из организма, то гемоглобин его и забирает, превращаясь в карбогемоглобин (HbСО2) - тоже непрочное соединение. Карбогемоглобин в легких распадется на Hb, способный соединиться с кислородом, поступившим при вдохе, и углекислый газ, предназначенный для вывода из организма при выдохе.
Схематично эти реакции можно представить в виде химических реакций, которые, возможно, читатель хорошо помнит еще из школьных уроков:
- Hb (в эритроцитах) + О2 (приходит при вдохе с воздухом) → HbО2 - реакция идет в легких, полученное соединение направляется в ткани;
- HbО2 → Hb (дезоксигемоглобин) + О2 - в тканях, которые получают кислород для дыхания;
- Hb + СО2 (отработанный, из тканей) → HbСО2 (карбогемоглобин) - в тканях, образованный карбогемоглобин направляется в малый круг для газообмена и обогащения кислородом;
- HbСО2 (из тканей) → в легкие: Hb (свободен для получения кислорода) + СО2↑ (удаляется с выдохом);
- Hb + О2 (из вдыхаемого воздуха) - новый цикл.
Однако следует отметить, что все так хорошо получается, когда кислорода хватает, избытка углекислого газа нет, с легкими все в порядке - организм дышит чистым воздухом, ткани получают все, что им положено, кислородного голодания не испытывают, образованный в процессе газообмена СО2 благополучно покидает организм. Из схемы видно, что восстановленный гемоглобин (Hb), не имея прочных связей, всегда готов присоединить любой из компонентов (что попадается, то и присоединяет). Если в легких на тот момент окажется кислорода меньше, чем может забрать гемоглобин (гипоксемия), а углекислого газа будет более, чем достаточно (гиперкапния), то он заберет его (СО2) и понесет к тканям с артериальной кровью (артериальная гипоксемия) вместо ожидаемого кислорода. Пониженная оксигенация тканей - прямой путь к развитию гипоксии, то есть, кислородному голоданию тканей.
Очевидно, что трудно разделить такие симптомы, как гипоксия, гиперкапния и гипоксемия - они лежат в основе развития острой дыхательной недостаточности и определяют клиническую картину ОДН.
Тесные связи
Привести ткани к кислородному голоданию могут различные причинные факторы, однако, учитывая неразрывную связь гипоксии, гиперкапнии и гипоксемии, эти категории целесообразно рассматривать, не отрывая друг от друга, тогда читателю будет понятно, что из чего вытекает.
Итак, гипоксию по ее происхождению делят на две группы:
Экзогенная гипоксия - кислородное голодание, возникающее вследствие снижения парциального давления О2 в воздухе, который мы вдыхаем и, соответственно, к недостаточному насыщению артериальной крови кислородом (менее 96% - гипоксемия). Такая форма гипоксии хорошо известна любителям полетов на больших высотах, покорения высоких гор, а также лицам, чья профессия связана с различными системами, обеспечивающими дыхание в необычных условиях (акваланг, барокамера), или людям, случайно попавшим в зону сильного загрязнения атмосферы вредными для человека газообразными веществами.
- Респираторную гипоксию, формирующуюся в результате альвеолярной гиповентиляции, которая возникает при различных обстоятельствах: травмах грудной клетки, непроходимости дыхательных путей, уменьшении поверхности легких, осуществляющих дыхательную деятельность, угнетении дыхательного центра, например, лекарственными средствами, воспалительных процессах и отеке легких. Это - различные заболевания органов дыхания: пневмония, эмфизема, пневмосклероз, ХОБЛ (хроническая обструктивная болезнь легких), а также поражение органов дыхания агрессивными ядами: фосгеном, аммиаком, сильными неорганическими кислотами (соляная, серная) и др.;
- Циркуляторную форму, в основе которой лежит острая и хроническая недостаточность системы кровообращения (врожденные пороки сердца, при которых венозная кровь, не заходя в малый круг кровообращения, попадает в левые отделы сердца, что случается, например, при открытом овальном окне);
- Тканевой вариант гипоксии, который имеет при отравлениях, затормаживающих передачу тканям кислорода, поскольку из-за подавления функциональной активности дыхательных ферментов те перестают его принимать и усваивать;
- Гемическую (кровяную) гипоксию - результат уменьшения в циркулирующей крови красных кровяных телец (эритроцитов) или снижения уровня красного пигмента (гемоглобина), связывающего кислород. Такая форма, как правило, характерна для различного рода анемичных состояний (острая кровопотеря, ЖДА, гемолитические анемии).
Тяжелую форму гипоксии легко отличить по таким признакам, как цианоз, учащенное сердцебиение, снижение артериального давления, возможны судороги и потеря сознания, что чревато быстрым развитием сердечно-сосудистой недостаточности, которая, если немедленно не ликвидировать первопричину, так же быстро может привести к гибели больного.
Излишнее накопление делает этот газ вредным для организма
В основе развития гиперкапнии находится нарушение соотношения между альвеолярной вентиляцией и накоплением СО2 в тканях и в крови (HbСО2) (показатель этого накопления - РаСО2, который в норме не должен превышать 45 мм. рт. ст.).
К гиперкапнии приводят следующие обстоятельства:
- Расстройства вентиляции, вызванные патологическим состоянием органов дыхания (обструкция) или нарушения, формируемые самим пациентом при попытке снизить дыхательный объем за счет глубины дыхания, поскольку вдох вызывает дополнительные болевые ощущения (травмы грудной клетки, операции на органах брюшной полости и др.);
- Угнетение дыхательного центра и нарушение регуляции в результате этого (травмы, опухоли, отек головного мозга, деструктивные изменения в тканях ГМ, отравление отдельными лекарственными средствами);
- Ослабление мышечного тонуса грудной клетки в результате патологических изменений.
Таким образам, к причинам возникновения гиперкапнии относят:
- ХОБЛ;
- Ацидоз;
- Инфекции бронхо-легочной системы;
- Атеросклероз;
- Профессиональную деятельность (пекари, сталевары, водолазы);
- Загрязнение воздуха, длительное пребывание в непроветриваемых помещениях, курение, в том числе, и пассивное.
рисунок: уровень углекислого газа в помещении и влияние на человека
Признаки увеличения в крови концентрации двуокиси углерода:
- Увеличивается частота сердечных сокращений;
- Проблема - уснуть ночью, зато сонливость днем;
- Кружится и болит голова;
- Тошнит, иной раз доходит до рвоты;
- Повышается внутричерепное давление, возможно развитие отека ГМ;
- Стремится вверх артериальное давление;
- Трудно дышать (одышка);
- Болит в груди.
При быстром увеличении содержания углекислого газа в крови существует опасность развития гиперкапнической комы, которая, в свою очередь, грозит остановкой дыхания и сердечной деятельности.
Факторы, тормозящие оксигенацию
Основу гипоксемии составляет расстройство насыщения кислородом артериальной крови в легких. Узнать, что в легких кровь не оксигенируется можно по такому показателю, как парциальное напряжение кислорода (РаО2), значения которого в норме не должны опускаться ниже 80 мм. рт. ст.
Причинами снижения оксигенации крови являются:
- Альвеолярная гиповентиляция, возникающая в результате влияния различных факторов, в первую очередь, недостатка кислорода во вдыхаемом воздухе, что влечет его снижение в альвеолах и приводит к развитию экзогенной гипоксии;
- Расстройство вентиляционно-перфузионных соотношений, возникающих при хронических заболеваниях легких - это самый частый причинный фактор развития гипоксемии и респираторной гипоксии;
- Шунтирование справа налево при нарушении кровообращения и попадании венозной крови сразу в левое сердце без посещения легких (пороки сердца) с развитием циркуляторной гипоксии;
- Нарушение диффузных способностей альвеолярно-капиллярной мембраны.
Чтобы читатель мог представить роль вентиляционно-перфузионных отношения и значение диффузных способностей альвеолярно - капиллярной мембраны, следует разъяснить суть данных понятий.
Что происходит в легких?
В легких человека газообмен обеспечивается вентиляцией и током крови по малому кругу, однако вентиляция и перфузия происходит не в равной степени. К примеру, отдельные зоны вентилируются, но не обеспечиваются кровью, то есть, в газообмене не участвуют или, наоборот, на каких-то участках кровоток сохранен, но они не вентилируются и тоже исключены из процесса газообмена (альвеолы верхушек легких). Расширение зон, не участвующих в газообмене (отсутствие перфузии), приводит к гипоксемии, которая чуть позже повлечет за собой и гиперкапнию.
Нарушение легочного кровотока вытекает из различных патологических состояний жизненно важных органов и, в первую очередь - кровеносной системы, которые становятся причинами гипоксемии:
пример развития гипоксемии при ТЭЛА
Диффузная способность альвеолярно-капиллярной мембраны, зависящая от многих параметров, может менять свои значения (увеличиваться и уменьшаться) в зависимости от обстоятельств (компенсаторно-приспособительные механизмы при нагрузке, изменении положения тела и др.). У людей взрослых молодых людей (за 20 лет) она снижается естественным образом, что считается физиологическим процессом. Чрезмерное уменьшение этого показателя наблюдается при заболеваниях органов дыхания (воспаление легких, отек, ХОБЛ, эмфизема), которые значительно снижают диффузионную способность АКМ (газы не могут преодолеть длинные пути, образованные в результате патологических изменений, а кровоток нарушается из-за уменьшения количества капилляров). По причине подобных нарушений начинают проявляться основные признаки гипоксии, гипоксемии и гиперкапнии, указывающие на развитие дыхательной недостаточности.
Признаки снижения О2 в крови
Признаки снижения кислорода могут проявиться быстро (концентрация кислорода падает, но организм пытается компенсировать потерю собственными силами) или запаздывать (на фоне хронической патологии основных систем жизнеобеспечения, компенсаторные возможности которых уже закончились).
- Синюшность кожных покровов (цианоз). Цвет кожи определяет тяжесть состояния, поэтому при слабой степени гипоксемии до цианоза обычно не доходит, но бледность, тем не менее, имеет место;
- Учащенное сердцебиение (тахикардия) - сердце пытается компенсировать недостаток кислорода;
- Снижение артериального давления (артериальная гипотензия);
- Обморочные состояния, если РаО2 падает до очень низких значений (менее 30 мм.рт. ст.)
Снижение концентрации кислорода в крови, конечно, ведет к страданиям головного мозга с нарушением памяти, ослаблением концентрации внимания, расстройствам сна (ночное апноэ и его последствия), развитием синдрома хронической усталости.
Небольшая разница в лечении
Гиперкапния и гипоксемия настолько тесно связаны между собой, что разобраться в лечении может только специалист, который проводит его под контролем лабораторных показателей газового состава крови. Общим в лечении этих состояний являются:
- Вдыхание кислорода (оксигенотерапия), чаще газовой смеси обогащенной кислородом (дозы и методы подбираются врачом с учетом причины, вида гипоксии, тяжести состояния);
- ИВЛ (искусственная вентиляция легких) - в тяжелых случаях при отсутствии сознания у больного (кома);
- По показаниям - антибиотики, препараты, расширяющие бронхи, отхаркивающие лекарственные средства, диуретики.
- В зависимости от состояния больного - ЛФК, массаж грудной клетки.
При лечении гипоксии, вызванной снижением концентрации кислорода, или повышением содержания углекислого газа нельзя забывать о причинах, повлекших данные состояния. По возможности стараются устранить их или хотя бы минимизировать влияние негативных факторов.
Оксигемоглобин: понятие, роль, образование, кривая диссоциации
Красный пигмент крови человека, сложный железосодержащий белок (хромопротеин, состоящий из глобина и четырех гемов с двухвалентным железом в центре каждого) - гемоглобин (Hb), соединяясь с молекулярным кислородом (O2) в легких, образует оксигенированную форму - оксигемоглобин (HHbO2). Оксигемоглобин, приобретая уникальные свойства и обеспечивая дыхание, как одно из элементарных проявлений жизни, продолжает саму жизнь организма. Например, достаточно ввести окись углерода вместо кислорода или нарушить потребление О2 клетками при попадании цианидов (солей синильной кислоты), которые ингибируют ферментные системы тканевого дыхания, как тут же наступает гибель организма.
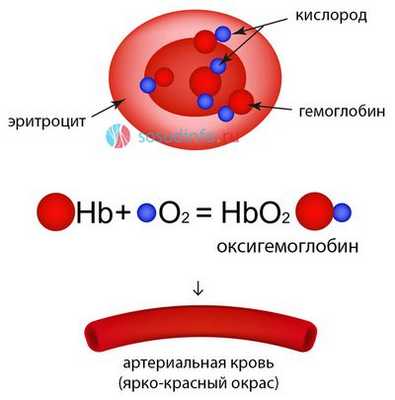
Дыхание, на первый взгляд, кажется совсем простым процессом. Между тем, оно основано на взаимодействии многих компонентов, составляющих гигантскую молекулу красного пигмента крови - хромопротеина гемоглобина, который, в свою очередь, отличается многообразием производных, где из их числа несомненный интерес вызывает оксигемоглобин. Итак, оксигемоглобин образуется в легких путем соединения сложного железосодержащего белка гемоглобина с кислородом, поступающим с вдыхаемым воздухом.
Образование и распад оксигемоглобина
В спокойном состоянии тканям человеческого тела достаточно около 0,2 л кислорода в одну минуту, но все меняется при физической нагрузке и чем она интенсивнее, тем больше необходимого для дыхания газа запрашивают ткани. Для удовлетворения их нужд потребность в кислороде может увеличиваться в 10 - 15 раз и составлять до 2, а то и 3 литров О2 в одну минуту. Однако газообразный кислород в данном количестве никак не сможет пробраться в ткани, поскольку он почти не растворим и в воде, и в плазме, то есть, этот элемент в ткани должен доставить какой-то белок, способный соединиться с ним и решить задачу транспорта.
Кровь, как биологическая среда, реализует свои функциональные обязанности по обеспечению дыхания за счет присутствия в ней сложного содержащего железо протеина - гемоглобина, физиологическая роль которого, как транспортного средства кислорода, базируется на способности Hb связывать и отдавать О2 в корреляции с концентрацией (парциальным давлением - P) данного газа в крови. Образование оксигемоглобина осуществляется в паренхиме легких, куда кислород прибывает при дыхании из воздуха окружающей среды.
Процесс образования HHbO2 происходит в доли секунды (0,01 с), поскольку кровь в легких задерживается всего-то на полсекунды. Схематично и коротко образование оксигемоглобина можно представить в следующем виде:
- Попадая в капиллярные сосуды легких, кровь обогащается кислородом, то есть, красный кровяной пигмент к своим 4 гемам присоединяет кислород - идет реакция окисления (оксигенации);
- Кислород связывается с гемами хромопротеина при помощи координационных связей феррума (железо - Fe) и, не изменяя в данном случае валентности последнего (в геме валентность железа всегда - II), переводит его (Hb) в несколько иное состояние;
- Гем железосодержащего протеина представляет собой активный центр, с его помощью хромопротеин в результате вышеуказанной реакции переходит в непрочный комплекс - оксигенированный гемоглобин (HHbO2), который, находясь в красных кровяных тельцах - эритроцитах, с током крови доставляется к клеткам тканей, чтобы через распад оксигемоглобина и выделения в процессе диссоциации кислорода, обеспечить их дыхание.
Таким образом, результатом реакции оксигенации становится образование оксигемоглобина, подкисление биологической жидкости, снижение ее щелочного резерва, то есть, ее умения связывать углекислоту (СО2), которое, разумеется, на тот момент снижается.
Железосодержащий протеин, насытившись в легочной паренхиме кислородом и приобретя оксигенированную форму, уносит О2 к тканям, в капиллярных сосудах которых его концентрация в крови резко понижена. Там происходит распад оксигемоглобина (диссоциация), кислород уходит на тканевое дыхание, гемоглобин забирает отработанный углекислый газ, превращаясь в другую физиологическую модель - карбогемоглобин (HHbCO2), и в этом качестве отправляется в главный орган дыхания, чтобы обменять CO2 на очередную порцию необходимого организму газа.
Кривая образования и распада (диссоциации) оксигемоглобина
Агентом, гарантирующим быстрое насыщение железосодержащего белка кислородом (образование оксигемоглобина), выступает высокое напряжение (парциальное давление) О2 в легочных альвеолах (порядка 100 мм рт. ст.).
Корреляцию между степенью насыщения красного кровяного пигмента кислородом и парциальным давлением O2 (PO 2) выражают в виде S-образной кривой (сигмоиды), которую называют кривой диссоциации оксигемоглобина.
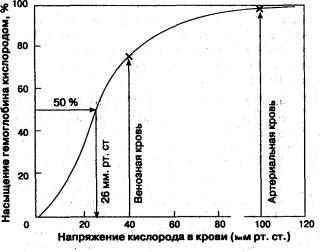
Свойственная красному кровяному пигменту S-образная (сигмоида) кривая диссоциации оксигемоглобина свидетельствует о том, что контактирование первой молекулы О2 с одним из гемов Hb открывает путь присоединению других молекул элемента остальными тремя гемами. Кривой насыщения железосодержащего белка кислородом принадлежит немалая физиологическая значимость - S-образная конфигурация позволяет крови обогатиться данным газом при изменениях концентрации кислорода в биологической жидкости в довольно обширных интервалах. К примеру, не следует ожидать таких особенных расстройств дыхательной функции крови, как выраженное кислородное голодание (гипоксия), при подъеме на высоту до 3,5 км над уровнем моря или во время перелета на самолете. Хотя PO 2 во вдыхаемом воздухе сильно понизится, концентрация кислорода в крови будет находиться на достаточно высоком уровне, чтобы обеспечить насыщение Hb данным газом. На это указывает и отлогий график формирования и распада оксигемоглобина на верхнем его отрезке (верхний отрезок кривой свидетельствует о течении процесса насыщения О2 красного пигмента крови в легочной паренхиме и находится в пределах 75 - 98%).
Кривая диссоциации оксигемоглобина может быть разделена на 4 отрезка, каждому их которых соответствует определенный период образования оксигемоглобина (зависимость скорости насыщения хромопротеина кислородом от парциального давления газа в крови):
- 0 - 10 мм рт. ст. - гемоглобин не спешит насыщаться;
- 10 - 40 мм рт. ст. - оксигенация резко ускоряется (стремительный подъем кривой), доходя до 75%;
- 40 - 60 мм рт. ст. - оксигенация заметно замедляется, потихоньку добираясь до 90%;
- Значения PO2 пересекают отметку 60 мм рт. ст. - насыщение идет слабо (линия лениво ползет вверх). Однако кривая медленно продолжает стремиться к отметке 100%, но, так и не достигнув ее, останавливается на уровне 96 - 98%. Кстати, и такие показатели насыщения Hb кислородом отмечаются только у молодых и здоровых людей (PO2 артериальной крови ≈ 95 мм рт. ст., легочных капилляров - ≈ 100 мм рт. ст.). С возрастом дыхательные способности крови снижаются.
Несовпадение парциального давления кислорода артериальной крови и смеси газов в альвеолах легких трактуется:
- Некоторыми разногласиями между интенсивностью тока крови и вентилированием разных отделов главного органа дыхания - легких;
- Притоком незначительного объема крови из бронхиальных вен в венозные сосуды легких (шунтирование), где, как известно, течет артериальная кровь;
- Прибытием доли крови из коронарных вен в левый желудочек сердца посредством тебезиевых вен (вены Тебезия-Вьессена), в которых проходимость возможна в обоих направлениях.
Между тем, причины, вследствие которых кривая образования и диссоциации оксигемоглобина приобрела сигмоидную форму, пока остаются не до конца выясненными.
Смещение кривой диссоциации оксигемоглобина
Но кривая диссоциации оксигемоглобина, о которой идет речь выше, справедлива, если в организме все нормально. В других ситуациях график может сдвигаться в ту или иную сторону.
В числовом выражении сродство гемоглобина к кислороду обозначается величиной P50 - напряжение полунасыщения красного пигмента крови кислородом или иными словами: парциальное напряжение О2, при котором 50% Hb пребывает в форме оксигемоглобина (оптимальные условия: рН - 7,4, tº - 37ºC). Нормальные значения этого показателя в артериальной крови приближаются к величине 34,67 гПа (26 мм рт. ст.). Смещение графика вправо указывает на то, что способность красного кровяного пигмента соединяться с кислородом снижается, что, естественно, увеличивает значения P50. И, наоборот - смещение кривой влево говорит об увеличении сродства этого хромопротеина к кислороду (↓P50.).
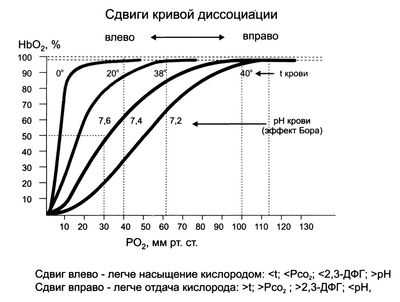
Ходу сигмоиды помогают некоторые факторы, повышающие обогащение крови кислородом и таким образом участвующие в тканевом дыхании, поэтому названные вспомогательными:
- Повышение водородного показателя (pH) крови (эффект Бора), поскольку способность гемоглобина присоединять кислород связана с водородным показателем (pH) данной биологической среды (гемоглобин представляет одну из четырех буферных систем и влияет на регуляцию кислотно-основного баланса, поддерживая pH на нужном уровне: 7,36 - 7,4). Следовательно, чем выше водородный показатель, тем активнее ведет себя гемоглобин в отношении кислорода и наоборот - снижение pH отнимает возможности хромопротеина присоединять кислород, например: ↓pH до 7,2 заставит график отклоняться вправо (≈ на 15%), ↑pH до 7,6 передвинет кривую диссоциации оксигемоглобина влево (≈ на 15%);
- Отделение углекислого газа от карбогемоглобина в легких и выход СО2 с выдыхаемым воздухом (эффект Бора-Вериго) на фоне повышения водородного показателя создает условия для жадного насыщения гемоглобина кислородом (образование оксигемоглобина в легких);
- Возрастание уровня значимого для обмена фосфата - 2,3-дифосфоглицерата (2,3-ДФГ), содержание которого в крови меняется в зависимости от условий протекания обменных процессов;
- Снижение температуры в легких (в тканях она выше, нежели в легких) и чем ниже упадет tº, тем больше способностей присоединять кислород появляется у железосодержащего белка (при повышении температуры идет обратный эффект).
Уровень красного пигмента в крови, а также его способность присоединять кислород (кривая диссоциации оксигемоглобина) в некоторой степени подвержены возрастным колебаниям. Так, у младенцев, только-только известившим мир о своем появлении первым криком, количество гемоглобина заметно выше, что объясняется присутствием фетального гемоглобина, который, как известно, обладает повышенным сродством к кислороду. Красный пигмент крови стариков, напротив, постепенно снижает способности связывать кислород.
В заключение хочется заметить, что гемоглобин не только имеет сродство к кислороду и довольно легко соединяется с углекислым газом. Кроме физиологических соединений красного кровяного пигмента при определенных условиях возникают связи с другими газами, в частности - с угарным газом (CO) и оксидом азота (NO), причем соединение происходит также непринужденно
Высокое сродство Hb к угарному газу влечет образование карбоксигемоглобина (HHbCO), который препятствует соединению хромопротеина с кислородом, а в результате этого ткани остаются без O2. К чему это может привести - всем известно: при отравлении угарным газом высок риск смертельного исхода, если вовремя не помочь человеку.
При отравлении оксидом азота или парами нитробензола гемоглобин переходит в метгемоглобин (HHbOH) с изменением валентности железа (II → III). Метгемоглобин также не позволяет кислороду соединиться с гемоглобином, в итоге - наступает кислородное голодание тканей, создается угроза жизни организма.
5.3. Мониторинг дыхания (респираторный мониторинг).
Понятие респираторного мониторинга включает мониторинг газообмена, а также мониторинг механики легких и грудной клетки.
5.3.1.Мониторинг газообмена
Мониторинг газообмена подразумевает анализ газового состава артериальной и венозной крови, а также выдыхаемого воздуха. Для оценки адекватности газообмена имеет значение определение рН, концентрации бикарбонатов и величины анионного провала. С дидактической точки зрения, можно разделить мониторинг газообмена на мониторинг оксигенации и мониторинг вентиляции.
Мониторинг оксигенации
При проведении мониторинга оксигенации врач должен получить ответы на три вопроса:
•Сколько кислорода может быть доставлено к тканям?
•Какой ценой достался этот кислород организму?
•Как его усвоили ткани?
Для ответа на первый вопрос оценивают напряжение кислорода (рaО2) и насыщения (сатурации) гемоглобина кислородом в артериальной крови (SaО2). Зная эти величины, по формуле рассчитывают содержание кислорода в артериальной крови (Cа - content arterial)
Cа = (0,00138 × SatО2 × Hb) + (0,003 × рa О2)
Умножая эту величину на величину сердечного выброса (CO - cardiac output), измеренного, например, методом термодилюции, можно рассчитать доставку кислорода (DО2 - delivery of oxygen) к тканям:
Не зная, какую долю сердечного выброса получает каждый отдельный орган (например, мозг), нельзя подсчитать, какое точное количество кислорода ему достается.
Для ответа на второй вопрос сравнивают напряжение кислорода в артериальной крови (рaО2) и в воздухе альвеол (РАО2). Величину РАО2 можно или измерить прямо, или рассчитать из так называемого уравнения альвеолярного газа. Прямое измерение возможно при помощи метода быстрой оксиметрии. При использовании этого метода непрерывно измеряют напряжение кислорода во вдыхаемом и выдыхаемом газе. Приборы, предоставляющие возможность измерения этих показателей, обладают низкой инерционностью, оцениваемой по очень быстрому времени отклика (600 мсек и менее).
Для определения РАО 2 интерес представляют конечные порции выдыхаемого газа, то есть фактически газ, выдыхаемый из альвеол. Эффективность обмена кислорода оценивается на основе расчета альвеолоартериального градиента по кислороду:
Р(А- а)О2
Этот показатель имеет нелинейный характер даже у здорового человека и зависит от содержания кислорода во вдыхаемой смеси (FiО2.): при дыхании воздухом он равен 10, при дыхании 100%-ным кислородом - около 100. Кроме того, он зависит от нарушений вентиляционно-перфузионных отношений и изменений венозной сатурации.
Для оценки эффективности кислородообмена большее практическое значение имеет расчет индексов оксигенации. Один из наиболее часто используемых индексов рассчитывается как частное от деления напряжения кислорода в артериальной крови к процентному содержанию кислорода во вдыхаемой смеси, выраженному в долях единицы:
рaО2 / FiО2
В норме этот показатель превышает 350-400 мм рт.ст. Снижение его ниже 300 мм рт.ст. является признаком острого повреждения легких, ниже 200 мм рт.ст. - острого респираторного дистресс-синдрома.
Расчет РАО 2 возможен с помощью уравнения альвеолярного газа, которое с этой целью используется в упрощенном варианте.
Немного физиологии
Уравнение альвеолярного газа в полной его форме представляет собой следующее математическое выражение:
РАО2 = РIО2 - (PAСО2 /RQ) +(PAСО2 × FiО2 × (1 - RQ)/RQ),
где РАО2 - напряжение кислорода в альвеолярном газе, PAС О2 - напряжение углекислоты в альвеолярном газе, РIО2 - напряжение кислорода во вдыхаемом воздухе, FiО2 - доля кислорода во вдыхаемом воздухе, RQ - респираторный коэффициент (respiratory quotent).
Обычно это уравнение используют для расчета респираторного коэффициента, а не РАО2. Данный коэффициент зависит от сопряжения процессов потребления кислорода и выделения углекислоты периферическими тканями, что определяется характером использующихся нутриентов - белков, жиров или углеводов. Он самый высокий при использовании углеводов (1,0), самый низкий при преимущественном поступлении в организм жиров (0,7).
Напряжение кислорода во вдыхаемом воздухе рассчитывается следующим образом:
РIО2 = (барометрическое давление - 47) × FiО2
Величины РАО2 и PAСО2 измеряют прямо в конечно-выдыхаемых порциях дыхательной смеси (то есть в альвеолярном воздухе) методами капнографии и быстрой оксиметрии.
Используя уравнение альвеолярного газа, можно рассчитать респираторный коэффициент, то есть фактически поглощение кислорода и выделение углекислоты на единицу объема вдыхаемого и выдыхаемого воздуха. Сопоставив эти показатели с величиной минутного объема вентиляции, можно оценить величину потребления организмом энергии и подобрать эффективную нутритивную поддержку.
Если величину респираторного коэффициента считать неизменной в течение коротких промежутков времени, то уравнение альвеолярного газа упрощается:
РАО2 = РIО2 - (1,25 × PAСО2),
Измеряя конечно-выдыхаемые величины PAСО2, можно вычислить РАО2. Из этого уравнения следует, что в норме при дыхании воздухом РАО2 равно 100-110 мм рт.ст., при дыхании чистым кислородом - 550 мм рт.ст.
Для ответа на третий вопрос оценивают потребление кислорода и эффективность его обмена. Потребление кислорода может быть рассчитано при помощи прямого и обратного методов Фика.
При использовании прямого метода Фика необходимо измерение напряжения кислорода в воздухе альвеол (РАО2) с помощью метода быстрой оксиметрии. Зная напряжение кислорода во вдыхаемом воздухе (РIО2) и в выдыхаемом воздухе (РА О2), измерив минутный объем дыхания с помощью спирометрии, можно рассчитать количество поступившего в организм и оставшегося в легких кислорода. Вычитая из первой величины вторую, рассчитывают потребление кислорода.
При использовании непрямого метода Фика потребление организмом кислорода является производным сердечного выброса и разницы в содержании кислорода в артериальной (Cа) и венозной (Сv) крови
Содержание кислорода в венозной крови считают по той же формуле, что и Ca, только используют показатели напряжения кислорода и сатурации гемоглобина не в артериальной, а в венозной крови.
Сv = (0,003 х рvО2) + (0,00138 х SvО2 х Hb)
Напряжение кислорода в артериальной и венозной крови, а также сатурацию гемоглобина измеряют инвазивными и неинвазивными способами. При инвазивных способах возможна дискретная и непрерывная оценка. При дискретной оценке повторно исследуют кровь из артерии или вены в газоанализаторе. Для непрерывной оценки SvО2 используют фиброоптические катетеры. Чтобы определить потребление кислорода для всего организма, этот катетер устанавливают в легочную артерию, то есть в сосуд, содержащий смешанную венозную кровь от всего организма. Необходимо предостеречь от использования для анализа крови, взятой из периферической вены. Эта кровь отражает доставку и потребление кислорода только в том периферическом участке, от которого она оттекает, и не может служить средством оценки оксигенации венозной крови в целом. В отличие от венозной, артериальная кровь практически одинакова в любой артерии, и поэтому нет разницы, что анализировать - кровь из аорты, сонной или лучевой артерии.
Кроме описанных методов, возможно также чрескожное (транскутанное) определение р О2 (как впрочем и рСО2), при помощи специальных датчиков с прогреванием кожи под ними. Показания этих датчиков хорошо согласуются с прямым определением рО2 и рСО2 в артериальной крови у детей. Однако нет единого мнения исследователей в вопросе, можно ли метод применять у взрослых пациентов.
Для неинвазивной оценки сатурации гемоглобина артериальной крови используют пульсоксиметрию. Принцип пульсоксиметрии основан на пропускании через ткани пальца или мочки уха параинфракрасного излучения. Излучение частично проходит через ткани, частично задерживается оксигенированным гемоглобином. Величина поглощенного излучения непрерывно меняется с каждым пульсовым сокращением. Анализ этой изменяющейся величины составляет основу пульсоксиметрической оценки сатурации гемоглобина артериальной крови (рис. 5.16).
Измерение потребления и доставки кислорода позволяет оценить зависимость первого показателя от второго. В норме потребление не зависит от доставки. Однако если доставка снижается, то наступает определенный момент, когда потребление тоже начинает снижаться. В тканях постепенно прекращаются зависимые от кислорода процессы (цикл трикарбоновых кислот) и нарастает накопление лактата из-за незавершенного анаэробного гликолиза. Эти взаимоотношения отображаются характерной кривой (рис. 5.17). Большинство исследователей считает, что при сепсисе эта кривая смещается вправо, отражая нарушение утилизации кислорода тканями.
Для изучения указанных процессов нужны независимые методы оценки потребления кислорода (прямой метод Фика с использованием быстрой оксиметрии и спирометрии) и доставки кислорода (непрямой метод Фика с использованием термодилюции и анализа газового состава крови). В ряде научных исследований авторы пытаются получить информацию о доставке и потреблении, используя для измерения и того, и другого показателя только один непрямой метод. Такой подход является методологически неправильным, так как нельзя изучить зависимость или независимость этих двух показателей, сам процесс измерения которых (одним методом!) делает их зависимыми друг от друга.
Мониторинг вентиляции
Мониторинг вентиляции чаще всего сводится к анализу содержания углекислого газа в выдыхаемом воздухе с помощью капнографии и прямому определению напряжения СО2 в крови с использованием газоанализатора.
При проведении анализа содержания углекислого газа нужно соблюдать ряд методологических условий. Главное из них - необходимость определенного промежутка времени перед проведением анализа после изменения параметров вентиляции легких. В организме существуют большие резервуары углекислоты с различной емкостью и скоростью наполнения и высвобождения СО2. Это приводит к значительной отсрочке стабилизации уровня СО2 - через 10 мин после гипервентиляции и 40 мин после гиповентиляции (J.J. Marini, A.P. Wheeler, 1997).
Прямое определение рСО2 в артериальной крови производят обычно одновременно с определением рО2 при заборе проб артериальной крови. Динамический контроль напряжения углекислого газа можно проводить, используя пробы венозной крови, где рСО2 обычно выше на 3-8 мм рт.ст., чем в артерии. Для анализа берут кровь из центральной вены или легочной артерии, но не из периферической вены.
При анализе выдыхаемого газа концентрация СО2 чаще всего представляют в качестве функции времени, реже - функции объема выдыхаемого газа. Изменения СО 2 во времени менее информативны, однако позволяют оценить степень нарушения вентиляционно-перфузионных отношений по форме кривой, мониторировать ритм дыхания, определить наличие гипо- и гипервентиляции (рис. 5.18). При отсутствии изменений нормальной кривой можно оценить напряжение углекислого газа в артериальной крови (рaСО2) по его напряжению в конечно-выдыхаемых (end tidal) порциях альвеолярного воздуха (рETСО 2 ). В норме величина градиента рaСО 2 - рETСО 2 равна 3-8 мм рт.ст. При развитии грубых нарушений вентиляционно-перфузионных отношений (ТЭЛА, ОРДС, аспирации крови и желудочного содержимого в трахею) этот градиент значительно возрастает. Изменяется также форма кривой напряжения углекислого газа в конечно-выдыхаемом воздухе. Минимизация величины рaСО 2 - рETСО 2 может использоваться как метод подбора оптимального РЕЕР.
Более информативно представление концентрации СО 2 в качестве функции объема выдыхаемого газа. Это позволяет определить, кроме указанных показателей, также среднюю концентрацию СО 2 в выдыхаемом газе и рассчитать величину дыхательного мертвого пространства, соотнесенного с дыхательным объемом (рис. 5.19).
Мониторинг механических свойств легких и грудной клетки
Показатели, имеющие клиническое значение для оценки динамики легочных нарушений - податливость (compliance - С), сопротивление (resistance - R), среднее давление в дыхательных путях (mPaw) и аутоРЕЕР.
Податливость.
Податливость - это изменение объема (volume, V), соотнесенное к изменениям давления (pressure, P):
С = ∆V/ ∆P.
Различают податливость легких (СL), грудной клетки (СW) и респираторной системы (СRS), но на практике оценивают обычно только последний показатель. Для расчета величины ∆V при проведении ИВЛ следует учитывать потери части дыхательного объема (VT) в контуре респиратора. Для приблизительного расчета используют специальную величину - фактор компрессии дыхательного контура (circuit compression factor - Сcf). Для большинства дыхательных контуров она считается равной 3 мл кислородно-воздушной смеси на каждый сантиметр водного столба пикового давления, подаваемого респиратором при вдохе.
Для измерения податливости нужно «выключить» с помощью медикаментов спонтанное дыхание больного и измерить давление в дыхательных путях во время пауз вдоха и выдоха (создать так называемые пассивные условия). Для чего нужны эти паузы? Нас интересует давление во всей респираторной системе, но измерить можно только давление на конце интубационной трубки. Чтобы это измеряемое давление отражало показатели давления в альвеолах, в бронхах, трахее и у конца интубационной трубки, создаются короткие паузы в конце вдоха и выдоха. Вследствие этого величины давления в разных частях респираторной системы временно уравниваются. Податливость респираторной системы определяется следующим образом:
СRS = VT × Сcf / PplatoInsp - PplatoExsp,
где PplatoInsp - давление на плато вдоха (inspiration) в условиях окончания вдоха и остановки потока, PplatoExsp - давление на плато выдоха (expiration) в условиях окончания выдоха и остановки потока (рис. 5.20). Нижняя граница нормы для величины податливости системы грудная клетка-легкие - 120-150 мл/см вод. ст. или 1,5-2 мл/см вод.ст на 1 кг массы тела.
Для раздельной оценки податливости грудной клетки и легких необходимо дополнительное измерение давления в пищеводе, которое отражает внутриплевральное давление. В настоящее время средствами раздельной оценки податливости легких и грудной клетки снабжены некоторые современные аппараты ИВЛ, что позволяет оптимизировать проведение респираторной поддержки при тяжелых дыхательных расстройствах.
Сопротивление
Различают инспираторное сопротивление дыхательных путей и экспираторное. Экспираторное сопротивление всегда больше, чем инспираторное, причем эта разница возрастает при патологии. Однако на практике обычно оценивают только инспираторное сопротивление (рис. 5.21):
RI = PD - PplatoInsp /Flow,
где RI - инспираторное сопротивление, Flow - поток (обычно пиковый поток респиратора), PD - пиковое давление в дыхательных путях, PplatoInsp - давление на плато вдоха (в условиях окончания вдоха и остановки потока). Верхняя граница инспираторного сопротивления - 5 см вод.ст./л∙сек. Увеличение инспираторного сопротивления свидетельствует об ухудшении проходимости трахео-бронхиального дерева из-за бронхоспазма, отека, скопления мокроты.
Среднее давление в дыхательных путях
С некоторой долей упрощения можно считать, что среднее давление в альвеолах (alveolar mean pressure, mPalv) соответствует среднему давлению в дыхательных путях (airways mean pressure, mPaw). Среднее давление в альвеолах - это усредненное давление, которое растягивает альвеолы и грудную клетку. Следовательно, mPalv и mPaw определяют артериальную оксигенацию и сопротивление венозному возврату. Для клинических целей нужно понимать, что mPaw увеличивается при возрастании минутного объема дыхания, положительного давления в дыхательных путях в конце выдоха (positive end-expiratory pressure, РЕЕР) и времени вдоха. Эти факторы, с одной стороны, повышают оксигенацию, с другой - снижают венозный возврат и повышают опасность баро- и волюмотравмы легких.
АутоРЕЕР
АутоРЕЕР представляет собой разницу между общим (тотальным) РЕЕР и установленным врачом на панели респиратора показателем положительного давления в дыхательных путях к концу выдоха. Тотальный РЕЕР определяют по показаниям манометра респиратора в конце вдоха при создании экспираторной паузы. Наличие аутоРЕЕР свидетельствует о затруднении выдоха (рис. 5.22). Имеется две основные причины этого состояния. Первая причина - повышение сопротивления в дыхательных путях во время выдоха, вследствие чего вдох начинается при не полностью законченном выдохе. Такая ситуация вызывает постепенное нарастание количества воздуха, задержанного в легких - так называемую дыхательную гиперинфляцию (рис. 5.23). Вторая причина аутоРЕЕР - появление активности мышц вдоха во время не полностью закончившегося выдоха. Мышечная активность отражает несинхронность работы аппарата ИВЛ и дыхательных попыток больного.
Первую причину аутоРЕЕР можно компенсировать увеличением пикового потока вдоха на панели респиратора. Это приводит к укорочению времени вдоха и удлинению времени выдоха. В результате пациент успевает выдохнуть до того, как наступит новый вдох. Причиной гиперинфляции может быть нерациональное использование паузы вдоха, что вызывает избыточное удлинение фазы вдоха. Это состояние компенсируется при исключении паузы вдоха.
Во втором случае появление аутоРЕЕР свидетельствует о нерациональном подборе режимов вентиляции, причиной чего могут быть недостаточные минутный объем дыхания, чувствительность триггера, содержание кислорода во вдыхаемой смеси, аппаратный РЕЕР. Одним из способов подбора оптимального аппаратного РЕЕР является его постепенное повышение до того уровня, когда исчезает аутоРЕЕР.
Расчет податливости, сопротивления, среднего давления в дыхательных путях и аутоРЕЕР производится на основе анализа обычных кривых, отражающих изменение давления в дыхательных путях, объема и потока газа во времени: кривые «давление в дыхательных путях - время», «поток воздуха - время», «объем воздуха - время» (рис. 5.23) Современные респираторы позволяют получать информацию также в виде петель давление-объем (P-V-петля) и поток-объем (F-V-петля) (рис. 5.24).
Принципиально новой информации они не несут, но делают ее представление более наглядным. Например, появление характерного «клюва» на петле давление-объем свидетельствует о снижении податливости легких и их перерастяжении вдуваемым дыхательным объемом. Разорванность петли поток-объем свидетельствует о наличии утечек в контуре аппарата ИВЛ.
Читайте также:
