КТ, МРТ, ангиограмма при дуральной фистуле задней черепной ямки с интраспинальным сбросом
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Это сосудистая мальформация головного мозга , представляющая собой соединения между двумя кровеносными сосудами, а именно между артерией и веной твердой мозговой оболочки.
- Наиболее частая локализация: поперечный (50%) и пещеристый синус (16%).
- Частота: 10-15% всех внутричерепных артериовенозных сосудистых мальформаций
- Локальный артериовенозный шунт в твердой мозговой оболочке (стенка синуса, венозное сплетение основания черепа, место, где кортикальные вены впадают в венозный синус).
- Этиология неизвестна; вероятно, возникает вследствие приобретенной патологии синуса твердой мозговой оболочки, например, воспаления, тромбоза или травмы.
Классификация и планирование лечения (Djidjian Merland):
- Тип I: Дренирование в венозный синус с нормальным направлением кровотока (рефлюкс отсутствует)
- Тип II: Дренирование в венозный синус с рефлюксом в другой синус или в вены
- Тип II а: Рефлюкс в близлежащий синус
- Тип II b: Рефлюкс в кортикальные вены
- Тип III: Прямой отток в кортикальные вены
- Тип IV: Аналогично типу III, но с варикозно расширенными венами
- Тип V: Краниальные фистулы с перимедуллярным венозным или ради- куломедуллярным дренированием.
Клинические проявления
- Данная сосудистая мальформация головного мозга имеет множественные симптомы и проявления.
- В зависимости от типа фистулы она может быть бессимптомной;
- вызывать функциональные симптомы, например, звон в ушах (тип I);
- повышенное внутричерепное давление (сниженная острота зрения, хемоз, экзофтальм, головная боль, вклинение миндалин мозжечка; тип II а);
- очаговую неврологическую симптоматику, миелопатию и внутримозговое кровоизлияние (типы IIЬ, II а и Ь, и III-V).
Какой метод диагностики фистулы выбрать: МРТ, КТ, ангиографию
Метод выбора:
Что покажут снимки КТ и МРТ головного мозга наличии фистулы
- Обычно неинформативны
- Нередко имеется частичная или полная окклюзия пораженного венозного синуса вследствие тромбоза
- Реже артерия, питающая фистулу, расширена или имеется артериальный кровоток в дренирующих венах.
Проводят ли ангиографию сосудов мозга
- Одна питающая артерия, несколько питающих артерий или фистула, возникающая непосредственно из крупной артерии, например, из внутренней сонной артерии.
- Они часто кровоснабжают дуральный синус через диффузную сосудистую сеть, что приводит к его преждевременному контрастному усилению
- В зависимости от типа фистулы также наблюдается контрастное усиление кортикальных вен или верхней глазной вены
Что хотел бы знать лечащий врач?
- Визуализация всех питающих артерий
- Подтвердить и установить локализацию фистулы
- Определение типа фистулы
Какие заболевания имеют симптомы, схожие с артериовенозной фистулой оболочки мозга
Пиальная АВМ:
- Артериовенозное «короткое замыкание» в мягкой мозговой оболочке
Гломусные опухоли:
-Типичная МР-картина с опухолеподобным «солидным» контрастным усилением и характерной картиной «соли и перца»
-Локализация: бифуркация общей сонной артерии (сонный гломус), верхний узел (яремный ганглий) или нижний узел (узловатый ганглий) блуждающего нерва, барабанная полость.
Дуральная артериовенозная фистула — редкая причина пульсирующего шума в ухе

Ключевые слова
Полный текст
АКТУАЛЬНОСТЬ
Шум в ухе или обоих ушах (тиннитус, от лат. tinnire — звенеть) представляет собой звуковое ощущение, не связанное с внешним акустическим стимулом [1]. Пациенты описывают его как звук, исходящий из одного или обоих ушей, находящийся внутри головы, или как внешний отдаленный шум, который «гудит, звенит, шипит, пульсирует» или имитирует другие знакомые звуки. Шум возникает периодически или ощущается постоянно, но неизменно снижает качество жизни пациентов [2].
ДУРАЛЬНЫЕ АРТЕРИОВЕНОЗНЫЕ ФИСТУЛЫ
Последний фактор имеет важное значение в формировании приобретенных дуральных фистул. В одном из исследований подобная коморбидность выявлена в 72% случаев [10]. Развитию тромбоза венозного синуса и кортикальных вен способствуют гормональные изменения, связанные с беременностью, родами или, напротив, с использованием оральных контрацептивов; прокоагулянтное состояние крови: дефицит протеинов С и S, антитромбина III, мутации в генах II, V факторов свертывания; травмы головы, внутричерепные хирургические вмешательства, компрессия и окклюзия венозного синуса опухолью (чаще всего менингиомой), отиты и синуситы 13.
Существуют две гипотезы формирования ДАВФ в условиях синус-тромбоза. Согласно первой, повышение венозного давления, связанное с тромбозом и обструкцией венозного оттока, приводит к открытию ранее существующих физиологических шунтов в твердой мозговой оболочке с постепенной гипертрофией стенки синуса и формированием ДАВФ [13]. Изменение интракраниального гомеостаза на фоне тромбоза лежит в основе второй гипотезы. Длительная церебральная венозная гипертензия становится причиной развития локальной хронической гипоперфузии головного мозга, маркерами которой являются низкое церебральное перфузионное давление и снижение регионарного мозгового кровотока. В этих условиях усиление экспрессии фактора-1α (Hypoxia-inducible factor 1-alpha, HIF-1α) и эндотелиального фактора роста сосудов (Vascular endothelial growth factor, VEGF) приводит к аберрантному ангиогенезу и образованию ДАВФ [14].
Классификация
Среди неврологов и нейрохирургов наибольшее признание получили классификации дуральных соустий (1995) по Borden и Cognard 10. В обеих делается акцент на оценку ретроградного лептоменингеального и коркового венозного сброса, характеристики которых важны для выбора тактики ведения пациента с ДАВФ 12. В 2015 г. Комитетом по стандартам и правилам Общества нейроэндоваскулярной хирургии (Standard and Guidelines Committee for the Society of Neurointenventional Surgery) была предложена упрощенная классификация (SNIS S&G Classification), согласно которой ДАВФ делят на тип 1 (неагрессивный, без кортикального венозного рефлюкса) и тип 2 (агрессивный, с кортикальным венозным рефлюксом). Каждый из них может быть бессимптомным и симптомным, требующим срочного хирургического вмешательства [16].
Клиническая картина
При наличии ДАВФ больные чаще всего предъявляют жалобы на пульсирующий шум в ухе (81% случаев) и головную боль (15%), связанную с раздражением рецепторов менингеальных сосудов [9]. Внезапное появление головной боли и общемозговых симптомов — признак внутричерепного кровоизлияния (10%) [10].
Особенности других симптомов, возникающих в дебюте и при прогрессировании заболевания, во многом определяются локализацией фистул. Нарушение венозного оттока из глазных вен при каротидно-кавернозном соустье, локализованном в передней черепной ямке, может приводить к внутриглазной гипертензии, периокулярному отеку. Следствием этого являются развитие ретроорбитальной боли, периорбитального отека, хемоза, птоза, диплопии (вследствие наружной офтальмоплегии), а также снижение остроты зрения [7, 13], в редких случаях — ретинопатия и глаукома [9].
Пульсирующий шум в ухе может быть единственным симптомом фистулы поперечного или сигмовидного синусов, которые составляют до 80% при ДАВФ средней черепной ямки. Шум часто невыносимый, выматывающий больного. Возникновение его связано с увеличением объема крови, поступающей напрямую под высоким давлением из питающих артерий в венозные синусы, что вызывает в них турбулентный кровоток, синхронизированный с систолической фазой сердцебиения [13, 15]. В 40% случаев он выслушивается врачом при аускультации [17]. Затылочная артерия, участвующая в кровоснабжении ДАВФ этой области, обычно гипертрофирована. Ее прижатие к сосцевидному отростку уменьшает шум при физикальном осмотре [15]. Наличие пульсирующего шума в ухе, слышимого пациентом и/или врачом при аускультации над сосцевидным отростком, служит показанием к нейровизуализационному исследованию [10].
ДАВФ, расположенные субтенториально, — значимый фактор риска развития инфаркта ствола мозга, шейной миелопатии [10]. Изолированное поражение черепных нервов обусловлено их компрессией гипертрофированными питающими артериями или дренирующими венами [13].
Разрыв кортикальных вен, в зависимости от их расположения, приводит к внутримозговому, субарахноидальному или субдуральному кровоизлиянию. Кроме того, мощный шунтирующий поток, независимо от наличия или отсутствия тромбоза венозного синуса, может вызывать дистально от места поражения локальную или системную венозную гипертензию, развитие венозного геморрагического инфаркта. При повышении венозного давления возрастает и внутричерепное, вследствие этого в фазу декомпенсации клинические проявления заболевания могут напоминать таковые при объемном образовании (симптомы псевдоопухоли), начиная от головной боли, тошноты/рвоты, снижения остроты зрения вследствие отека соска зрительного нерва, до фокальных неврологических нарушений, включая гемигиперестезию, гемипарез, афазию. В тяжелых случаях развиваются когнитивная дисфункция, локальные или генерализованные судороги, сопор, кома [7, 9, 11].
Некоторые мальформации остаются бессимптомными или сохраняют стабильную клиническую и ангиографическую картину на протяжении многих лет, подвергаются спонтанной инволюции со стабилизацией или уменьшением неврологических симптомов. Факторы, предрасполагающие к регрессу заболевания, остаются неизвестными [8].
Диагностика
На начальном этапе для диагностики сосудистых мальформаций целесообразно проведение магнитно-резонансной (МР) ангио- и веносинусографии. Времяпролетная МР-ангиография (Time of flight, TOF) позволяет выявить особенности перестройки сосудистой системы при ДАВФ: увеличение числа и размера питающих артерий, расширение дренирующих вен, наличие сосудистой сети в дуральном синусе или мозговых оболочках, состояние коллатерального кровообращения и венозного оттока. МР-изображения, взвешенные по магнитной восприимчивости (susceptibility weighted imaging, SWI), обнаруживают признаки гипертензии кортикальных вен или небольшое кровоизлияние [15, 18-20].
Бесконтрастная компьютерная томография (КТ) головного мозга эффективна только в диагностике неблагоприятных исходов ДАВФ — кровоизлияний и отека мозга, однако КТ-ангиография способна идентифицировать измененные артерии и вены, выраженную сосудистую сеть в дуральном синусе или мозговых оболочках, тромбоз венозного синуса. В ряде случаев аномальная перестройка сосудистой сети может быть скрыта артефактами, исходящими от костей черепа. Используя алгоритмы реконструкции для удаления костных структур на изображениях, недостатки исследования могут быть устранены [12, 21]. Однако «золотым стандартом» диагностики ДАВФ остается цифровая субтракционная ангиография [2, 10]. Благодаря высокому пространственному и временному разрешению катетерная ангиография позволяет получить информацию о расположении и анатомических особенностях соустья, идентифицировать важные особенности ДАВФ, такие как наличие кортикального рефлюкса, обструкции венозного оттока, аневризмы [9, 15, 19].
Ультразвуковые методы, в частности дуплексное сканирование брахиоцефальных сосудов, транскраниальная допплерография и транскраниальное дуплексное сканирование интракраниальных сосудов, являются дополнительными методами диагностики ДАВФ, особенно для лиц с неспецифическими проявлениями. Основными преимуществами ультразвуковых методов являются неинвазивность, широкая распространенность и относительно невысокая стоимость по сравнению с остальными ангиовизуализационными методами диагностики [22]. У пациентов с ДАВФ при проведении ультразвуковых методов регистрируются более низкие индексы периферического сопротивления (индексы Гослинга и Пурсело) в питающих артериях, включая наружную сонную артерию и ее ветви (например, в затылочной артерии). Доказано, что значение индексов периферического сопротивления в питающих артериях коррелирует с эффективностью лечения и клинической эволюцией ДАВФ. Кроме того, у больных с ДАВФ транскраниальные методы выявляют высокую скорость кровотока, обратное направление потока крови и аномальную форму допплеровской волны (артериализация кровотока) в церебральных венах и синусах, глазных венах [23].
Независимо от исходных диагностических результатов или вариантов лечения, долгосрочное ангиографическое и/или ультразвуковое наблюдение рекомендовано всем пациентам с ДАВФ [24].
Лечение
Оптимальный метод лечения ДАВФ — полная элиминация фистулы. Эндоваскулярные вмешательства в виде трансартериальной, трансвенозной или комбинированной эмболизации в последние годы являются наиболее предпочтительными. В технически сложных случаях возможно проведение эндоваскулярного вмешательства с последующей микрохирургической резекцией [25]. При неэффективности или невозможности использования эндоваскулярных подходов осуществляют интраоперационную эмболизацию менингеальных артерий или вен, резекцию твердой мозговой оболочки [6]. Стереотаксическая радиохирургия применяется при высоком риске оперативного вмешательства или в случаях, когда проведение трансвенозной или трансартериальной эмболизации фистулы невозможно [12, 25]. С помощью гамма-ножа, линейных ускорителей или протонных пучков устранение фистулы достигается благодаря направленной доставке определенной дозы интенсивного излучения в зону ее локализации [26].
Ниже представлено клиническое наблюдение пациента, причиной пульсирующего шума у которого стала дуральная артериовенозная фистула.
КЛИНИЧЕСКИЙ ПРИМЕР
О пациенте
Пациент Д., 64 года, обратился с жалобами на постоянный пульсирующий шум за левым ухом, который усиливался в тишине, преимущественно в ночное время, в связи с чем Д. стал испытывать трудности засыпания.
Из анамнеза заболевания известно, что на протяжении последних двух лет Д. отмечал умеренное снижение слуха на оба уха, наблюдался у оториноларинголога с диагнозом нейросенсорной тугоухости. Периодически отмечал пульсирующий шум в левом ухе, который слышал во время засыпания, однако смена позы или поворот головы помогали устранить его. С сентября 2019 г. пульсация стала беспокоить независимо от времени суток с усилением в период отсутствия окружающего шума (ранние утренние часы, тихое помещение, шумоподавление и пр.). Нарушился ночной сон — не мог долго уснуть, смена положения тела и головы не давала должного эффекта. Стал тревожным, раздражительным из-за депривации сна и навязчивых ощущений. Лечился в неврологическом стационаре по направлению поликлиники, проводился курс сосудистой, нейрометаболической терапии без эффекта. Обращался в психоневрологический диспансер, где был установлен диагноз «Сенестопатическое расстройство». Назначены противотревожные, снотворные препараты.
Из анамнеза жизни известно, что в течение многих лет Д. страдает пароксизмальной формой мерцательной аритмии, артериальной гипертонией I степени; постоянно принимает антикоагулянты, гипотензивную терапию. Заболевания органов слуха, травмы, оперативные вмешательства области головы, перенесенные инфекционные заболевания отрицает.
Исследования при поступлении и окончательный диагноз
При осмотре пациента выявлена пульсация мочки уха слева, при аускультации заушной области над сосцевидным отростком выслушивался интенсивный пульсирующий шум, совпадающий с тонами сердца. Сопоставление анамнеза и клинических данных позволило заподозрить наличие сосудистой мальформации, требующей подтверждения с помощью ультразвуковых и/или нейровизуализационных методов исследования.
Проведенное дуплексное сканирование сосудов головы обнаружило признаки артериовенозной мальформации в бассейне левой наружной сонной артерии с артериализацией и усилением кровотока по внутренней яремной вене. Усиление скорости кровотока по задней околоушной артерии позволило предположить ее в качестве «питающего» сосуда (рис. 1). Контрастная МР-ангиография подтвердила наличие артериовенозного соустья с вовлечением поперечного и частично сигмовидного синусов слева (рис. 2).
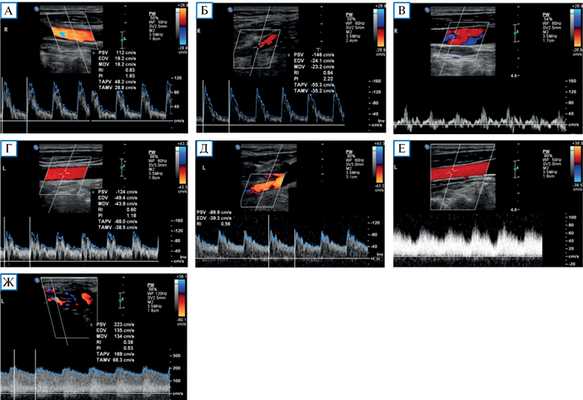
Рис. 1. Дуплексное сканирование сосудов шеи
Примечание. Кровоток по общей сонной артерии (А) и наружной сонной артерии (Б) справа с нормальными индексами периферического сопротивления (PI и RI). Физиологический трехфазный кровоток по правой внутренней яремной вене (В). Кровоток по общей сонной артерии (Г) и наружной сонной артерии (Д) слева со сниженными индексами периферического сопротивления. Артериализация кровотока по левой внутренней яремной вене (Е). Значительно повышенный кровоток с низкими индексами периферического сопротивления по задней околоушной артерии (ветви наружной сонной артерии) в области артериовенозной мальформации (Ж).
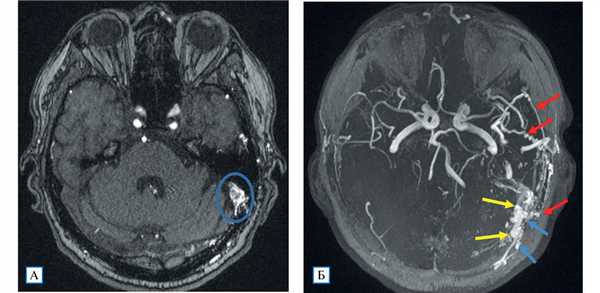
Рис. 2. МР-ангиография (3D TOF-ангиография)
Примечание. А — сброс крови из ветвей наружной сонной артерии в левый поперечный синус; Б — аксиальная MIP-реконструкция: визуализируются нормальные артерии Виллизиева круга; слева расширенные и извитые ветви наружной сонной артерии (алые стрелки), из которых происходит сброс крови в поперечный и сигмовидный синусы (желтые стрелки), извитость и расширение дуральных вен вследствие полнокровия (голубые стрелки).
Пациент консультирован нейрохирургом, запланировано эндоваскулярное лечение фистулы.
ЗАКЛЮЧЕНИЕ
Дуральные артериовенозные фистулы — редкая форма патологии. Знание и правильная оценка ее симптомов — необходимое условие для адекватной интерпретации клинических данных, выбора методов обследования больного, определения прогноза заболевания и тактики лечения.
Опухоли задней черепной ямки
Задняя черепная ямка (ЗЧЯ) является наиболее часто является местом локализации опухолей у детей. Медуллобластомы и астроцитомы мозжечка у них составляют почти две трети всех опухолей ЗЧЯ. Оставшуюся одну треть занимают эпендимомы и глиомы ствола мозга. У всех больных с опухолями этой локализации доминируют клинические симптомы, связанные с дисфункцией мозжечка (атаксия, тошнота и рвота).
Взрослые
- Метастатическое поражение (в особенности рак легкого и молочных желез, а также меланома, опухоли щитовидной железы, почечно-клеточный рак).
- Гемангиобластома — наиболее часто встречаемая первичная опухоль головного мозга
- Медуллобластома и астроцитома встречается в 1% случаев у взрослых в области задней черепной ямки.
Детский возраст
- Астроцитомы
- Пилоцитарная астроцитома — наиболее часто встречаемая
- Глиома ствола головного мозга
Медуллобластома
Медуллобластома - высокозлокачественная (IV тип по классификации ВОЗ) опухоль, которая чаще всего (75%) растет из червя мозжечка. Она является второй по частоте (после астроцитомы) опухолью у детей и наиболее частой опухолью задней черепной ямки в детской популяции.
КТ
При КТ медуллобластомы обычно выглядят как солидные гиперденсивные опухоли. Кистозные изменения и некроз встречаются в 50% случаев, кальцинаты - в 20%, кровоизлияния наблюдаются редко. КТ без контрастного вещества является наиболее надежным методом для дифференциации с астроцитомами мозжечка.
Астроцитома обычно бывает изо- и гиподенсивная, в то время как медуллобластома гиперденсивна, что отражает плотную клеточную структуру опухоли.
МРТ
При МРТ медуллобластомы обычно гипоинтенсивны по сравнению с серым веществом на изображениях в режиме T1 и чрезвычайно разнообразны на изображениях в режиме T2. Почти всегда присутствует перитуморальный отек. Накопление контрастного вещества интенсивное и гетерогенное. Медуллобластомы метастазируют ликворным путем и обычно выявляются, как накапливающие контраст в месте операции, в желудочках, интратекально в позвоночном канале, особенно вдоль заднего края спинного мозга. Системные метастазы встречаются в 5% случаев, часто поражая кости.
Пилоцитарная астроцитома
Пилоцитарная астроцитома - медленно растущая, хорошо отграниченная наиболее часто встречающаяся опухоль головного мозга у детей. Большинство пилоцитарных астроцитом (60%) локализуется субтенториально, однако опухоль может поражать любой участок мозга, особенно зрительные нервы (глиома зрительного нерва) и хиазму/гипоталамус.
Клинические симптомы отражают локализацию опухоли. Пилоцитарные астроцитомы классифицируются по системе ВОЗ как опухоли I степени злокачественности, с медленным ростом и чрезвычайно редким рецидивированием и диссеминацией.
Радиологические находки
Классический радиологический внешний вид пилоцитарной астроцитомы мозжечка - это хорошо отграниченная, в основном кистозная опухоль с интенсивно накапливающим контрастное вещество узлом, сходная с гемангиобластомой.
Соответственно, эта опухоль гиподенсивна при КТ, выглядит как хорошо отграниченное объемное образование в черве или гемисфере мозжечка с солидным участком, который является изо- и гиподенсивным по сравнению с тканью головного мозга.
При МРТ эти опухоли изогипоинтенсивны в сравнении с серым веществом на изображениях при коротком TR и гиперинтенсивны при длинном TR. Кистозная часть нередко содержит белковую жидкость, и поэтому может отличаться по сигналу от ликвора. Окружающий отек встречается редко. Солидный компонент обычно накапливает контраст в различной степени.
Эпендимома
Эпендимомы составляют примерно 6-12% всех интракраниальных опухолей и встречаются в основном у детей и подростков (средний возраст около 6 лет). Существует второй возрастной пик - в 30-40 лет.
Эпендимомы возникают из эпендимальной выстилки желудочков и центрального канала спинного мозга. Они являются медленно растущими, солидными, хорошо отграниченными опухолями, которые скорее смещают, чем инфильтрируют окружающую паренхиму головного мозга и классифицируются по системе ВОЗ как опухоли II степени злокачественности.
Частыми признаками являются наличие кровоизлияния и кальцификации. Кистозные изменения чаще встречаются при супратенториальных эпендимомах.
Эпендимомы обычно изоденсивны по сравнению с мозгом при КТ без контраста. Большие участки кальцификации (50%), кисты (15%), кровоизлияния (10%) являются частыми признаками и обусловливают гетерогенный внешний вид опухоли.
При МРТ эпендимомы выглядят хорошо отграниченными новообразованями, несколько гипоинтенсивными в сравнении с серым веществом на изображениях при коротком TR и гиперинтенсивными при длинном TR. Кистозные участки (более гиперинтенсивные) и кальцификаты (гипоинтенсивные) создают гетерогенный вид на изображениях при длинном TR. Присутствует умеренное накопление контраста в солидном узле. Распространение через отверстия из четвертого желудочка в мостомозжечковый угол или в большую затылочную цистерну является характерным признаком этих опухолей и может помочь при дифференцировании с другими опухолями ЗЧЯ детского возраста.
Глиома ствола головного мозга
Глиомы ствола головного мозга представляют исключительно гетерогенную группу опухолей головного мозга и составляют примерно 15% всех детских новообразований ЦНС.
Клиническая симптоматика зависит от вовлечения в опухоль ядер черепных нервов и проводящих путей ствола.
Глиомы ствола возникают в мосту (наиболее часто), среднем или продолговатом мозге и могут быть диффузными, фокальными и смешанными. Большинство глиом ствола (60%) считаются опухолями низкой степени злокачественности, хотя часто встречается гистологическая гетерогенность даже внутри одной опухоли.
При КТ в типичных случаях глиома ствола выглядит как фокальная, гипо- и изоденсивной плотности, с расширением моста, с чрезвычайно варьирующим усилением, которое со временем может изменяться. Степень усиления достоверно не коррелирует со злокачественностью опухоли или с уровнем выживаемости. Однако наличие гиподенсивных зон и вовлечение всего ствола мозга коррелирует с неблагоприятным исходом.
При МРТ выявляется типичное удлинение T1 и T2. Изображения при длинном TR позволяют лучше оценить истинную распространенность опухоли в силу гиперинтенсивного контраста с нормальным белым веществом. Гидроцефалия - редкий признак глиом ствола вследствие их медленного роста. Кровоизлияния или кисты встречаются в 25% случаев, чаще при фокальном, а не диффузном росте. Примерно одна треть изображений этих опухолей усиливается после введения контрастного вещества. Накопление последнего не является надежным прогностическим признаком.
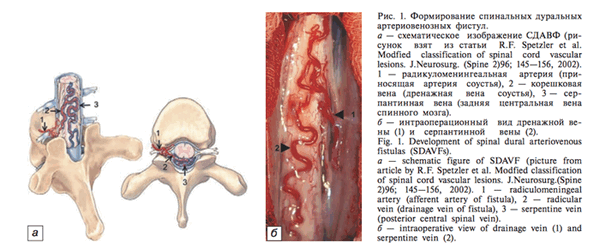
Спинальные дуральные артериовенозные фистулы (СДАВФ)
Спинальные дуральные фистулы (СДАВФ) являются наиболее распространенным типом сосудистой мальформации спинного мозга и составляет ~70% всех поражений.
Эпидемиология
Чаще болеют мужчины (5:1). Пик заболеваемости между 5 и 6 декадой.
Патоморфология
Спинальные дуральные артериовенозные фистулы являются разновидностью артериовенозных мальформаций (АВМ) и характеризуются образованием патологического соустья между артериями твердой оболочки спинного мозга, дурального выворота корешка и спинальной сегментарной дренирующей веной. Заболевание характеризуется шунтированием в спинальную венозную систему (перимедуллярные вены) большого количества крови, повышением венозного давления во всей спинальной венозной системе, что затрудняет отток крови из капиллярной системы спинного мозга, обусловливает возникновение так называемой «гипертензивной венозной миелопатиии»
![1]()
Клинические проявления
В случае локализации артериовенозной дуральной фистулы в спинальной твердой мозговой оболочке, проявления связаны со сдавлением фистулой нервных корешков или ткани спинного мозга. При этом, симптоматика обычно медленно прогрессирует. Отмечаются парезы и параличи ног, иногда и рук, нарушается чувствительность ног, а также страдают функции кишечника и мочевого пузыря. Все это связано с характерной поясничной локализацией дуральной спинальной фистулы. У мужчин может быть импотенция.
Радиологические признаки
Информативность компьютерно-томографической ангиографии при аневризмах головного мозга
В статье показано, что метод компьютерно - томографической ангиографии (КТА) позволяет неинвазивно и с высокой точностью оценить сосудистые структуры на большом протяжении. Проанализированные результаты КТА 35 пациентов позволили выявить важнейшие характеристики аневризм, необходимые для выработки дальнейшей лечебной тактики.
Статья
ординатор кафедры нейрохирургии ФГБОУ ДПО РМАНПО Минздрава РФ
ординатор кафедры лучевой диагностики и лучевой терапии им. Н.Е. Штерна СГМУ
зав. кафедрой нейрохирургии ФГБОУ ДПО РМАНПО
Минздрава РФ, д.м.н., профессор Древаль О.Н.;
к.м.н., доцент Илясова Е.Б. ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского МЗ РФ,
кафедра лучевой диагностики и лучевой терапии им. Н.Е. Штерна СГМУ.
Актуальность
Компьютерно-томографическая ангиография используется при подозрении на сосудистые изменения различной локализации, в том числе головного мозга. КТА - это метод выбора при острой сосудистой патологии: аневризма, расслоение аорты, тромбоэмболия легочной артерии. Смертность при разрыве аневризмы составляет около 65%, в связи с чем своевременное выявление этой жизнеугрожающей патологии является крайне важным для предупреждения фатальных последствий. Учитывая вышеизложенное, изучение возможностей метода компьютерной томографии для своевременной диагностики внутричерепных аневризм является актуальным.
Цель исследования
Оценка информативности КТА при аневризмах сосудов головного мозга.
Материалы и методы
Проведен выборочный анализ 35 историй болезни с детальной оценкой результатов КТА головного мозга пациентов, у которых в ГУЗ «Областная клиническая больница» был поставлен окончательный клинический диагноз аневризмы головного мозга. КТА головного мозга проводилась на компьютерном томографе Optima CT 660, для внутривенного усиления использовался Омнипак. В исследовании учитывались следующие показатели: пол, возраст пациентов, локализация патологического образования, строение, форма и размеры аневризмы, сведения о наследственной предрасположенности, наличие осложнений, результаты проведённого лечения.
Результаты
Оценка данных компьютерно-томографической ангиографии позволила диагностировать наличие 39 аневризм у 35 пациентов. В 6 % случаев (n=2) выявлены множественные (у каждого из пациентов по 3) внутричерепные аневризмы, располагающиеся в бассейнах передней мозговой и внутренних сонных артерий. Билатерально симметричных патологических образований не выявлено.
Анализ данных КТА показал, что по локализации аневризмы располагаются таким образом: на передней мозговой - передней соединительной артериях ‑ у 49% пациентов (n=18), на внутренних сонных артерий - в 27% случаев ( n=10), в области бифуркации средней мозговой артерии аневризмы были обнаружены у 19% пациентов ( n=7 ), наиболее редкая локализация аневризм в нашем исследовании - базилярная артерия - 5% ( n=2 ). Следовательно, преобладающей локализацией аневризм являлись передние отделы Виллизиева круга.
Анализ клинической картины и анамнестических данных позволил выявить наследственную предрасположенность к формированию аневризм у 19% пациентов (n=7): наличие дисплазии соединительной ткани у шести из них и поликистоза почек у одного. Эти результаты совпадают с литературными данными о том, что хотя происхождение аневризм многофакторное, но наибольшее значение имеет наследственная предрасположенность в виде системных изменений соединительной ткани. Поэтому всем таким пациентам необходимо проводить исследование церебральных сосудов с помощью метода КТА.
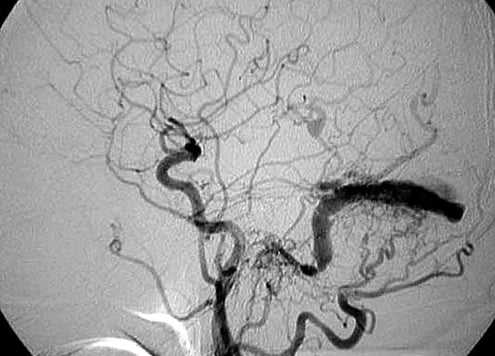
У одного из пациентов, наряду с наличием аневризмы супраклиноидного отдела левой внутренней сонной артерии, обнаружена сосудистая мальформация - дуральная артерио-венозная фистула в области задней черепной ямки с афферентацией в синусный сток (Рис. 1). В соответствии с тем, что происхождение аневризм и сосудистых мальформаций головного мозга, возможно, имеет одинаковую природу, наличие выявленной мальформации диктует необходимость поиска церебральных аневризм.
Большая часть (90%) всех диагностированных аневризм имела мешотчатую форму, остальные - фузиформную, а в одном наблюдении аневризма была смешанной (мешотчато-веретенообразная) формы и распологалась в месте бифуркации базилярной артерии (Рис. 2). По количеству камер все выявленные патологические образования являлись однокамерными. Определение формы аневризмы с помощью КТА имела большое значение для выбора дальнейшей тактики хирургического лечения. Так, аневризмы мешотчатой формы подвергались оперативному вмешательству с эндоваскулярным выключением аневризмы из кровотока.
При ранжировании результатов исследования по размерам аневризм получены следующие данные: у 1 пациента (3% случаев) отмечалась гигантская аневризма (27 мм в диаметре), которая располагалась в супраклиноидном отделе левой внутренней сонной артерии и имела мешотчатую форму; у 7 пациентов (20%) ‑ аневризмы больших размеров (16-25мм); у 2 пациентов (6%) ‑ милиарные аневризмы (менее 3мм в диаметре); в остальных 25 случаях (71%) ‑ обычного размера (4-15мм).
На основании данных компьютерно-томографического исследования пациенты были стратифицированы на группы по наличию осложнений:
1. Бессимптомная аневризма (не вызывала клинических симптомов и была выявлена случайно) - 6 % (n=2);
2. Неразорвавшаяся аневризма (симптомы сдавления головного мозга и черепных нервов) ‑ 20 % (n=7);
3. Разорвавшаяся аневризма (признаки внутричерепного кровотечения) ‑ 74 % (n=26).
Распределение аневризм по размерам в этих группах представлено в табл. 1.
В группе пациентов (n=2) со случайно выявленными бессимптомными внутричерепными аневризмами размеры их были милиарными (до 3 мм в диаметре). Следовательно, аневризмы столь малых размеров не приводили к развитию клинической симптоматики и были обнаружены только с помощью метода КТА. В дальнейшем они должны подвергаться контрольным исследованиям с целью наблюдения за их возможным увеличением, что будет являться показанием к хирургическому лечению.
Группа с наличием неразорвавшихся аневризм (с клиническими симптомами сдавления головного мозга и черепных нервов): 1 гигантская аневризма (27 мм в диаметре) ‑ 14%, 4 большого размера (16-25мм) - 57% и 2 - среднего (4-15мм) - 29%. В этих случаях, особенно при аневризмах больших и гигантских размеров, возникали клинические проявления вследствие сдавления ими близлежащих структур.
В группе с разрывом аневризм и внутричерепным кровоизлиянием с большей частотой встречаются аневризмы средних размеров 88% (n=23), а также большие 12% (n=3). Это можно объяснить преобладанием пациентов со средним (обычным) размером церебральных аневризм в популяции.
Заключение
1. Метод компьютерной томографической ангиографии позволяет неинвазивно и с высокой точностью оценить сосудистые структуры на большом протяжении.
2. КТА обладает высокой информативностью при выявлении аневризмы головного мозга и уточнении ее локализации, распространенности, формы, размеров (от гигантских до милиарных), структуры, что поможет в выработке лечебной тактики и определении прогноза заболевания.
3. При развитии осложнений церебральной аневризмы в виде субарахноидального кровоизлияния данный метод позволяет на раннем этапе выявить его причину, что будет способствовать предотвращению повторного кровоизлияния.
4. Выявлена зависимость возникновения внутричерепных аневризм от наличия системных заболеваний соединительной ткани, что предполагает у таких пациентов необходимость в контрольных исследованиях сосудов головного мозга с помощью КТА.
Читайте также: