КТ, МРТ оссификации желтой связки
Добавил пользователь Morpheus Обновлено: 21.01.2026
В качестве стандартных методов обследования при острой травме коленного сустава чаще всего используются клинические и рентгенологические методы. При первичном обследовании поврежденного коленного сустава врач травматолог-ортопед часто пренебрегает использованием такого современного неинвазивного метода диагностики, как магнитно-резонансная томография (МРТ). Поэтому ошибки в диагностике патологии коленного сустава в острой стадии, по мнению многих авторов, достигают 30% [1—3]. Несмотря на то что МРТ-диагностика с успехом используется в медицине начиная с 1990-х годов, в нашей стране только в последнее десятилетие произошел бурный рост активности использования современных МР-томографов с высоким разрешением изображения, увеличилось их количество [4]. Однако стоимость МРТ-исследования с каждым годом растет, что замедляет распространение и использование этого метода диагностики острых травм, в частности, коленного сустава. МР-томографы с напряжением магнитного поля от 1,5 Tesla и более позволяют с 95—98% точностью определять повреждения связочно-капсульных структур, менисков, хряща и костной ткани коленного сустава [5]. Наше внимание привлекли контузионные изменения мыщелков бедренной и большеберцовой костей и их влияние на клиническую картину повреждения передней крестообразной связки (ПКС) коленного сустава. В тактике общего лечения острой травмы коленного сустава мы стали учитывать обнаруженные при МРТ контузионные изменения костных структур, образующих коленный сустав. В момент травмы коленного сустава наиболее часто контузии подвергаются наружные мыщелки бедренной и большеберцовой костей, что на МРТ выглядит в виде сигнала низкой интенсивности в режиме Т1 и сигнала высокой интенсивности в режиме Т2 [6, 7].
Материал и методы
В период 2003—2006 гг. на базе ГМЦ № 1 Минздрава России, НМХЦ им. Н.И. Пирогова в отделении ортопедии был прооперирован 221 пациент (67 (30,4%) женщин и 154 (69,6%) мужчины) с острым повреждением ПКС и хронической нестабильностью коленного сустава. Возраст пациентов колебался от 15 до 57 лет (средний возраст составил 29,3 года).
Из общего числа пациентов острая травма коленного сустава отмечена у 86 (40,7%) пациентов, хроническая и рецидивная нестабильность коленного сустава — у 125 (59,3%) пациентов. Механизм травмы коленного сустава был связан со сгибанием, ротацией, вальгусным и варусным отведением. Клиническое и специальное обследование пациентов проводилось по стандартным методикам. При этом мы ввели МРТ-диагностику в стандартное обследование.
Все пациенты как с хронической патологией коленного сустава, так и с острой его травмой были обследованы с помощью МРТ-диагностики, что резко повысило качество дооперационной диагностики внутрисуставных повреждений коленного сустава. МРТ-диагностику выполняли на томографах 3—4-го поколения, с напряжением магнитного поля свыше 1,5 Tesla, разрешающая способность которых позволяла визуализировать повреждения связочных структур, менисков, суставного хряща, костной ткани коленного сустава (рис. 1 и 2).
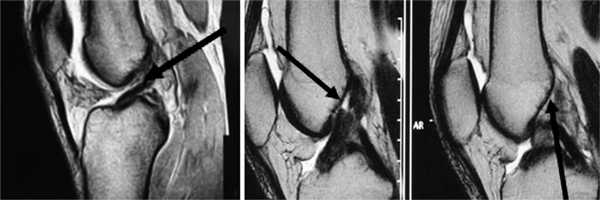
Рис. 1. Острое повреждение ПКС коленного сустава. Стрелки указывают на зоны повреждения ПКС.
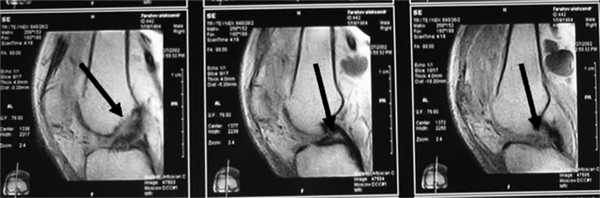
Рис. 2. МРТ старого повреждения ПКС коленного сустава. Стрелки указывают на зоны повреждения ПКС.
При МРТ-исследовании у 86 пациентов с острой травмой коленного сустава мы обнаружили в 39 (43%) случаях не только мягкотканные повреждения связочного аппарата, менисков, хряща, но и участки с контузией губчатой части мыщелков бедра и большеберцовой кости разной степени выраженности. Без применения МРТ такие травматические изменения (контузия) губчатой кости ранее вообще не диагностировались никакими другими методами. Мы обратили внимание на то, что все эти пациенты в отличие от остальных пациентов с острой травмой коленного сустава жаловались на выраженный болевой синдром и имели длительный период сгибательно-разгибательной контрактуры коленного сустава. В таких случаях мы откладывали оперативное лечение до стихания острого периода и болевых ощущений (рис. 3).
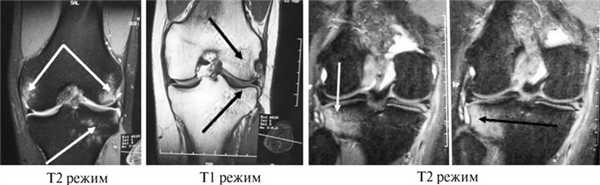
Рис. 3. МРТ-изображение коленного сустава в Т1- и Т2-режимах с участками острых контузионных изменений в мыщелках бедренной кости и наружном мыщелке большеберцовой кости (указано стрелками).
С помощью МРТ-контроля мы обнаружили, что внутрикостные кровоизлияния в мыщелках бедра и большеберцовой кости регрессировали примерно через 2—4 мес после травмы при условии целенаправленного медикаментозного и физиотерапевтического лечения именно этих контузионных явлений. По мере того как, по данным МРТ, костная ткань становилась нормальной, уменьшались болевой синдром и болевая защитная контрактура коленного сустава, возникала более благоприятная ситуация для дальнейшего оперативного лечения. И только на этом этапе всем 39 пациентам была проведена реконструкция ПКС из аутотканей по стандартным артроскопическим методикам.
Результаты
Дооперационное выполнение МРТ-диагностики всем без исключения 211 пациентам с патологией коленного сустава позволило повысить уровень диагностики острой травмы коленного сустава до 76,6%, а в хронической стадии этот процент был доведен до 100. Таким образом, в клинике нам удалось повысить качество дооперационной диагностики острого повреждения ПКС коленного сустава.
Кроме того, после операции, помимо клинического обследования, мы выполняли МРТ для еще большей объективизации результатов аутопластики ПКС коленного сустава. Контрольная МРТ проводилась через год после аутопластики ПКС (рис. 4).
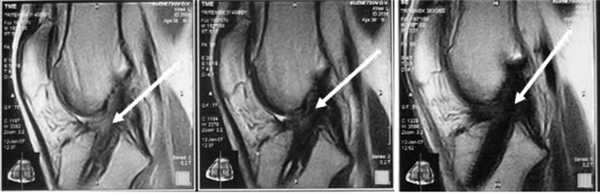
Рис. 4. МРТ-изображение трансплантата ПКС в разных срезах через 1 год после операции (указано стрелками). Трансплантат выглядит структурным, гомогенным и напряженным.
В последующем при обращении пациентов в клинику проводился МРТ-контроль в более поздние сроки. МРТ-контроль позволял определить плотность, структуру, напряжение трансплантата по наличию четкого контура, признаки его разрыхленности или повреждения (рис. 5 и 6).
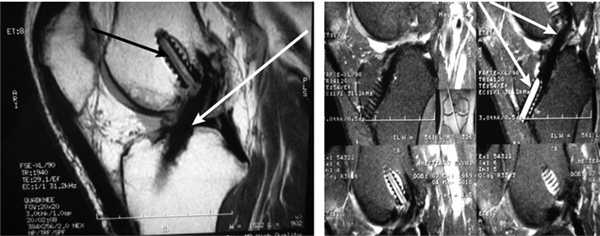
Рис. 5. МРТ коленного сустава через 3 года после аутопластики ПКС из BTB (кость—связка—кость) с фиксацией рассасывающимися винтами (стрелки указывают на хорошо сформированный трансплантат ПКС и на винты в бедренном и большеберцовом каналах). Показывают расположение трансплантата и имплантов в бедренной и большеберцовой костях.
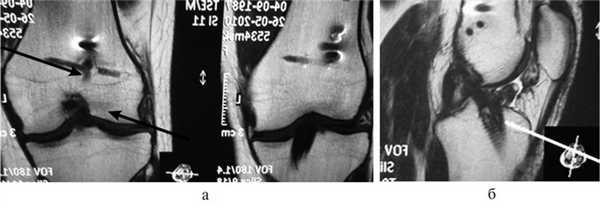
Рис. 6. МРТ левого коленного сустава через 5 лет после аутопластики ПКС из STGT (а) с поперечной фиксацией RigitFix в бедренном канале и винтом BioIntrafix в большеберцовом канале (б). Это известные аббревиатуры для травматологов-ортопедов.
Заключение
Качественная МРТ-диагностика была ранее недоступна клиницистам, что приводило к длительному болевому синдрому в коленном суставе, формированию артрогенных контрактур и других нарушений у больных. Информация, которую способна дать МРТ, особенно важна в случае выполнения операции по реконструкции ПКС. По нашему мнению, если хирург не догадывается о наличии контузии мыщелков бедра и большеберцовой кости, он не может объяснить отрицательную клиническую картину у оперированных пациентов в ближайшем послеоперационном периоде.
Таким образом, не умаляя необходимости проведения полноценного клинического обследования, мы считаем, что МРТ-диагностика должна стать в нашей стране стандартным методом исследования патологии не только коленного, но и любого другого сустава как в хронической, так и в острой стадии, и особенно в острой. Кроме того, МРТ-диагностика крайне полезна для послеоперационного наблюдения за трансплантатом ПКС при условии использования рассасывающихся фиксирующих имплантатов.
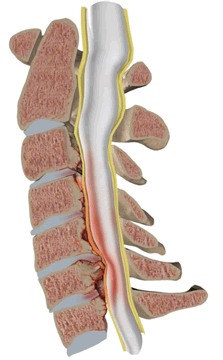
Оссификация желтой связки
Оссификация желтой связки - это линейное поражение связок дуги позвонка, характеризующееся линейной оссификацией в толще связки.
Эпидемиология
Чаще встречается на 4-6 декадах жизни, преимущественно у мужчин, ;чаще встречается в японской, северо-африканской популяциях.
Сочетанная патология
- Диффузный идиопатический скелетный гиперостоз или болезнь Форестье.
- Синдром Барттера (тубулопатия, проявляющаяся выраженными нарушениями электролитного обмена)
- Гипомагниемия
Клинические проявления
Наиболее частыми признаками являются хронические симптомы миелопатии грудного отдела позвоночника, проявляющиеся трудностями при передвижениях, слабостью мышц, болью в спине и парестезии в нижних конечностях. Изначально клиника поражения задних столбов спинного мозга, а вторичные проявления уже будут прогрессирующий спастический парапарез.
Диагностика
Рентгенография
Тонкая неравномерная оссификация тканей вдоль вентральной поверхности дуги позвонка.
Компьютерная томография
Неравномерное утолщение желтой связки, в которых определяются зоны оссификации.
Магнитно-резонансная томография (МРТ)
- Т1-взвешенное изображение
- гипо- и гиперинтенсивные линейные зоны в толще желтой связки, которые могут компримировать спинной мозг
- гипоинтенсивные линейные зоны в толще желтой связки
- гипоинтенсивное утолщение желтой связки. На GRE изображениях возможна переоценка выраженности стеноза спинномозгового канала, что обусловлено наличием артефактов магнитной восприимчивости
История и этимология
Данная патология впервые была описана Полгаром (Polgar) при боковой рентгенографии.
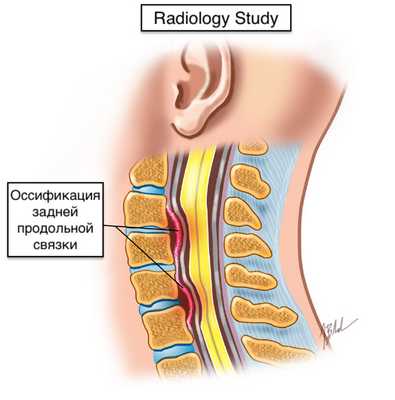
Оссификация задней продольной связки
![]()
Оссификация задней продольной связки (ОЗПС) - оссификация в толще продольной связки позвоночника.
Эпидемиология:
- Заболевание обычно развивается в возрасте старше 50 лет, младше 30 лет патология встречается редко. Мужской пол более привержен к данному заболеванию 2:1. Что касаемо этнической предрасположенности в Японии данное заболевание встречается чаще, чем в других странах в 2-4% случаях.
ОЗПС присутствует у 16% пациентов с анкилозируищим спондилитом в Мексике и 23% пациентов с этим заболеванием в Канаде.
Патология:
По поводу этиологии однозначного мнения не существует.
Возможные этиологические факторы: инфекционные агенты, аутоиммунные заболевания или травмыГенетическая предрасположенность:
- Полиморфизм гена, расположенного в 6 хромосоме (COL11А2) приводящей к изменению а-цепочки коллагена Xl типа, который ассоциируют с предраспопоженностью к ОЗПС
- Полиморфизм гена, кодирующего структуру коллагена VI типа (COL6AU -+ изменения а-цепочки коплагена VI типа, что ассоциируют с предраспопоженностью к ОЗПС.
Ассоциация:
- Гипертрофия задней продольной связки рассматривается как предвестник ОЗПС
- У 25% пациентов с ОЗПС наблюдается диффузный идиопатический скелетный гиперостоз (ДИСГ).
- ОЗПС сопровождает 16-20% случаев оссифииции желтых связок (ОЖС).
Анкилозирующий спондилит
В начальных или ранних стадиях данного заболевания определяется гипертрофированная ЗПС с единичными выключениями кальцинатов. При этом ранние изменения тяжело дифференцировать с распространенным спондилезом. У пациентов с ОЗПС отмечают большую минеральную плотность костной ткани, чем соответствующие им по возрасту здоровые люди, что возможно является предрасполагающим фактором к костеобразованию.
Макроскопические особенности:
- Массивная оссификация задней продольной связки, ограниченная нормальной кортикальной слоем кости и содержащий не изменённый костный мозг.
Формы:
- Тип 1 - Непрерывная форма - патология вдоль нескольких позвоночных сегментов.
- Тип 2 - Сегментарная форма - ограниченная оссифицированные участки позади каждого из тел позвонков.
- Тип 3 - Смешанная форма - участки оссификации, как протяжённое, так и сегментарные.
- Тип 4 - Локализованная форма - поражение не более 2 сегментов.
Клинические проявления:
Клиника миелопатии, зависящая от уровня стеноза. Клинические проявления, характерные для миелопатии, чаще развивается при диаметре спинномозгового канала менее 6 мм. При диаметре от 6 до 14 мм клинические проявления вариабельны. В более тяжёлых случаях проявления патологии обычного прогрессирующий тетра- и парапарез.
Радиологические находки:
Общие особенности:
Равномерный протяженный оссификат, расположенный вдоль задней поверхности тел позвонков, при относительно минимальных дегенеративных изменениях межпозвонковых дисков и отсутствии анкилоза дугоотростчатых суставов.
Локализация:
Чаще от среднешейного уровня (СЗ-С5) до среднегрудного уровня (Th4-Тh7)
Размеры:
От локального утолщения до протяженной непрерывной оссификации (толщина связки составляет около 2-5 мм).
Морфологические особенности:
Оссификация ЗПС приводит к уменьшению передне-заднего диаметра спинномозгового канала, что приводит к стенозу спиннопозвоночного канала, сдавление спинного мозга.
Рентгенография:
- Протяженная зона оссификации кзади от тел позвонков.
- В боковой проекции тень оссификата нередко наспаивается на тени дугоотростчатых суставов.
- При интерпретации рентгенограмм изменения могут быть настолько минимальными, что легко могут быть просмотрены, в связи с чем необходимо всегда помнить об этой патологии.
Компьютерная томография (КТ).
- Характерный вид ЗПС в виде «перевернутой буквы Т» или «галстука-бабочки» на аксиальных срезах.
- Картина оссификации ЗПС аналогичная таковой на бескострастных КТ срезах.
- Кортикальная пластинка, ограничивающая центрально расположенное костномозговое пространство, может соединиться с подлежащей покровной пластинкой.
- Тела позвонка либо быть отграниченной от нее.
- Костномозговые пространства оссифицированной ЗПС и тела позвонка не сообщаются.
Магнитно-взвешенное изображение (MPT).
T1-взвешенное изображение:
- Непрерывный оссификат расположенный кзади от тел позвонка, распространяющийся на сагиттальных изображениях на несколько уровней.
- Характерный вид ЗПС а виде «перевернутой буквы Т» или «галстука бабочки» на аксиальных изображениях.
- Сигнал обычно отличается низкой интенсивностью во всех режимах исследования
- При значительном объеме жирового компонента в костно-мозговом пространстве оссификата интенсивность сигнала может быть гиперинтесивной.
Т2-взвешенное изображение.
- Картина ОЗПС схожа с картиной на Т1.
- Визуализация спинного мозга с наличием гиперинтенсивного сигнала коррелируется с миеломаляцией и отеком.
T2-GRE
- Гипоинтенсивность сигнала оссифицированной ЗПС
- Степень стеноза нередко переоценивается из-за артефактов магнитной восприимчивости.
Дифференциальный диагноз:
Спондилез:
- Изменения ограничены обычно уровнем межтелового пространства и редко захватывают четыре и более сегментов позвоночника.
- Более выраженные, чем при ОЗПС дегенеративные изменения дугоотростчатых суставов и межгюзвонковык дисков
- Отсутствие характерной (в виде буквы Т) оссификации ЗПС
Кальцифицированная грыжа диска:
- Фокальное кальцифицированное «образование», ограниченное уровнем одного межпозвонкового диска
- Отсутствие характерной (в виде буквы Т) оссификации ЗПС
Менингиома:
- Активно накапливающее контрагг объемное образование твердой мозговой оболочки+дуральный «хвост», ровные края
- Нередко на фоне капьцификации отмечается гипоинтенсивность Т2-сигнала
- Отсутствие характерной (в виде буквы Т) оссификации ЗПС
Перидуральная кальцификация шейного отдела позвоночника у диализных пациентов:
- Неравномерная оссификация твердой мозговой оболочки, может быть циркулярной
- Пациент, получающий гемодиализ±миелопатия, чувствительные нарушения
- В дополнение к ляминэктомии/ляминопластике показана резекция твердой мозговой оболочки.
Течение и прогноз:
- Бессимптомные пациенты - наблюдение, консервативное лечение.
- Пациенты с выраженной клиникой являются претендентами корпорэктомию, ламинэктомия, ламинопластику.
Источники:
2. Li H et al: A systematic review of complications in cervical spine surgery for ossification of the posterior longitudinal ligament. Spine J. 11(11):1049-57, 2011
3. Saetia K et al: Ossification of the posterior longitudinal ligament: a review. Neurosurg Focus. 30(3):E1, 2011
4. Shin JH et al: Dorsal versus ventral surgery for cervical ossification of the posterior longitudinal ligament: considerations for approach selection and review of surgical outcomes. Neurosurg Focus. 30(3):E8, 2011
7. Matsunaga S et al: Clinical course of patients with ossification of the posterior longitudinal ligament: a minimum 10-year cohort study. J Neurosurg. 100(3 Suppl):245-8, 2004
8. Shiraishi T et al: Cervical peridural calcification in patients undergoing long- term hemodialysis. Report of two cases. 100(3 Suppl): 284-6, 2004
10. Epstein N: Diagnosis and surgical management of cervical ossification of the posterior longitudinal ligament. Spine J. 2(6):436-49, 2002
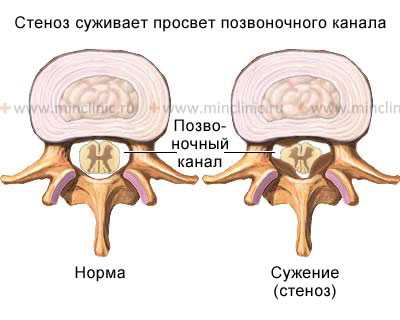
Стеноз позвоночного канала, остеофиты позвонков и оссификация связок
Стеноз позвоночного канала как самостоятельное заболевание чаще всего рассматривается на поясничном уровне позвоночника. Но встречается стеноз позвоночного канала и на шейном и грудном уровне позвоночника. Стеноз позвоночного канала связан с врожденными или приобретенными анатомическими изменениями в самих позвонках (костные остеофиты), а также в хрящевых и связочных образованиях, формирующих позвоночный канал.
Сужение поперечного сечения позвоночного канала может быть или следствием увеличения в размерах костных образований: дужек, суставных отростков, разрастания задних поверхностей тел позвонков, или в результате расплющивания позвонков и смещения их в просвет позвоночного канала.
![Стеноз (сужение) просвета позвоночного канала со сдавлением спинного мозга с гипертрофией задней продольной и жёлтой связки.]()
Стеноз (сужение) просвета позвоночного канала со сдавлением спинного мозга с гипертрофией задней продольной и жёлтой связки.
Также к сужению позвоночного канала приводят гипертрофия желтой и задней продольной связок, увеличение толщины суставных капсул межпозвонковых суставов, смещения межпозвонковых дисков и фиброзного кольца, участвующих в формировании позвоночного канала.
Стеноз позвоночного канала может быть равномерным со всех сторон, но чаще встречается сужение позвоночного канала спереди назад. Также стеноз позвоночного канала может наблюдаться на уровне всех или нескольких поясничных позвонков, но встречается и на уровне одного позвонка.
Сужение позвоночного канала в переднезаднем направлении может быть обусловлено его вторичным стенозом, гипертрофией задней продольной и жёлтой связки, спондилолистезом. Для установления стеноза позвоночного канала необходимо измерение канала в сагиттальной плоскости. Абсолютным стенозом принято считать уменьшение диаметра канала до 10 мм и менее. Величина в 10-15 мм соответствует частичному стенозу. Толщина задней продольной связки в норме не должна превышать 2 мм, желтой связки — 3 мм.
![Стеноз позвоночного канала со сдавлением спинного мозга при спондилёзе на уровне шейного отдела позвоночника с гипертрофией задней продольной и жёлтой связки.]()
Стеноз позвоночного канала со сдавлением спинного мозга при спондилёзе на уровне шейного отдела позвоночника с гипертрофией задней продольной и жёлтой связки.
![Сдавление L3 спинального нерва в межпозвонковом отверстии при экстрафораминальном стенозе (сужении просвета).]()
Сдавление L3 спинального нерва в межпозвонковом отверстии при экстрафораминальном стенозе (сужении просвета).
Стеноз позвоночного канала поясничного отдела позвоночника (люмбальный стеноз) — это преходящая хроническая компрессия нервных корешков конского хвоста. Стеноз поясничного отдела позвоночника (люмбальный стеноз) возникает при врожденной узости позвоночного канала на поясничном уровне, которое усиливается в результате протрузии диска и спондилёзе позвоночника.
Физические нагрузки при стенозе провоцирует у больного боли в области ягодиц, бёдер и икр, иррадиирущие по ходу седалищного нерва. Боли при стенозе позвоночного канала уменьшаются у больных в покое. Эти боли напоминают перемежающуюся хромоту сосудистого генеза и требуют консультации сосудистого хирурга для исключения заболеваний артерий нижних конечностей. На усилении болей по сравнению с состоянием покоя определяется снижение глубоких сухожильных рефлексов и чувствительности на ногах, тогда как при исследовании сосудов на УЗИ изменений не обнаруживают. Стеноз позвоночного канала поясничного отдела позвоночника (люмбальный стеноз) и шейный спондилёз часто сочетаются друг с другом у одних и тех же пациентов, что может провоцировать периодические спазмы и подёргивания мышц (фасцикуляции) на ногах при шейном спондилёзе.
Диагностика стеноза позвоночного канала, остеофитов позвоночника и оссификации связок
При диагностике стеноза позвоночного канала на обзорных рентгенограммах позвоночника (спондилограммах) могут быть видны увеличенные в размерах суставные отростки, утолщенные корни дужек, сниженная высота тел позвонков, участки склерозирования связок и остеофиты. На позитивных миелограммах видно равномерное или в виде перетяжек сужение позвоночного канала на нескольких уровнях. В дифференциально-диагностическом плане большое значение имеет получение поперечных срезов на разных уровнях при компьютерной томографии позвоночника на уровне обнаруженного стеноза позвоночного канала.
Компьютерная томография (КТ) позвоночника демонстрирует изменения при стенозе позвоночного канала.
В клинической картине при стенозе позвоночного канала могут наблюдаться монорадикулярные симптомы (при протрузии и грыжах межпозвонковых дисков, при увеличении размеров смежных суставных отростков, что приводит к уменьшению сечения межпозвонкового отверстия), или симптомы компрессионно-ишемической миелорадикулопатии, или даже синдром поперечного поражения спинного мозга.
![Стеноз позвоночного канала со сдавлением спинного мозга на уровне поясничного отдела позвоночника с гипертрофией задней продольной и жёлтой связки.]()
Стеноз позвоночного канала со сдавлением спинного мозга на уровне поясничного отдела позвоночника с гипертрофией задней продольной и жёлтой связки.
Всё начинается с неврологического и ортопедического осмотра в врача. По её результатам могут быть назначены дополнительно следующие диагностические процедуры:
- пояснично-крестцового отдела позвоночника с функциональными пробами пояснично-крестцового позвоночника пояснично-крестцового отдела позвоночника
Однако основными симптомами истинного стеноза позвоночного канала являются продолжительные боли в поясничном отделе позвоночника без какой-либо «сторонности» и без иррадиации по ходу нервных корешков. Боли в пояснице могут носить постоянный характер и не меняются при перемене положения тела в пространстве (иногда в положении лежа боли даже усиливаются). По мере прогрессирования заболевания присоединяется сглаженность поясничного лордоза, появляется сколиоз, мышечные контрактуры и анталгические деформации позвоночника.
![Сужение позвоночного канала со сдавлением спинного мозга на МРТ грудного отдела позвоночника опухолью.]()
Сужение позвоночного канала со сдавлением спинного мозга на МРТ грудного отдела позвоночника опухолью.
Лечение стеноза позвоночного канала, остеофитов позвоночника и оссификации связок
При лечении стеноза позвоночного канала, в зависимости от тяжести клинических проявлений и причин возникновения стеноза позвоночного канала, у пациента возможны следующие действия, направленные на улучшение состояния больного:
- (НПВС, анальгетики, гормоны) — инъекции препаратов в полость канала (мышечная, суставная и корешковая техника) (УВЧ , СМТ и т.д.)
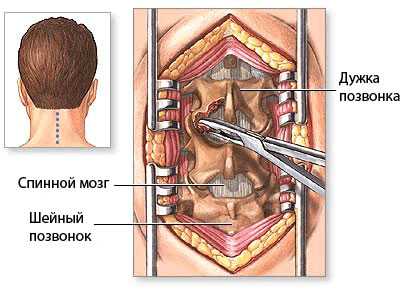
При определении показаний к операции в случае установления диагноза стеноза позвоночного канала следует учитывать распространенность процесса. При операциях на одном или двух уровнях позвонков и односторонних симптомах компрессии корешков может быть использована интерламинотомия или гемиламинэктомия.
При двусторонних симптомах компрессии нервно-сосудистых образований позвоночного канала и на нескольких уровнях, может быть выполнена двусторонняя гемиламинэктомия с сохранением остистых отростков и межостистой связки, иссекаются гипертрофированная желтая связка, остеофиты. Целесообразно при стенозе позвоночного канала параллельное проведение фораминотомии. В отдельных случаях стеноза позвоночного канала бывает необходимо использование стабилизирующих позвоночник металлоконструкций.
![Операция гемиламинэктомия при стенозе позвоночного канала со сдавлением спинного мозга на уровне шейного отдела позвоночника с гипертрофией задней продольной и жёлтой связки.]()
Операция гемиламинэктомия при стенозе позвоночного канала со сдавлением спинного мозга на уровне шейного отдела позвоночника с гипертрофией задней продольной и жёлтой связки.
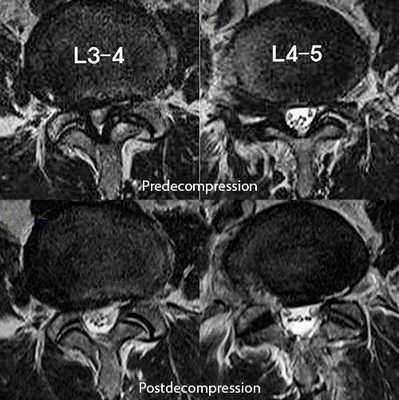
![На МРТ поясничного отдела позвоночника показан стеноз позвоночного канала и состояние после операции эндоскопической декомпрессии на уровнях L3-L4 и L4-L5.]()
На МРТ поясничного отдела позвоночника показан стеноз позвоночного канала и состояние после операции эндоскопической декомпрессии на уровнях L3-L4 и L4-L5.
Иногда при стенозе позвоночного канала бывает целесообразно разделить операцию на два этапа. На первом этапе выполняется декомпрессия наиболее страдающих корешков спинного мозга, проводится курс интенсивной вазоактивной и нейростимулирующей терапии. И, если не достигнуто улучшение и облегчение состояния больного, можно предложить второй этап операции — более широкую декомпрессию (двустороннюю гемиламинэктомию) и создание дополнительных резервных пространств при стенозе позвоночного канала.
Стенозом поясничного отдела позвоночника страдают примерно 103 миллиона человек во всем мире и 11% пожилых людей в США. Терапией первой линии является модификация активности, обезболивание и физиотерапия. Долгосрочные преимущества эпидуральных инъекций стероидов не установлены. Отдельные пациенты с сохраняющейся болью и ограничением активности могут быть кандидатами на декомпрессивную хирургию.
КТ, МРТ оссификации желтой связки
1 ФГБОУ ВО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
В статье представлены демонстрация клинического случая комплексной лучевой диагностики оссифицирующего капсулита плечевого сустава, а также динамическое наблюдение за патологическим процессом. Тема работы является весьма актуальной, поскольку патология плечевого сустава встречается довольно часто, а болевой синдром и нарушение функции сустава резко снижают работоспособность и качество жизни пациентов. Проанализированы данные магнитно-резонансной томографии и мультиспиральной компьютерной томографии пациентки Л., 49 лет. МРТ выполнена на современном аппарате с индукцией магнитного поля 1,5 Т. МР-картина выявленных патологических изменений соответствовала акромиально-ключичному артрозу II стадии, плечелопаточному артрозу I стадии, субдельтовидно-субакромиальному бурситу, оссифицирующему капсулиту плечевого сустава. При повторной МР-томографии через 1 год и 2 месяца наблюдалась более раздробленная и обширная оссификация в зоне медиального отдела капсулы и субдельтовидной сумки, основной кальцинат сместился кверху, под сухожилие надостной мышцы, усилился отек околосуставных мягких тканей. Для более детальной оценки обызвествлений выполнена КТ. Визуализированы диффузно-глыбчатая оссификация капсулы сустава по медиальной поверхности, обызвествление капсулы вокруг сухожилия бицепса; кальцинаты в подклювовидном и субдельтовидном пространствах. Таким образом, применение комплексного подхода к лучевой диагностике оссифицирующего капсулита плечевого сустава позволило нам оценить диагностические возможности методов МРТ и КТ при данном заболевании, наблюдать за динамикой патологического процесса.
1. Беленький А.Г. Патология плечевого сустава. Плечелопаточный периартрит. Прощание с термином: от приблизительности - к конкретным нозологическим формам // Consilium medicum. 2004. Т. 6. № 2. С. 15-20.
2. Страфун А.С. Лечение кальцифицирующего тендинита сухожилий ротаторной манжеты плечевого сустава // Травма. 2017. Т. 18. № 1. С. 19-26.
3. Казакова С.С., Колесов В.Ю., Хазов А.П. МРТ-диагностика субакромиального импинджмент-синдрома // Факультетская клиника: сб.науч.тр., посв. юбилею Засл. деятеля науки РФ, проф. Гармаша В.Я. / сост.: Ю.А. Панфилов, А.А. Сидоров; ГБОУ ВПО РязГМУ Минздрава России. Рязань: РИО УМУ, 2016. С. 95.
4. Филистеев П.А., Крючкова О.В. Лучевая диагностика болезней депонирования пирофосфата и гидроксиапатита кальция // REJR. 2015. № 5 (3). С. 56-64.
5. Liu Y.Z., Jackson A.P., Cosgrove S.D. Contribution of calcium-containing crystals to cartilage degradation and synovial inflammation in osteoarthritis. Osteoarthritis Cartilage. 2009. Vol. 17 (10). P. 1333-1340.
6. Farpour F., Phan S.J., Burns J., Tehranzadeh J. Enhanced MR imaging of the shoulder, and sternoclavicular and acromioclavicular joint arthritis in primary hemochromatosis. Rheumatology International. 2009. Vol. 31 (3). P. 395-398.
7. Хитров Н.А. Варианты периартрита плечевого сустава: дифференциальная диагностика, течение, лечение // РМЖ. 2012. № 7. С. 366.
8. Носкова Т.С., Широкова К.Ю., Бахтиярова Т.И., Филимонова Н.С. Болезни отложения кристаллов кальция: клиника и лечение // Клиническая геронтология. 2012. № 3-4. С. 59-63.
Боль в плечевом суставе - одна из частых жалоб, с которой пациенты обращаются к врачам разных специальностей (неврологам, ортопедам, ревматологам и др.). По данным ВОЗ, от 5 до 30% взрослого населения в мире страдают от болевого синдрома и нарушения функции в плечевом суставе. Поэтому патологические процессы в области плеча являются весьма актуальной медицинской проблемой [1, 2].
В эру рентгенографических изображений при болевом синдроме в области плечевого сустава часто обнаруживали обызвествления в проекции синовиальных сумок. Появился диагноз - bursitis calcarea, или каменный бурсит. Первые описания этой болезни относятся к 1907-1908 годам. Каменный бурсит наблюдается главным образом в области плечевого сустава. В области других суставов подобные обызвествления отмечаются крайне редко и без болевых проявлений [1]. Сейчас современные высокотехнологичные аппараты лучевой диагностики позволяют не только выявить обызвествление, но и оценить состояние мягкотканых структур сустава [3].
Сегодня в отечественных и зарубежных литературных источниках периартикулярные обызвествления в области плечевых суставов описываются различными терминами, являющимися синонимами (кальцифицирующий тендинит плеча, перитендинит плечевого сустава, периартропатия, болезнь накопления гидроксиапатита кальция и др.), и характеризуются отложением солей кальция (пирофосфата, гидроксиапатита, ортофосфата) в суставах, сухожильно-связочном аппарате и прилежащих мягких тканях 4. Отложение депозитов кальция в скелетно-мышечной системе на начальном этапе протекает бессимптомно, а в дальнейшем проявляется клиническим симптомокомплексом, характерным для острого артрита или хронической артропатии. Этиология заболевания изучена недостаточно полно. К предрасполагающим факторам относятся гиперпаратиреоз, гемохроматоз, гемосидероз, гипотиреоз, нейропатическая артропатия и др. [4]. Также немаловажную роль играют дегенеративные и дистрофические процессы в суставе, например возрастной износ сухожилий, при котором отмечаются разрушение и изменение их тканей. Нарушается кровоснабжение, и происходит отложение солей кальция в местах повреждения сухожилий [2].
Болезнь накопления гидроксиапатита кальция (МКБ Х: M11 Другие кристаллические артропатии. M11.0 Отложение гидроксиапатита) протекает стадийно. Выделяют 4 фазы: 1) фаза формирования (происходят трансформация фиброзно-хрящевого матрикса, отложение в нем кристаллов гидроксиапатита кальция, которые напоминают глыбки извести); 2) фаза покоя (депозиты не увеличиваются, боль отсутствует; крупные депозиты могут вызывать нарушение функции сустава); 3) фаза резорбции (воспалительная реакция, резорбция кристаллов гидроксиапатита кальция макрофагами; отложения имеют вид зубной пасты и могут распространяться с сухожилий на прилежащие околосуставные сумки или мигрировать под них); 4) фаза восстановления структуры сухожилия.
Также заслуживает внимания классификация по Moseley. Выделяют: латентную фазу (кристаллы гидроксиапатита кальция откладываются в толще сухожилия, в области артериальных анастомозов, в критической зоне (обычно нет жалоб)); механическую фазу (депозиты гидроксиапатита кальция увеличиваются, усугубляя повреждение сухожилия (развитие болевого синдрома); фаза адгезивного периартрита (кальцифицирующий тендинит в сочетании с адгезивным бурситом).
Патогенез болезни депонирования солей кальция изучен относительно хорошо. При этом происходят вовлечение сухожилий ротаторной манжеты, нарушение метаболизма и асептическое воспаление в суставе [7].
При поражении плечевого сустава патоморфологически, как правило, поражаются сухожилия, связки, капсула, суставные сумки, большой бугорок плечевой кости, появляются участки кистовидной перестройки в головке или большом бугорке. Депозит под клювовидно-акромиальной связкой имеет вид гантели или песочных часов [8].
Гистологически в сухожилиях обнаруживаются многочисленные очаги кальцификации, окруженные мононуклеарами и гигантскими клетками, содержащими в цитоплазме фагоцитированные кристаллы гидроксиапатита. При микроскопическом изучении синовиальной жидкости в период приступа можно обнаружить многочисленные скопления кристаллов внутри и вне клеток. На высоте приступа кристаллы исчезают, очевидно, вследствие их фагоцитоза и быстрого внутриклеточного растворения. Это быстрое растворение кристаллов апатита, вероятно, обусловливает редкость их обнаружения в синовиальной жидкости у больных. Тот факт, что вне приступа в синовиальной жидкости кристаллы апатита отсутствуют, заставляет предполагать их внесиновиальное происхождение и рассматривать синовит, развивающийся у больных ГА, как реактивный, возникающий в части случаев и без проникновения кристаллов в синовиальную полость [8].
В литературе описаны случаи оссифицирующих процессов в области различных суставов (коленных, тазобедренных, плечевых, голеностопных и др.). При этом методами лучевой диагностики в основном служат рентгенологическое исследование и компьютерная томография [7].
Цель исследования: оценить диагностические возможности магнитно-резонансной томографии и компьютерной томографии при оссифицирующем капсулите плечевого сустава, провести наблюдение за динамикой патологического процесса.
Материал и методы исследования. Проанализированы клинико-лучевые данные пациентки Л., 49 лет, впервые обратившейся в медицинский диагностический центр МРТ и КТ ООО «Нью МРТ и КТ на Зубковой» г. Рязани в январе 2018 года по направлению врача-ортопеда. Пациентка предъявляла жалобы на боль в левом плечевом суставе (дельтовидной области), лечилась консервативно (нестероидные противовоспалительные средства, блокады) с временным положительным эффектом. Из анамнеза известно, что около двух лет назад при дорожно-транспортном происшествии пациентка получила травматический перелом правой ключицы с последующим довольно длительным заживлением, но повреждений левого плечевого сустава выявлено не было. Данный факт позволяет высказаться о вынужденной длительной повышенной функциональной нагрузке на здоровую (левую) верхнюю конечность (пациентка правша).
МРТ выполнено на высокопольном аппарате Philips Intera (индукция магнитного поля 1,5 Тл) с использованием гибкой катушки для плечевого сустава. Протокол магнитно-резонансной томографии включал следующие последовательности: Т1-ВИ аксиальные, Т2+pd+fs ВИ аксиальные, Т2-ВИ корональные, Т2+pd+fs ВИ корональные, Т2-ВИ или PD+fs сагиттальные срезы с толщиной по 3,5 мм. Общее время сканирования составило около 20 минут. Компьютерная томография (КТ) выполнена на 40-срезовом компьютерном томографе Philips Brilliance.
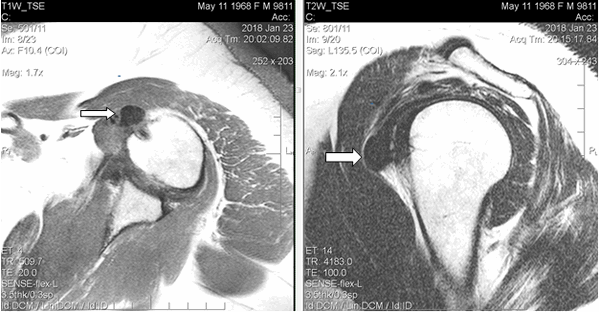
Результаты исследования и их обсуждение. При магнитно-резонансной томографии, (январь 2018 г.) в левом плечевом суставе выявлены умеренные дегенеративные изменения в виде краевых заострений суставной впадины лопатки, кальцинат в субдельтовидной сумке размерами 1,5х1,2 см, субхондральная киста акромиона диаметром до 0,4 см, небольшое количество выпота в субдельтовидно-субакромиальной сумке. Таким образом, МР-картина соответствовала акромиально-ключичному артрозу II стадии, плечелопаточному артрозу I стадии; выявлены субдельтовидно-субакромиальный бурсит, оссифицирующий капсулит плечевого сустава (рис. 1). Рекомендована консультация ортопеда.
![]()
Рис. 1. МРТ левого плечевого сустава пациентки Л., 49 лет (январь 2018 г.), Т1-ВИ, аксиальный срез (а) и Т2-ВИ, сагиттальный срез (б). В субдельтовидном пространстве в зоне отрога капсулы сустава вдоль сухожилия длинной головки на 9 часах условного циферблата головки плечевой кости визуализируется крупный кальцинат (обозначен стрелками) в виде гомогенно-гипоинтенсивного на Т1-ВИ и Т2-ВИ образования неправильно-округлой формы с четкими контурами размерами 1,5х1,2х1,1 см, без перифокального отека, деформирующий передний пучок дельтовидной мышцы
На фоне назначенного лечащим врачом консервативного лечения в течение года пациентка отмечала периоды ремиссии и обострения. Болевой синдром окончательно не исчез. В марте 2019 г. женщина обратилась в указанный медицинский диагностический центр снова. Было выполнено комплексное лучевое исследование, включающее МРТ и КТ.
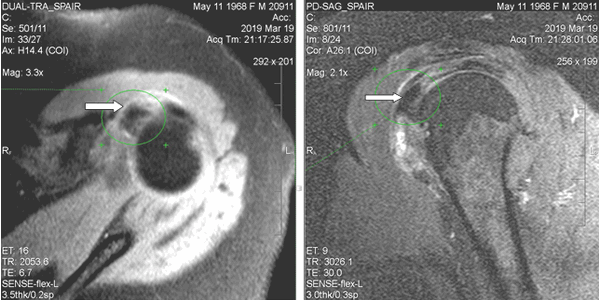
При магнитно-резонансной томографии (март 2019 г.) выявлены неравномерный отек капсулы, неоднородная оссификация капсулы в медиальном отделе. В полости сустава физиологическое количество жидкости. В субдельтовидно-субакромиальной сумке небольшое количество выпота (толщиной до 0,2 см). Суставная щель равномерная, признаков подвывиха головки плечевой кости не выявлено. Краевые заострения суставной впадины лопатки. Акромиально-плечевой промежуток 0,7 см (достаточный). Умеренный отек околосуставных мягких тканей. Ротаторная манжета: сухожилие надостной мышцы с явлениями слабого отека, целостность сохранена; сухожилие подлопаточной мышцы с явлениями слабого отека и дегенеративных изменений; целостность остальных сухожилий (подостной, малой круглой мышц) не нарушена, структура сухожилий не изменена. По сравнению с МР исследованием от января 2018 г. отмечаются более раздробленная и обширная оссификация в медиальном отделе капсулы и субдельтовидной сумки; усиление отека околосуставных мягких тканей; основной кальцинат сместился кверху, под сухожилие надостной мышцы (ранее находился чуть дистальнее сухожилия подлопаточной мышцы) (рис. 2).
![]()
Рис. 2. МР-томограммы левого плечевого сустава пациентки Л., 50 лет (март 2019 г.). Определяется утолщение стенок субдельтовидной сумки, крупный кальцинат на 10-11 часах условного циферблата головки плечевой кости (обозначен стрелками), под сухожилием надостной мышцы. Обращают на себя внимание нечеткость контуров кальцината и перифокальный отек мягких тканей, что характерно для фазы резорбции и соответствует клинической картине
Таким образом, магнитно-резонансная томография, выполненная с интервалом 1 год и 2 месяца, позволила наблюдать за динамикой патологических изменений в плечевом суставе, определить фрагментацию и частичную резорбцию ранее выявленного основного крупного кальцината с его «перемещением» в зоне медиального отдела капсулы и субдельтовидной сумки, наглядно продемонстрировала радиологические отличия фаз покоя и резорбции оссифицирующего капсулита.
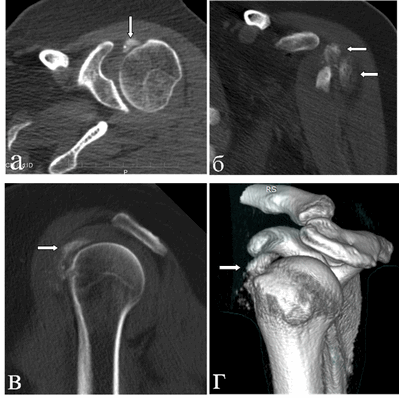
При компьютерной томографии выявлена диффузно-глыбчатая оссификация капсулы сустава по медиальной поверхности (на 8-12 часах условного циферблата головки плечевой кости по сагиттальным снимкам) на участке размерами 1,5х0,7х4,5 см плотностью от 200 до 890 HU (средней плотностью ~ 300 HU), медиальных отделов субдельтовидной сумки, в зоне малого бугорка (в области фиксации сухожилия подлопаточной мышцы), более «нежная» по капсуле вокруг вертикального сегмента сухожилия длинной головки бицепса; отсутствует в области фиксации остальных сухожилий ротаторной манжеты к большому бугорку и в самом сухожилии длинной головки бицепса (рис. 3). Данный характер оссификации также подтверждает представления о фазном характере течения рассматриваемой патологии.
![]()
Рис. 3. КТ левого плечевого сустава пациентки Л., 50 лет (март 2019 г.). Аксиальный срез (а) на уровне верхней части головки плечевой кости: бобовидной формы крупный кальцинат по медиальному контуру головки плечевой кости в зоне расположения капсулы; МПР-корональный срез демонстрирует расположение кальцинатов по капсуле вдоль вертикального сегмента сухожилия длинной головки бицепса (б), МПР-сагиттальный срез весьма наглядно показывает локализацию кальцинатов по капсуле и в зоне субдельтовидной сумки (в) и 3D реконструкция правого плечевого сустава в объемном представлении детализирует патологическое состояние в мягкотканых структурах сустава (г). Визуализируется оссификация капсулы вокруг сухожилия бицепса; кальцинаты в подклювовидном и субдельтовидном пространствах
Таким образом, МР-исследования с интервалом более одного года у пациентки Л. позволили наблюдать миграцию крупного кальцината в периартикулярных тканях плеча, выявить периартикулярные мягкотканые изменения сухожилий, капсулы сустава. При этом мультиспиральная компьютерная томография позволила более отчетливо визуализировать кальцификаты, точно оценив их анатомическую принадлежность (по капсуле, вне полости сустава), распространенность и плотностные характеристики.
Заключение. В наши дни мультимодальный подход в диагностике заболеваний плечевого сустава, в частности оссифицирующего капсулита, является залогом постановки правильного диагноза, а, следовательно, грамотного планирования лечения и корректной оценки его эффективности.
МРТ является ведущим и наиболее комплексным методом оценки суставной и околосуставной патологии. Однако при подозрении на наличие оссифицирующих процессов, в частности в области плечевого сустава, магнитно-резонансную томографию необходимо дополнять рентгеновской компьютерной томографией. Последняя дает возможность детализировать обызвествления, определять их локализацию, распространенность, характер, размер, а также состояние костных компонентов сустава. Сочетание методов и динамическое наблюдение позволяют точно определять фазу заболевания и корректировать лечебный подход.
Читайте также: