КТ, МРТ при врожденной мастоидальной холестеатоме
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Холестеатома гистологически эквивалентна эпидермоидной кисте, содержит слущеный многослойный плоский ороговевающий эпителий, образующий матрикс. Как правило, сопровождается тугоухостью, степень которой зависит от давности и степени разрушения элементов звукопроводящей системы.
Патология
Объемное образование выстланное эпителием (обращенным внутрь), за счет чего характеризуется продолжающимся ростом. Содержит большое количество кристалов холестерина, благодаря чему и имеет данное название, хотя термин "кератома" гистологически возможно был бы более подходящим.
Холестеатомы височной кости и среднего уха делятся на:
- врожденные холестеатомы: составляют только 2%
- приобретенные холестеатомы: 98%
- первичные (без хронического отомастоидита в анамнезе)
- вторичные (подовляющее большинство):
- натянутая часть барабанной перепонки
- ненатянутая часть барабанной перепонки
Диагностика
Всем пациентам с подозрением на холестеатому рекомендовано проведение рутинной МРТ без контрастного усиления, с получением диффузионно-взвешенных изображений. Пациентам имеющим в анамнезе операцию по поводу холесетатомы исследование назначается для выявления рецидива или наличия остаточной опухоли - так как отрицательные результаты МРТ позволяют избежать диагностической операции.
Стандартное обследование включает в себя получение Т2 взвешенных серии в корональной и аксиальной плоскостях, с дополненных серией non-ЕРI DWI (B-фактор 0, 1000). На изображениях DWI с B-фактором 1000 с/мм2 холестеатомы визуализируются, в виде области гиперинтенсивного МР сигнала. Интенсивность МР сигнала должна быть выше, чем на изображениях с B-фактором 0 с/мм2. На ИКД в зоне патологии благодаря ограничению диффузии определяется сигнал низкой интенсивности.
На 1.5 Тл магнитно-резонансном томографе можно выявить холестеатомы разменами от 2 мм и более.
Рецидивирующие холестеатомы диагностируются со 100% специфичностью.КТ-сканирование дополнянет МРТ в предоперационном планировании позволяя выявить наличие кариозных изменений структур среднего уха, исключить перфорацию крыши, получить реконструкцию слуховых косточек. Патологический процесс начинающийся в пространстве Пруссака обычно распространяется кзади, сочетаясь с медиальным смещением молоточка и наковальни.
Дифференциальный диагноз
- холестероловая гранулема
- воспаление
В отличие от холестеатомы указанные процессы сопровождаются повышением МР сигнала на ИКД изображениях.
Дальнейшая дифференциальная диагностика проводится между:
- серной пробкой: имеет аналогичные холестеатоме характеристики на изображениях, но находится во наружном слуховом проходе
- абсцесс среднего уха: может иметь схожий паттерн/результаты визуализации, но характеризуется совершенно иной клинической картиной
Ключевые моменты
Важными моментами, которые необходимо отразить в описании КТ исследования по поводу холестеатомы, являются:
КТ, МРТ при врожденной мастоидальной холестеатоме
Кафедра оториноларингологии Российской медицинской академии последипломного образования, Москва
Рентгенодиагностическое отделение ЦКБ гражданской авиации
Кафедра оториноларингологии учебно-научного медицинского центра Управления делами Президента России, Москва
Кафедра оториноларингологии РМАПО
МРТ в предоперационном обследовании и послеоперационном контроле при хроническом среднем отите с холестеатомой
Журнал: Вестник оториноларингологии. 2012;77(5): 14‑19
Косяков С.Я., Лазебный В.В., Коршок В.В., Пчеленок Е.В. МРТ в предоперационном обследовании и послеоперационном контроле при хроническом среднем отите с холестеатомой. Вестник оториноларингологии. 2012;77(5):14‑19.
Kosiakov SIa, Lazebnyĭ VV, Korshok VV, Pchelenok EV. The role of MRI in the preoperative examination and postoperative follow up of the patients presenting with a combination of chronic otitis media and cholesteatoma. Vestnik Oto-Rino-Laringologii. 2012;77(5):14‑19. (In Russ.).Цель работы - изучить возможности определенных режимов МРТ в диагностике холестеатомы, а также определить критерии предлагаемых протоколов. Исследование проводилось в стандартных режимах Т1, Т2, а также в режиме non-EPI DWI. Нами были обследованы пациенты как с первичной холестеатомой, так и с резидуальной и рецидивирующей холестеатомой. Основной алгоритм радиологической диагностики холестеатомы заключался в следующем: низкоинтенсивный сигнал в режиме Т1, сигнал высокой интенсивности в режимах Т2 и non-EPI DWI. В статье представлены 3 клинических наблюдения. Всем пациентам была выполнена МРТ в режимах Т1, Т2 и non-EPI DWI. У 2 пациентов было подтверждено наличие холестеатомы и верифицирован данный факт на операции, а в одном из примеров данный метод позволил исключить наличие холестеатомы.
Холестеатома — это скопление кератина в матриксе чешуйчатого эпителия в полости среднего уха. Только в 2% случаев холестеатома может быть врожденной. В остальных же случаях это приобретенное заболевание, развивающееся на фоне хронического среднего отита в результате ретракции барабанной перепонки [1].
Холестеатома разрушает структуры среднего уха, нарушает такие функции последнего, как слух, равновесие, функцию лицевого нерва и вызывает осложнения.
Осложнения холестеатомы связаны с костной деструкцией в полости среднего уха, что обусловлено механическим давлением и активностью медиаторов воспаления, которые стимулируют остеокласты. Костная деструкция приводит к разрушению цепи слуховых косточек, развитию лабиринтных фистул, эрозиям канала лицевого нерва с развитием пареза и, наконец, к тяжелым внутричерепным осложнениям.
Лечение холестеатомы всегда только хирургическое. Хирургические подходы могут быть различными и включать операции с сохранением задней стенки наружного слухового прохода и ее удалением, с реконструкцией цепи слуховых косточек и стенок паратимпанальных пространств [2]. Закрытые типы операций длительное время применяли с большой осторожностью по причине высокого процента развития как резидуальных заболеваний, так и рецидива холестеатомы. В связи с этим «золотой стандарт» лечения включал обязательную ревизию через год после операции. Например, по данным клиники в Антверпене, повторные оперативные вмешательства у взрослых составляют 57%, из которых только в 7,2% случаев обнаружена резидуальная холестеатома, а в остальных случаях (92,8%) проводились необоснованные оперативные вмешательства [3].
В настоящее время для предоперационного обследования больных широко используется компьютерная томография (КТ) височных костей. Данный метод позволяет определить состояние слуховых косточек, сосцевидного отростка, надбарабанного пространства, стенок барабанной полости, состояние окон лабиринта и внутреннего уха [4]. Однако специфичность КТ в диагностике холестеатомы низка. В связи с этим КТ можно рассматривать только как «дорожную карту» для оценки состояния различных структур среднего уха (сохранены, повреждены, разрушены). Это дает возможность ориентироваться в наличии анатомических структур, определить костную деструкцию, но ни в коем случае не определить, за счет чего произошла деструкция. На КТ невозможно дифференцировать холестеатому, грануляционную, рубцовую ткань и опухоль. Исследования последних 15 лет это подтверждают [5]. Для послеоперационного контроля КТ имеет еще меньшее значение, так как вследствие низкой специфичности не позволяет дифференцировать послеоперационные рубцовые изменения от экссудата или резидуальной холестеатомы. КТ наиболее значима при определении аэрации среднего уха и сосцевидного отростка, но значимость ее снижается при наличии мягкотканных образований [6].
В течение последних нескольких лет было опубликовано несколько работ [5, 7—10] о диагностике холестеатомы с применением магнитно-резонансной томографии (МРТ) в различных режимах (Т1, Т2, EPI DWI и non-EPI DWI). Эти работы были опубликованы в основном врачами-радиологами в соавторстве с оториноларингологами и носят специфический характер, так как информация в них излагается с позиций рентгенологов с указанием массы технических характеристик оборудования и протоколов обследования.
Цель нашей работы — изучить возможности определенных режимов МРТ в диагностике первичной холестеатомы различных размеров в диагностически сложных случаях, резидуальной холестеатомы у пациентов, подвергнутых множественным оперативным вмешательствам. В конечном счете, предполагается популяризировать данный метод и сделать его доступным для лечебной практики.
Методика исследования
Все пациенты были обследованы на МР-томографе Signa HD GE («Helthcare», США) с напряженностью магнитного поля 1,5 Тесла. Обследование выполнялось без контрастирования в импульсных последовательностях:
— Т1 во фронтальной плоскости с подавлением сигнала от жировой ткани с толщиной среза 3 мм;
— Т2 во фронтальной и сагиттальной плоскостях с толщиной среза 3 мм;
— non-EPI DWI в аксиальной плоскости с толщиной среза 2 мм.
При наличии холестеатомы характерны следующие МРТ-признаки:
1. Сигнал низкой интенсивности в режиме Т1.
2. Гиперинтенсивный сигнал или сигнал средней интенсивности в режиме Т2.
3. Сигнал высокой интенсивности в режиме non-EPI DWI.
При наличии воспаления и грануляционной ткани выявляются следующие МРТ-признаки:
1. Сигнал низкой интенсивности в неконтрастном режиме Т1.
2. Cигнал высокой интенсивности в режиме T2.
3. Сигнал низкой интенсивности в режиме non-EPI DWI.
Для холестерол-гранулемы характерны следующие МРТ-признаки:
1. Сигнал высокой интенсивности в режиме Т1.
2. Сигнал высокой интенсивности в режиме Т2.
Основная проблема закрытых методов хирургии уха заключается в необходимости длительного наблюдения. Развитие резидуальной холестеатомы после первичной операции до момента клинических проявлений, как правило, занимает около 12—18 мес [7]. Учитывая огромные пространства нашей страны, повторная ревизия для иногороднего пациента часто представляет финансовую нагрузку. В то же время с широким распространением диагностического оборудования и, в частности, магнитно-резонансных томографов, появляется возможность, применив описанный метод, контролировать состояние заболевания, не прибегая к повторному хирургическому вмешательству.
Идеальным методом скрининга на сегодняшний день является применение МРТ в режиме non-EPI DWI. Преимуществом является отсутствие необходимости применения дорогого контраста (например, гадолиниума) и связанного с его применением возможного нефротоксического действия, сокращение времени обследования на 45 мин (ожидание поздней фазы контрастирования). Обследование только в режиме non-EPI занимает всего 3—6 мин [8].
Существует два диагностических исключения, которые могут маскироваться под наличие холестеатомы и демонстрировать те же закономерности. Это абсцесс (как правило, имеющий клинические признаки) и скопление серы в наружном слуховом проходе.
Метод МРТ обеспечивает высокую безопасность при хирургических вмешательствах, использующих облитерацию паратимпанальных пространств, что дает возможность контроля резидуального заболевания и позволяет диагностировать рецидивы холестеатомы. Проведение МРТ-исследования в режиме non-EPI DWI через 1 год и 5 лет позволяет, в зависимости от результата, планировать хирургическое вмешательство [10, 12].
Послеоперационный контроль заключается в тщательной отоскопии и наблюдении в течение 10 лет, при подозрении на рецидив холестеатомы необходимо проводить МРТ-исследование (в том числе в режиме non-EPI DWI).
Под нашим наблюдением находились 30 пациентов с подозрением на первичную холестеатому (где клиническая картина не была однозначна) и пациенты со сложностями в диагностике, ранее подвергнутые оперативным вмешательствам. Всем пациентам была проведена МРТ основания черепа в стандартных режимах (во фронтальной проекции) и режиме non-EPI DWI (в аксиальной проекции), без контрастного усиления.
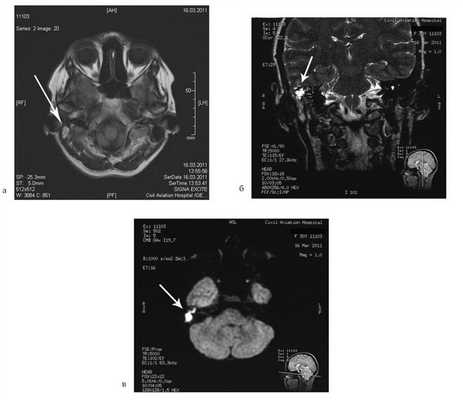
Больная Ф., 30 лет, обратилась с жалобами на головокружение, снижение слуха на правое ухо, слизистое отделяемое из правого уха. Болеет в течение 6 лет, лечилась консервативно. При отомикроскопии визуализируется перфорация в верхнем отделе барабанной перепонки.
![]()
Пациентке была выполнена МРТ основания черепа по описанной методике (рис. 1). Рисунок 1. МРТ основания черепа больной Ф. с хроническим правосторонним гнойным средним отитом. Фистула лабиринта. Холестеатома. а — исследование в режиме Т1; б — в режиме Т2; в — в режиме non-EPI DWI.
В режиме Т1 справа определяется образование с низкой интенсивностью сигнала, а в режиме Т2 и non-EPI DWI — образование с гиперинтенсивным сигналом. Диагноз: хронический правосторонний гнойный средний отит; холестеатома; фистула лабиринта. Пациентка была подвергнута санирующей операции на правом ухе с тимпанопластикой и облитерацией паратимпанальных пространств. Были выявлены холестеатома, заполняющая аттик, адитус, антрум, деструкция цепи слуховых косточек, фистула латерального полукружного канала. Послеоперационный период протекал без особенностей, на 15-е сутки была удалена гемостатическая губка и силиконовая выстилка. При контрольном осмотре ухо сухое, отмечает улучшение слуха, головокружения нет. Через 12 мес проведено повторное МРТ-исследование. Признаков холестеатомы не обнаружено. Получен хороший функциональный результат — ухо толерантно к воде, самоочищается.
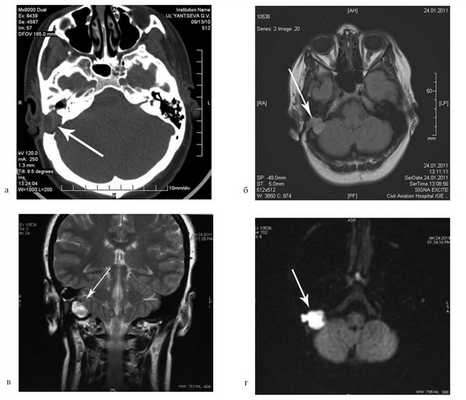
Больная У., 25 лет, обратилась с жалобами на снижение слуха на правое ухо, периодические выделения из правого уха. 18 лет назад была выполнена радикальная операция по поводу острого мастоидита, острого гнойного среднего отита справа. После операции развился парез лицевого нерва. В связи с продолжающимися обострениями через 8 лет была выполнена повторная операция с тимпанопластикой и мастоидопластикой. Частота обострений снизилась, но периодические выделения из уха продолжались. При отомикроскопии визуализируется неомембрана на задней стенке наружного слухового прохода с отверстием 2×4 мм, которое ведет в мастоидальную полость. Дно и стенки полости необозримы.
![]()
На КТ височных костей справа послеоперационная полость, заполненная мягкотканным образованием, определяется большой костный дефект в направлении сигмовидного синуса и мозжечка (рис. 2, а). Рисунок 2. КТ и МРТ височных костей больной У. с хроническим правосторонним средним отитом. Состояние после радикальной операции (1993 г.), санирующей операции с мастоидопластикой и тимпанопластикой (2003 г.). Холестеатома. Парез лицевого нерва. а — КТ; б — МРТ основания черепа в режиме Т1; в — в режиме Т2; г — в режиме non-EPI DWI.
Больной была выполнена МРТ (рис. 2, б—г).
В режимах Т2 и non-EPI DWI определяется сигнал высокой интенсивности, в режиме Т1 — низкоинтенсивный сигнал. Это может свидетельствовать о наличии холестеатомы мастоидальной полости и пирамиды височной кости. Диагноз: хронический правосторонний средний отит; состояние после радикальной операции в 1993 г. и санирующей операции с мастоидопластикой и тимпанопластикой в 2003 г.; холестеатома; парез лицевого нерва.
Больной произведена санирующая реоперация, в ходе которой удалена холестеатома больших размеров, заполняющая отшнурованную послеоперационную полость. Эта полость распространялась до верхушки сосцевидного отростка, граничила с твердой мозговой оболочкой и достигала верхушки пирамиды височной кости. Полость облитерирована. В послеоперационном периоде получен хороший функциональный результат. Ухо толерантно к воде, не было обострений, гноетечения, головокружений. Сохранилась кондуктивная тугоухость I степени. МРТ через 9 мес подтвердила отсутствие холестеатомы.
Больной А., 44 лет, обратился с жалобами на периодические (2 раза в год) гноетечения из правого уха. Ранее пациенту неоднократно предлагалось оперативное вмешательство.
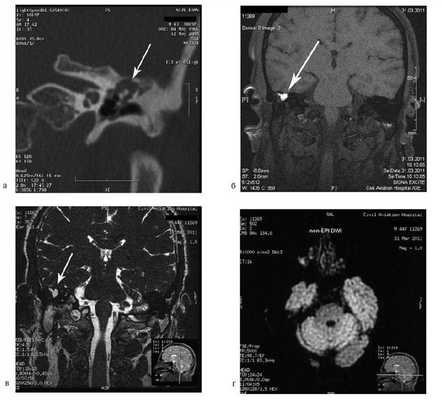
При отомикроскопии определяется утолщение барабанной перепонки, перфорация не визуализируется, признаков холестеатомы нет.
![]()
На КТ правой височной кости определяется затемнение в области аттика и антрума, цепь слуховых косточек сохранена (рис. 3, а). Рисунок 3. КТ и МРТ височных костей больного А. с адгезивным средним отитом справа, фиброзной облитерацией аттика. а — КТ; б — МРТ основания черепа в режиме Т1; в — в режиме Т2; г — в режиме non-EPI DWI.
Пациенту выполнена МРТ основания черепа по описанной методике (рис. 3, б—г).
В режиме Т1 и Т2 справа определяется очаг с высокой интенсивностью сигнала, тогда как в режиме non-EPI DWI патологических образований не выявлено. Диагноз: адгезивный средний отит справа, фиброзная облитерация аттика.
В связи с отсутствием данных о холестеатоме операция не производилась, выявленные изменения расценены как фиброзные изменения, оторея была обусловлена периодическим возникновением наружного отита. Больной получал консервативное лечение.
Результаты и обсуждение
Приведенные примеры характеризуют диагностически сложные ситуации, когда пациент перенес, например, несколько обострений, не было четко обозримой перфорации, когда можно было только заподозрить развитие холестеатомы, учитывая данные анамнеза, и, напротив, несколько перенесенных операций затрудняли дифференцирование холестеатомы от послеоперационных изменений.
Проведение пациентам КТ позволило определить мягкотканные образования, но они могли быть обусловлены грануляциями, полипами, рубцовой тканью, мозговой грыжей, а также холестеатомой. Предложенные нами клинические примеры можно разделить на 2 группы. 1-ю группу составили пациенты с хроническим гнойным средним отитом, где была заподозрена первичная холестеатома. Диагностическая сложность состояла в отсутствии явных клинических признаков, наличии косвенных признаков холестеатомы на КТ. 2-ю группу составили пациенты, которые были подвергнуты неоднократным оперативным вмешательствам, однако полного выздоровления не было достигнуто и было подозрение на развитие резидуальной холестеатомы в отшнурованных областях. Для определения наличия и точной локализации распространения резидуальной холестеатомы КТ не могла дать нам достоверной информации, потому что все патологические изменения выглядели абсолютно одинаково. Кроме того, у этих больных периодически возникали обострения, а это само по себе может давать затемнение на КТ. Поэтому нами было принято решение выполнить МРТ основания черепа. Это позволило в большинстве случаев с высокой степенью достоверности подтвердить наличие холестеатомы и верифицировать данный факт на операции, а в одном из примеров отвергнуть ее наличие.
В исследовании, проведенном P. Aikele и соавт. [9], была проведена оценка эффективности МРТ-исследования у пациентов, ранее оперированных по поводу холестеатомы. Из 17 пациентов у 13 холестеатома была выявлена на МРТ и верифицирована при повторном оперативном вмешательстве. Наименьший размер диагностированной холестеатомы составил 5 мм.
Согласно исследованиям B. De Foer и соавт. [10], режим non-EPI DWI позволяет определять холестеатому размером до 2 мм. По данным авторов, повторные оперативные вмешательства в послеоперационном контроле проводились в 62% случаев. С использованием новой методики этот процент снизился до 10%.
У нас в стране пока данный метод не получил широкого распространения, но результаты даже предварительных исследований показали, что МРТ — достоверный метод диагностики холестеатомы, но требуются дальнейшие исследования по определению его чувствительности и специфичности.
Заключение
Метод МРТ, особенно в режиме non-EPI DWI, эффективен в диагностически сложных случаях — при отсутствии явных клинических признаков холестеатомы, но существующем подозрении на нее. Метод также эффективен для диагностики резидуальной холестеатомы и рецидива и может применяться в качестве контроля у пациентов, ранее оперированных по поводу холестеатомы, не прибегая к повторным ревизиям.
Использование метода МРТ изменяет взгляд за закрытые типы операций, снимая последний сдерживающий фактор — трудность контроля. МРТ позволяет диагностировать рецидив холестеатомы и резидуальное заболевание и является абсолютно экономически эффективным методом [11].
Запорожский государственный медицинский университет, Украина
Санкт-Петербургский НИИ уха, горла, носа и речи Минздрава России, Санкт-Петербург, Россия, 190013
ФГБУ «Санкт-Петербургский НИИ уха, горла, носа и речи» Минздрава России, Санкт-Петербург, Россия
Санкт-Петербургский научно-исследовательский институт уха, горла, носа и речи Минздрава России, Санкт-Петербург, Россия, 190013
Особенности диагностики и хирургического лечения различных форм врожденной холестеатомы височной кости
Журнал: Вестник оториноларингологии. 2020;85(3): 23‑27
Цель исследования. Провести ретро- и проспективный анализ клинических особенностей и результатов хирургического лечения пациентов с врожденной холестеатомой височной кости. Пациенты и методы. На базе ФГБУ «СПб НИИ ЛОР» Минздрава России за период с 2011 по 2018 г. у 23 пациентов была диагностирована врожденная холестеатома височной кости. Мужчин было 11 (47,8%), женщин — 12 (52,2%), возраст больных — от 2 до 44 лет. Для верификации врожденной холестеатомы среднего уха были использованы критерии M. Levenson (1986 г.). Согласно интраоперационным находкам, для врожденной холестеатомы среднего уха нами были выделены ее стадии согласно классификации ChOLE. К другим видам врожденной холестеатомы височной кости были отнесены пациенты, имеющее врожденную атрезию наружного слухового прохода, сочетанную с врожденной холестеатомой височной кости; пациент с обтурирующими наружный слуховой проход экзостозами, сочетанными с врожденной холестеатомой среднего уха; пациент с врожденной холестеатомой пирамиды височной кости. Результаты. Отмечено увеличение встречаемости врожденной холестеатомы височной кости, что, вероятно, связано с повышением информированности специалистов и более широким применением визуализирующих методов исследования. Выявлена связь между стадией врожденной холестеатомы по классификации ChOLE и необходимым объемом оперативного вмешательства. Из общего числа наблюдений врожденной холестеатомы височной кости 26,1% составили пациенты с аномалиями развития наружного и среднего уха. Заключение. Всем пациентам с предполагаемой врожденной холестеатомой височной кости необходимо проведение МСКТ височных костей и МРТ среднего уха в DWI-режиме.
Список сокращений:
МСКТ — мультиспиральная компьютерная томография;
МРТ — магнитно-резонансная томография;
ЦСК — цепь слуховых косточек;
НСП — наружный слуховой проход;
ВХ — врожденная холестеатома.
Холестеатома височной кости — кистоподобное образование, состоящее из ороговевающего плоскоклеточного эпителия кожного типа, расположенное в полостях височной кости и способное вызывать в процессе своего роста воспалительную реакцию и резорбтивные процессы в прилежащих костных тканях [1].
По этиологии холестеатому височной кости принято разделять на врожденную (первичную), приобретенную (вторичную) и ятрогенную (третичную) [2].
Наиболее часто в литературе упоминаются случаи врожденной холестеатомы (ВХ) среднего уха [3, 4]. Однако встречаются единичные описания ее изолированного расположения в сосцевидном отростке [5, 6], в пирамиде височной кости [7, 8], в толще барабанной перепонки [9] и сочетания ее с другой патологией височной кости (врожденная полная костная атрезия наружного слухового прохода (НСП) [10—12], экзостозы НСП [13]).
ВХ среднего уха, по данным зарубежной литературы, составляет от 3,7 до 28% всех наблюдений диагностированных холестеатом височной кости и встречается наиболее часто в возрастной группе от 4 до 6 лет, преимущественно у лиц мужского пола [14—16]. Однако H.S. Cho и соавт. [17] в своем ретроспективном (1997—2012 гг.) исследовании ВХ среднего уха (93 случая) выявили увеличение частоты встречаемости данной патологии более чем в 2 раза с 2008 г.
Цель исследования — провести ретро- и проспективный анализ клинических особенностей и результатов хирургического лечения пациентов с ВХ височной кости.
Пациенты и методы
На базе ФГБУ «СПб НИИ ЛОР» Минздрава России за период с 2011 по 2018 г. у 23 пациентов была диагностирована ВХ височной кости. Мужчин было 11 (47,8%), женщин — 12 (52,2%), возраст больных — от 2 до 44 лет.
Ретроспективный анализ историй болезни с 2011 по 2016 г. был проведен у 11 (47,8%) пациентов.
Предоперационное обследование включало стандартное общеклиническое, отоларингологическое и радиологическое тестирование. В проспективном исследовании с 2017—2018 гг. была включена мультиспиральная компьютерная томография (МСКТ) височных костей и, по показаниям, магнитно-резонансная томография (МРТ) головного мозга в DWI-режиме.
Операции выполняли под эндотрахеальным наркозом через заушный разрез трансмеатальным, трансмастоидальным или смешанным доступом под контролем операционного микроскопа, в ряде случаев с эндовидеоскопической поддержкой и записью хода операции с использованием HD-камеры, интраперационным мониторингом лицевого нерва.
Диагноз ВХ височной кости был поставлен на основании отомикроскопии, радиологического обследования, интраоперационных находок и результатов гистологического исследования операционного материала.
Пациенты были распределены на две группы: 1-я группа — пациенты с ВХ среднего уха, 2-я группа — пациенты с другими типами ВХ височной кости.
Критерии M. Levenson (1986 г.) были использованы нами для верификации ВХ среднего уха: новообразование перламутрово-белого цвета, располагающееся медиальнее неизмененной барабанной перепонки с интактной натянутой и ненатянутой ее частями, при отсутствии в анамнезе у пациента отореи, перфорации барабанной перепонки, предыдущих отологических хирургических процедур, интрамембранозной и гигантской холестеатомы, при этом предыдущие эпизоды развития острого среднего отита не являются причиной исключения данной патологии [3].
К другим видам ВХ височной кости были отнесены клинические случаи, исключаемые M. Levenson: пациенты, имеющее врожденную полную атрезию НСП, сочетанную с ВХ височной кости; пациент с обтурирующими НСП экзостозами, сочетанными с ВХ среднего уха; пациент с ВХ пирамиды височной кости.
Согласно интраоперационным находкам, для ВХ среднего уха нами были выделены ее стадии по классификации ChOLE, разработанной T. Linder и соавт. [1]. Данная классификация учитывает распространенность холестеатомы (Сh), состояние цепи слуховых косточек (ЦСК) после операции (O), экстра-/интракраниальные осложнения (L), вентиляционную функцию слуховой трубы и пневматизацию сосцевидного отростка (E). Суммируя баллы по каждому из признаков, производим окончательный расчет стадий от I до III в соответствии со следующими правилами: I стадия — от 1 до 3 баллов, II стадия — от 4 до 8 баллов, III стадия — более 8 баллов [1].
Статистическую обработку данных проводили с использованием программы Statistica v.10 (Windows 10).
Результаты
Проведенное исследование показало, что большая часть пациентов поступила на хирургическое лечение в последние годы анализируемого периода (рис. 1).
Пациенты с ВХ среднего уха составили 15 (65,2%) наблюдений от всех случаев ВХ височной кости. Средний возраст пациентов данной группы — 12,9±7,3 года. Из них 9 (60,0%) мужчин, 6 (40,0%) женщин, 10 (66,7%) пациентов — дети в возрасте до 10 лет.
Самой частой первичной жалобой пациентов с ВХ среднего уха были: снижение слуха — у 11 (73,3%) пациентов, оталгии — у 3 (20,0%), эпизоды экссудативного отита в анамнезе — у 7 (46,6%), головокружения — у 1 (6,7%). В 2 (13,3%) случаях жалобы отсутствовали, а наличие ВХ было случайной находкой при отоскопии.
У 4 (26,7%) пациентов ВХ среднего уха была локализована в передневерхнем квадранте барабанной полости, у 2 (13,3%) занимала задний отдел барабанной полости, у 1 (6,7%) — нижний отдел и у 1 (6,7%) — передний отдел. В 7 (46,7%) наблюдениях ВХ тотально заполняла барабанную полость.
МСКТ височных костей в предоперационном периоде была выполнена всем 15 пациентам. Помимо определения мягкотканного образования в барабанной полости и костно-деструктивных изменений, при МСКТ удалось оценить пневматизацию сосцевидного отростка, что было необходимо для выделения стадии холестеатомы по классификации ChOLE. МРТ среднего уха в DWI-режиме была проведена 3 (20,0%) пациентам: в одном наблюдении ВХ занимала задние отделы барабанной полости и плохо визуализировалась при проведении отомикроскопии; 2 других пациента являлись одними из самых старших представителей этой группы — их возраст составлял 33 года и 41 год. Появление первых симптомов в данном возрасте и наличие образования за неповрежденной барабанной перепонкой дали основание для проведения МРТ среднего уха в DWI-режиме с целью дифференциальной диагностики с опухолью среднего уха.
Согласно классификации ChOLE, пациенты с ВХ среднего уха были отнесены к I стадии в 6 (40,0%) случаях, к II стадии в 7 (46,7%) случаях и к III стадии в 2 (13,3%) случаях.
Выбор оперативного пособия в данной группе пациентов был следующим: у 5 (33,3%) пациентов была выполнена тимпанотомия с ревизией барабанной полости и удалением холестеатомы из барабанной полости, у 4 (26,7%) — раздельная аттикоантромастоидотомия, у 6 (40,0%) пациентов проведена радикальная операция на среднем ухе с одномоментной тимпанопластикой. При этом наблюдалась прямая положительная связь между стадиями по классификации ChOLE и объемом оперативного вмешательства. Установка титанового протеза ЦСК потребовалась 11 (73,3%) пациентам.
Количество наблюдений, отнесенных к другим видам ВХ височной кости, составило 8 (34,8%) случаев: 6 (26,1%) пациентов с ВХ височной кости, сочетанной с ипсилатеральной врожденной полной атрезией НСП; 1 (4,3%) пациент с ВХ среднего уха, сочетанной с обтурирующими НСП экзостозами [13]; 1 (4,3%) пациентка с инфралабиринтной ВХ пирамиды височной кости [7].
Средний возраст пациентов с ВХ височной кости, сочетавшейся с ипсилатеральной врожденной полной атрезией НСП, составил 14,8±8,3 года. Из них 1 (16,7%) мужчина и 5 (83,3%) женщин. Все пациенты данной группы не предъявляли других жалоб, кроме снижения слуха на одно ухо.
Показанием к проведению оперативного вмешательства послужили результаты МСКТ височных костей и МРТ среднего уха в DWI-режиме — было определено наличие мягкотканного субстрата в височной кости.
У 3 (50,0%) пациентов холестеатома локализовалась между атретической пластинкой и фиброзной тканью, представляющей гипоплазированную барабанную перепонку (рис. 2).
Всем 6 пациентам была выполнена операция по устранению врожденной полной костной атрезии НСП с одномоментным удалением ВХ и выполнением тимпанопластики. Одному пациенту была выполнена оссикулопластика с установкой титанового протезаTORP.
Как и в исследовании H. Cho и соавт. [17], нами было отмечено выраженное увеличение частоты случаев ВХ височной кости за последние 3 года анализируемого периода.
По данным литературы, средний возраст пациентов с ВХ среднего уха, поступающих на оперативное лечение, составляет 4—6 лет [14—18]. Данный показатель в нашей выборке был существенно выше — 12,9±7,3 года. Это связано с тем, что во многих работах, посвященных ВХ, анализ проводится среди детской популяции. В нашем исследовании 5 (33,3%) пациентов были старше 18 лет, что говорит о невозможности позиционирования ВХ среднего уха исключительно как детской патологии. Преобладания пациентов мужского пола также не было отмечено.
Выявленные первичные жалобы пациентов соответствуют данным литературы [3—6, 16, 17]. К самой частой из них относили снижение слуха. Экссудативные отиты в анамнезе наблюдались у 7 (46,7%) пациентов. ВХ среднего уха протекала латентно и являлась случайной отоскопической находкой только в 2 (13,3%) случаях, что указывает на позднее ее выявление в подавляющем большинстве клинических наблюдений. Об этом также можно судить по тому, что у 7 (46,7%) пациентов холестеатома тотально заполняла барабанную полость, хотя, по данным других исследователей, она чаще локализуется в передневерхнем квадранте барабанной полости [11, 14, 19].
При сопоставлении стадии холестеатомы по классификации ChOLE [1] с объемом выполненной операции мы отметили между ними прямую положительную связь. Следовательно, существует необходимость более масштабных исследований с вероятным подтверждением возможности применения классификации ChOLE для интраоперационной оценки объема требуемого хирургического вмешательства.
Пациенты с ВХ и врожденной полной атрезией НСП составили 26,1% от общего числа выявленных случаев ВХ височной кости, что противоречит данным литературы о невысокой частоте встречаемости подобных сочетаний [10, 11]. У всех 6 пациентов заболевание протекало латентно, кроме снижения слуха, объясняемого наличием врожденной атрезии НСП. В 2 (33,3%) случаях проведение МСКТ височных костей не позволило выявить ВХ на дооперационном этапе из-за ее расположения между атретической пластинкой и фиброзной тканью, представлявшей гипоплазированную барабанную перепонку. Данные особенности сочетанной патологии говорят о необходимости расширить объем инструментальных методов исследования у пациентов с полной атрезией НСП, дополнив его МРТ среднего уха в DWI-режиме, что позволит достоверно дифференцировать холестеатому [20].
Описанные нами единичные наблюдения ВХ других локализаций указывают на важность детального обследования пациентов, поступающих на отохирургическое лечение, с обязательным проведением МСКТ височных костей и МРТ среднего уха в DWI-режиме, так как в этих случаях нельзя было предположить наличие холестеатомы на этапах общеклинического и отоларингологического обследования.
Заключение
1. За последние годы мы отметили увеличение встречаемости ВХ височной кости, что, вероятно, связано с повышением информированности специалистов и более широким применением визуализирующих методов исследования, которые позволяют выявить ВХ до развития вторичного воспаления с перфорацией барабанной перепонки.
2. Средний возраст пациентов с ВХ среднего уха составил 12,9±7,3 года.
3. Стадия холестеатомы по классификации ChOLE имеет прямую связь с объемом необходимого оперативного вмешательства.
4. Из общего числа наблюдений ВХ височной кости 26,1% составили пациенты с аномалиями развития наружного и среднего уха (сочетание холестеатомы с врожденной полной костной атрезией НСП), что свидетельствует о необходимости полного комплексного обследования данной группы пациентов для своевременной верификации ВХ, а при ее выявлении оперативное лечение следует проводить в кратчайшее сроки, независимо от возраста пациента и состояния второго уха.
5. Всем пациентам с предполагаемой ВХ височной кости, а также тем, у кого нельзя исключить ее наличия на этапе общеклинического и оториноларингологического обследования, необходимо проведение МСКТ височных костей и МРТ среднего уха в DWI-режиме.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Московский научно-практический центр оториноларингологии Департамента здравоохранения Москвы
Московский научно-практический центр оториноларингологии ДЗ Москвы
Федеральный медико-биологический Центр им. А.И. Бурназяна ФМБА России, Москва, Россия, 123098
Хирургическое лечение холестеатомы пирамиды височной кости
Журнал: Вестник оториноларингологии. 2015;80(3): 57‑60
Кратко представлена эпидемиология, классификация, диагностика и современные тенденции хирургического лечения холестеатомы пирамиды височной кости. Описан клинический случай диагностики и хирургического лечения холестеатомы верхушки пирамиды височной кости.
Из всех заболеваний верхушки пирамиды височной кости холестеатома встречается в 3,4—9% случаев. Наиболее часто (в 60%) в этой зоне выявляется холестероловая гранулема. В то же время имеются случаи диагностики мукоцеле, арахноидальных кист, менингиомы, хордомы, ксантомы, кавернозной гемангиомы, аневризм внутренней сонной артерии, фиброзной дисплазии, хондросаркомы и метастатической карциномы. Может симулировать заболевание верхушки пирамиды и асимметричная пневматизация этой локализации [1—5].
Среди больных с холестеатомой височной кости у 2,9% встречается холестеатома пирамиды височной кости. Холестеатома этой локализации может быть первичной (врожденной), происходящей из остатков эмбриональной или аберрантной эпителиальной ткани, или вторичной вследствие инвазии холестеатомы из среднего уха или сосцевидного отростка. Вторичная холестеатома выявляется у 58%, а первичная — у 12% пациентов [2, 6]. В зависимости от локализации холестеатомы в пирамиде височной кости по классификации M. Sanna [7] выделяют пять ее видов: супралабиринтная, инфралабиринтная, массивная лабиринтная, инфралабиринтная с апикальным распространением и апикальная [7]. Наиболее часто встречается супралабиринтная (26,7—67%), массивная лабиринтная (20—38%) и инфралабиринтная (7—40%) холестеатомы [1, 6, 8].
При холестеатоме пирамиды височной кости часто наблюдается бессимптомное течение при значительном ее объеме. В зависимости от локализации ранними симптомами могут быть выраженное снижение слуха или глухота (у 9—69%), дисфункция лицевого нерва (у 29—53%), оторея (у 66,7%), периферическое головокружение (у 33,3%) или центральные неврологические осложнения вследствие эрозии рядом расположенных важных анатомических структур [1, 2, 6, 8, 9].
Применение в диагностике высокоинформативных методов исследования: мультиспиральной компьютерной томографии (МСКТ) и магнитно-резонансоной томографии (МРТ) с контрастным усилением, в том числе в non- EPY режиме, позволяет определить локализацию, распространение холестеатомы и на дооперационном этапе планировать хирургический подход.
В литературе имеются единичные обзоры, посвященные диагностике и хирургии холестеатомы пирамиды височной кости, освещающие значительное количество клинических случаев [1, 6, 8—11]. Основными задачами операции являются тотальное макроскопическое удаление холестеатомы, сохранение ствола лицевого нерва, предупреждение ликвореи и менингита и сохранение слуховой функции. Поэтому современный алгоритм выбора хирургического подхода строится на локализации холестеатомы, состоянии слуховой функции и лицевого нерва. Большинство авторов отдают предпочтение закрытым вариантам с облитерацией зоны операции и ушиванием наружного слухового прохода по Rambo, учитывая современные средства реабилитации слуха. Так, при супралабиринтной холестеатоме и нормальном слухе используют транстемпоральный супралабиринтный подход через среднюю черепную ямку, а при сенсоневральной тугоухости — выполняют субтотальную петрозэктомию транслабиринтным и транскохлеарным подходом. При инфралабиринтной холестеатоме и нормальном слухе применяют субтотальную петрозэктомию трансмастоидальным и ретролабиринтным подходами, а при сенсоневральной тугоухости — транслабиринтным и транскохлеарным подходами [6, 11, 12]. В то же время стремление сохранить слух после операции в ущерб радикальному удалению холестеатомы может привести к резидуальной патологии и необходимости повторного вмешательства. В тех случаях, когда холестеатома распространяется медиальнее капсулы лабиринта, сохранить слух невозможно, и на выбор хирургического подхода влияет состояние лицевого нерва. При этих локализациях холестеатомы при сохранной функции лицевого нерва применяют транслабиринтный и транскохлеарный или инфратемпоральный доступы, а при дисфункции лицевого нерва — транскохлеарный. Для лечения дисфункции лицевого нерва в зависимости от места компрессии выполняют декомпрессию ствола нерва, нейропластику или VII—XII анастомоз одновременно (или на втором этапе) [1, 6, 10]. Лучшие результаты операции отмечают при длительности дисфункции лицевого нерва менее 12 мес. В результате лечения глухота оперированного уха наблюдается у 18—83%, рецидив холестеатомы в разные сроки — у 2—19% и интракраниальные осложнения у 2—6% больных [6, 8].
В последние годы некоторые авторы выполняют модифицированную субтотальную петрозэктомию различными подходами, в зависимости от локализации холестеатомы, с тимпанооссикулопластикой для сохранения или улучшения функции слуха. По их данным, преимуществами открытой реконструкции являются функциональный результат, ранняя диагностика рецидива холестеатомы и менее сложная ревизионная хирургия в условиях необлитерированной полости. При этой методике после удаления холестеатомы пирамиды височной кости у 90% пациентов выполнялась тимпанопластика и у 52% — оссикулопластика. В результате операции слух улучшился у 38% пациентов, сохранился на прежнем уровне — у 29% и у 33% отмечено его ухудшение [8].
В нашей стране хирургией пирамиды височной кости занимаются преимущественно нейрохирурги. Однако и их возможности ограничены при распространенной холестеатоме пирамиды височной кости.
Представляем случай диагностики и хирургического лечения холестеатомы верхушки пирамиды височной кости.
Пациентка М., 32 года, обратилась в отделение нейрохирургии клиники ФГБУ ФМБЦ им. А.И. Бурназяна с жалобами на отсутствие слуха на правое ухо, периодические выделения из него, асимметрию лица.
Из анамнеза известно, что пациентка с детства страдает хроническим гнойным правосторонним средним отитом с периодическими обострениями в виде выделений из правого уха на фоне ОРВИ или попадания воды в ухо. Регулярно проводилась местная антибактериальная терапия с временным положительным эффектом. С 16-летнего возраста стала отмечать головокружения системного характера. В 2006 г. обратилась в клинику МОНИКИ, где выполнена КТ височных костей, по данным которой выявлено новообразование правой пирамиды височной кости. В той же клинике выполнена санирующая операция на правой височной кости с удалением задней стенки слухового прохода. В послеоперационном периоде головокружения купировались, но сохранялись выделения из этого уха. В 2009 г. стала отмечать подергивание мышц правой половины лица, эпизоды по типу гемифациального спазма до нескольких раз в день. В НИИ нейрохирургии им. Н.Н. Бурденко выполнена ретросигмовидным доступом операция на пирамиде височной кости с удалением холестеатомы правой пирамиды височной кости. После операции у пациентки полностью восстановилась функция лицевого нерва справа. Однако в 2012 г. у пациентки вновь развился парез лицевого нерва справа. Обратилась в отделение нейрохирургии клиники ФМБЦ им. А.И. Бурназяна для обследования и лечения.
При поступлении: общее состояние больной удовлетворительное. Температура тела нормальная. Кожные покровы обычной окраски. В легких дыхание везикулярное, без хрипов. АД — 120/80 мм рт.ст. Пульс 90 в 1 мин, ритмичный, удовлетворительных свойств.
При осмотре имеются спокойные, безболезненные послеоперационные рубцы в правой заушной и ретросигмовидной области. При отомикроскопии справа — наружный слуховой проход широкий, свободный, без отделяемого. Барабанная перепонка сохранена только в передних отделах. Слизистая оболочка в мезогипотимпануме утолщенная, полипозно-измененная. Полость в мастоидальном отделе небольшая, покрыта утолщенной слизистой оболочкой без эпидермиса. Слуховая труба проходима по Вальсальва. Слева наружный слуховой проход широкий, свободный. Барабанная перепонка серого цвета, опознавательные знаки дифференцируются.
В неврологическом статусе: сознание ясное. Контактная. Менингеальных знаков нет. Гипостезия в зоне иннервации V нерва справа (больше по 1—2 ветвям), корнеальный рефлекс снижен справа. Определяется грубый парез правого лицевого нерва справа (V степень по шкале House—Brackmann). Координаторные пробы выполняла удовлетворительно.
При тональной пороговой аудиометрии (ТПА) выявлена правосторонняя глухота. Слух слева в пределах возрастной нормы.
По данным электронейромиографии отмечались признаки умеренного поражения правого лицевого нерва по смешанному типу (аксональному и демиелинизирующему), проводимость по всем ветвям составляла 30—40% от нормы по типу неврита.
![]()
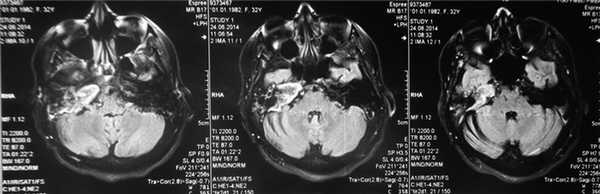
Рис. 1. КТ височных костей пациентки М. а — коронарная проекция: деструктивная полость в пирамиде височной кости, заполненная субстратом неоднородной плотности, капсула лабиринта значительно разрушена на уровне базального и апикального завитков улитки, латерального и верхнего полукружных каналов; б — аксиальная проекция: деструктивная полость с разрушением задней грани пирамиды, передневерхней и нижней поверхности.
По результатам МРТ головного мозга правая пирамида височной кости деформирована, увеличена в объеме, выполнена субстратом размером до 5,5—2,8—3 см, распространяющимся на область внутреннего слухового прохода, заднего полукружного канала, медиальные отделы барабанной полости, сосцевидный отросток. Описанный субстрат изо-гипоинтенсивен в режиме Т1, гиперинтенсивен — в Т2 и non-EPI DWI (рис. 2). Заключение: признаки рецидива холестеатомы с деструктивными изменениями структур внутреннего и среднего уха на фоне хронических воспалительных изменений.
![]()
Рис. 2. Магнитно-резонансная томография головного мозга пациентки М. Деформированная, увеличенная в объеме пирамида височной кости выполнена мягкотканым субстратом.
Учитывая анамнез заболевания, ранее выполненные операции, клинические проявления (глухота, явления периферического пареза лицевого нерва) и локализацию процесса по данным КТ височных костей и МРТ, свидетельствующие о массивной лабиринтной холестеатоме, пациентке была выполнена реоперация. Транслабиринтным подходом произведена субтотальная петрозэктомия (частичная лабиринтэктомия) с удалением холестеатомы и пластикой дефекта височной кости жиром. При ревизии определялась послеоперационная неэпидермизированная мастоидальная полость, которая была заполнена утолщенной слизистой оболочкой. В барабанной полости также определялась утолщенная полипозная слизистая оболочка. Барабанная перепонка сохранена только в передних отделах. Цепь слуховых косточек отсутствовала. За счет удаления перилабиринтных клеток, заднего верхнего и латерального полукружных каналов был открыт широкий доступ в сторону верхушки пирамиды, где выявлена большая холестеатома, распространявшаяся от верхушки сосцевидного отростка до верхушки пирамиды височной кости. Выявлено обнажение луковицы яремной вены, мозговых оболочек задней черепной ямки, нисходящей части канала лицевого нерва. Холестеатома удалена с образованием большой полости внутри пирамиды височной кости. При удалении холестеатомы из области внутреннего слухового прохода (который не дифференцировался) отмечалась ликворея. Эпидермальные оболочки оставлены на луковице яремной вены, у верхушки пирамиды височной кости, под улиткой. Произведена герметизация твердой мозговой оболочки двухкомпонентным фибриновым клеем. В область верхушки пирамиды височной кости уложена подкожно-жировая клетчатка, которая была взята с передней брюшной стенки. Выполнена пластика полости свободным миофасциальным лоскутом. В барабанную полость, под остатки барабанной перепонки, уложена аутофасция. Слуховой проход не ушивался для возможности контроля за созданной полостью.
По данным гистологического исследования удаленного образования от 29.07.14: в присланном материале бесструктурные холестеатомные массы и мелкий пласт многослойного плоского эпителия с рыхлой подэпителиальной стромой с кровоизлияниями.
При наблюдении в послеоперационном периоде отмечена длительная эпителизация послеоперационной полости и сохранение пареза правого лицевого нерва (V степень по шкале House—Brackmann). Неврологический статус — без отрицательной динамики.
Представленный случай свидетельствует о возможности успешного применения транслабиринтного подхода для удаления холестеатомы верхушки пирамиды височной совместно с нейрохирургами.
Холестеатома уха
Холестеатома уха — это опухолевидное инкапсулированное образование среднего уха, состоящее преимущественно из клеток слущенного эпителия и кристаллов холестерина. Различают истинную (врожденную) и ложную холестеатому уха. Проявляется заболевание ощущением распирания и болями в ухе, снижением слуха смешанного типа, небольшим количеством имеющих гнилостный запах выделений из уха. Холестеатома уха диагностируется при помощи рентгенографии и КТ черепа, отоскопии, зондирования и промывания барабанной полости, исследований вестибулярного и слухового анализаторов. Лечение холестеатомы уха в большинстве случаев заключается в радикальном хирургическом удалении. Иногда возможно промывание надбарабанной полости с расположенной в ней холестеатомой.
МКБ-10
![Холестеатома уха]()
![КТ височных костей. Деструкция сосцевидного отростка, сосцевидной пещеры, пирамиды и среднего уха правой височной кости, обусловленная холестеатомой]()
![МРТ головы. Гиперинтенсивный сигнал в области сосцевидной пещеры, сосцевидного отростка и пирамиды правой височной кости (холестеатома)]()
Общие сведения
Холестеатома - эмбриональное или (чаще) приобретенное псевдоопухолевое образование, происходящее из тканей среднего уха. В 90% случаев она появляется на фоне хронического гнойного среднего отита. В популяции частота гнойный отитов, осложненных холестеатомой, составляет 0,01%. Заболеванием чаще страдают дети старше 10 лет и взрослые 20-30 лет. У детей патология протекает более агрессивно с многократными рецидивами.
![Холестеатома уха]()
Причины
Холестеатома уха может иметь врожденный характер. В таких случаях она носит название истинной. Благодаря гладкой, напоминающей поверхность жемчужины, капсуле истинную холестеатому уха называют еще «жемчужной опухолью». Она возникает вследствие эмбриональных нарушений и располагается в пирамиде височной кости. Истинная холестеатома может также находиться в других костях черепа, в боковой цистерне и желудочках головного мозга.
Ложная холестеатома уха образуется в результате длительно протекающих отитов или как последствие травмы уха. Считается, что образование ложной холестеатомы уха возможно 2 путями. В первом случае происходит врастание плоского эпителия наружного слухового прохода в полость среднего уха через краевой разрыв барабанной перепонки. Второй механизм образования холестеатомы уха реализуется при нарушении проходимости слуховой трубы в связи с евстахиитом. В результате пониженного давления в барабанной полости происходит втяжение в нее части барабанной перепонки. Когда втяжение становится достаточно глубоким, в нем начинает накапливаться кератин и слущенный эпителий, что ведет к развитию холестеатомы уха.
Патогенез
Холестеатома уха не является истинной опухолью уха, хотя по своему внешнему виду и характеру роста напоминает опухолевое образование. Холестеатома уха имеет слоистую структуру. Сверху она покрыта капсулой из соединительной ткани, под которой находится ороговевающий плоский эпителий. Средний слой холестеатомы уха представлен наложенными одна на другую пластинами слущенного эпителия и расположенными между ними кристаллами холестерина. Центральную часть холестеатомы уха или ее ядро занимает имеющий гнилостный запах беловатый детрит.
Холестеатома уха может быть единичным образованием или представляет собой скопление большого количества узелков, имеющих плотную консистенцию и размер от 3 мм. Холестеатома уха выделяет специфические химические вещества, которые приводят к резорбции окружающих холестеатому костных тканей с образованием гладкостенной полости. Кроме того, эти вещества оказывают токсическое воздействие на рецепторный аппарат внутреннего уха, вызывая расстройство звуковосприятия и реактивный лабиринтит.
Симптомы холестеатомы уха
В начальном периоде холестеатома уха может иметь бессимптомное течение. Затем пациент начинает предъявлять жалобы на чувство распирания в ухе, появление тупой, давящей, ноющей или стреляющей ушной боли. Происходит понижение слуха. Возможны головные боли, при развитии лабиринтита — головокружения. Наблюдаются выделения из уха, которые обычно имеют гнилостный запах и носят скудный характер. Отличительной особенностью является обнаружение в отделяемом небольших комочков белого цвета.
При холестеатоме уха тугоухость имеет смешанный характер. С одной стороны она обусловлена нарушением звукопроведения в связи с ограничением подвижности слуховых косточек, а с другой — расстройством звуковосприятия в результате токсического поражения рецепторов лабиринта проникающими в него агрессивными выделениями холестеатомы.
Осложнения
Разрушая рядом расположенные костные образования, холестеатома уха увеличивается в размерах. Так она со временем заполняет ячейки сосцевидного отростка, доходит до капсулы лабиринта и способна разрушить его полукружные канальцы с образованием фистулы лабиринта. При разрушении коркового слоя сосцевидного отростка холестеатома уха выходит под кожу сосцевидной области.
Разрушение стенки косного канала лицевого нерва ведет к развитию пареза лицевого нерва, стенки сигмовидного синуса — к его тромбозу. Зачастую холестеатома уха достигает размера грецкого ореха и имеет расходящиеся в различных направлениях отростки. При этом она образует гигантскую полость, похожую на полость, остающуюся после общеполостной операции на ухе.
Старая холестеатома уха включает содержащие токсическую жидкость кисты, прорыв которых в подпаутинное пространство приводит к развитию асептического менингита, в вещество головного мозга — к появлению менингоэнцефалита. Эти осложнения могут привести к гибели больного от отека головного мозга. Обострение среднего отита часто сопровождается гнойным распадом холестеатомы уха, обуславливающим развитие гнойного лабиринтита и менингита, околосинусового и экстрадурального абсцесса, абсцесса головного мозга, отогенного сепсиса.
Диагностика
К диагностике холестеатомы уха могут привлекаться не только врачи-отоларингологи, но также неврологи и нейрохирурги. В современной отоларингологии используется комплекс визуализирующих и функциональных методик:
- Рентгенография височных костей. На рентгенограммах в проекции по Майеру, Шюллеру или Стенверсу холестеатома определяется как имеющая среднюю плотность однородная тень, которая находится в круглой патологической полости с гладкими и четко визуализирующимися краями. Более точную визуальную картину образования получают при проведении КТ и МСКТ черепа.
![КТ височных костей. Деструкция сосцевидного отростка, сосцевидной пещеры, пирамиды и среднего уха правой височной кости, обусловленная холестеатомой]()
КТ височных костей. Деструкция сосцевидного отростка, сосцевидной пещеры, пирамиды и среднего уха правой височной кости, обусловленная холестеатомой
- Эндоскопия уха. При отоскопии возможно обнаружение краевой перфорации барабанной перепонки, признаков деструкции костной части слухового прохода, обусловленных разрастанием холестеатомы. При наличии краевой перфорации производят зондирование полости среднего уха пуговчатым зондом и промывание надбарабанного пространства. О наличии деструктивного процесса свидетельствует шероховатая при прощупывании поверхность кости. В пользу холестеатомы уха говорит присутствие в промывных водах включений и чешуек эпидермиса.
- Исследование слухового анализатора. Дополнительно у пациентов с холестеатомой уха проводят исследование слуха и вестибулярного анализатора. Аудиометрия выявляет снижение слуха, пороговая аудиометрия — смешанный тип тугоухости. Производят также исследование камертоном, определение проходимости слуховой трубы, электрокохлеографию, акустическую импедансометрию, отоакустическую эмиссию, вестибулометрию, электронистагмографию, стабилографию, непрямую отолитометрию.
- Неврологическая диагностика. В диагностике осложнений может применяться неврологический осмотр, МРТ головного мозга, люмбальная пункция и др.
![МРТ головы. Гиперинтенсивный сигнал в области сосцевидной пещеры, сосцевидного отростка и пирамиды правой височной кости (холестеатома)]()
МРТ головы. Гиперинтенсивный сигнал в области сосцевидной пещеры, сосцевидного отростка и пирамиды правой височной кости (холестеатома)
Холестеатому уха необходимо дифференцировать от опухолей и инородных тел уха, кохлеарного неврита, серной пробки, гломусной опухоли, адгезивного среднего отита, специфических гранулем при туберкулезе и сифилисе.
Лечение холестеатомы уха
Консервативная тактика
Консервативное лечение возможно лишь в случае небольшой холестеатомы уха, находящейся в надбарабанном пространстве. Терапия таких холестеатом заключается в промывании надбарабанного пространства растворами протеолитических ферментов и борной кислоты. Начинают и заканчивают процедуру промыванием полости изотоническим раствором. Подобную манипуляцию проводят ежедневно в течение недели.
Хирургическое лечение
При неэффективности консервативного лечения, большом размере холестеатомы уха, наличии осложнений показано радикальное удаление образования. В зависимости от распространенности холестеатомы хирургическое вмешательство может включать:
- санирующую операцию на среднем ухе;
- лабиринтотомию;
- транслабиринтное вскрытие пирамиды височной кости;
- тимпанпластику, мастоидопластику, мирингопластику и пр.
Прогноз и профилактика
В случае своевременного выявления, последовательного консервативного или радикального хирургического лечения холестеатомы прогноз благоприятный. В отдельных случаях возможны рецидивы процесса. В запущенных стадиях возможно развитие тугоухости, жизнеугрожающих внутричерепных осложнений. Профилактика холестеатомы заключается в предупреждении ХГСО, своевременном лечении воспаления среднего уха.
Читайте также:
- Инфекции вызванные парвовирусами: диагностика, лечение, профилактика
- Средняя степень тяжести ларвального парагонимоза. Тяжелое течение ларвального парагонимоза
- Гиперкалиемический дистальноканальцевый ацидоз
- Дренирование клетчаточных пространств у женщин.
- Женский псевдогермафродитизм: признаки, фенотип