Лапароскопия при запущенном раке шейки матки - показания, возможности
Добавил пользователь Валентин П. Обновлено: 16.01.2026
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
Московский научно-исследовательский онкологический институт им. П.А. Герцена
Радикальные лапароскопические операции в хирургическом лечении рака тела матки
Журнал: Российский вестник акушера-гинеколога. 2014;14(5): 60‑65
Шевчук А.С., Новикова Е.Г., Анпилогов С.В. Радикальные лапароскопические операции в хирургическом лечении рака тела матки. Российский вестник акушера-гинеколога. 2014;14(5):60‑65.
Shevchuk AS, Novikova EG, Anpilogov SV. Radical laparoscopic operations in surgical treatment for cancer of the corpus uteri. Russian Bulletin of Obstetrician-Gynecologist. 2014;14(5):60‑65. (In Russ.).
Цель исследования - сравнительный анализ ближайших результатов хирургического лечения больных раком эндометрия I стадии с помощью лапароскопического и лапаротомного доступов. Материал и методы. В отделении гинекологии Московского научно-исследовательского онкологического института им. П.А. Герцена с июля 2010 г. по декабрь 2013 г. лапароскопическая гистерэктомия с тазовой лимфаденэктомией по поводу рака эндометрия выполнена у 87 женщин. Группу сравнения составила 41 пациентка с аналогичной распространенностью опухолевого процесса, которым выполнялась операция из классического лапаротомного доступа идентичного объема с июня 2008 г. по июль 2010 г. В исследование включались больные с клиническим диагнозом рак эндометрия IА-С стадии. Результаты. Сравнительный анализ двух групп больных показал, что видеоэндоскопическая экстирпация матки с тазовой лимфаденэктомией может рассматриваться в качестве адекватной альтернативы классическим "открытым" операциям у больных со злокачественными опухолями матки I стадии, так как имеет такие преимущества, как минимальная кровопотеря, низкое число осложнений, более быстрая реабилитация больных. Заключение. Период наблюдения после видеоскопической операции в настоящее время недостаточен (медиана наблюдений - 15 мес), чтобы делать окончательные выводы.
Впервые лапароскопическая экстирпация матки выполнена в январе 1988 г. гинекологом H. Reich в США. В 1992 г. по поводу начального рака эндометрия выполнена первая видеоассистированная вагинальная гистерэктомия. Спустя 1 год гистерэктомия была дополнена тазовой лимфаденэктомией и появились первые работы по выполнению полностью видеоэндоскопической экстирпации матки, без вагинального этапа (J. Childers и соавт., 1992, 1993; H. Reich, L. Sckel, 1993).
В России первую лапароскопическую экстирпацию матки выполнили В.К. Карнаух и соавт. в 1993 г. [3]. Проблема лапароскопического доступа в лечении многих гинекологических заболеваний (миома матки, эндометриоз, доброкачественные кистозные образования яичников) в нашей стране разрабатывалась и широко освещалась в работах Л.В. Адамян и соавт. [1]. В настоящее время в нашей стране, как и в мире, он применяется также и в лечении злокачественных опухолей [2, 4].
Вопрос о применении видеоэндоскопичских методик в онкологии остается предметом дискуссий. Лапароскопические операции не позволяют провести адекватную пальпаторную ревизию, могут способствовать интраоперационному распространению злокачественных клеток на фоне карбоксиперитонеума и использования инструментов, травмирующих опухоль, таким образом могут привести к увеличению частоты рецидивов и ухудшению прогноза заболевания по сравнению с лапаротомными вмешательствами [13].
В этом аспекте предметом активных дискуссий является вопрос о возможности применения маточного манипулятора в ходе лапароскопических операций у больных раком эндометрия [6]. В частности, утверждается, что длительная механическая травматизация неоплазированного эндометрия наконечником маточного манипулятора может способствовать попаданию опухолевых клеток в сосудистое русло либо в брюшную полость по маточным трубам [9, 10]. Было показано, что существенных гистологических различий в удаленных препаратах между открытыми и лапароскопическими операциями не выявляется, и применение маточного манипулятора не влияет на правильность морфологической оценки истинной распространенности опухолевого процесса [7, 12]. Однако отмечается наличие большей частоты сосудистой инвазии опухоли, или «псевдоинвазии», обусловленной давлением внутриматочного наконечника [8, 11], что потенциально может приводить к увеличению рецидивов заболевания [5]. Помимо этого, некоторые исследователи отмечают большую частоту обнаружения опухолевых клеток в перитонеальных смывах (4,3%) после введения наконечника манипулятора у больных со злокачественными опухолями тела матки [10].
Экстирпация матки с придатками и с тазовой лимфаденэктомией в настоящее время является стандартом хирургического лечения больных раком эндометрия. Выполнение тазовой лимфаденэктомии требуется при наличии неблагоприятных факторов прогноза заболевания (низкая степень дифференцировки, серозная или светлоклеточная морфологические формы опухоли, инвазия опухоли в миометрий на глубину более половины его толщины, тотальное поражение всей полости матки), при которых риск субклинического поражения регионарных лимфатических узлов крайне высок.
Цель исследования - сравнительный анализ ближайших результатов хирургического лечения больных раком эндометрия I стадии с помощью лапароскопического и лапаротомного доступов.
Материал и методы
В отделении гинекологии института им. П.А. Герцена с июля 2010 г. по декабрь 2013 г. лапароскопическая гистерэктомия с тазовой лимфаденэктомией по поводу рака эндометрия была выполнена у 87 женщин (основная группа). Группу сравнения составила 41 пациентка с аналогичной распространенностью опухолевого процесса, которым была выполнена лапаротомная операция идентичного объема с июня 2008 г. по июль 2010 г.
Показанием к хирургическому лечению в указанном объеме явилась совокупность признаков:
1. Клиническая стадия заболевания (по классификации FIGO 2002 г, TNM 6-е издание):
- IA (T1aNoMo) в сочетании с умеренной или низкой степенью дифференцировки опухоли и тотальным поражением всей полости матки;
- IA (T1aNoMo) - рецидив либо продолженный рост опухоли после самостоятельной гормонотерапии у пациенток репродуктивного возраста;
- IB, IC (T1b,cNoMo) стадии.
2. Гистологические варианты: эндометриоидная аденокарцинома, эндометриоидная аденокарцинома с плоскоклеточной дифференцировкой, светлоклеточная аденокарцинома, аденоплоскоклеточный рак.
3. Отсутствие распространения опухоли на шейку матки и признаков метастатического поражения регионарных лимфатических узлов по данным магнитно-резонансной томографии (МРТ) и УЗИ.
Техника лапароскопической экстирпации матки у больных с опухолью эндометрия имела ряд особенностей по сравнению с аналогичной операцией, выполняемой при доброкачественной патологии (миома матки, аденомиоз). На 1-м этапе для предотвращения попадания опухолевых клеток в брюшную полость и общий кровоток коагулировались маточные трубы, собственные связки яичников, круглые и воронкотазовые связки матки с пересечением двух последних. Затем перевязывались либо клипировались маточные артерии и вены на расстоянии 1 см от места отхождения от передней ветви внутренних подвздошных сосудов. После лигирования основных сосудистых пучков матки операция продолжалась уже на фоне введения в полость матки наконечника маточного манипулятора.
Следующий этап операции - тазовая лимфаденэктомия. Условной проксимальной ее границей был уровень на 2 см выше бифуркации общей подвздошной артерии. В дистальном направлении клетчатку удаляли до вены, огибающей подвздошную кость. Наружной и внутренней границами лимфаденэктомии являлись подвздошно-поясничная мышца и пупочная артерия (ветвь внутренней подвздошной). Обтураторный нерв являлся задней границей лимфодиссекции. Удаленную клетчатку отдельно с каждой стороны извлекали из брюшной полости в контейнерах через троакарные раны.
В исследование были включены больные с клиническим диагнозом рака эндометрия стадии IА-С (FIGO, 2002). Средний возраст всех пациенток составил 55±10,5 года, при этом половина из них находились в пери- и постменопаузе.
У 63% пациенток в основной группе и у 66% в группе сравнения имелась избыточная масса тела либо ожирение, играющие определенную роль в патогенезе рака эндометрия.
Результаты
Были проанализированы основные хирургические показатели лапароскопических операций в сравнении с аналогичными лапаротомными.
Продолжительность видеоэндоскопических хирургических вмешательств варьировала от 115 до 300 мин, в среднем составила 202,3±43,1 мин, медиана 195 мин. В исследование были включены пациентки, которым впервые выполнялась лапароскопическая экстирпация матки с придатками и тазовой лимфаденэктомией. По мере освоения методики продолжительность операции закономерно снижалась («кривая обучения»). Была проанализирована продолжительность последних 41 лапароскопических операций, при этом средние значения составили 176,3±33,8 мин, медиана 180 мин. В группе сравнения продолжительность хирургического вмешательства была равна 153,9±37 мин, медиана 150 мин.
Лапароскопический доступ, несмотря на расширенный характер операции, затрагивающей области магистральных сосудов, характеризовался в большинстве случаев минимальной кровопотерей. В среднем она составила 130 мл (медиана 70 мл), при этом у 50% больных находилась в интервале от 70 до 100 мл. У одной (1,2%) пациентки в связи с ранением внутренней подвздошной вены этот показатель увеличился до 2000 мл. Отсутствие других тяжелых интраоперационных осложнений позволило рассматривать лапароскопическую методику как относительно безопасную. Кровопотеря в группе сравнения в среднем составила 400±199 мл, медиана 400 мл, что значительно выше, чем в основной группе.
Дренаж устанавливали всем пациенткам. Сроки его удаления определяли индивидуально. В течение первых 3 сут отмечался рост количества отделяемого (соответственно в среднем 96, 146 и 206 мл). Затем наступало «плато», и в ближайшие 2 сут его количество оставалось на одном уровне. С 4-го дня после операции определялась тенденция к возрастанию лимфореи. У 64% пациенток дренаж вынимался к 3-м суткам. Количество лимфокист в подвздошных областях оказалось меньше (10,3% случаев по сравнению с 41,5% в группе сравнения).

Послеоперационный период в основной группе (лапароскопия) характеризовался в целом гладким течением и минимальным числом осложнений (табл. 1).
Среди общехирургических осложнений в группе сравнения следует отметить нагноение послеоперационного шва, тромбоэмболию легочной артерии (ТЭЛА) с летальным исходом (при одинаковом проценте случаев тромбоза вен нижних конечностей), а также повторное хирургическое вмешательство по поводу кишечной непроходимости, которые не встречались после лапароскопических операций.
Послеоперационный период пребывания больных в стационаре в основной группе в среднем в 1,5 раза был меньше, чем в группе сравнения (8,9±2,6 и 13±2,5 дня соответственно).

При плановом гистологическом исследовании морфологическая форма опухоли в большинстве случаев была представлена эндометриоидной аденокарциномой. При этом высокая (G1) и умеренная (G2) степени дифференцировки опухоли встречались приблизительно в равном количестве у большинства пациенток (табл. 2).
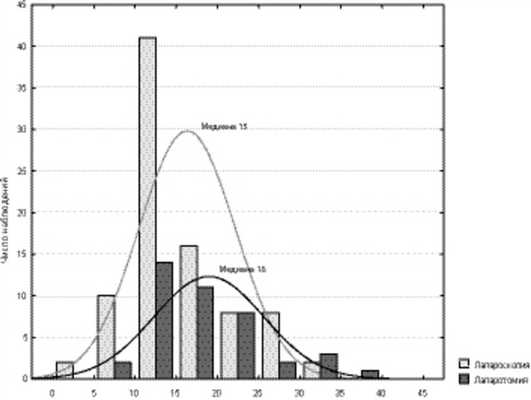
Среднее количество удаленных лимфатических узлов после лапароскопической операции на 1 больную составило 16,2±5,8, медиана 15. В 2 (2,3%) случаях подтверждено метастатическое поражение тазовых лимфатических узлов. В группе сравнения в среднем было удалено 18,8±6,6 подвздошно-обтураторных лимфоузлов, медиана 18. У одной (2,4%) пациентки были выявлены метастазы в тазовых лимфоузлах (рис. 1). Рисунок 1. Распределение пациенток обследованных групп по количеству удаленных лимфатических узлов.
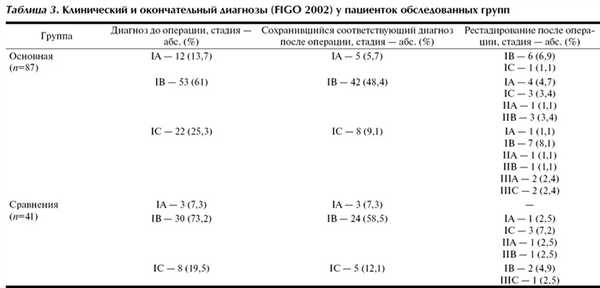
Основную долю в исследовании составили пациентки с IB стадией заболевания - 63%. Ограничения разрешающей способности инструментальных методов обследования (УЗИ, МРТ) не исключают получение ложноположительных и ложноотрицательных результатов. Сопутствующие фоновые процессы в матке (миома, аденомиоз) создают объективные трудности для правильной оценки распространенности опухоли. В связи с этим в обеих группах отмечены случаи изменения диагноза рака тела матки как в сторону увеличения, так и уменьшения стадии. У 32 (36,8%) пациенток в основной группе и у 9 (22%) в группе сравнения первичный диагноз был изменен на основании результатов планового гистологического исследования (табл. 3).
При наличии инвазивной опухоли всегда существует риск субклинического метастатического поражения регионарных лимфатических узлов. У 3 пациенток: 2 (2,4%) в основной и 1 (2,5%) в группе сравнения, в связи с этим проведено повторное определение стадии рака эндометрия на основании обнаружения микрометастазов в регионарных лимфатических узлах, что соответствовало IIIC стадии.
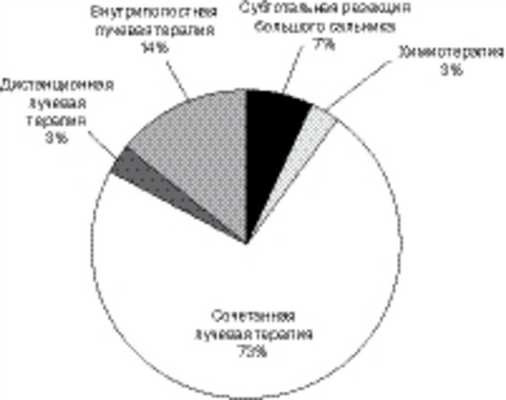
У 30 (34,4%) пациенток основной группы выполнено адъювантное дополнительное лечение (рис. 2). Рисунок 2. Адъювантное лечение у пациенток основной группы.
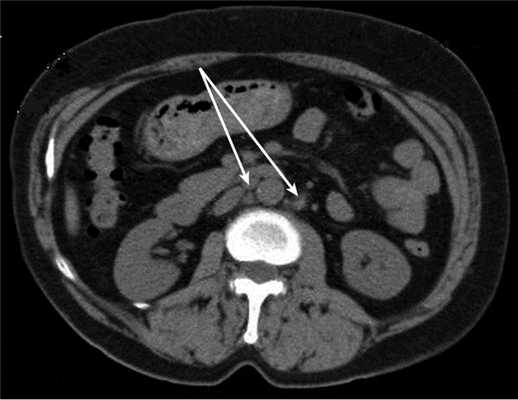
Медиана наблюдения больных основной группы в рамках проспективного исследования составила 15 мес. У одной пациентки 61 года с диагнозом рак эндометрия IIIC стадии рT1cN1Mo через 7 мес после завершения первичного комбинированного лечения диагностирован рецидив заболевания в области забрюшинных лимфатических узлов на уровне отхождения почечных сосудов до 2 см в диаметре (рис. 3). Рисунок 3. Локализация рецидива (стрелки) в забрюшинном пространстве на уровне почечных сосудов у больных основной группы.
На консилиуме принято решение выполнить циторедуктивное хирургическое вмешательство - парааортальную лимфаденэктомию. Морфологически структура опухоли была аналогична первичной неоплазии в матке, представлена низкодифференцированной эндометриоидной аденокарциномой с субтотальным замещением лимфоидной ткани. В послеоперационном периоде проведена дистанционная лучевая терапия с последующей полихимиотерапией. Пациентка жива, находится под наблюдением 2 мес.
Специфических для лапароскопических операций «port-site» метастазов либо местных рецидивов в области культи влагалища за данный период наблюдения не выявлено.
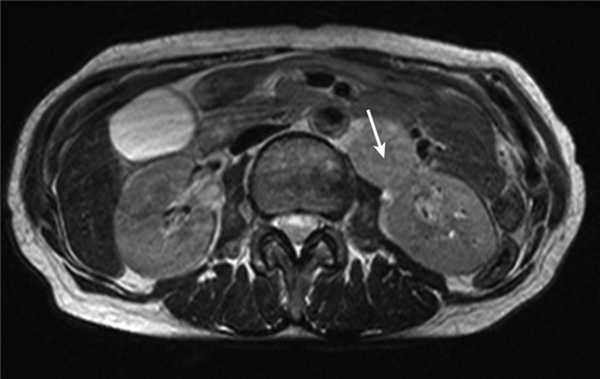
Медиана наблюдения пациенток группы сравнения составила 45,5 мес. За это время одна пациентка 64 лет была исключена из исследования в связи с летальным исходом в раннем послеоперационном периоде, возникшем на фоне ТЭЛА. В одном случае у больной 60 лет с диагнозом рак эндометрия IIA стадии (T2aNoMo) через 15 мес после окончания первичного лечения (операция с адъювантной сочетанной лучевой терапией) диагностирован рецидив заболевания: при контрольном обследовании в парааортальной зоне в области ворот левой почки выявлен конгломерат опухолевых узлов до 4 см (рис. 4). Рисунок 4. Рецидив опухоли в виде конгломерата лимфатических узлов в области ворот левой почки (стрелка) у больных группы сравнения.
Пациентке была выполнена повторная операция - парааортальная лимфаденэктомия. В качестве адъювантного противорецидивного лечения была проведена дистанционная лучевая терапия на эту зону с последующими курсами полихимиотерапии. В настоящее время пациентка жива, находится под наблюдением 6 мес без признаков прогрессирования заболевания.
Сравнительный анализ полученных результатов лечения пациенток двух выбранных групп свидетельствует о том, что лапароскопический доступ может быть представлен как альтернатива классической хирургии в радикальном лечении начального рака эндометрия. С учетом основных параметров операции, таких как продолжительность, кровопотеря, осложнения, очевидно, что видеоэндоскопические хирургические вмешательства не уступают лапаротомным, но при этом имеют свои преимущества. Среди особенностей послеоперационного периода следует отметить меньшее число осложнений, в том числе лимфокист. Легкое течение послеоперационного периода после лапароскопической операции объясняется меньшей травматичностью доступа. На основании данных планового гистологического исследования в обеих группах преобладала эндометриоидная аденокарцинома высокой и умеренной степени дифференцировки. Количество удаленных лимфатических узлов после лапароскопической и лапаротомной операции было в среднем 16,2±5,8 и 18,8±6,6 соответственно, что сопоставимо и достаточно для оценки состояния регионарных лимфатических узлов. Приблизительно в 2% случаев в каждой группе выявлены метастазы в последних. Преобладающей стадией заболевания (FIGO 2002) являлась IB (около 60% пациенток в обеих группах); ⅓ пациенток обеих групп получили дополнительное лечение (34,4% - после лапароскопический операции, 31,8% - после лапаротомной).
Таким образом, выбранные группы в целом сопоставимы по основным хирургическим позициям, результатам планового гистологического исследования и проведенному дополнительному лечению (лучевая терапия, повторная операция, химиотерапия) и могут быть использованы для оценки отдаленных онкологических результатов. Однако период наблюдения после видеоэндоскопической операции в настоящее время недостаточен (медиана составляет 15 мес), чтобы сделать окончательные выводы, которые представляются весьма перспективными. Тем не менее уже сейчас очевидно, что такие преимущества оперативной лапароскопии при раке эндометрия, как минимальная кровопотеря, низкая частота осложнений, быстрая реабилитация, являются актуальными для пациенток с точки зрения отсутствия задержек в проведении дополнительного лечения.
Выводы
1. Проведенное исследование выявило такие преимущества оперативной лапароскопии при раке эндометрия I стадии, как минимальная кровопотеря, низкое число осложнений, более быстрая реабилитация больных и поэтому обеспечение отсутствия задержек в проведении дополнительного лечения.
2. Группы пациенток, оперированных лапароскопическим и лапаротомным доступами, в целом сопоставимы по принципам хирургического лечения, результатам планового гистологического исследования и показаниям к проведению дополнительного лечения и могут быть использованы для оценки отдаленных результатов.
3. Однако период наблюдения после видеоэндоскопической операции в настоящее время недостаточен (медиана наблюдения - 15 мес), чтобы сделать окончательные выводы.
Лапароскопия в гинекологии: нюансы, о которых необходимо знать
Вам предстоит гинекологическая операция и вы хотите обойтись без рассечения брюшной полости и образования непривлекательных рубцов на коже? Значит, вам необходимо больше узнать о лапароскопии.
Лапароскопия - что это такое?
Лапароскопия - это один из методов оперативной гинекологии (и хирургии вообще), который позволяет обходиться без послойного разреза брюшной стенки. Для доступа к оперируемым органам врач делает небольшие проколы размером не более 5-7 миллиметров, которые после вмешательства достаточно быстро заживают. В процессе проведения операции в проблемную зону вводят специальный прибор - лапароскоп, который представляет собой гибкую трубку, оснащенную системой линз и видеокамерой.
Преимущества лапароскопии
Видеокамера выводит увеличенное в 40 раз изображение на монитор, что позволяет врачу-хирургу осмотреть репродуктивные органы, недоступные при обычном гинекологическом осмотре. При помощи четкого изображения на мониторе специалист получает возможность выявить нарушения и провести оперативное лечение.
До изобретения лапароскопа хирурги были вынуждены оперировать через большой и долго заживающий разрез, чтобы подробно рассмотреть проблемную зону. А сейчас благодаря гинекологической лапароскопии пациентка чаще всего получает возможность вернуться домой уже на следующий день после операции - в большинстве случаев необходимость в длительной госпитализации отсутствует.
Виды лапароскопии
Диагностическая лапароскопия применяется для уточнения диагноза и разработки тактики лечения. При помощи лапароскопа можно заметить нарушения, которые не всегда видны при проведении УЗИ. Также существует лечебная или лечебно-диагностическая лапароскопия, когда врач одновременно оценивает состояние внутренних репродуктивных органов и проводит оперативное лечение.
Что необходимо знать?
В случае возможности проведения плановой лапароскопии пациентка может заранее выбрать клинику и врача, которому она доверяет. При необходимости проведения экстренной операции ситуация другая: вмешательство выполняют как можно быстрее и чаще всего - в первой попавшейся клинике. Поэтому при наличии показаний к гинекологической операции лучше не тянуть время и не ожидать самоисцеления, а заранее позаботиться о выборе клиники и врача.
Помните: лапароскопия в гинекологии является достаточно серьезным вмешательством, которое требует высокой квалификации оперирующего хирурга и анестезиолога, а также современного оснащения операционной. Во многих государственных и малоизвестных частных клиниках работают специалисты, не обладающие достаточным опытом в проведении лапароскопических вмешательств. Также они не имеют возможности пользоваться качественными лапароскопами. Все это нередко приводит к тому, что операция, которая изначально планировалась как лапароскопическая, в процессе проведения становится общей полостной, когда врач не справляется с лапароскопом и вынужден делать большие разрезы на брюшной полости.
Если вы не хотите рисковать своим здоровьем и стремитесь, чтобы лапароскопическая операция прошла успешно и не потребовала длительной реабилитации, обращайтесь только в надежные клиники, которые существуют на рынке много лет и за это время успели завоевать доверие пациентов.
Показания к проведению лапароскопии в гинекологии
Чаще всего лапароскопию назначают для диагностики и лечения следующих заболеваний и состояний:
- аномалии развития репродуктивных органов;
- эндометриоз;
- миома матки;
- непроходимость маточных труб;
- опухолевые новообразования, в том числе кисты;
- заболевания яичников, в том числе поликистоз;
- экстренная гинекологическая патология (внематочная беременность, разрыв кисты);
- воспаление придатков;
- бесплодие неясного генеза.
Также лапароскопия требуется перед планированием ЭКО (экстракорпорального оплодотворения), при хронических тазовых болях, при необходимости проведения биопсии яичников и матки, а также с целью контроля результатов ранее проведенного лечения. Во всех возможных случаях проводятся органосохраняющие операции, после которых женщина сможет иметь детей.
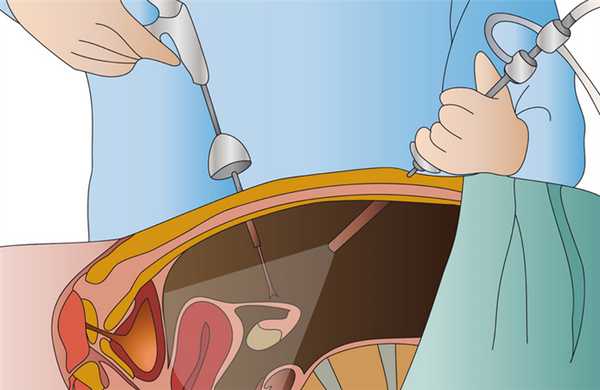
Подготовка и проведение лапароскопии в гинекологии
Перед лапароскопией необходимо сдать ряд лабораторных анализов и исследований, включая ЭКГ, УЗИ малого таза, анализы мочи и крови, мазок из влагалища.
За несколько дней до операции необходимо ограничить употребление продуктов, которые вызывают повышенное газообразование. Накануне вмешательства необходимо сделать очистительную клизму.
В процессе операции после применения и начала действия анестезии врач делает небольшие проколы в зоне пупка и над лобком, после чего вводит туда лапароскоп. Предварительно в брюшную полость вводят углекислый газ, который безвреден для организма и позволяет лучше рассмотреть внутренние органы. Далее специалист проводит диагностику и хирургическое лечение. После этого проколы на коже ушиваются косметическими швами.
Правильно проведенная гинекологическая лапароскопия сопровождается минимальной кровопотерей (не более 15 мл), оставляет практически невидимые места проколов после их заживления и не нарушает функции репродуктивных органов.
Операции при раке матки
Хирургия — основной метод лечения рака матки. Чаще всего начинают именно с операции, дополняя её курсом лучевой терапии и химиотерапии. Выбирая тип хирургического вмешательства, врач учитывает стадию опухоли, возраст и состояние здоровья женщины.

Все операции при раке матки и её придатков можно разделить на четыре группы:
- Радикальные. Цель такой операции — удалить всю опухоль целиком. Впоследствии проводится курс адъювантной химиотерапии, чтобы уничтожить оставшиеся в организме раковые клетки.
- Циторедуктивные. Проводятся в случае, когда опухоль невозможно удалить целиком, из-за больших размеров или сильного прорастания в соседние органы. Хирург старается иссечь как можно больший объем опухолевой ткани. На оставшуюся воздействуют при помощи химиотерапии или лучевой терапии. Как правило, к циторедуктивным операциям прибегают, когда рак матки распространился на всю тазовую полость и на брюшную полость.
- Диагностические. Такие хирургические вмешательства проводят для того, чтобы уточнить стадию рака, оценить, насколько сильно опухоль проросла в соседние органы, взять образцы тканей для биопсии.
- Паллиативные. Проводятся при некурабельных опухолях на поздних стадиях. Цель такой операции — уменьшить симптомы, облегчить состояние пациента, устранить сдавление опухолью внутренних органов.
Операционные «Евроонко» оснащены современным оборудованием. Наши хирурги проводят операции любой сложности при раке матки на любых стадиях.
Преимущества лапароскопических операций при раке матки
Первая лапароскопическая операция на матке была выполнена еще в 1989 году. С тех пор метод совершенствовался, показания к таким операциям расширялись. Врачи накопили большой опыт в проведении лапароскопических вмешательств. По сравнению с открытыми операциями лапароскопия имеет некоторые преимущества:
- меньше травматизация тканей;
- меньше кровопотеря;
- ниже риск некоторых осложнений;
- более короткий реабилитационный период, возможность быстрее восстановиться и вернуться к привычной жизни.
Диагностическая лапароскопия
В «Евроонко» есть возможность провести лапароскопическое ультразвуковое исследование с доплеровским картированием. Специальный ультразвуковой датчик вводят прямо в брюшную полость. Он напрямую контактирует с исследуемым органом, благодаря чему УЗ-сигнал не искажается, врач получает максимально четкое и информативное изображение, может оценить кровоток в опухолевой ткани.

Удаление опухоли
В зависимости от стадии опухоли, степени прорастания в соседние ткани и распространения в близлежащие лимфатические узлы, объем операции будет различаться. По возможности онкогинекологи стараются отдавать предпочтение лапароскопическим операциям. Но в ряде случаев приходится прибегать к открытым вмешательствам.
Гистерэктомия (экстирпация матки)
Гистерэктомия представляет собой хирургическое вмешательство, во время которого удаляют пораженную опухолью матку.
Зачастую приходится прибегать к расширенной гистерэктомии, во время которой удаляют матку вместе с шейкой и верхней частью влагалища, окружающую тазовую клетчатку и лимфатические узлы. Если в дальнейшем планируется курс лучевой терапии в области таза, выполняют транспозицию яичников: их перемещают вверх, для того чтобы они не попали в поле облучения.
Еще более серьезной операцией является эвисцерация таза, во время которой удаляют матку вместе с её придатками, шейку матки, влагалище, мочевой пузырь, прямую кишку, окружающие ткани и лимфатические узлы. К таким вмешательствам прибегают при рецидивах рака.
Удаление придатков матки
При инвазивном раке матки приходится удалять её придатки: маточные (фаллопиевы) трубы вместе с яичниками. Такая операция имеет серьезные последствия для женского организма, так как после неё наступает искусственная менопауза.
Если женщина еще не перенесла климакс, и рак матки был диагностирован на ранних стадиях, хирурги стараются сохранить яичники. В случаях, когда это возможно, врачи «Евроонко» стараются придерживаться органосохраняющей тактики.
Удаление лимфатических узлов
Во время операции по поводу рака матки могут быть удалены следующие группы лимфатических узлов:
- Тазовые. В данном случае они являются регионарными, так как непосредственно собирают лимфу от матки и других тазовых органов. Именно сюда в первую очередь попадают раковые клетки, распространяющиеся лимфогенным путем.
- Парааортальные. Находятся вокруг нижней части аорты. Сюда попадают раковые клетки, распространившиеся за пределы таза.
Операция по удалению лимфатических узлов называется лимфодиссекцией, или лимфаденоэктомией.
Лапароскопическая хирургия играет важную роль в лечении рака матки и женских половых органов. При правильном подходе лапароскопическая операция по радикальности не уступает «большой», открытой. В клиниках «Евроонко» проводится как радикальное, так и паллиативное лечение онкологических заболеваний на любых стадиях. Мы знаем, как помочь.
Дисплазия шейки матки
Шейка матки расположена в нижней части матки, открывается в верхнюю часть влагалища. Дисплазия - это патологические изменения клеток, расположенных на поверхности шейки.
Врачи не считают эту патологию раком, но относят к предраковым состояниям. Это означает, что без правильного лечения возможна трансформация изменившихся клеток в злокачественную опухоль. В редких случаях дисплазия исчезает без лечения. Заболевание диагностируют в любом возрасте.
Причины дисплазии шейки матки
Основной причиной считают инфицирование вирусом папилломы человека, ВПЧ. Вирус имеет множество подтипов - около 200, часть из них обладает канцерогенными свойствами. 16 и 18 подтипы вызывают 70% предраковых и раковых заболеваний шейки матки, другие штаммы - генитальные бородавки или кондиломы. Заражение ВПЧ происходит только половым путем. Риск инфицирования повышен в следующих случаях:
- начало половой жизни до 18 лет
- роды до 16 лет
- большое количество сексуальных партнеров
- заболевания, связанные со снижением иммунитета (ВИЧ, сахарный диабет)
- использование лекарств, подавляющих иммунитет
- отказ от презервативов. Этот способ предохранения не может полностью защитить от заражения вирусами, тем не менее, снижает риск инфицирования.
- курение.
Методы диагностики дисплазии шейки матки
Самым простым и информативным тестом считают Пап-мазок. Анализ имеет и другие названия: Пап-тест, мазок на цитологию, мазок на атипичные клетки, мазок Папаниколау. Врач-гинеколог берет мазок с поверхности шейки матки во время осмотра, это безболезненная процедура. Затем врач-лаборант исследует под микроскопом форму, размер, количество, расположение, состав клеток. Исследование нужно проводить ежегодно, начиная с 18 лет.
Т.к. некоторые штаммы ВПЧ считают канцерогенными, проводят исследование мазка из влагалища на обнаружение ДНК этих возбудителей. Исследование выполняют методом полимеразной цепной реакции (ПЦР), делают качественный анализ с типированием. Исследование на онкогенные вирусы обязательно у женщин старше 30 лет и в том случае, если есть невыраженные изменения в Пап-тесте. Определение уровня антител к вирусам в крови не информативно.
При обнаружении атипичных клеток в Пап-тесте проводят биопсию. Для этого во влагалище вводят оптическую систему - кольпоскоп. Она помогает врачу увидеть наиболее измененные участки и взять фрагмент ткани. По результатам исследования биоптата дисплазия - ее еще называют цервикальной интраэпителиальной неоплазией (CIN) - может быть сгруппирована по категориям.
Виды дисплазии шейки матки
Виды заболевания определяют при цитологическом исследовании. Пап-тест выявляет плоскоклеточное (сквамозное) интраэпителиальное поражение. Результаты теста могут быть описаны несколькими способами:
- изменения низкой степени
- изменения высокой степени
- возможно, злокачественные клетки
- наличие атипичных железистых клеток
- наличие атипичных клеток плоского эпителия.
Степени дисплазии
Во время исследования биоптата дисплазия может быть сгруппирована по категориям:
- 1 степень дисплазии (CIN I)
- 2 степень дисплазии (CIN II)
- 3 степень дисплазии (CIN III)
Некоторые специалисты выделяют 4 степень, которая представляет собой атипию.
Дисплазия шейки матки 1 степени (слабая)
Легкая дисплазия. Изменения только нижнего слоя эпителия затрагивают не более ⅓ его толщины.
Дисплазия шейки матки 2 степени (умеренная)
Изменения выражены умеренно. Поражения занимают до ⅔ всего эпителиального слоя.
Дисплазия шейки матки 3 степени (тяжелая)
Значительно выраженные изменения вплоть до появления начальных признаков карциномы. Поражен эпителий во всех слоях, но выхода за пределы базальной мембраны нет.
Симптомы дисплазии шейки матки
В подавляющем большинстве случаев никаких симптомов заболевания нет. Именно поэтому врачи настаивают на регулярном гинекологическом осмотре.
Лечение дисплазии шейки матки
Зависит от степени дисплазии, возраста женщины, репродуктивных планов. Без лечения возможна трансформация дисплазии в рак.
Лечение дисплазии шейки матки 1 степени
При этой патологии врач обычно занимает выжидательную позицию, так как возможно самоизлечение. Если есть хламидиоз, трихомониаз или гонорея, лечат от них. Через 3-6 месяцев мазок повторяют. В случае, если изменения не исчезли, или есть ухудшение по данным микроскопии, начинают терапию.
Лечение дисплазии шейки матки 2 и 3 степени
В этом случае заболевание обычно не проходит само. Лечение проводят различными хирургическими методами.
Хирургическое лечение дисплазии шейки матки
Возможны следующие способы:
- криохирургия (замораживание)
- лазеротерапия
- петлевая электроэксцизия шейки матки
- операция конизации, т.е.удаление измененных тканей с помощью скальпеля
- гистерэктомия, т.е. удаление матки с шейкой (проводится редко).
Дисплазия шейки матки и беременность
В настоящее время врачи делают все возможное, чтобы женщина с патологией шейки матки могла родить здорового ребенка. При выявлении дисплазии 2-3 степени пораженную ткань удаляют, и пациентка наблюдается у онкогинеколога. Беременность возможна не ранее, чем через 6 месяцев после операции.
В очень серьезных случаях, например, когда планируют гистерэктомию, рекомендуют консультацию по поводу суррогатного материнства.
Наблюдение и профилактика дисплазии шейки матки
В настоящее время проводят вакцинацию с целью защиты от инфицирования самыми опасными штаммами ВПЧ. Используют вакцины “Гардасил” (четырехвалентная, содержит белки ВПЧ типов 6,11,16,18), “Церварикс” (двухвалентная, типы 16, 18). Презерватив не считают надежной защитой от вируса папилломы человека, так как вирусы могут находиться на незащищенных латексом участках наружных половых органов. Поэтому прививка показана не только женщинам, которые могут заболеть, но и мужчинам-переносчикам вируса. Наибольший эффект у женщин и мужчин вакцинация дает в возрасте от 9 до 26 лет. По данным некоторых клинических исследований вакцина у женщин работает, если вводить ее до 45 лет. Инфицирование от прививки невозможно, потому что она содержит не живые вирусы, а только их белки. Также нет данных о серьезных побочных эффектах, т.е. мифы о бесплодии после введения вакцин против ВПЧ не подтверждены фактами. Нужно знать, что полностью защитить от дисплазии прививки не могут.
Профилактика дисплазии включает еще несколько простых рекомендаций:
- не курить
- начинать половую жизнь в возрасте 18 лет или старше
- практиковать безопасные сексуальные контакты с использованием презерватива
- поддерживать моногамные отношения.
Если Пап-тест выявил изменения, то его повторяют через 6-12 месяцев. При отрицательных результатах Пап-теста и теста на ВПЧ - через три года.
Лапароскопия при запущенном раке шейки матки - показания, возможности

Тюляндина Александра Сергеевна
Заведующая отделением лекарственных методов лечения злокачественных опухолей №4 НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, профессор кафедры онкологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), председатель Комитета молодых онкологов RUSSCOjr, член правления RUSSCO, член Комитета молодых онкологов ESMO, член Flims Alumni Club, доктор медицинских наук, Москва
Совсем недавно внедрение миниинвазивных хирургических вмешательств рассматривалось как перспективное направление в лечении гинекологических опухолей. Причины, приведшие к вышеизложенной тенденции, очевидны и связаны с попыткой улучшить качество хирургического лечения, переносимость оперативного вмешательства самой пациенткой, уменьшение длительности пребывания на койке, снижение кровопотери во время операции. Эти благие намерения привели к появлению многочисленных исследований II фазы, а также публикаций собственных наблюдений после лапароскопических и робот-ассистируемых операций в онкогинекологии.
Еще совсем недавно лапароскопические вмешательства внедрялись при распространенном раке яичников. Только после публикации работ, которые показали достоверное снижение продолжительности жизни больных, эксперты полностью отказались от хирургических вмешательств из минидоступа при данной патологии [1]. Полученные результаты связаны с несколькими причинами, это отсутствие возможности выполнить адекватную ревизию брюшной полости с целью удаления всех видимых очагов болезни, что приводит к снижению числа полных оптимальных циторедукций. Лапароскопическая операция при раке яичников имеет ценность только как диагностическая манипуляция для подтверждения диагноза и оценки распространенности процесса. За редким исключением обсуждается вопрос использования лапароскопических вмешательств у больных ранним раком яичников при органосохранных операциях. Лапароскопические операции «second look», популярные в 90-х годах XX столетия, сейчас вспоминаются как историческое наследие прошлого.
С потерей широкого распространения миниинвазивных современных методик при раке яичников активное развитие лапароскопической и робот-ассистированной хирургии продолжилось при лечении рака шейки матки и эндометрия. У больных раком шейки матки это казалось обоснованным при ранних стадиях заболевания. Проведенные ранее ретроспективные анализы по сравнению расширенных доступов и лапароскопий демонстрировали равнозначную эффективность обоих методов [2]. На основании полученных данных было инициировано рандомизированное проспективное исследование LAAC, под эгидой которого прошли все гинекологические сессии и конгрессы 2018 года [3]. Работа посвящена сравнению открытой хирургии и операций из миниинвазивных доступов с использованием лапароскопических (84,4%) или робот-ассистируемых (15,6%) вмешательств. Дизайн исследования был спланирован как non-inferiority с целью доказать, что миниинвазивная техника не уступает в эффективности обычному хирургическому вмешательству. В работу включена 631 пациентка с IА1, IА2, IB1 стадиями рака шейки матки. Участие приняли 33 центра, находящиеся в большинстве случаев на территории США, а также в нескольких странах Латинской Америки. Перед включением в исследование все центры проходили аккредитацию, которая включала оценку качества выполнения операций в объеме Piver II и III лапаротомным и миниинвазивным доступами.
Набор в исследование завершился досрочно после промежуточного анализа. В марте 2018 года были доложены неожиданные результаты исследования, которые привели к многочисленным обсуждениям данной работы на всех последующих конференциях. Конечной точкой являлось 4,5-летняя безрецидивная выживаемость (БРВ), в группе открытой хирургии данный показатель составил 96,5% и в группе мининвазивной хирургии - 86%. При проведении superiority анализа было получено достоверное увеличение 3-летней БРВ в группе лапаротомии по сравнению с группой миниинвазивных вмешательств: 97,1% и 91,2% соответственно (HR=3,74; р=0,002). Та же тенденция наблюдалась и при оценке выживаемости больных: 99,0% против 93,8% (HR 6,00; 95% CI 1,77-20,30). Частота локорегиональных рецидивов была достоверно выше в группе лапароскопических вмешательств. При этом авторы не нашли взаимосвязи с определенными центрами участниками, все возникшие рецидивы распределились между 14 центрами. Даже при опухолях менее 2 см не было получено преимуществ от использования миниинвазивных операций.
Любопытные факты по оценке качества жизни были доложены на конференции IGCS 2018 в Киото. Оказалось, что качество жизни при использовании лапароскопических и робот-ассистируемых вмешательств было достоверно выше только в первые 6 дней после операции, а в течении последующих 6 месяцев наблюдения качество жизни было сопоставимо в обеих исследуемых группах. Очевидно, что расширенные операции в объеме Piver III при любой методике, если выполнены качественно, будут иметь одинаковую частоту осложнений. Это было озвучено в исследовании LAAC: частота хирургических осложнений отмечалась в одинаковом проценте случаев при лапароскопическом (10,5%) и лапартомном (11,4%) доступах.
Главные координаторы исследования P. Ramirez, M. Frumovitz и A. Obermair, являющиеся ведущими специалистами в хирургическом лечении рака шейки матки и сделавшие ставку на миниинвазивную хирургию, не ожидали полученных результатов. Детально проанализировав выводы ретроспективных работ, они нашли множество погрешностей в выполнении этих анализов, начиная от небольшой прослеженности отдаленных результатов, что могло привести к отсутствию статистических различий между группами открытой и лапароскопической хирургии. Другим объяснением может быть то, что при выполнении лапароскопической хирургии использование маточного манипулятора может увеличить вероятность «разбрызгивания» опухолевых клеток в малом тазу. Второй причиной может быть инсуффляция CO2 - этот газ может потенцировать деление опухолевых клеток, что было показано в нескольких исследованиях [4].
Данные LAAC опубликованы в NEJM в октябре 2018 года и привели к отказу от лапароскопических операций большинством экспертов. Уже в последней версии рекомендаций NCCN 2019 года прописано, что лапароскопические вмешательства при ранних стадиях рака шейки матки не исключаются, однако должны обсуждаться с пациентками возможные риски и польза от такого подхода. Вероятнее всего в ближайшее время в большинстве рекомендаций эксперты откажутся от рутинных лапароскопических вмешательств при раке шейки матки.
Сразу же за результатами исследования LAAC на ASCO 2018 были опубликованы результаты оценки 5-летней выживаемости больных раком шейки матки c IB1 стадией по данным национального регистра США [5]. В анализ включено 2830 женщин, 982 пациентки в группе открытых операций и 910 - в группе лапароскопий. 5-летняя ОВ была достоверно выше в группе лапаротомий.
Сегодня начинает казаться, что лапароскопическая и робот-ассистируемая хирургия сохраняет свои позиции только при раке эндометрия. Однако в октябре 2018 года Cochrane публикует результаты большого анализа по сравнению лапароскопий и лапаротомий при раннем раке эндометрия [6]. Анализ 9 включенных исследований и 4389 пациенток показал, что оба метода имеют одинаковую безрецидивную и общую выживаемость. Не было получено статистически значимых различий по частоте хирургических осложнений. Авторы делают выводы о низкой достоверности в пользу преимущества лапароскопических операций. Безусловно, это ретроспективный анализ, но в будущем он приведет к инициации проспективных исследований, посвященных этой проблеме.
В заключение хочется отметить, что все развивается по синусоиде. Мы наблюдали активный тренд по внедрению лапароскопических операций в онкогинекологии за последнее десятилетие. Теперь, наоборот, отмечено явное снижение интереса и моды к этому виду хирургии. Безусловно, нельзя полностью исключать миниинвазивные вмешательства из списка возможных хирургических опций. Этот подход показан определенной группе больных с большим индексом массы тела, декомпенсированной сопутствующей патологией и не должен становиться рутинным стандартом в онкологических клиниках, как это распространено во многих стационарах России.
Таким образом, 2018 год прошел под эгидой большого разочарования в миниинвазивной хирургии в онкогинекологии.
Читайте также:
- Санитарно-микробиологические исследования пищевых продуктов. Исследование продуктов.
- Хирургические методы лечения нестабильной стенокардии. Реабилитация больных нестабильной стенокардией
- Техника, этапы операции при переломе лопатки
- Лечение аритмий. Классификация антиаритмических средств, разработанная Воганом Уильямсом
- УЗИ при эхогенном объемном образовании печени
