Механизм сокращения гладкой мышцы. Химические основы сокращений гладкой мышцы
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
-освобождение Са2+ из саркоплазматического ретикулума:
А) электромех.сопряжение (Переход электрической энергии потенциала действия мембраны мышечного волокна в мех.энергию сокращения.)
Б) кавеолы +СПР, Са2+ канал L-типа + Рианодиновый рецептор
В)Фаромакомеханическое сопряжение (При фармакомеханическом сопряжении химические факторы (например, освобождение нейромедиаторов) могут индуцировать сокращение гладкой мышцы без потребности в изменении мембранного потенциала. При взаимодействие вазоконстрикторов (таких как норадреналин) со специфическим рецептором мембраны (таким как а-адренорецептор) запускает процесс, который при водит к увеличению уровня свободного внутриклеточного Са 24 по двум причинам. Одна заключается в том, что активированный рецептор может открыть хемоуправляемые кальциевые каналы(ХУК) поверхностной мембраны, что приводит к поступлению j Са 2+ из внеклеточной жидкости. Другая — в том, что активированный рецептор может стимулировать образование внутриклеточного вторичного медиатора, инозинтрифосфата (ИТФ), который открывает специфические каналы, через которые происходит освобождение О 2 * из депо внутриклеточного саркоплазматнческого ретикулума. В обоих случаях активированный рецептор сперва стимулирует специфические гуанозинтрифосфат-связывающие белки (ГТФ-связывающие белки или протеины G)
Серотонин, норадреналин повышают образование инозитолтрифосфата (ИТФ) в клетке - от открывает леганд зависимые Са2+ каналы на мембране СПР
Механизм сокращения гладкой мускулатуры
Сокращение гладкомышечных клеток, как и клеток других типов мускулатуры, реализуется за счет скольжения актиновых филаментов вдоль филаментов миозина, которое сопровождается расщеплением АТФ. Гладкая мышца сокращается медленнее скелетной, развивает большую силу и может находиться в сокращенном состоянии достаточно длительное время при минимальном потреблении АТФ. Такие особенности сокращения миоцитов обусловлены тем, что головки молекул миозина медленнее прикрепляются к актину, дольше остаются прикрепленными и медленнее отсоединяются. При этом у головок миозина в гладкой мускулатуре АТФ- азная активность ниже, чем у головок миозина в скелетной мускулатуре (рис. 2.8).
Рис. 2.8. Длительность одиночных сокращений волокон скелетной, сердечной и гладкой мускулатуры
Процесс сокращения миоцитов, как и волокон скелетной мускулатуры, запускается поступлением в цитоплазму ионов Са 2+ . Кальций поступает как из межклеточной жидкости, так и из внутриклеточных цистерн саркоплазматического ретикулума. Из межклеточной жидкости кальций поступает по потенциалзависимым и рецептор-управляемым Са 2+ -каналам. Из цистерн саркоплазматического ретикулума ионы кальция выбрасываются в цитоплазму под влиянием инозитол-3-фосфата, который образуется под воздействием фосфолипазы С из фосфолипидов мембраны. Фосфолипаза С, в свою очередь, активируется мембранным G-белком, связанным с метаботропными рецепторами. Эти же рецепторы управляют мембранными Са 2+ -каналами. Кроме того, на мембранах Са 2+ -цистерн имеются рианодиновые рецепторы, активируемые ионами кальция и улавливающие выброс кальция в цитоплазму (рис. 2.9, а).
Ионы Са 2+ в цитоплазме миоцитов взаимодействуют с белком кальмо- дулином, который активирует киназу легких цепей миозина. Эта киназа, в свою очередь, фосфорилирует легкие цепи миозиновых головок, увеличивая их АТФ-азную активность. Возросшая АТФ-азная активность миозиновых головок приводит к образованию поперечных мостиков и началу скольжения миозиновых филаментов вдоль актиновых. Механизм скольжения аналогичен таковому в волокнах скелетной мускулатуры.
Рис. 2.9. Схема поступления ионов кальция в саркоплазму гладкомышечной клетки при сокращении (а)
Молекулярные основы мышечного сокращения.
В настоящее время общепризнанной теорией мышечного сокращения является теория скользящих нитей, созданная в 1950—1960-х гг. Согласно данной теории процесс сокращения заключается во взаимодействии актино- вых и миозиновых фибрилл под действием нервных импульсов: акти- новые и миозиновые протофибриллы скользят навстречу друг другу. Но поскольку актиновые протофибриллы жестко закреплены в Z-дисках, а миозиновые — свободны, то происходит сжатие саркомера, миофи- бриллы, мышечного волокна и соответственно всей мышцы.
Сигналом для начала процесса мышечного сокращения является нервный импульс, приходящий из спинного мозга по аксонам моторных нейронов. На каждом мышечном волокне есть одно нервное окончание:
- 1) под действием нервного импульса происходит возбуждение мембраны мышечного волокна (сарколеммы), и это возбуждение распространяется по мембране волокна (в том числе и по Т-каналам), достигая глубинных районов волокна;
- 2) с мембраны Т-каналов, сигнал передается на внутриклеточные цистерны гладкого эндоплазматического ретикулума (L-каналы), в которых находятся запасы ионов Са +2 . Ионы кальция выходят в цитоплазму волокна и взаимодействуют с саркомерами;
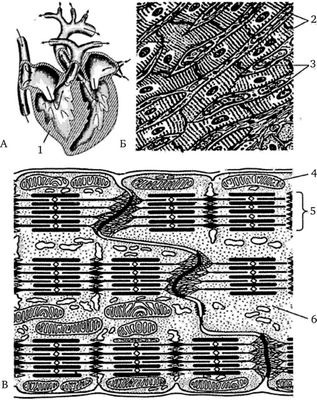
Рис. 10.3. Сердечная поперечно-полосатая мышечная ткань:
А — разрез сердца; Б — пучки кардиомиоцитов (световой микроскоп);
В — фрагмент ультраструктуры кардиомиоцита (электронный микроскоп):
- 1 — миокард; 2 — клетки миокарда (кардиомиоциты); 3 — вставочные диски (граница между кардиомиоцитами); 4 — митохондрии; 5 — миофибриллы;
- 6 — цитоплазма кардиомиоцита
- 3) к моменту сокращения актиновые молекулы не могут взаимодействовать с миозиновыми, так как они закрыты молекулами вспомогательных белков — тропонина и тропомиозина. Задача ионов кальция — взаимодействовать с молекулой одного из вспомогательных белков саркомера — тропонина. В результате активации тропонина происходит сдвиг молекулы тропомиозина и актин может взаимодействовать с миозином;
- 4) головки миозиновых молекул взаимодействуют с глобулами актина. При этом они поворачиваются на определенный угол (как шарнир) и начинается взаимное, шаг за шагом, скольжение нитей, которое продолжается до максимального сжатия саркомера;
5) как только прекращается нервный импульс, ионы кальция закачиваются обратно в L-каналы и процесс взаимодействия миозина с актином прерывается, поскольку тропомиозин опять закрывает актин.
Процесс сокращения закончился, начинается процесс расслабления мышцы.
Процесс расслабления мышцы идет пассивно (без затраты энергии) за счет упругих свойств молекул вспомогательных белков саркомера — титина и небулина. Титин в момент сокращения сжимается как пружина, а затем распрямляется, возвращая саркомеру его первоначальную длину.
Такой тип регуляции процесса сокращения поперечно-полосатых мышц получил наименование актинового, поскольку ионы кальция связываются с актиновой протофибриллой.
Такая регуляция характерна для всех поперечно-полосатых соматических и сердечных мышц позвоночных.
Механизм сокращения гладких мышц. Роль вторичных посредников. Фармако- и электромеханическое сопряжение.
В)Фаромакомеханическое сопряжение (При фармакомеханическом сопряжении химические факторы (например, освобождение нейромедиаторов) могут индуцировать сокращение гладкой мышцы без потребности в изменении мембранного потенциала. При взаимодействие вазоконстрикторов (таких как норадреналин) со специфическим рецептором мембраны (таким как а-адренорецептор) запускает процесс, который при водит к увеличению уровня свободного внутриклеточного Са 24 по двум причинам. Одна заключается в том, что активированный рецептор может открыть хемоуправляемые кальциевые каналы(ХУК) поверхностной мембраны, что приводит к поступлению j Са 2+ из внеклеточной жидкости. Другая — в том, что активированный рецептор может стимулировать образование внутриклеточного вторичного медиатора, инозинтрифосфата (ИТФ), который открывает специфические каналы, через которые происходит освобождение О 2 * из депо внутриклеточного саркоплазматнческогоретикулума. В обоих случаях активированный рецептор сперва стимулирует специфические гуанозинтрифосфат-связывающие белки (ГТФ-связывающие белки или протеины G)
-Вхад Са2+ через леганд зависимые каналы
Роль вторичных посредников.
Играют роль в процессах расслабления и сокращения гладких мышц:
Познавательно:
Отношения СССР со странами «третьего мира» Локальные войны. СССР противостоял экспансионистской политике США.
НЭП: ПРИЧИНЫ, СУЩНОСТЬ И ПРОТИВОРЕЧИЯ 1. Причины перехода к НЭПу После завершения основных боёв Гражданской войны в 1920 году перед большевиками встаёт задача перехода к.
Задатки и способности. Виды способностей «Способности - свойства и качества (индивидуальные особенности) человека.
Понятие и структура гражданского правоотношения Гражданское правоотношение - урегулированное нормами гражданского права общественное отношение.
Алгоритм катетеризации мочевого пузыря у женщин (с помощью пинцета) Показания: острая задержка мочи, промывание мочевого пузыря и введение в него лекарственных препаратов, для.
3.2.2. Механизм сокращения и пластичность гладкой мышцы
Процесс сокращения гладкомышечных волокон совершается по тому же механизму скольжения нитей актина и миозина относительно друг друга, что и в скелетных мышцах.
Однако у гладкомышечных клеток нет той стройной аранжировки сократительных белков, как у скелетных мышц. У этих клеток миофибриллы с саркомерами расположены нерегулярно, поэтому клетка не имеет поперечной исчерченности. Электромеханическое сопряжение в этих клетках идет иначе, чем в скелетных мышцах, так как в них слабо выражен саркоплазматический ретикулум. В связи с этим триггером для мышечного сокращения служит поступление ионов Са 2+ в клетку из межклеточной среды в процессе генерации ПД. Того количества кальция, которое входит в клетку при возбуждении, вполне достаточно для полноценного фазного сокращения.
Инициация сокращений гладких мышц с помощью ионов Са 2+ также имеет несколько другой механизм, чем в поперечнополосатых волокнах. Ионы Са 2+ воздействуют на белок кальмодулин, который активирует киназы легких цепей миозина. Это обеспечивает перенос фосфатной группы на миозин и сразу вызывает срабатывание, т.е. сокращение, поперечных мостиков. О существовании тропонин-тропомиозиновой системы сведений не имеется. При снижении в миоплазме концентрации ионов Са 2+ фосфатаза дефосфорилирует миозин, и он перестает связываться с актином. Скорость сокращения гладких мышц невелика — на 1—2 порядка ниже, чем у скелетных мышц. Сила сокращений некоторых гладких мышц позвоночных не уступает силе сокращений скелетных мышц.
Подобно сердечной и скелетной мускулатуре, гладкие мышцы всегда расслабляются при падении внутриклеточной концентрации Са 2+ ниже 10 -7 М. Однако их расслабление происходит гораздо медленнее, поскольку скорость поглощения ионов Са 2+ саркоплазматическим ретикулумом или удаления их через клеточную мембрану здесь ниже. Удаление Са 2+ приводит к расщеплению фосфатазой функционально важной фосфатной группы миозина. Его дефосфорилированные головки теряют способность образовывать поперечные мостики с актином. Пока неясно, каким образом образующиеся в гладкомышечных клетках цАМФ и цГМФ вызывают понижение их тонуса. Возможно, цАМФ ингибирует активность киназы легких цепей миозина или усиливает поглощение Са 2+ саркоплазматическим ретикулумом. С другой стороны, вполне вероятна роль цГМФ как внутриклеточного посредника в расслаблении гладких мышц сосудов, которое индуцируется расслабляющим фактором эндотелия.
Регуляция сокращений гладких мышц. Среди гладкомышечных клеток можно выделить несколько групппо механизму возбуждения.
− Гладкие мышцы с миогенной (спонтанной) активностью.Во многих гладких мышцах кишечника (например, толстой кишки) одиночное сокращение, вызванное потенциалом действия, продолжается несколько секунд. Следовательно, сокращения с интервалом менее 2 с накладываются друг на друга, а при частоте выше 1 Гц сливаются в более или менее гладкий тетанус (тетанообразный “тонус”), который отличается от тетануса скелетных мышц только низкой частотой сливающихся одиночных сокращений и необходимых для этого потенциалов действия. Природа такого “тонуса” -миогенная; в отличие от скелетной мускулатуры, гладкие мышцы кишечника, мочеточника, желудка и матки способны к спонтанным тетанообразным сокращениям после изоляции и денервации и даже при блокаде нейронов интрамуральных ганглиев. Следовательно, их потенциалы действия не обусловлены передачей к мышце нервных импульсов, т. е. у них не нейрогенное, а миогенное происхождение (как в сердце).
Миогенное возбуждение возникает в клетках - ритмоводителях (пейсмекерах), идентичных другим мышечным клеткам по структуре, но отличающихся электрофизиологическими свойствами. Препотенциалы, или пейсмекерные потенциалы, деполяризуют их мембрану до порогового уровня, вызывая потенциал действия. Из-за поступления в клетку катионов (главным образом Са 2+ ) мембрана деполяризуется до нулевого уровня и даже на несколько миллисекунд меняет полярность до + 20 мВ. За реполяризацией следует новый препотенциал, обеспечивающий генерирование следующего потенциала действия. Интервал между потенциалами действия пейсмекера зависит как от скорости деполяризации, вызываемой препотенциалами, так и от разницы между исходным мембранным и пороговым потенциалами.При нанесении напрепарат мышцы толстой кишки ацетилхолина пейсмекерные клетки деполяризуются до околопорогового уровня, и частота потенциалов действия возрастает. Вызываемые ими сокращения сливаются до почти гладкого тетануса. Чем выше частота потенциалов действия, тем слитнее тетанус и тем сильнее сокращение, возникающее в результате суммации одиночных сокращений. И напротив, нанесение на тот же препаратнорадреналинагиперполяризует мембрану и в результате снижает частоту потенциалов действия и величину тонуса. Таковы механизмы модуляции спонтанной активности пейсмекеров вегетативной нервной системой и ее медиаторами.
Возбуждение распространяетсяпо гладкой мыщце через особые «щелевые контакты» (нексусы)между плазматическими мембранами сопредельных мышечных клеток. Эти области с низким электрическим сопротивлением обеспечивают электротоническую передачу деполяризации от возбужденных клеток к соседним. Как только местный ток, протекающий через нексус, деполяризует мембрану до порогового уровня, возникает потенциал действия, который в свою очередь вызывает возбуждение в других электротонически сопряженных клетках. Таким образом, активность распространяется по всей мышце со скоростью около 5-10 см/с, и мышца ведет себя как единая функциональная единица, почти синхронно воспроизводя активность своего пейсмекера.
Таким образом, среди гладкомышечных клеток есть фоновоактивные — водители ритма (пейсмекеры). Непосредственной причиной их ПД является спонтанная медленная деполяризация мембраны (препотенциал). Эти периодические ПД пейсмекерных клеток, распространяясь по прочей массе мышечных клеток (со скоростью 5—10 см/с), создают миогенный тонус гладких мышц.
− Другие гладкомышечные клетки,будучи растяжимыми и пластичными, как и все гладкомышечные ткани,при определенной степени растяжения способны возбуждаться (деполяризоваться) и отвечать на это растяжение сокращением. После обусловленного эластическими свойствами начального подъема напряжения гладкая мышца развивает пластическую податливость, и ее напряжение падает постепенно — вначале быстро, потом медленнее.
Таким образом, пластичность объясняет характерное свойство гладкой мышцы: она способна быть расслабленной в укороченном и в растянутом состояниях. Благодаря пластичности гладкой мускулатуры стенок мочевого пузыря давление внутри него относительно мало изменяется при значительной градации наполнения, и лишь при более значительном депонировании мочи давление, а следовательно, и растяжение стенок резко возрастает и происходит сокращение мышц детрузора — эвакуация мочи даже в тех случаях, когда его нервная регуляция нарушена в результате повреждения спинного мозга.. Этот феномен лежит в основе периферической саморегуляции тонуса гладких мышц некоторых кровеносных сосудов, лимфангионов, мочевого пузыря и других органов.
− Третий вид гладкомышечных клеток(цилиарное тело, радужка глаза, артерии и семенные протоки)имеет более мощную (плотную) иннервацию и слабое развитие межклеточных контактов. Спонтанная активность этих мышц обычно слабая или её вообще нет. Тонус этих мышц и его колебания имеют в основном нейрогенную природу. Гладкие мышцы иннервируются вегетативными нервами, многие имеют парасимпатические и симпатические входы. Нервные влияния регулируют активность висцеральных гладкомышечных образований.
Функции висцеральных гладких мышц управляются также нейронами интрамуральных нервных сплетений, не только перерабатывающих центробежную импульсацию, но и формирующих собственные автономные команды. При наличии чувствительных, вставочных и моторных нейронов в интрамуральных узлах осуществляется рефлекторная деятельность. Так, мускулатура кишечного тракта функционирует под влиянием импульсов из ауэрбахова и мейснерова сплетений, заложенных в кишечной стенке. Эта особенность делает возможной автоматизированную, четко организованную моторную функцию кишечника.
Эффектором вегетативных входов чаще является пучок неисчерченных мышечных клеток, а не отдельная мышечная клетка. Плотность иннервации различна в разных гладких мышцах и даже в соседних участках одной и той же мышцы.
Читайте также:
