Даназол. Избыток андрогенов у женщин и гирсутизм
Добавил пользователь Владимир З. Обновлено: 01.02.2026
У взрослых есть два типа волос: пушковые и терминальные. Третий тип волос — лануго — имеет место только у плода и новорожденного. Пушковые волосы являются непигментированными, мягкими и покрывают все тело. Терминальный волос является пигментированным, толстым и покрывает скальп, подмышечные зоны и лобковую зону.
Волосы имеет 3 стадии роста:
- анаген (фаза роста);
- катаген (фаза инволюции, волосы перестают расти и выходят из волосяных фолликулов;
- телоген (фаза отдыха, предшествует потере волос).
Андрогены отвечают за конверсию пушковых волос в терминальные в пубертатном периоде, следствием чего является появление лобкового и аксилярного оволосения. Аномальное увеличение терминальных волос может происходить вследствие гиперпродукции андрогенов или роста активности фермента 5а-редуктазы, которая конвертирует тестостерон в более активный андроген дигидротестостерон (ДГТ), который является основным стимулятором развития терминальных волос.
Гирсутизм
Гирсутизм — это рост терминальных волос в андрогенчувствительных зонах женщины — на лице, груди, спине, нижней части живота и внутренней поверхности бедер. Часто рост лобковых волос происходит по мужскому типу и имеет ромбовидную форму, в отличие от треугольной формы чисто женского лобкового оволосения.
Основными причинами гирсутизма являются:
- рост действия экзогенных андрогенов;
- увеличение яичниковой или надпочечниковой продукции андрогенов;
- повышение чувствительности органов-мишеней к действию андрогенов вследствие повышения активности 5а-редуктазы.
Модуляторами действия андрогенов в организме могут быть ферменты и белки:
1) глобулин, связывающий половые гормоны (ГСПГ). Этот модулятор связывает циркулирующие андрогены, уменьшает уровень циркулирующих, свободных андрогенов; только свободные андрогены достигают клеток-мишеней;
2) 5а-редуктаза — энзим, конвертирует андрогены в дигидротестостерон.
Вирилизация — развитие мужских черт: снижение тембра голоса, фронтальное облысение, рост мышечной массы, клиторомегалия, атрофия молочных желез и приобретения мужских контуров тела.
Исследование причин гирсутизма и вирилизма у женщин является сложным процессом и требует понимания процессов пубертатного развития, функции надпочечников, яичников, особого внимания к изменению синтеза глюкокортикоидов, минералокортикоидов, андрогенов и эстрогенов.
Дифференциальная диагностика причин гирсутизма
- Синдром поликистозных яичников
- Гиперплазия надпочечников с началом во взрослом возрасте
- Андрогенпродуцирующие опухоли яичников и надпочечников
- Гиперпролактинемия
- Влияние экзогенных андрогенов
- Идиопатические
Нормальный синтез андрогенов
Надпочечники состоят из двух компонентов: коры, которая отвечает за синтез глюкокортикоидов, минералокортикоидов и андрогенов, и мозгового вещества, участвующего в синтезе катехоламинов. Кора надпочечников имеет три слоя. Внешний слой, гранулезно продуцирует альдостерон и регулируется ренин-ангиотензиновую систему. Эта зона не имеет фермента 17а-гидроксилазы и, следовательно, кортизол и андрогены в ней не синтезируются. Между внутренними слоями, продуцирующими кортизол и андрогены, не образуются альдостерон вследствие отсутствия фермента альдостерон-синтазы. Эти два внутренних слоя коры надпочечников регулируются адренокортикотропным гормоном (АКТГ).
Указанный гормон регулирует конверсию холестерола в прегненолон путем гидроксилирования и расщепления косвенного цепи. Прегненолон конвертируется в прогестерон и, наконец, — в альдостерон или кортизол или шунтируется для продукции половых стероидов.
В надпочечниках андрогены синтезируются с их предшественником — 17а-гидроксипрегненолоном, который конвертируется в дегидроэпиандростерон (ДГЭА) и его сульфат (ДГЭАС), андростендион и, наконец — в тестостерон. ДГЭА и ДГЭАС является крупнейшей группой надпочечников андрогенов; другие андрогены в них синтезируются в незначительном количестве.
В яичниках клетки внутренней тека-оболочки фолликулов (тека-клетки) стимулируются лютеинизирующим гормоном к продукции андростендиона и тестостерона. Андростендион и тестостерон в дальнейшем ароматизируются в гранулезных клетках в эстрон и эстрадиол, соответственно, в ответ на действие ФСГ. Итак, повышение соотношения ЛГ / ФСГ может привести к увеличению синтеза андрогенов.
Патологическая продукция андрогенов
Повышение продукции андрогенов может быть следствием как надпочечниковых, так и яичниковых расстройств. Учитывая, что синтез стероидных гормонов корой надпочечников стимулируется АКТГ недифференцированным путем, повышение уровня АКТГ приводит к росту продукции стероидных гормонов, в том числе андрогенов. При наличии энзимного дефекта, ближайший к дефекту предшественник аккумулируется и шунтирует на другой путь развития. Так, энзимный блок синтезируя как кортизол, так и альдостерон, приводит к росту продукции андрогенов.
В яичниках роста ЛГ или соотношение ЛГ / ФСГ также приводит к чрезмерной продукции андрогенов. Независимо от причины, повышение продукции андрогенов приводит к гирсутизму и может способствовать развитию вирилизма.
Заболевания надпочечников
Заболевания надпочечников, которые могут повлечь вирилизации у женщин, разделяют на 2 группы: ненеопластические и неопластические заболевания. Андрогенпродуцирующие опухоли надпочечников могут быть представлены аденомами или карциномами (раком). Аденомы надпочечников обычно вызывают чрезмерную продукцию глюкокортикоидов, вирилизирующие последствия редки. Карциномы могут более быстро прогрессировать и вызывать значительное повышение уровня глюкокортикоидов, минералокортикоидов и андрогенных стероидов.
Синдром Кушинга
Синдром Кушинга характеризуется избыточной продукцией кортизола. Учитывая, что промежуточными продуктами синтеза кортизола являются андрогены, синдром Кушинга может сопровождаться сопутствующим гиперандрогенным состоянием. Причинами развития синдрома Кушинга могут быть аденомы гипофиза, эктопическая продукция АКТГ, опухоли надпочечников.
При синдроме Кушинга, вызванном развитием аденомы гипофиза, имеет место гиперсекреция АКТГ. Паранеопластический синдром, например негипофизарные АКТГ-продуцирующие опухоли, также приводит к росту уровня АКТГ. Опухоли надпочечников обычно сопровождаются снижением уровня АКТГ вследствие отрицательной обратной связи с повышением уровня надпочечников стероидных гормонов. Все три причины приводят к чрезмерной продукции глюкокортикоидов — глюкокортикоидного эксцесса, что и вызывает развитие синдрома Кушинга, а также гирсутизм, акне, нерегулярные менструальные кровотечения вследствие гиперпродукции андрогенов надпочечниками.
При подозрении на синдром Кушинга диагноз подтверждают с помощью ночного дексаметазонового супрессорного теста. Если имеет место нормальная отрицательная обратная связь от экзогенного стероидного гормона, надпочечники должны уменьшить гормональную продукцию в ответ на дексаметазон. Уровень кортизола в плазме крови измеряют следующее утро. Если уровень кортизола 10 мг / дл считается диагностическим, тогда как значение в пределах 5-10 мг / дл — неопределенными. Для подтверждения диагноза оценивают уровень свободного кортизола в 24-часовой количества мочи.
Врожденная гиперплазия коры надпочечников
Врожденная гиперплазия коры надпочечников — это комплекс дефицитов энзимов, включенных в стероидогенез. Наиболее частым нарушением является дефицит 21а-гидроксилазы. Энзимный блок на этом уровне приводит к накоплению 17а-гидроксипрогестерона (17-ОГП), который шунтирует в круг синтеза андрогенов.
Пациентки с врожденной гиперплазией коры надпочечников не синтезируют кортизол или минералокортикоиды, что проявляется адреналовой недостаточностью и потерей натрия при рождении. Новорожденные женского пола имеют неопределенные гениталии вследствие избытка продукции андрогенов. При более мягкой форме гиперплазии коры надпочечников с началом во взрослом возрасте степень дефицита может варьировать и часто имеют место лишь признаки мягкой вирилизации или нерегулярность ритма менструаций.
Другие типы врожденной гиперплазии коры надпочечников, которые ассоциируются с вирилизацией, включают дефицит 11р-гидроксилазы и 3р-гидроксистероид-дегидрогеназы (3р- ГСД). Пациентки с дефицитом 11р-гидроксилазы имеют сходные симптомы избыточной продукции андрогенов — предшественники аккумулируются и шунтируются на синтез андростендиона и тестостерона.
Пациентки с дефицитом 3Р-ГСД аккумулируют ДГЭА вследствие невозможного преобразования прегненолона в прогестерон, или ДГЭА уменьшает синтез андрогенов. ДГЭА и ДГЭАС имеют мягкое андрогенное действие. В случае присутствия этого дефекта у гонадного стероидогенеза у мужчин имеет место феминизация, а у женщин — гирсутизм и вирилизация. Все пациентки имеют нарушенный синтез кортизола и различные степени избытка или дефицита минералокортикоидов, в зависимости от локализации энзимного блока.
При подозрении на врожденную гиперплазию коры надпочечников, определяют уровень 17-ОГП, так как дефицит 21а-гидроксилазы является наиболее частым. Если 17-ОГП повышен (> 200 нг / дл), диагноз подтверждают тестом со стимуляцией АКТГ. Препарат АКТГ (кортрозин) вводят в / в и через 1 ч измеряют уровень 17-ОГП. Значительный рост уровня 17-ОГП свидетельствует о врожденной гиперплазии коры надпочечников, несколько ниже значения могут свидетельствовать о врожденной гиперплазией коры надпочечников с более поздним началом во взрослом возрасте или гетерозиготности по дефициту 21а-гидроксилазы.
Функциональные расстройства яичников
Заболевания яичников, которые могут повлечь вирилизацию, разделяют на ненеопластические и неопластические. Ненеопластические поражения включают поликистозные яичники, тека-лютеиновые кисты, стромальную гиперплазию и стромальный гипертекоз. Неопластические заболевания варьируют и часто приводят к быстрому началу вирилизации.
Ненеопластические заболевания яичников
Синдром поликистозных яичников
Синдром поликистозных яичников (СПКЯ, синдром Штейна-Левенталя) — является довольно частым заболеванием, которое поражает около 4-5% женщин репродуктивного возраста и передается, возможно, по аутосомно-доминантному типу. Синдром сопровождается комплексом патологических симптомов, включающих гирсутизм, вирилизации, ановуляцию, аменорею и ожирения. У таких пациенток также растет частота гиперинсулинемии, инсулинорезистентности и сахарного диабета типа II (инсулиннезависимого сахарного диабета).
Причина гиперандрогенного состояния при СПКЯ связана с избыточной ЛГ-стимуляцией, а также гиперинсулинемией, что приводит к кистозных изменений в яичниках и рост яичниковой секреции андрогенов.
Основными клиническими критериями диагностики СПКЯ считают
1) гиперандрогенные (клиническую или биохимическую);
2) нарушение менструального цикла вследствие олигоовуляции и ановуляции.
Для подтверждения диагноза СПКЯ используют следующие показатели:
Тека-лютеиновые кисты
Тека-клетки яичника стимулируются ЛГ и продуцируют андростендион и тестостерон. В норме эти андрогены шунтируются к гранулезным клеткам для ароматизации в эстрон и эстрадиол. Тека-лютеиновые кисты возникают при длительной и массивной стимуляции яичника гонадотропинами и продуцируют избыточное количество андрогенов. Такие кисты в большинстве случаев являются двусторонними и могут наблюдаться при нормальной беременности и трофобластической болезни. Яичники являются увеличенными у пациенток, у которых имеют место гирсутизм и, редко, вирилизация. Тека-лютеиновые кисты нередко регрессируют спонтанно.
Стромальная гиперплазия и гипертекоз
Стромальная гиперплазия (гиперплазия стромы яичника) является частой между 50 и 70 годами жизни и может вызывать развитие гирсутизма. Яичники являются униформно увеличенными. Стромальный гипертекоз характеризуется накоплением «гнезд» тека-клеток среди гиперплазированной стромы и более часто приводит к вирилизации, чем простая стромальная гиперплазия, потому что накопленные тека-клетки сохраняют способность к синтезу андрогенов. Яичники выглядят увеличенными и мясистыми, не соответствующими возрасту больных.
Сертоли-Лейдига-клеточные опухоли обычно возникают у молодых женщин и составляют около 1% всех опухолей яичников. Гилюсноклеточные клетки являются более редкими, чем Сертоли-Лейдига-клеточные, и наблюдаются преимущественно у женщин в постменопаузе. Эти опухоли могут секретировать андрогены, что приводит к развитию гирсутизма и вирилизма.
Во время беременности может развиваться лютеома — доброкачественная опухоль, которая растет в ответ на стимуляцию ХГЧ. Эта опухоль может вызывать значительное повышение уровня тестостерона и андростендиона и, соответственно, вирилизации у 65% плодов женского пола. Эти изменения исчезают после родов.
Другие опухоли яичников
Избыточный синтез андрогенов может иметь место и при других опухолях яичников — цистаденоме, опухоли Крукенберга. Эти опухоли не секретируют андрогены, но стимулируют пролиферацию прилегающей стромы яичников, что, в свою очередь, может привести к избыточной секреции андрогенов.
Медикаментозные препараты и экзогенные гормоны
Значительное количество медикаментозных препаратов может влиять на уровень циркулирующего ГСПГ, циркулирующий тестостерон, оставляя небольшое количество «свободного» тестостерона для взаимодействий на клеточном уровне. Андрогены и кортикостероиды уменьшают уровень ГСПГ, освобождая большее количество «свободного» тестостерона в циркуляции. Пациентки, которые получают анаболические стероиды, даназол или тестостерон, часто имеют гирсутизм и вирилизации. Такие препараты, как миноксидил, фенитоин, диазоксид, циклоспорин могут вызывать гирсутизм, не влияя на синтез андрогенов.
Идиопатический гирсутизм
Существуют национальные, семейные и расовые различия степени оволосения тела. Гирсутизм считается идиопатическим при отсутствии патологии яичников и надпочечников, при экзогенном воздействии андрогенов или употреблении определенных медикаментозных препаратов.
Пациентки могут иметь увеличенную продукцию андрогенов, хотя многие из них имеют нормальный уровень циркулирующих андрогенов. В этих случаях может иметь место рост периферической продукции андрогенов вследствие повышения активности 5а-редуктазы на уровне кожи и волосяных фолликулов.
Клиническая манифестация. Пациенток опрашивают относительно начала, прогрессирования и симптомов гирсутизма и вирилизации, выясняют пубертатный, менструальный и репродуктивный, а также семейный (генетические нарушения, включая гиперплазию надпочечников) анамнез, наличие приема медикаментов, которые влияют на уровень ГСПГ или изменяют внутреннюю андрогенную активностью.
Объективное обследование включает оценку типа роста волос (лицо, грудь, спина, живот, внутренние поверхности бедер), а также оценку наличия фронтального облысения, контуров тела. Оценку выраженности гирсутизма проводят по шкале Ферримана-Голуэе.
Обследование молочной железы может выявить атрофические изменения. При гинекологическом исследовании оценивают линию роста лобковых волос, величину клитора, размеры яичников. Проявляют кушингоидные черты, наличие акантоза (утолщенной, бархатной гиперпигментации в аксиллярной зоне и на шее), что может быть проявлением СПКЯ.
Диагностика. Лабораторные исследования включают определение уровня свободного тестостерона, 17-ОГП, ДГЭАС и пролактина. Повышение уровня 17-ОГП (измеряют утром) позволяет заподозрить врожденную гиперплазию надпочечников. Повышение уровня свободного тестостерона подтверждает чрезмерную продукцию андрогенов, сопроводительное повышения ДГЭАС свидетельствует о поражении надпочечников.
Увеличение уровня ДГЭАС> 700 мкг / дл подозрительно относительно возможной опухоли надпочечников. Наличие опухоли надпочечников определяют с помощью компьютерной или магнитно-резонансной томографии. Выполняют тест с АКТГ и оценивают содержание кортизола в 24-часовом анализе мочи для диагностики синдрома Кушинга.
Если уровень ДГЭАС является нормальным или несколько повышенным, подозревают поражения яичников и с целью исключения опухоли яичников выполняют ультрасонографию или компьютерную томографию. Повышение соотношения ЛГ / ФСГ> 3: 1 свидетельствует о СПКЯ. Быстрое начало вирилизации и уровень тестостерона> 200 нг / дл может свидетельствовать о наличии андрогенсекретирующей опухоли яичника.
Для подтверждения генеза чрезмерной продукции андрогенов используют магнитно-резонансную томографию и селективный анализ венозной крови для выявления локализации поражения. У женщин с гирсутизмом и нормальным уровнем свободного тестостерона определяют активность 5а-редуктазы для выявления роли увеличенной периферической энзимной активности в развитии гирсутизма.
Лечение. Существуют различные варианты лечения гирсутизма в зависимости от причины и выраженности клинических проявлений. Супрессия действия надпочечниковых андрогенов при отсутствии опухоли надпочечников может быть достигнута назначением глюкокортикоидов (преднизон, преднизолон). Финастерид ингибирует энзим 5а-редуктазу, что уменьшает периферическую конверсию тестостерона в дигидротестостерон. Антиандрогены (ципротерон-ацетат (андрокур), спиронолактон) могут быть эффективными. В случае опухолей яичников выполняют хирургическое лечение.
Яичниковые ненеопластические заболевания, сопровождающиеся увеличением продукции андрогенов, подлежат супрессии путем применения комбинированных оральных контрацептивов, что приводит к супрессии выделения ЛГ и ФСГ, а также росту ГСПГ.
Наиболее эффективным является Диане-35, который как гестагенный компонент содержит ципротерон-ацетат с антиандрогенными свойствами. Гестагены также могут быть применены у пациенток с противопоказаниями к эстрогенной терапии. Прогестины уменьшают уровень ЛГ и, следовательно, продукцию андрогенов (андрокур и др.). Кроме того, растет катаболизм тестостерона, что ведет к уменьшению его уровня.
С целью супрессии ЛГ и ФСГ могут быть применены агонисты ГнРГ (золадекс, декапептил, диферелин т.п.). Длительное применение агонистов ГнРГ может привести к гипоэстрогенному состоянию и потребовать заместительной эстрогенной терапии.
Пациенткам с медикаментознозависимым гирсутизмом рекомендуют прекратить прием андрогенстимулирующих препаратов. Симптоматическая терапия включает депиляцию, электролизис, сбривание волос и другие косметические процедуры. Сбривание волос не увеличивает его рост и сопровождается меньшим риском фолликулита и образования рубцов.
Андрогенная алопеция (облысение у женщин) - симптомы и лечение
Что такое андрогенная алопеция (облысение у женщин)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Побилат Анны Евгеньевны, дерматолога со стажем в 19 лет.
Над статьей доктора Побилат Анны Евгеньевны работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Андрогенетическая алопеция (АГА) — это поредение волос, в основе которого лежит прогрессирующее уменьшение волосяных фолликулов [1] . АГА относится к нерубцовой форме алопеции, при которой отсутствует предшествующее повреждение кожи и рубец в очаге поражения. Это сложное состояние, к которому приводит влияние множества факторов и генов. Андрогенетическая алопеция поражает до 80 % мужчин и 42 % женщин [2] . Вероятность выпадения волос по этому типу у женщин увеличивается с возрастом, достигая у европеоидов к 70 годам 40 % [3] . Развитие заболевания сопровождается интенсивными переживаниями [4] .
Генетическое наследование при андрогенетической алопеции до сих пор остаётся неясным. Вероятнее всего, тип наследования является полигенным (обусловлен влиянием сочетания нескольких генов). Согласно недавним исследованиям, раннее начало заболевания (до 30 лет) связано с геном рецептора андрогена EBA2R на Х-хромосоме [14] . Также изучалось влияние мутации в гене, определяющем работу ароматазы (фермента, который трансформирует андрогены в эстрогены), оно было признано значимым [15] , но не подтвердилось в более позднем исследовании [16] .
Анализ данных репликации (процесса создания дочерних молекул ДНК на основе родительской молекулы ДНК) выявил четыре наиболее значимых локуса (местоположения гена на карте хромосомы) риска для AGA на хромосомах 2q35, 3q25. 1, 5q33.3 и 12p12.1. Самый сильный сигнал был получен для rs7349332 на хромосоме 2q35, который находится в WNT10A. Таким образом, исследования экспрессии в ткани фолликула человеческого волоса показывают, что ген WNT10A играет важную роль в развитии андрогенетической алопеции [18] .
Заболевание может как быть симптомом системной патологии, так и сочетаться с другими состояниями. Оно сопровождает другие кожные или общие признаки гиперандрогении (повышенное содержание мужских половых гормонов), такие как гирсутизм, акне, нерегулярные менструации, бесплодие, галакторею (выделение молока вне периода грудного вскармливания) и инсулинорезистентность. Наиболее распространённой эндокринологической патологией, связанной с АГА, является синдром поликистозных яичников (СПКЯ).
Еще одной важной ассоциацией с АГА является метаболический синдром — нарушенный углеводный обмен, повышающий риск развития патологии сердечно-сосудистой системы. Корейские учёные, изучив 1701 пациентку, доказали положительную статистическую связь между АГА и метаболическим синдромом [28] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы андрогенной алопеции (облысении у женщин)
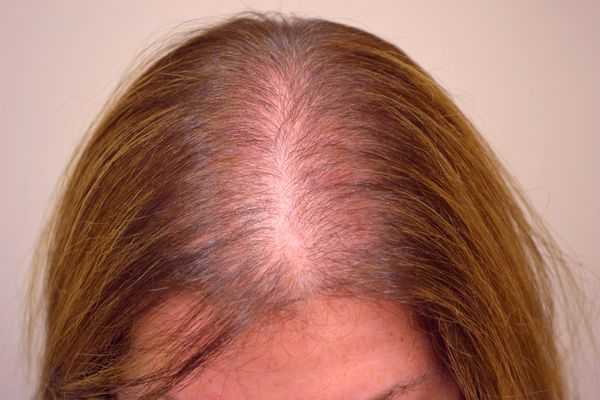
Нормальным считается выпадение 60 - 80 волос в день, при котором они не становятся тоньше и их объём не меняется. При алопеции пациенты жалуются на прогрессивное истончение волос, сокращение их объёма и на непрерывное или скачкообразное выпадение. Заболевание у женщин прогрессирует медленнее, чем у мужчин, и обычно равномерно поражает волосистую часть головы. У женщин алопеция развивается позднее, чем у мужчин, но может начаться и в подростковом возрасте. Первые проявления заболевания почти незаметны [3] .
Патогенез андрогенной алопеции (облысении у женщин)
Волосяные фолликулы постоянно находятся в циклическом процессе смены фаз. Выделяют три фазы:
- анаген — период роста;
- катаген — переход от одной стадии к другой;
- телоген — период покоя.
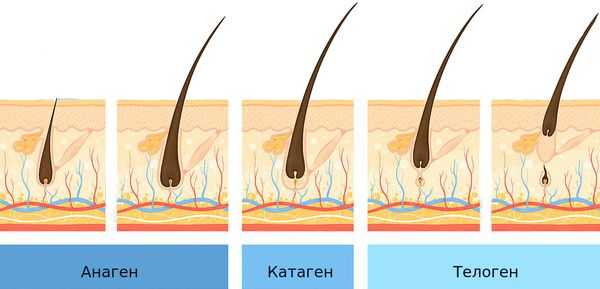
Продолжительность фазы роста (анагена) определяет длину волос. Большинство волос на коже головы (85-90 %) находятся в фазе анагена, которая длится примерно 2-6 лет. Оставшаяся часть волос (10-15 %) находятся в фазе телогена — фазе покоя волосяных фолликулов, которая длится около трёх месяцев. Волос в это время можно сравнить с цветком, который находится в вазе. Он срезан, не растёт, ни сцеплен с вазой, но и не может её оставить. В конце фазы телогена волос покидает фолликул.
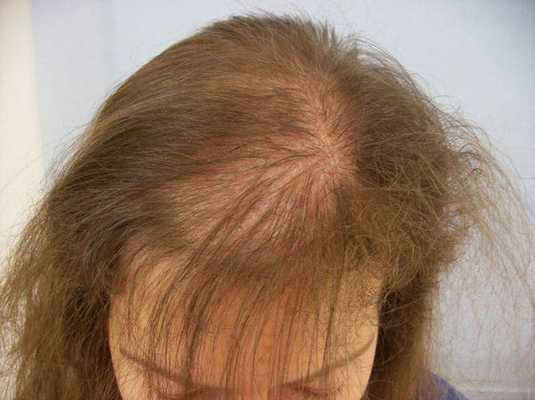
Волосы могут различаться по диаметру и длине стержня, выделяют пушковые и терминальные волосы. Пушковые волосы (vellus) тоньше и короче терминальных, лишены пигментации. При заболевании волосяные фолликулы уменьшаются и происходит превращение терминальных фолликулов в веллусоподобные. Эти веллусоподобные фолликулы имеют укороченный цикл волос — фаза анагена у них меньше и они производят короткие и тонкие волосяные стержни.
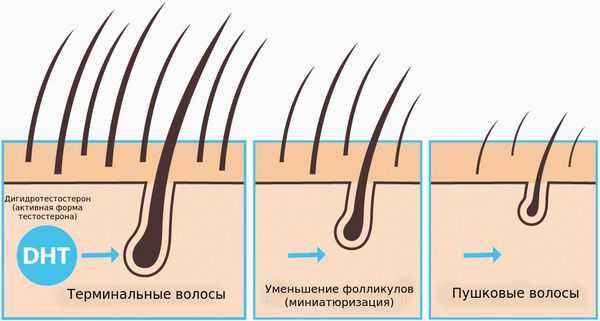
В отличие от мужчин, уменьшение фолликулов у женщин происходит неравномерно и не так интенсивно, поэтому, за исключением редких случаев, у них не появляются области полного облысения [5] .
У некоторых женщин с андрогенетической алопецией выявляют изменённый метаболизм андрогенов, зачастую — избыток, но не во всех случаях. Сывороточный тестостерон у большинства пациенток находится в пределах нормы [6] [7] [8] .
Заболевание у пациенток с нормальным содержанием мужских половых гормонов может возникать из-за повышенной чувствительности волосяного фолликула к нормальному уровню андрогенов. Причина этого может быть в большом количестве рецепторов к андрогенам и сниженной активности ароматазы (фермента, трансформирующего андрогены в эстрогены).
Алопеция также развивается у людей с синдромом нечувствительности к андрогенам или дефицитом 5-альфа-редуктазы (фермента, участвующего в метаболизме стероидов) [9] . Это указывает на то, что андрогенетическая алопеция у женщин, в отличие от мужского выпадения волос, может развиваться даже в отсутствие андрогенов.
Недавнее исследование показало, что лечение андрогенами может улучшить состояние волос у некоторых женщин. В течение года исследовалось влияние подкожных имплантатов тестостерона на частоту развития рака молочной железы у пациенток в пре- и постменопаузе. Большинство женщин (63 %), которые жаловались на истончение волос, сообщили о положительной динамике [10] . Таким образом, гиперандрогения (повышенное содержание мужских половых гормонов — андрогенов) сама по себе не обязательно приводит к андрогенетической алопеции [11] . Механизм воздействия андрогенов на волосы, вызывающий алопецию, связан с преждевременным старением волосяных фолликулов и усилением выработки цитокинов ( белки клеток иммунной системы, которые обеспечивают межклеточные взаимодействия ), сокращающих продолжительность фазы анагена [12] [13] .
Андрогенетическая алопеция усугубляется диффузной телогеновой алопецией, возникающей вследствие приёма некоторых лекарств, стресса, резкой потери веса, гормональной перестройки (например, родов) и терапии препаратами с проандрогенными эффектами, такими как норэтистерон, леворногестрел и тиболон.
Классификация и стадии развития андрогенной алопеции (облысении у женщин)
Андрогенетическая алопеция у женщин протекает иначе, чем у мужчин — сохраняется линия волос в области лба, выпадение равномерное в пределах лобно-теменной зоны и не настолько выраженное [19] .
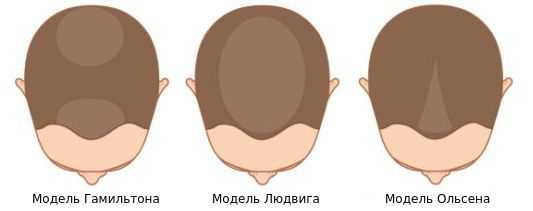
Выделяют три модели андрогенетической алопеции:
- модель Гамильтона — истончение и поредение волос в теменной зоне и расширение лобно-височных углов, скорее характерное для мужчин, которое наблюдается у женщин в менопаузе или с гиперандрогенией;
- модель Людвига — обширное истончение волос в пределах макушки с сохранением линии роста волос в области лба;
- модель Ольсена или "рождественской ёлки" — истончение и поредение волос центральной части головы с поражением линии роста волос в области лба.
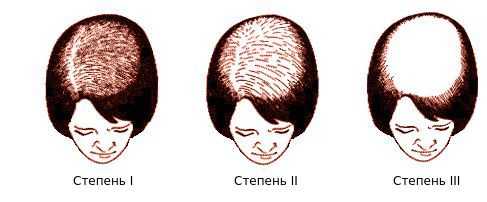
Осмотрев 468 пациенток, немецкий дерматолог Людвиг выделил три степени поредения волос лобно-теменной зоны [20] [21] :
- Заметное истончение волос и расширение пробора.
- Выраженное разрежение волос.
- Волосы полностью утрачены (встречается менее, чем у 5 % женщин).
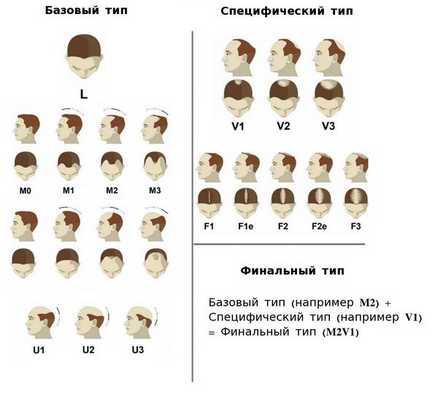
В 2007 году Ли и соавторы предложили базовую и специфическую (BASP) систему классификации, которая представляет собой усовершенствованный вариант классификации Норвуд — Гамильтона и включает четыре базовых типа (L, M, C, U) и два специфических типа (F и V) [22] .
Следует учитывать, что у женщины с паттерном по Людвигу после менопаузы может развиться дополнительно паттерн по Гамильтону, то есть оба типа могут сочетаться [23] .
Осложнения андрогенной алопеции (облысении у женщин)
Основным осложнением при андрогенной алопеции у женщин является полная потеря волос без возможности их естественного восстановления. Потеря волос не приводит к утрате работоспособности, ухудшению общего состояния и не требует длительного нахождения в стационаре. Однако выпадение волос ухудшает эмоциональное состояние пациенток и влияет на качество жизни. Пациентки могут страдать лёгкими формами тревожных, депрессивных и социофобических расстройств.

Диагностика андрогенной алопеции (облысении у женщин)
Диагноз устанавливается на основе клинических признаков. Также проводят тест на вытягивание волос или тракционную пробу. Метод заключается в мягком потягивании волос вдоль скальпа. Проба обычно является положительной в лобно-теменной зоне кожи головы. Положительная тракционная проба со всей поверхности кожи указывает на сочетание андрогенетической алопеции с диффузной телогеновой.
Для раннего выявления и дифференциальной диагностики с другими алопециями проводят дерматоскопию [24] . Дерматоскопическими признаками андрогенетической алопеции является анизотрихоз (вариабельность диаметров более 20 % за счёт истончения волос), перипапиллярные признаки (коричневый ореол вокруг фолликула, жёлтые точки), и увеличение количества веллусоподобных волос [25] [26] .
При диагностике важно оценить функцию щитовидной железы, уровень ферритина, цинка, витамина D и пролактина. Это необходимо, чтобы исключить факторы, которые могут увеличить выпадение волос и усугубить заболевание [34] .
Пациенты с нерегулярными менструациями в анамнезе, повышенным индексом массы тела или кожными признаками гиперандрогении должны быть направлены к эндокринологу для выявления возможного СПКЯ (синдрома поликистозных яичников) и ВДКН (врождённой дисфункции коры надпочечников).
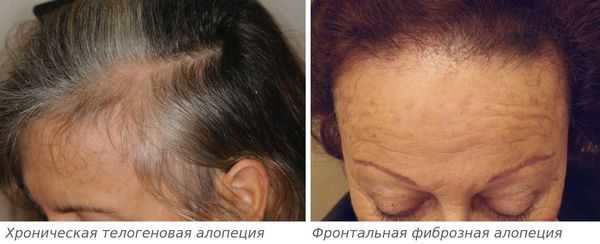
Андрогенетическую алопецию дифференцируют с хронической телогеновой и фронтальной фиброзной, алопецией, вызванной необратимым поражением части волосяных фолликулов химиотерапией, скрытой формой гнездной алопеции:
- для хронической телогеновой алопеции характерно поредение волос в лобно-височной области [30] ;
- алопеция, вызванная химиотерапией, вероятно, связана с поражением стволовых клеток волосяных фолликулов [31] ;
- скрытая форма гнездной алопеции проявляет себя быстро прогрессирующим истончением волос и наличием большого количества жёлтых точек при дерматоскопии [32] ;
- фронтальная фиброзная алопеция — это лимфоцитарная рубцовая алопеция, которая считается вариантом красного плоского лишая.
Лечение андрогенной алопеции (облысении у женщин)
Единственным лекарственным соединением, одобренным FDA ( Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов, США) для терапии андрогенетической алопеции, является 2 % местный миноксидил.
Миноксидил усиливает образование новых кровеносных сосудов вокруг фолликула и побуждает фолликулы вступать в фазу анагена, продлевая его продолжительность, увеличивает количество волос [35] .
Первая группа альтернативной терапии — это синтетические антиандрогены, которые используются перорально для блокирования связывания рецепторов андрогенов. Они включают ацетат ципротерона, спиронолактон и флутамид. Назначение ципротерона ацетата оправдано при лабораторно подтверждённой гиперандрогении [37] .
Спиронолактон — это калийсберегающее мочегонное средство, которое снижает выработку тестостерона в надпочечниках и блокирует рецепторы андрогенов в тканях-мишенях. Он эффективен при лечении гирсутизма, связанного с синдромом поликистозных яичников и акне [37] .
Применение флутамида ограничено, поскольку он даже в низких дозировках токсичен для печени [38] .
Вторая группа соединений препятствует воздействию дигидротестостерона. Финастерид уменьшает выпадение волос и стимулирует их отрастание, увеличивая количество волос. Данные об эффективности его применения у женщин в литературе противоречивы, требуются дополнительные контролируемые исследования.
Женщины в пременопаузе должны использовать безопасные методы контрацепции во время лечения финастеридом, так как, если принимать препарат в течение всей беременности, он может вызвать феминизацию мужского плода. Другое возможное побочное действие — это небольшой подъём уровня эстрогенов. По этой причине финастерид не рекомендуется женщинам с семейным или личным анамнезом рака молочной железы, так как может вызвать развитие гормональнозависимой формы рака.
Есть некоторые доказательства того, что световые процедуры могут стимулировать рост волос, но механизм, с помощью которого это происходит, неясен. Lasercomb Hair MaxR — это портативное лазерное устройство, широко продаваемое в качестве средства для отрастания волос. Проведено одно контролируемое исследование у мужчин, показывающее эффективность этой технологии [41] , но исследований, доказывающих его эффективность для женщин, нет.

Латанопрост и биматопрост изначально разработаны для лечения глаукомы, и одним из замеченных побочных эффектов был рост ресниц. Существует одно исследование у 16 мужчин, показывающее, что латанопрост на 0,1 % увеличил плотность волос на коже головы по сравнению с исходным уровнем и плацебо [42] .
При стабильном выпадении волос у пациентов старше 25 лет поможет пересадка волос. Золотой стандарт — это трансплантация фолликулярных единиц, поскольку она даёт хороший результат, который выглядит естественно [43] . Волосяные фолликулы имплантируются индивидуально в соответствии с линией волос пациента. Это многоэтапная процедура, которую должна выполнять опытная хирургическая бригада.
Прогноз. Профилактика
Андрогенетическая алопеция является хроническим заболеванием и без лечения прогрессирует. Официально признанным во всем мире средством для лечения АГА у женщин в настоящий момент является 2 % миноксидил [1] [2] [3] . Если пациентки начинают лечение миноксидилом, то оно должно быть пожизненным, поскольку при прекращении приёма развивается синдром отмены. Также следует знать, что этот препарат, как и большинство антиандрогенных средств, не применяется у беременных и кормящих.
Даназол. Избыток андрогенов у женщин и гирсутизм
ВГМУ, Профессорская клиника Юцковских, Владивосток
Профессорская клиника Юцковских, Владивосток
Владивостокский государственный медицинский университет
Андрогензависимые синдромы кожи у женщин: роль антиандрогенной терапии на современном этапе
Одной из сложных задач современной дерматологии и косметологии остается лечение андрогензависимых синдромов кожи. Синдромы гиперандрогении (ГА) часто служат причиной психологического дискомфорта и отрицательно влияют на качество жизни женщин. Синдромы ГА у женщин являются частыми причинами психологического дистресса. Внешние проявления избытка андрогенов отмечаются у 10—30% женщин в популяции и становятся существенным косметическим дефектом, отражающимся на нервно-психическом статусе женщины, приводя к раздражительности, депрессивным состояниям, снижая качество жизни и обусловливая социальные проблемы в виде ограничений в выборе профессии и сложностей в трудоустройстве, снижая чувство достоинства женщин. В патогенезе этих процессов большое значение уделяется роли гормонов. Под влиянием избытка андрогенов у женщин развивается синдром ГА, что клинически проявляется себореей, гирсутизмом, андрогензависимой алопецией.
Заболевания, при которых имеются признаки повышенной продукции андрогенов, относятся к междисциплинарной патологии и требуют пристального внимания и знаний не только гинеколога, но и в равной степени затрагивают сферу интересов эндокринологов, дерматологов, косметологов.
Кожа человека является комплексом андрогенчувствительных структур (сальные и потовые железы, волосяные фолликулы). Под влиянием андрогенов находятся многие важные функции кожи: митотическая активность клеток, активность сальных желез, рост волос, выраженность пигментации. Являясь тканью-мишенью для половых стероидных гормонов, например андрогенов, кожа принимает активное участие в метаболизме стероидных половых гормонов, в частности, в экстрагландулярном образовании из стероидов-предшественников.
Источником андрогенов в организме женщины являются яичники и кора надпочечников. Их синтез происходит под стимулирующим действием лютеинизирующего гормона (ЛГ) и адренокортикотропного гормона (АКТГ). Основной андроген надпочечников — дигидроэпиандростерон (ДГЭА) и его сульфат (ДГЭАС), яичников — тестостерон (Т) и андростендион (А). Действие половых гормонов на кожу осуществляется через специфические андрогенные рецепторы (АР) сосочкового слоя дермы, фибробласты, кератиноциты, эпителиальные клетки просвета апокриновых желез и секреторный отдел эккриновых сальных желез, а также в себоцитах и волосяных фолликулах.
Мишенями для половых стероидов в коже являются эпидермис, волосяные фолликулы, сальные железы, меланоциты и фибробласты. Под воздействием андрогенов усиливаются дифференцировка и митотическая активность клеток эпидермиса, увеличивается синтез межклеточных липидов, увеличивается толщина эпидермиса, стимулируется рост и пигментация волос, усиливается продукция кожного сала, снижается синтез глобулина, связывающего половые стероиды (ГСПС) в печени. В то же время под воздействием эстрогенов тормозится рост волос в андрогензависимых зонах, угнетается продукция кожного сала, усиливается синтез ГСПС.
Важным патогенетическим звеном при ГА является нарушение связывания андрогенов со специфическим ГСПС. Связанные с ГСПС стероиды недоступны для соединения с рецепторами в тканях-мишенях и оказания биологического эффекта. Биологический эффект в клетках-мишенях оказывает лишь свободная фракция половых стероидов. Она же ответственна за клинические проявления андрогенного эффекта.
Таким образом, ГА в организме женщины сопровождается избыточной секрецией мужских половых гормонов или повышенной чувствительностью тканей к неизмененному уровню андрогенов. Совокупность признаков поражения кожи и ее придатков, возникающих в результате избытка андрогенов в женском организме (себорея, гирсутизм, андрогензависимая алопеция), можно обозначить термином «гиперандрогенная дермопатия».
ГА может проявляться в виде абсолютного увеличения количества гормонов (абсолютная ГА) или повышенной чувствительностью рецепторов к нормальному или сниженному содержанию андрогенов в организме (относительная ГА).
Акне. В клетках сальных желез — себоцитах тестостерон под действием фермента α5-редуктазы 1-го типа переходит в самый активный метаболит — дигидротестостерон, который служит непосредственным стимулятором роста и созревания себоцитов, образования кожного сала. Основными причинами относительной ГА являются повышенная активность фермента α5-редуктазы 1-го типа, повышенная плотность ядерных дигидротестостероновых рецепторов, увеличение свободной фракции тестостерона в крови. Таким образом, в патогенезе акне ведущая роль принадлежит гормональному фактору, приводящему к гипертрофии и повышенному функционированию сальных желез, фолликулярному гиперкератозу в протоке сально-волосяного фолликула (СВФ), активизации микроорганизмов с последующим воспалением.
Себорея. Себорея — патологическое состояние кожи, обусловленное нарушением функции сальных желез, изменением состава их секрета. Возникновение синдрома ГА — себореи, связано с избытком андрогенов. Проявляется в местах, богатых сальными железами, — на лице, волосистой части головы, верхней части груди, в межлопаточной области. Развитию себореи способствуют нарушения функции половых желез (в частности, нормального соотношения между эстрогенами и андрогенами), надпочечников, щитовидной железы, а также иммунной, пищеварительной, центральной и вегетативной систем. Различают сухую и жирную себорею. У некоторых больных может быть смешанная себорея: на одних участках имеются симптомы сухой, а на других — жирной себореи.
Огромная роль в патогенезе себореи отводится наследственности. Генотип — врожденные качества, заложенные в генах. Структура кожного покрова является врожденной и неизменной на протяжении всей жизни, несмотря на то что поверхность кожи может постоянно меняться — трескаться, шелушиться, менять цвет (тускнеть), стать более грубой, тем не менее структура ее всегда индивидуальная, не меняющаяся.
При повышенном уровне мужских половых гормонов может изменяться тип кожи. Она становится жирной, поры на лице и себорейных участках расширяются, рН достигает 6, появляется склонность к дисхромиям.
Жирную себорею подразделяют на жидкую и густую, в зависимости от консистенции кожного сала, что определяется его физико-химическим составом. Участвуя в формировании водно-липидной мантии, кожное сало оказывает выраженное бактерио- и фунгицидное действие на большинство микроорганизмов. Компоненты липидной пленки на поверхности кожи являются производными сальных желез и эпидермиса и на 60% представлены триглицеридами, на 20—25% — эфирами воска, на 10—15% — скваленом, на 1—3% — эстерифицированными стеролами и на 0,5—2% — свободным стеролом. В увеличенном объеме кожного сала снижается концентрация незаменимой α-линоевой кислоты, которая подавляет экспрессию фермента трансглутаминазы. α-Линоевая кислота является основным регулятором дифференцировки кератиноцитов. Трансглутаминаза участвует в синтезе кератина 1-й и 10-й фракций, белков инволюкрина, лорикрина и филлагрина — основных компонентов цементирующего межклеточного вещества. Уменьшение количества линолевой кислоты приводит к повышению рН кожного сала, в итоге значительно нарушается барьерная функция эпителия и создаются условия для роста микроорганизмов на поверхности кожи и внутри сально-волосяных фолликулов.
Основными критериями оценки типов кожи на приеме у врача-косметолога являются характеристика салообразования — повышенное, пониженное, умеренное; степень расширения пор — расширенные, умеренно-расширенные, точечные; состояние липидной субстанции эпидермиса после умывания — чувство стянутости, дискомфорт, шелушение, покраснение.
Сравнивая различные состояния кожи здоровых пациентов и пациентов с себореей посредством неинвазивных методов морфофункциональной диагностики кожи (себуметрии, корнеометрии, рН-метрии) с применением аппарата SOFT PLUS, CATELLANI GROUP (Италия), мы получили следующие результаты (табл. 1).
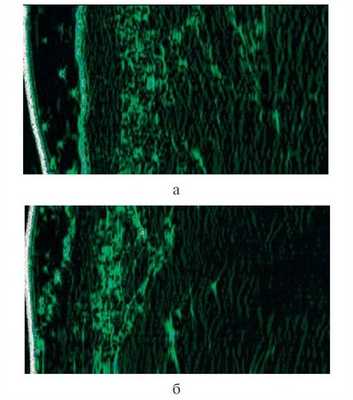
Одним из объективных методов оценки состояния кожи является ультразвуковое исследование (УЗИ). У пациента с нормальной кожей при УЗИ видны сглаженность рельефа эпидермиса, равномерное распределение эхосигнала; эпидермис четко отграничен от дермы, дерма дифференцирована на отделы, расположение волокон дермы линейное (рис. 1, а). Рисунок 1. Ультразвуковая картина кожи в норме (а) и у пациента с себореей (б). У пациента с себореей отмечаются изменение эхоструктуры эпидермиса, нарушение его рельефа, протоки сальных желез расширены; отсутствует четкая граница между эпидермисом и дермой, эхогенность субэпидермального отдела дермы снижена (рис. 1, б).
Еще одним симптомом ГА является гирсутизм.
Гирсутизм. Под гирсутизмом (рис. 2) Рисунок 2. Гирсутизм у пациентки (из фотоархива ООО «Профессорская клиника Юцковских»). следует понимать увеличение у женщин количества волос на лице, груди, животе, вокруг сосков, а также на спине и бедрах. При усиленном оволосении женщин еще говорят о гипертрихозе. Между терминами «гирсутизм» и «гипертрихоз» существует разница: первый обозначает мужской тип роста волос у женщин, а второй — количественное увеличение волос на теле. Гирсутизм чаще всего является признаком некоторых эндокринных заболеваний, вызванных поражением гипоталамо-гипофизарной области, коры надпочечников и яичников. Но гирсутизм не всегда связан с нейроэндокринной патологией.
Выделяют следующие формы гирсутизма, не связанные с патологией яичников или надпочечников: конституциональный, экзогенный, идиопатический. Конституциональная форма гирсутизма носит наследственный характер. При этом виде повышенного оволосения продукция андрогенов в норме. К этой форме гирсутизма относится избыточное оволосение у женщин отдельных национальностей (жительницы стран Востока и Средиземноморья). Экзогенная форма гирсутизма возникает в тех случаях, когда приходится вводить андрогены в виде инъекций лекарственных препаратов. Гирсутизм может развиваться при применении таких препаратов, как кортикостероиды, стрептомицин. Предположение об идиопатическом гирсутизме возникает в тех случаях, когда не обнаруживается эндокринная патология и исключается экзогенный и конституциональный гирсутизм. Этот диагноз ставится при нормальном и повышенном содержании свободного тестостерона и невозможности установить причину заболевания. Учитывая, что достаточно часто гирсутизм служит проявлением ГА, целесообразно применение антиандрогенных препаратов. При гирсутизме косметическое устранение волос (эпиляция) эффективно только при условии удаления или угнетения источника повышенной секреции андрогенов.
Алопеция. В развитии андрогенной алопеции (рис. 3) Рисунок 3. Андрогенная алопеция у пациентки (из фотоархива ООО «Профессорская клиника Юцковских»). основная роль принадлежит α5-редуктазе — ферменту, который восстанавливает тестостерон до дигидротестостерона (ДГТ). ДГТ сокращает фазу роста волосяного фолликула, что приводит к его уменьшению и постепенной атрофии. Одновременно сокращается продолжительность жизненного цикла волоса, в результате чего наблюдается усиленное выпадение волос. Исследования показали, что уровень андрогенов у женщин с андрогенной алопецией часто не превышает норму. Это свидетельствует о том, что в патогенезе андрогенной алопеции основную роль играет повышенная чувствительность фолликулов к действию ДГТ. Женская андрогенная алопеция носит диффузный характер и редко приводит к облысению. При андрогенной алопеции на голове всегда остается венчик волос в затылочной и височных областях. Суть феномена состоит в том, что волосяные фолликулы в этих зонах не имеют рецепторов, способных воспринимать действие андрогенов. Поэтому исключается одна из обязательных причин андрогенной алопеции — гормональная активность — и волосы в этих областях генетически «застрахованы» от выпадения.
Современные подходы к лечению различных форм ГА включают назначение системных и наружных препаратов. Выбор методов лечения ГА должен основываться на адекватной клинической оценке степени тяжести синдромов ГА. Следует всегда учитывать состояние эндокринного фона, сопутствующие заболевания и состояния.
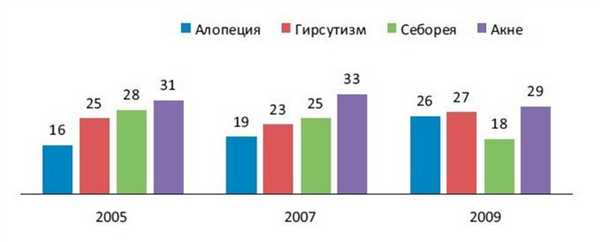
По нашим данным, за последние 5 лет значительно увеличилась обращаемость пациентов с синдромами ГА, особенно с такими, как алопеция и гирсутизм (рис. 4). Рисунок 4. Динамика обращаемости пациентов с синдромами гиперандрогении (по данным ООО «Профессорская клиника Юцковских», 2005—2009 гг.).
Механизм антиандрогенного действия КОК заключается в снижении продукции гонадотропинов (ЛГ), редукции уровня циркулирующих андрогенов, увеличении связывания андрогенов, снижении секреции андрогенов надпочечниками, ингибировании α5-редуктазы, связывании андрогенных рецепторов.
Первым КОК антиандрогенного действия был препарат диане-50, созданный на основе синтезированного в 1961 г. ципротерон-ацетата. В 1985 г. были созданы диане-35 (со снижением дозы эстрогенного компонента) и препарат андрокур (10 или 50 мг ципротерона ацетата).
Проведенные в 40 странах Европы два плацебо-контролируемых исследования с участием 1072 женщин в возрасте 14—45 лет с проявлениями акне показали, что применение КОК Джес по сравнению с плацебо к концу 6-го месяца способствует выраженному регрессу как невоспалительных, так и воспалительных акне. К окончанию терапии в среднем по группе акне регрессировали на 56%; состояния клинического излечения удалось достичь у 22% пациенток. Наиболее выраженное улучшение наблюдалось у женщин в возрасте от 14 до 22 лет.
В другом исследовании, посвященном оценке косметических аспектов приема антиандрогенного КОК на основе дроспиренона, к концу 6-го месяца терапии было продемонстрировано уменьшение себореи (на 71%), акне (на 75%) и гипертрихоза (показатель Ферримана—Галлвея — на 43%). При оценке толщины эпидермиса (корнеометрия) выявлено повышение гидратации на 26%, что было обусловлено как влиянием эстрогена в составе КОК, так и снижением концентрации андрогенов и/или их активности. Патоморфологически повышение гидратации эпидермиса обусловлено стимуляцией эстрогенами синтеза гиалуроновой кислоты. Определение снижения уровня испарения жидкости с поверхности кожи (на 35%) с помощью теваметрии (TEWL) также свидетельствовало об улучшении состояния кожи.
Важнейшим преимуществом Джес является хорошая переносимость, в частности, отсутствие влияния на массу тела, а иногда ее снижение. Это объясняется тем, что дроспиренон, входящий в состав препарата, дает антиминералокортикоидный эффект и препятствует задержке жидкости в организме, которая часто служит причиной увеличения массы тела при приеме КОК. Джес эффективно уменьшает проявления предменструального синдрома, в частности, появление акне в период, предшествующий менструации.
Таким образом, патогенетически оправдано и клинически актуально использование для лечения себореи, гирсутизма, андрогензависимой алопеции современных КОК, в частности Джес, которые подавляют секрецию гонадотропинов, стимулируют синтез ГСПС и снижают активность α5-редуктазы. Применение КОК, оказывающих антиандрогенный эффект, может улучшить не только гормональные параметры и классические проявления ГА, но и общее состояние, а также качество кожи, повышая гидратацию и улучшая характеристики, отражающие состояние кожи.
Так как диагностика и лечение различных форм ГА находятся на стыке нескольких специальностей (гинекология, эндокринология, дерматология), то только их объединение позволит добиться высоких результатов в лечении себореи, гирсутизма и андрогензависимой алопеции.
Московский областной НИИ акушерства и гинекологии
Гиперандрогения у женщин в постменопаузе: клинические формы и дифференциальная диагностика
Журнал: Российский вестник акушера-гинеколога. 2013;13(4): 89‑94
Зайдиева Я.З. Гиперандрогения у женщин в постменопаузе: клинические формы и дифференциальная диагностика. Российский вестник акушера-гинеколога. 2013;13(4):89‑94.
Zaĭdieva IaZ. Hyperandrogenism in postmenopausal women: clinical forms and differential diagnosis. Russian Bulletin of Obstetrician-Gynecologist. 2013;13(4):89‑94. (In Russ.).
Наличие клинических и/или биохимических данных, свидетельствующих об избытке андрогенов у женщин в постменопаузе, требует проведения тщательной дифференциальной диагностики для постановки правильного диагноза. Врачам необходимо иметь возможность разграничить изменения, характерные для нормального процесса старения, от возможной патологии у пожилых женщин. В данной статье обсуждаются оценка и лечение гирсутизма и гиперандрогении у женщин в период постменопаузы. Избыток андрогенов, возможно, имеет отдаленные отрицательные последствия для здоровья, и потому его следует выявлять и лечить.
Гиперандрогения - состояние, связанное с избыточной секрецией андрогенов и/или их усиленным воздействием на организм, которое у женщин чаще всего проявляется вирилизацией (появление мужских черт).
У женщин циркулирующие в крови андрогены (группа стероидных гормонов) в норме синтезируются в яичниках и надпочечниках, а также путем периферической конверсии андростендиона (АНД) и дегидроэпиандростерона (ДГЭА) в тестостерон (Т). В клинической практике большое значение имеют следующие андрогены и их предшественники: тестостерон, дигидротестостерон (ДГТ), 17-ОН-прогестерон (17-оксипрогестерон), АНД, дегидроэпиандростерон-сульфат (ДГЭАС).
Среди всех эндокринных заболеваний в гинекологической практике чаще всего встречаются патология щитовидной железы и рассматриваемая нами гиперандрогения. Для понимания данной проблемы необходимо обратиться к схеме синтеза андрогенов, как можно более упростив ее. Весь процесс в основном контролируется гормонами гипофиза - АКТГ (аденокортикотропным гормоном) и ЛГ (лютеинизирующим гормоном). Синтез всех стероидных гормонов начинается с превращения холестерина в прегненолон. Важно понимать следующее: этот этап происходит во всех стероидпродуцирующих тканях! Остальные процессы также в той или иной степени происходят во всех органах, имеющих отношение к стероидогенезу, однако в результате разными органами продуцируются как одинаковые, так и разные стероидные гормоны.
Кроме того, необходимо добавить, что продукция стероидных гормонов может происходить не только в эндокринных органах, но также и на периферии. В частности, для женщины важную роль в продукции стероидов играет подкожная жировая клетчатка.
Большинство врачей не считают необходимой оценку уровней андрогенов у женщин в постменопаузе при наличии клинических симптомов или биохимически подтвержденного их повышения из-за отсутствия взаимосвязи их уровней с различными изменениями в организме, возникающими в период естественного процесса старения. Однако при наличии клинических симптомов гиперандрогении следует обязательно проводить дифференциальную диагностику заболеваний, которые приводят к избытку андрогенов у женщин в постменопаузе. Рассмотрение возможных ключевых моментов в анамнезе, при физикальном обследовании и соответствующей лабораторной и рентгенологической оценке приведет к подбору оптимальных стратегий лечения выявленных причин гиперандрогении.
Ведущие признаки и симптомы

Большинство женщин с гиперандрогенией в период постменопаузы жалуются на гирсутизм в области лица и/или туловища вместе с потерей волос на голове. Подробный анамнез имеет решающее значение в разграничении прогрессирующего гирсутизма от истинной вирилизации. Гирсутизм - это избыточный рост терминальных волос, особенно на подбородке, верхней губе и в области белой линии живота [13]. Степень гирсутизма можно оценить по шкале Ферримана-Галлвея (1961), которая описывает степень роста волос в баллах от 0 до 4 в 9 областях тела. Считается, что у женщин в период пременопаузы степень гирсутизма равна 8 баллам и более, хотя в постменопаузе общий балл не обладает такой достоверностью. Вирилизация - комбинация выраженного гирсутизма вместе с облысением по мужскому типу, анаболическим (андроидным) типом ожирения, снижением тембра голоса и клиторомегалией (≥1,5×2,5 см) [13]. Наличие симптомов вирилизации предполагает выраженную гиперандрогению и необходимость проведения обследования для обнаружения опухоли (см. таблицу).
Синдром поликистозных яичников (СПКЯ)
СПКЯ (синдром Штейна-Левенталя) - сочетание олигоменореи или аменореи и двусторонних множественных кист яичников. При этом заболевании чаще всего встречаются нарушение менструального цикла, бесплодие, гирсутизм и ожирение [4]. Диагноз ставится при наличии гиперандрогении и хронической ановуляции [2]. При СПКЯ повышен риск развития инсулинорезистентности и гиперинсулинемии; сахарный диабет наблюдается у 20% больных.
Женщины с СПКЯ составляют особую группу, так как данное заболевание сохраняется вплоть до периода менопаузального перехода. В виду того что синтез Т яичниками снижается при естественной менопаузе постепенно [6], симптомы гиперандрогении, связанные с СПКЯ, могут сохраняться. Тщательно собранный анамнез, подтверждающий регулярность менструального цикла, время проявления симптомов гиперандрогении и прибавки массы тела помогут определить точный диагноз [20]. Поскольку женщины с СПКЯ имеют повышенный риск развития метаболического синдрома, сахарного диабета 2-го типа и гиперпластических процессов в эндометрии [15], должны быть определены методы раннего их выявления и проведено соответствующее лечение.
Гиперандрогения, вызванная ожирением
Известно, что не все женщины с избыточной массой тела имеют СПКЯ. В клинической практике широко распространено сочетание ожирения и симптомов, схожих с СПКЯ, но они сильно отличаются от симптомов классического СПКЯ, в связи с чем была выделена отдельная группа женщин с «гиперандрогенией, вызванной ожирением» [19]. Для таких женщин обычно характерно своевременное наступление менархе и регулярный менструальный цикл, но часто есть связь прибавки массы тела в анамнезе с беременностью без ее снижения до исходного уровня в течение последующих лет. На этом фоне менструальный цикл у женщин с наступлением периода пременопаузы становится нерегулярным. Позже развиваются признаки гиперандрогении, часто с образованием кист в яичниках, но без повышенного соотношения ЛГ/ФСГ, характерного для СПКЯ. Предполагают, что избыток ароматазы и 5α-редуктазы в жировой ткани вызывает местное повышение уровня эстрогенов и андрогенов, что приводит к нерегулярному циклу, гирсутизму и акне соответственно. Схожий сценарий наблюдается при достижении критической пороговой массы тела в период постменопаузы. В этом случае анамнез и время прибавки массы тела также помогут разграничить гиперандрогению при СПКЯ или вызванную ожирением. Стигмы, характерные для СПКЯ, помогают поставить диагноз, но они не исчезают при снижении массы тела. Как показывает клиническая практика, фенотипические симптомы гиперандрогении, вызванные ожирением, при снижении массы тела исчезают.
Дифференциальная диагностика СПКЯ и гиперандрогении, вызванной ожирением, у женщин в постменопаузе достаточно сложна. В то время как уровни Т резко падают при хирургической менопаузе, естественная менопауза приводит к более постепенному снижению уровня Т с возрастом (H. Judd и соавт., 1974). S. Winters и соавт. [26] доказали, что уровни Т всегда выше у женщин с СПКЯ по сравнению с женщинами контрольных групп соответствующего возраста. Однако недостатком данного исследования является то, что самая старшая возрастная группа включала женщин только от 47 до 57 лет и не была разделена по статусу относительно возраста наступления менопаузы. Не было также данных по изучению детального изменения уровней андрогенов у женщин с СПКЯ после менопаузы по сравнению с такими данными у женщин с ожирением с таким же индексом массы тела (ИМТ), не имевших СПКЯ.
Синдром Кушинга
Синдром Кушинга - состояние, характеризующееся избытком продукции глюкокортикоидов надпочечниками. У большинства больных отмечается увеличение массы тела с отложением жира на лице (лунообразное лицо), шее, туловище. Характерными клиническими проявлениями являются гирсутизм, нарушение менструальной функции, бесплодие, атрофия мышц конечностей, остеопороз, снижение иммунорезистентности, нарушение толерантности к глюкозе, депрессия и психозы. Существуют следующие варианты синдрома:
А. АКТГ-зависимый синдром гипофизарный - чаще всего опухолевое поражение гипофиза - и эктопический - секреция АКТГ (или кортиколиберина) опухолью любой локализации.
Б. АКТГ-независимый синдром надпочечниковый - рак, аденома или гиперплазия коры надпочечников - и экзогенный - самолечение препаратами глюкокортикоидов или вынужденный прием данных препаратов при другой патологии.
Гипертекоз (синдром Френкеля)
Гипертекоз яичников - двустороннее разрастание стромы яичников за счет пролиферации и лютеинизации. Клинически проявляется высокой вирилизацией женского организма вследствие выработки стромальными клетками яичника ДГЭА, андростендиона и Т. В плазме значительно повышено содержание эстрона (Э1). Соотношение ЛГ и ФСГ в норме или снижено. Кломифеновая проба отрицательная.
Еще в 1942 г. J. Gains отметил связь между клиническими проявлениями вирилизации и наличием островков лютеинизированных клеток в строме яичников. Впоследствии это явление стали называть стромальным гипертекозом. По мнению Е.Г. Иванова, гипертекоз - это наличие группы лютеинизированных клеток, которые расположены участками или диффузно в строме, захватывают область химуса. В отличие от СПКЯ, при гипертекозе кистозно атрезирующиеся фолликулы имеются в небольшом количестве либо отсутствуют, а белочная оболочка чаще всего не утолщена.
Гипертекоз является тяжелой формой СПКЯ, приводит к чрезмерной продукции андрогенов стромальными клетками яичников (S. Braithwaite и соавт., 1978). Это заболевание может проявиться у женщин как в пре-, так и в постменопаузе. Хотя основная этиология заболевания неясна, но считается, что причина гипертекоза яичников связана с повышенным уровнем гонадотропинов, в основном, ЛГ [12]. Яичники могут иметь нормальные размеры для пременопаузы, но не для постменопаузы; поэтому при интерпретации результатов УЗИ необходимо учитывать возраст женщины и период климактерия [3]. При гипертекозе наряду с гиперсекрецией андрогенов также повышена продукция эстрогенов на периферии, и эти женщины часто относятся к группе риска развития гиперплазии эндометрия и карциномы яичников [12]. Наличие симптомов СПКЯ в анамнезе может помочь при проведении дифференциальной диагностики. Женщины с гипертекозом имеют риск развития метаболических осложнений - гиперлипидемии и сахарного диабета 2-го типа [12, 16], хотя крупных исследований, в которых бы изучались их частота, клинические проявления и отдаленные последствия у таких пациенток в постменораузе, не проводилось.
Таким образом, гипертекоз - это неопухолевая патология яичников, при которой в их строме появляются пролиферирующие островки лютеинизированных клеток. При гипертекозе продукция Т, АНТ и ДГЭА возрастает в большей степени, чем при СПКЯ. Уровни ЛГ и ФСГ могут быть нормальными или сниженными, а степень инсулинорезистентности и гиперинсулинемии превышает таковую при СПКЯ.
Опухоли яичников или надпочечников
У женщин с опухолями яичников или надпочечников имеются быстро прогрессирующие признаки вирилизации, обусловленные высоким уровнем андрогенов.
Андробластома - односторонняя опухоль яичника, встречается в любом возрасте. Оказывает на организм женщины двухфазное воздействие: дефеминизацию, а затем маскулинизацию. Характерна гипоменорея, затем аменорея, выраженный гирсутизм, гипертрофия клитора, гипоплазия матки и молочных желез; в менопаузе - облысение, изменение тембра голоса.
Гистологическая картина ткани опухолей яичников у больных с гиперандрогенией представлена опухолевыми клетками Лейдига, Сертоли и стероидными клетками яичника (L. Morgan, 1990). Число случаев этих опухолей составляет 10% среди всех опухолей яичников. В источниках литературы описаны менее 150 случаев опухолей, состоящих только из опухолевых клеток Лейдига [11]. Данный тип опухоли продуцирует T и/или другие фракции андрогенов наряду с эстрогенами или без последних.
Врожденная гиперплазия коры надпочечников
Врожденная гиперплазия коры надпочечников (ВГКН) - наследственное генетическое заболевание, связанное с наследственным дефицитом 11β- или 21-гидроксилазы.
В зависимости от этнической принадлежности пациентки различают 2 формы ВГКН: врожденная гиперплазия коры надпочечников, классическая (редко) или неклассическая (чаще), может быть причиной гиперандрогении в постменопаузе [22]. Семейный анамнез раннего пубархе, низкорослость и этническая принадлежность (повышенный риск у эскимосов, ашкенази, испанцев, итальянцев) позволяют предположить ВГКН, для подтверждения которой необходимо проведение лабораторной и инструментальной оценки. При этом повышается синтез кортикостероидов, что приводит к стимуляции выделения гипофизом АКТГ, а это в свою очередь ведет к усиленной секреции андрогенов корой надпочечников с последующей ее гиперплазией. Наряду с вирилизацией у больных развиваются слабость, мышечные боли, снижение артериального давления, пигментация кожных покровов. Уровень 17-ОКС в моче снижен, но при увеличении общего уровня 17-КС увеличивается уровень ДГЭА. Рентгенологически тень надпочечников более интенсивна при гиперплазии, чем при опухоли.
Лечение [19] ингибиторами ароматазы при раке молочной железы может спровоцировать гиперандрогению у женщин в постменопаузе с ранее неизвестной ВГКН.
Ятрогенная гиперандрогения
Применение лекарственных препаратов и/или пищевых добавок, а также гель с Т, используемый партнером, может привести к гирсутизму у женщин в постменопаузе [13]. Для лечения менопаузальных симптомов некоторые женщины используют комбинацию эстрогенов с Т или ДГЭА, которые в фармакологических дозах вызывают гирсутизм и другие симптомы гиперандрогении. Тщательный анализ лекарственных препаратов, пищевых добавок и гормональной терапии партнера поможет выявить эти обратимые причины.
Лабораторные исследования
Изучение анамнеза и физикальный осмотр проводят перед лабораторным и инструментальным исследованиями. Наиболее важным лабораторным исследованием для выявления гиперандрогении является определение уровней тестостерона и ДГЭАС [13]. Определение ДГЭА малоинформативно, так как этот гормон имеет неустойчивый ритм в течение суток и меняется при стрессе. Большинство коммерческих тестов были разработаны для определения общего Т у мужчин, поскольку порог чувствительности уровня Т у женщин очень низкий [17]; тем не менее уровни Т, значительно превышающие пределы нормального диапазона, могут быть использованы для диагностики гиперандрогении и контроля за ее динамикой во время лечения [17, 22]. Учитывая, что секреция андрогенов в яичниках и надпочечниках снижается с возрастом [6], следует критически относиться к достоверности оценки уровня андрогенов при гиперандрогении в пожилом возрасте. Относительно недавно разработаны тест-системы для определения уровня Т методом масс-спектрометрии, которые более чувствительны к низким уровням Т, чем радиоиммунный метод. С появлением этого метода появилась возможность определения нормального или повышенного уровня андрогенов в течение всей жизни женщины [18]. Имеются данные, свидетельствующие о том, что гиперпролактинемия может быть причиной гирсутизма; в связи с этим необходимы определение и контроль уровня пролактина у женщин различных возрастных групп [13]. Основным диагностическим тестом синдрома Кушинга является определение уровня свободного кортизола в суточной моче или слюне после пробы с 1 мг дексаметазона [14, 23]. Больные с аденомой надпочечников в большинстве случаев имеют нормальные показатели свободного кортизола. В связи с этим проба с дексаметазоном является идеальным тестом для выявления пациенток с субклиническими формами синдрома Кушинга [28]. После некоторых сомнений и споров в прессе по поводу того, имеются ли пороговые уровни Т и ДГЭАС, определяющие наличие опухолей яичников или надпочечников, было установлено, что при повышенных уровнях T >200 нг/дл (6,94 нмоль/л) или ДГЭАС >800 нг/мл (2171 нмоль/л) можно предполагать наличие опухолей яичников или надпочечников. Однако результаты проведенного обследования 478 женщин (в пре- и постменопаузе) с признаками и симптомами гиперандрогении противоречивы. В 11 (2-3%) случаях был выявлен высокий уровень T >250 нг/дл (8,68 нмоль/л) и только у 1 из 11 выявлена опухоль яичника. Из 10 женщин с уровнем ДГЭАС >600 нг/мл (1628 нмоль/л) у 9 была установлена опухоль надпочечника [24]. В другом исследовании, в котором принимали участие 60 женщин с диагностированной андрогенпродуцирующей опухолью яичников, у большинства из их числа уровень T колебался от 100 до 200 нг/дл (3,47-6,94 нмоль/л) [1]. Результаты данного исследования свидетельствуют о том, что андрогенпродуцирующие опухоли яичников встречаются и при уровне T ≤200 нг/дл. С целью проведения дифференциальной диагностики между опухолями яичников и надпочечников некоторые исследователи предлагают проводить 2-5-дневные тесты с минимальными дозами дексаметазона [9]. Снижение изначально повышенных уровней Т, АНД или ДГЭАС позволяет установить яичниковый генез гиперандрогении. Исследования у женщин с гиперандрогенизмом в постменопаузе весьма ограничены, в связи с этим данная проблема требует дальнейшего изучения.
Подходы к лечению постменопаузальной гиперандрогении
Методы лечения зависят от этиологии гиперандрогении. Медикаментозное и/или хирургическое лечение первичного заболевания (опухоли яичников или надпочечников, гипертекоза, ятрогенных причин, ВГКН или опухоли гипофиза) оказывает положительный эффект, проявляющийся снижением гиперандрогении. Аналоги ГнРГ могут быть использованы как в диагностических, так и в лечебных целях. Если уровни андрогенов снижаются в ответ на введение аналогов ГнРГ, опухоль считается гонадотропинзависимой; однако это не было подтверждено контролируемыми исследованиями.
Лечение гирсутизма рассмотрено в последних рекомендациях Общества эндокринологов и включает применение таких препаратов, как спиронолактон или флутамид, оказывающих антиандрогенный эффект [13]. Хотя ципротерона ацетат - прогестаген мощного антиандрогенного действия не используется для лечения гиперандрогении в США, он широко распространен в Европе [13]. Было установлено, что сенситайзеры инсулина подавляют андрогены у женщин в пременопаузе с СПКЯ [10], хотя данных об их влиянии на женщин в постменопаузе не существует.
Кардиометаболические последствия гиперандрогении. Надо ли лечить?
Читайте также:
