Метод сцепления маркеров для обнаружения наследственных болезней - мутаций
Добавил пользователь Владимир З. Обновлено: 22.01.2026
Своевременная диагностика наследственных заболеваний важна как в детстве, так и в зрелом возрасте. Врожденные болезни различной этиологии составляют весомую долю в списке общих патологий, однако не всегда удается найти источник тех или иных клинических проявлений в геноме. Диагностика может потребовать усилий нескольких специалистов ввиду большого многообразия форм генетических заболеваний.
Именно поэтому к поиску причин сбоев в работе организма нужно подходить комплексно на базе современной клиники, обладающей необходимым диагностических оборудованием, лабораторией, а также штатом врачей с соответствующей практикой. Некоторые наследственные заболевания встречаются крайне редко, и только внимание и опыт специалиста позволят определить причину патологии и поставить верный диагноз.
Этапы лабораторной диагностики наследственных заболеваний
Диагностика наследственных заболеваний проводится на основании результатов нескольких разных исследований. Во внимание обязательно берутся значения лабораторных анализов, клинических тестов, а также генетическая предрасположенность к тем или иным недугам. Сложность диагностики заключается в том, что любая наследственная болезнь может проявлять себя как соматическое заболевание. Поэтому для точного установления диагноза важно обращаться к опытному квалифицированному специалисту.

Чтобы правильно сделать заключение, врач должен провести полное обследование пациента. Обычно оно начинается с назначения общих клинических анализов, а в случае выявления любых отклонений от нормы доктор предлагает провести дополнительные обследования. Важный этап - изучение истории болезни пациента, особенно когда речь идет о генетических заболеваниях. Например, если обследуется ребенок, врач обязательно расспрашивает о том, как проходили беременность и роды, не было ли проблем со здоровьем у матери и ребенка в раннем возрасте. Любой нюанс может стать решающим при постановке диагноза.
Рекомендуемые статьи по теме:
Задавая вопросы родителям, доктор обязательно уточняет их возраст, род занятий, образ жизни, наличие хронических заболеваний. К примеру, ранняя диагностика такой генетической патологии, как синдром Дауна, проводится на основании данных о матери ребенка, в частности, ее возрасте на момент зачатия. Этот фактор имеет значение и при подозрениях на синдром Марфана и синдром Шерешевского-Тернера, которые характеризуются хромосомными мутациями, обуславливающими аномалии физического развития.
Специалист может заподозрить наличие наследственных заболеваний в том случае, если у пациента при ранней диагностике наблюдаются редкие специфические симптомы или патологии:
наличие частичного или полного вывиха хрусталика глаза в большинстве случаев указывает на развитие синдрома Вейля-Марчезани;
патологии полового развития зачастую обусловлены хромосомными заболеваниями;
значительная гепатомегалия наблюдается при галакто-, фруктоземии и пр.;
отсутствие менструаций у девушек является признаком синдрома Шерешевского-Тернера;
мукополисахаридоз диагностируется в большинстве случаев при запавшей переносице;
мышечная аплазия рук является признаком синдрома Эдвардса.
Клинической диагностике наследственных заболеваний обычно предшествует полная антропометрия пациента. В обязательном порядке проводят измерения окружности головы, длины рук, ног и туловища, показателей роста и веса, объема грудной клетки и т. д. Если доктор подозревает наличие у пациента хромосомных заболеваний, он может назначить дополнительную дерматоглифику, то есть тщательное исследование кожных покровов, узоров на ладонях, ступнях и пальцах.
Диагностика наследственных заболеваний в современной медицине включает такие методы, как иммунологический, клинико-биохимический, радиологический. Они позволяют выявить редкие и опасные болезни, такие как фенилкетонурию и муковисцидоз.
Помимо этого, наследственные болезни диагностируют с помощью скрининговых исследований, а также иммуно- и цитогенетических методов.
Методы диагностики наследственных заболеваний
Генеалогический метод диагностики наследственных заболеваний
В Московском научно-исследовательском институте педиатрии и детской хирургии такой метод диагностики наследственных заболеваний, как генеалогическое исследование, используется с 70-х годов ХХ века и имеет огромную значимость в их лечении.

Суть генеалогического метода заключается в том, что генетиком составляется генеалогическая карта, которая позволяет выявить определенные закономерности в передаче заболеваний от предков потомкам. На основании данной карты можно делать предположения, является ли недуг наследственным. Генеалогический метод можно использовать для прогнозирования вероятности рождения детей с различными болезнями.
Пациент проходит специальный опрос с целью уточнения у него подробной информации о состоянии здоровья его родственников. Если обследуется ребенок, анкету заполняет мать, причем обязательно учитывается информация о периодах беременности, родов, первого года жизни малыша. Опрос напоминает процедуру сбора анамнеза при посещении терапевта, но более детальную. Если есть такая возможность, то дополнительно проводится беседа с родственниками больного с их личным присутствием.
Предполагается большой объем работы по анализу собранных данных. Это теоретическая база для проведения дальнейших исследований и назначения лечения пациенту. Метод применяется также для определения вероятности рождения детей с отклонениями и патологиями у супружеских пар. С помощью анализа собранной информации можно выявить родственников пациента, которые находятся в группе риска по проявлению конкретных наследственных заболеваний в будущем. В такой ситуации им показано более точное лабораторное обследование.
Молекулярно-генетическая диагностика наследственных заболеваний
Данная методика, по сути, является разновидностью ДНК-диагностики наследственных заболеваний. Она позволяет выявить ошибки в формировании дезоксирибонуклеиновой кислоты. К молекулярно-генетической диагностике относятся:
метод FISH, с помощью которого выявляются генетические мутации;
метод ПЦР, который выявляет различные инфекции в организме, даже если их влияние очень мало;
метод CGH, применяемый для выявления онкологических заболеваний;
метод SKY, суть которого заключается в использовании при исследовании специального красящего вещества, способного выделять определенные участки ДНК, имеющие патологии.
Данные методы используются в пренатальной диагностике наследственных заболеваний, что позволяет выявить патологии и отклонения в развитии еще до рождения ребенка. Также подобные исследования делают при проведении искусственного оплодотворения, чтобы спрогнозировать возможные заболевания плода до помещения зародыша в матку матери.

Молекулярно-генетические методы широко используются не только в пренатальной диагностике врожденных и наследственных заболеваний, но также для выявления таких болезней, как вирус иммунодефицита человека, туберкулез, вирусный гепатит, энцефалит и других. В качестве биоматериала для исследования подходят различные жидкости, выделяемые организмом (слюна, мокрота, кровь). ДНК-исследования позволяют поставить точный диагноз и назначить наиболее эффективное лечение. К примеру, с их помощью выявляют чувствительность вирусов и бактерий к определенным препаратам, чтобы подобрать подходящую медикаментозную терапию.
Биохимические методы
Диагностика наследственных заболеваний обмена веществ возможна с помощью метода биохимического анализа. Его суть заключается в обнаружении в организме человека продуктов несовершенного метаболизма. Таким способом можно диагностировать фенилкетонурию, нарушения обмена пуринов и пиримидинов, гликогеноз.
Обнаружить недуги, связанные с нарушением обмена веществ, можно уже в самом раннем возрасте. Обычно у детей с подобными проблемами наблюдаются задержка развития, нарушение процессов пищеварения, различные аллергические реакции. Биохимический анализ делается по крови и моче.
Описываемый метод предполагает двухэтапное проведение исследования. Сначала делается общий анализ, к примеру, анализ на фенилкетонурию у всех новорожденных или общие обследования для всех учащихся школ и воспитанников детских садов. В случае выявления отклонений результатов анализа от нормы детям назначают углубленное обследование, которое проходит в специальных лабораториях.
Стоит отметить, что биохимические методы анализа позволяют выявить не только генетические заболевания обмена веществ, но и другие серьезные недуги. Так, к примеру, в США ученые разрабатывают тест, который позволил бы диагностировать аутизм у детей раннего возраста по наличию в крови метаболитов. Сейчас эта болезнь может быть выявлена только путем проведения ряда психометрических тестов в более старшем возрасте ребенка.
Цитогенетический метод
Цитогенетическое исследование относится к методам пренатальной диагностики наследственных заболеваний. Это также один из самых старых способов выявления генетических болезней, который заключается в исследовании структуры хромосом под микроскопом на предмет патологий. В частности, цитогенетическое исследование проводится всем беременным женщинам старше 35 лет, а также будущим мамам, попадающим в зону риска по наследственным заболеваниям. Данный анализ врач может назначить пациентке и в том случае, если он заметит какие-либо отклонения в развитии плода.

Для проведения скрининг-диагностики наследственных заболеваний цитогенетическим методом у пациента берут кровь, которая проходит предварительную подготовку. Так, если в обычном состоянии хромосомы скручены, и определить участки с повреждениями на них практически невозможно, то после ввода специального препарата, способствующего раскручиванию нити хромосомы, удается выявить отклонения в ее строении.
Данная методика исследования позволяет проводить диагностику наследственных заболеваний на стадии развития плода в период беременности, а также выявлять нарушения репродуктивной функции мужчин и женщин, особенно если все остальные анализы не позволяют поставить диагноз.
Дерматоглифика
Многие слышали о таком методе исследования, как дактилоскопия - изучение уникального рисунка на пальцах. Он относится к дерматоглифике. В эту группу методов исследования входят также пальмоскопия, то есть изучение рисунка на ладонях, и плантоскопия - изучение рисунка кожи на стопах.
Фундаментальные исследования в данной области провел чешский физиолог Я. Пуркинье, который представил научному сообществу классификацию пальцевых узоров. Он смог выявить, что определенные изменения рисунка на коже могут свидетельствовать о наличии и развитии генетических болезней. Многие наследственные заболевания, такие как синдром Нейджели-Франческетти-Ядассон, синдром Дауна, синдром Рубинштейна-Тейби, и даже гипертонию, шизофрению и онкологию можно обнаружить при диагностике по изменению расположения борозд на коже пальцев.
Рекомендуем
Дерматоглифика может проводиться во время общего осмотра пациента в специальных генетических центрах.
Метод выявления гетерозиготного носительства
Некоторые генетические заболевания связаны с нарушениями только в одном гене. Они имеют название моногенные заболевания. Сюда можно отнести определенные нарушения обмена веществ, дисфункцию иммунной системы, болезни ЦНС. Наследственную информацию ребенку передают мать и отец, поэтому вполне возможна ситуация, что у совершенно здоровых родителей ребенок имеет определенные проблемы со здоровьем, так как предки передали ему поврежденные гены. Метод позволяет определить, являются ли родители носителями наследственных заболеваний, а также спрогнозировать риски рождения детей с патологиями.
Существует ряд болезней, которые передаются детям, даже если только один из родителей является их носителем. Поэтому в период планирования беременности супругам необходимо проконсультироваться у генетика, чтобы определить риски рождения детей с генетическими патологиями.
Наследственные болезни нередко бывают обусловлены полом, то есть могут проявляться только у детей определенной половой принадлежности. Метод выявления гетерозиготного носительства позволяет оценить и подобные нарушения развития плода.
Генетическое прогнозирование
Многие заболевания являются многофакторными, то есть развиваются под влиянием большого количества причин. Так, генетические болезни обуславливают предрасположенность человека к определенному недугу, однако воздействие тех или иных факторов может как ускорить развитие болезни, так и не допустить ее. К таким факторам относятся экологическая ситуация, рацион питания человека, условия его проживания, род деятельности и т. д.
Генетическое прогнозирование позволяет определить вероятность возникновения и развития заболеваний посредством проведения медико-генетических исследований и консультирования. В настоящее время подобные обследования проводятся супружеским парам во время планирования беременности, людям, находящимся в зоне риска по определенным заболеваниям, например, курильщикам - с целью определения вероятности развития рака легких и т. п.
Особенности пренатальной диагностики наследственных заболеваний человека
Перинатальная диагностика наследственных заболеваний представляет особый интерес для исследования и заслуживает отдельного внимания. Это вид обследования, который позволяет обнаружить наследственные заболеваний плода в период беременности матери. Именно генетические отклонения становятся причиной младенческой смертности в 7 % случаев. Поэтому своевременное выявление болезней может позволить вовремя начать лечение или даже прооперировать плод в материнской утробе.
Проведение пренатальной диагностики назначается в следующих случаях:
Наличие у родителей родственников с генетическими заболеваниями.
Возраст матери старше 35 лет.
Выявленное генетическое отклонение у одного из родителей, обусловленное полом.
Выявленная гетерозиготность по ряду заболеваний одного из родителей.
Выкидыши в анамнезе по неустановленным причинам.
В качестве методов пренатальной диагностики выступают ультразвуковое исследование плода, генетический анализ околоплодной жидкости или пуповинной крови, биохимическое исследование крови беременной женщины, проба ворсинчатого хориона и т. д. Врач определяет, какие именно способы обследования необходимо провести конкретному пациенту.
Благодаря тому, что большинство наследственных заболеваний в настоящее время можно выявить еще в период беременности, у родителей появляется шанс вовремя начать лечение и избежать проблем со здоровьем ребенка в будущем. На этапе планирования беременности генетические исследования позволяют определить риски возникновения тех или иных патологий, принять правильное решение относительно профилактики заболеваний, скорректировать образ жизни, чтобы в будущем иметь здоровое потомство.
3 вида профилактики диагностированных наследственных заболеваний
Еще сто лет назад многие наследственные болезни считались приговором. Однако благодаря развитию медицины и генетики в наше время многие заболевания можно диагностировать и начать своевременно лечить, чтобы избежать серьезных осложнений в будущем.

Наследственные болезни подразделяют на три большие группы: требующие симптоматического лечения, требующие этиологического лечения и требующие патогенетического лечения. Врач может назначать подходящие методы терапии в зависимости от множества факторов, таких как возраст пациента, особенности протекания недуга, наличие других сопутствующих заболеваний.
Важно понимать, что выбор медикаментозной терапии в случаях, когда речь идет о генетических заболеваниях, - сложный и ответственный процесс. К тому же чаще всего лечение необходимо проводить на постоянной основе.
Профилактические меры:
Первичная профилактика. Это мероприятия, направленные на повышение вероятности рождения здорового потомства в период планирования беременности. К ним можно отнести здоровый образ жизни и выбор правильного возраста для зачатия, который находится в диапазоне 21-35 лет.
Вторичная профилактика. Речь идет о раннем прерывании беременности с патологиями, которые могут быть выявлены у плода с помощью методов пренатальной диагностики.
Третичная профилактика. Это мероприятия коррекции выявленных патологий в период вынашивания плода, а также в раннем детском возрасте. Некоторые методы лечения, назначенные во время беременности, способны нормализовать состояние плода и добиться выраженного снижения уровня патологических процессов. Также определенную степень эффективности показывают методы лечения наследственных болезней в период доклинической стадии развития.
Достижения биохимии и молекулярной генетики современной медицины позволяют добиться значительных результатов в диагностике и лечении наследственных заболеваний. Это достигается за счет своевременного назначения медикаментозной терапии.
Почему клиенты выбирают Клинику эстетической медицины и Салон красоты Veronika Herba:
Это Клиника эстетической медицины и Салон красоты, где вы сможете ухаживать за собой по умеренной стоимости, при этом вашим лицом и/или телом будет заниматься не рядовой косметолог, а один из лучших дерматологов в Москве. Это совершенно другой, более высокий уровень сервиса!
Получить квалифицированную помощь вы можете в любое удобное для себя время. Клиника эстетической медицины и Салон красоты работает с 9:00 до 21:00 без выходных. Главное — заранее согласовать с врачом дату и час приема.
Косвенное выявление мутаций
на генетической карте, применяют косвенное выявление мутаций. Фактически это соответствует диагностике с помощью метода сцепления генов.
Косвенная ДНК-диагностика, по существу, сводится к анализу полиморфных генетических маркеров у больных и здоровых членов семьи. Эти маркеры должны быть расположены в том же хромосомном регионе, где и ген болезни, т.е. они сцеплены. Такими маркерами могут быть участки ДНК, существующие в популяции в нескольких аллельных вариантах. Различия могут быть по составу нуклеотидов, по числу динуклеотидных повторов. На основе вариабельности состава маркерных участков ДНК можно дифференцировать материнское или отцовское происхождение конкретного варианта маркера, сцепленного с геном болезни. Сцепление означает, что маркер и ген болезни располагаются близко друг к другу; они передаются в составе одного хромосомного сегмента. Благодаря анализу полиморфных генетических маркеров можно проследить в ряду поколений наследование каждой из родительских хромосом.
Технические приемы в косвенной диагностике те же самые, что и в прямой (получение ДНК, рестрикция, электрофорез и т.д.). Естественно, к этому добавляется математический анализ сцепления признаков.
Использование косвенных подходов оказалось возможным благодаря существованию в геноме полиморфных участков (локусов) ДНК. Нуклеотидные замены достаточно часто встречаются в некодирующих участках ДНК. Значительное число нуклеотидных замен приводит к изменению мест рестрикции. Эти изменения можно выявить с помощью блот-гибридизации по Саузерну, поскольку изменяется длина рестриктных фрагментов. Эта разновидность полиморфизма ДНК получила название полиморфизма по длине рестриктных фрагментов.
Расположенный вблизи изучаемого гена или внутри него полиморфный сайт может служить маркером аллельных вариантов этого гена, в том числе маркером патологических мутаций.
Полиморфизм, обусловленный нуклеотидными заменами или делециями, как правило, диаллелен, а, значит, его информационная ценность ограничена. Более информативны кластеры тандемных повторов, которые обусловливают полиморфизм по количеству копий (VNTR - variable number of tandem repeats), так называемый полиморфизм мини- и микросателлитных последовательностей.
Микросателлиты - короткие тандемные повторы, обычно двугексануклеотидные. Самый распространенный из них - CA-повтор. Показано, что кластеры СА-повторов встречаются в среднем 1 на 30 000 пар нуклеотидов. Они локализованы, как правило, в некодирующих районах ДНК. Блоки СА-повторов имеют менделевское наследование в семьях и не обнаруживают новых мутаций (рис. 9.20). Немаловажным положительным фактором является относительная простота обнаружения таких повторов в геноме человека. Кроме СА-повторов, достаточно распространены GA-повторы и другие кластеры тандемных повторов (ТТТА)хп, (TCTA)xn, (TTTC)xn, также обнаруживающие вариабельность по числу повторов. Широкая распростра-
ненность в геноме (частота различных микросателлитов, взятых вместе, составляет 1 на 6000 пар нуклеотидов) и высокий уровень полиморфизма делают микро- и мини-сателлиты идеальными полиморфными маркерами для картирования генов наследственных заболеваний и проведения косвенной ДНК-диагностики.
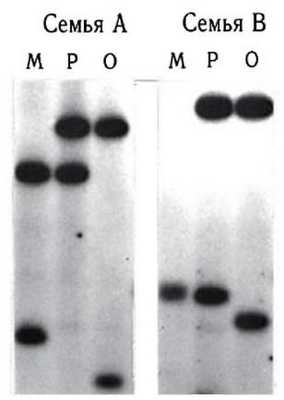
Рис. 9.20. Семейный анализ фрагментов ДНК с помощью блотгибридизации по Саузерну: М - мать, Р - ребенок, О - отец
Полиморфные ДНК-маркеры и интегральная карта их расположения позволяют определить и проследить в поколениях хромосому, несущую патологический ген, а также подробнейшим образом охарактеризовать определенный хромосомный район, выявить субмикроскопические перестройки, определить наименьший район их перекрывания и локализовать ген-кандидат, ответственный за заболевание.
Основной недостаток косвенных методов диагностики - обязательное предварительное изучение генотипа (гаплотипа) хотя бы одного пораженного родственника. В случае отсутствия пораженных
родственников, доступных для обследования, диагностика (за редким исключением) становится невозможной.
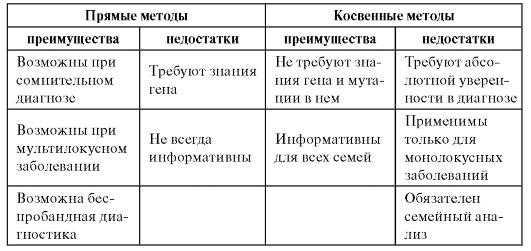
Итак, существует достаточно много молекулярно-генетических методов диагностики наследственных болезней. Эти методы оказались настолько универсальными, что нашли применение не только в медицинской генетике, но и диагностике инфекционных заболеваний. Каждый из представленных в табл. 9.4 методов имеет много вариантов. Одни и те же болезни можно диагностировать разными методами. Можно диагностировать болезнь даже в трудных случаях (невозможность обследования родителей, малое количество биологического материала, отсутствие сведений о гене и т.д.).
Таблица 9.4. Сравнительные характеристики прямых и непрямых методов ДНК-диагностики
Вся методология молекулярно-генетической диагностики наследственных болезней представлена на рис. 9.21 в виде алгоритма.
Поскольку генодиагностика проводится в специализированных, хорошо оснащенных лабораториях и сопряжена с немалыми расходами, для проведения анализа должны быть строгие клинические показания. Лечащий врач и врач-генетик совместно составляют схему обследования больного. Такое взаимодействие, как правило, обеспечивает успех.
Автоматизация существующих методов и разработка принципиально новых подходов к изучению структуры нуклеиновых кислот
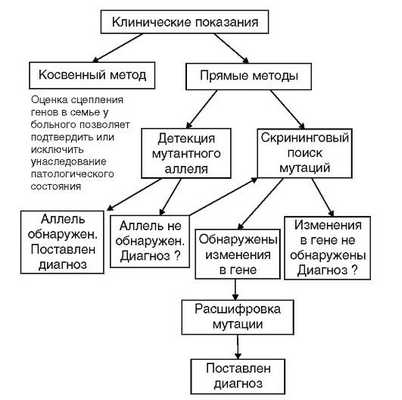
Рис. 9.21. Алгоритм генодиагностики наследственных заболеваний
наряду с ускоренными темпами изучения генома человека и клонирования генов, ответственных за развитие моногенной патологии, позволяют прогнозировать появление в недалеком будущем средств диагностики большинства известных наследственных болезней человека.
Генетические нарушения у человека и методы их выявления

Генами называются участки ДНК, в которых закодирована структура всех белков в теле человека или любого другого живого организма. В биологии действует правило: «один ген - один белок», то есть в каждом гене содержится информация только об одном определенном белке.
В 1990 году большая группа ученых из разных стран начала проект под названием «Геном человека». Он завершился в 2003 году и помог установить, что человеческий геном содержит 20-25 тысяч генов. Каждый ген представлен двумя копиями, которые кодируют один и тот же белок, но могут немного различаться. Большинство генов одинаковые у всех людей - различается всего 1%.
ДНК находится в клетке внутри ядра. Она особым образом организована в виде хромосом - эти нитеподобные структуры можно рассмотреть в микроскоп с достаточно большим увеличением. Внутри хромосомы ДНК намотана на белки - гистоны. Когда гены неактивны, они расположены очень компактно, а во время считывания генетического материала молекула ДНК расплетается.
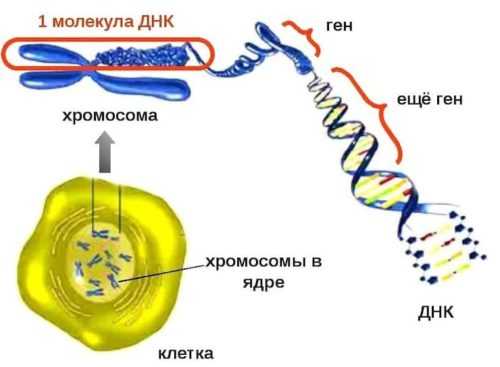
В клетках человека есть структуры, которые называются митохондриями. Они выполняют роль «электростанций» и отвечают за дыхание. Это единственные клеточные органеллы, у которых есть собственная ДНК. И в ней тоже могут возникать нарушения.
Весь набор хромосом в клетке называется кариотипом. В норме у человека он представлен 23 парами хромосом, всего их 46. Выделяют два вида хромосом:
- 22 пары аутосом одинаковы у мужчин и женщин. В каждой паре хромосомы имеют одинаковую длину и содержат одинаковые наборы генов.
- Одна пара половых хромосом. У женщин это две X-хромосомы. Одна из них неактивна и плотно свернута - ее называют тельцем Барра. У мужчин одна половая хромосома представлена X-хромосомой, а вторая - Y-хромосомой, она меньше по размерам.
Методы исследования хромосом
Для исследования кариотипа применяют специальный метод - световую микроскопию дифференциально окрашенных метафазных хромосом культивированных лимфоцитов периферической крови.
Этот анализ применяется для диагностики различных хромосомных заболеваний. Он позволяет выявлять такие нарушения, как:
- Грубые изменения в кариотипе - изменение количества хромосом. Например, при синдроме Дауна в клетках ребенка присутствует лишняя хромосома №21.
- Присутствие в организме клеток с разными кариотипами. Это явление называется мозаицизмом.
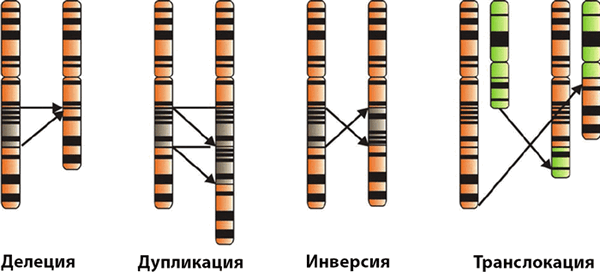
- Хромосомные аберрации - нарушение структуры хромосом, внутрихромосомные и межхромосомные перестройки. Сюда относятся делеции (утрата участка хромосомы), дупликации (удвоение участка хромосомы), инверсии (поворот участка хромосомы на 180 градусов), транслокации (перенос участка одной хромосомы в другую).
Однако с помощью исследования кариотипа можно выявить не все генетические нарушения. Оно не способно обнаружить такие изменения, как:
- микроделеции и микродупликации, когда утрачивается или дублируется очень маленький участок хромосомы;
- болезни обмена, вызванные нарушением последовательности «букв» генетического кода в отдельных генах;
- митохондриальные заболевания, связанные с нарушениями в генетическом материале митохондрий;
- низкопроцентный мозаицизм, когда клеток с неправильным кариотипом очень мало;
- мутации в отдельных генах, которые не приводят к изменению внешнего вида хромосом;
- эпигенетические расстройства, при которых структура хромосом и генов не меняется, но изменяется их функция.
Для получения дополнительной информации, не видимой в световой микроскоп, используют хромосомный микроматричный анализ (ХМА). С его помощью можно изучить все клинически значимые участки генома и выявить изменения в количестве и структуре хромосом, а именно микрополомки (микроделеции и микродупликации).
Во время хромосомного микроматричного анализа применяют технологию полногеномной амплификации и гибридизации фрагментов опытной ДНК с олигонуклеотидами, нанесенными на микроматрицу. Если объяснять простыми словами, то сначала ДНК, которую необходимо изучить, копируют, чтобы увеличить ее количество, а затем смешивают ее со специальными ДНК-микрочипами, которые помогают выявлять различные нарушения.
Эта методика позволяет в одном исследовании выявлять делеции и дупликации участков ДНК по всему геному. Разрешающая способность стандартного ХМА от 100 000 пар нуклеотидов - «букв» генетического кода (в отдельных регионах от 10 000 п. н.).
С помощью ХМА можно выявлять:
- изменения числа хромосом;
- дупликации и делеции, в том числе микродупликации и микроделеции;
- отсутствие гетерозиготности - утрату одной из двух копий гена. Это явление имеет важное значение в онкологии, при болезнях импринтинга (когда активность гена зависит от того, от какого из родителей он получен), аутосомно-рецессивных заболеваниях (связанных с рецессивными генами - о них мы поговорим ниже), близкородственных браках;
- однородительские дисомии, когда в геноме ребенка присутствуют две хромосомы от одного родителя.
Однако, как и предыдущий метод, хромосомный микроматричный анализ имеет некоторые ограничения. Он не позволяет выявлять или ограничен в выявлении таких аномалий, как:
- сбалансированные хромосомные аномалии, когда в хромосомах происходят изменения, которые не приводят к добавлению или утрате генетического материала. К ним относятся инверсии (разворот участка хромосомы на 180 градусов), реципрокные транслокации (обмен участками между хромосомами), небольшие инсерции (вставки в хромосомах);
- мозаицизм, если клеток с нарушениями в кариотипе менее 15%;
- CNV (copy number variation) - повторы небольших участков генома;
- точечные мутации - замены отдельных «букв» генетического кода;
- экспансия (увеличение) повторов коротких участков в ДНК;
- аномалии метилирования - присоединения особых метильных групп к определенным участкам ДНК, которые меняют активность генов.
Мутации в генах и заболевания, к которым они способны приводить
Мутации - это изменения, которые происходят в ДНК как случайным образом, так и под действием разных факторов, например химических веществ, ионизирующих излучений. Они могут затрагивать как отдельные «буквы» генетического кода, так и большие участки генома. Мутации происходят постоянно, и это основной двигатель эволюции. Чаще всего они бывают нейтральными, то есть ни на что не влияют, не приносят ни вреда, ни пользы. В редких случаях встречаются полезные мутации - они дают организму некоторые преимущества. Также встречаются вредные мутации - из-за них нарушается работа важных белков, наоборот, происходят достаточно часто. Генетические изменения, которые происходят более чем у 1% людей, называются полиморфизмами - это нормальная, естественная изменчивость ДНК Полиморфизмы ответственны за множество нормальных отличий между людьми, таких как цвет глаз, волос и группа крови.
Все внешние признаки и особенности работы организма, которые человек получает от родителей, передаются с помощью генов. Это важнейшее свойство всех живых организмов называется наследственностью. В зависимости от того, как проявляются гены в тех или иных признаках, их делят на две большие группы.
- Доминантные гены. Выражаясь простым языком, эти гены более «сильные». Если в клетках присутствует хотя бы одна копия такого гена, его признаки проявятся.
- Рецессивные гены «слабее» доминантных. Если у человека одна копия гена доминантная и одна рецессивная, - проявится признак доминантной. А для проявления рецессивного признака нужно две соответствующих копий.

Например, карий цвет глаз у человека является доминантным. Поэтому у кареглазых родителей с высокой вероятностью родится кареглазый ребенок. Если у одного из родителей глаза карие, а у другого голубые, то вероятность рождения кареглазых детей в такой семье тоже высока. У двух голубоглазых родителей, скорее всего, все дети тоже будут голубоглазыми. А вот у кареглазых родителей может родиться ребенок с голубыми глазами, если у обоих есть рецессивные «гены голубоглазости», и они достанутся ребенку. Конечно, это упрощенная схема, потому что за цвет глаз отвечает не один, а несколько генов, но на практике эти законы наследования зачастую работают. Аналогичным образом потомству могут передаваться и наследственные заболевания.
Как выявляют рецессивные мутации?
Для выявления мутаций, которые передаются рецессивно, используют целый ряд исследований.
Секвенирование по Сэнгеру - метод секвенирования (определения последовательности нуклеотидов, буквально - «прочтение» генетического кода) ДНК, также известен как метод обрыва цепи. Анализ используется для подтверждения выявленных мутаций. Это лучший метод для идентификации коротких тандемных повторов и секвенирования отдельных генов. Метод может обрабатывать только относительно короткие последовательности ДНК (до 300-1000 пар оснований) одновременно. Однако самым большим недостатком этого метода является большое количество времени, которое требуется для его проведения.
Если неизвестно, какую нужно выявить мутацию, то используют специальные панели.
Панель исследования — тестирование на наличие определенных мутаций, входящих в перечень конкретной панели исследования. Анализ позволяет выявить одномоментно разные мутации, которые могут приводить к генетическим заболеваниям. Анализ позволяет компоновать мутации в панели по частоте встречаемости (скрининговые панели, направленные на выявление носительства патологической мутации, часто встречаемой в данном регионе или в определенной замкнутой популяции) и по поражаемому органу или системе органов (панель «Патология соединительной ткани»). Но и у этого анализа есть ограничения. Анализ не позволяет выявить хромосомные аберрации, мозаицизм и мутации, не включенные в панель, митохондриальные заболевания, а также эпигенетические нарушения.
Не в каждой семье можно отследить все возможные рецессивные заболевания. Тогда на помощь приходит секвенирование экзома - тест для определения генетических повреждений (мутаций) в ДНК путем исследования в одном тесте практически всех областей генома, кодирующих белки, изменения которых являются причиной наследственных болезней.
Секвенирование следующего поколения-NGS - определение последовательности нуклеотидов в геномной ДНК или в совокупности информационных РНК (транскриптоме) путем амплификации (копирования) множества коротких участков генов. Это разнообразие генных фрагментов в итоге покрывает всю совокупность целевых генов или, при необходимости, весь геном.

Анализ позволяет выявить точечные мутации, вставки, делеции, инверсии и перестановки в экзоме. Анализ не позволяет выявить большие перестройки; мутации с изменением числа копий (CNV); мутации, вовлеченные в трехаллельное наследование; мутации митохондриального генома; эпигенетические эффекты; большие тринуклеотидные повторы; рецессивные мутации, связанные с Х-хромосомой, у женщин при заболеваниях, связанных с неравномерной Х-деактивацией, фенокопии и однородительские дисомии, и гены, имеющие близкие по структуре псевдогены, могут не распознаваться.
Что делать, если в семье есть наследственное заболевание?
Существуют два способа выявить наследственные генетические мутации у эмбриона:
Предимплантационное генетическое тестирование (ПГТ) в цикле ЭКО. Это диагностика генетических заболеваний у эмбриона человека перед имплантацией в слизистую оболочку матки, то есть до начала беременности. Обычно для анализа проводится биопсия одного бластомера (клетки зародыша) у эмбриона на стадии дробления (4-10 бластомеров). Существует несколько видов ПГТ: на хромосомные отклонения, на моногенные заболевания и на структурные хромосомные перестройки. Данные Simon с соавторами (2018) говорят о том, что в случае проведения ЭКО с ПГТ у пациентки 38-40 лет результативность ЭКО составляет 60%. Но при исследовании эмбриона есть ряд ограничений. Так, из-за ограниченного числа клеток можно не определить мозаицизм.
Если нет возможности провести ЭКО с ПГТ, то используют второй вариант - исследование плодного материала во время беременности.
Для забора плодного материала используют инвазивные методы:
- биопсия хориона - когда берут клетки из плаценты;
- амниоцентез - когда берут клетки амниотической жидкости.
Далее эти клетки исследуют при помощи одного или нескольких генетических тестов (которые имеют свои ограничения). Проведение инвазивных методов может быть связано с риском для беременности порядка 1%.
Таким образом, проведя дополнительные исследования, можно значительно снизить риск рождения ребенка с генетическим заболеванием в конкретной семье. Но привести этот риск к нулю на сегодняшний день, к сожалению, невозможно, так как любой генетический тест имеет ряд ограничений, что делает невозможным исключить абсолютно все генетические болезни.

Автор статьи
Пелина Ангелина Георгиевна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.
Молекулярно-генетическая диагностика в онкологии (NGS, FISH-тест, ПЦР, секвенирование по Сэнгеру и пр.)
Различные методы молекулярно-генетической диагностики в онкологии предоставляют врачу (химиотерапевту, клиническому онкологу) сведения о наличии, расположении и типе мутаций в генах конкретного пациента. Информация о мутациях (и их сочетаниях) помогает выбрать наиболее эффективный вариант лечения уже диагностированного онкозаболевания, либо указать на чрезвычайно высокую вероятность рака, передающегося по наследству (так называемые наследственные или семейные раки).

Секвенатор Illuminaдля выполнения секвенирования генома нового поколения (NGS), установленный в молекулярно-генетической лаборатории МИБС
Основные практические задачи, которые решает молекулярно-генетическое тестирование в онкологии
- поиск “поломок” в генах клеток опухолис целью выявления наиболее эффективнойтактики лечения - например, для определения мутаций, при которых эффективной будет иммунотерапия или таргетная терапия;
- раннее профилактическое выявление генных мутаций, ответственных за развитие наследственных раков у здоровых пациентов, в чьей семейной истории есть случаи онкологических заболеваний из списка наиболее часто передающихся по наследству - наследственный ДНК-онкотест (на базе NGS).
Список генов, подлежащих рассмотрению, задается задачами исследования. Это позволяет оптимизировать стоимость и срок выполнения молекулярно-генетической диагностики, выбрав оптимальный метод либо комбинацию методов исследования генов ДНК конкретного человека. В онкологии изучению подлежат гены, мутации в которых участвуют в развитии рака.
Наиболее часто с развитием опухолей связаны мутации в таких генах как: BRAF, BRCA, EGFR, HRAS, KRAS, MET и др.
Научно доказано, что клиническую важность имеют не только мутации в отдельных генах, но и сочетание различных мутаций в разных участках генов. По этой причине наиболее эффективно применение методов, которые позволяют выявить мутации в любом из генов, ассоциированных с развитием онкологического заболевания, без предварительного указания зоны поиска (изучается так называемая “панель генов”).
Преимущество в точности интерпретаций получают лаборатории, проводящие поиск сочетаний выявленных мутаций в специализированных постоянно пополняемых базах данных международного уровня.
Секвенирование нового поколения (NGS)
Наиболее информативным методом молекулярно-генетической диагностики в клинической онкологии является секвенирование нового поколения (NGS). Эта методика предусматривает секвенирование (разделение) молекулы ДНК конкретного человека на отдельные гены с последующим рассмотрением и фиксацией найденных отклонений от нормального строения каждого гена из интересующего списка (панели генов).
Панель генов, поиск мутаций в которых методом NGS можно заказать в молекулярно-генетической лаборатории МИБС: ATM, ATR, BARD1, BRCA1, BRCA2, BRIP1, CDH1, CDK12, CHEK1, CHEK2, EPCAM, FANCL, MLH1, MSH2, NBN, NF1, PALB2, PMS2, RAD51B, RAD51C, RAD51D, RAD54L, STK11, TP53, POLE
Основным отличием секвенирования нового поколения, основанного на применении высокотехнологичного оборудования (секвенаторов) и мощных вычислительных систем (биоинформатика), является широкий спектр одномоментно изучаемых генов и высокая точность в сочетании с умеренной стоимостью.
Какой лучше: достоинства и недостатки разных методов молекулярной диагностики
Среди современных видов молекулярной генетической диагностики в онкологии наибольшее применение имеют ПЦР (полимеразно-цепная реакция) и секвенирование нового поколения (NGS, next generation sequencing), которые практически вытеснили из клинической практики ранее имевшее широкое применение секвенирование по Сэнгеру.
Остальные методы либо уступают по информативности и точности получаемых данных, либо используются исключительно в научной деятельности из-за высокой стоимости тестирования.
Отдельно следует упомянуть цитогенетический метод FISH (флуоресцентная гибридизация in situ). Так называемый FISH-тест выполняется для подтверждения предположений клинического онколога о наличии специфических мутаций в определенных генах и служит для избрания оптимальной тактики лечения. Однако более корректно отнести FISH к разделу морфологических исследований, так как основой метода является микроскопическая визуализация процесса взаимодействия компонентов во время исследования. В таком случае любые заключения являются субъективными и зависят от квалификации специалистов, выполняющих диагностику. Кроме того, некорректно сравнивать FISH-тест с другими видами генетической диагностики - часто FISH имеет специфическое применение в качестве единственного возможного метода диагностики, например, при таких заболеваниях, как миелолейкоз, лейкоз, хронический лимфолейкоз и др.
NGS (секвенирование нового поколения)
Позволяет рассмотреть все мутации в заданном списке генов в рамках одного исследования (исследование панели генов), давая полную картину имеющихся мутаций, что позволяет избежать дополнительного тестирования. Важное значение данного метода генетической диагностики для медицины нашло отражение в самом его названии - “новое поколение” характеризует превосходство в объеме и точности предоставляемой информации.
Обработка огромного количества информации о ДНК конкретного человека, получаемого при NGS, позволяет:
- определить и описать (указать расположения в конкретном гене) отклонения от нормального для популяции строения ДНК;
- сравнить имеющиеся сочетания различных мутаций с базами данных для определения фактора онкогенности (способности вызывать онкологическое заболевание) выявленных “наборов” мутаций;
- если выполняется наследственный ДНК-онкотест на базе NGS - не только выявить мутации, ассоциированные с наследственными (семейными) раками, но и указать в заключении на необходимость дополнительной консультации с онкологом для принятия мер по предупреждению и раннему выявления начала заболевания.
Значительный объем данных, получаемых при выполнении секвенирования генома, обуславливает продолжительность выполнения NGS-секвенирования генома. Например, изучение панели наиболее распространенных генов, мутации в которых имеют клиническую значимость в онкологии (примерно 30 генов), методом NGS выполняется в срок 20-30 рабочих дней.
Технологические возможности секвенаторов, работающих в лаборатории МИБС, позволяют говорить о резерве снижения срока выполнения тестирования по мере роста спроса на профессиональную генетическую диагностику со стороны российских онкологов из других регионов. С конца 2021 года МИБС предлагает удобную схему логистики образцов тканей опухолей и образцов крови для выполнения NGS-исследований, что открывает доступ к высокотехнологичной диагностике онкологу из любого региона, тем самым повышая качество лечения онкологических заболеваний на уровне государства.
Для выбора наиболее оптимальной схемы лечения с включением в ее состав иммунотерапии либо таргетной терапии, клинические онкологи лечебных центров, входящих в структуру МИБС (Онкологическая клиника МИБС, Центр протонной терапии МИБС) используют данные NGS, полученные в собственной молекулярно-генетической лаборатории
ПЦР (полимеразная цепная реакция)
Полимеразная цепная реакция - это хорошо знакомый, точный и востребованный метод определения мутаций в указанных генах. Именно ПЦР, точнее, информация о мутациях в наиболее распространенных генах (чаще всего BRAF-мутации, а также BRCA1/BRCA2, EGFR, HRAS, KRAS, MET) стал основой развития технологий таргетной терапии и иммунотерапии.
С появлением секвенирования нового поколения метод ПЦР утрачивает клиническую важность при необходимости исследования широкой панели генов. В таком случае невысокая стоимость и небольшой срок выполнения исследования, являющиеся преимуществом ПЦР при решении точечных диагностических задач при необходимости всестороннего изучения генов у онкологических пациентов не перекрывают определенных ограничений, которые присущи ПЦР.
В первую очередь, это недостаточная информативность - один ПЦР-анализ позволяет проверить мутацию в одном конкретном гене, которую может предположить врач-онколог. В случае подозрения о наличии мутаций в различных генах необходимо многократное повторение ПЦР-тестирования на каждом из интересующих участков ДНК. Это резко повышает общую стоимость исследования и длительность самого процесса диагностики, требует проведения дополнительной биопсии для получения дополнительного объема опухолевых тканей, что также увеличивает общий срок и стоимость исследований.
Сравнение полноты исследования генетических мутаций между ПЦР и секвенированием нового поколения (NGS)
Рассмотрим «разрешающую способность» этих двух методов на примере тестирования образца опухоли у пациентки с необходимостью выявления возможных мутаций BRCA1/BRCA2. На двух иллюстрациях ниже розовым отмечены зоны генов, которые возможно исследовать этими двумя методами:
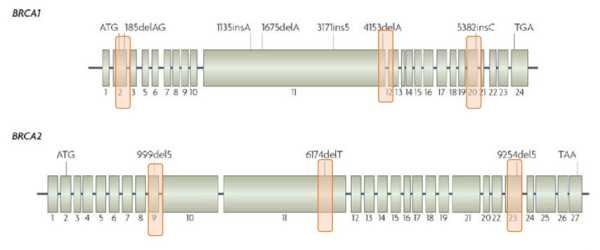
ПЦР исследование - позволяет диагностировать только 4-10 частых мутаций из более чем 3000 описанных патогенных в базах данных, рассматривается только 2 гена из более чем 100 генов (к.м.н. Гордиев М.Г., из личного архива)
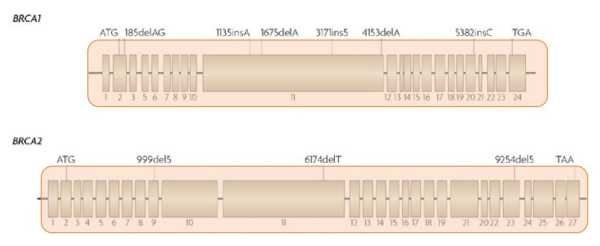
Cеквенирование нового поколения (NGS) - диагностируются все мутации в генах BRCA1/BRCA2, а также все мутации в других генах (к.м.н. Гордиев М.Г., из личного архива)
При этом даже многократное ПЦР-тестирование опухоли, в отличие от метода секвенирования нового поколения (NGS), не дает исчерпывающей информации о мутациях в генах, не вошедших в список для изучения. Это может приводить к ложно-отрицательным результатам в случае редких генетических мутаций, либо при недостаточно полной формулировке диагностической задачи со стороны направляющего врача-онколога.
Секвенирование по Сэнгеру
С развитием других методов генетической диагностики данный метод постепенно выходит из клинической практики. Основной недостаток метода Сэнгера - низкая чувствительность. Это означает, что для выявления генной мутации обязательным условием является наличие в предоставленных образцах опухолевых тканей не менее 15-20% клеток с мутациями. Из-за неравномерности распределения клеток в объеме солидных опухолей применение секвенирования по Сэнгеру приводит к значительному количеству ложно-отрицательных результатов (как следствие - пациенту проводится лечение, которое не будет эффективным).
Учитывая развитие и доступность в России (в том числе по ОМС в МИБС) более современных методов генетической диагностики можно сказать, что на начало 2022 года применение секвенирования по Сэнгеру обусловлено реактивностью мышления и недостаточной информированностью некоторых врачей, которые игнорируют более современные технологии.
При каких видах рака нужна молекулярно-генетическая диагностика?
Список основных видов рака, при лечении которых информация о генных мутациях имеет практическую клиническую ценность:
- немелкоклеточный рак легкого - гены EGFR, BRAF, KRAS, MET, NRAS, ERBB2, JAK2, JAK3
- рак толстой кишки (колорректальный рак) - гены KRAS, NRAS, BRAF
- меланома - гены BRAF, NRAS, KIT
- гастроинтестинальная стромальная опухоль - гены PDGFRA, KIT
- глиальные опухоли, острый миелоидный лейкоз - гены IDH1, IDH2
- рак молочной железы - гены PIK3CA, BRCA1, BRCA2
- рак яичников - гены BRCA1, BRCA2, TP53
Секвенирование нового поколения в МИБС: в чем преимущество?
Наша лаборатория использует NGS-секвенирование на оборудовании Illumina, являющееся на начало 2022 года “золотым стандартом” в отрасли секвенирования генома. Данное оборудование, точнее, технологический цикл секвенирования с использованием оборудования Illumina, обеспечивает высокую скорость расшифровки (секвенирования) ДНК и относительно низкую стоимость исследования, позволяющую использовать этот современный диагностический метод в широкой клинической практике. Интерпретация полученных данных проводится в соответствии с постоянно дополняемыми международными информационными базами мутаций.
В нашей лаборатории работают уникальные специалисты, имеющие профессиональную подготовку и богатый подтвержденный опыт как клинической, так и научной работы в направлении секвенирования генома. Вовлеченность в международное профессиональное сообщество и постоянное взаимодействие с клиническими онкологами и химиотерапевтами лечебных центров МИБС позволяет оперативно реагировать на потребности отрасли.
К тому же большинство исследований, связанных с определением эффективности лечения, могут быть выполнены в нашей лаборатории за счет ОМС, независимо от региона проживания гражданина РФ.
Комплексное геномное профилирование
С июля 2022 молекулярно-генетическая диагностика в МИБС вышла на новый уровень: внедрена услуга комплексного геномного профилирования (в партнерстве с Foundation Medicine, частью международной компании Roche).
Комплексное геномное профилирование (КГП) определяет уникальный молекулярный профиль опухоли, изучая список из 324 генов, значимых с точки зрения лечения онкологических заболеваний. Тест выполняется в рамках одного биоматериала (парафиновые блоки образцов опухоли либо образец крови, в зависимости от заболевания) во внешней лаборатории Foundation Medicine (Пензбург, Германия).
Результаты КГП позволяют оптимизировать проводимую противоопухолевую терапию у детей и взрослых, назначив персонализированное таргетное лечение при любых солидных опухолях, гемобластозах, саркомах.
По результатам проведения КГП также определяются клинические исследования, в которых могут принять участие пациенты, исходя из их геномного профиля.
Комплексное геномное профилирование (КГП) выполняется на коммерческой основе, однако стоимость данного исследования в МИБС - одна из самых низких в РФ. Наши пациенты имеют возможность передать образцы на тестирование, заключив договор на получение услуги в любом из 79 региональных диагностических центров МИБС в более чем 60 городах РФ.
Общее время ожидания результатов КГП, включая транспортировку, составит 5-6 недель. Отчет, полученный из Германии, будет содержать информацию о выявленных генетических изменениях, клинически эффективных видах терапии и ведущихся клинических исследованиях, участие в которых рекомендовано пациенту, исходя из его геномного профиля.
ДНК-тест рисков наследственного рака (на основе NGS)
С появлением метода секвенирования генома нового поколения, позволяющего одномоментно проанализировать широкую панель генов и сравнить с имеющейся всемирной базой выявленные мутации, на новый виток развития выходят программы предупреждения и ранней диагностики широкого ряда онкологических заболеваний - программы скрининга, которые включают исследование наследственных рисков развития онкозаболеваний.
На сегодня научно доказано, что на долю наследственного фактора приходится до 20% всех случаев некоторых видов онкологических заболеваний (например, наследственный рак молочной железы или рак яичников). У пациентов, несущих гены семейных раков, вероятность развития онкологического заболевания составляет до 90% вместо среднего для популяции значения в 10%. В целом 1,5-2% всех людей в популяции имеют генные мутации, которые говорят о повышенном риске рака.
Наиболее частые наследственные (семейные) раки:
- рак молочной железы (как у женщин, так и у мужчин);
- рак яичников;
- рак предстательной железы;
- колоректальный рак;
- рак поджелудочной железы;
- рак желудка;
- меланома.
Наиболее оптимальным вариантом является ДНК тест наследственного рака у тех, кто входит в группу риска - семейная история одного вида рака в нескольких поколениях, наличие особенностей течения заболевания (например, двусторонний рак молочной железы, рак груди у мужчин, рак яичников или молочной железы в возрасте до 50 лет и др.). В такой группе вероятность развития опухолей значительно выше, чем у просто носителей мутаций.
Фактически, предоставив в лабораторию МИБС образец крови, можно предсказать рак. И, если ДНК-тестирование покажет наличие определенного набора генных мутаций, у пациента в сотрудничестве с врачом-генетиком и врачом-онкологом появляется шанс предпринять необходимые радикальные либо терапевтические действия, чтобы снизить или полностью исключить риск развития данного вида рака.
Самым известным примером такого подхода является актриса Анджелина Джоли, в семейной истории которой было несколько случаев рака молочной железы. Этот фактор в сочетании с выявленными мутациями в генах BRCA1 и BRCA2 показал максимальную вероятность раннего развития рака. Поэтому актриса выбрала наиболее радикальный путь (двухсторонняя мастэктомия и тотальная овариэктомия). В других случаях возможны и более мягкие решения в пределах персонализированного скрининга: более пристального наблюдения с более частой диспансеризацией, расширение состава скрининга (например, регулярная дерматоскопия у пациентов с семейной меланомой, МРТ молочных желез для молодых пациенток с семейным раком груди, контроль динамики уровня ПСА у пациентов с наследственным раком простаты).
Читайте также:
- Инфекции, вызванные вирусом Зика
- Механизм действия дофамина и его эффекты
- Боевые отравляющие вещества кожно-нарывного действия
- Диагностика врожденных дефектов свода черепа по КТ, МРТ
- Нервная регуляция секреции пищеварительных соков и моторики желудка и кишечника. Рефлекторная дуга центрального пищеводно
