Нарушение зрения при перивентрикулярной лейкомаляции у ребенка
Добавил пользователь Morpheus Обновлено: 29.01.2026
Кафедра офтальмологии педиатрического факультета ГБОУ ВПО "Российский национальный научно-исследовательский медицинский университет им. Н.И. Пирогова", Москва;
ГБУЗ "Городская больница №8" Департамента здравоохранения Москвы
Кафедра офтальмологии педиатрического факультета ГБОУ ВПО "Российский национальный научно-исследовательский медицинский университет им. Н.И. Пирогова", Москва
Кафедра офтальмологии педиатрического факультета Российского государственного медицинского университета, Москва
кафедра ультразвуковой диагностики ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования», Москва, Россия;
Перинатальный центр ГБУЗ «Городская клиническая больница №24» Департамента здравоохранения Москвы, Москва, Россия
Неврологические нарушения у недоношенных детей с ретинопатией
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2017;117(11‑2): 41‑46
Цель исследования. Установление корреляции частоты и выраженности гипоксического поражения ЦНС у недоношенных детей с ретинопатией и улучшение ранней диагностики поражений структур головного мозга на основании клинических офтальмологических данных. Материал и методы. На протяжении 2006—2016 гг. обследованы 712 недоношенных детей с массой тела до 1500 г, рожденных до 30-й недели гестационного возраста. Проведены офтальмологический мониторинг ретинопатии недоношенных (РН), анализ историй болезни, неврологическое и нейросонографическое обследование детей. Результаты и заключение. РН была выявлена у 367 (51,5%) детей. В 255 случаях заболевание самопроизвольно регрессировало. У 112 (15,7%) детей было тяжелое течение РН, которое требовало проведения лазеркоагуляции аваскулярных зон сетчатки. Признаки внутрижелудочковых кровоизлияний (ВЖК) отмечены в неонатальном периоде у 434 (61%) детей. У детей с РН ВЖК были выявлены в 285 (77,6%) случаев. РН с регрессом после лазеркоагуляции сочеталась с ВЖК в 98% случаев, преобладали (55,3%) ВЖК 3-й степени. Перивентрикулярная лейкомаляция (ПВЛ) у детей без РН выявлена в 10% случаев, в 2 раза чаще у детей с РН с самопроизвольным регрессом (22,3%) и в 5 раз чаще при РН с лазеркоагуляцией сетчатки (51,7%). У 70 детей с 14—15-го дня жизни выявлены нейросонографические признаки ишемии головок хвостатого ядра. В этой группе РН развилась у 54 (77%) детей, лазеркоагуляция сетчатки потребовалась 27 (38,5%) детям. Установленная связь тяжести РН и гипоксического поражения ЦНС у глубоко недоношенных детей позволит прогнозировать зрительные и нейросоматические нарушения в раннем возрасте и своевременно проводить эффективную реабилитацию.
Состояние недоношенности ассоциируется с сочетанным поражением ЦНС, бронхолегочной и сердечно-сосудистой систем и ретинопатией недоношенных (РН). РН — тяжелое вазопролиферативное заболевание, развивающееся преимущественно у глубоко недоношенных детей, которое продолжает занимать ведущее место в структуре детской инвалидности с раннего детства [1—4]. Несмотря на достижения современной неонатологии, более качественный мониторинг оксигенотерапии, она остается одной из актуальных проблем офтальмологии и педиатрии.
Поражение ЦНС относят к ведущим симптомокомплексам у недоношенных детей с РН на первом году жизни [5].
Внутрижелудочковые кровоизлияния (ВЖК) и паренхиматозные кровоизлияния являются самым серьезным видом внутричерепных кровотечений (ВЧК). Общая частота ВЧК у недоношенных новорожденных неизвестна, поскольку она зависит от вида геморрагии и гестационного возраста новорожденного ребенка. Чем меньше гестация недоношенного ребенка, тем выше вероятность ВЧК. В.И. Гузева [6] указывает на частоту ВЖК у недоношенных от 15 до 50%. Кровоизлияния в мозжечок наблюдаются у 20% недоношенных детей, рожденных с очень низкой массой тела [6—9].
Известно, что одним из ведущих звеньев в патогенезе ВЧК у недоношенных новорожденных являются особенности строения сосудов. Особенностями сосудов герминального матрикса (ГМ) является высокая склонность к гипоксически-ишемическим повреждениям. В сосудах ГМ отсутствует мышечный слой, они имеют неправильную форму с выраженными областями просвета, дренажные вены относительно большого диаметра с тонкими стенками, что способствует легкому их разрыву. ГМ расположен между хвостатым ядром и эпендимой бокового желудочка. Большая его часть находится в каудоталамическом переходе сразу сзади отверстия Монро. Перечисленные особенности ГМ способствуют возникновению и распространению геморрагий у недоношенных детей. В.И. Гузева [6] связывает с кровоизлияниями из ГМ 90% всех ВЖК. ВЖК выявляются у 26% недоношенных с гестационным возрастом менее 32 нед и массой рождения менее 1500 г.
Перивентрикулярная лейкомаляция (ПВЛ) — особая форма гипоксически-ишемического поражения вещества головного мозга, характерная для недоношенных детей. По данным разных авторов, она встречается в 4—10% случаев у недоношенных детей, рожденных до 33 нед гестации. Среди недоношенных детей, умерших на первой неделе жизни, выявляемость ПВЛ составляет 7%. У погибших после 7-дневного возраста на аутопсии ПВЛ выявляют в 75% случаев [10]. У детей, получающих аппаратную вентиляцию, частота развития ПВЛ может достигать 60%, в отличие от 6% случаев развития ПВЛ у невентилируемых детей [6].
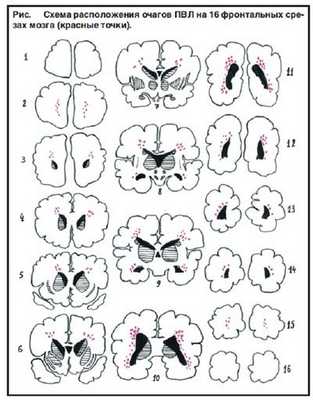
Очаги ПВЛ чаще располагаются в зонах смежного кровообращения между передними, средними и задними мозговыми артериями. В перивентрикулярных областях боковых желудочков головного мозга нет концевых зон трех главных мозговых артерий, а смежная зона кровообращения образуется между небольшими вентрикулофугальными и вентрикулопетальными артериями. У недоношенных детей наблюдается недоразвитие вентрикулофугальных артерий, что способствует развитию ПВЛ. Во внутриутробном периоде артериальных анастомозов в коре головного мозга больше, чем в перивентрикулярной зоне [11]. Несовершенство механизмов ауторегуляции мозгового кровообращения и незрелость сосудов у недоношенных приводят к ишемическому поражению белого вещества головного мозга в зонах смежного кровообращения. В области некротизированной ткани нередко происходят вторичные кровоизлияния, не являющиеся результатом прорыва крови из бокового желудочка в прилежащую паренхиму [12].
И.М. Мосин и соавт. [13] установили, что у 38% недоношенных детей с регрессом РН выявленная слепота была обусловлена ПВЛ, при этом они отметили недостаточный объем нейроофтальмологического обследования младенцев.
Y. Ozsurekci и соавт. [14], Е.И. Сидоренко, Г. В. Николаева [15] и другие авторы [16—18] выявили параллели между патогенезом ПВЛ и РН (неполное развитие и ингибирование васкуляризации белого вещества ЦНС и сетчатки; увеличение активных форм кислорода и азота на фоне недостаточности антиоксидантной системы; нарушение местной гемодинамики и ишемические изменения). К ишемическому повреждению развивающегося белого вещества и сетчатки приводят связанные с незрелостью нарушения ауторегуляции кровотока.
J. Steck и соавт. [19] в эксперименте доказали существование единых механизмов повреждения белого вещества развивающегося головного мозга и сетчатки.
Достижения современной неонатологии способствовали увеличению показателей выживания глубоко недоношенных детей с очень низкой (до 1500 г) и экстремально низкой (до 1000 г) массой тела. Это определило развитие новой волны заболеваемости РН у недоношенных детей во всем мире [1—3, 18, 20, 22].
Преждевременное рождение, переход из гипоксичной внутриутробной среды в относительно гипероксичную внешнюю, потеря материнских медиаторов постнатального роста приводят к задержке развития сосудов сетчатки, спазму и вазооблитерации существующих сосудов. Относительная гипероксия, усугубляемая дополнительной оксигенотерапией, способствует нарушению регуляции гипоксия-индуцированными факторами (HIF) факторов роста сосудов (в частности, эритропоэтина и фактора роста эндотелия сосудов — VEGF), снижает их экспрессию. Задержка нормального развития сосудов, спазм и вазооблитерация существующих сосудов — первая гипоксическая/ишемическая фаза патогенеза Р.Н. Нейронная сетчатка в этот период продолжает развиваться, усугубляя гипоксию [18, 20—22]. Во вторую, пролиферативную фазу патогенеза РН нарастающая гипоксия сетчатки на фоне растущих метаболических потребностей приводит к накоплению и транслокации индуцированного гипоксией фактора (HIF), транскрипции генов ангиогенеза, кодирующих VEGF, циклооксигеназу, эритропоэтин и ангиопоэтин 2 и повышенной выработке факторов роста сосудов, запускает патологическую вазопролиферацию [18, 20—22].
Цель офтальмологического мониторинга, который проводится недоношенным детям, заключается в выявлении перехода от первой фазы патогенеза РН ко второй, который сопровождается манифестацией заболевания. Для ранней, доклинической профилактики РН необходимо четко представлять механизмы развития первой, ишемической фазы РН у недоношенных детей.
По мнению А. Hellström [22], мероприятия по снижению риска РН у недоношенных детей будут способствовать снижению риска и сопутствующей неонатальной патологии (неврологической дисфункции, внутрижелудочковых кровоизлияний, бронхолегочной дисплазии, некротизирующего энтероколита). Сетчатка является частью ЦНС. Снижение факторов, нарушающих постнатальное развитие сетчатки, будет способствовать нормальному развитию ЦНС [22]. В свою очередь раннее выявление признаков гипоксического поражения ЦНС у недоношенных детей может быть критерием риска развития РН.
Цель настоящего исследования — изучение корреляции частоты и выраженности гипоксического поражения ЦНС с РН у глубоко недоношенных детей и улучшении ранней диагностики поражений структур головного мозга на основании данных клинического офтальмологического обследования.
Материал и методы
Исследование проведено на базе отделения реанимации и интенсивной терапии филиала «Перинатальный центр» городской клинической больницы № 24 на протяжении 2006—2016 гг.
В основную выборку вошли 712 детей.
Критериями включения детей в исследование являлись гестационный возраст при рождении от 22 до 30 нед, масса тела от 450 г до 1500 г.
Офтальмологический мониторинг начинали с 29—30-й недели постконцептуального гестационного возраста у детей, рожденных до 27-й недели гестации, и в постнатальном возрасте — 1 мес у детей, рожденных на более поздних сроках гестации. Кратность офтальмологических осмотров определялась офтальмоскопической картиной глазного дна. Осмотры проводили в случае отсутствия патологических изменений каждые 2 нед. Показанием к более частому офтальмоскопическому обследованию (каждые 10 дней) было наличие широкой аваскулярной зоны или выявление признаков активности сосудов (увеличение калибра сосудов в динамике, полнокровие вен, извитой ход артерий, патологическое ветвление сосудов на границе с аваскулярной зоной). При развитии РН осмотры проводили через 7, 5 или 3 дня в зависимости от активности процесса.
В каждом случае был проведен анализ историй болезни, данных неврологического и нейросонографического обследования.
Нейросонографическое исследование проводили с первого дня жизни с кратностью 3, 5 или 7 сут (по показаниям) на аппаратах Esaote MyLab 70 (Италия) и Sonosite Micromax (США); использовали фазированные датчики Микроконвекс с частотой 5—11 МГц.
Исследование было одобрено комитетом по этике Российского национального исследовательского медицинского университета им. Н.И. Пирогова.
Результаты
Жизнеспособность недоношенного новорожденного ребенка в первую очередь определяется его гестационным возрастом и массой тела при рождении. С этими показателями связано и морфологическое состояние зрительного анализатора, степень завершенности васкуляризации сетчатки, риск развития Р.Н. Средний гестационный возраст детей, вошедших в исследуемую группу, составил 27,7±2 нед. Средняя масса тела составила 1045±256 г.
При первом офтальмологическом исследовании выявлялись признаки выраженной морфологической незрелости: низкая прозрачность оптических сред за счет выраженной опалесценции роговиц и эмбриональной сосудистой капсулы хрусталика; фон глазного дна серо-желтый; диск зрительного нерва бледно-серый, сосудистая воронка отсутствует; ретинальные сосуды значительно сужены. Было характерно наличие широких аваскулярных зон.
РН была выявлена в ходе офтальмологического мониторинга у 367 (51,5%) детей. В 255 случаях заболевание завершилось самопроизвольным регрессом. У 112 (15,7%) детей тяжелое течение заболевания требовало проведения лазеркоагуляции аваскулярных зон сетчатки.
РН, потребовавшая применения лазеркоагуляции, преимущественно развивалась у новорожденных с очень малой массой тела — менее 1000 г (763±138 грамм) морфологически незрелых и гестационным возрастом менее 27 нед (25,4±0,7). Течение Р.Н. с невысокой активностью и самопроизвольным регрессом отмечено у детей, рожденных на 26,5±1,2 неделе гестации с массой 905±224 г. У детей без РН средняя масса тела при рождении была больше и составила 1162±322 г, гестационный возраст 28,6±1,4 нед (p<0,05).
В клиническом диагнозе у всех обследованных детей фигурировали «гипоксически-ишемическое поражение ЦНС» или «церебральная ишемия II степени».
Признаки ВЖК были отмечены у 434 (61%) детей. У детей с развившейся РН при нейросонографическом исследовании ВЖК были выявлены в неонатальном периоде в 285 (77,6%) случаях.
Тяжелому течению РН, потребовавшему проведения лазеркоагуляции сетчатки, геморрагическое поражение ЦНС сопутствовало в 98% случаев.
ПВЛ сформировалась у 142 (20%) детей. В 2 раза чаще ПВЛ выявляли у недоношенных детей с РН с самопроизвольным регрессом (22,3%) и в 5 раз чаще — при РН с индуцированным регрессом (51,7%) по сравнению с недоношенными детьми без РН (10% случаев).
Таким образом, формирование ВЖК и ПВЛ было характерно для новорожденных детей группы РН и с высокой частотой выявлялось у детей с тяжелым, прогрессирующим течением РН (см. таблицу). Частота перинатальных неврологических поражений ЦНС при разной тяжести течения РН у глубоко недоношенных детей
Отмечена взаимосвязь тяжести сформировавшегося в неонатальном периоде ВЖК и состояния глаз по итогам офтальмологического мониторинга. При прогрессирующем, тяжелом течении РН, потребовавшем проведения лазеркоагуляции сетчатки, чаще выявлялись ВЖК 3-й степени (55,3%). Для детей с РН, завершившейся самопроизвольным регрессом, больше были характерны ВЖК 2-й степени (43,5%).
Таким образом, частота выявления структурных гипоксических поражений ЦНС была выше у недоношенных детей с РН. РН с тяжелым течением, потребовавшая хирургического вмешательства, в 55,3% случаев развивалась на фоне ВЖК 3-й степени и в 51,7% случаев — на фоне ПВЛ.
У 70 детей при нейросонографическом исследовании было выявлено повышение эхогенности в проекции головки хвостатого ядра, расцененное по локализации и характеру как ишемия. Данная симптоматика регистрировалась с 14—15-го дня жизни. Нейросонографическая картина гиперэхогенности сохранялась до 2 мес, в 10% случаев в исходе происходило формирование многокамерной псевдокисты. По данным допплерографического исследования отмечен резистентный кровоток в передней мозговой, средней мозговой и базилярной артериях, допплерографический показатель индекса резистентности в большинстве случаев достигал 0,9—1,0. Средний гестационный возраст этих детей был 28,8±1,8 нед, масса тела при рождении составляла 1144±370 г. Отмечен высокий удельный вес развития РН в этих случаях — 54 (77%) ребенка. Тяжелое течение заболевания по типу задней агрессивной формы РН или РН с плюс-болезнью было у 27 (38,5%) детей.
Таким образом, у недоношенных детей исследуемой группы был отмечен высокий удельный вес перинатальных гипоксически-ишемических поражений ЦНС: ВЖК и ПВЛ. Частота развития ВЖК, ПВЛ и РН находилась в прямой зависимости от массы тела и гестационного возраста при рождении детей, т. е. от их морфологической зрелости. Значимо чаще эти изменения выявлялись у детей, рожденных с массой тела менее 1000 г (763±138 г) и гестационным возрастом менее 27 нед (25,4±0,7 нед) на момент рождения (p<0,05).
Выявление ВЖК 3-й степени у недоношенных детей относят к факторам риска развития РН [23]. Согласно полученным нами данным ВЖК 3-й степени и ПВЛ чаще встречались у детей с РН и обнаруживались в половине случаев развития тяжелых форм РН.
В наших предыдущих работах [14, 16] уже была показана связь развития ПВЛ и РН у недоношенных детей, особенно тяжелых форм РН и ВЖК 3-й степени. Проведенное на большом клиническом материале исследование подтвердило наши более ранние выводы.
Е.И. Сидоренко [24] доказал, что физиология ретинальных сосудов сходна с физиологией сосудов мозга, и для них характерна ауторегуляция кровотока подобно сосудам мозга. А.Я. Бунин [25], Е.И. Сидоренко [24], А.С. Никифоров, М.Р. Гусева [26] отметили сходство условий кровотока в сосудах головного мозга и глаза, единство механизмов регуляции гемодинамики. Установленная связь частоты и тяжести перинатальных гипоксически-ишемических поражений ЦНС (ВЖК, ПВЛ) с частотой развития и тяжестью течения РН у недоношенных детей подтверждает выдвинутую ранее концепцию о единстве механизмов нарушения гемодинамики в сосудах глаза и ЦНС [14—16].
Y. Ng и соавт. [27] отметили связь между ПВЛ и РН недоношенных и считают, что эпизод гипоперфузии, сопровождающийся церебральной ишемией, в том числе приводит и к усугублению ишемии сетчатки, увеличивая риск и тяжесть РН.
Таким образом, выявление при проведении нейросонографии признаков ишемии головок хвостатых ядер позволяет уже в неонатальном периоде сформировать группу риска развития тяжелой РН и скорректировать тактику неонатологов и офтальмологов. Установленная зависимость тяжести РН от ВЖК и наличия лейкомаляции у глубоко недоношенных детей позволит прогнозировать зрительные и нейросоматические нарушения в раннем возрасте без применения сложных и дорогостоящих методик и обеспечивать более эффективную функциональную зрительную и социальную реабилитацию этой группы больных.
Перивентрикулярная лейкомаляция
Перивентрикулярная лейкомаляция — это гипоксически-ишемическая энцефалопатия, характеризующаяся поражением белого вещества головного мозга новорожденных. Состояние чаще возникает у недоношенных, провоцируется патологиями течения беременности и родов, неадекватной респираторной поддержкой в постнатальном периоде. Заболевание проявляется мышечной дистонией, судорожным синдромом, задержкой психомоторного развития. Для диагностики болезни назначается КТ или МРТ мозга, ЭЭГ, допплерография церебральных сосудов. Лечение лейкомаляции включает медикаменты (нейропротекторы, инфузионные растворы, антиконвульсанты), индивидуальный комплекс физиотерапии, массажа, ЛФК.
МКБ-10
Общие сведения
Причины
Основной этиологический фактор перивентрикулярной лейкомаляции — внутриутробная гипоксия, которая выступает следствием осложнений протекания беременности, материнских факторов риска либо негативного экзогенного воздействия. Также состояние может возникать при перинатальной гипоксии, которая развивается во время родов, в первые дни жизни младенца (при синдроме дыхательных расстройств, врожденных аномалиях сердца и легких, неонатальном сепсисе).
В группе риска наибольшую по численности категорию составляют недоношенные младенцы. Зачастую лейкомаляция выявляется у детей, которое были рождены от матерей с сахарным диабетом, хронической анемией, гипертиреозом либо страдавших от преэклампсии и эклампсии. Состояние возникает при выполнении экстренного кесарева сечения, неадекватном родовспоможении (травмирующие акушерские пособия). Высокая частота лейкомаляции (до 22%) отмечается при сочетании длительного безводного периода с хориоамнионитом у матери.
Патогенез
Поражение головного мозга связано со снижением кровотока в церебральных сосудах, недостаточным поступлением кислорода и питательных ингредиентов. Перивентрикулярная область наиболее чувствительна к этим изменениям, что обусловлено особенностями кровоснабжения, несовершенством процессов ауторегуляции, нейроонтогенетическими особенностями головного мозга у младенцев.
Недоношенные намного чаще страдают лейкомаляцией, поскольку у них на фоне гипоксии не увеличивается церебральный кровоток, как это бывает у рожденных в срок младенцев. В результате этого резко уменьшается кровоток в зоне между вентрикулофугальными и вентрикулопетальными артериями, быстро формируется гиперкапния и ацидоз. Расстройства микроциркуляции проявляются стазом, тромбозом, вне- и внутриклеточным отеком белого вещества.
Формирование ПВЛ возможно не только при недостатке кислорода, но и при гипероксии — при проведении ИВЛ, оказании других видов респираторной поддержки. При избыточном поступлении кислорода повышается рН крови в мозговой ткани, что вызывает рефлекторный спазм сосудов, затруднение венозного оттока. Также кислород активизирует процессы свободнорадикального церебрального повреждения.
Симптомы
Как правило, перивентрикулярная лейкомаляция формируется антенатально или на протяжении первых часов после рождения ребенка, поэтому начальные признаки заметны уже в родильном доме, особенно если младенец рожден недоношенным. При обширном повреждении белого вещества происходят нарушения сознания по типу летаргии или комы, однако возможна обратная симптоматика — повышенная возбудимость, оживление безусловных рефлексов, судорожный синдром.
Типичным проявлением патологии являются изменения тонуса мышц. На первом месяце жизни преобладает слабость мускулатуры ног в сочетании с нормальным формированием мышц верхних конечностей. У недоношенных новорожденных часто отмечается тотальная мышечная гипотония. Такие нарушения сохраняются в среднем до 6 месяцев, после чего они сменяются спастическими явлениями — повышением тонуса мускулатуры нижних конечностей, оживлением коленных рефлексов.
Течение перивентрикулярной лейкомаляции имеет неравномерный характер: периоды обострения симптоматики сменяются «мнимым благополучием», когда ребенок развивается относительно нормально. Затем происходит задержка формирования моторных навыков, развиваются различные сенсорные нарушения, дизартрия. 66% детей, особенно недоношенные, страдают от снижения остроты зрения вплоть до полной слепоты вследствие атрофии зрительных нервов.
Осложнения
Перивентрикулярные поражения белого вещества — крайне тяжелое состояние. Недоношенные дети с ПВЛ умирают в 50% случаев еще в период новорожденности, у выживших обычно наступает инвалидность с полной дезадаптацией. Пациенты с длительно сохраняющимся судорожными приступами в 85% случаев имеют грубую задержку психомоторного развития. У перенесших ПВЛ в будущем в 1,5 раза чаще встречаются фебрильные судороги, в 27 раз чаще формируется эпилепсия.
При множественных кистах в перивентрикулярной зоне у 80-97% больных (чаще — недоношенных) возникает детский церебральный паралич (ДЦП), который сопровождается глубоким психоречевым отставанием. Развитие заболевания связано с повреждением центральной части внутренней капсулы, средне- и заднелобных сегментов белого вещества полушарий. Также лейкомаляция вызывает микроцефалию (у 42% пациентов), нейросенсорную тугоухость (у 28% больных).
Диагностика
Постановка правильного диагноза в неонатальном периоде затруднена, что объясняется полиморфностью клинической картины, отсутствием патогномоничных симптомов. При физикальном осмотре выявляется асимметрия мышечного тонуса, патологическое усиление рефлексов, на более поздних этапах — спастическая диплегия. Особую настороженность следует проявлять в отношении детей, родившихся недоношенными. В план обследования новорожденных с подозрением на ПВЛ включаются:
- Нейровизуализация. При КТ и МРТ головного мозга определяются множественные очаги атрофии белого вещества, зачастую визуализируются кисты перивентрикулярной области размером более 4 мм, что коррелирует с тяжелым неврологическим дефицитом.
- Дуплексное сканирование сосудов. Исследование артерий головы и шеи с помощью допплерографии имеет важное значение для уточнения параметров кровотока, исключения сосудистых аномалий, которые могли быть причиной постнатальной гипоксии. По показаниям исследование дополняется реоэнцефалографией.
- ЭЭГ. При судорожном синдроме электроэнцефалография необходима для обнаружения зон мозга с повышенной электрической активностью. Недоношенным новорожденным требуются повторные исследования в разные возрастные периоды для оценки динамики морфофункционального созревания мозга.
- Консультации специалистов. При подозрении на патологию зрения, рекомендуется обследование у офтальмолога с осмотром глазного дна. Больным со сниженным слухом необходима консультация ЛОР-врача. Иногда требуется визит к детскому психологу, психиатру.
Лечение перивентрикулярной лейкомаляции
Терапия перивентрикулярной лейкомаляции представляет собой сложную задачу, учитывая необратимый характер повреждений белого вещества, частое сочетание гипоксически-ишемической энцефалопатии с поражениями других систем организма у недоношенных. Медикаментозное лечение подбирается на основе ведущих синдромов болезни и включает следующие группы препаратов:
- Инфузионная терапия. Растворы глюкозы, электролитов, витаминов оказывают положительное влияние на церебральный метаболизм, повышают устойчивость перивентрикулярных зон к гипоксии.
- Нейрометаболиты. Препараты улучшают кровоток и стимулируют доставку питательных веществ в головной мозг, а также выполняют функцию нейропротекторов, способствуют формированию когнитивных навыков.
- Антиконвульсанты. Для купирования судорог используются медикаменты из группы бензодиазепиновых транквилизаторов, а при их неэффективности применяются барбитураты, препараты для наркоза.
- Глюкокортикоиды. Лекарства показаны в случае осложнения заболевания внутричерепной гипертензией. В таком случае они дополняются осмотическими диуретиками.
Учитывая высокую частоту резидуальных неврологических явлений, рекомендовано восстановительное лечение. Чтобы улучшить двигательные способности, назначаются курсы массажа, физиотерапии, лечебной физкультуры. Для развития речевых навыков требуются коррекционные занятия у логопеда, дефектолога. Детям с поражением органов чувств нужна помощь тифлопедагога, сурдопедагога. Пациентам с ДЦП необходимы специальные ходунки, костыли, инвалидные коляски.
Прогноз и профилактика
В большинстве случаев лейкомаляция отличается неблагоприятным течением, отличается высоким уровнем смертности во время младенчества. Для выживших детей прогноз напрямую зависит от тяжести органического дефекта перивентрикулярной зоны, своевременности и полноты проведенного лечения. Профилактика ПВЛ включает рациональное ведение беременности, предупреждение родового травматизма, соблюдение протоколов при респираторной поддержке в роддоме, усиленный контроль за развитием недоношенных.
2. Перивентрикулярная лейкомаляция: этиология, патогенез, клиника, исходы/ Э.Ф. Юсупова, Д.Д. Гайнетдинова// Вопросы современной педиатрии. — 2010. — №4.
3. Перивентрикулярная лейкомаляция: факторы риска возникновения, выживаемость и мониторинг развития детей. Автореферат диссертации/ Е.П. Ониангет. — 2006.
4. Перивентрикулярная лейкомаляция у новорожденных/ И.Н. Пронин// Медицинская визуализация. — 2005. — №2.
Перивентрикулярная лейкомаляция — нарушение головного мозга новорожденных
Мозг, это самое главное, что есть в человеческом организме. Именно благодаря нему мы можем разговаривать, думать, воспринимать информацию. Но, к сожалению, случается и так, что головной мозг дает сбой в своей работе еще при внутриутробном развитии плода и начинают развиваться различного рода заболевания. Одним из таких заболеваний является лейкомаляция.
Лейкомаляция головного мозга диагностируется у новорожденных, чаще всего недоношенных детей, при этом происходит ишемическое и гипоксическое повреждение мозга.
Это достаточно сложное заболевание, которое относится к неврологическим повреждениям головного мозга. При развитии болезни обнаруживаются очаги поражения, вызванные некрозом. Это следствие гипоксии и дальнейшего нарушения кровотока в области головного мозга.
Перивентрикулярная лейкомаляция и механизм ее развития
Так как очаги некроза располагаются чаще всего в перивентрикулярных областях белого вещества полушарий головного мозга, то почти всегда развивается именно перивентикулярная лейкомаляция (ПВЛ).
Заболевание почти встречается у недоношенных малышей (редко недоношенных), причем есть прямая зависимость от массы тела. В основном заболеванием страдают малыши, вес которых составляет от 1500 до 2000 грамм. В этом случае патология фиксируется у каждого третьего малыша.
Если верить статистике, то практически 60 % недоношенных детей, или появившихся на свет при помощи кесарево сечения в той иной степени страдают от этого заболевания.
Нейросонограмма — стрелкой указан очаг ПВЛ
Так как главным фактором, который провоцируют лейкомаляцию, является кислородное голодание, то в области поражение также может развиться кистозное образование или полость. И формируются они не в утробе, а на первом месяце жизни. Поэтому обязательным условием для каждого новорожденного достигшего месячного возраста является проведение нейросонографии.
При данном заболевании в мозгу гибнут нервные клетки, а вместо них образуются рубцы. Также для данного нарушения характерно повторное кровоизлияние.
Короткая анатомическая справка
Очаги заболевания бывают около 2-3 миллиметров диаметре и могут быть обнаружены в теменных долях и лобных. При этом их образование абсолютно ассиметрично.
Основным исходом заболевания является образование огромного количества кист, при этом они все разных размеров. На появление некроза и образования кистозных соединений уходит около двух недель, а затем в мозгу малыша происходит спадание полостей - то есть атрофия нервных тканей головного мозга.
Провоцирующие факторы
ПВЛ у недоношенных детей возникает по следующим причинам:
- недоношенность малыша, соответственно, как ранее уже обозначалось, идет привязка к массе тела;
- в большей степени это заболевание поражает мальчиков, так как у девочек оно встречается реже;
- вредные привычки будущей мамы;
- если у мамы в крови больше количество содержания углекислого газа или же кислородное отравление, то малыш в наибольшей степени подвержен данному заболеванию.
Симптомы и проявления
При осмотре малыша невролог видит, что происходит избыточная нервно-рефлекторная возбудимость или же наоборот происходит так, что она полностью отсутствует.
Малыша мучает судорожный синдром, характерно появление гипотонуса мышц. Эти симптомы может определить только врач.
Но и родители должны обращать внимание на то, как меняется их малыш. Если заболевание имеет место быть, то у малыша начинает развиваться косоглазие. Так же ребенок перестает реагировать на действия окружающих, а впоследствии, в большей степени не понимает, чего от него хотят.
Вот как выглядит ребенок, у которого диагностирована лейкомаляция головного мозга и другие дружественные патологии…
Как помочь малышу?
Церебральная лейкомаляция сопровождается изменениями нервной ткани и данные изменения необратимы, и, к сожалению, какой-либо четкой схемы лечения заболевания на данный момент просто нет. Как правило, врачи смотрят на симптоматику, а затем назначают лечение в зависимости от проявлений нарушения.
Для лечения заболевания применяют ноотропные лекарства, благодаря которым происходит улучшение кровотока в головном мозге и также улучшается метаболизм. Препараты, которые чаще всего назначают - Пирацетам, Стугерон.
Вся остальная терапия, назначенная врачом, идет на исправление двигательных движений, а также нарушений психомоторного развития.
Для того чтобы избежать появления заболевания акушеры стараются сохранить беременность как можно дольше. Но в случае, если малыш родился недоношенным, то они необходимо сделать все возможное для его безопасности. Сразу после родов налаживается дыхание, и оно обязательно контролируется. Важно, чтобы было правильное соотношение кислорода и углекислого газа в крови, должно быть в норме артериальное давление.
Если малыш подрос…
После того, как малыш достигает возраста одного года, лечение становится больше симптоматическим. Состояние ребенка в этот период требует постоянного наблюдения и в случае обнаружения симптомов лейкомаляции, ему назначаются такие препараты, как: Пантогам, Фенибут. Благодаря их применению происходит тормозной эффект в образований зон некроза в коре мозга.
Если у ребенка фиксируется нарушение сна, то ему прописываются успокаивающие препараты - Валериана и Мелисса. Также хорошим эффектом обладают водные процедуры.
Если у малыша фиксируется повышение артериального давления, то назначают препараты Диакарб, Фуросемид или Глицерин. Но последние два препарата не применяются самостоятельно, обязательно необходимо, чтобы в организм поступал калий.
Все судорожные проявления убираются с помощью препарата Фенобарбитал. Если его применение вызывает тахикардию и давление, то его можно заменить его на бета-адреноблокаторы - Анаприлин и Обзидан.
Так как заболевание влечет за собой нарушение в работе двигательного аппарата, то назначают массаж и упражнения, а также физиотерапевтическое лечение.
В особо сложных случаях развивается респираторный дистресс-синдром. Для того, чтобы его избежать применяются препараты сурфактаната. Благодаря его применению уменьшается тяжесть дыхательного расстройства и потребность в аппарате для вентиляции легких пропадает.
…А вот какие методы реабилитации могут помочь:
Профилактические меры
Чтобы снизить риски развития лейкомаляции необходимо:
- продлить срок беременности, так как, чем меньше срок, тем больше вероятность в развитии данного заболевания;
- по возможности необходимо предупредить у роженицы преждевременные роды.
Но не только врач может повлиять на развитие беременности, но и сама беременная может изменить ситуацию в положительную сторону. Что нужно делать:
- прежде всего, беременная женщина - это будущая мать и она должна вести здоровый образ жизни;
- нельзя, чтобы беременность возникла спонтанно, ее необходимо тщательно запланировать;
- питание должно быть слаженным и сбалансированным;
- каждая женщина в положении должна встать на учет и строго следовать рекомендациям врачей;
Во время беременности нужно стараться не болеть различными заболеваниями, особенно вирусными и инфекционными. Из-за перенесенного заболевания может пострадать будущий малыш.
Последствия для будущего ребенка и взрослого человека
Ребенок, у которого появляются первые симптомы заболевания не отличается ни чем, от здорового, но как только болезнь начинает прогрессировать, она становится основной причиной развития детского церебрального паралича.
При это тяжесть симптомов ДЦП будет зависеть от тяжести и зоны повреждения головного мозга.
У самого ребенка в этот период можно заметить:
- нарушения в сознании;
- изменения в дыхательных функциях;
- изменяется функция глотания;
- повышается артериальное давление;
- сильно страдает умственное развитие и изменяется работа ЦНС.
Прогноз зависит от масштаба самого заболевания. Если нарушения минимальные, то они ведут к изменениям неврологического статуса, а если они максимальные, то может развиться детский церебральный паралич.
Благодаря тому, что медицина не стоит на месте, проведенное лечение может способствовать уменьшению рисков появления такого рода заболеваний.
Это изменения в ткани мозга, которые выглядят как небольшие полости, кисты. Поэтому наблюдение за ребенком становится еще более тщательным, так как они могут стать причиной развития детского церебрального паралича.
Однако судить о степени тяжести и типе ДЦП по таким изменениям сложно. Ведь все зависит от величины, расположения и количества кист. Одиночные кисты менее опасны, чем множественные. Маленькие кисты не так опасны, как большие.
Кисты расположены в ткани головного мозга на пути нервно-мышечных проводящих путей. И они обеспечивают связь головного мозга и мышечных волокон, поэтому перерыв этих путей может вызвать ДЦП. Тем не менее возможности человеческого мозга мало изучены. Часто бывает, что здоровые участки мозга берут на себя функцию поврежденных, и нарушения у ребенка сводятся к минимуму.
Перивентрикулярная лейкомаляция чаще развивается у недоношенных детей, и это связано с особенностями кровоснабжения перивентрикулярной области. Кроме того, к перивентрикулярной лейкомаляции приводят тяжелые внутрижелудочковые кровоизлияния 4 степени. Перивентрикулярная лейкомаляция нередко развивается на фоне врожденного сепсиса.
Предсказать появление кист бывает очень сложно. Поэтому, чтобы исключить их развитие, во многих клиниках перед выпиской ребенку, родившемуся с весом менее 1000 г, проводят магнитно-резонансную томографию головного мозга.
Крючко Дарья Сергеевна
Начальник Отдела анализа и координации работы по совершенствованию оказания неонатологической помощи
ФГБУ «Научный Центр Акушерства, Гинекологии и Перинатологии имени академика В. И. Кулакова Министерства здравоохранения Российской Федерации,
Директор дирекции социальных проектов Фонда социально-культурных инициатив.
Что такое гидроцефалия? Почему она возникает? И как лечат детей с таким диагнозом?
- Гидроцефалия (от др.-греч. ὕδωρ «вода» + κεφαλή «голова») - это избыточное скопление спинномозговой жидкости - ликвора - внутри головного мозга. В народе это заболевание еще называют водянкой головного мозга.
Ликвор вырабатывается постоянно в желудочках головного мозга, циркулирует внутри черепа, а потом всасывается на поверхности головного мозга мелкими венами в ток крови.
Ликвор предохраняет головной и спинной мозг от внешних механических воздействий, а также выводит из мозга вредные вещества и доставляет полезные. В норме количество вырабатываемого ликвора должно равняться количеству всасываемого. Но так бывает не всегда.
Существуют два больших вида гидроцефалии:
Первый - окклюзионная гидроцефалия, когда отток ликвора нарушается из-за какого-то механического препятствия.
Второй вид - арезорбтивная гидроцефалия, при которой снижена способность к всасыванию ликвора.
У многих недоношенных младенцев случаются внутрижелудочковые кровоизлияния. Кровь попадает внутрь ликвора, образует тромбы, и они механически могут закупоривать узкие места внутри полостей головного мозга - желудочков. Эти узкие места - так называемый водопровод мозга и выход из 4 желудочка.
При этом ликвор продолжает вырабатываться, а вышележащие отделы начинают расширяться. Это окклюзионные формы гидроцефалии. В результате возникает сдавление мозга, бесконтрольный рост головы, нарушается развитие малыша.
Арезорбтивная гидроцефалия возникает в результате нарушения всасывания. Одной из причин этого тоже могут являться внутрижелудочковые кровоизлияния: кровь попадает в ликворные пространства вокруг головного мозга. Происходит гибель образований, которые всасывают ликвор. Недостаток кислорода тоже может вызывать гибель структур, которые отвечают за всасывание.
В этом случае также наблюдается типичная картина гидроцефалии: рост головы, нарушение развития. Но к какому-то моменту жизни, в возрасте от 6 до 9 месяцев, ситуация нормализуется и часто не требует хирургического лечения, в отличие от окклюзионной формы гидроцефалии.
Также механическое нарушение оттока ликвора вызывают воспалительные процессы - менингит, менингоэнцефалит, вентрикулит, которые приводят к формированию спаек внутри ликворной системы.
- Внутрижелудочковое кровоизлияние - это то, с чем чаще всего сталкиваются недоношенные дети. Есть ли возможность этого избежать?
- Существует 4 степени внутрижелудочкового кровоизлияния. 1 степень - самая благоприятная - это кровоизлияние без прорыва в желудочковую систему. Она не приводит к механической закупорке ликворных путей и формированию гидроцефалии. Чаще всего протекает бессимптомно, ее находят по ультразвуку - практически никаких последствий это не несет.
Остальные формы опасны тем, что происходит прорыв крови в желудочки мозга с формированием тромбов внутри желудочков и механическая закупорка этими тромбами узких отверстий. В результате расширяется либо 3 либо 4 желудочка (можно встретить термин тривентрикулярная или тетравентрикулярная гидроцефалия - в зависимости от количества расширенных полостей).
Единственное, что врач может сделать, чтобы препятствовать возникновению внутрижелудочковых кровоизлияний - ввести ребенку препарат Викасол. Есть некоторые реанимационные приемы, которые могут вести к повышению внутричерепного давления и повышать риск разрыва мелких сосудиков - это тоже может играть роль. В остальном избежать довольно сложно.
- Обычно на 3-5 сутки делают детям УЗИ и диагностируют кровоизлияние 2-3 степени. Что происходит дальше? Когда принимают решение о хирургическом вмешательстве?
- Допустим, мы делаем ультразвук на третьи сутки жизни и видим, что есть внутрижелудочковое кровоизлияние второй степени. Начинается массивная гемостатическая (кровоостанавливающая) терапия, идет терапия, которая препятствуют отеку головного мозга и снижает венозное давление. Дальше мы продолжаем наблюдать ультразвуком ситуацию (на мой взгляд, это безопасный метод, УЗИ можно делать ежедневно и несколько раз в день). Если мы видим, что тромбы не увеличиваются в размерах, то мы продолжаем ту же терапию и дальше наблюдаем.
Если мы видим нарастание степени кровоизлияния, расширение желудочков мозга - это кровоизлияние 3 степени. При 4 степени происходит тампонада желудочков - все желудочки забиты кровью, имеются внутримозговые гематомы, то есть кровь изливается не только в желудочки, но и в сам мозг. Эта ситуация требует быстрого хирургического решения по удалению гематомы и отмыванию этих сгустков.
При 2-3 степени выжидательная тактика идет, наблюдаем - если гидроцефалия нарастает, мы можем избрать активную хирургическую тактику по отмыванию сгустков. Не все этим владеют. Должна быть хорошая детская эндоскопическая техника, навыки. Заграницей довольно часто пользуются этим методом. Если хорошо быстро все отмыть, то можно избежать возникновения гидроцефалии.
Также если гидроцефалия развивается, рассматривается вопрос о временном отведении ликвора, чтобы снизить давление в голове и нагрузку на головной мозг. Нейрохирург может поставить так называемый наружный дренаж - трубочку, которая будет отводить ликвор наружу в специальный мешочек-ликвороприемник.
То есть вся эта лишняя жидкость течет наружу. Мы удаляем излишки крови, продуктов распада крови из ликвора - это раз. Имеем возможность контролировать анализ ликвора - это два. Если нужно, по дренажу в обратную сторону мы можем вводить кровоостанавливающие препараты и антибиотики, если вдруг не дай бог у нас присоединяется какая-то инфекция. Да, антибиотики напрямую в голову - в некоторых случаях мы практиковали такие вещи, и это помогало. Особенно когда дети переводились из других стационаров, где уже долго шла антибактериальная терапия, их давно лечили и уже лечить нечем.
Источник: Журнал «Нейрохирургия и неврология детского возраста» №2 2014г.
- Мы знаем, что крайний этап лечения гидроцефалии - это шунтирование. А для чего нужен этот промежуточный этап с кармашком под кожей и ликвороприемником?
- Что такое шунт? Это способ отведения лишней спинномозговой жидкости из головы в брюшную полость. В брюшной полости жидкость должна всосаться в венозное русло. Если в ликворе имеются продукты распада крови или вообще чистая кровь, если высоко содержание белка, брюшина эту жидкость не всосет, поэтому шунтирующая система работать не будет.
Также шунтирующая система внутри себя имеет тонкие канальцы, и если кровь попадет в них, эти же тромбы будут образовываться внутри системы, забивая ее проходимость - работать она не будет. Поэтому шунтирующая система ставится в том случае, когда нет никаких противопоказаний со стороны спинномозговой жидкости. Это отсутствие признаков воспаления, отсутствие крови в ликворе и нормальный уровень белка.
Если ситуация не позволяет провести шунтирующую операцию, то делаются временные манипуляции, чтобы стабилизировать состояние малыша, очистить ликвор, побороть воспалительный процесс в ликворе - выиграть время и уже потом поставить шунтирующую систему.
- Расскажите пожалуйста о последствиях гидроцефалии.
- Чем больше степень внутримозгового кровоизлияния, тем тяжелее последствия. Это можно сравнить с губкой, которую мы положим под шкаф и достанем через 3 месяца - она не расправится до своего первоначального вида. Это грубое сравнение, но оно хорошо иллюстрирует то, что происходит с мозгом. Происходит разрастание соединительной ткани внутри мозга, он теряет свои эластические свойства, нарушается микрокровообращение. В зависимости от локализации кровоизлияния, могут выпадать довольно серьезные функции. Это приводит к развитию гемипарезов, тетрапарезов, зрительных нарушений, довольно часто мы наблюдаем сходящееся косоглазие.
Выраженное сдавление затылочных долей ведет к нарушениям зрения. При большом повышении давления развивается отек зрительного нерва, с исходом в частичную атрофию. Об общей задержке развития тоже нельзя забывать. В довольно большом проценте случаев у этих детей в последующем возникает эпилепсия. Чем позднее происходит нейрохирургическое вмешательство, тем выше риски.
Но последствия не у всех: есть дети, которые пережили гидроцефалию, а потом выросли, женились, детей родили, и все у них хорошо. То есть, дети абсолютно разные, и прогнозировать в общей массе очень трудно.
- Это правда, что компенсаторные возможности мозга недоношенного ребенка гораздо выше, чем у ребенка доношенного, который переживает такую же катастрофу после рождения?
- Да, конечно. Взрослый человек от того, что переживают дети, вообще бы погиб. Ни для кого не секрет, что мы не используем на полную мощность резервы своего мозга. То же самое происходит у малышей - у них резервное состояние гораздо выше, ввиду того, что мозг еще продолжает развиваться. Если помогают нейрохирурги, неврологи, можно добиться очень хороших результатов. А если еще родители активно участвуют в дальнейшей реабилитации, то вообще замечательно.
Во следующих материалах - подробно о шунтировании и особенностях жизни с шунтом.
Читайте также:
