Нарушения обмена глюкозы у новорожденного с неврологическими проявлениями: гипогликемия, гипогликорахия, гипергликемия
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
Глюкоза является основным источником энергии для центральной нервной системы (ЦНС) уже с периода внутриутробного развития. Примерно 90% глюкозы, циркулирующей в крови плода, участвует в окислительных биохимических реакциях в ткани мозга. Депонирование углеводов в ЦНС отсутствует, в связи с чем важным условием нормального церебрального энергетического метаболизма является регулярный транспорт глюкозы в нервную ткань. Ферментативные системы глюконеогенеза и гликогенолиза в эмбриональном периоде неактивны, поэтому энергетическая потребность плода обеспечивается глюкозой, поступающей от матери трансплацентарно по градиенту концентрации со скоростью 4-6 мг/кг/мин (7 г/кг/сут). Гликемия плода составляет 60-80% от концентрации глюкозы в крови беременной женщины 1.
После рождения нормогликемия обеспечивается энтеральным потреблением углеводов (лактоза грудного молока) и собственной эндогенной продукцией глюкозы (печеночный глюконеогенез, гликогенолиз). Следует отметить, что даже у здоровых доношенных новорожденных биохимические пути синтеза глюкозы активизируются в течение первых 2-3 дней жизни и продолжают формироваться на протяжении последующих нескольких недель (физиологическая незрелость гомеостаза углеводов). По данным литературы, половина здоровых новорожденных в первые 8-12 ч после рождения не способны удерживать голодовой нормальный уровень глюкозы в плазме [4]. Использование же альтернативных источников энергии (кетоновые тела, аминокислоты, лактат, глицерин, короткоцепочечные жирные кислоты и др.) в неонатальном периоде ограничено в связи с незрелостью ферментативных систем. Кроме того, существует ряд перинатальных факторов, приводящих к пролонгированию гипогликемии. К ним относятся перинатальная асфиксия, сахарный диабет у беременной, недоношенность, задержка внутриутробного развития (ЗВУР), прием некоторых медикаментов и др. В ряде случаев персистирование гипогликемии может быть обусловлено врожденными нарушениями обмена веществ, ферментопатиями или дисфункцией эндокринных желез, так как метаболизм глюкозы осуществляется с участием различных ферментов и регулируется гормонами (инсулин, глюкагон, кортизол, адреналин и др.). Указанные обстоятельства обусловливают высокую частоту встречаемости гипогликемий у новорожденных (1-5 случаев на 1000 живорожденных, не относящихся к группам риска) [4].
Влияние низкого уровня глюкозы на развитие нервной системы детей активно дискутируется. Многочисленные исследования показывают, что гипогликемии в неонатальном периоде приводят к различным неврологическим нарушениям в постнатальной жизни (судорожный синдром, задержка психомоторного развития, сниженные показатели IQ, нарушение когнитивных функций и др.) [3, 5-8]. Это связано с повреждающим действием низкого уровня глюкозы на нейроны головного мозга.
Дефицит глюкозы в ЦНС увеличивает продукцию лактата, способствует развитию тканевого ацидоза, снижению уровня креатинфосфата и АТФ в клетках мозга. Вследствие этого возникают деполяризация мембраны нейрона и тканевые электролитные нарушения - поступление калия в экстрацеллюлярное пространство и внутриклеточное повышение уровня натрия, хлорида и кальция. Указанные изменения приводят к аккумуляции жидкости в нейронах, высвобождению свободных радикалов, активации простагландинов, тромбоксанов и лейкотриенов, развиваются отек нейронов, атрофия глиальных клеток и демиелинизация белого вещества. Спазм сосудов, обусловленный повышенным содержанием внутриклеточного кальция, усугубляет гипоксию ткани мозга, что в конечном итоге приводит к необратимому повреждению мембран клеток и селективной гибели нейронов [1, 3, 5-9].
По мнению ряда авторов, поражение ЦНС при гипогликемии и развитие нейронального некроза обусловлено нарастанием содержания нейромодулятора глутамата с последующей активацией и увеличением количества функциональных NMDA-рецепторов. Сопутствующие изменения в цикле трикарбоновых кислот приводят к нарушению окислительных процессов, нарастанию свободных радикалов, повреждению митохондриальных мембран и ДНК, снижению активности NADH-дегидрогеназы и количества АТФ. Кроме того, гипогликемия повышает чувствительность NMDA-рецепторов к действию глутамата, что в сочетании с нарушением митохондриального метаболизма приводит к активации клеточных фосфолипаз и протеаз и нарушению синаптической передачи. Конечным результатом указанных процессов являются изменение трансмембранных ионных потоков, нарушение процесса ветвления дендритов, активация апоптоза, гибель нейронов и последующее развитие метаболической (гипогликемической) энцефалопатии. Важно, что для развития незрелого мозга решающее значение имеет нормальный уровень активности рецепторов NMDA, поэтому содержание глутамата коррелирует с выраженностью метаболических изменений в ЦНС в зависимости от гестационного возраста [2, 3].
Наиболее неблагоприятные последствия наблюдаются при одновременном воздействии гипогликемии и церебральной гипоксии. Механизмы развития патологических изменений в ЦНС при указанных состояниях практически идентичны, а при сочетании их отмечается синергическое взаимодействие. Анаэробный гликолиз, возникающий при гипоксии, усугубляет дефицит глюкозы в тканях мозга и ускоряет снижение содержания АТФ. Гипогликемия нарушает защитный эффект вазодилатации мозговых кровеносных сосудов, появляющийся при гипоксии в условиях нормального гомеостаза глюкозы. Кроме того, увеличение объемной скорости мозгового кровотока (защитный механизм при гипогликемии) в сочетании с гипоксией может приводить к риску кровоизлияния [3, 5-7, 9].
Согласно данным литературы, при неонатальных гипогликемиях в первую очередь повреждаются нейроны коры, стриарной системы и гиппокампа. В последующем у таких детей нарушаются когнитивные и сенсорные функции, формируются задержка моторного развития и поведенческие дефекты [1, 3, 5-9]. У 35-50% новорожденных с клиническими гипогликемиями и 20% младенцев с асимптомными гипогликемиями в последующем имеются различные неврологические проблемы [3].
По данным S. Chandran и соавт. [1], у новорожденных через 7 дней после гипогликемии при МРТ головного мозга визуализируются гиперинтенсивные сигналы в теменно-затылочной области. Эти изменения сочетаются с повышенным содержанием лактата и свободных жирных кислот в крови и с большой долей вероятности свидетельствуют о влиянии низкого уровня глюкозы на ЦНС.
В литературе представлены результаты изучения катамнеза доношенных детей без гипоксии при рождении, у которых имела место неонатальная гипогликемия. Полученные данные указывают на высокую частоту (до 90-94%) структурных изменений головного мозга (по данным МРТ) у этих пациентов в возрасте 1,5 года (кортикальные поражения, поражения базальных ганглиев и/или таламуса, признаки кровоизлияния в белое вещество, инфаркты в бассейне средней мозговой артерии) [1-3, 5]. У недоношенных детей на втором году жизни обнаружена корреляция между длительностью гипогликемии в неонатальном периоде и последующей патологией ЦНС. Так, младенцы с персистирующей гипогликемией (свыше 5 дней) в последующем имели задержку психомоторного развития, а также более высокую частоту детского церебрального паралича, чем недоношенные с кратковременным аналогичным снижением уровня глюкозы крови или однократным эпизодом тяжелой гипогликемии.
Важно подчеркнуть, что в большинстве случаев неонатальные гипогликемии протекают бессимптомно, даже при существенном снижении уровня глюкозы крови. Вместе с тем несколько когортных исследований, выполненных в разных странах, установили высокую частоту дефицита внимания и малой мозговой дисфункции у детей, имеющих в анамнезе бессимптомные гипогликемии [1, 3, 5]. Ряд авторов указывают на причастность тяжелой неонатальной гипогликемии к развитию судорожного синдрома в раннем детском возрасте [1-3, 5].
Все это определяет актуальность проблемы неонатальных гипогликемий. Цель настоящей публикации - представить обобщенные данные по тактике ведения новорожденных детей с низким содержанием глюкозы крови.

Гипогликемия новорожденного - это снижение концентрации глюкозы в крови
Клинические варианты гипогликемии у новорожденных
1. Бессимптомная гипогликемия (низкий уровень глюкозы в крови не проявляется клинической симптоматикой, возможны неблагоприятные отсроченные последствия).
2. Симптоматическая гипогликемия (низкий уровень глюкозы в крови сочетается с клиническими проявлениями).
NB ! Наиболее часто у новорожденных детей отмечаются бессимптомные гипогликемии.
Особенность клиники гипогликемии у новорожденных - неспецифичность симптомов (аналогичные проявления могут быть при других заболеваниях).
Дифференциально-диагностические признаки гипогликемии у новорожденного (триада Уиппла) [3, 5-7]:
- появление клинических симптомов при лабораторно низком уровне глюкозы крови;
- исчезновение этих симптомов при нормализации уровня гликемии;
- возобновление клинических симптомов при снижении уровня глюкозы крови.
Наиболее частые клинические симптомы при гипогликемии у новорожденного [3, 5, 6]:
- глазная симптоматика (круговые, плавающие движения глазных яблок, нистагм, снижение тонуса глазных мышц, исчезновение окулоцефального рефлекса);
- слабый высокочастотный пронзительный неэмоциональный крик;
- слабость, вялость, «бедность» движений;
- вялое сосание, срыгивания, анорексия;
- повышенная возбудимость, раздражительность;
- повышенный рефлекс Моро.
Менее частые симптомы при гипогликемии у новорожденного:
- периоральный, общий цианоз или акроцианоз;
- нестабильность температуры тела (склонность к гипотермии);
- тахикардия, тахипноэ, артериальная гипотензия;
- бледность кожи, повышенное потоотделение;
NB! Гипогликемия (даже бессимптомная) в периоде новорожденности без лечения может привести к необратимому повреждению головного мозга.
В зависимости от этиологии и патогенеза неонатальные гипогликемии могут быть транзиторными (преходящими) и персистирующими (стойкими).
Гипогликемия
Гипогликемия - это снижение плазменной концентрации глюкозы менее 2,8 ммоль/л. Причины включают несоблюдение режима инсулинотерапии при диабете (пропуск приема пищи, физическая нагрузка, употребление алкоголя), различные эндокринные и метаболические расстройства, онкологические заболевания. Клинический симптомокомплекс представлен вегетативными и нервно-психическими расстройствами разной степени выраженности. Диагноз устанавливается на основании обнаружения низкого содержания глюкозы в плазме натощак либо после приема пищи. Для купирования гипогликемии применяются пероральные быстроусваиваемые углеводы, введение глюкозы или глюкагона.
Гипогликемия - это не самостоятельное заболевание, а клинико-лабораторный синдром. При диабете данное состояние встречается примерно у 40-60% пациентов. Среди людей с сахарным диабетом 1 типа процент случаев гипогликемии несколько выше, однако, ввиду гораздо большей распространенности сахарного диабета 2 типа, преобладающее число эпизодов гипогликемии приходится на эту форму СД. Причем при диабете у больных с длительной гипергликемией (декомпенсация) симптомы начинают возникать уже при уровне глюкозы 5-6 ммоль/л. Находящаяся в процессе созревания нервная система детей (особенно новорожденных) расходует большее количество глюкозы и поэтому более остро реагирует на гипогликемию.
Причины гипогликемии
Состояние имеет множество этиологических факторов. У здорового человека причинами снижения глюкозы меньше нормальных значений могут быть беременность, интенсивные физические нагрузки, длительное голодание. Однако такие случаи крайне редки. Чаще всего гипогликемия развивается при различных заболеваниях и патологических состояниях:
- Погрешности инсулинотерапии при диабете. Считаются наиболее частой причиной гипогликемии. В основном она развивается, если пациент, регулярно выполняющий себе инъекции инсулина, пропускает прием пищи, употребляет алкоголь, начинает заниматься физическими упражнениями. Иногда причиной становится нарушение техники инъекции, случайная или преднамеренная передозировка инсулина.
- Гиперинсулинизм. Секреция в кровь неадекватно большого количества инсулина бета-клетками поджелудочной железы встречается при инсулиноме, гиперплазии островков Лангерганса (незидиобластозе). Также причинами избыточной продукции инсулина и инсулиноподобного фактора роста являются некоторые злокачественные опухоли (карцинома, мезотелиома). Гипогликемия может возникнуть при наличии аутоантител к инсулину, связывающихся с инсулиновыми рецепторами (болезнь Хирата).
- Эндокринные расстройства. Дефицит так называемых контринсулярных гормонов, т.е. гормонов с антагонистическим действием по отношению к инсулину (кортизол, тироксин, соматотропин) наблюдается при гипотиреозе, надпочечниковой недостаточности, гипофизарном нанизме.
- Прием лекарств. Кроме инсулина причиной снижения концентрации глюкозы могут быть другие лекарственные препараты. В первую очередь к ним относятся медикаменты, использующиеся при диабете 2 типа (сахароснижающие средства), которые стимулируют выработку инсулина поджелудочной железой - производные сульфонилмочевины (глибенкламид), глиниды (репаглинид).
- Операции на органах ЖКТ. Такие оперативные вмешательства на органах пищеварения, как резекция желудка или начального отдела тонкой кишки, приводят к демпинг-синдрому, обусловленному ускоренным попаданием в кишечник непереваренной пищи. В результате этого происходит недостаточное расщепление и всасывание углеводов.
- Наследственные заболевания. Это тяжелые метаболические заболевания (гликогенозы, галактоземия, фруктоземия), характеризующиеся генетически детерминированным дефектом ферментов, участвующих в обмене углеводов (гликогена, фруктозы, галактозы). В результате дефицита энзимов происходит нарушение превращения глюкозы из других углеводов или затруднение ее высвобождения из гликогена, что становится причиной падения уровня гликемии.
К развитию гипогликемии предрасполагают хронические заболевания, при которых замедляется клиренс сахароснижающих препаратов, регулирующих уровень глюкозы в крови - почечная, печеночная недостаточность. Гипогликемический эффект производных сульфонилмочевины усиливается при их одновременном приеме с сульфаниламидами, салицилатами, синтетическими противомалярийными средствами. Также гипогликемии способствует замедление опорожнения желудка (диабетический гастропарез).
Патогенез
Глюкоза - это основной энергетический субстрат для центральной нервной системы. Поэтому ЦНС очень чувствительна к гипогликемии. Сначала в качестве компенсаторной реакции в кровь выбрасываются контринсулярные гормоны, в том числе катехоламины (адреналин, норадреналин), которые выступают причиной вегетативной симптоматики. Если глюкоза продолжает находиться на низком уровне, возникает нейрогликопения.
Клетки головного мозга (главным образом, кора больших полушарий, диэнцефальные структуры) начинают испытывать энергетическое голодание, в них тормозятся все обменные процессы, окислительно-восстановительные реакции и т.д. Сохраняющаяся гипогликемия поражает продолговатый мозг, верхние отделы спинного мозга, что приводит к угнетению рефлексов, судорожной готовности головного мозга, нарушению сознания, коме. Патоморфологические изменения включают отек, некроз отдельных участков головного мозга.
Классификация
Выявление гипогликемии в анализе крови не всегда соответствует действительности. Ложная, или псевдогипогликемия, может встречаться при лейкоцитозе, эритроцитозе. Отдельно выделяют транзиторную гипогликемию новорожденных, родившихся от матерей, страдающих сахарным диабетом. По степени тяжести гипогликемию разделяют на легкую, среднюю, тяжелую, по течению - на острую, подострую, хроническую. По этиопатогенезу различают следующие виды гипогликемии:
- Тощаковая (спонтанная). Развивается при избыточной секреции инсулина, инсулиноподобного фактора и заболеваниях, сопровождающихся дефицитом контринсулярных гормонов.
- Реактивная (постпрандиальная). Возникает через 2-4 часа после еды. Причиной является ранняя стадия СД, наследственные метаболические расстройства, пострезекционные синдромы, аутоиммунный инсулиновый синдром.
- Индуцированная. Развивается при диабете, вызывается приемом алкоголя, лекарственных средств.

Симптомы гипогликемии
Наличие симптоматики и ее выраженность могут не коррелировать с уровнем гликемии. Первые симптомы обусловлены активацией симпато-адреналовой системы (выбросом адреналина, норадреналина). Возникает резкое и сильное чувство голода, мышечная дрожь, потливость. Сердечно-сосудистая система реагирует учащением сердцебиения, повышением артериального давления, стенокардическими болями в сердце. Присоединяются нервно-психические симптомы: беспокойство, двигательное возбуждение, подавленное настроение или, наоборот, чувство эйфории.
Характерны парестезии (ощущение покалывания губ, языка, кончиков пальцев). Это так называемый адренергический или вегетативный синдром. Если гипогликемия продолжается, развивается нейрогликопения. Ухудшается концентрация внимания, координация движений (атаксия), речь становится невнятной, смазанной. Больного начинает клонить в сон, он плохо реагирует на внешние раздражители, иногда появляются фотопсии (вспышки молний перед глазами), зрительные галлюцинации.
Тонико-клонические судорожные припадки, напоминающие эпилепсию, свидетельствуют о глубоком угнетении нервной системы и крайне тяжелом состоянии пациента. Развитие судорог предшествует гипогликемической коме. У лиц с хронической гипогликемией (при инсулиноме) единственным клиническим проявлением может быть периодически возникающая головная боль, которая быстро прекращается после приема углеводной пищи. При снижении концентрации глюкозы в ночное время некоторых пациентов беспокоит тревожный сон или кошмарные сновидения. Существуют также атипичные гипогликемические симптомы - тошнота, рвота, брадикардия.
Осложнения
Гипогликемия тяжелой степени характеризуется широким спектром неблагоприятных последствий с высокой частотой летального исхода. К наиболее частым из них относятся сердечно-сосудистые осложнения (гипертонический криз, инфаркт миокарда, инсульт), обусловленные выбросом большого количества катехоламинов в кровь. Гипогликемия также может вызвать жизнеугрожающие нарушения ритма сердца, например, пароксизмальную желудочковую тахикардию, причиной которой становится удлинение интервала QT. Осложнения глубокой гипогликемии включают отек мозга, кому, остановку дыхания и сердцебиения.
Диагностика
Курацией пациентов с гипогликемией занимаются врачи-эндокринологи. На первичном приеме врач опрашивает пациента, какие лекарства он принимает, проводились ли ему какие-либо операции. При общем осмотре больного обращается внимание на влажность кожных покровов, расширение зрачков (мидриаз), угнетение физиологических рефлексов (сухожильных, кожных) и появление патологических (рефлекс Бабинского).
Для органического гиперинсулинизма (инсулинома, незидиобластоз) характерна триада Уиппла: приступы спонтанной гипогликемии, снижение уровня глюкозы во время приступа ниже 2,8, быстрое прекращение приступа введением глюкозы или приемом углеводов. Наиболее сложную задачу представляет собой установление причины гипогликемии. Для этого назначается дополнительное обследование, включающее:
- Лабораторные исследования. В анализах крови измеряется С-пептид, глюкозо-инсулиновое соотношение. При диабете проводится глюкозотолерантный тест, анализ на гликированный гемоглобин. Проверяется наличие антиинсулиновых антител, антител к инсулиновым рецепторам. Изучается концентрация контринсулярных гормонов (тиреотропного гормона, свободного тироксина, соматотропина, выполняется проба с АКТГ). Исследуется активность ферментов углеводного метаболизма (глюкозо-6-фосфатазы, фосфофруктокиназы, гликогенсинтетазы).
- Провокационные пробы. Диагностика инсулином крайне трудна, поэтому очень часто выполняются различные провокационные тесты. Наиболее информативной является проба с 72-часовым голоданием. Также проводятся стимуляционные тесты на подавление С-пептида после введения глюкагона, лейцина, толбутамида.
- ЭКГ. На электрокардиограмме обнаруживаются синусовая тахикардия, предсердные, желудочковые экстрасистолии, удлинение QT-интервала, иногда может регистрироваться пароксизмальная желудочковая тахикардия. При развитии ишемии миокарда вследствие избытка катехоламинов отмечается депрессия сегмента ST, отрицательный зубец Т.
- Визуализация инсулиномы. Примерно у 50% пациентов инсулиному удается визуализировать с помощью УЗИ и КТ органов брюшной полости. Большей чувствительностью обладают мультиспиральная томография, интраоперационное УЗИ. Очень эффективным способом диагностики признана селективная панкреатическая артериография с введением глюконата кальция и последующим забором крови для измерения уровня инсулина, глюкозы.
Гипогликемию следует дифференцировать с алкогольным опьянением, эпилепсией, вегетативным кризом (панические атаки). Также необходимо исключить ОНМК. Возбужденное психическое состояние, выраженное двигательное беспокойство нужно отличать от психических расстройств (истерии, психозы). При диабете по клиническим признакам бывает достаточно сложно отдифференцировать гипогликемическую кому от гипергликемической.

Лечение гипогликемии
Консервативная терапия
Для лечения легкой гипогликемии достаточно принять легкоусвояемые углеводы - фруктовый сок, сладкий чай, несколько кусочков рафинированного сахара. При средней и тяжелой степени необходима госпитализация больного в отделение эндокринологии, а при угнетенном сознании и коме - в отделение реанимации и интенсивной терапии, где проводится:
- Купирование гипогликемии. Внутривенно вводится раствор глюкозы, если больной не приходит в сознание, продолжается ее капельное введение. Также эффективно внутримышечное введение глюкагона (кроме гипогликемий, вызванных алкоголем и производными сульфонилмочевины). Для улучшения утилизации глюкозы нейронами применяется аскорбиновая кислота. С целью профилактики отека головного мозга у тяжелых пациентов используется сернокислая магнезия, дексаметазон, диуретики (маннитол или фуросемид).
- Лечение основного заболевания. Если причиной гипогликемии стал дефицит контринсулярных гормонов, проводится заместительная гормональная терапия (гидрокортизон, флудрокортизон, L-тироксин). При аутоиммунном инсулиновом синдроме применяются глюкокортикостероиды, иммуносупрессанты, сеансы плазмафереза. Для лечения злокачественных инсулином при наличии противопоказаний к операции назначается препарат стрептозоцин, вызывающий гибель бета-клеток ПЖЖ. Для улучшения моторно-эвакуационной функции желудка при диабете применяются прокинетики (итоприд).
Хирургическое лечение
Наиболее эффективным способом лечения инсулином и незидиобластоза является хирургическая операция. В 90% случаев операцией удается добиться полного излечения от заболевания. Методом выбора считается энуклеация опухоли. Иногда производится резекция головки, тела или хвоста поджелудочной железы. В качестве предоперационной подготовки назначается мощный ингибитор секреции инсулина диазоксид. В течение 72 часов после операции возможна гипергликемия. Для ее предотвращения вводится инсулин короткого действия. После удаления внепанкреатических опухолей уровень гликемии очень быстро нормализуется.
Прогноз и профилактика
Несмотря на значительное количество осложнений, в большинстве случаев гипогликемия имеет легкую или среднюю тяжесть течения. При диабете она занимает лишь 3-4% в структуре смертности. Основной причиной летального исхода выступают сердечно-сосудистые катастрофы (инфаркт, инсульт). Для профилактики гипогликемии при диабете пациент должен строго соблюдать дозировку, технику и частоту введения инсулина, не пропускать прием пищи, избегать употребления алкоголя.
При проведении инсулинотерапии нужно регулярно контролировать уровень глюкозы крови глюкометром, иметь при себе быстроусваиваемые углеводы для самостоятельного купирования гипогликемии. Также необходим грамотный подбор дозы сахароснижающих препаратов с учетом функции печени и почек больного, возможных лекарственных взаимодействий. Пациентам с метаболическими расстройствами (гликогенозами, галактоземией) рекомендуется частое дробное питание с большим количеством углеводов.
1. Дифференциальная диагностика и лечение эндокринных заболеваний/ Балаболкин М.И., Клебанова Е.Н., Креминская В.М. - 2002.
2. Алгоритмы специализированной медицинской помощибольным сахарным диабетом/ под. ред Дедова И.И., Шестаковой М.В. - 2013.
Неонатальная гипогликемия
Неонатальная гипогликемия — это снижение уровня глюкозы в крови новорожденного менее 2,6 ммоль/л. Возникает как вариант транзиторного состояния у младенцев либо под действием патологических причин: гиперинсулинизма, метаболических заболеваний, перинатальных нарушений. Гипогликемия проявляется неврологическими (тремор, вялость, судороги) и вегетативными симптомами (колебания пульса, АД, температуры тела). Диагностика включает исследование гликемического уровня, расширенные биохимические и гормональные анализы, скрининг наследственных болезней обмена (НБО). Лечение предполагает внутривенную инфузию глюкозных растворов, гормонотерапию глюкагоном, кортикостероидами.
МКБ-10

Общие сведения
Данные о распространенности неонатальной гипогликемии у новорожденных сильно разнятся, что объясняется неспецифичностью симптоматики, отсутствием четких диагностических критериев. При выполнении скрининга в первые 6 часов по окончании родов гипогликемия обнаруживается у 11,4% доношенных детей, у 20,3% недоношенных. В других исследованиях, при более позднем измерении концентрации углевода получены данные, что у 40-57% новорожденных временно падают показатели гликемии. При этом среди младенцев из группы риска снижение глюкозы крови встречается в 80% случаев.

Причины
Физиологическое снижение гликемии на протяжение первых двух суток жизни новорожденного обусловлено несоответствием между уровнем инсулина, активностью гликогенолиза и глюконеогенеза. Проблема относится к пограничным состояниям новорожденных, не сопровождается клинической симптоматикой, характеризуется незначительным колебанием гликемического уровня. К патологическим факторам развития неонатальных гипогликемий относят следующие:
- Транзиторный гиперинсулинизм. Чаще всего он наблюдается у детей, рожденных женщинами с сахарным диабетом. У таких пациенток гипергликемия провоцирует усиленную выработку инсулина организмом плода в последнем триместре беременности. Гиперфункция поджелудочной железы сохраняется в период новорожденности, вызывая временную гипогликемию.
- Врожденный гиперинсулинизм. Состояние обусловлено мутациями генов KIR6.2, изменением структуры глюкокиназы, глутаматдегидрогеназы. Также оно встречается при врожденных нарушениях гликозилирования (CDG-синдромах), инсулиноме, синдроме Беквита-Видемана.
- Эндокринные заболевания. Падение сахара в крови ассоциировано с недостаточным уровнем контринсулярных гормонов: глюкагона, кортизола. Состояние зачастую провоцируется врожденными поражениями гипофизарно-гипоталамической системы, при которых снижается выработка соматотропина, АКТГ.
- Врожденные метаболические расстройства. Гипогликемические состояния развиваются при нарушениях синтеза аминокислот: болезни кленового сиропа, метилмалоновой ацидемии, тирозинемии. Причиной неонатальной гипогликемии также выступают расстройства обмена гликогена при недостатке ферментов глюкозо-6-фосфатазы, гликосинтетазы.
- Перинатальные патологии. Гипогликемия возникает у новорожденных с задержкой внутриутробного развития, недоношенных и маловесных новорожденных. Это связано с дефицитом запасов гликогена у ребенка, из-за чего нарушается эндогенный путь образования глюкозы. Вышеперечисленные проблемы часто формируются при плацентарной недостаточности.
- Медикаментозное воздействие. Состояние появляется у детей, чьи матери во время беременности принимали салицилаты, вальпроевую кислоту, блокаторы бета-адренорецепторов. Если новорожденному назначали индометацин, гепарин, фторхинолоны, он находится в группе риска по расстройствам метаболизма углеводов.
После родов в организме ребенка происходит резкий переход на самостоятельный синтез глюкозы для поддержания нормогликемии. В раннем неонатальном периоде вследствие незрелости ферментов и гормональной дисфункции образование глюкозы недостаточное, в то же время возможна повышенная потребность в ней на фоне анаэробного гликолиза. Эти механизмы в сочетании с периодом становления грудного или искусственного вскармливания вызывают тяжелую гипогликемию.
При недостаточном поступлении глюкозы в ЦНС повышается образование лактата, нарастает ацидоз, снижается уровень энергетических молекул АТФ в нейронах. Как следствие неонатальной дисфункции возникают электролитные нарушения, изменяются процессы деполяризации в нервных клетках. В результате наблюдается отек нейронов, атрофия клеток нейроглии, демиелинизация нервных волокон. При несвоевременной коррекции состояние заканчивается селективной гибелью нейронов.
В практической неонатологии обычно применяется классификация заболевания по времени развития и этиологическому принципу, которая предложена в 1993 году. Согласно ей выделяют 4 формы неонатальной гипогликемии:
Симптомы неонатальной гипогликемии
Типичным признаком неонатальной гипогликемии считается высокочастотный неэмоциональный крик, который продолжается долго без очевидных причин. Нарушения вегетативных реакций проявляются учащением сердцебиения, снижением артериального давления, повышенной потливостью. К редким признакам относят судороги, периоральный или акроцианоз, понижение температуры. В тяжелых случаях развивается гипогликемическая кома.
При неонатальной патологии углеводного обмена первым страдает головной мозг: кора больших полушарий, стриопаллидарная система. У 35-50% младенцев с выраженными гипогликемиями и у 20% детей с асимптомными расстройствами в будущем возникают неврологические проблемы: задержка моторного развития, снижение темпов формирования речи, поведенческие дефекты.
Тяжесть поражения коррелирует с продолжительностью гипогликемии. Если состояние длится дольше 5 суток, у 90-94% детей при инструментальной визуализации находят кортикальные поражения, геморрагии в белое вещество, нарушения анатомической структуры базальных ганглиев. Установлено, что продолжительная гипогликемия в неонатальном периоде — триггер манифестации ДЦП.
Основную роль играет анализ глюкозы сначала в капиллярной крови, а затем подтверждение результатов в образце венозной крови. Инвазивная диагностика рекомендована новорожденным с симптоматическими гипогликемиями, всем недоношенным, маловесным детям и рожденным от матерей с клиникой сахарного диабета. Если нарушение гликемии продолжается более 2 суток, необходимо включить в диагностический комплекс следующие методы:
- Биохимический анализ крови. У новорожденного исследуют уровень кетоновых тел, лактата, жирных кислот. Также определяют концентрацию мочевой кислоты, показатели работы печени (АЛТ, АСТ, билирубин).
- Гормональный профиль. При персистирующей гипогликемии целесообразно измерить уровни инсулина, кортизола, соматотропного гормона. При сочетании нарушений гликемии и длительной желтухи обязательно исследуют показатели тиреоидных гормонов.
- Скрининг на НБО. По показаниям назначают исследования на врожденные нарушения обмена веществ. Анализ выполняется методом тандемной масс-спектрометрии (ТМС) в капиллярной крови, может показывать до 40 видов генетических метаболических расстройств.
Лечение неонатальной гипогликемии
Лечение неосложненных форм гипогликемии начинается с кормления новорожденного грудным молоком или смесью в привычном объеме, а также перорального или интрагастрального введения 10% глюкозного раствора. При показателе глюкозы крови от 2,2 до 2,6 ммоль/л и отсутствии клинической симптоматики такие мероприятия восстанавливают нормогликемию. При выявлении более серьезных патологических состояниях используется другая тактика:
- Если у ребенка глюкоза снижается до уровня 2,2-2,6 ммоль/л, выражены характерные признаки неонатальной гипогликемии, немедленно начинают внутривенное введение 10% раствора глюкозы со скоростью 3-8 мл/кг-мин, что зависит от гестационного возраста новорожденного.
- Если уровень гликемии падает ниже 2,2 ммоль/л, растворы, содержащие глюкозу, вводятся сначала болюсно в дозе 2 мл/кг, затем продолжается внутривенная капельная инфузия. При судорогах дозу глюкозного болюса удваивают.
- Если гликемия меньше 2,2 ммоль/л, а предыдущее лечение не помогает, добавляют гормонотерапию. Новорожденным разрешено вводить глюкагон, гидрокортизон, преднизолон. При доказанном гиперинсулинизме показаны октреотид, диазоксид.
Большинство расстройств углеводного обмена успешно корректируются введением инфузионных растворов, поэтому в короткие сроки состояние новорожденного стабилизируется. Однако при поздней диагностике состояния или наличии тяжелого врожденного заболевания прогноз сомнительный. Профилактика включает антенатальную охрану плода, назначение рациональной гипогликемической терапии беременным, страдающим сахарным диабетом.
1. Гипогликемии у новорожденных: обзор литературы и описание клинического случая/ Т.Е. Таранушенко, Н.Г. Киселева, О.В. Лазарева, И.И. Калюжная// Проблемы эндокринологии. — 2019.
4. Практические рекомендации коррекции неонатальных метаболических (гипо-, гипергликемия) нарушений, требующих быстрой коррекции/ А.К. Ткаченко, А.В. Солнцева. — 2006.
Гипергликемия
Гипергликемия - это увеличение концентрации глюкозы в плазме крови более 6,1 ммоль/л. Причинами данного состояния могут быть стресс, высокоуглеводная диета, прием лекарств, а также болезни эндокринной системы и внутренних органов. Основные клинические проявления включают сухость во рту, обильное мочеиспускание, мышечную слабость. Уровень гликемии исследуется по венозной или капиллярной крови до приема пищи и медикаментов. Для нормализации уровня сахара в крови используются диета, лекарственные препараты (инсулин, сахароснижающие средства), лечение основного заболевания.
По степени тяжести гипергликемию разделяют на:
- Легкую - до 8,2 ммоль/л.
- Умеренную - от 8,3 до 11 ммоль/л.
- Тяжелую - свыше 11 ммоль/л.
Данное числовое разделение считается весьма условным, так как большее значение имеет не уровень гликемии, а скорость не нарастания. По характеру выделяют физиологическую (стресс, прием углеводной пищи) и патологическую гипергликемию. По происхождению гипергликемии бывают:
- Гормонально-обусловленные. Повышение сахара вызвано различными эндокринными патологиями (диабет, гиперкортицизм и т.д.).
- Центрального генеза. Увеличение уровня глюкозы происходит при заболеваниях центральной нервной системы и травмах головного мозга.
- Алиментарно-обусловленные. Гипергликемия развивается вследствие редких наследственных конституциональных и метаболических нарушений.
Причины гипергликемии
Физиологические состояния
Кратковременное повышение в крови сахара может наблюдаться во время беременности, при приеме углеводсодержащей пищи накануне сдачи биохимического анализа. При стрессе гипергликемия возникает по причине активации симпато-адреналовой и гипоталамо-гипофизарно-надпочечниковой систем и выработки контринсулярных гормонов. При данных состояниях гипергликемия является транзиторной (обратимой) и не требует никакого вмешательства.
Сахарный диабет
Сахарный диабет (СД) ‒ ведущая причина повышенного содержания в крови глюкозы. Патогенетические механизмы развития гипергликемии несколько отличаются при разных типах диабета. Для СД 1 типа характерно снижение выработки инсулина бета-клетками островков Лангерганса поджелудочной железы (абсолютная инсулиновая недостаточность), что приводит к нарушению утилизации глюкозы как энергетического субстрата периферическими тканями (жировой, мышечной) и, соответственно, ее задержке в крови.
При СД 2 типа, напротив, вследствие длительно протекающей гиперинсулинемии, возникает инсулинорезистентность (повышение порога чувствительности к инсулину) в связи с уменьшением количества рецепторов к инсулину на поверхностях клеток мышечной и жировой тканей (относительная инсулиновая недостаточность). Гестационный сахарный диабет (ГСД) обусловлен снижением клиренса инсулина, а также действием фетоплацентарных гормонов (плацентарного лактогена, прогестерона).
- Диабет 1 типа. Типичен скачкообразный характер гипергликемии. Резкое увеличение в крови уровня сахара может возникнуть и в момент клинической манифестации заболевания, и, что чаще всего, при несоблюдении дозировок либо пропусках инъекций инсулина. Для поддержания глюкозы в пределах нормальных значений необходима пожизненная инсулинотерапия.
- Диабет 2 типа. Отличается медленным и неуклонным нарастанием концентрации глюкозы, из-за чего она может достигать очень высоких значений (30-40 ммоль/л). Уровень гликемии снижается под влиянием диеты и приема сахароснижающих средств. Нормализация массы тела и бариатрическая хирургия способны уменьшить либо полностью избавить от потребности в лечении.
- ГСД. При гестационном диабете сахар крови постепенно повышается во II-III триместрах беременности. Специфическое лечение проводится до наступления родов либо оперативного родоразрешения. В послеродовом периоде часто наблюдается спонтанная ремиссия, однако возможно сохранение гипергликемии с переходом в сахарный диабет 2 типа.

Другие эндокринные расстройства
Помимо сахарного диабета к гипергликемии могут приводить и другие заболевания эндокринной системы. Главным образом это касается эндокринопатий, сопровождающихся усиленной выработкой контринсулярных гормонов, т.е. гормонов повышающих концентрацию глюкозы путем влияния на различные этапы углеводного метаболизма:
- Тиреотоксикоз. При диффузном токсическом зобе или токсической аденоме гормоны щитовидной железы активируют гликогенолиз, глюконеогенез, стимулируют всасывание глюкозы в кишечнике. Гипергликемия умеренная, разрешается после нормализации уровня тиреоидных гормонов.
- Гиперкортицизм. Глюкокортикостероиды (кортизол) усиливают глюконеогенез и подавляют расщепление глюкозы. При болезни/синдроме Иценко-Кушинга нередко развивается так называемый «стероидный диабет».
- Феохромоцитома. Катехоламины (адреналин, норадреналин) стимулируют распад в печени гликогена. Гипергликемия протекает пароксизмально, уровень глюкозы резко увеличивается в момент симпато-адреналового криза. В межприступный период гликемия остается в пределах нормы.
- Акромегалия. Гормон роста, продуцируемый опухолью гипофиза соматотропиномой, помимо прямого гипергликемического эффекта, подавляет утилизацию глюкозы периферическими тканями, т.е. формирует инсулинорезистентность. Поэтому гипергликемия при акромегалии носит особый характер. В отличие от других эндокринопатий, при которых чаще имеет место нарушение толерантности к глюкозе, акромегалия довольно часто приводит к развитию 2 типа СД.
- Глюкагонома. Глюкагон как основной антагонист инсулина, стимулирует образование глюкозы из аминокислот в печени. Гипергликемия носит легкое течение. В большинстве случаев изменений в диете достаточно для нормализации сахара крови.
Другие причины
- Судорожные состояния.
- Органические поражения ЦНС:энцефалиты, опухоли головного мозга, кровоизлияния в IV желудочек.
- Печеночная недостаточность.
- Тяжелые заболевания поджелудочной железы: панкреонекроз, муковисцидоз.
- Прием лекарственных препаратов: тиазидных диуретиков, глюкокортикостероидов, блокаторов бета-адренорецепторов.
- Тяжелые соматические расстройства:сепсис, обширные ожоги.
- Аутоиммунные полигландулярыне синдромы:синдром Шмидта.
- Редкие наследственные синдромы: липодистрофия Сайпа-Лоренса, синдром Прадера-Вилли, синдром Видеманна-Беквита.
- ВИЧ-инфекция.
Первично гипергликемия выявляется при профилактическом или целенаправленном лабораторном исследовании крови на сахар. Однако пациенты, имеющие портативный глюкометр, могут самостоятельно обнаружить у себя регулярное повышение глюкозы утром натощак. В этом случае следует незамедлительно посетить врача-терапевта или эндокринолога. В дальнейшем для уточнения характера патологического процесса может быть проведено:
- Исследование углеводного обмена. Пациенту с гипергликемией выполняется исследование мочи на сахар, пероральный глюкозо-толерантный тест, суточный мониторинг гликемического профиля. Совместно с анализами на глюкозу часто дополнительно назначается определение уровня гликированного гемоглобина, инсулина крови, индекса HOMA (инсулинорезистентности).
- Гормональные исследования. При подозрении на патологию эндокринной системы проводится анализ крови на тиреоидные гормоны (ТТГ, свободный Т4, Т3), инсулиноподобный фактор роста-1, измерение уровня метанефринов в суточной моче. Если у пациента имеются клинические признаки гиперкортицизма, измеряют концентрацию кортизола в слюне, а также в плазме после выполнения малой и большой дексаметазоновых проб.
- УЗИ. В случае гипергликемии панкреатогенного происхождения на УЗИ органов брюшной полости обнаруживается снижение эхогенной плотности поджелудочной железы, ее отечность, нечеткость контуров, наличие кист и пр. При гипертиреозе УЗИ щитовидной железы показывает снижение эхогенности паренхимы, наличие узловых образований.
- КТ. При лабораторном подтверждении гиперпродукции гормонов коры надпочечников проводится КТ надпочечников на предмет поиска опухолевого образования - кортикостеромы.
- МРТ. При акромегалии и болезни Иценко-Кушинга на МРТ головного мозга отмечается доброкачественная опухоль гипофиза - аденома.
Так как длительная гипергликемия сама по себе оказывает неблагоприятное воздействие на весь организм человека, в случае ее выявления, особенно после многократного измерения сахара крови, назначается обследование для оценки состояния органов-мишеней, которое включает:
- исследование общего холестерина и липидного профиля;
- измерение артериального давления;
- снятие электрокардиограммы;
- определение в сыворотке крови уровня креатинина, мочевины, в моче - общего белка, альбумин-креатининового соотношения, при необходимости производится расчет скорости клубочковой фильтрации;
- осмотр глазного дна.

Коррекция
После получения анализов с превышением референсных значений глюкозы нужно обратиться к врачу. Кратковременное увеличение гликемии вследствие физиологических факторов не требует лечения. При лекарственно-индуцированной гипергликемии необходима отмена причинного препарата, а также консультация специалиста, назначившего данное ЛС, для осуществления его замены.
В ряде случаев для нормализации гликемии достаточно грамотной терапии основного заболевания (назначение тиреостатических средств, ингибиторов стероидогенеза, аналогов соматостатина). Для лечения пациентов с патологической гипергликемией, особенно вызванной сахарным диабетом, применяются следующие мероприятия:
- Диета. Соблюдение низкоуглеводной диеты - одно из главных условий успешной коррекции гипергликемии. В первую очередь ограничиваются легкоусваиваемые углеводы - шоколад, пирожные, торты. Предпочтение отдается цельнозерновым продуктам (гречневая, овсяная крупа).
- Физические нагрузки. Благодаря регулярному выполнению различных физических упражнений происходит повышенная утилизация глюкозы мышцами, что позволяет добиться снижения гликемии.
- Инсулинотерапия. Инъекции инсулина показаны всем пациентам с сахарным диабетом 1 типа и беременным женщинам, страдающим гестационным диабетом. Также инсулин назначается при декомпенсации 2 типа диабета. Эффективностью терапии является достижение целевых показателей гликированного гемоглобина (HbA1c).
- Сахароснижающие средства. При II типе диабета, а также гипергликемии, вызванной другими эндокринопатиями, препаратами выбора считаются сахароснижающие ЛС - бигуаниды (метформин), производные сульфонилмочевины (глибенкламид), ингибиторы ДПП-4 (вилдаглиптин).
В некоторых случаях, когда гипергликемия не поддается коррекции консервативными методами (например, у пациентов с морбидным ожирением и диабетом II типа), прибегают к бариатрической хирургии - желудочному шунтированию, резекции, бандажированию желудка. Для успешного лечения многих эндокринопатий, требуется хирургическая операция - тиреоидэктомия при тиреотоксикозе, трансназальная аденомэктомия при акромегалии, двусторонняя адреналэктомия при синдроме Кушинга.
Прогноз
Патологическая гипергликемия является крайне неблагоприятным прогностическим фактором. Высокий уровень глюкозы может вызвать острые жизнеугрожающие состояния - гиперосмолярную гипергликемическую и лактатацидотическую кому. Гипергликемия угнетает фагоцитарную активность лейкоцитов, вследствие чего возникает повышенная восприимчивость к инфекционным заболеваниям.
Длительная гипергликемия за счет гликозилирования липопротеидов и эндотелия сосудистых стенок стремительно ускоряет прогрессирование атеросклероза. Впоследствии это может привести к раннему развитию сердечно-сосудистых катастроф (острого инфаркта миокарда, инсульта), а также хронической почечной недостаточности, потере зрения, гангрене конечностей.
1. Актуальные вопросы эндокринологии в терапевтической практике: рук. для врачей/ Под ред. М. Н. Калинкина, Л. В. Шпак. — 2014.
2. Алгоритмы специализированной медицинской помощи больным сахарным диабетом/ Под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. — 2017.
4. Доказательная эндокринология: руководство для врачей/ Под ред. Полайн М. Камачо, Хоссейн Гариб, Глен В. Сайзмо. — 2008.
Нарушения обмена глюкозы у новорожденного с неврологическими проявлениями: гипогликемия, гипогликорахия, гипергликемия

1. Ogilvy-Stuart A.L., Beardsall K. Management of hyperglycaemia in the preterm infant. Arch. Dis. Child. Fetal. Neonatal. Ed. 2010. Vol. 95, N 2. P. F126-F131. DOI: 10.1136/adc.2008.154716.
2. Morgan C. The potential risks and benefits of insulin treatment in hyperglycaemic preterm neonates. Early Hum. Dev. 2015. Vol. 91, N 11. P. 655-659. DOI: 10.1016/j.earlhumdev.2015.08.011.
3. Bottino M., Cowett R.M., Sinclair J.C. Interventions for treatment of neonatal hyperglycemia in very low birth weight infants. Cochrane Database Syst. Rev. 2009. N 1. CD007453. DOI: 10.1002/14651858.CD007453.pub2.
4. Hay W.W., Rozance P.J. Neonatal Hyperglycemia-Causes, Treatments, and Cautions. J. Pediatr. 2018. Vol. 200. P. 6-8. DOI: 10.1016/j.jpeds.2018.04.046.
5. Shang P.W., Lu G.Z., Sun X., Bian Z.M., Shang Z.Y., Li J. The influence of continuous glucose monitoring of high-risk neonate on guiding perinatal complications and one-year follow-up results. Eur. Rev. Med. Pharmacol. Sci. 2016. Vol. 20, N 1. P. 125-128.
6. Sinclair J.C. Approaches to the definition of neonatal hypoglycemia. Acta Paediatr. Jpn. 1997. Vol. 39, Suppl. 1. P. S17-S20.
7. Rozance P.J, Hay W.W. Hypoglycemia in newborn infants: Features associated with adverse outcomes. Biol. Neonate. 2006. Vol. 90, N 2. P. 74-86. DOI: 10.1159/000091948.
8. Rysavy M.A., Marlow N., Doyle L.W., Tyson J.E., Serenius F., Iams J.D., Stoll B.J., Barrington K.J., Bell E.F. Reporting Outcomes of Extremely Preterm Births. Pediatrics. 2016. Vol. 138, N 3. P. e20160689. DOI: 10.1542/peds.2016-0689.
9. Mejri A., Dorval V.G., Nuyt A.M., Carceller A. Hypoglycemia in term newborns with a birth weight below the 10th percentile. Paediatr. Child. Health. 2010. Vol. 15, N 5. P. 271-275. DOI: 10.1093/pch/15.5.271.
10. Ogilvy-Stuart A.L., Harding J.E., Beardsall K. Thresholds for hypoglycaemic screening-a cause for concern? Arch. Dis. Child. Educ. Pract. Ed. 2019. Vol. 104, N 1. P. 33-34. DOI: 10.1136/archdischild-2017-314135.
11. Uettwiller F., Chemin A., Bonnemaison E., Favrais G., Saliba E., Labarthe F. Real-time continuous glucose monitoring reduces the duration of hypoglycemia episodes: a randomized trial in very low birth weight neonates. PLoS One. 2015. Vol. 10, N 1. P. e0116255. DOI: 10.1371/journal.pone.0116255.
12. Tiberi E., Cota F., Barone G., Perri A., Romano V., Iannotta R., Romagnoli C., Zecca E. Continuous glucose monitoring in preterm infants: evaluation by a modified Clarke error grid. Ital. J. Pediatr. 2016. Vol. 42. P. 29. DOI: 10.1186/s13052-016-0236-9.
13. Galderisi A., Facchinetti A., Steil G.M., Ortiz-Rubio P., Cavallin F., Tamborlane W.V., Baraldi E., Cobelli C., Trevisanuto D. Continuous Glucose Monitoring in Very Preterm Infants: A Randomized Controlled Trial. Pediatrics. 2017. Vol. 140, N 4. P. e20171162. DOI: 10.1542/peds.2017-1162.
14. Szymońska I., Jagła M., Starzec K., Hrnciar K., Kwinta P. The incidence of hyperglycaemia in very low birth weight preterm newborns. Results of a continuous glucose monitoring study--preliminary report. Dev. Period. Med. 2015. Vol. 19, N 3, Pt. 1. P. 305-312.
15. Harris D.L., Battin M.R., Weston P.J., Harding J.E. Continuous glucose monitoring in newborn babies at risk of hypoglycemia. J. Pediatr. 2010. Vol. 157, N 2. P. 198-202.e1. DOI: 10.1016/j.jpeds.2010.02.003.
16. Beardsall K., Thomson L., Guy C., van Weissenbruch M.M., Iglesias I., Muthukumar P., Somisetty S.K., Bond S., Petrou S., Dunger D. Protocol of a randomised controlled trial of real-time continuous glucose monitoring in neonatal intensive care 'REACT'. BMJ Open. 2018. Vol. 8, N 6. P. e020816. DOI: 10.1136/bmjopen-2017-020816.
17. Nathan R. Hill., Nick S. Oliver., Pratik Choudhary., Jonathan C. Levy., Peter Hindmarsh., David R. Matthews. Normal Reference Range for Mean Tissue Glucose and Glycemic Variability Derived from Continuous Glucose Monitoring for Subjects Without Diabetes in Different Ethnic Groups. Diabetes Technol Ther. 2011. Vol. 13, N 9. P. 921-928.e.l DOI: 10.1089/dia.2010.0247.
Гипогликемия и гипергликемия часто встречаются у новорожденных детей с различной массой тела во время реабилитации, но диагностика и предотвращение таких состояний не всегда происходят вовремя 1. У новорожденных, нуждающихся в интенсивной терапии, нарушен контроль уровня глюкозы и наблюдаются значительные колебания уровня глюкозы в крови, их развивающийся мозг более восприимчив к этим метаболическим нарушениям [4]. Гипогликемия связана с плохим исходом развития нервной системы, а гипергликемия связана с повышенной смертностью и заболеваемостью у недоношенных детей 6. Нарушения углеводного обмена связаны с плохими клиническими исходами, но данные и клинически значимые пороги гипогликемии и гипергликемии в различных источниках противоречивы, так же как и методы диагностики [8]. Определение уровня глюкозы в плазме представляет собой золотой стандарт для диагностики метаболических нарушений, однако этот метод позволяет получать только точечные значения и не позволяет в режиме реального времени контролировать уровень гликемии и ее тенденций. Это может объяснить различные нормогликемии по литературным данным в популяции новорожденных и недостаток правильных диагнозов [9; 10]. В частности, нет единого мнения об определении «значимой гипогликемии» (значения глюкозы в крови, требующей медицинского лечения), а также о пороге концентрации глюкозы и времени, необходимого для причинения неврологического повреждения [11; 12]. Непрерывный мониторинг глюкозы (CGM) может быть использован для изучения гомеостаза глюкозы в неонатальном периоде, и некоторые исследования показали, что его использование безопасно и надежно [13; 14]. Кроме того, продемонстрировано, что CGM может обнаруживать значительно большее количество эпизодов гипо/гипергликемии по сравнению с прерывистым измерением уровня глюкозы в крови. Большой группой ученых было проведено перспективное исследование доношенных и поздних недоношенных детей, подверженных риску неонатальной гипогликемии, которым был установлен непрерывный мониторинг уровня гликемии в течение первых 48 часов жизни. Это исследование показало, что, несмотря на регулярное тестирование глюкозы и клиническую цель поддерживать глюкозу >2,6 ммоль /л, многие дети подвергались длительным периодам, когда уровень глюкозы в сенсоре был
Цель исследования: оценить возможности использования системы непрерывного мониторинга гликемии у недоношенных новорождённых для прогнозирования и контроля жизненно угрожающих состояний.
Материалы и методы исследования
Для достижения цели и решения поставленных задач были изучены истории болезни пациентов отделения патологии новорожденных ОГАУЗ «Областной перинатальный центр им. И.Д. Евтушенко» г. Томск.
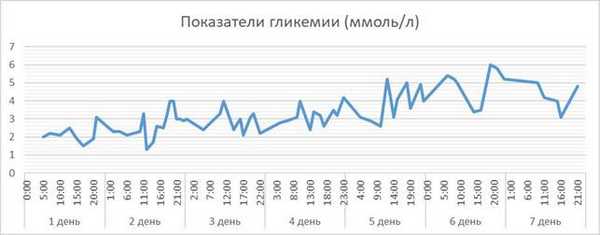
Рис. 1. Динамика гликемии в течение 7 дней
Читайте также:
- Техника тенодеза бицепса с применением анкера SwiveLock с интерферентной фиксацией
- Зачем откладывать операцию при сходящемся косоглазии (инфантильной эзотропии)?
- Причины возникновения чумы: симптомы, лечение, диагностика и профилактика
- Анатомия: Небо, palatum. Твердое небо. Мягкое небо
- Специальные неврологические тесты голеностопного сустава и стопы
