Нарушения проводимости при инфаркте миокарда ( оим, ОИМ ). Атриовентрикулярная блокада при инфаркте миокарда ( оим, ОИМ ). Неотложная помощь при атриовентрикулярной блокаде.
Добавил пользователь Cypher Обновлено: 10.01.2026
Инфаркт миокарда (ИМ) - остро возникшее состояние, которое характеризуется развитием очага омертвления в миокарде из-за остановки кислородоснабжения участка.
Острый коронарный синдром (ОКС) - симптомокомплекс, позволяющий заподозрить ишемические изменения в миокарде (ИМ, нестабильная стенокардия). Диагностируется на основании болевого синдрома и ЭКГ-признаков.
Ранняя диагностика, своевременная госпитализация и успешно оказанная неотложная помощь при инфаркте миокарда значительно снижают показатели смертности, инвалидности и улучшают результаты дальнейшего лечения.
Оказание помощи пациенту в домашних условиях до приезда скорой помощи
Способность вовремя сориентироваться и оказать адекватную поддержку больному до приезда бригады скорой помощи в разы увеличивает его шансы на выживание.
Первую помощь при инфаркте миокарда нужно оказывать незамедлительно.
Алгоритм действий
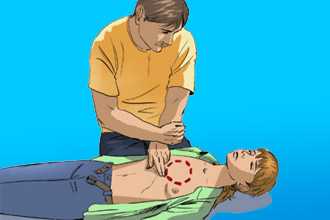
- Немедленно вызвать скорую помощь (в разговоре с диспетчером максимально четко сформулировать симптомы, озвучить подозрение на ИМ, чтобы на вызов приехала специализированная кардиологическая или реанимационная бригада).
- Обеспечить больному полусидячее положение (возвышенное положение верхней половины туловища снижает преднагрузку на сердце).
- Постараться успокоить пациента (эмоциональное и физическое напряжение увеличивает выброс вазоконстрикторов, что усиливает ишемию миокарда и увеличивает его потребность в кислороде).
- Обеспечить приток кислорода (открыть окна, двери, включить кондиционер).
- Снять верхнюю одежду и ослабить все сжимающие тело элементы (галстук, ремень, колье и т. д.).
- При возможности измерить АД и посчитать пульс. При выраженной тахикардии принять «Анаприллин» 1 табл., гипертонии - «Каптоприл» 1 табл.
- Дать «АСК» (150-325 мг) или «Клопидогрель» (100 мг). Эффект произойдет быстрее, если таблетки разжевать.
- Сублингвально дать 1 табл. «Нитроглицерина». Повторять прием через каждых 5 минут (но не более 3-х доз).
- До приезда скорой помощи запрещено принимать ненаркотические анальгетики!
Если больной внезапно потерял сознание, перестал дышать и произошла остановка сердца, необходимо до приезда врачей выполнять сердечно-легочную реанимацию:
- расположить пациента лежа на спине, запрокинуть голову назад, подложить под шею валик, выдвинуть нижнюю челюсть (профилактика обтурации дыхательных путей языком);
- проверить пульс на сонной артерии;
- проводить непрямой массаж сердца и делать искусственное дыхание с частотой 30:2, если процедуру выполняет один человек, или 15:1, если вдвоем. Нажатия стоит проводить быстро (100 в минуту), ритмично и с достаточной силой для обеспечения сердечного выброса;
- через каждых 2-3 минуты проверять, не появился ли пульс.
Неотложка на догоспитальном этапе
Стандарт приезда бригады ЭМП в городе равняется 10 минутам, за городской чертой - 20 минут после регистрации вызова в диспетчерской службе. Если принимать во внимание метеоусловия, эпидситуацию и дорожную ситуацию, возможно превышение времени (не дольше чем на 10 минут).
Согласно протоколу, алгоритм действий бригады по прибытию к больному включает:
При возможности рекомендовано проведение тромболизисной терапии ТЛТ (стрептокиназа, альтеплаза, актилизе) на догоспитальном этапе. Если тромболизис получается провести в течение 2 часов от начала ишемических изменений (оптимально за 60 минут), это может оборвать развитие некроза при ИМ, уменьшить область поражения и основательно снизить смертность. ТЛТ не эффективна, если от начала болевого приступа прошло больше 12 часов. Также процедуру не выполняют при наличии абсолютных противопоказаний: интракраниальное кровотечение или геморрагический инсульт за последние 3 месяца, злокачественное новообразование мозга, аневризма брюшного отдела аорты с тенденцией к расслоению, кровотечения из ЖКТ в течение последнего месяца, нарушения системы гемостаза.
Всех пациентов с ОКС госпитализируют в реанимационное отделение специализированного кардиологического стационара с возможностью выполнения экстренной ангиографии и реперфузионных вмешательств.
От чего зависит успех оказания первой помощи больному с инфарктом миокарда?
Качество оказания первой помощи пациенту зависит от множества факторов:
- знаний человека, оказывающего помощь, алгоритма действий при инфаркте, умения выполнять реанимационные действия;
- времени, прошедшего от приступа до начала действий;
- медикаментозного обеспечения и инструментальной поддержки (тонометр, «Нитроглицерин», «Аспирин»);
- укомплектованности бригад скорой помощи необходимой аппаратурой, препаратами, квалификации персонала;
- удаленности от специализированных кардиологических отделений.
Также существуют факторы, усугубляющие течение инфаркта, и тем самым снижающие шансы на успех:
- возраст старше 70 лет;
- сопутствующая патология (сахарный диабет, ожирение, патология почек, распространенный атеросклероз, гиперхолестеринэмия, гипертоническая болезнь);
- безболевое начало ишемии или атипичная клиническая картина;
- обширный очаг некроза (трансмуральный ИМ) с кардиогенным шоком;
- возникновение тяжелых аритмий и нарушений сердечной проводимости.
Выводы
Рационально оказанная первая помощь больному с ИМ напрямую повышает шансы пациента выжить и уменьшает вероятность возникновения осложнений в дальнейшем.
Как показала мировая практика, много смертей происходит еще до прибытия специализированных медицинских бригад.
Поэтому очень важно обучать пациентов распознавать первые признаки приступа и уметь оказать себе помощь в самом начале ситуации. Все больные из группы риска должны соблюдать рекомендации врача и придерживаться принципов здорового образа жизни.
Также важно проинформировать родственников пациента о том, как распознать начало развития ишемии и о правилах оказания первой помощи при инфаркте в домашних условиях.
Для подготовки материала использовались следующие источники информации.
Лечение нарушений ритма при остром инфаркте миокарда
Аритмии - самое частое осложнение инфаркта миокарда (ИМ) и самая частая причина смерти на догоспитальном этапе. Половина летальных исходов при ИМ происходит в первые два часа, в большинстве случаев вследствие фибрилляции желудочков. На госпитальном этапе аритмии являются второй по частоте (после острой сердечной недостаточности) причиной летальных исходов больных с ИМ. Нарушения ритма являются отражением обширного поражения миокарда и часто вызывают появление или усиление нарушений гемодинамики и клинических проявлений недостаточности кровообращения. В последние годы произошли заметные изменения многих представлений о лечении аритмий у больных с острым ИМ.
Чаще всего при ИМ отмечается желудочковая экстрасистолия. До недавнего времени желудочковой экстрасистолии при ИМ придавали очень большое значение. Популярной была концепция так называемых "предупреждающих аритмий", согласно которой желудочковые экстрасистолы высоких градаций (частые, полиморфные, групповые и ранние - типа "R на Т") являются предвестниками фибрилляции желудочков, а лечение желудочковых экстрасистол должно способствовать снижению частоты возникновения фибрилляции. Концепция "предупреждающих аритмий" не подтвердилась. В настоящее время установлено, что экстрасистолы, возникающие в первые 1-1,5 суток ИМ, сами по себе безопасны (их даже называют "косметическими аритмиями") и не являются предвестниками фибрилляции желудочков. А самое главное - лечение экстрасистолии не влияет на частоту возникновения фибрилляции желудочков. В рекомендациях Американской Кардиологической Ассоциации по лечению острого ИМ (1996 г.) специально подчеркивается, что регистрация желудочковых экстрасистол и даже неустойчивой желудочковой тахикардии (включая полиморфную желудочковую тахикардию продолжительностью до 5 комплексов) не является показанием для назначения антиаритмических препаратов (!). Отрицательное прогностическое значение имеет выявление частых желудочковых экстрасистол через 1-1,5 суток от начала ИМ, т.к. в этих случаях желудочковые экстрасистолы являются "вторичными" и, как правило, возникают вследствие выраженной дисфункции левого желудочка ("маркеры дисфункции левого желудочка").
Эпизоды неустойчивой желудочковой тахикардии, продолжительностью менее 30 сек., не сопровождающиеся нарушениями гемодинамики, многие авторы так же, как и желудочковую экстрасистолию, относят к "косметическим аритмиям" (их называют "энтузиастическими" выскальзывающими ритмами). Антиаритмические препараты назначают только при очень частых, обычно групповых экстрасистолах (вплоть до так называемых "пробежек" неустойчивой желудочковой тахикардии), если они вызывают нарушения гемодинамики с возникновением клинических симптомов или субъективно очень плохо переносятся больными. Клиническая ситуация при ИМ очень динамична, аритмии часто носят преходящий характер, и очень трудно провести оценку эффективности лечебных мероприятий. Тем не менее в настоящее время рекомендуется избегать применения антиаритмических препаратов класса I (за исключением лидокаина), а при наличии показаний для антиаритмической терапии предпочтение отдается бета-блокаторам, амиодарону и соталолу. Следует также подчеркнуть, что показаний для назначения так называемых метаболических препаратов и манипуляций типа лазерного облучения при аритмиях у больных ИМ не существует. Препаратом выбора для лечения желудочковых аритмий при ИМ по-прежнему остается лидокаин. Лидокаин вводят внутривенно - 200 мг в течение 20 мин. (обычно повторными болюсами по 50 мг). При необходимости проводят инфузию со скоростью 1-4 мг/мин. При отсутствии эффекта от лидокаина раньше, как правило, назначали новокаинамид внутривенно 1 г в течение 30-50 мин., скорость введения новокаинамида при длительной инфузии составляет 1-4 мг/мин. Однако в последние годы при отсутствии эффекта от лидокаина чаще применяют бета-блокаторы или амиодарон. Удобнее использовать внутривенное введение короткодействующих бета-блокаторов, например, эсмолола. Однако в нашей стране в настоящее время наиболее доступным препаратом этой группы для внутривенного введения янляется пропранолол (обзидан). Обзидан при ИМ вводят со скоростью 1 мг в течение 5 минут. Доза обзидана при внутривенном введении составляет от 1 до 5 мг. При наличии эффекта переходят на прием бета-блокаторов внутрь. Амиодарон (кордарон) вводят внутривенно медленно в дозе 150-450 мг. Скорость введения амиодарона при длительной инфузии составляет 0,5-1,0 мг/мин. Следует отметить, что профилактическое назначение лидокаина больным с острым инфарктом миокарда не показано. Для предупреждения возникновения фибрилляции желудочков наиболее эффективным является возможно более раннее назначение бета-блокаторов. В настоящее время проводятся исследования целесообразности профилактического применения амиодарона.
ЖЕЛУДОЧКОВАЯ ТАХИКАРДИЯ
Для лечения полиморфной желудочковой тахикардии (включая тахикардию типа "пируэт") препаратом выбора является сульфат магния - внутривенное введение 1-2 г в течение 5 минут и последующая инфузия со скоростью 10-50 мг/мин. При отсутствии эффекта от сульфата магния у больных без удлинения интервала QT оценивают действие бета-блокаторов и амиодарона. При наличии удлинения интервала QT используют электрокардиостимуляцию с частотой около 100 в минуту. Следует отметить, что у больных с острым ИМ даже при удлинении интервала QT в лечении тахикардии типа "пируэт" может быть эффективным применение бета-блокаторов и амиодарона.
ФИБРИЛЛЯЦИЯ ЖЕЛУДОЧКОВ
Примерно 60% всех случаев фибрилляции желудочков происходят в первые 4 часа. "80% - в первые 12 часов ИМ. Частота возникновения фибрилляции желудочков после поступления больного в блок интенсивной терапии составляет 4,5-7%. В основном это так называемая первичная фибрилляция желудочков (не связанная с рецидивированием ИМ, ишемией и недостаточностью кровообращения).
Единственным эффективным методом лечения фибрилляции желудочков является немедленное проведение электрической дефибрилляции. При отсутствии дефибриллятора реанимационные мероприятия при фибрилляции желудочков практически всегда безуспешны, более того, с каждой минутой снижается вероятность успешной электрической дефибрилляции. Эффективность немедленной электрической дефибрилляции при ИМ составляет около 90%. Сначала используют разряд в 200 Дж (5 кВ), при отсутствии эффекта максимально быстро проводят повторные попытки, увеличивая мощность разрядов до 300-400 Дж (6-7 кВ). Если после нескольких попыток дефибрилляции ритм не восстанавливается, на фоне продолжения общих реанимационных мероприятий и повторных попыток дефибрилляции через каждые 5 минут вводят адреналин (внутривенно по 1 мг). При рефрактерной фибрилляции кроме адреналина повторно вводят лидокаин (по 100 мг), а при отсутствии эффекта - бретилий, амиодарон или сульфат магния. После восстановления синусового ритма назначают инфузию эффективного антифибрилляторного препарата (лидокаина, бретилия, амиодарона или сульфата магния). При наличии признаков активации симпатической нервной системы, например, при синусовой тахикардии, не связанной с сердечной недостаточностью, дополнительно применяют бета-блокаторы.
Прогноз у больных, перенесших первичную фибрилляцию желудочков, как правило, вполне благоприятный и по некоторым данным практически не отличается от прогноза у больных с неосложненным ИМ. Фибрилляция желудочков, возникающая в более поздние сроки (после первых суток), в большинстве случаев является вторичной и обычно возникает у больных с выраженным поражением миокарда, рецидивирующими ИМ, ишемией миокарда или признаками сердечной недостаточности. Следует отметить, что вторичная фибрилляция желудочков может наблюдаться и в течение первых суток ИМ. Неблагоприятный прогноз при этом определяется тяжестью поражения миокарда. Частота возникновения вторичной фибрилляции желудочков составляет 2,2-7%, в том числе у 60% в первые 12 часов. У 25% больных вторичная фибрилляция желудочков отмечается на фоне мерцания предсердий. Эффективность дефибрилляции при вторичной фибрилляции составляет от 20 до 50%, повторные эпизоды возникают у 50% больных, летальность больных в стационаре составляет 40-50%.
Проведение тромболитической терапии позволяет резко (в десятки раз) снизить частоту возникновения устойчивой желудочковой тахикардии и вторичной фибрилляции желудочков. Реперфузионные аритмии не представляют проблемы, в основном это частые желудочковые экстрасистолы и ускоренный идиовентрикулярный ритм ("косметические аритмии") - показатель успешного тромболизиса. Редко возникающие более серьезные аритмии, как правило, хорошо поддаются стандартной терапии.
АСИСТОЛИЯ ЖЕЛУДОЧКОВ И ЭЛЕКТРОМЕХАНИЧЕСКАЯ ДИССОЦИАЦИЯ
Эти причины остановки сердца, как правило, являются следствием тяжелого, часто необратимого повреждения миокарда с длительным периодом выраженной ишемии.
Очень важно исключить наличие вторичной электромеханической диссоциации, основными причинами которой являются гиповолемия, гиперкалиемия, тампонада сердца, массивная тромбоэмболия легочной артерии, напряженный пневмоторакс. Всегда показано введение плазмозамещающих растворов, т.к. гиповолемия является одной из самых частых причин электромеханической диссоциации.
НАДЖЕЛУДОЧКОВЫЕ ТАХИАРИТМИИ
Из наджелудочковых тахиаритмий (если не учитывать синусовую тахикардию) в остром периоде ИМ чаще всего наблюдается мерцание предсердий - у 15-20% больных. Все остальные варианты наджелудочковых тахикардий при ИМ встречаются очень редко и обычно прекращаются самостоятельно. При необходимости проводятся стандартные лечебные мероприятия. Ранняя мерцательная аритмия (в первые сутки ИМ), как правило, носит преходящий характер, ее возникновение связывают с ишемией предсердий и эпистенокардическим перикардитом. Возникновение мерцательной аритмии в более поздние сроки в большинстве случаев является следствием растяжения левого предсердия у больных с дисфункцией левого желудочка. При отсутствии заметных нарушений гемодинамики мерцание предсердий не требует проведения лечебных мероприятий. При наличии выраженных нарушений гемодинамики методом выбора является проведение неотложной электрической кардиоверсии.
При более стабильном состоянии возможны 2 варианта ведения больных: 1) урежение ЧСС при тахисистолической форме в среднем до 70 в минуту с помощью внутривенного введения дигоксина, бета-блокаторов, верапамила или дилтиазема; 2) восстановление синусового ритма с помощью внутривенного введения амиодарона или соталола. Преимуществом второго варианта является возможность достижения восстановления синусового ритма и одновременно быстрое урежение ЧСС в случае сохранения мерцания предсердий. У больных с явной сердечной недостаточностью выбор проводится между двумя препаратами: дигоксин (внутривенное введение около 1 мг дробными дозами) или амиодарон (внутривенно 150-450 мг). Всем больным с мерцанием предсердий показано внутривенное введение гепарина.
БРАДИАРИТМИИ
Нарушение функции синусового узла и атриовентрикулярные (АВ) блокады чаще наблюдаются при ИМ нижней локализации, особенно в первые часы. Синусовая брадикардия редко представляет какие-либо проблемы. При сочетании синусовой брадикардии с выраженной гипотонией (синдром "брадикардии-гипотонии") используют внутривенное введение атропина
Атриовентрикулярные блокады также чаще регистрируются у больных с нижним ИМ. Частота возникновения АВ-блокады II-III степени при нижнем ИМ достигает 20%, а если имеется сопутствующий ИМ правого желудочка - АВ-блокада отмечается у 45-75% больных. АВ-блокада при ИМ нижней локализации, как правило, развивается постепенно: сначала удлинение интервала PR, затем АВ-блокада II степени типа I (Мобитц-I, периодика Самойлова-Венкебаха) и только после этого - полная АВ-блокада. Даже полная АВ-блокада при нижнем ИМ почти всегда носит преходящий характер и продолжается от нескольких часов до 3-7 суток (у 60% больных - менее суток).
Однако возникновение АВ-блокады является признаком более выраженного поражения: госпитальная летальность при неосложненном нижнем ИМ составляет 2-10%, а при возникновении АВ-блокады достигает 20% и более. Причиной смерти при этом является не сама АВ-блокада, а сердечная недостаточность, вследствие более обширного поражения миокарда.
При ИМ передней локализации АВ-блокада II-III степени развивается только у больных с очень массивным поражением миокарда. При этом АВ-блокада происходит на уровне системы Гиса-Пуркинье. Прогноз у таких больных очень плохой - смертность достигает 80-90% (как при кардиогенном шоке). Причиной смерти является сердечная недостаточность, вплоть до развития кардиогенного шока, или вторичная фибрилляция желудочков.
В заключение необходимо подчеркнуть, что при аритмиях, сопровождающихся гипотонией, прежде всего необходимо восстановить синусовый ритм или нормальную ЧСС. В этих случаях даже внутривенное введение препаратов типа верапамила (например, при тахисистолической форме мерцания предсердий) или новокаинамида (при желудочковой тахикардии) может улучшить гемодинамику, в частности, повысить АД. Полезно помнить о предложенной рабочей группой Американской Кардиологической Ассоциации "кардиоваскулярной триаде": ЧСС, объем крови и насосная функция сердца. Если у больного с отеком легких, выраженной гипотонией или шоком имеется тахикардия или брадикардия, коррекция ЧСС является первой целью лечебных мероприятий. При отсутствии отека легких, а тем более при наличии признаков гиповолемии, у больных с коллапсом или шоком проводят пробу с жидкостью: болюсное введение 250-500 мл физиологического раствора. При хорошей реакции на введение жидкости продолжают инфузию плазмозамещающих растворов со скоростью, достаточной для поддержания АД на уровне около 90-100 мм. Если реакция на введение жидкости отсутствует или появляются признаки застоя в легких, начинают внутривенную инфузию мощных инотропных и вазопрессорных препаратов: норадреналина, допамина, добутамина, амринона.
Показания и сроки имплантации кардиостимулятора при атриовентрикулярных блокадах, осложнивших течение острого инфаркта миокарда
У 195 больных с острым инфарктом миокарда (ОИМ), осложненным атриовентрикулярной (АВ) блокадой II-III степени, изучалась динамика АВ-проведения, уточнялись сроки и показания для имплантации кардиостимулятора. Из них у 118 больных (60,5%) проводили временную трансвенозную электрокардиостимуляцию (ЭКС), а у 32 больных (16,4%) была произведена операция имплантации кардиостимулятора в сроки от 12 до 25 суток, в среднем через 16,4+/-1,5 суток от начала ОИМ. Показаниями для постоянной ЭКС были: стабильное сохранение АВ-блокад III и II степени (тип 2:1 и далеко зашедшая блокада) более двух недель от начала заболевания и сочетающихся с блокадами ножек пучка Гиса. При соблюдении этих правил стойкое восстановление синусового ритма на фоне постоянной ЭКС наблюдалось лишь у двух больных, а рецидивы АВ-блокады II-III степени после перенесенного ОИМ у больных без постоянной ЭКС были выявлены в 11,2% случаев.
Ключевые слова: острый инфаркт миокарда, атриовентрикулярная блокада, показания к ЭКС, имплантация кардиостимулятoра.
Частота возникновения атриовентрикулярных блокад II и III степени при остром инфаркте миокарда (ОИМ) колеблется от 12 до 20% [6, 7]. Известно, что при передней локализации ОИМ, осложненного полной поперечной блокадой сердца, прогноз значительно хуже, чем при задней локализации поражения и смертность без применения временной трансвенозной электрокардиостимуляции (ЭКС) достигает 80% [4, 5]. Применение метода временной ЭКС в большинстве случаев позволяет вывести больных из состояния брадиаритмического шока, предупредить возникновение приступов Морганьи-Адамса-Стокса и значительно улучшить прогноз [6]. В ряде случаев развившиеся в остром периоде инфаркта миокарда атриовентрикулярные (АВ) блокады могут сохраняться в постинфарктном периоде.
В рекомендациях, предложенных в 1991 году рабочей группой Американской ассоциации кардиологов и Американского колледжа кардиологов (АНА/АСС), АВ-блокады, осложняющие течение ОИМ, выделены в отдельную категорию показаний к постоянной ЭКС [8]. При этом, показаниями к имплантации кардиостимулятора являются как устойчивая, так и преходящая АВ-блокада II-III степени, сочетающаяся с блокадой ножек пучка Гиса, а относительным показанием - устойчивая АВ-узловая блокада. Несмотря на это, данные об оптимальных сроках имплантации кардиостимулятора при 0ИМ противоречивы. Некоторые авторы подчеркивают, что, поскольку ближайший прогноз у данной категории больных в основном зависит от величины некроза миокарда, степени дисфункции левого желудочка и динамики АВ-проведения, постоянная ЭКС должна быть отсроченной [1]. М.Я. Руда и соавт. [5] считают, что, если поперечная блокада сердца, развившаяся как осложнение ОИМ, сохраняется более 4 недель, то это, чаще всего, свидетельствует о ее переходе в постоянную форму и является показанем к имплантации кардиостимулятора. Однако, Ю.Ю. Бредикис [2] рекомендует имплантацию кардиостимулятора через 6-9 дней при сохранении АВ-блокады II-III степени, осложняющей течение ОИМ и сочетающейся с блокадой ножек пучка Гиса.
Целью работы явилось изучение динамики АВ-блокады II-III степени, осложнившей течение ОИМ, уточнение сроков и показаний для имплантации кардиостимулятора.
Материал и методы
За 9 лет работы в блоке интенсивной терапии и реанимации при городском инфарктном отделении из 1652 больных, поступивших с диагнозом ОИМ у 195 (14,7%) диагностировано осложнение в виде АВ-блокады II и III степени (соответственно, у 117 и 78 больных). Возраст больных (108 мужчин и 87 женщин) составил 37-75 лет, в среднем - 64,7+/-4,5 года. Из них у 91 больного (46,7%) был выявлен ОИМ передней локализации и у 104 (53,3%) - задней. АВ-блокала II-III степени чаще сочеталась с задней локализацией ОИМ, реже - с передней (соответственно, в 78.5 и 21,5% случаев). Из 78 больных с АВ-блокадой III степени у 46 (58,9%) диагностирован дистальный тип и у 32 (41,1%) - проксимальный тип. При АВ-блокаде II степени отмечены следующие типы блокады: тип Самойлова-Венкебаха у 54 больных, тип Мобитца у 23 больных, тип 2:1 у 29 больных и далеко зашедшая блокада у 11 больных. У 65 больных (33,3%) АВ-блокада носила перемежающийся характер, преимущественно при задней локализации.
Повторный ОИМ был диагностирован у 71 больного (36,4%), в том числе передняя локализация - у 37 и задняя - у 34. Кроме того, у 23 больных (32,4%) повторный ОИМ развился в области ранее перенесенного инфаркта миокарда, а у 48 больных (67,6%) - в противоположной стенке сердца. Важно отметить, что из числа 71 больного с повторным ОИМ у 15 (21,1%) течение первичного инфаркта миокарда осложнялось преходящими АВ-блокадами. Также из 195 больных у 49 (25,1%) на исходной ЭКГ были выявлены нарушения внутрижелудочковой проводимости, в том числе у 10 больных - билатеральная бифасцикулярная блокада ножек пучка Гиса.
АВ-блокады чаще возникали в период до 6 суток от начала заболевания и в большинстве случаев отягощали течение ОИМ. Так, у 57 больных (73,1%) АВ-блокада III степени сопровождалась острой сердечной недостаточностью (отек легких, кардиогенный шок), в том числе у всех больных с передним и повторным ОИМ. При АВ-блокаде II степени указанное осложнение отмечено в 44,4% случаев. Кроме того, у 45 больных (23,1%) диагностирован синдром Морганьи-Адамса-Стокса с приступами синкопе; у трех из них была фибрилляция желудочков на фоне полной АВ-блокады, а у остальных - асистолия.
С учетом общепринятых показаний у 118 больных (60,5%) проводили временную учащающую трансвенозную ЭКС из верхушки правого желудочка в режиме R-запрещающей стимуляции. У остальных больных эндокардиальный электрод с профилактической целью вводился в правое предсердие. Из них лишь у 7 в дальнейшем возникла необходимость в проведении временной ЭКС. Частота ЭКС в зависимости от тяжести сердечной недостаточности колебалась от 55 до 80 имп/мин.
Результаты и их обсуждение
Учитывая динамику ОИМ (клиническое течение, электрокардиографические и лабораторные данные), характер АВ-блокады (стойкость и степень блокады, результаты медикаментозной стимуляции, наличие синдрома Морганьи-Адамса-Стокса) у 32 больных ( 16,4%) в сроки от 12 до 25 суток от начала О ИМ (в среднем 16,4+/-1,5 суток) была произведена имплантация кардиостимулятора и навязан ритм эндокардиальным способом в режиме R-запрещающей стимуляции желудочков (режим VVI). Следует отметить, что операция имплантации кардиостимулятора проводилась в той же клинике, и после операции больные наблюдались в инфарктном отделении. Кроме местного обезболивания, перед операцией внутримышечно вводились наркотические анальгетики и барбитураты с целью предупреждения ангинозного приступа. В ходе операции у некоторых больных возникали преходящие желудочковые экстрасистолы, иногда групповые, связанные с механическим раздражением эндокарда электродом. Важно, что послеоперационных осложнений ЭКС и рецидива ОИМ не наблюдали.
Необходимо отметить, что у 21 из 32 больных была АВ-блокада III степени, у 7 - II степени типа 2:1 и у 4 - далеко зашедшая блокада. Кроме того, у 23 больных диагностирован повторный ОИМ, у 9 - первичный. Передняя локализация ОИМ была выявлена у 20 больных и задняя - у 12. У трех больных с повторным ОИМ отмечалась преходящая АВ-блокада II-III степени, осложнившая течение перенесенного в прошлом инфаркта миокарда и у 26 больных имело место нарушение внутрижелудочковой проводимости.
Проспективное наблюдение в течение года после перенесенного ОИМ показало, что частота рецидивов АВ-блокады II-III степени составляла 11,2%. Так, у 12 больных с преходящей АВ-блокадой II-III степени, осложнившей течение ОИМ, блокада возобновилась в сроки от двух до 7 мес от начала заболевания. Для этих больных характерными являлись: перенесенный повторный инфаркт миокарда, сохранение АВ-блокады более одной недели и преходящая бифасцикулярная блокада ножек пучка Гиса в остром периоде инфаркта миокарда. Кроме того, у 24 больных сохранялась АВ-блокада I степени, в том числе, у 18 - сочетание ее с монофасцикулярной блокадой ножек пучка Гиса. У 11 больных были выявлены эпизоды АВ-блокады II степени типа Самойлова-Венкебаха на фоне приема лекарств, угнетающих АВ-проводимость. У 7 больных наблюдалась полная блокада левой ножки и у двух - правой ножки пучка Гиса. Следует отметить, что у 23 больных инфаркт миокарда имел рецидивирующее течение, а у 10 больных в течение года развился повторный ОИМ.
Длительность наблюдения за больными с имплантированным кардиостимулятором составила 6 лет. В динамике изучалось состояние АВ-проводимости путем кратковременного отключения кардиостимулятора или программированного урежения частоты электроимпульсов. Выявлено, что у 22 больных (68,8%) АВ-блокада II-III степени носила перемежающийся характер, а у двух больных стойко восстановилась нормальная АВ-проводимость (через 3 и 5 мес. после ОИМ). У обоих больных был диагностирован первичный ОИМ: у одного - передней локализации, осложненный АВ-блокадой II степени типа 2:1 и бифасцикулярной блокадой ножек пучка Гиса, а у другого - задней локализации с перемежающейся АВ-блокадой III степени и преходящей полной блокадой правой ножки пучка Гиса. Только у 8 больных, у которых до имплантации кардиостимулятора диагностировался дистальный тип блокады, отмечена стойкая АВ-блокада II-III степени.
Наши наблюдения показывают, что из 18 больных со стойкой АВ-блокадой II-III степени длительностью больше двух недель, у 12 (66,7%) действительно блокада оказалась постоянной, а при длительности АВ-блокады до 7-10 суток частота ее рецидивов составляла 18,4%.
Летальность за первый год после перенесенного ОИМ составила в этой выборке 38,5% (75 человек). Из них у 29 больных (38,7%) смерть наступила в стационаре на фоне временной ЭКС в течение первых 8 суток от начала заболевания. Важно отметить, что летальный исход обуславливали не нарушения АВ-проводимости (больным проводилась временная ЭКС), а другие непосредственные осложнения инфаркта миокарда (кардиогенный шок, альвеолярный отек легких, разрыв сердца, фибрилляция желудочков). В течение года после ОИМ, осложненного преходящими АВ-блокадами и без постоянной ЭКС, умерли еще 39 больных.
Ранее P. Murphy и соавт. [9] показали, что у больных с ОИМ, осложненным брадикардиями, физиологическая ЭКС, по сравнению с однокамерной и фиксированной желудочковой стимуляцией, имеет гемодинамические преимущества и более благоприятный прогноз. По данным З.И. Янушкевичус и соавт. [7], АВ-блокада III степени ухудшает и отдаленный прогноз. Через год после инфаркта миокарда, осложненного АВ-блокадой III степени, летальность больных составила 55,6% и была достоверно выше, чем больных без нарушений АВ-проводимости (8,6%). Это подтверждает целесообразность применения постоянной ЭКС у больных с ОИМ, осложненным АВ-блокадами.
Наши наблюдения показывают, что повторное развитие АВ-блокады после двух недель от начала ОИМ маловеротно (если нет рецидива самого инфаркта миокарда). Поэтому после восстановления АВ-проводимости, эндокардиальный электрод с профилактической целью мы оставляем в правом предсердии не дольше 3-4 суток. Это значительно снижает частоту инфекционных и тромбоэмболических осложнений и способствует ранней активизации больных. Однако, М.Я. Руда и соавт. [5] рекомендуют оставлять эндокардиальный электрод при проксимальном типе АВ-блокады на срок 3-5 суток, а при дистальном типе - на 2-3 недели.
Р.М. Валеева и соавт. [3] приводят данные об имплантации кардиостимулятора при ОИМ, осложненном АВ-блокадой II-III степени. Из 11 больных, оперированных в остром периоде инфаркта миокарда (в работе не указаны сроки имплантации кардиостимулятора), в стационаре умерли 4 человека от прогрессирующей левожелудочковой недостаточности. В данном случае, вероятно, речь идет о более раннем периоде ОИМ.
Таким образом, выбор оптимального срока имплантации кардиостимулятора при остром инфаркте миокарда, осложненном атриовентрикулярной блокадой II-III степени, имеет важное практическое значение. Не оправдана как поздняя имплантация кардиостимулятора (через 1 мес), так и слишком раннее ее проведение, до завершения резорбционно-некротического процесса. Имплантация кардиостимулятора с лечебной целью показана при атриовентрикулярных блокадах III и II степени (тип 2:1 и далеко зашедшая блокада), сохраняющихся более двух недель и сочетающихся с бифасцикулярными блокадами ножек пучка Гиса. При преходящих атриовентрикулярных блокадах II-III степени, осложнивших течение острого инфаркта миокарда, имплантация кардиостимулятора является профилактической.
ЛИТЕРАТУРА
1. Бокерия Л.А., Ревишвили А.Ш., Левант А.Д. и др. Рекомендации имплантации электрокардиостимуляторов при брадикардиях // Грудная и сердечно-сосудистая хирургия. -1993. -№5. -С.36-43.
2. Бредикис Ю.Ю. Электрическая стимуляция сердца. В кн.: Болезни сердца и сосудов. // Под ред. Е.И. Чазова. -М. -1992. -С.97-133.
3. Валеева P.M., Тюлькина Е.Е., Кочубеева О.В. и др. Атриовентрикулярные блокады при остром инфаркте миокарда. // Тезисы I международного славянского Конгресса по электростимуляции и клинической электрофизиологии сердца и III Всероссийской конференции по электростимуляции и клинической электрофизиологии сердца. - Санкт-Петербург. -1993. -С. 7.
5. Руда М.Я.,3ыско А.П. Инфаркт миокарда. // -М. -1981.
6. Сыркин А.Л. Инфаркт миокарда. // -М. -1991.
7. Янушкевичус З.И., Бредикис Ю.Ю., Лукошявичюте А.И., Забела П.В. Нарушения ритма и проводимости сердца. // -М. -1984. -С. 147-174.
8. Dreifus L.S., Fisch C., Griffin J.C. et al. Guidelines for implantation ofpacemakers and antiarrhythmia devices. // J. Am. Coil. Cardiol. -1991. -Vol.l8. -P.1-13.
9. Murphy P., Morton P., Murtagh J.G. et al. Hemodynamic effects of different temporary pacing modes for the management ofbradycardias complicating acute myocardial infarction. // PACE. -1992. - Vol. 15. -P. 391-396.
Abstract
We have studied dynamic changes in the AV conduction to determine indications and terms ofcardiostimulator implantation in 195 patients with acute myocardial infarction complicated with AV block II to III degrees. 118 patients (60,5%) underwent porary transvenous electrocardiostimulation, while in 32 patients (16,4%) the stimulator was implanted surgically after 12 to 25 days, in average 16,4+/-1,5 days after the infarction onset. Indications for permanent stimulation were as follows: stable sistence of AV blocks II to III degrees (2:1 type and a well developed blockade 2 weeks after the onset, and with concomitant idle branches blocks. With these rules abided only in two patients with constant stimulation sinus rhythm was restored, while 1,2% of all cases AV blocks reoccurred after a myocardial infarction.
Key words: acute myocardial infarction, AV blockade, electric stimulation, indications for electric stimulation.
Тромболизис при остром инфаркте миокарда
Сердечно-сосудистые заболевания занимают первое место в общей структуре патология и являются причиной преждевременной смерти среди населения более чем у 60% случаев. Сердечно-сосудистые катастрофы (нестабильная стенокардия, инфаркт миокарда) особенно опасны из-за своего внезапного начала, что часто сопровождается развитием жизненно опасных осложнений. Поэтому стоит в кратчайшие сроки начать высококвалифицированное лечение, так как наибольшие потери случаются именно в первые 2 часа заболевания.
В основе развития ОИМ (острый инфаркт миокарда) лежит внутрикоронарный тромбоз на месте дестабилизированной атеросклеротической бляшки, что приводит к прекращению кровоснабжения и развитию некроза участка сердечной мышцы. Это очень скоротечный процесс: уже через 60 минут от начала ишемии погибает около 50% кардиомиоцитов в зоне поражения.
Экстренная помощь при ОИМ на догоспитальном этапе должна быть направлена на:
- адекватное обезболивание;
- возобновление проходимости поврежденного сосуда, предупреждение реокклюзии (повторного прекращения кровообращения);
- поддержание проходимости венечных артерий, уменьшение агрегации тромбоцитов;
- ограничение зоны ишемии, профилактику или устранение осложнений.
Что такое тромболизис и как его проводят?
Тромболизис (ТЛТ) - это процесс растворения тромба под влиянием введённого в системный кровоток фермента, который вызывает разрушение основы тромба.
Препараты для проведения ТЛТ (тканевые активаторы плазминогена) делятся на прямые (Стрептокиназа) и непрямые (Альтеплаза, Актилизе, Тенектеплаза).
В механизме действия ТАП условно выделяют 3 этапа:
- Связывание фермента с плазминогеном, который находится на фибрине (образование тройного комплекса);
- ТАП способствует проникновению плазминогена в фибрин, превращая его в плазмин;
- Образовавшийся плазмин расщепляет фибрин на мелкие фрагменты (разрушает тромб).
Существует прямая зависимость между временем начала ТЛТ и прогнозом для пациента. В методических рекомендациях Европейской ассоциации кардиологов указано на проведение тромболизиса до 12 часов от начала заболевания (далее введение препарата нецелесообразно).
Процедура ТЛТ вызывает активацию тромбоцитов, повышает концентрацию свободных мелких тромбов. Поэтому ТЛТ необходимо проводить вместе с адъювантной антитромбоцитарной терапией.
Тенектеплазу используют для ТЛТ на догоспитальном этапе. Ее вводят внутривенно болюсно (внутривенно струйно, с помощью шприца) на протяжении 10 секунд. Это ТАП III поколения, который имеет высокий профиль безопасности (низкий риск развития геморрагических и гемодинамических осложнений, аллергических реакций), не требует специфических условий хранения и просто в использовании.

Альтеплаза вводится в условиях стационара. После введения 5 тис ОД гепарина, болюсно вводят 15 мг препарата. Далее переходят на капельное введение 0,75 мг/кг на протяжении 30 минут и 0,5 мг/кг за 60 минут. Общая доза составляет 100 мг. Вся процедура проводиться на фоне непрерывной инфузии гепарина.
Стрептокиназа вводится внутривенно капельно в дозировке 1,5 млн ОД разведенной на 100 мл физиологического раствора на протяжении 30-60 минут. Перед применением препарата вводят болюсно 5 тыс ОД гепарина с последующим возобновлением инфузии не ранее чем через 4 часа после окончания введения Стрептокиназы.
Согласно приказу министерства, после проведения ТЛТ пациента нужно доставить в специализированный стационар с возможностью проведения балонной ангиопластики или стентирования не позже 12 часов.
Показания к проведению
Показаниями к тромболизису при инфаркте миокарда являются:
- Длительный (более 20 минут) ангинозный приступ в первые 12 часов от его начала;
- Элевация сегмента ST на 0,1 мВ и более в двух смежных стандартных или 0,2 мВ в соседних перикардиальных отведениях ЭКГ;
- Полная блокада левой ножки пучка Гиса, которая возникла впервые в присутствии болевого синдрома.
ТЛТ показана в условиях отсутствия возможности проведения ПКВ за 90-120 минут с момента первого контакта с больным.
Тромболизис в случае инфаркта миокарда имеет право выполнять специализированная кардиологическая бригада скорой помощи укомплектована всем необходимым для купирования возможных осложнений.
Противопоказания
Абсолютные противопоказания к тромболизису при инфаркте миокарда:
- Перенесенное геморрагическое ОНМК менее 6 месяцев назад;
- ЧМТ в анамнезе, хирургическое вмешательство до 3 недель;
- Желудочно-кишечное кровотечение менее 1 месяца назад;
- Нарушения свертывающей системы крови;
- Расслаивающая аневризма аорты;
- Рефрактерная артериальная гипертензия (САТ более 200 мм.рт.ст., ДАТ выше 110 мм.рт.ст.).
- ТИА менее 6 месяцев назад;
- Систематическое применение прямых антикоагулянтов;
- Беременность, первые 28 дней после родов;
- Пунктированные сосудов крупного диаметра недоступных для компрессии;
- Длительная травматическая сердечно-легочная реанимация;
- Недавняя лазеротерапия заболеваний сетчатки глазного дна;
- Печеночная недостаточность;
- Язвенная болезнь желудка в стадии обострения;
- Инфекционный эндокардит;
- Диабетическая геморрагическая ретинопатия и другие кровоизлияния в сетчатку глаза.
Врач обязан предупредить пациента обо всех возможных противопоказаниях и осложнениях процедуры. Согласие на ТЛТ пациент подтверждает письменно в протоколе проведения тромболизиса.
Возможные осложнения тромболитической терапии (встречаются не более чем у 0,7% случаев):
- Паренхиматозные кровоизлияния, кровотечение в месте введения;
- Острые нарушения ритма - фибрилляция предсердия рассматривается как показатель реканализации (восстановление кровообращения) сосуда;
- Аллергическая реакция, лихорадка.
Клинические критерии успешной реперфузии (возобновление кислородного питания) миокарда:
- Быстрая регрессия болевого синдрома;
- Проявления во время введения тромболитика реперфузионных аритмий;
- Инволюция изменений ЭКГ (приближение сегмента ST к изолинии;
- Снижение уровня кардиоспецифических биохимических маркеров некроза.
На эффективность ТЛТ влияет и время суток - реканализация происходит хуже в утренние часы. В это время имеют максимальную дневные показатели активность тромбоцитов, коагуляторных процессов, вязкости крови, вазомоторного тонуса и природного ингибирования фибринолиза.
Тромболитическая терапия входит в перечень стандартных мероприятий при оказании помощи больным с острым коронарным синдромом на догоспитальном этапе. Использование ТЛТ в первые часы от появления симптомов ОИМ позволяет спасти пациентов с потенциально некротизированным миокардом, улучшить функцию левого желудочка и снизить показатель смертности от ОИМ. Риск ретромбоза (повторная закупорка) снижает комбинация тромболизиса с гепаринотерапией и длительным применением Аспирина.
Атриовентрикулярная блокада
Атриовентрикулярная (предсердно-желудочковая) блокада (АВ-блокада) - нарушение функции проводимости, выражающееся в замедлении или прекращении прохождения электрического импульса между предсердиями и желудочками и приводящее к расстройству сердечного ритма и гемодинамики. АВ-блокада может протекать бессимптомно или сопровождаться брадикардией, слабостью, головокружением, приступами стенокардии и потери сознания. Атриовентрикулярная блокада подтверждается с помощью электрокардиографии, холтеровского ЭКГ-мониторирования, ЭФИ. Лечение атриовентрикулярной блокады может быть медикаментозным или кардиохирургическим (имплантация электрокардиостимулятора).
Общие сведения
В основе атриовентрикулярной блокады лежит замедление или полное прекращение прохождения импульса от предсердий к желудочкам вследствие поражения собственно АВ-узла, пучка Гиса или ножек пучка Гиса. При этом, чем ниже уровень поражения, тем тяжелее проявления блокады и неудовлетворительнее прогноз. Распространенность атриовентрикулярной блокады выше среди пациентов, страдающих сопутствующей кардиопатологией. Среди лиц с заболеваниями сердца АВ-блокада I степени встречается в 5% случаев, II степени - в 2% случаев, III степень АВ-блокады обычно развивается у пациентов старше 70 лет. Внезапная сердечная смерть, по статистике, наступает у 17% пациентов с полной АВ-блокадой.
Атриовентрикулярный узел (АВ-узел) является частью проводящей системы сердца, обеспечивающей последовательное сокращение предсердий и желудочков. Движение электрических импульсов, поступающих из синусового узла, замедляется в АВ-узле, обеспечивая возможность сокращения предсердий и нагнетания крови в желудочки. После небольшой задержки импульсы распространяются по пучку Гиса и его ножкам к правому и левому желудочку, способствуя их возбуждению и сокращению. Этот механизм обеспечивает поочередное сокращение миокарда предсердий и желудочков и поддерживает стабильную гемодинамику.
Классификация АВ-блокад
В зависимости от уровня, на котором развивается нарушение проведения электрического импульса, выделяют проксимальные, дистальные и комбинированные атриовентрикулярные блокады. При проксимальных АВ-блокадах проведение импульса может нарушаться на уровне предсердий, АВ-узла, ствола пучка Гиса; при дистальных - на уровне ветвей пучка Гиса; при комбинированных - наблюдаются разноуровневые нарушения проводимости.
С учетом продолжительности развития атриовентрикулярной блокады выделяют ее острую (при инфаркте миокарда, передозировке лекарственных средств и т. д.), интермиттирующую (перемежающуюся - при ИБС, сопровождающейся преходящей коронарной недостаточностью) и хроническую формы. По электрокардиографическим критериям (замедление, периодичность или полное отсутствие проведения импульса к желудочкам) различают три степени атриовентрикулярной блокады:
- I степень - атриовентрикулярная проводимость через АВ-узел замедлена, однако все импульсы из предсердий достигают желудочков. Клинически не распознается; на ЭКГ интервал P-Q удлинен > 0,20 секунд.
- II степень - неполная атриовентриулярная блокада; не все предсердные импульсы достигают желудочков. На ЭКГ - периодическое выпадение желудочковых комплексов. Выделяют три типа АВ-блокады II степени по Мобитцу:
- Тип I Мобитца - задержка каждого последующего импульса в АВ-узле приводит к полной задержке одного из них и выпадению желудочкового комплекса (период Самойлова - Венкебаха).
- Тип II Мобитца - критическая задержка импульса развивается внезапно, без предшествующего удлинения периода задержки. При этом отмечается отсутствие проведения каждого второго (2:1) или третьего (3:1) импульса.
- III степень - (полная атриовентрикулярная блокада) - полное прекращение прохождения импульсов от предсердий к желудочкам. Предсердия сокращаются под влиянием синусового узла, желудочки - в собственном ритме, реже 40 раз в мин., что недостаточно для обеспечения адекватного кровообращения.
- Шланговые противогазы для рабочих. Требования к противогазам на производстве
- Сопутствующие зрачкам движения глаз. Феномен Вестфаль-Пильца (Westphal-Piltz)
- Т-клеточный пролимфоцитарный лейкоз. Диагностика т-клеточного пролиферативного лейкоза.
- Признаки базальноклеточного рака уха и его прогноз
- Защита от вредного влияния рентгеновых лучей. Рентгеноскопия
Атриовентрикулярные блокады I и II степени являются частичными (неполными), блокада III степени - полной.
Причины развития АВ-блокад
По этиологии различаются функциональные и органические атриовентрикулярные блокады. Функциональные АВ-блокады обусловлены повышением тонуса парасимпатического отдела нервной системы. Атриовентрикулярная блокада I и II степени в единичных случаях наблюдается у молодых физически здоровых лиц, тренированных спортсменов, летчиков. Обычно она развивается во сне и исчезает во время физической активности, что объясняется повышенной активностью блуждающего нерва и рассматривается как вариант нормы.
АВ-блокады органического (кардиального) генеза развиваются в результате идиопатического фиброза и склероза проводящей системы сердца при различных его заболеваниях. Причинами кардиальных АВ-блокад могут служить ревматические процессы в миокарде, кардиосклероз, сифилитическое поражение сердца, инфаркт межжелудочковой перегородки, пороки сердца, кардиомиопатии, микседема, диффузные заболевания соединительной ткани, миокардиты различного генеза (аутоиммунного, дифтерийного, тиреотоксического), амилоидоз, саркоидоз, гемохроматоз, опухоли сердца и др. При кардиальных АВ-блокадах вначале может наблюдаться частичная блокада, однако, по мере прогрессирования кардиопатологии, развивается блокада III степени.
К развитию атриовентрикулярных блокад могут привести различные хирургические процедуры: протезирование аортального клапана, пластика врожденных пороков сердца, атриовентрикулярная РЧА сердца, катетеризация правых отделов сердца и пр.
Довольно редко в кардиологии встречается врожденная форма предсердно-желудочковой блокады (1:20 000 новорожденных). В случае врожденных АВ-блокад наблюдается отсутствие участков проводящей системы (между предсердиями и АВ-узлом, между АВ-узлом и желудочками или обеими ножками пучка Гиса) с развитием соответствующего уровня блокады. У четверти новорожденных атриовентрикулярная блокада сочетается с другими сердечными аномалиями врожденного характера.
Среди причин развития атриовентрикулярных блокад нередко встречается интоксикация лекарственными препаратами: сердечными гликозидами (дигиталисом), β-блокаторами, блокаторами кальциевых каналов (верапамилом, дилтиаземом, реже - коринфаром), антиаритмиками (хинидином), солями лития, некоторыми другими препаратами и их комбинациями.
Симптомы АВ-блокад
Характер клинических проявлений атриовентрикулярных блокад зависит от уровня нарушения проводимости, степени блокады, этиологии и тяжести сопутствующего заболевания сердца. Блокады, развившиеся на уровне атриовентрикулярного узла и не вызывающие брадикардию, клинически никак себя не проявляют. Клиника АВ-блокады при данной топографии нарушений развивается в случаях выраженной брадикардии. Из-за малой ЧСС и падения минутного выброса крови сердцем в условиях физической нагрузки у таких пациентов отмечаются слабость, одышка, иногда - приступы стенокардии. Из-за снижения церебрального кровотока могут наблюдаться головокружение, преходящие ощущения спутанности сознания и обмороки.
При атриовентрикулярной блокаде II степени пациенты ощущают выпадение пульсовой волны как перебои в области сердца. При АВ-блокаде III типа возникают приступы Морганьи-Адамса-Стокса: урежение пульса до 40 и менее ударов в минуту, головокружение, слабость, потемнение в глазах, кратковременная потеря сознания, боли в области сердца, цианоз лица, возможно - судороги. Врожденные АВ-блокады у пациентов детского и юношеского возраста могут протекать бессимптомно.
Осложнения АВ-блокад
Осложнения при атриовентрикулярных блокадах в основном обусловлены выраженным замедлением ритма, развивающимся на фоне органического поражения сердца. Наиболее часто течение АВ-блокад сопровождается появлением или усугублением хронической сердечной недостаточности и развитием эктопических аритмий, в том числе, желудочковой тахикардии.
Течение полной атриовентрикулярной блокады может осложниться развитием приступов Морганьи-Адамса-Стокса, связанных с гипоксией мозга в результате брадикардии. Началу приступа может предшествовать ощущение жара в голове, приступы слабости и головокружения; во время приступа пациент бледнеет, затем развивается цианоз и потеря сознания. В этот момент пациенту может потребоваться проведение непрямого массажа сердца и ИВЛ, так как длительная асистолия или присоединение желудочковых аритмий повышает вероятность внезапной сердечной смерти.
Многократные эпизоды потери сознания у пациентов старческого возраста могут привести к развитию или усугублению интеллектуально-мнестических нарушений. Реже при АВ-блокадах возможно развитие аритмогенного кардиогенного шока, чаще у пациентов с инфарктом миокарда.
В условиях недостаточности кровоснабжения при АВ-блокадах иногда наблюдаются явления сердечно-сосудистой недостаточности (коллапс, обмороки), обострение ишемической болезни сердца, заболеваний почек.
Диагностика АВ-блокад
При оценке анамнеза пациента в случае подозрения на атриовентрикулярную блокаду выясняют факт перенесенных в прошлом инфаркта миокарда, миокардита, других кардиопатологий, приема лекарственных препаратов, нарушающих атриовентрикулярную проводимость (дигиталиса, β-блокаторов, блокаторов кальциевых каналов и др.).
При аускультации сердечного ритма выслушивается правильный ритм, прерываемый длинными паузами, указывающими на выпадение желудочковых сокращений, брадикардия, появление пушечного I тона Стражеско. Определяется увеличение пульсации шейных вен по сравнению с сонными и лучевыми артериями.
На ЭКГ АВ-блокада I степени проявляется удлинением интервала Р-Q > 0,20 сек.; II степени - синусовым ритмом с паузами, в результате выпадений желудочковых комплексов после зубца Р, появлением комплексов Самойлова-Венкебаха; III степени - уменьшением числа желудочковых комплексов в 2-3 раза по сравнению с предсердными (от 20 до 50 в минуту).
Проведение суточного мониторирования ЭКГ по Холтеру при АВ-блокадах позволяет сопоставить субъективные ощущения пациента с электрокардиографическими изменениями (например, обмороки с резкой брадикардией), оценить степень брадикардии и блокады, связь с деятельностью пациента, приемом лекарств, определить наличие показаний к имплантации кардиостимулятора и др.
С помощью проведения электрофизиологического исследования сердца (ЭФИ) уточняется топография АВ-блокады и определяются показания к ее хирургической коррекции. При наличие сопутствующей кардиопатологии и для ее выявления при АВ-блокаде проводят эхокардиографию, МСКТ или МРТ сердца.
Проведение дополнительных лабораторных исследований при АВ-блокаде показано при наличии сопутствующих состояний и заболеваний (определение в крови уровня электролитов при гиперкалиемии, содержания антиаритмиков при их передозировке, активности ферментов при инфаркте миокарда).
Лечение АВ-блокад
При атриовентрикулярной блокаде I степени, протекающей без клинических проявлений, возможно только динамическое наблюдение. Если АВ-блокада вызвана приемом лекарственных средств (сердечных гликозидов, антиаритмических препаратов, β-блокаторов), необходимо проведение корректировки дозы или их полная отмена.
При АВ-блокадах кардиального генеза (при инфаркте миокарда, миокардитах, кардиосклерозе и др.) проводится курс лечения β-адреностимуляторами (изопреналином, орципреналином), в дальнейшем показана имплантация кардиостимулятора.
Препаратами первой помощи для купирования приступов Морганьи-Адамса-Стокса являются изопреналин (сублингвально), атропин (внутривенно или подкожно). При явлениях застойной сердечной недостаточности назначают диуретики, сердечные гликозиды (с осторожностью), вазодилататоры. В качестве симптоматической терапии при хронической форме АВ-блокад проводится лечениетеофиллином, экстрактом белладонны, нифедипином.
Радикальным методом лечения АВ-блокад является установка электрокардиостимулятора (ЭКС), восстанавливающего нормальный ритм и частоту сердечных сокращений. Показаниями к имплантации эндокардиального ЭКС служат наличие в анамнезе приступов Морганьи-Адамса-Стокса (даже однократного); частота желудочкового ритма менее 40 в минуту и периоды асистолии 3 и более секунд; АВ-блокада II степени (II типа по Мобитцу) или III степени; полная АВ-блокада, сопровождающаяся стенокардией, застойной сердечной недостаточностью, высокой артериальной гипертензией и т. д. Для решения вопроса об операции необходима консультация кардиохирурга.
Прогноз и профилактика АВ-блокад
Влияние развившейся атриовентрикулярной блокады на дальнейшую жизнь и трудоспособность пациента определяется рядом факторов и, прежде всего, уровнем и степенью блокады, основным заболеванием. Наиболее серьезный прогноз при III степени АВ-блокады: пациенты нетрудоспособны, отмечается развитие сердечной недостаточности.
Осложняет прогноз развитие дистальных АВ-блокад из-за угрозы полной блокады и редкого желудочкового ритма, а также их возникновение на фоне острого инфаркта миокарда. Ранняя имплантация электрокардиостимулятора позволяет увеличить продолжительность жизни пациентов с АВ-блокадами и улучшить качество их жизни. Полные врожденные атриовентрикулярные блокады прогностически более благоприятны, чем приобретенные.
Как правило, атриовентрикулярная блокада обусловлена основным заболеванием или патологическим состоянием, поэтому ее профилактикой является устранение этиологических факторов (лечение сердечной патологии, исключение бесконтрольного приема препаратов, влияющих на проведение импульсов и т. д.). Для профилактики усугубления степени АВ-блокады показана имплантация электрокардиостимулятора.
Читайте также:
