Нарушения слуха и вестибулярный аппарат при врожденной расщелине неба. Ложные расщелины
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Красноярский государственный медицинский университет, ГСП №8, Красноярск
Кафедра ЛОР-болезней с курсом последипломного образования
Чувашский государственный университет им. И.Н. Ульянова, Вторая городская больница, Чебоксары
Хирургия расщелин неба с устранением патологии ЛОР-органов
Журнал: Стоматология. 2014;93(2): 33‑36
Радкевич А.А., Вахрушев С.Г., Гантимуров А.А., Иванов В.А. Хирургия расщелин неба с устранением патологии ЛОР-органов. Стоматология. 2014;93(2):33‑36.
Radkevich AA, Vakhrushev SG, Gantimurov AA, Ivanov VA. Cleft palate surgery with ENT-pathology correction. Stomatologiya. 2014;93(2):33‑36. (In Russ.).
Представлена технология устранения расщелин неба, включающая в себя одномоментное вмешательство на ЛОР-органах (шунтирование барабанных полостей, сегментарную или полную аденотомию и др.) с восстановлением анатомии сошника и реконструкцией твердого неба сверхэластичным тонкопрофильным имплантатом на основе никелида титана. Описаны преимущества разработанной методики в сравнении с ранее известными.
В целях устранения патологических изменений ЛОР-органов и предотвращения послеоперационных дефектов у больных с расщелинами неба разработана технология уранопластики с использованием материалов с памятью формы.
Техника операции. Освежают края расщелины; в области боковых отделов твердого неба рассекают слизистую оболочку (СО) и надкостницу по Лангенбеку и производят разрезы в переднем и среднем отделе твердого неба для образования слизисто-надкостничных лоскутов, пользуясь одной из известных методик 3 (у больных с двусторонними расщелинами выполняют разрезы с правой и левой сторон дефекта для формирования слизисто-надкостничных лоскутов с учетом перекрытия расщелины за счет СО и надкостницы межчелюстной кости, небных и альвеолярных отростков верхних челюстей - ВЧ). Слизисто-надкостничные лоскуты отслаивают от небных и альвеолярных отростков ВЧ и горизонтальных пластинок небных костей. Образуют и мобилизуют слизисто-надкостничные лоскуты в переднем и среднем отделе твердого неба. Выводят и мобилизуют сосудисто-нервные пучки из больших небных каналов после резекции их задних стенок, мобилизуют СО нижнего отдела полости носа, отделяют слизисто-надкостничные лоскуты от СО носа в области границы твердого и мягкого неба вперед, рассекают СО и подслизистый слой в ретромолярных зонах до язычной поверхности альвеолярного отростка нижней челюсти и обнажают крючки крыловидных отростков основной кости. Отделяют мягкие ткани от последних в слое межфасциального пространства и от внутренней поверхности внутренней пластинки основной кости до прикрепления m. pharingo-palatini, не изменяя места прикрепления m. tensor veli palatini. При недостаточной мобильности тканей пересекают верхние полюса сухожилий данных мышц. В области дефекта сошника отсепаровывают поднадкостнично СО вертикальной пластинки решетчатой кости с обеих сторон на 0,4-0,8 см и поднадкостнично в зону дефекта сошника и костей твердого неба с нижней поверхности устанавливают тканевый никелид-титановый имплантат, разработанный в НИИ медицинских материалов и имплантатов с памятью формы (Томск), изготовленный из никелид-титановой нити диаметром 50-60 мкм с размером ячеек
Во всех случаях выполняют парацентез барабанных перепонок с последующей эвакуацией слизистого или слизисто-гнойного содержимого из барабанных полостей и шунтированием последних. В случаях уменьшенного объема нижнего носового хода, обусловленного гипертрофией нижней носовой раковины, для предотвращения затрудненного носового дыхания на медиальной поверхности переднего конца нижней носовой раковины наконечником лазерного кварцевого световода диаметром 0,5 мм выполняют аппликацию излучением Nd-Yag-лазера с длиной волны 0,89 мкм мощностью 20 Вт в непрерывном режиме, с продвижением световода в подслизистом слое параллельно костному остову и СО на всю длину раковины со скоростью 2 см/с, затем в полость носа вводят кровеостанавливающий тампон. Искривление носовой перегородки устраняют путем резекции выступающего в сторону участка или рассечением у основания, в средней и верхней части четырехугольного хряща. Гипертрофические изменения глоточной миндалины иссекают полностью или только в проекции устьев слуховых труб (в целях сохранения функции небно-глоточного затвора).
С применением данной технологии осуществлено лечение 18 больных с одно- и двусторонними расщелинами твердого и мягкого неба.
Анализ отдаленных (3 года) анатомических результатов показал, что в области твердого неба в проекции срединного небного шва наблюдалось удовлетворительное состояние послеоперационного рубца. В участках вторичного заживления (небные отростки ВЧ и горизонтальные пластинки небных костей) выявлялась умеренно выраженная гипертрофическая рубцовая деформация СО твердого неба. Ригидность мягкого неба незначительна. При передней риноскопии гипертрофической рубцовой деформации нижнего носового хода в проекции расщелины не отмечалось, каких-либо анатомических и функциональных нарушений со стороны ЛОР-органов, твердого и мягкого неба, связанных с оперативным вмешательством, не наблюдалось.
В качестве иллюстрации приводим наблюдение.
Больной В., 3 лет, обратился в клинику по поводу врожденной левосторонней расщелины верхней губы, твердого и мягкого неба, состояния после хейлоринопластики с целью хирургического лечения (рис. 1). Рис. 1. Больной В. до оперативного лечения. Под эндотрахеальным наркозом выполнены шунтирование барабанных полостей (рис. 2) Рис. 2. Больной В., состояние после шунтирования барабанной полости. и сегментарная аденотомия (рис. 3). Рис. 3. Больной В., состояние после сегментарной аденотомии. Над гипертрофированными участками СО заднего конца нижней носовой раковины выполнена аппликационная коагуляция. В полость носа введены кровеостанавливающие тампоны. Освежены края расщелины, проведены разрезы Лангенбека-Эрнста, образованы и мобилизованы слизисто-надкостничные лоскуты, мобилизована СО нижнего отдела полости носа, в области дефекта сошника отсепарована поднадкостнично СО вертикальной пластинки решетчатой кости с обеих сторон на 0,5 см и поднадкостнично в зону дефекта сошника и костей твердого неба с нижней поверхности установлен тканевый никелид-титановый имплантат вышеописанной конструкции (рис. 4). Рис. 4. Больной В., состояние после установки тканевого никелид-титанового имплантата. Лоскуты мягкого неба ушиты между собой в 3 слоя, слизисто-надкостничные лоскуты твердого неба ушиты между собой (рис. 5) Рис. 5. Больной В., состояние после фиссурорафии. , раны в зоне крыловидно-нижнечелюстных пространств с учетом ретранспозиции неба ушиты узловыми швами наглухо, изъян переднего отдела твердого неба устранен при помощи лоскута по В.И. Заусаеву, проведена дополнительная фиксация слизисто-надкостничных лоскутов йодоформными полосками и съемной защитной пластинкой. Послеоперационное ведение больного соответствовало общепринятой методике, течение гладкое. Тампоны из полости носа удалены на 2-е сутки, швы сняты на 10-е сутки. Заживление раны со стороны полости рта первичное, со стороны полости носа вторичное. При осмотре через 3 года отмечены удовлетворительные анатомические и функциональные результаты (рис. 6) Рисунок 6. Рис. 6а. Больной В. через 3 года после оперативного лечения. Состояние ротовой полости. Рисунок 6. Рис. 6б. Больной В. через 3 года после оперативного лечения. Состояние твердого неба. Рисунок 6. Рис. 6в. Больной В. через 3 года после оперативного лечения. Состояние левого носового хода. .
Преимущество предлагаемой технологии перед ранее известными состоит в том, что ткань из никелида титана, установленная между слизисто-надкостничными лоскутами, костной частью твердого неба и дном полости носа, благодаря биохимической и биомеханической совместимости с тканями организма, способностью удерживать жидкость обеспечивает восстановление СО дна носового хода, надежно изолирует ротовую и носовую полости в случаях расхождения слизисто-надкостничных швов, некроза части лоскутов. В данных ситуациях соединительная ткань со стороны реципиентных областей прорастает сквозь ячеистую структуру имплантата с образованием в зоне бывшего изъяна единого соединительнотканного регенерата. Отсутствие необходимости накладывать выворотные швы на СО дна полости носа значительно сокращает время операции, предотвращает гипертрофическую рубцовую деформацию и сужение нижнего носового хода, а одномоментное устранение патологических состояний органов полости носа обеспечивает нормализацию носового дыхания и предупреждает развитие риносинуситов. Сегментарная аденотомия дает возможность нормализовать функциональное состояние слуховых труб, не приводя к функциональной недостаточности небно-глоточного затвора.
Что нужно знать про снижение слуха у детей при врождённой расщелине нёба
Слух является жизненно-важной функцией для ребенка. Нарушение слуха это одна из самых распространенных проблем у новорожденных, даже без расщелины неба. Три ребенка из тысячи имеют значительные нарушения слуха, менее выраженные нарушения встречаются у большего количества детей.
Современные технологии позволяют исследовать функцию слуха даже у спящего ребенка. Поэтому в любом случае необходимо пройти исследование слуха, если не в роддоме, то позже.
Механизм слуха у детей и методы исследования
Компьютерная аудиометрия (ABR auditory brainstem response) — это метод регистрации вызванных потенциалов (ВП) мозга, Проведение компьютерной аудиометрии показано детям первого года жизни и детям младшего возраста. Метод позволяет объективно определить эквивалент порога слуха у ребенка.
ОАЭ (система регистрации отоакустической эмиссии): небольшой зонд вставляется в слуховой проход. Он измеряет функцию внутреннего уха. Этот тест малоспецифичен и не показывает реальное снижение слуха.
Поведенческий тест: тест для более взрослых детей, которые могут повернуть голову или протянуть руки в ответ на звуковой раздражитель. Тест определяет насколько тихие звуки может слышать ваш ребенок и какие слова он понимает.
Акустический импеданс (тимпанометрия): позволяет выявить проблемы за барабанной перепонкой. Используется у детей любого возраста, но менее показателен у маленьких. Отражает функцию среднего уха, но не показывает нарушение слуха.
Виды нарушения слуха
Выделяют два основных типа снижения слуха: нейросенсорный (проблемы с нервом) и кондуктивный (слуховой канал и проблемы в среднем ухе). К кондуктивной тугоухости могут приводить ушные инфекции. Дети с расщелиной имеют повышенный риск развития нейросенсорной тугоухости. Но большинство детей с расщелиной страдают именно от кондуктивной тугоухости, которая легко поддается лечению.
Даже дети с умеренной тугоухостью могут пропускать до 50% обсуждений в классе. При отсутствии лечения это может повлиять на формирование речи, поведение и самовосприятие. Ребенку с расщелиной необходимо проходить периодические обследования у специалистов. Проблемами, связанными с нарушением слуха, занимаются ЛОР врачи (оториноларингологи), аудиологи (исследуют слух) и логопеды (занимаются проблемами формирования речи).
Расщелина неба и средний отит
Ухо состоит из нескольких частей: наружное ухо, слуховой проход, среднее ухо и внутреннее ухо (рис. 1). Полость среднего уха обычно заполнена воздухом, в нем находятся маленькие косточки, которые соединяют барабанную перепонку с внутренним ухом. Внутреннее ухо содержит нервные окончания, которые передают звуковые сигналы для обработки в мозг. Среднее ухо соединяется с глоткой посредством слуховой (Евстахиевой) трубы, которая открывается и смыкается во время зевания или глотания. Вы можете почувствовать, как работают слуховые трубы во время полета в самолете, при этом в ушах слышатся щелчки.
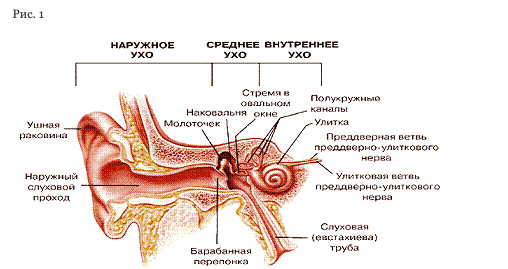
Дети с расщелиной больше подвержены ушным инфекциям
У детей с расщелиной губы, но без расщелины неба проблемы со слухом возникают не чаще, чем у здоровых детей. Дети с ращелиной неба испытывают больше проблем с ушами, вот почему:
Когда слуховая труба раскрывается, по ней в полость среднего уха попадает воздух. Это выравнивает давление в полости среднего уха с атмосферным давлением, то есть происходит «вентиляция» среднего уха. Если среднее ухо вентилируется недостаточно, это приводит к скоплению жидкости (за счет возникающего разряжения), что может привести к инфекции. За правильное открытие слуховых труб отвечают мышцы мягкого неба (рис. 2).
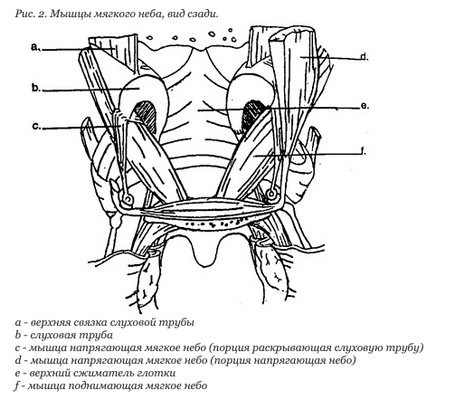
Функции мышц неба
Levator veli palatini - при сокращении кроме поднимания неба также смещает перешеек слуховой трубы медиально, кзади и кверху, то есть увеличивает диаметр просвета перешейка и суживает глоточное отверстие.
При расщелине нарушается её функция и возникает экссудативный средний отит.
Tensor veli palatini идет под углом 30-40 град по отношению к слуховой трубе и перегибается на 90 град вокруг крючка клиновидной кости перед тем, как выйти на мягкое небо. Формирует апоневроз. При сокращении раскрывает слуховую трубу.
M. Salpingopharyngeus - оттягивает заднюю губу устья и расширяет его.
Согласованная работа мышц создает механизм насоса, который позволяет эвакуировать содержимое трубы и втягивать воздух.
У детей с расщелиной неба эти мышцы работают неправильно. В некоторых случаях мышцы неба даже не доходят до слуховой трубы. У таких детей с большей вероятностью в полости среднего уха скапливается жидкость, что приводит к инфекции («среднему отиту»). Даже после пластики неба эти мышцы могут продолжать работать неправильно. Поэтому у некоторых детей проблемы с ушами остаются и после взросления. Подавляющее большинство детей с расщелиной неба имеют воспалительные изменения в среднем ухе. У половины из них возникают повторные случаи воспаления в течение первого года жизни. Ушные инфекции могут иметь неприятные последствия в виде нарушения питания и сна, стрельбы в ухе, раздражительности, повышении температуры или гноетечении. При выявлении среднего отита могут назначить лечение антибиотиками.
Антибиотики нужны не всегда, при условии нераспространения инфекции в полость среднего уха. Скопление жидкости в среднем ухе может вызывать чувство неудобства, но не привести к появлению симптомов инфекции. Вы можете даже не заметить незначительное ухудшение слуха у ребенка. Тем не менее, это может повлиять на развитие речи.
Ушные инфекции и слух
Дети с жидкостью в среднем ухе выявляются при ранних слуховых тестах. Если ваш ребенок не прошел слуховой тест, это еще не значит, что он глухой. Хотя у детей с расщелиной повышен риск возникновения нейросенсорной тугоухости, большинство из них все же имеют временные нарушения слуха, связанные с наличием жидкости в среднем ухе. Такой тип потери слуха поддается лечению!
После получения отрицательных результатов слуховых тестов ваш ребенок будет направлен на обследование аудиолога и оториноларинголога для выявления наличия жидкости в среднем ухе. Лучше всего пройти такие обследования до возраста 6 мес. Ранняя помощь способствует улучшению развития речи.
Если вашему ребенку требуются шунты, которые устанавливаются в барабанную перепонку, то это может быть сделано одновременно с уранопластикой или даже раньше.
Поскольку ваш ребенок подвержен повышенному риску развития инфекции и скопления жидкости в среднем ухе, ему требуется периодическое обследование. Ушные инфекции могут развиваться и у детей школьного возраста. Поэтому как минимум 1 раз в год необходимо проверять слух. При выявлении патологии обследование необходимо проводить еще чаще. С возрастом риск развития отита уменьшается, тем не менее иногда он может развиться и у взрослых.
Шунты
При неэффективности медикаментозного лечения заболеваний среднего уха чаще всего прибегают к установке специальных трубочек, выравнивающих давление, чаще всего называемых «шунтами». Эта процедура выполняется оториноларингологом в операционной под наркозом с использованием микроскопа. Одновременно может быть произведено любое другое необходимое хирургическое вмешательство.
Формирование речи
Снижение слуха может быть одной из причин нарушения речи у детей с расщелиной неба или другой краниофациальной аномалией. Такому ребенку необходимо наблюдение у специалиста, занимающегося патологией речи (логопед), который оценит ситуацию и определит необходимость лечения. Логопед должен работать в тесном контакте с аудиологом и оториноларинглогом, которые выявили нарушение слуха.
Логопед также поможет получить ответы на интересующие вас вопросы:
— имеется ли у ребенка задержка речевого развития,
— какие конкретные проблемы есть у ребенка,
— связана ли эта задержка с нарушением слуха,
— каков оптимальный план лечения.
Исследование речевого развития включает также выявление словарного запаса ребенка, способности строить предложения, соответствия лексикона возрасту.
Основным механизмом формирования речи является имитация. Если дети слышат неправильно произнесенные слова, они повторяют их также не правильно.
Ребенок может не произносить начало или конец слова, которые плохо слышит. Снижение слуха не позволяет ребенку правильно слышать все сказанные слова, это может приводить к снижению интереса ребенка к общению. Родители могут ошибочно полагать, что ребенок отказывается их слушать. Такое непонимание может спровоцировать проблемы поведения. Часто у таких детей ошибочно выявляют нарушения внимания.
Лечение нарушений речи
Для вашего ребенка очень важно, чтобы вы стимулировали его речевую активность. Начинайте разговаривать с вашим ребенком сразу после его рождения. Говорите четко с достаточной громкостью. При наличии проблем со слухом, делайте акценты и жестикулируйте, чтобы ребенок начинал правильно понимать ваши слова.
Ранняя речевая терапия может предотвратить развитие патологических речевых привычек, которые трудно устранить. Вы можете поговорить со специалистами из школы или вашим педиатром по поводу участия ребенка в программе раннего речевого лечения. Эти программы предназначены для детей дошкольного возраста, а речь вашего ребенка можно оценить начиная с годовалого возраста. Логопед из команды специалистов, занимающихся лечением расщелины неба, должен посмотреть вашего ребенка в возрасте 18 месяцев.
Важно, чтобы вашего ребенка осмотрели все необходимые медицинские специалисты (хирург, стоматолог, логопед, аудиолог) для установления полного диагноза и составления оптимального плана лечения.
Литература:
1. Cleft palate and hearing loss — cleft palate foundation.
2. S. Mathes. Plastic surgery. Vol. 4 — Pediatric plastic surgery. — Saunders.
Нарушения слуха и вестибулярный аппарат при врожденной расщелине неба. Ложные расщелины
Российский государственный медицинский университет;
НИИ цереброваскулярной патологии и инсульта, Москва
ФГБУ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России, Москва, Россия
Научно-исследовательский институт цереброваскулярной патологии и инсульта Российского государственного медицинского университета, Москва
ГОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва, Россия;
ФГБНУ «Российский онкологический научный центр им. Н.Н. Блохина», Научно-исследовательский институт клинической и экспериментальной радиологии, Москва, Россия
Неврологические нарушения у детей с расщелиной губы и неба
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2016;116(4‑2): 76‑82
Цель исследования. Выявление и описание неврологических проявлений генетических синдромов, в структуру которых входят врожденные расщелины губы и неба (РГН). Материал и методы. Обследовали 21 пациента с РГН, средний возраст 12,0±4,7 года (основная группа) в сравнении со здоровыми (контрольная группа). Результаты и заключение. У пациентов основной группы достоверно чаще (p
Пороки развития лица являются одними из наиболее распространенных среди всех форм врожденной патологии. Среди пороков развития лица расщелина губы и неба (РГН), безусловно, занимает первое место по частоте — до 86,9%. РГН в мире составляет в среднем 1:800—1:600 новорожденных. В России этот показатель выше и составляет в среднем 1:500 новорожденных, достигая в группах риска показателя 1:150. Ежегодно в России рождается около 5000—6000 детей с данной патологией, при этом за последние 15 лет отмечается рост частоты рождаемости детей с РГН [1—3].
РГН имеют многофакторную этиологию и сложный, связанный с взаимодействием различных генетически и негенетических (средовые) факторов патогенез.
Около 30% РГН являются синдромными, т. е. входят в состав врожденных генетически обусловленных синдромов, которых насчитывается более 300. При этом различие между синдромными и несиндромными РГН нечеткое: в семьях с синдромными РГН у некоторых членов семьи выявляются только орофациальные расщелины из-за переменной клинической экспрессии генетически обусловленного синдрома; в то же время более чем у 20% пациентов с несиндромными РГН при тщательном обследовании можно выявить другие врожденные аномалии [1, 3—10].
Наличие у новорожденного с РГН морфологических дефектов губы, альвеолярного отростка и неба приводит к нарушению таких жизненно важных функций, как дыхание, сосание и глотание, что осложняет естественное вскармливание. Устранение этих нарушений и дальнейшая медицинская и социальная реабилитация пациентов с РГН требуют комплексного подхода с привлечением специалистов разного профиля: челюстно-лицевых хирургов, ортодонтов, стоматологов-терапевтов, ортопедов, логопедов и психологов. Пациенты с РГН обречены на 4—5 реконструктивных операций по устранению врожденных дефектов лица, первая из которых — хейлопластика — выполняется уже в первые дни жизни ребенка. Такие больные нуждаются в постоянном ортодонтическом лечении до 18—20-летнего возраста и в последующем сложном протезировании. Анатомические и функциональные дефекты создают постоянные трудности в речевой и психологической реабилитации пациентов с РГН и, следовательно, в их социальной адаптации [1, 3, 6, 8, 10—14].
У больных с РГН обнаруживается замещение значительной части мышцы языка соединительной тканью, его «распластанное» положение на дне ротовой полости (в отличие от нормального — параллельного небу), ограничение подвижности языка, особенно подъема его к верхним зубам. В ряде случаев подобные особенности строения мышцы языка и его расположения в ротовой полости можно выявить уже у плода с расщелиной неба (РН) [15—18].
Врожденные пороки лицевого скелета нередко сочетаются с множественными нарушениями развития других органов и систем организма, в том числе — с пороками развития ЦНС: врожденными аномалиями головного мозга, черепных нервов, органов чувств. Неврологические проявления сложных генетических синдромов, в структуру которых входят РГН/РН, подробно описаны. Однако исчерпывающих описаний неврологического статуса пациентов с несиндромными РГН/РН в доступной литературе обнаружить не удалось.
В подавляющем большинстве случаев дети с несиндромными РГН признаются педиатрами и детскими неврологами при диспансерных осмотрах практически здоровыми. Однако при этом не учитывается, что такие характерные для пациентов с РГН/РН сопутствующие заболевания, как рецидивирующие отиты, могут быть связаны с нарушениями глотания. Логопедические нарушения по типу дизартрии и так называемой общей задержки речевого развития принято связывать исключительно с наличием собственно расщелины и сопутствующей ортодонтической патологией. Специфическое положение языка в ротовой полости трактуется как адаптационная реакция, направленная на разобщение полости носа и полости рта. Психовегетативные нарушения принято расценивать как реакцию пациента на связанную с внешним дефектом социальную изоляцию [11, 13, 14, 19—22].
У пациентов с РГН может быть выявлена микроочаговая неврологическая симптоматика: признаки вегетативной неустойчивости, пирамидная недостаточность, оральная и артикуляторная апраксия, нарушение мелкой моторики, общая моторная неловкость, нарушение мимики, гиперактивность, тики, признаки «минимальной мозговой дисфункции». Однако грубая неврологическая симптоматика описывается редко [11, 12, 19].
Все эти особенности, хотя и не достигают уровня определенной неврологической нозологии, но, несомненно, формируют специфический «неврологический портрет» пациента с РГН.
Цель настоящей работы — выявление и описание неврологических нарушений у пациентов с РГН.
Материал и методы
Обследование больных проводилось совместно неврологом и врачом-ортодонтом. Исследование проводилось в 2 этапа: задачей первого этапа стало описание специфических неврологических нарушений у пациентов с РГН; задачей второго этапа стал сравнительный анализ частоты выявленных неврологических нарушений у больных с РГН и в группе контроля.
Основную группу составил 21 пациент с РГН (13 лиц женского и 8 лиц мужского пола, в возрасте от 6 до 24 лет; средний возраст 12,0±4,7 года). В контрольную группу вошли 11 молодых людей, 9 лиц женского и 2 — мужского пола, не имеющих РГН.
По результатам обследования неврологические симптомы были отражены в специально разработанной анкете.
При обследовании больных применялась также магнитно-резонансная томография (МРТ) головного мозга. Она осуществлялась на МРТ-системах Signa HD («General Electric», США) и Magnetom Espree («Siemens», ФРГ) с получением Т1- и Т2-взвешенных изображений (Т1ВИ и Т2ВИ соответственно) в ортогональных проекциях с использованием стандартных импульсных последовательностей быстрого спинового эхо (Turbo или Fast Spin Echo — TSE или FSE соответственно) и Т2ВИ на базе импульсной последовательности быстрой инверсии-восстановления с подавлением сигнала от свободной жидкости (Fluid Attenuated inversion Recovery — FLAIR).
Статистический анализ данных проводился по общепринятым правилам, для оценки межгрупповых различий использовался точный критерий Фишера. За достоверные принимались различия при p
Результаты
У пациентов с РГН наиболее часто выявлялись элементы бульбарного, несколько реже — псевдобульбарного синдрома, нередки были признаки стволовой дисфункции, часто выявлялись признаки дизрафического статуса, в том числе вертебральные аномалии (табл. 1).
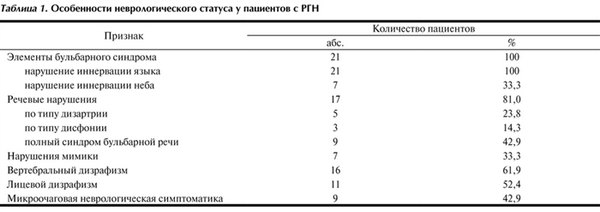
Таблица 1. Особенности неврологического статуса у пациентов с РГН
Элементы бульбарного синдрома в различной степени выраженности были обнаружены у 100% пациентов с РГН и имели свои особенности. Прежде всего обращали на себя внимание нарушения иннервации языка (рис. 1): девиация языка выявлена у 13 (61,9%) пациентов; гипотрофия языка — у 18 (85,7%) пациентов (центральная — у 13 (61,9%) больных, краевая — у 2 (14,3%), общая — у 3 (9,5%) пациентов); фасцикуляции и двигательное беспокойство языка — у 5 (23,8%) и 4 (19,0%) обследованных с РГН соответственно.
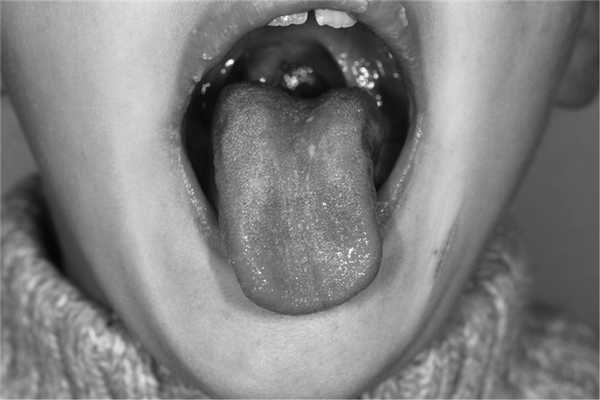
Рис. 1. Язык ребенка с РГН.
Провисание мягкого неба и девиация язычка мягкого неба (uvula) отмечены у 7 (33,3%) больных основной группы. При этом глотание и глоточный рефлекс были сохранны практически у всех пациентов. Только в 1 (4,8%) случае имели место негрубые нарушения глотания.
У 17 (81,0%) пациентов основной группы отмечались речевые нарушения: изолированная дизартрия — 5 (23,8%), изолированная дис- и назофония — 3 (14,3%). Грубые речевые нарушения в виде полного синдрома бульбарной речи — выраженной дизартрии в сочетании с нарушениями звучности голоса (назо- и дисфония), а также с особенностями речевого потока (замедленная, реже — 3 (14,3%) случая — скандированная речь) были выявлены у 9 (42,9%) больных. Тяжелые речевые нарушения чаще отмечали у пациентов более молодого возраста — их средний возраст составил 9,9±2,0 года.
Несколько реже у пациентов с РГН выявлялась неврологическая симптоматика со стороны других черепных нервов (III, IV, V, VI, VII пар): мимической иннервации — периоральные фасцикуляции — 6 (28,6%), гипомимия — 5 (23,8%), «форсаж» мимики — 3 (14,3%), асимметрия лица — 2 (9,5%); слабость жевательной мускулатуры и/или девиация нижней челюсти выявлены у 2 (9,5%); признаки нарушения функции глазодвигательных нервов — косоглазие и нистагм — у 3 (14,3%) и 4 (19,0%) соответственно. У нескольких пациентов выявлены нарушения со стороны органов чувств: врожденная тугоухость — 2 (9,5%), врожденная прогрессирующая миопия — 1 (4,8%).
Нарушения мимической иннервации оказались на 2-м месте по частоте встречаемости у пациентов с РГН после элементов бульбарного синдрома: в целом по группе специфические особенности мимики в виде гипомимии, реже своеобразной «форсированной» подчеркнутой мимики выявлены у 7 (33,3%) пациентов с РГН.
Также очень часто у пациентов с РГН выявлялось нарушение статики (рис. 2), преимущественно со стороны шейно-грудного отдела позвоночника — 16 (61,9%) обследованных основной группы. У больных основной группы выявлялись различная высота плеч — 13 (50,0%) пациентов, асимметрия грудной клетки с односторонней гипотрофией мышц — 3 (14,3%), кифосколиоз — 12 (57,1%) пациентов, ограничение подвижности позвоночника — 3 (14,3%) пациента.
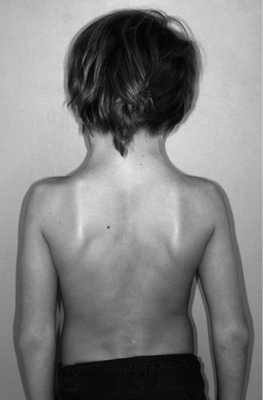
Рис. 2. Нарушение статики (вариант развития шейно-грудного отдела позвоночника) у ребенка с РГН.
Частыми были проявления лицевого дизрафизма: разностояние глаз — 11 (52,4%) пациентов, гипо- и гипертелоризм — 7 (33,3%) пациентов, асимметрия лица с недоразвитием одной его половины — 7 (33,3%) пациентов, разная высота расположения ушных раковин — 3 (14,3%) пациента.
Таким образом, можно составить своеобразный «неврологический портрет» пациента с РГН: специфические элементы бульбарного синдрома (преимущественно затрагивающие мышцу языка), особенности мимики, лицевой и спинальный (преимущественно со стороны шейно-грудного отдела) дизрафизм. С увеличением возраста обследуемых уменьшалась выраженность дизартрии и стволовой дисфункции (со стороны III—VII пар черепных нервов), но негрубые речевые нарушения (дисфония и/или назофония) сохранялись даже у взрослых пациентов. У пациентов более старшего возраста на первый план выступали вертебральные проблемы (боль в спине, рецидивирующие корешковые синдромы, ранние дегенеративные изменения позвоночника) и признаки вегетативной дисфункции. По этому поводу у невролога наблюдались 6 из 10 (60%) пациентов с РГН старше 12 лет.
Помимо особенностей черепной иннервации у 9 (42,9%) пациентов с РГН была обнаружена микроочаговая неврологическая симптоматика. Она была преимущественно представлена элементами мозжечкового синдрома (нистагм, мышечная гипотония, минимальные координаторные нарушения) — 4 (19,0%) пациента, вегетативно-сосудистыми нарушениями у более старших пациентов — 5 (23,8%) у пациентов в возрасте 15—17 лет. У 2 (9,5%) выявлены элементы акинетико-ригидного синдрома.
Важно отметить, что когнитивная недостаточность не была характерна для пациентов основной группы: признаки легкого когнитивного расстройства (не ограничивающего социальную адаптацию) были выявлены лишь у 2 (9,5%) обследованных пациентов с расщелинами.
У нескольких пациентов с РГН по данным осмотра были выявлены признаки неврологического заболевания, что потребовало более углубленного дообследования (МРТ головного мозга и позвоночника, ультразвукового исследования брахиоцефальных артерий, консультации педиатра и генетика). По данным такого дообследования, проведенного 5 (23,8%) пациентам основной группы, были выявлены аномалии развития ствола головного мозга и задней черепной ямки, краниовертебрального перехода и нервной трубки, у 2 пациенток установлены генетически-детерминированные заболевания: неполная аномалия Денди—Уокера (недоразвитие мозжечка, расширение большой и нижней мозжечковых цистерн без признаков гидроцефалии) в структуре синдрома Стиклера — 1 пациентка; аплазия мозололистого тела (рис. 3) и аномалия ствола головного мозга в структуре синдрома Мебиуса — 1 пациентка; аномалия Киари I типа в сочетании с особенностями сосудов вертебрально-базилярной системы (кинкинг-синдром основной артерии) — 1 пациент; аномалия Киари II типа в сочетании с расщеплением тел позвонков (spina bifida) — 1 пациент; у 1 пациента выявлены признаки парагипокампального склероза с эпилептическим синдромом (табл. 2).
Таблица 2. Аномалии развития и заболевания нервной системы у пациентов с РГН
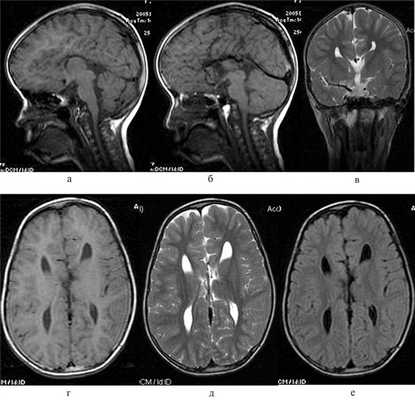
Рис. 3. МРТ-картина аплазии мозолистого тела у девочки Р., 12 лет, с РН. На сагиттальных FSE Т1ВИ (а, б) мозолистое тело не дифференцируется, обращает внимание расширенное отверстие Можанди (а) при относительно сохранном объеме мозжечка; миндалины его незначительно опущены (б) — до входа в большое затылочное отверстие. При этом отмечается незначительное расширение межполушарной щели и типичная «бабочка» боковых желудочков на FSE Т2ВИ в коронарной проекции (в). На аксиальных FSE Т1ВИ (г) и ТЕ2ВИ (д), FLAIR Т2ВИ (е) вместо мозолистого тела видна несколько расширенная межполушарная щель с характерным для аплазии мозолистого тела изменением конфигурации желудочков.
Признаки спинального дизрафизма (разная высота плеч, кифосколиоз) выявлены у 6 (54,5%) обследованных контрольной группы, лицевого (разная высота глазных щелей, асимметрия лица) — у 4 (36,3%), реже, чем в основной группе, но без статистически значимых различий с ней. Важно отметить, что на основании клинического осмотра фиксировались лишь так называемые малые аномалии развития, часто выявляемые у практически здоровых людей. При этом относительно грубых нарушений статики шейно-грудного отдела, выявляемых у пациентов с РГН (недоразвитие одной половины грудной клетки, кифосколиоз высоких градаций, фиксированная кривошея), в контрольной группе не обнаружено.
Таким образом, проведенное исследование показало, что правомерно говорить о специфических особенностях неврологического статуса пациентов с РГН. У таких больных достоверно чаще встречаются нарушения иннервации языка, мягкого неба и мимической мускулатуры. Элементы бульбарного синдрома в той или иной степени выраженности вообще настолько характерны для пациентов с расщелинами неба, что обнаруживаются у них в 100% случаев. Прежде всего это проявляется нарушениями функции и строения языка: гипотрофией и фасцикуляциями в языке, девиацией и нарушениями его подвижности. Также для пациентов с РГН характерны нарушение подвижности мягкого неба и иннервации мимической мускулатуры.
Выявленные неврологические особенности объясняют тот факт, что несмотря на проведенное хирургическое, ортодонтическое и логопедическое лечение, у пациентов с РГН сохраняются речевые дефекты разной степени выраженности. Сочетанное нарушение подвижности лица, неба и глотки, языка, обусловленное именно особенностями иннервации, а не только анатомическими дефектами, способствует персистированию дизартрии. Следует отметить, что нарушений глотания при этом практически не выявляется, по-видимому, эта жизненно важная функция обладает более широкими возможностями спонтанной или терапевтической компенсации, так и при бульбарных расстройствах другого генеза, например при прогрессирующем бульбарном параличе (вариант болезни двигательного нейрона), нарушения глотания развиваются позднее, чем дизартрия и при более глубоком поражении.
При этом прочие проявления дизрафизма — со стороны лица, позвоночного столба, другие неврологические стигмы — у пациентов с РГН встречались хоть и чаще, чем в группе контроля, но данные различия соответствовали лишь уровню тенденции. Следует отметить, что в данном случае речь идет о так называемых «малых пороках развития», регистрирующихся у большинства здоровых людей (с частотой от 0 до 4 признаков у одного человека) и не оказывающих какого-либо влияния на общее здоровье [1, 4].
В заключение следует отметить, что проведенное пилотное исследование позволило выявить у пациентов с РГН особенности неврологического статуса, свидетельствующие о поражении ствола головного мозга, мимической иннервации, черепных нервов бульбарной группы, дефектах развития нервной трубки. У пациентов с РГН часто (в 23,8% случаев) выявлялись неврологические заболевания, преимущественно в виде аномалий развития ствола головного мозга, задней черепной ямки и краниовертебрального перехода. Выявленные особенности, несомненно, влияют на реабилитацию пациентов с РГН и, вероятно, могут оказывать влияние на здоровье таких больных и во взрослом возрасте, переходя в симптомную стадию [8, 23, 24]. Большинство обследованных нами пациентов были детьми или подростками, лишь несколько больных были в периоде ранней юности. В доступной литературе не удалось найти сведений о частоте и динамике краниовертебральных аномалий у подобных больных. Поэтому для уточнения вопросов о неврологической патологии у пациентов с РН, ее влиянии на реабилитацию и дальнейшую жизнь больных, возможностях коррекции необходимы дальнейшие, более масштабные исследования — с привлечением большего числа участников, применением углубленного дообследования (визуализационные методики, генетические исследования, изучение катамнеза).
Врожденная расщелина неба при синдроме делеции 22q11.2 (22q11DS) — одно из многообразных клинических проявлений данного заболевания, характеризующегося делецией (потерей участка хромосомы) в области q11.2 длинного плеча хромосомы 22. Данная хромосомная аномалия приводит к грубым нарушениям эмбриогенеза третьей и четвертой глоточной дуг, и соответственно, к характерным патологическим проявлениям: аномалиям развития сердца и выводящего тракта (тетрада Фалло, дефект межжелудочковой перегородки, прерванная дуга аорты), вилочковой железы (Т-клеточный иммунодефицит), паращитовидных желез (гипокальциемия) [1—5].
Наличие данного синдрома у детей с врожденной расщелиной неба предполагает составление индивидуального плана лечения ребенка соответственно алгоритму ведения пациентов с синдромом делеции 22q11.2. Сопутствующие патологические нарушения могут оказывать отягощающее влияние на течение послеоперационного процесса, усугубляя общее состояние ребенка. При ведении ребенка с врожденной расщелиной неба при делеции 22 хромосомы нужно учитывать частую задержку психоречевого развития, а иногда и психические отклонения ребенка [6, 7].
Важно при первичной диагностике врожденной расщелины неба при наличии других врожденных аномалий, в первую очередь пороков сердца и/или паращитовидных желез, исключить наличие у ребенка делеции 22 хромосомы, проведя генетическое консультирование и исследование. Подготовка ребенка к операции и его лечение проводится под командой специалистов, в соответствии со сложными патофизиологическими процессами данного заболевания [8, 9].
Синдром делеции 22 хромосомы
Синдром делеции 22 хромосомы — это хромосомная аномалия, при которой на длинном плече хромосомы 22, в районе q11.2, происходит потеря геномного материала до 35 генов, кодирующих развитие сердца и выводящего тракта, вилочковой железы, паращитовидных желез и неба. Нарушение экспрессии генов данного локуса, в частности гена ТВХ1, приводит к множественным клиническим проявлениям: врожденным порокам сердца, аномалиям развития крупных сосудов, врожденным порокам челюстно-лицевой области, эндокринным и иммунным нарушениям. Синдром делеции 22q11.2 — del 22q11.2 (22q11DS) может проявляться более чем 180 различными физическими, функциональными и психическими ассоциациями в разной степени выраженности.
Частота встречаемости указанного синдрома составляет от 1:3000 до 1:6000 [1—3].
Для данного синдрома характерны краниофациальные нарушения, проявляющиеся в первую очередь врожденной расщелиной неба, которая выявляется в 14% случаев у пациентов с 22q11DS, причем у 5% из них диагностируется скрытая расщелина неба. Некоторые пациенты, помимо врожденной расщелины неба, имеют расщелину губы [8, 10]. Для данного синдрома также характерны особенности фенотипа: монголоидный разрез глаз с узкими глазными щелями и широкой выступающей переносицей, широко расставленные глаза, оттопыренные, низко посаженные, с плохо сформированным завитком ушные раковины. У ребенка могут быть узкие носовые ходы с широким кончиком носа, удлиненная средняя и нижняя часть лица, микрогения. У детей с 22q11DS в 15% происходит сенсоневральная потеря слуха, а у 75% выявляется экссудативный средний отит [11, 12]
Клинический пример
В данной статье приводим клинический пример врожденной расщелины у ребенка с синдромом делеции 22 хромосомы.
Ребенок А. обратился в Научный центр здоровья детей в возрасте 4 мес. Ребенок от 1-й беременности, протекающей с гестозом, гипоксией, 1-х родов в срок. Вес при рождении 2520 г. Рост при рождении 46 см. Оценка по шкале APGAR 8/8 баллов. Состояние после рождения средней тяжести. Диагноз при рождении: гипотрофия 2-й степени. Церебральная ишемия. Синдром мышечной дистонии. Врожденная срединная расщелина неба. При УЗИ вилочковой железы выявлена гипоплазия (со сниженным уровнем Т-лимфоцитов), тазобедренных суставов в возрасте 3 месяцев — задержка оссификации, при ЭхоКГ — открытое овальное окно до 2,2 мм, УЗИ брюшной полости — незначительное увеличение размеров селезенки. У ребенка диагностирована ангиопатия сетчатки, недостаточность слезных протоков левого глаза (с последующим их зондированием), рахит I ст. с подострым течением. Со стороны челюстно-лицевой области обращали на себя внимание диспластичные асимметричные низкорасположенные ушные раковины, левосторонний эпикант. Также по́зднее прорезывание зубов. Со стороны костно-мышечной системы вальгусная установка стоп, наложение пальцев стоп. Ребенок развивался с темповой задержкой моторного и речевого развития. Со стороны психологической сферы ребенка: окружающим интересуется, эмоции несколько обеднены, внимание неустойчивое, отсутствие коммуникативных навыков.
В связи с наличием у ребенка множественных патологических проявлений был проведен микроматричный хромосомный анализ: выявлена микроделеция длинного плеча 22 хромосомы, захватывающая регион 22q11.21. Молекулярный кариотип: 46, ХХ. arr22q11.21 (18916842−21465659) х1. Размер: 2 548 817 пн.
Ребенок проходил курс реабилитации с целью нормализации мышечного тонуса, ускорения двигательного и психоречевого развития. Вакцинация ребенку до 1 года не проводилась, в последующем ребенок вакцинировался по национальному календарю с индивидуальным графиком. После вакцинации выявлено уменьшение количества Т-лимфоцитов, митохондриальная недостаточность всех популяций.
Оперативное лечение врожденной расщелины неба у ребенка проводилось в соответствии с алгоритмом наблюдения и лечения детей с делецией 22 хромосомы. В предоперационном периоде ребенку было проведено комплексное обследование с участием узкопрофильных специалистов, с обязательным скринингом уровня Са в крови и иммунного статуса. В возрасте 1 года ребенку была проведена уранопластика. Наблюдение ребенка в послеоперационном периоде осуществлялось мультидисциплинарно с мониторированием показателей Са, иммуноглобулинов, Т-лимфоцитов. В раннем послеоперационном периоде у ребенка присоединилась вирусная инфекция, на фоне которой произошло расхождение швов в области мягкого неба.
В возрасте 1 год 9 мес у ребенка диагностирован экссудативный среднией отит, в 2 года 6 мес — гиперметропия слабой степени, расходящееся косоглазие, 2 года 9 мес — вертикальная резцовая дизокклюзия. Инфантильный тип глотания.
В возрасте 2 лет ребенку была произведена реоперация с благополучным заживлением.
Заключение
Лечение ребенка с врожденной расщелиной неба при диагностированном синдроме делеции 22 хромосомы должно проводиться с применением мультидисциплинарного подхода с постоянным мониторированием важных показателей систем и органов, патологические нарушения которых характерны для данного синдрома. С другой стороны, при верификации врожденной расщелины неба, особенно при наличии врожденного порока сердца и гипокальциемии, необходимо исключить синдром 22q11.2. Так как взаимоотягощающее влияние патологии систем и органов осложняет течение послеоперационного периода, соматическое состояние ребенка [8, 13]. Гипокальциемия вызывает недоразвитие костного скелета ребенка, в том числе и зубочелюстной области, особенно верхней челюсти после уранопластики [1—3].
Ведение и наблюдение ребенка с врожденной расщелиной неба должно проводится согласно алгоритму лечения детей с синдромом делеции 22 хромосомы.
Так, согласно этому алгоритму ребенку должен проводиться скрининг уровня кальция крови, УЗИ щитовидной и паращитовидной желез, уровень иммуноглобулинов и Т-лимфоцитов [1, 3, 5].
В предоперационной подготовке важно проведение консилиума в составе кардиолога, эндокринолога, иммунолога с целью определения противопоказаний со стороны соматического состояния ребенка к проведению уранопластики.
Так как у таких детей экссудативные средние отиты и сенсоневральная тугоухость часто сопутствуют врожденной расщелине неба, одноэтапно при проведении уранопластики выполняется, как правило, тимпаностомия барабанных полостей. Алгоритм лечения детей с врожденной расщелиной неба и делецией 22 хромосомы включает динамическое наблюдение ребенка у сурдолога [1, 11, 12].
После проведения уранопластики для восстановления функции речи проводится курс логопедического обучения. У детей с делецией 22 хромосомы логопедическое обучение может быть усложнено нарушениями в психоэмоциональной сфере ребенка. Дети плохо концентрируются, неусидчивы, эмоционально лабильны. В данном случае нужно учитывать, что сложности обучения ребенка связаны с особенностями данного синдрома и педагогическому окружению рекомендуется составление индивидуальный программы обучения с учетом эмоционального фона ребенка, образовательных способностей, с проведением неврологического и психического контроля, и при необходимости с медикаментозной поддержкой [1, 14].
Таким образом, врожденная расщелина неба при делеции 22 хромосомы является одной из составляющих сложного патологического состояния ребенка, и ее лечение должно проводиться с учетом всех особенностей проявления данного синдрома с целью предупреждения тяжелых взаимоотягощающих симптомов, характерных для данного заболевания.
Конфликт интересов:
Л.С. Намазова-Баранова — получение исследовательских грантов от фармацевтических компаний «Пьер Фабр», «Genzyme Europe B.V.», ООО «Астра Зенека Фармасьютикалз», Gilead/PRA «Фармасьютикал Рисерч Ассошиэйтс СиАйЭс», «Teva Branded Pharmaceutical Products R&D, Inc», ООО «ППД Девелопмент» (Смоленск), «Сталлержен С.А.»/»Квинтайлс ГезмбХ» (Австрия)
И.В. Давыдова сотрудничает с компанией «Abbvie».
Остальные авторы подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
Волчья пасть
Общие сведения
Волчья пасть (палатосхизис) - врожденный порок развития челюстно-лицевой области, представляющий собой расщепление мягкого и твердого нёба, приводящее к нарушению процессов дыхания, питания, звукообразования. Дефект формируется в результате задержки срастания отростков верхней челюсти с непарной костью лицевого отдела черепа - сошником. С волчьей пастью в мире рождается 0,1% новорожденных.
При волчьей пасти расщепление нёба может быть: полным - с расщелиной в твердом и мягком нёбе и неполным - с отверстием в нёбе. Наличие волчьей пасти часто сочетается с раздвоением язычка - отростка задней части мягкого нёба в результате нарушения соединения медиального, латерального небных отростков и носовой перегородки. Волчья пасть является одним из самых частых врожденных дефектов.
Формирование расщепления нёба обусловлено генетически: при работе с данными расшифровки генома человека британские ученые в 1991 году обнаружили ген, ответственный за развитие волчьей пасти - это измененный ген TBX22, расположенный в Х-хромосоме. Факторами, приводящими к изменениям на генном уровне и способствующими формированию нёбного дефекта, служат тератогенные воздействия на плод. На сегодняшний день четко прослежена зависимость между формированием заячьей губы и волчьей пасти у ребенка и пристрастием будущей матери к алкоголю, табакокурению и наркотикам.
Риск формирования неполноценной верхней челюсти увеличивается при ожирении матери и недостатке фолиевой кислоты в ее рационе. Также способствуют развитию волчьей пасти экологические проблемы местности проживания беременной, перенесенные ею токсикоз и острые инфекции, психические или механические травмы. В первые три месяца развития плод наиболее уязвим и восприимчив к воздействию различного рода повреждающих факторов, именно в этот период происходит формирование челюстно-лицевых органов.
Особенности строения и развития неба
Верхнее нёбо - это анатомический барьер, разделяющий ротовую и носовую полость. Эволюционно нёбо развивалось у организмов, приспосабливающихся к жизни на суше. Оно образуется двумя частями: твердым и мягким нёбом. Твердое нёбо находится в передней части полости рта и образуется костной основой из небных отростков верхней челюсти и горизонтальных пластинок небных костей.
Генетический сбой в период закладки челюстно-лицевой системы приводит к развитию дефектов - незаращению верхней губы и неба. Распознать наличие волчьей пасти у плода возможно по УЗИ лишь на поздних сроках беременности. Дети с заячьей губой и волчьей пастью болезненны, т. к. вдыхаемый ими воздух не согревается и не увлажняется, что приводит к развитию воспалительных процессов дыхательных путей и внутреннего уха. У таких пациентов отмечаются изменения челюстно-лицевого скелета, зубочелюстного ряда, слухового аппарата. Незаращение нёба и верхней губы может встречаться изолированно или сочетаться вместе и с другой челюстной патологией.
Проявления волчьей пасти
Сложности у детей с расщеплением нёба начинаются с момента рождения, т. к. во время родов возможна аспирация околоплодной жидкости в дыхательные пути. Дыхание новорожденного с волчьей пастью затруднено, сосание невозможно, из-за чего наблюдается отставание ребенка в весе и развитии. Кормление малыша до операции осуществляют с помощью специальных ложечек, одевающихся на бутылочки.
Наличие расщелины нёба нарушает нормальное функционирование верхних дыхательных и пищеварительных путей, развитие речи и слуха, а также может вызывать снижение самооценки личности ребенка. У детей, имеющих волчью пасть, изменена речь в связи с нарушением процесса правильного формирования звуков. Речевые расстройства выражаются в открытой ринолалии, обусловливающей ФФН или ОНР.
Дефект нёба приводит к свободному выхождению через нос вдыхаемого воздуха, а также попаданию в нос пищи и жидкости. Жидкость через расщелину в нёбе может попасть в евстахиевы трубы и пазухи носа, что способствует развитию у таких пациентов отита и синуситов. При волчьей пасти отмечается наличие деформации прикуса и зубов, нарушающих процесс жевания пищи.
Лечение волчьей пасти
Принципы лечения пациентов с волчьей пастью
Операции по устранению врожденных челюстно-лицевых пороков обычно проводятся поэтапно. Количество вмешательств может варьировать от 2-3 до 5-7 и даже более. Возраст проведения коррекции волчьей пасти определяется специалистами, наблюдающими ребенка с рождения, по индивидуальным показаниям, но не ранее 3-6 месяцев (обычно в более поздние сроки). Окончание лечения, включая восстановительный период, должно быть завершено к возрасту 6-7 лет.
Возраст от 3 до 7 лет благоприятен для проведения дополнительных косметических операций по улучшению внешности ребенка с тем, чтобы после полной реабилитации он мог посещать общеобразовательное учебное заведение, поскольку психическое и умственное развитие детей с волчьей пастью не отличается от таковых у здоровых детей. После исправления дефекта нёба и прохождения полного курса реабилитации дети снимаются с учета по инвалидности.
Лечением челюстно-лицевых дефектов занимаются профилированные клиники, в которых есть все необходимые специалисты: педиатр и микропедиатр, хирург, ортодонт, педагог логопед, психолог и социальный работник. Современная пластическая медицина призвана не только помочь ребенку избавиться от внешнего дефекта, но и преодолеть последствия психической травмы от ощущения своей неполноценности для дальнейшей полноценной адаптации в обществе.
Коррекция волчьей пасти методом уранопластики
Задачу восстановления правильной анатомической структуры мягкого и твердого неба, а также средних отделов глотки решает проведение уранопластики. Классическим вариантом уранопластики при волчьей пасти, решающим данные задачи, служит операция по методу Лимберга. Уранопластика по Лимбергу на сегодняшний день является основной методикой лечения врожденного дефекта нёба. При сочетании расщелины нёба с заячьей губой также проводится хейлопластика - операция по коррекции верхней губы.
Перед проведением уранопластики осуществляется индивидуальное планирование операции, подбирается пластический материал для ликвидации дефекта расщепления нёба. Современные методы уранопластики и квалификация пластических хирургов обеспечивают восстановление полноценной анатомической структуры нёба у 92-98% пациентов.
Радикальное исправление дефектов мягкого и твердого нёба подразумевает решение сложного комплекса задач: восстановление анатомически правильной непрерывности каждого слоя мягкого и твердого нёба и их размеров; устранение порочного прикрепления небно-глоточных мышц, анатомически правильное их соединение; исключение повреждения нервов, обеспечивающих сокращение этих мышц при операции; выполнение стабильного закрепления восстановленных анатомических структур, формы и функции неба.
Радикальную уранопластику предпочтительнее выполнять детям в возрасте 3-6 лет. В 3-5-летнем возрасте оперируют пациентов, имеющих несквозные расщелины нёба; с 5 до 6 лет - со сквозными одно- и двусторонними расщелинами. Осуществление радикальной уранопластики не рекомендуется у детей раннего возраста, т. к. это может вызвать задержку развития верхней челюсти. Выполнение щадящих способов уранопластики возможно до достижения ребенком возраста 2-х лет.
В дооперационном периоде детям рекомендуется ношение «плавающего» обтуратора, способствующего нормальному вскармливанию, дыханию, становлению правильной речи. Обтуратор снимают за 2 недели до проведения уранопластики.
Послеоперационный уход включает соблюдение постельного режима в течение 2-3 дней, прием только протертой пищи, обильное щелочное питье. Тщательное внимание уделяется уходу за ротовой полостью: до и после приема пищи проводятся орошения рта слабым раствором перманганата калия. Несколько раз в день рекомендуется надувать воздушные шарики. С 14-х суток необходимо проведение специального комплекса упражнений и пальцевого массажа мягкого нёба.
С целью предотвращения послеоперационной инфекции назначаются антибиотики на 5-7 дней, для купирования болевого синдрома - обезболивающие средства. На лице после уранопластики остается послеоперационный рубец. Выписку из стационара осуществляют на 21-28 день после операции.
В дальнейшем пациентам предстоит длительная и кропотливая работа по восстановлению полноценного небно-глоточного смыкания и подвижности нёба с помощью физиотерапевтических методик лечения.
Читайте также:
- Тетрациклины для лечения заболеваний уха, горла, носа
- Мужская свобода. Ограничения и поощрения мужчин
- Укладка при рентгенограмме лицевого отдела черепа, придаточных пазух в теменно-акантиальной и акантио-теменной проекции по методу Уотерса
- Диагностика гипомиелинизации головного мозга по КТ, МРТ
- КТ, МРТ при ecchordosis physaliphora
