Нейродегенеративные заболевания у детей: мукополисахаридозы
Добавил пользователь Alex Обновлено: 22.01.2026
Мукополисахаридозы (МПС) - группа наследственных заболеваний соединительной ткани, протекающих с поражением нервной системы, глаз, внутренних органов и опорно-двигательного аппарата, возникающих вследствие накопления в организме гликозаминогликанов. В различных подразделениях ФГБУ «НЦЗД» РАМН под руководством академика РАН и РАМН, профессора А.А. Баранова наблюдаются и получают лечение дети с МПС различных типов.
В курации детей с МПС принимают участие врачи 16 специальностей. В статье обобщен зарубежный и отечественный опыт лечения этого тяжелого генетически обусловленного заболевания, в том числе собственный опыт авторов по применению ферментозаместительной терапии препаратом Элапраза в лечении МПС II типа (синдрома Хантера) у детей.
- КЛЮЧЕВЫЕ СЛОВА: психоневрологические заболевания у детей, детская неврология, неврологическая патология у детей, психоневрология, педиатрия, неврология, психиатрия
Мукополисахаридозы (МПС) относятся к группе лизосомных (лизосомальных) генетических болезней, которых в настоящее время насчитывается свыше 40 3. Это метаболические заболевания, причина возникновения которых заключается в отсутствии или нарушении функций лизосомных ферментов, необходимых для расщепления гликозаминогликанов (ГАГ), или мукополисахаридов. Как известно, ГАГ - это высокомолекулярные полимеры, состоящие преимущественно из гексозаминов и гексуроновых кислот. В организме они существуют в виде соединений и белковых комплексов [3]. Среди МПС наиболее часто встречается синдром Хантера (МПС II типа) [3, 4].
Патогенез МПС II типа
Как и при других типах МПС, при синдроме Хантера развитие болезни сопряжено с дисфункцией (недостаточностью) одного из лизосомных ферментов - идуронат-2-сульфатазы (ИДС), называемой также идуронатсульфатсульфатазой 1. Функцией этого фермента является обеспечение одного из этапов катаболизма ГАГ, поэтому при дефиците ИДС ГАГ накапливаются в различных органах и тканях [3]. Прогрессивное накопление ГАГ в лизосомах клеток сопровождается феноменом клеточного перенасыщения, деструкцией тканей и нарушением функций различных органов. Cреди ГАГ, аккумулируемых в организме при МПС II типа, следует указать в первую очередь гепарансульфат и дерматансульфат, избытком которых обусловлено поражение печени и кожных покровов. Гепарансульфат содержится в плазматических мембранах различных клеток и в межклеточном веществе, а дерматансульфат (хондроитинсульфат В) является изомером хондроитинсульфатов, в котором место остатков D-глюкуроновой кислоты занимают остатки L-идуроновой кислоты [4, 5]. Дерматансульфат широко распространен в тканях, особенно он характерен для кожи, кровеносных сосудов, сердечных клапанов.
Генетические аспекты МПС II типа
Распространенность МПС II типа составляет 1 случай на 100 тыс. населения. Синдром Хантера от других МПС отличает тип наследования болезни - Х-сцепленный рецессивный 3. В базе данных человеческих генов и генетических болезней Online Mendelian Inheritance in Man (OMIM) МПС II типа соответствует рубрике № 309900 (генный локус IDS Xq27.3-28) [5, 6]. Y.B. Sohn и соавт. (2012) идентифицировали 11 новых мутаций у пациентов с МПС II типа [7]. M. Beck и соавт. (2012) разработали генетическую карту для клинического использования при МПС II типа [8]. В настоящее время продолжаются активные исследования отдельных мутаций, ассоциированных с cиндромом Хантера, а также анализ гена ИДС у пациентов с МПС II типа [9, 10]. D.M. Burruss и соавт. (2011) описали фенотип тяжелого синдрома Хантера, вторичный по отношению к большой делеции в хромосоме Х, охватывающей гены ИДС, FMR1 и AFF2 (FMR2) [11].
Клинические проявления МПС II типа
Клинические проявления МПС различаются в зависимости от типа болезни [12]. МПС II типа условно принято подразделять на легкую и тяжелую формы [2, 3]. Синдром Хантера обычно манифестирует у детей в возрасте 3-8 лет, а его формы с более благоприятным течением - в 10-15-летнем возрасте [3]. Типичными неврологическими признаками всех МПС являются мышечная гипотония и общие двигательные нарушения. Если для МПС I типа (синдром Пфаундлера - Гурлер) характерны отставание в умственном развитии, микрогнатия, грубые черты лица (гаргоилизм), макроглоссия, дегенерация сетчатки, помутнение роговой оболочки, кардиомиопатия и гепатоспленомегалия, то МПС II типа преимущественно проявляется отставанием в умственном развитии. Остальные симптомы болезни, сходные с таковыми при МПС I типа, отличаются меньшей выраженностью 3. Тяжесть заболевания зависит от того, в каком возрасте появляются первые клинические симптомы, и степени прогрессирования болезни. Симптоматику МПС II типа определяет также депозиция и аккумуляция ГАГ в различных тканях организма [1-3, 6, 12-14].
Наиболее частыми признаками синдрома Хантера являются повышенная экскреция ГАГ с мочой, лицевой дисморфизм, органомегалия, тугоподвижность суставов и/или контрактура, легочная дисфункция (бронхообструкция, апноэ и т.д.), увеличение размеров миокарда (кардиомегалия) и дисфункция клапанов сердца, а также различные неврологические нарушения (снижение интеллекта, гиперактивность и др.) [14]. Последние имеют особое значение, поскольку, как указывают R. Martin и соавт. (2008), у детей с поражением ЦНС летальный исход обычно наступает во втором десятилетии, а при минимальных неврологических нарушениях или их отсутствии (при относительной или полной сохранности интеллекта) пациенты доживают до совершеннолетнего возраста [13]. Гаргоилизм при синдроме Хантера выражается в специфическом огрубении черт лица (короткий нос, уплощенное лицо, макроцефалия с выступающим лбом). Так, для детей с МПС II типа характерны круглые лица с полными розовыми щеками, широкий нос с плоской переносицей, короткая шея, утолщенные (полные) губы, макроглоссия [2]. У некоторых пациентов отмечаются локальные изменения кожных покровов, являющиеся патогномоничными для МПС II типа. Эти образования на коже обычно локализуются между лопаток, в области грудины, шеи, а также по задней подмышечной линии (симметрично) и напоминают морскую гальку цвета слоновой кости [3].
Основными клиническими симптомами при МПС II типа считаются обструктивный синдром верхних дыхательных путей, пороки сердца (приобретенные), снижение слуха (нейросенсорная тугоухость), тугоподвижность суставов и поражение нервной системы (центральной и/или периферической) [1-3, 5, 6, 12, 13]. Так называемые «ортопедические» симптомы МПС II типа (поражение скелетно-мышечной системы в виде ограничений движения в различных суставах, нарушений походки и др.) детально описаны в работах S.R. Morini и соавт. (2010), а также B. Link и соавт. (2010) [15, 16]. S. Al Sawaf и соавт. (2008) отмечают такие неврологические нарушения при синдроме Хантера, как гидроцефалия, сдавление спинного мозга и цервикальная миелопатия, оптический неврит, снижение слуха, кистевой туннельный синдром [17]. J.Y. Kwon и соавт. (2011) подтверждают высокую частоту кистевого туннельного синдрома у детей с МПС II типа [18]. В качестве основных ранних клинических маркеров поражения ЦНС при МПС II типа J. Holt и соавт. (2011) предлагают рассматривать следующие:
- нарушения сна;
- гиперактивность;
- нарушения поведения;
- пароксизмальноподобное поведение (англ. seizure-like behavior);
- персеверативное жевание;
- неспособность контроля над кишечником;
- неспособность к контролю функций мочевого пузыря [19].
Для характеристики психологического статуса пациентов с легкой формой МПС II типа I. Kuratsubo и соавт. (2009) использовали шкалу интеллекта Векслера, шкалу функциональной независимости, а также личностный тест Yatabe-Guilford и тест с рисованием дерева; для оценки психического здоровья - опросники GHQ-60 и STAI [20]. Интеллектуальный фон у таких детей (полнообъемный, вербальный и оперативный IQ) составлял 72,8, 76,1 и 79,3 соответственно. По данным теста Yatabe-Guilford, у 9 из 10 пациентов не было признаков невроза и тенденций к психозу; у 1 ребенка был отмечен психотический паттерн. При выполнении теста с рисованием дерева (англ. the tree-drawing test) многие дети рисовали дерево без земли, что указывало на сложности в установлении контактов с окружающими. Результаты тестов GHQ-60 и STAI выявили повышенные уровни тревожности у обследуемых пациентов. Наличие статистически достоверной негативной корреляции между оценкой GHQ-60 и функциональной независимостью (R = -0,77) указывало на возможность ухудшения показателей психологического статуса в дальнейшем [20].
Сравнительно широкий спектр патологии со стороны сердечно-сосудистой системы у детей с синдромом Хантера подробно описали C. Kampman и соавт. (2011) [21]. С.В. Михайлова и соавт. (2001) указывают, что, в отличие от МПС I типа, при синдроме Хантера не отмечается помутнения роговицы [3]. Пигментный ретинит при МПС II типа описали Y. Suzuki и соавт. (2009) [22]. G.S. Shah и соавт. (2010) охарактеризовали атипичные проявления синдрома Хантера [23]. Рецидивирующие «необъяснимые» эпизоды цианоза лица и одышки при МПС II типа описали G.D. Simonetti и соавт. (2009) [24]. A. Keilmann и соавт. (2012) указали на проблему снижения слуха при МПС II типа [25]. У многих больных с синдромом Хантера отмечается раннее формирование грыж (пупочных, паховых и/или пахово-мошоночных). Естественное прогрессирование неврологического дефицита у больных МПС II типа описали в своей работе J.B. Holt и соавт. (2011) [26]. В обзоре смертности и причин наступления летального исхода у пациентов с синдромом Хантера S.A. Jones и соавт. (2009) подчеркивают, что когнитивные нарушения указывают на более тяжелое течение МПС II типа и меньшую ожидаемую продолжительность жизни [27].
Диагностика МПС II типа
Установление диагноза болезни на основании имеющейся симптоматики возможно, но представляется затруднительным, поскольку клинический фенотип при синдроме Хантера характеризуется исключительной гетерогенностью [3]. Основой диагностики МПС II типа является лабораторное исследование спектра и количества экскретируемых пациентом ГАГ, определение активности специфического фермента ИДС, а также ДНК-диагностика 30. A.C. Sosa и соавт. (2011) разработали метод ELISA «сэндвичного» типа для количественного определения ИДС [31]. A.A. Tolun и соавт. (2012) описали новый флуорометрический метод ферментного анализа для выявления синдрома Хантера с использованием пятен высохшей крови [32]. При обследовании детей с синдромом Хантера применяются многие другие лабораторные и инструментальные методы исследований (биохимические, иммунологические, ультразвуковые, нейровизуализационные и т.д.). C.T. Finn и соавт. (2008), R.S. Iyer и P.C. Khanna (2010), J.E. Davison и соавт. (2010), Z. Fan и соавт. (2010), R. Manara и соавт. (2011), M.L. Calleja Gero и соавт. (2011) представили данные МРТ-исследования пациентов с МПС II типа 34. Среди них следует особо выделить количественный МР-спектроскопический мониторинг поражения ЦНС, а также автоматизированный корреляционно-волюметрический анализ данных МРТ головного мозга и исследования когнитивных нарушений у детей с синдромом Хантера [36, 37].
Г.М. Дворяковская и соавт. (2010) подчеркивают роль ультразвуковой диагностики в определении состояния внутренних органов у детей с МПС [39]. E.B. Fung и соавт. (2010) считают необходимой оценку плотности костей у детей с МПС II типа [40]. При рентгенологическом исследовании у пациентов с МПС выявляются признаки раннего окостенения затылочно-теменного шва, так называемые «рыбьи позвонки». Cообщается о возможностях пренатальной диагностики МПС II типа [41]. G. Altarescu и соавт. (2011) предложили метод преимплантационной генетической диагностики (PGD) для своевременной идентификации пораженных болезнью эмбрионов [42]. K. Nakamura и соавт. (2001) отмечают роль неонатального скрининга в выявлении лизосомных болезней (включая МПС II типа), а B.J. Wolfe и соавт. (2011) подчеркивают значение тандемной масс-спектрометрии (ТМС) в оценке лизосомных ферментов при скрининг-обследовании новорожденных на наличие синдрома Хантера [43, 44]. И.В. Бахмани (2010) cчитает, что ранняя диагностика МПС предотвращает детскую смертность и инвалидность [45].
Лечение МПС II типа
Специфического лечения для МПС II типа до недавнего времени не существовало. Традиционно осуществлялась симптоматическая терапия, ортопедические и реабилитационные мероприятия. В настоящее время проводится заместительная терапия синтетическим энзимом идурсульфазой (препарат Элапраза). Препарат Элапраза выпускается в форме концентрата для приготовления раствора для внутривенного введения (1 мл концентрата содержит 2 мг идурсульфазы). Единственным показанием к применению Элапразы является длительное лечение пациентов с синдромом Хантера. Противопоказанием к использованию препарата служит повышенная чувствительность к активному или любому из вспомогательных веществ, входящих в его состав [46]. Идурсульфаза, входящая в состав Элапразы, представляет собой очищенную форму лизосомного фермента идуронат-2-сульфатазы, полученную с использованием культуры человеческих клеток, что обеспечивает профиль гликозилирования, аналогичный естественному профилю ИДС [46]. Внутривенное введение идурсульфазы пациентам с МПC II типа позволяет обеспечить поступление экзогенного фермента в лизосомы клеток, что приводит к интернализации ИДС, нацеленного на внутриклеточные лизосомы, с последующим катаболизмом накапливаемых ГАГ [46]. Лечению синдрома Хантера и применению идурсульфазы посвящены многочисленные работы зарубежных исследователей 49.
В систематическом обзоре, представленном E.M. da Silva (Бразилия) и соавт. (2011), была оценена эффективность и безопасность ферментозаместительной терапии МПС II типа идурсульфазой [59]. Авторы констатируют, что после 53 недель терапии (идурсульфаза в дозе 0,5 мг/кг 1 раз в неделю) у пациентов отмечается значительное улучшение (по сравнению с плацебо) по показателю способности к прохождению расстояния за 6-минутный период (различия статистически достоверны). У пациентов, получавших идурсульфазу в той же дозе 1 раз в 2 недели, также отмечалось улучшение, однако оно не было статистически достоверным по сравнению с группой плацебо. При обоих терапевтических режимах размеры печени и селезенки, а также уровни экскреции ГАГ с мочой были значительно ниже базисных (до лечения). Переносимость идурсульфазы в целом была хорошей, несмотря на отдельные реакции на инфузионное введение препарата. Антитела к идурсульфазе обнаруживались у 31,7% пациентов к концу 53-недельного исследования (в этих случаях отмечалось меньшее снижение уровней ГАГ в моче). E.M. da Silva и соавт. констатируют доказанный терапевтический эффект лечения идурсульфазой, при этом подчеркивают необходимость дальнейшего изучения долговременной эффективности препарата.
1. Вашакмадзе Н.Д., Намазова-Баранова Л.С., Геворкян А.К., Кузенкова Л.М., Христочевский А.Д., Высоцкая Л.М., Дадашев А.С. Мукополисахаридоз II типа // Педиатрическая фармакология. 2011. Т. 8. № 3. С. 66-68.
Мукополисахаридоз
Мукополисахаридозы - это группа генетически обусловленных заболеваний, возникающих вследствие нарушения обмена кислых мукополисахаридов (гликозаминогликанов). Характерны системные поражения скелета и задержка физического развития. При некоторых формах наблюдается умственная отсталость. Возможны нарушения сердечной деятельности, патология органов зрения, образование грыж, неврологические нарушения, гипертрихоз, увеличение печени и селезенки. Диагноз выставляется на основании клинических признаков, данных рентгенографии и других исследований. Лечение симптоматическое.
МКБ-10
Общие сведения
Мукополисахаридозы - группа генетических заболеваний, сопровождающихся накоплением кислых мукополисахаридов в органах и тканях. Причиной развития является передающаяся по наследству неполноценность лизосомных ферментов. Впервые мукополисахаридоз был описан Гурлер в 1917 году. Лечение мукополисахаридоза осуществляют травматологи-ортопеды при участии кардиологов, офтальмологов, неврологов, отоларингологов и других специалистов.
Виды мукополисахаридоза
Мукополисахаридоз типа IH
Мукополисахаридоз типа IH или синдром Гурлер встречается у 1 новорожденного из 20-25 тысяч. Симптомы мукополисахаридоза появляются в течение первого года жизни, полная клиническая картина формируется к 1-2 годам. Для данной формы мукополисахаридоза характерны грубые черты лица и деформация черепа в форме лодочного киля (скароцефалия). Из-за увеличенных аденоидов и пороков развития в области лица и носа больные дышат ртом. Отмечаются прогрессирующие деформации конечностей и других частей скелета, отставание в росте.
Позвоночник пациентов с мукополисахаридозом искривлен, из-за чего в положении сидя возникает симптом «кошачьей спины». Отмечается укорочение шеи, высокое расположение лопаток и выстояние нижних ребер. Кисти широкие, напоминающие когтистую лапу. Со временем у больных мукополисахаридозом формируются контрактуры суставов. Вначале поражаются локтевые и плечевые суставы, затем - коленные, тазобедренные и голеностопные. Из-за ограничения движений возникает характерная походка - на цыпочках с полусогнутыми ногами.
Тоны сердца приглушены, границы расширены. При аускультации определяются систолические шумы, на ЭКГ выявляется диффузное поражение миокарда. Передняя брюшная стенка пациентов с мукополисахаридозом ослаблена, живот увеличен, часто выявляются гидроцеле, пупочные и паховые грыжи. Печень и селезенка увеличены. Характерны нарушения зрения и слуха. Возможно помутнение и увеличение роговицы, пигментная дистрофия сетчатки, глаукома, атрофия зрительных нервов и застойные явления в области глазного дна. У больных мукополисахаридозом этого типа развивается прогрессирующая умственная отсталость. Могут возникать нарушения координации движений, парезы и параличи. Выявляется избыточный рост пушковых волос.
Рентгенография позвоночника пациентов с мукополисахаридозом свидетельствует о характерной деформации позвонков. Позвонки имеют кубовидную форму, их контуры закруглены, в переходном отделе выявляется скошенность передневерхних углов, углообразный кифоз, утолщение и укорочение отростков. На рентгенографии грудной клетки определяется утолщение передних и истончение задних отделов ребер, сопровождающиеся их лопатовидной или саблевидной деформацией, укорочение и деформация ключиц, уменьшение и смещение головок плечевых костей.
Рентгенография таза подтверждает сужение тазового кольца, скошенность вертлужных впадин и уменьшение головок бедренных костей. На рентгенограммах трубчатых костей выявляется истончение кортикального слоя и расширение костномозгового канала. Рентгенография костей кисти свидетельствует о недоразвитии ногтевых фаланг, укорочении и расширении пястных костей, проксимальных и средних фаланг. На рентгенограммах черепа определяется недоразвитие костей лицевого черепа, краниостеноз и макроцефалия.
Мукополисахаридоз типа I-S
Мукополисахаридоз типа I-S или болезнь Шейе (описана в 1962 г. американским офтальмологом Шейе) является более поздним, относительно благоприятно протекающим вариантом мукополисахаридоза типа IH (синдрома Гурлер). До 3-6 лет развитие детей соответствует норме. Первым признаком мукополисахаридоза становятся сгибательные контрактуры пальцев рук. В последующем ограничивается разгибания в лучезапястных, локтевых и плечевых суставах. Контрактуры нижних конечностей, как правило, слабо выражены. Полная клиническая картина мукополисахаридоза формируется к началу подросткового возраста.
Пациенты с мукополисахаридозом коренастые, невысокие, с грубыми чертами лица и хорошо развитой мускулатурой. Отмечается повышенное оволосение (гипертрихоз). Часто возникают паховые или пупочные грыжи. Кожа на пальцах натянута и утолщена. Из-за сдавления срединного нерва возможно развитие синдрома запястного канала, сопровождающееся атрофией мышц области тенара и парестезиями в области III-IV пальцев. У некоторых больных мукополисахаридозом выявляется аортальный стеноз, недостаточность клапанов аорты, пигментная дистрофия сетчатки, глаукома и помутнение роговицы. Интеллект в норме, увеличение селезенки и печени нехарактерно. На рентгенограммах определяется картина, аналогичная мукополисахаридозу типа IH, но патологические изменения выражены менее резко.
Мукополисахаридоз типа II
Мукополисахаридоз типа II или синдром Хантера чаще выявляется у мальчиков и обычно развивается на 2-3 году жизни. Как и при мукополисахаридозе типа IH наблюдается скафоцефалия, огрубление черт лица, низкий голос и затруднения дыхания из-за деформации лицевого скелета. При этом характерный для мукополисахаридоза типа IH кифоз обычно не выявляется, симптом «кошачьей спины» отрицательный. Пациенты часто страдают от респираторных инфекций (бронхитов, трахеитов, пневмоний). Постепенно развиваются нарушения координации движений, возрастает агрессивность. Настроение неустойчивое, с резкими перепадами.
Также при данной форме мукополисахаридоза наблюдается незначительное увеличение селезенки и печени, прогрессирующая тугоухость, узелки на коже спины и некоторое снижение интеллекта. В последующем может развиться помутнение роговицы. Рентгенологическая картина - как при мукополисахаридозе типа I-S. Возможны два варианта развития болезни: благоприятный (вариант В) и неблагоприятный (вариант А). При благоприятном варианте симптомы выражены нерезко, иногда возникает незначительная умственная отсталость, пациенты с мукополисахаридозом могут доживать до 30 и более лет. Для неблагоприятного варианта характерна яркая клиническая картина и серьезные нарушения интеллекта. Летальный исход наступает в подростковом возрасте.
Мукополисахаридоз типа III
Мукополисахаридоз типа III или болезнь Санфилиппо (описана в 1963 г. американским педиатром Санфилиппо) развивается у 1 новорожденного из 100-200 тысяч. В первые годы жизни развитие соответствует возрасту, иногда наблюдаются затруднения глотания и неуклюжая походка. В возрасте 3-5 лет ребенок с мукополисахаридозом становится апатичным и начинает отставать в развитии. Возникают нарушения речи, огрубление черт лица, недержание мочи и кала. Со временем умственная отсталость прогрессирует и занимает центральное положение в клинической картине этого типа мукополисахаридоза.
Наряду с нарушениями интеллекта наблюдается умеренное увеличение печени и селезенки, повышенное оволосение, контрактуры и задержка роста. Патология со стороны глаз и сердечно-сосудистой системы для этой формы мукополисахаридоза нехарактерна. Рентгенологическая картина - без изменений или как при мукополисахаридозе типа I-S, но менее выраженная. Больные мукополисахаридозом третьего типа, как правило, погибают в возрасте 10-20 лет от инфекционных осложнений.
Мукополисахаридоз типа IV
Мукополисахаридоз типа IV или болезнь Моркио (описана в 1929 г. уругвайским педиатром Моркио) наблюдается у 1 новорожденного из 40 тысяч. До 1-3 лет дети развиваются нормально. В последующем возникает значительное отставание в росте, укорочение шеи и туловища, контрактуры и вальгусная деформация конечностей, сколиоз или кифоз, разнообразные деформации грудной клетки, снижение силы мышц, утолщение кожи и огрубление черт лица. При этом типе мукополисахаридоза часто развиваются паховые и пупочные грыжи, дистрофия роговицы и тугоухость. Интеллект сохранен.
На рентгенограммах позвоночника определяется кифоз, сколиоз, расширение и уплощение тел позвонков. При проведении рентгенографии таза и конечностей выявляются множественные деформации, неровность контуров, уплощение головок бедренных костей, укорочение костей предплечья и деформации стоп. Средняя продолжительность жизни больных мукополисахаридозом - менее 20 лет. Смерть при данной форме мукополисахаридоза наступает из-за сопутствующих заболеваний, осложняющихся сердечно-легочной недостаточностью.
Другие типы мукополисахаридоза
Мукополисахаридоз типа VI или болезнь Марото-Лами (описана в 1960 г. французами Лами и Марото) развивается в возрасте 2 года и старше. Возникает огрубление черт лица, отставание в росте, укорочение шеи, контрактуры суставов и бочкообразная деформация грудной клетки. Характерны частые простуды. Возможны грыжи, увеличение печени и селезенки. Интеллект не страдает. Наблюдается два варианта течения: классический и мукополисахаридоз со слабой выраженностью клинических проявлений. На рентгенограммах больных мукополисахаридозом определяется кубовидная или клиновидная деформация позвонков, треугольная деформация таза, недоразвитие и деформация головок бедренных костей, укорочение малоберцовых костей.
Мукополисахаридоз типа VII протекает, как мупоколисахаридоз типа III, различия выявляются только при проведении биохимических исследований. Мукополисахаридоз типа VIII по симптомам напоминает мукополисахаридоз типа IV, но, в отличие от него, сопровождается задержкой умственного развития.
Диагностика
Диагноз мукополисахаридоза устанавливается на основании характерной клинической и рентгенологической картины, выявления гликозаминогликанов в моче, изучения активности ферментов в клеточных культурах, генетического секвенирования. В ходе обследования больным мукополисахаридозом назначаются консультации различных специалистов: кардиолога, гастроэнтеролога, офтальмолога, отоларинголога, невролога, психиатра и т. д., проводятся инструментальные исследования для оценки состояния различных органов и систем.
Лечение мукополисахаридоза
Патогенетическая терапия не разработана. Лечение симптоматическое, может быть как консервативным, так и оперативным. Осуществляется профилактика и лечение респираторных инфекций, проводится коррекция нарушений зрения и слуха. При необходимости выполняются грыжесечение и герниопластика, операции по устранению контрактур и коррекции деформаций скелета.
Прогноз и профилактика
Прогноз при всех типах мукополисахаридоза неблагоприятный - продолжающееся накопление продуктов обмена в тканях приводит к усугублению патологических изменений со стороны всех органов и систем. Использование любых лечебных средств (переливания крови, введение гормонов и т. д.) при мукополисахаридозе обеспечивает лишь временное улучшение. Рекомендуется пренатальная профилактика.
1. Руководство по педиатрии. Врожденные и наследственные заболевания/ Новиков П.В., Баранов А.А., Каганов Б.С., Шиляев Р.Р - 2007
Синдром Санфилиппо ( Мукополисахаридоз III )
Синдром Санфилиппо (мукополисахаридоз III) — это генетическое заболевание из группы мукополисахаридозов, возникающее вследствие точечных мутаций и характеризующееся нарушением обмена гликозаминогликанов. Патология проявляется прогрессирующей задержкой психоречевого развития, множественными нарушениями поведения, грубыми двигательными расстройствами. Для диагностики синдрома назначается исследование уровня определенных ферментов в клеточных культурах, магнитно-резонансная томография головного мозга. Лечение симптоматическое: коррекция поведения, устранение судорожного синдрома, комплексная реабилитация и правильный уход.
Заболевание названо в честь американского педиатра Сильвестра Санфилиппо, который вместе с коллегами описал его характерные признаки в 1963 г. Этот синдром составляет до 47% всех случаев мукополисахаридозов. Частота встречаемости болезни Санфилиппо составляет от 0,28 до 4,1 на 100 000 живорожденных детей. Ученые считают, что истинная распространенность синдрома намного выше, что обусловлено наличие мягких форм с незначительной клинической симптоматикой.
Причины
Заболевание развивается вследствие мутаций генов, кодирующих определенные ферменты в цикле биохимических превращений гепарансульфатов. Благодаря усовершенствованию молекулярно-генетической диагностики удалось обнаружить 4 варианта генных аномалий, которые встречаются при разных подтипах синдрома Санфилиппо:
Патогенез
Вследствие дефицита специфических лизосомальных энзимов в организме повышается уровень продуктов частичной деградации гепарансульфата, оказывающих токсическое влияние на нервную систему. Вещества накапливаются в нейронах ЦНС, провоцируют прогрессивное увеличение размеров лизосом, дистрофию отростков нервных клеток, образование аксональных сфероидов, а также вызывают истончение миелинового слоя.
Появление деградированных гликозаминогликанов запускает патологические реакции в ЦНС, стимулирует образование свободных радикалов, оксида азота, провоспалительных цитокинов. Нарастает оксидантный стресс, усугубляющий течение нейродегенеративного процесса. В клетках накапливаются аномальные ганглиозиды, эфиры холестерина, которые образуют специфические полосатые тельца в коре больших полушарий, миндалевидном теле, среднем мозге.
Симптомы
У женщин, вынашивающих ребенка с синдромом Санфилиппо, отмечается осложненное течение беременности и родов: угроза самовольного прерывания, ягодичное предлежание плода, слабость родовой деятельности, требующая проведения оперативного кесарева сечения. В неонатальном периоде дети подвержены дыхательным расстройствам, нарушениям грудного вскармливания, затяжной желтухе, сопровождающейся крайне высоким содержанием билирубина.
Заболевание характеризуется некоторыми фенотипическими особенностями. У пациентов вытянутая форма головы, узкий высокий лоб, утолщенная вывернутая нижняя губа. Кожа грубая и плотная на ощупь, волосы сухие, жесткие. Обычно наблюдается избыточное оволосение (гипертрихоз). Поражение позвоночника проявляется сколиозом, кифозом, вследствие недоразвития головок бедренных костей отмечаются изменения походки.
Манифестация типичной клинической картины происходит в раннем детском возрасте. Основным признаком синдрома Санфилиппо являются нейродегенеративные нарушения, которые проходят 3 последовательные стадии. В первой фазе (1-4 годы жизни ребенка) превалируют задержка речевого развития, снижение слуха. Такие симптомы неспецифичны, поэтому на данном этапе диагноз устанавливается крайне редко.
Развернутая клиническая картина формируется во 2-й фазе (4-10 лет). Ребенок перестает разговаривать, утрачивает приобретенные ранее моторные и когнитивные навыки. Психические нарушения проявляются снижением концентрации внимания, расторможенностью, импульсивным или деструктивным поведением. Беспокоит бессонница, полностью сбивается режим дня, в ночное время больной зачастую жует постельное белье, беспричинно смеется или плачет.
Приблизительно в 10-летнем возрасте манифестирует 3 фаза синдрома Санфилиппо, которая характеризуется тяжелой неврологической симптоматикой. Помимо умственной отсталости и нарушений поведения, прогрессируют двигательные расстройства. Наблюдается неустойчивость при ходьбе, частые падения, потеря объема активных движений из-за гипотонии и мышечной спастичности. В большинстве случаев возникает судорожный синдром.
Осложнения
Необратимый нейродегенеративный процесс приводит к полной утрате способности к самостоятельному передвижению, регрессу всех когнитивных навыков. Такие пациенты со временем становятся тяжелыми инвалидами, требуют круглосуточного квалифицированного ухода. Иногда больные впадают в вегетативное состояние с отсутствием самопроизвольной психической активности.
Среди соматических осложнений синдрома Санфилиппо чаще всего встречаются гепатоспленомегалия, патологии сердца (гипертрофия левого желудочка, стеноз аортального клапана). У большинства пациентов в 1-2 фазе возникает хроническая диарея. На фоне нарушений глотания и дыхания развиваются затяжные инфекционные заболевания бронхолегочной системы, которые зачастую являются причиной летального исхода.
Для постановки диагноза требуется консультация генетика с привлечением к обследованию профильных специалистов — педиатров, детских неврологов, психиатров. Заподозрить болезнь Санфилиппо удается по специфическим изменениям фенотипа, прогрессирующей задержке речи в сочетании со множественными поведенческими нарушениями. Для комплексной диагностики синдрома применяются следующие методы:
- Лабораторные исследования. При биохимическом анализе мочи отмечается увеличение уровня секретируемых гликозаминогликанов. Исследование специфической ферментной активности в культуре фибробластов или лейкоцитов крови является 100% надежным методом диагностики.
- Нейровизуализация. По результатам МРТ головного мозга определяются диффузные атрофические процессы, расширение желудочковой системы, дегенерация мозолистого тела. Реже выявляется гипоинтенсивность базальных ганглиев в режиме Т2.
- Пренатальная диагностика. При отягощенном семейном анамнезе беременным женщинам выполняют биопсию ворсин хориона (на 12-14 неделе) или амниоцентез (на 14-16 неделе), чтобы подтвердить или опровергнуть диагноз путем генетического исследования.
Лечение синдрома Санфилиппо
Консервативная терапия
В настоящее время какие-либо патогенетические препараты, способные остановить или замедлить нейродегенеративные процессы в головном мозге, отсутствуют. Подбор симптоматической терапии проводится дифференцированно с учетом степени тяжести проявлений МПС III. Больным назначаются следующие лечебные мероприятия:
- Психотропные препараты. Коррекция поведенческих расстройств выполняется транквилизаторами, седативными средствами, ноотропами. При судорожном синдроме рекомендованы антиконвульсанты.
- Лечение бессонницы. Для нормализации циркадных ритмов и облегчения засыпания в основном применяется гормон мелатонин, который обеспечивает мягкую регуляцию сна, показывает высокую эффективность.
- Антибактериальная терапия. Противомикробные препараты показаны при бактериальных инфекциях дыхательных путей и среднего уха. Для лечение тяжелых аспирационных пневмоний комбинируют 2-3 лекарства, антибиотики резерва.
- Ортопедическая коррекция. Для исправления осанки, устранения тугоподвижности суставов проводится комплексная программа физиолечения, используются специально подобранные ортезы.
Экспериментальное лечение
В последние годы рассматривается использование субстратредуцирующей терапии, направленной на снижение синтеза гепарансульфата. Также обсуждаются вопросы интратекальной ферментозаместительной и генной терапии. Сейчас эти методы лечения находятся на этапе мультицентровых клинических исследований, и не исключено, что в будущем они смогут применяться для эффективного устранения проявлений синдрома Санфилиппо.
Реабилитация
Для улучшения качества жизни пациенту необходим постоянный уход в домашних условиях, проведение комплексных реабилитационных мероприятий. Программа включает массаж, лечебную физкультуру, физиотерапию (термотерапию, УВТ, метод биологической обратной связи). Обязательно назначается психолого-педагогическая помощь, чтобы частично сохранить способность больного к адекватным психическим реакциям, невербальной коммуникации с членами семьи.
При МПС IIIA наблюдается крайне тяжелое течение, большинство пациентов умирают в возрасте 15-25 лет от соматических осложнений. Более благоприятный прогноз при синдроме Санфилиппо типов B, C, D, которые могут протекать в мягкой форме: больные живут до 30-40 лет, имеют возможность самостоятельно передвигаться, отличаются более высоким уровнем интеллектуального развития. Специфическая профилактика мукополисахаридоза III не разработана.
1. Синдром Санфилиппо/ Л.А. Осипова, Л.М. Кузенкова, Л.С. Намазова-Баранова, А.К. Геворкян// Вестник РАМН. — 2015. — №4.
3. Федеральные клинические рекомендации по оказанию медицинской помощи детям с мукополисахаридозом III типа. — 2013.
Мукополисахаридоз VI типа у детей. Клинические рекомендации.
Ферментная заместительная терапия - лечение, заключающееся в пожизненном введении препарата (рекомбинантного энзима) пациентам с врожденным дефектом метаболизма.
1. Краткая информация
1.1 Определение
Мукополисахаридозы (МПС) - группа наследственных болезней обмена веществ, связанных с нарушением метаболизма гликозаминогликанов (ГАГ), приводящее к поражению органов и тканей. Обусловлены данные заболевания мутациями генов, контролирующих процесс внутрилизосомного гидролиза макромолекул.
Мукополисахаридоз VI типа (Синдром Марото Лами) Наследственная лизосомальная болезнь накопления, при которой недостаточность фермента N-ацетилгалактозамин-4-сульфатазы (арилсульфатазы В) приводит к нарушению ступенчатой деградации глюкозаминогликана (ГАГ) дерматансульфата 2.
Синдром Марото-Лами является клинически неоднородным заболеванием с точки зрения распространенности и скорости прогрессирования поражения различных органов и систем . Болезнь характеризуется отставанием в росте, изменениями со стороны органов зрения, огрубением черт лица, снижением слуха, тугоподвижностью в суставах, гепатоспленомегалией, постепенным развитием сердечно-сосудистой и дыхательной недостаточности. Все вышеперечисленные признаки приводят к инвалидизации, а при тяжелом течении болезни - к летальному исходу.
1.2 Этиология и патогенез
Недостаточность фермента N-ацетилгалактозамин-4-cульфатазы (арилсульфатазы В) приводит к нарушению ступенчатой деградации гликозаминогликана (ГАГ) дерматансульфата. ГАГ накапливается внутри лизосом и обусловливает клиническую картину тяжелого хронического прогрессирующего заболевания. Недостаточность арилсульфатазы В обнаруживается во всех тканях, в том числе в культуре фибробластов. Ген ARSB, кодирующий арилсульфатазу В, локализуется в хромосомной области 5q14.
Синдром Марото — Лами наследуется по аутосомно-рецессивному типу [3].
1.3 Эпидемиология
МПС VI типа встречается с популяционной частотой 1:300 000.
1.4 Кодирование по МКБ-10
E 76.2 - Мукополисахаридоз VI типа
1.5 Примеры диагнозов
Мукополисахаридоз VI типа (синдром Марото-Лами). Органическое поражение головного мозга, внутренняя гидроцефалия в стадии компенсации, состояние после наложения вентрикулоперитонеального шунта от 2007г. Слепота вследствие тотального помутнения роговицы обоих глаз и частичной атрофии зрительных нервов. Расходящееся косоглазие. Диспраксия походки и мелкой моторики рук. Сужение позвоночного канала в шейном отделе, компрессия спинного мозга в шейном отделе. Вторичная кардиомиопатия. Недостаточность митрального и аортального клапана. НК 2А степени. Синдром обструктивного апноэ сна тяжелой степени. Деформация позвоночника. Деформация грудной клетки. Сгибательные контрактуры локтевых и коленных суставов. Деформация лучезапястных суставов. Плоскостопие комбинированное 2 ст. Аденоиды 2-3 степени. Гипоплазия зубной эмали. Пупочная грыжа.
1.6 Классификация
В соответствии с дефицитом / отсутствием метаболических лизосомальных ферментам и соответствующим генным дефектам и тяжести клинической симптоматики выделяют несколько типов мукополисахаридозов (табл.1).
Таблица 1 - Классификация (номенклатура) МПС.
Дефицит или отсутствие идуронат-2-сульфатазы
Дефицит или отсутствие сульфоидуронат сульфатазы
Дефицит гепаран-?-глюкозаминид N-ацетилтрансферазы
Дефицит N-ацетилглюкозамин-6- сульфатазы
В настоящее время выделяют 3 формы Мукополисахаридоза VI типа (синдрома Марото-Лами): при тяжелой форме дебют заболевания происходит в возрасте 1-3 года, при среднетяжелой проявления начинают беспокоить с 6 лет, при легкой - после 20 лет.
1.7 Клиническая картина
Синдром Марото-Лами является клинически неоднородным заболеванием с точки зрения распространенности и скорости прогрессирования поражения различных органов и систем (Приложение Г1). Болезнь характеризуется отставанием в росте, изменениями со стороны органов зрения, огрубением черт лица, снижением слуха, тугоподвижностью в суставах, гепатоспленомегалией, постепенным развитием сердечно-сосудистой и дыхательной недостаточности 3.
Основными признаками болезни являются грубые черты лица при сохраненном интеллекте, контрактуры суставов различной степени выраженности, поражение сердечно-сосудистой системы, помутнение роговицы.
Внешний вид пациента характеризуется отставанием в росте (90-100 см при быстром прогрессировании; максимальный - 150 см), диспропорциональным телосложением - карликовостью с укорочением туловища. Отмечается изменение формы лица - большой нос с запавшей переносицей, пухлые губы, маленькие зубы с широкими зубными промежутками, позднее прорезывание зубов, макроглоссия. Возможна глухота, пупочная грыжа, паховая грыжа, уплотнение и утолщение кожи, грубые волосы, умеренный гирсутизм. На поздних стадиях развивается глухота, слепота.
Костная система: наблюдаются множественные дизостозы, умеренная тугоподвижность практически во всех суставах, сгибательные контрактуры межфаланговых суставов и клешневидная деформация кисти. Изменения тазобедренных суставов (дисплазия головки бедренной кости), деформация эпифизов бедренных костей с двух сторон ведет к прогрессирующей инвалидизации. Килевидная грудная клетка с широкими ребрами, дефект развития тел позвонков с передним переломом; Х-образное искривление ног; при рентгенографии - точечные пястные кости.
Органы дыхания: частые респираторные инфекции (риниты, отиты). Гипертрофия миндалин и аденоидов, увеличение языка, утолщение надгортанника и голосовых связок, обусловливают развитие дыхательных нарушений разной степени тяжести, включая обструктивное апноэ сна. Особенности деформаций грудной клетки (жесткая грудная клетка в сочетании с кифосколиозом и поясничным лордозом) способствует развитию рестриктивных дыхательных нарушений.
Органы зрения: отмечается помутнение роговицы, связанное с ее утолщением и увеличением (мегалокорнеа), ретинопатия, изменения диска зрительного нерва, внутриглазная гипертензия, глаукома. Поражение зрительного нерва может быть обусловлено отложением гликозаминогликанов в ганглиозных клетках зрительного нерва, компрессией зрительного нерва утолщенной твердой мозговой оболочкой или сужением костных структур вдоль тракта зрительного нерва, а также повышенным внутричерепных давлением. В случае изменения зрительного нерва или повышения внутриглазного давления следует провести исследование полей зрения. Зрительные вызванные потенциалы могут исследоваться для определения функции и сохранности зрительных нервов при затруднении фундоскопического исследования зрительного нерва выраженным помутнением роговицы.
Центральная нервная система: интеллект и поведенческие реакции у больных с данной нозологией обычно не страдают, однако высок риск развития миелопатии шейного отдела позвоночника. Возможно развитие компрессии спинного мозга вследствие сопутствующих нарушений опорно-двигательного аппарата. Описаны случаи сдавления спинного мозга, вызванного утолщением его оболочек или нестабильностью атлантоаксиального сустава (сопровождаются нарушением походки, мышечной слабостью, неуклюжестью при сохранных моторных навыках и дисфункцией мочевого пузыря).
Тяжелая форма болезни сопровождается открытой (сообщающейся) гидроцефалией, нарушениями резорбции спинномозговой жидкости (СМЖ), которые также вносят вклад в развитие неврологических нарушений
Признаки гидроцефалии зачастую появляются медленно и незаметно, и могут заключаться в изменении поведения, возникновении головной боли, нарушений зрения.
У пациентов с тяжёлой формой заболевания иногда наблюдаются судороги. Они могут иметь как фокальный, так и генерализованный характер. Появление судорог требует проведения оценки неврологического статуса. При прогрессировании заболевания часто наблюдаются генерализованные тонико-клонические пароксизмы.
Карпальный тоннельный синдром - нейропатия сдавления у пациентов с различными видами МПС. При отсутствии лечения может привести к необратимой контрактуре дистальных межфаланговых суставов, а также к нарушению или потере чувствительности первых 3 пальцев и к парезу мышц тенара.
Костные изменения при МПС VI типа приводят к снижению подвижности нижней челюсти, что ограничивает способность открывать рот и жевать. Нарушения глотания встречаются редко, отмечаются при среднетяжелом и тяжелом течении заболевания и, в основном, связаны с нарушением функционирования стволовых отделов головного мозга.
У пациентов наблюдаются признаки псевдобульбарного или бульбарного параличей. Симптомы дебютируют с редких поперхиваний твердой пищей, развиваются постепенно и в конечном итоге приводят к грубому нарушению функции глотания или полному ее исчезновению. Отсутствие правильной регуляции акта глотания приводит к забросу пищи, слюны в трахею и бронхиальное дерево и развитию вторичной инфекции в виде рецидивирующих аспирационных бронхитов и пневмоний. Это усугубляет дыхательные нарушения, являющиеся следствием отложения мукополисахаридов в верхних и нижних дыхательных путях.
Сердечно - сосудистая система: отмечается прогрессирующая дегенерация клапанов сердца с образованием стеноза (наиболее часто митрального и аортального). Проявления сердечно-сосудистых нарушений отмечаются с раннего возраста. Большинство пациентов имеют, по крайней мере, один признак ко второму десятилетию жизни. Кардиомиопатия отмечается нечасто.
Желудочно-кишечная система: синдром раздраженного кишечника, гепатоспленомегалия.
2. Диагностика
Диагноз МПС VI устанавливается на основании совокупности клинических данных, результатов лабораторного исследования и молекулярно-генетического анализа 3.
2.1 Жалобы и анамнез
При сборе анамнеза и жалоб следует обратить внимание на следующие жалобы и анамнестические события:
Орфанные заболевания в практике педиатра: мукополисахаридоз
Рассмотрены мукополисахаридозы - это группа наследственных болезней соединительной ткани, обусловленных нарушением обмена гликозаминогликанов. Приведены типы мукополисахаридозов, основные подходы к лечению больных, приведен клинический пример.
Mucopolysaccharidoses were considered- a group of connective tissue hereditary diseases, conditioned by disorders of glycosaminoglycan metabolism. Types of mucopolysaccharidoses were presented, as well as the main approaches to the patients treatment, a clinical example was given.
С 1 января 2012 г. в силу вступил новый Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», в котором впервые на государственном уровне введено понятие редких (орфанных) заболеваний. В список орфанных болезней на сегодняшний день внесено 230 наименований, однако в случае выявления новых болезней он будет пополняться. По данным Формулярного комитета Российской академии медицинских наук (РАМН), насчитывается около 300 тыс. россиян с этими болезнями.
Редкие (орфанные) заболевания — это встречающиеся с определенной частотой жизнеугрожающие или хронические прогрессирующие заболевания, при отсутствии лечения приводящие к смерти или пожизненной инвалидизации пациентов.
В разных странах определение и перечень орфанных болезней принимаются на государственном уровне, единого определения для них не существует, также как нет единого критерия отнесения заболеваний к этой группе.
В нашей стране к орфанным относятся заболевания, которые имеют распространенность не более 10 случаев заболевания на 100 000 населения.
Сегодня в мире насчитывается около 7000 редких заболеваний. Примерно половина из них обусловлена генетическими отклонениями. Симптомы могут быть очевидны с рождения или проявляться в детском возрасте.
Одним из заболеваний, включенным в группу орфанных, является мукополисахаридоз (МПС) (код по МКБ-10 Е76.1 — «нарушение обмена гликозаминогликанов», Постановление Правительства № 403 от 26 апреля 2012 г.).
Мукополисахаридоз — это группа наследственных болезней соединительной ткани, обусловленных нарушением обмена гликозаминогликанов (ГАГ) (кислых мукополисахаридов) в результате генетически обусловленной неполноценности 1 из 11 известных ферментов, участвующих в их расщеплении. Относится к лизосомным болезням накопления (табл.).
Для МПС характерно полисистемное поражение: прогрессирующие психоневрологические нарушения, гепатоспленомегалия, сердечно-легочные расстройства, костные деформации 1.
Представляем клиническую и лабораторную характеристику заболевания на примере МПС II типа.
Мукополисахаридоз II типа (синонимы: недостаточность фермента лизосомной идуронат-2-сульфатазы (a-L-идуроносульфатсульфатазы), синдром Гунтера (Хантера) — сцепленное с Х-хромосомой рецессивное заболевание, возникающее в результате снижения активности лизосомной идуронат-2-сульфатазы, участвующей в метаболизме ГАГ. Возникает почти исключительно у мальчиков (XY). У гетерозиготных женщин клинических проявлений синдрома Хантера, как правило, не наблюдается («носители»). К настоящему моменту описано лишь 2 случая заболевания у девочек, связанных с инактивацией второй, нормальной, Х-хромосомы.
Это панэтническое заболевание, частота встречаемости в мире — около 1 на 75 000 живых новорожденных мальчиков. Частота заболевания в популяции варьирует от 1 на 165 000 (Австралия) до 1 на 34 000 (Израиль). Развитие МПС II типа обусловлено мутациями в структурном гене лизосомной идуронат-2-сульфатазы — IDS, расположенном на длинном плече Х-хромосомы в локусе Xq28. В настоящее время описано более 300 различных мутаций в гене IDS. Более 50% мутаций составляют точечные мутации, около 26% — мелкие делеции и вставки, 11% — крупные делеции и перестройки гена IDS. Для пациентов России ДНК-анализ гена IDS показал, что крупные делеции и перестройки гена IDS составляют только 5,4% числа найденных мутаций.
Клинический фенотип гетерогенен и довольно условно подразделяется на тяжелую и легкую формы, различающиеся по тяжести клинических фенотипов. У пациентов с тяжелой формой наблюдают сходные с МПС I типа (синдромом Гурлер) клинические симптомы, но заболевание прогрессирует медленнее (рис.).
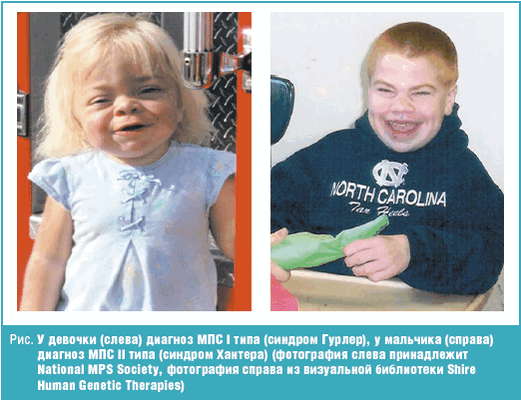
Заболевание манифестирует в возрасте от 1 до 3 лет. Отмечается изменение черт лица по типу гаргоилизма, задержка роста, признаки множественного костного дизостоза, огрубление и утолщение кожи, прогрессирующее снижение интеллекта. Специфичными для данного типа МПС являются изменения на коже спины, груди, шеи цвета слоновой кости, «монголоидные пятна» в пояснично-крестцовой области. Нарушения функции органов пищеварения проявляются в виде гепатомегалии, хронической диареи. Среди неврологических нарушений преобладают симптомы прогрессирующей сообщающейся гидроцефалии, спастическая параплегия в результате компрессии спинного мозга и прогрессирующая тугоухость. У детей с синдромом Хантера отмечается тугоподвижность крупных и мелких суставов. Прогрессируют сердечно-легочные расстройства. Летальный исход обычно наступает на втором десятилетии жизни.
Для подтверждения МПС II типа проводится определение уровня экскреции ГАГ с мочой и измерение активности лизосомной идуронат-2-сульфатазы в лейкоцитах или культуре кожных фибробластов. В случае заболевания в моче возрастает суммарная экскреция ГАГ.
Проведение ДНК-анализа — длительная и сложная диагностическая процедура, позволяющая определить молекулярные дефекты, приводящие к болезни Хантера, наиболее часто используется для определения носительства и пренатальной диагностики в семьях, имеющих больного ребенка. Применяются методы косвенной ДНК-диагностики, основанной на исследовании локусов Х-хромосомы, расположенных близко к гену IDS.
Кроме того, пренатальная диагностика проводится путем измерения активности идуронат-2-сульфатазы в биоптате ворсин хориона на 9-11 неделе беременности или определения спектра ГАГ в амниотической жидкости на 20-22 неделе беременности.
Наиболее часто дифференциальная диагностика проводится внутри группы МПС, а также с другими лизосомными болезнями накопления (муколипидозами, галактосиалидозом, ганглиозидозом и др.).
В качестве клинического примера приводим выписку из истории болезни.
Никита Б., дата рождения 11.12.2011.
Анамнез жизни. Ребенок от второй беременности (первая беременность окончилась выкидышем на раннем сроке), протекавшей на фоне маловодия, гипоксии плода, угрозы прерывания, отеков. Роды срочные, самостоятельные. Вес при рождении 4040 г, рост 58 см. С рождения на грудном вскармливании.
Формула развития: голову держит с 2 мес, переворачивается с 5 мес, сидит с 9 мес, ходит с 1 г 1 мес. К году — 5 слов. Перенесенные заболевания — острая респираторная вирусная инфекция 2 раза, трахеит.
Анамнез заболевания. С рождения — водянка оболочек яичек, с 5 мес — пахово-мошоночная грыжа, в 7 мес диагностирован кифоз поясничного отдела позвоночника, в 12 мес по данным электрокардиографии (ЭКГ) — синдром ранней реполяризации желудочков, неполная блокада правой ножки пучка Гиса (НБПНГ), в 1 г 3 мес проведена эхокардиография (Эхо-КГ), выявлена аневризма межпредсердной перегородки (МПП).
В 1 г 4 мес ребенок обследован в МГНЦ РАМН, заподозрен и подтвержден биохимическим и молекулярно-генетическим методами МПС II типа.
При поступлении в клинику состояние ребенка средней тяжести. Вес 15 кг. Рост 93 см. Волосы жесткие, тусклые, макростомия, макроглоссия, короткая шея, легкие черты гаргоилизма, камподактилия 4,5 пальца справа, широкое пупочное кольцо, кифоз поясничного отдела позвоночника, килевидная деформация грудной клетки, пахово-мошоночная грыжа слева, кожа — плотная на ощупь. Гипертрофия миндалин 2-3 ст. Дыхание через нос не затруднено. Дыхание везикулярное. Тоны сердца ритмичные, акцент второго тона. Частота сердечных сокращений (ЧСС) 120 уд./мин. Живот увеличен в объеме, печень +3,5 см, +4 см верхняя треть. Селезенка не пальпируется. Стул оформленный. Дизурических явлений нет.
Неврологический статус: в сознании, гиперактивен, быстро возбудим, говорит отдельные слова. Общемозговых, менингеальных знаков нет. Окружность головы = 50 см. Глазные щели OD = OS. Зрачки OD = OS. Движение глазных яблок в полном объеме. Низкий тембр голоса. Быстро истощается, ходит самостоятельно, легкая атаксия. Мышечная гипотония. Сухожильные рефлексы живые.
Общий анализ крови и мочи без патологических изменений.
Биохимический анализ крови — умеренное повышение уровня аланинаминотрансферазы (АЛТ) (42 Ед/л), аспартатаминотрансферазы (АСТ) (49 Ед/л).
ЭКГ: вертикальное положение электрической оси сердца (ЭОС), выраженная синусовая тахикардия 182-200 на фоне беспокойства. В ортостазе ЧСС 111-166 уд./мин.
Ультразвуковое исследование (УЗИ) брюшной полости: печень увеличена, правая доля 100 мм, левая — 45 мм. Структура однородная, стенки сосудов и протоков уплотнены. Эхогенность повышена. Поджелудочная железа 14 × 8 × 15 мм, структура неоднородная, эхогенность не изменена. Желчный пузырь — форма обычная, просвет чистый, стенки не утолщены. Селезенка не увеличена, 62 × 32 мм. Структура однородная. Почки без патологических изменений. Яички в мошонке, вагинальный отросток брюшины расширен с обеих сторон до 3 мм.
Электроэнцефалография (ЭЭГ): диффузные общемозговые изменения биоэлектрической активности по органическому типу в виде доминирования дельта-активности частотой 3-4 Гц по всем отделам конвекса безградиентно в сочетании с отдельными группами низкочастотных тета-колебаний. Эпилептиформная активность, фотопароксизмальная реакция не выявлены.
На основании комплексного исследования установлен диагноз: «Мукополисахаридоз II типа (синдром Хантера). Дегенеративное заболевание нервной системы. Задержка речевого развития. Синдром гипервозбудимости. Множественный костный дизостоз. Порок развития L1-L2 позвонков, врожденный кифоз. 2-стороннее гидроцеле. Пупочная грыжа».
По жизненным показания ребенку назначено внутривенное введение Элапразы в дозе 0,5 мг/кг еженедельно (15 кг × 0,5 = 7,5 мг на введение).
Ребенок с июля 2013 г. (возраст 1 г 7 мес) получает ферментозаместительную терапию в условиях детского отделения ГБУЗ МО МОНИКИ. В комплексную терапию включены занятия с логопедом, дефектологом, курсы физиотерапии, лечебная физкультура, L-карнитин (Элькар), Кудесан, глицин, церебролизин, Магне В6.
Литература
Т. А. Бокова 1 , кандидат медицинских наук
Е. В. Лукина
Н. В. Шестериков
Читайте также:
- КТ, МРТ при аденокарциноме мочевого пузыря
- Влияние депрессии на инфаркт миокарда. Влияние поведения врача на инфаркт миокарда
- Нервные сплетения легких. Иннервация легких
- Клиника острых отравлений. Неотложная помощь при острых отравлениях.
- Техника, этапы артроскопической резекции дистального конца ключицы
