Опухоли костной ткани детей. Лейкозы детей
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Под ред.: Киргизова К.И., Заместителя директора (НИИ ДОиГ ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России) по научной и образовательной работе, врач-детский онколог, ведущий научный сотрудник, к.м.н.
Детский лейкоз - это злокачественное заболевание системы крови. Одной из особенностей лейкоза является то, что его проявления на начальной стадии могут быть приняты за признаки других болезней. Сегодня мы расскажем о том, как проявляется лейкоз у детей, как распознать его по первым симптомам и к каким специалистам обратиться, чтобы не упустить драгоценное время.
ПРИЗНАКИ ЛЕЙКОЗА У ДЕТЕЙ
- частые недомогания;
- повышенная утомляемость;
- слабость;
- жар (лихорадка);
- частые кровотечения со слизистых оболочек и «беспричинные» (легко возникающие) гематомы;
- увеличение лимфатических узлов;
- боли в костях и суставах;
- необъяснимая бледность кожи.
СИМПТОМЫ ЛЕЙКОЗА У ДЕТЕЙ В НАЧАЛЬНОЙ СТАДИИ
- вялость и бледность (анемичное состояние);
- отказ от привычных игр и активностей;
- чувство постоянной усталости, жалобы на отсутствие сил.
РАЗВИТИЕ ЛЕЙКОЗА И ПРИЗНАКИ ПОЗДНИХ СТАДИЙ
Организму становится сложно бороться с вредными микроорганизмами, возбудителями болезней. Из-за этого ребенок становится более подвержен различным инфекциям, часто с высокой температурой и острым упадком сил.
Кроме того, сниженное количество тромбоцитов, которые отвечают за свертываемость крови, может приводить к точечным кровоизлияниям (гематомам) и кровоточивости слизистых оболочек. По мере того, как лейкозные клетки начинают заполнять не только костный мозг, но и другие органы и ткани, в организме у детей появляются и другие признаки лейкемии: боли в руках и ногах, в области живота, нарушения зрения, рвота, тошнота.
ВИДЫ ДЕТСКОЙ ЛЕЙКЕМИИ: ЧЕМ ОНИ ОТЛИЧАЮТСЯ
Лейкоз у детей и подростков известен под разными названиями: «лейкемия», «белокровие», «рак крови». Однако специалисты оперируют совсем другими терминами, призванными разделить виды детского лейкоза по типу клеток и их зрелости. В целом, лейкозы - это группа гематологических заболеваний, которые характеризуются избыточным размножением лейкозных и вытеснением нормальных клеток крови. Лейкозы разделяют на острые и хронические, а также в зависимости от преобладающего типа вовлеченных клеток.
ОСТРЫЙ ЛИМФОБЛАСТНЫЙ ЛЕЙКОЗ
Острый лимфобластный лейкоз (ОЛЛ) составляет около 25 % всех злокачественных опухолей у детей и подростков в возрасте до 18 лет и является самым частым онкологическим заболеванием детского возраста. Лимфоидные формы острых лейкозов составляют 80-90 % детских лейкозов. При ОЛЛ нарушается процесс созревания лимфоцитов - белых клеток крови, которые отвечают за борьбу с инфекциями и обеспечивают защиту организма. Незрелость белых кровяных клеток (бластов), замещение ими нормальных клеток крови и приводит к появлению у детей симптомов ОЛЛ: частым инфекциям, проблемам со свертываемостью крови, анемичному виду.
ОСТРЫЙ МИЕЛОИДНЫЙ ЛЕЙКОЗ
Острый миелоидный лейкоз (ОМЛ) является 2-м по распространенности детским лейкозом после ОЛЛ - он составляет 20 % всех острых детских лейкозов и 6 % всех опухолей у детей. Он поражает клетки крови, называемые миелоидными стволовыми клетками. В норме из этих клеток образуются зрелые клетки крови: эритроциты, гранулоциты и тромбоциты. Однако при ОМЛ этот процесс нарушается, и большое количество незрелых белых клеток крови вызывает вышеперечисленные симптомы.
ЮВЕНИЛЬНЫЙ МИЕЛОМОНОЦИТАРНЫЙ ЛЕЙКОЗ
Ювенильный миеломоноцитарный лейкоз (ЮММЛ) является одной из самых редких форм лейкоза, он возникает исключительно у детей раннего возраста. В среднем, этот диагноз ставится до достижения ребенком возраста 2 лет. ЮММЛ отличается от ХМЛ тем, что в его лейкемических клетках нет филадельфийской хромосомы (но часто присутствуют другие хромосомные аномалии). Кроме того, ЮММЛ ассоциирован не только с нарушением процессов кроветворения, но и с повышенной выработкой моноцитов.
ХРОНИЧЕСКИЙ МИЕЛОИДНЫЙ ЛЕЙКОЗ
Хронический миелоидный лейкоз (ХМЛ) возникает у детей очень редко, он составляет около 3-5 % всех случаев детских лейкозов. При этом у подавляющего большинства детей с ХМЛ есть генетическая мутация, которая носит название «филадельфийская хромосома». Будучи хронической формой лейкоза, ХМЛ развивается в течение достаточно длительного времени. В отличие от острого лейкоза, где счет идет на недели, при ХМЛ до появления первых симптомов могут пройти месяцы.
ДИАГНОСТИКА ЛЕЙКОЗА У ДЕТЕЙ
- Общий осмотр, оценка физического состояния пациента и сбор анамнеза.
- Общий развернутый анализ крови с обязательным дифференцированным подсчетом лейкоцитов (лейкоцитарная формула).
- Пункция костного мозга с последующим цитологическим и цитохимическим исследованием.
- Люмбальная пункция с исследованием спинномозговой жидкости.
- Рентген, ультразвуковое исследование и другие методы инструментальной диагностики.
При необходимости специалисты могут назначить другие анализы и процедуры - в частности, высокотехнологичные исследования на конкретные маркеры и параметры опухолевых клеток.
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА ЛЕЙКОЗА
- таргетная терапия;
- трансплантация костного мозга или стволовых клеток;
- иммунотерапия;
- лучевая терапия.
Наиболее оптимальный способ лечения индивидуально назначает врач-детский онколог, который подберет протокол терапии для достижения максимального результата. Лечение проводится в стационаре в соответствии с клиническими рекомендациями.
ПРОГНОЗ ПРИ ЛЕЙКОЗЕ У ДЕТЕЙ
К счастью, у двух наиболее распространенных форм детского лейкоза - ОЛЛ и ОМЛ - достаточно хорошие прогнозы по выживаемости и стойкой ремиссии. Современные протоколы лечения приводят к успеху у 80-90 % детей с лейкемией - причем с меньшим количеством осложнений, чем на предыдущих схемах10.
В обоих случаях пациенты считаются выздоровевшими примерно через 5 лет стойкой ремиссии, однако им следует продолжить диспансерное наблюдение у врача-онколога и/или гематолога.
Если же после первых курсов лечения врачи диагностируют резистентную форму (т. е., не реагирующую на лечение), или происходит рецидив лейкоза, дальнейшие варианты терапии подбираются с учетом всех параметров и доступных возможностей медицины.
Главное, о чем нужно помнить, столкнувшись с лейкемией, - современная медицина и вера в свои силы порой действительно творят чудеса! Лечение лейкозов становится все более и более высокотехнологичным, а прогнозы по лечению и ремиссии сегодня гораздо более оптимистичны, чем были в недавнем прошлом.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Клинические рекомендации Министерства здравоохранения Российской Федерации «Острый лимфобластный лейкоз», 2020.
5. Клинические рекомендации Министерства здравоохранения Российской Федерации «Острые миелоидные лейкозы», 2020.
Программа La Fondation La Roche-Posay (Ля Фондейшн Ля Рош Позэ) и CCI (Международная Ассоциация по борьбе с детским раком) прилагают все усилия, чтобы гарантировать, что предоставленная информация является точной и актуальной на момент публикации. Мы не несем ответственность за информацию, предоставленную третьими лицами, в т.ч. теми, на которых ссылаемся или выделили в данной публикации. Информацию в данной публикации следует использовать как дополнение к соответствующим профессиональным консультациям в ваших конкретных обстоятельствах.
Острый лимфобластный лейкоз
Острый лимфобластный лейкоз - злокачественное поражение системы кроветворения, сопровождающееся неконтролируемым увеличением количества лимфобластов. Проявляется анемией, симптомами интоксикации, увеличением лимфоузлов, печени и селезенки, повышенной кровоточивостью и дыхательными расстройствами. Из-за снижения иммунитета при остром лимфобластном лейкозе часто развиваются инфекционные заболевания. Возможно поражение ЦНС. Диагноз выставляется на основании клинических симптомов и данных лабораторных исследований. Лечение - химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10

Общие сведения
В соответствии с классификацией ВОЗ различают четыре типа ОЛЛ: пре-пре-В-клеточный, пре-В-клеточный, В-клеточный и Т-клеточный. В-клеточные острые лимфобластные лейкозы составляют 80-85% от общего количества случаев заболевания. Первый пик заболеваемости приходится на возраст 3 года. В последующем вероятность развития ОЛЛ повышается после 60 лет. Т-клеточный лейкоз составляет 15-20% от общего количества случаев болезни. Пик заболеваемости приходится на возраст 15 лет.

Причины острого лимфобластного лейкоза
Непосредственной причиной острого лимфобластного лейкоза является образование злокачественного клона - группы клеток, обладающих способностью к неконтролируемому размножению. Клон образуется в результате хромосомных аберраций: транслокации (обмена участками между двумя хромосомами), делеции (утраты участка хромосомы), инверсии (переворота участка хромосомы) или амплификации (образования дополнительных копий участка хромосомы). Предполагается, что генетические нарушения, вызывающие развитие острого лимфобластного лейкоза, возникают еще во внутриутробном периоде, однако для завершения процесса формирования злокачественного клона нередко требуются дополнительные внешние обстоятельства.
В числе факторов риска возникновения острого лимфобластного лейкоза обычно в первую очередь указывают лучевые воздействия: проживание в зоне с повышенным уровнем ионизирующей радиации, радиотерапию при лечении других онкологических заболеваний, многочисленные рентгенологические исследования, в том числе во внутриутробном периоде. Уровень связи, а также доказанность наличия зависимости между различными лучевыми воздействиями и развитием острого лимфобластного лейкоза сильно различаются.
Так, взаимосвязь между лейкозами и лучевой терапией в наши дни считается доказанной. Риск возникновения острого лимфобластного лейкоза после радиотерапии составляет 10%. У 85% пациентов болезнь диагностируется в течение 10 лет после окончания курса лучевой терапии. Связь между рентгенологическими исследованиями и развитием острого лимфобластного лейкоза в настоящее время остается на уровне предположений. Достоверных статистических данных, подтверждающих эту теорию, пока не существует.
Многие исследователи указывают на возможную связь между ОЛЛ и инфекционными заболеваниями. Вирус возбудителя острого лимфобластного лейкоза пока не выявлен. Существуют две основные гипотезы. Первая - ОЛЛ вызывается одним пока не установленным вирусом, однако болезнь возникает только при наличии предрасположенности. Вторая - причиной развития острого лимфобластного лейкоза могут стать разные вирусы, риск развития лейкоза у детей повышается при недостатке контактов с патогенными микроорганизмами в раннем возрасте (при «нетренированности» иммунной системы). Пока обе гипотезы не доказаны. Достоверные сведения о наличии связи между лейкозами и вирусными заболеваниями получены только для Т-клеточных лейкозов у взрослых больных, проживающих в странах Азии.
Вероятность развития острого лимфобластного лейкоза повышается при контакте матери с некоторыми токсическими веществами в период гестации, при некоторых генетических аномалиях (анемии Фанкони, синдроме Дауна, синдроме Швахмана, синдроме Клайнфельтера, синдроме Вискотта-Олдрича, нейрофиброматозе, целиакии, наследственно обусловленных иммунных нарушениях), наличии онкологических заболеваний в семейном анамнезе и приеме цитостатиков. Некоторые специалисты отмечают возможное негативное влияние курения.
Симптомы острого лимфобластного лейкоза
Болезнь развивается стремительно. К моменту постановки диагноза суммарная масса лимфобластов в организме может составлять 3-4% от общей массы тела, что обусловлено бурной пролиферацией клеток злокачественного клона на протяжении 1-3 предыдущих месяцев. В течение недели количество клеток увеличивается примерно вдвое. Различают несколько синдромов, характерных для острого лимфобластного лейкоза: интоксикационный, гиперпластический, анемический, геморрагический, инфекционный.
Интоксикационный синдром включает в себя слабость, утомляемость, лихорадку и потерю веса. Повышение температуры может провоцироваться как основным заболеванием, так и инфекционными осложнениями, которые особенно часто развиваются при наличии нейтропении. Гиперпластический синдром при остром лимфобластном лейкозе проявляется увеличением лимфоузлов, печени и селезенки (в результате лейкемической инфильтрации паренхимы органов). При увеличении паренхиматозных органов могут появляться боли в животе. Увеличение объема костного мозга, инфильтрация надкостницы и тканей суставных капсул могут становиться причиной ломящих костно-суставных болей.
О наличии анемического синдрома свидетельствуют слабость, головокружения, бледность кожи и учащение сердечных сокращений. Причиной развития геморрагического синдрома при остром лимфобластном лейкозе становятся тромбоцитопения и тромбозы мелких сосудов. На коже и слизистых выявляются петехии и экхимозы. При ушибах легко возникают обширные подкожные кровоизлияния. Наблюдаются повышенная кровоточивость из ран и царапин, кровоизлияния в сетчатку, десневые и носовые кровотечения. У некоторых больных острым лимфобластным лейкозом возникают желудочно-кишечные кровотечения, сопровождающиеся кровавой рвотой и дегтеобразным стулом.
Иммунные нарушения при остром лимфобластном лейкозе проявляются частым инфицированием ран, царапин и следов от уколов. Могут развиваться различные бактериальные, вирусные и грибковые инфекции. При увеличении лимфатических узлов средостения отмечаются нарушения дыхания, обусловленные уменьшением объема легких. Дыхательная недостаточность чаще обнаруживается при Т-клеточном остром лимфобластном лейкозе. Нейролейкозы, спровоцированные инфильтрацией оболочек спинного и головного мозга, чаще отмечаются во время рецидивов.
При вовлечении ЦНС выявляются положительные менингеальные симптомы и признаки повышения внутричерепного давления (отек дисков зрительных нервов, головная боль, тошнота и рвота). Иногда поражение ЦНС при остром лимфобластном лейкозе протекает бессимптомно и диагностируется только после исследования цереброспинальной жидкости. У 5-30% мальчиков появляются инфильтраты в яичках. У пациентов обоих полов на коже и слизистых оболочках могут возникать багрово-синюшные инфильтраты (лейкемиды). В редких случаях наблюдаются выпотной перикардит и нарушения функции почек. Описаны случаи поражений кишечника.
С учетом особенностей клинической симптоматики можно выделить четыре периода развития острого лимфобластного лейкоза: начальный, разгара, ремиссии, терминальный. Продолжительность начального периода составляет 1-3 месяца. Преобладает неспецифическая симптоматика: вялость, утомляемость, ухудшение аппетита, субфебрилитет и нарастающая бледность кожи. Возможны головные боли, боли в животе, костях и суставах. В период разгара острого лимфобластного лейкоза выявляются все перечисленные выше характерные синдромы. В период ремиссии проявления болезни исчезают. Терминальный период характеризуется прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика острого лимфобластного лейкоза
Диагноз выставляют с учетом клинических признаков, результатов анализа периферической крови и данных миелограммы. В периферической крови пациентов с острым лимфобластным лейкозом выявляются анемия, тромбоцитопения, повышение СОЭ и изменение количества лейкоцитов (обычно - лейкоцитоз). Лимфобласты составляют 15-20 и более процентов от общего количества лейкоцитов. Количество нейтрофилов снижено. В миелограмме преобладают бластные клетки, определяется выраженное угнетение эритроидного, нейтрофильного и тромбоцитарного ростка.
В программу обследования при остром лимфобластном лейкозе входят люмбальная пункция (для исключения нейролейкоза), УЗИ органов брюшной полости (для оценки состояния паренхиматозных органов и лимфатических узлов), рентгенография грудной клетки (для обнаружения увеличенных лимфоузлов средостения) и биохимический анализ крови (для выявления нарушений функции печени и почек). Дифференциальный диагноз острого лимфобластного лейкоза проводят с другими лейкозами, отравлениями, состояниями при тяжелых инфекционных заболеваниях, инфекционным лимфоцитозом и инфекционным мононуклеозом.
Лечение и прогноз при остром лимфобластном лейкозе
Основой терапии являются химиопрепараты. Выделяют два этапа лечения ОЛЛ: этап интенсивной терапии и этап поддерживающей терапии. Этап интенсивной терапии острого лимфобластного лейкоза включает в себя две фазы и длится около полугода. В первой фазе осуществляют внутривенную полихимиотерапию для достижения ремиссии. О состоянии ремиссии свидетельствуют нормализация кроветворения, наличие не более 5% бластов в костном мозге и отсутствие бластов в периферической крови. Во второй фазе проводят мероприятия для продления ремиссии, замедления или прекращения пролиферации клеток злокачественного клона. Введение препаратов также осуществляют внутривенно.
Продолжительность этапа поддерживающей терапии при остром лимфобластном лейкозе составляет около 2 лет. В этот период больного выписывают на амбулаторное лечение, назначают препараты для перорального приема, осуществляют регулярные обследования для контроля над состоянием костного мозга и периферической крови. План лечения острого лимфобластного лейкоза составляют индивидуально с учетом уровня риска у конкретного больного. Наряду с химиотерапией используют иммунохимиотерапию, радиотерапию и другие методики. При низкой эффективности лечения и высоком риске развития рецидивов осуществляют трансплантацию костного мозга. Средняя пятилетняя выживаемость при В-клеточном остром лимфобластном лейкозе в детском возрасте составляет 80-85%, во взрослом - 35-40%. При Т-лимфобластном лейкозе прогноз менее благоприятен.
Лейкоз у детей
Лейкоз у детей - злокачественное заболевание крови, характеризующееся опухолевой пролиферацией незрелых клеток-предшественников лейкоцитов. Клинические проявления лейкоза у детей могут включать увеличение лимфатических узлов, геморрагический синдром, боли в костях и суставах, гепатоспленомегалию, поражение ЦНС и др. Диагностике лейкоза у детей способствует развернутый общий анализ крови, проведение стернальной пункции с исследованием пунктата костного мозга. Лечение лейкоза у детей проводится в специализированных гематологических стационарах с помощью химиотерапии, иммунотерапии, заместительной терапии, трансплантации костного мозга.

Лейкоз у детей (лейкемия) - системный гемобластоз, сопровождающийся нарушением костномозгового кроветворения и замещением нормальных клеток крови незрелыми бластными клетками лейкоцитарного ряда. В детской онкогематологии частота лейкозов составляет 4-5 случаев на 100 тыс. детей. Согласно статистике, острый лейкоз является самым частым онкологическим заболеванием детского возраста (примерно 30%); наиболее часто рак крови поражает детей в возрасте 2-5 лет. Актуальной проблемой педиатрии служит наблюдаемая в последние годы тенденция к росту заболеваемости лейкозами среди детей и сохраняющаяся высокая летальность.

Причины лейкоза у детей
Некоторые аспекты развития лейкоза у детей до настоящего времени остаются неясными. На современном этапе доказано этиологическое влияние радиационного излучения, онкогенных вирусных штаммов, химических факторов, наследственной предрасположенности, эндогенных нарушений (гормональных, иммунных) на частоту возникновения лейкоза у детей. Вторичный лейкоз может развиться у ребенка, перенесшего в анамнезе лучевую или химиотерапию по поводу другого онкологического заболевания.
На сегодняшней день механизмы развития лейкоза у детей принято рассматривать с точки зрения мутационной теории и клоновой концепции. Мутация ДНК кроветворной клетки сопровождается сбоем дифференцировки на стадии незрелой бластной клетки с последующей пролиферацией. Таким образом, лейкозные клетки - есть не что иное, как клоны мутировавшей клетки, неспособные к дифференцировке и созреванию и подавляющие нормальные ростки кроветворения. Попадая в кровь, бластные клетки разносятся по всему организму, способствуя лейкемической инфильтрации тканей и органов. Метастатическое проникновение бластных клеток через гематоэнцефалический барьер приводит к инфильтрации оболочек и вещества головного мозга и развитию нейролейкоза.
Отмечено, что у детей с болезнью Дауна лейкоз развивается в 15 раз чаще, чем у других детей. Повышенный риск развития лейкоза и других опухолей имеется у детей с синдромами Ли-Фраумени, Клайнфельтера, Вискотт-Олдрича, Блума, анемией Фанкони, первичными иммунодефицитами (Х-сцепленной агаммаглобулинемией, атаксией-телеангиэктазией Луи-Барр и др.), полицитемией и др.
Классификация лейкоза у детей
На основании продолжительности заболевания выделяют острую (до 2-х лет) и хроническую (более 2-х лет) формы лейкоза у детей. У детей в абсолютном большинстве случаев (97%) встречаются острые лейкозы. Особую форму острого лейкоза у детей представляет врожденный лейкоз.
С учетом данных морфологических характеристик опухолевых клеток острые лейкозы у детей делятся на лимфобластные и нелимфобластные. Лимфобластный лейкоз развивается при бесконтрольной пролиферации незрелых лимфоцитов - лимфобластов и может быть трех типов: L1 - с малыми лимфобластами; L2 - с большими полиморфными лимфобластами; L3 - с большими полиморфными лимфобластами с вакуолизацией цитоплазмы. По антигенным маркерам различают 0-клеточные (70-80%), Т-клеточные (15-25%) и В-клеточные (1-3%) острые лимфобластные лейкозы у детей. Среди острых лимфобластных лейкозов у детей чаще встречается лейкоз с клетками типа L1.
В ряду нелимфобластных лейкозов, в зависимости от преобладания тех или иных бластных клеток, различают миелобластный малодифференцированный (M1), миелобластный высокодифференцированный (М2), промиелоцитарный (М3), миеломонобластный (М4), монобластный (М5), эритромиелоз (М6), мегакариоцитарный (М7), эозинофильный (М8), недифференцированный (М0) лейкоз у детей.
В клиническом течении лейкоза у детей выделяют 3 стадии, с учетом которых выстраивается лечебная тактика.
- I - острая фаза лейкоза у детей; охватывает период от манифестации симптомов до улучшения клинико-гематологических показателей в результате проводимой терапии;
- II - неполная или полная ремиссия. При неполной ремиссии отмечается нормализация гемограммы и клинических показателей; количество бластных клеток в пунктате костного мозга составляет не более 20%. Полная ремиссия характеризуется наличием в миелограмме не более 5% бластных клеток;
- III - рецидив лейкоза у детей. На фоне гематологического благополучия появляются экстрамедуллярные очаги лейкозной инфильтрации в нервной системе, яичках, легких и др. органах.
Симптомы лейкоза у детей
В большинстве случаев клиника лейкоза развивается исподволь и характеризуется неспецифическими симптомами: утомляемостью ребенка, нарушением сна, снижением аппетита, оссалгиями и артралгиями, немотивированным повышением температуры тела. Иногда лейкоз у детей манифестирует внезапно с интоксикационного или геморрагического синдрома.
У детей, страдающих лейкозом, отмечается выраженная бледность кожных покровов и слизистых оболочек; иногда кожа приобретает желтушный или землистый оттенок. Вследствие лейкемической инфильтрации слизистых оболочек у детей нередко возникают гингивит, стоматит, тонзиллит. Лейкемическая гиперплазия лимфатических узлов проявляется лимфаденопатией; слюнных желез - сиаладенопатией; печени и селезенки - гепатоспленомегалией.
Для течения острого лейкоза у детей типичен геморрагический синдром, характеризующийся кровоизлияниями в кожу и слизистые, гематурией, носовыми, маточными, желудочно-кишечными, легочными кровотечениями, кровоизлияниями в полость суставов и др. Закономерным спутником острого лейкоза у детей является анемический синдром, обусловленный угнетением эритропоэза и кровотечениями. Выраженность анемии у детей зависит от степени пролиферации бластных клеток в костном мозге.
Кардиоваскулярные расстройства при лейкозах у детей могут выражаться развитием тахикардии, аритмии, расширением границ сердца (по данным рентгенографии органов грудной клетки), диффузными изменениями миокарда (по данным ЭКГ), снижением фракции выброса (по данным ЭхоКГ).
Интоксикационный синдром, сопровождающий течение лейкоза у детей, протекает со значительной слабостью, лихорадкой, потливостью, анорексией, тошнотой и рвотой, гипотрофией. Проявлениями иммунодефицитного синдрома при лейкозе у детей служит наслоение инфекционно-воспалительных процессов, которые могут принимать тяжелое, угрожающее течение. Гибель детей, страдающих лейкозом, нередко происходит вследствие тяжелой пневмонии или сепсиса.
Крайне опасным осложнением лейкоза у детей является лейкемическая инфильтрация головного мозга, мозговых оболочек и нервных стволов. Нейролейкоз сопровождается головокружением, головной болью, тошнотой, диплопией, ригидностью затылочных мышц. При инфильтрации вещества спинного мозга возможно развитие парапареза ног, нарушения чувствительности, тазовых расстройств.
Ведущая роль в первичном выявлении лейкозов у детей принадлежит педиатру; дальнейшее обследование и ведение ребенка осуществляется детским онкогематологом. Основу диагностики лейкозов у детей составляют лабораторные методы: исследование периферической крови и костного мозга.
При остром лейкозе у детей выявляются характерные изменения в общем анализе крови: анемия; тромбоцитопения, ретикулоцитопения, высокая СОЭ; лейкоцитоз различной степени или лейкопения (редко), бластемия, исчезновение базофилов и эозинофилов. Типичным признаком служит феномен «лейкемического провала» - отсутствие промежуточных форм (юных, палочкоядерных, сегментоядерных лейкоцитов) между зрелыми и бластными клетками.
Стернальная пункция и исследование миелограммы являются обязательными в диагностике лейкоза у детей. Решающим аргументом в пользу заболевания служит содержание бластных клеток от 30% и выше. При отсутствии четких данных за лейкоз у детей по результатам исследования костного мозга, прибегают к трепанобиопсии (пункции подвздошной кости). Для определения различных вариантов острого лейкоза у детей выполняются цитохимические, иммунологические и цитогенетические исследования. С целью подтверждения диагноза нейролейкоза проводится консультация детского невролога и детского офтальмолога, люмбальная пункция и исследование цереброспинальной жидкости, рентгенография черепа, офтальмоскопия.
Вспомогательное диагностическое значение имеют УЗИ лимфатических узлов, УЗИ слюнных желез, УЗИ печени и селезенки, УЗИ мошонки у мальчиков, рентгенография органов грудной клетки, КТ у детей (для выявления метастазов в различных анатомических регионах). Дифференциальную диагностику лейкозов у детей следует проводить с лейкозоподобной реакцией, наблюдаемой при тяжелых формах туберкулеза, коклюше, инфекционном мононуклеозе, цитомегаловирусной инфекции, сепсисе и имеющей обратимый транзиторный характер.
Лечение лейкоза у детей
Дети с лейкозами госпитализируются в специализированные учреждения онкогематологического профиля. В целях профилактики инфекционных осложнений ребенок помещается в отдельный бокс, условия в котором максимально приближенны к стерильным. Большое внимание уделяется питанию, которое должно быть полноценным и сбалансированным.
Основу лечения лейкозов у детей составляет полихимиотерапия, направленная на полную эрадикацию лейкозного клона. Протоколы лечения, используемые при острых лимфобластных и миелобластных лейкозах, различаются комбинацией химиопрепаратов, их дозами и способами введения. Поэтапное лечение острого лейкоза у детей предполагает достижение клинико-гематологической ремиссии, ее консолидацию (закрепление), поддерживающую терапию, профилактику или лечение осложнений.
В дополнение к химиотерапии может проводиться активная и пассивная иммунотерапия: введение лейкозных клеток, вакцины БЦЖ, противооспенной вакцины, интерферонов, иммунных лимфоцитов и др. Перспективными методами лечения лейкоза у детей служит трансплантация костного мозга, пуповинной крови, стволовых клеток.
Симптоматическая терапия при лейкозах у детей включает переливание эритроцитарной и тромбоцитарной массы, проведение гемостатической терапии, антибиотикотерапию инфекционных осложнений, дезинтоксикационные мероприятия (внутривенные инфузии, гемосорбцию, плазмосорбцию, плазмаферез).
Прогноз лейкоза у детей
Перспективы развития заболевания определяются многими факторами: возрастом возникновения лейкоза, цитоиммунологическим вариантом, стадией диагностирования и т. д. Худший прогноз следует ожидать у детей, заболевших острым лейкозом в возрасте до 2-х лет и старше 10-ти лет; имеющих лимфаденопатию и гепатоспленомегалию, а также нейролейкоз на момент установления диагноза; Т- и В-клеточные варианты лейкоза, бластный гиперлейкоцитоз. Прогностически благоприятными факторами служат острый лимфобластный лейкоз L1 типа, раннее начало лечения, быстрое достижение ремиссии, возраст детей от 2 до 10 лет. У девочек с острым лимфобластным лейкозом вероятность излечение несколько выше, чем у мальчиков.
Отсутствие специфического лечения лейкоза у детей сопровождается 100%-ной летальностью. На фоне современной химиотерапии пятилетнее безрецидивное течение лейкоза отмечается у 50-80% детей. О вероятном выздоровлении можно говорить после 6-7 лет отсутствия рецидива. Во избежание провокации рецидива детям не рекомендуется физиотерапевтическое лечение, изменение климатических условий. Вакцинопрофилактика проводится по индивидуальному календарю с учетом эпидемической ситуации.
Острый лейкоз
Острый лейкоз - опухолевое поражение кроветворной системы, морфологической основой которого выступают незрелые (бластные) клетки, вытесняющие нормальные гемопоэтические ростки. Клиническая симптоматика острого лейкоза представлена прогрессирующей слабостью, немотивированным подъемом температуры, артралгиями и оссалгиями, кровотечениями различных локализаций, лимфаденопатией, гепатоспленомегалией, гингивитами, стоматитами, ангинами. Для подтверждения диагноза необходимо исследование гемограммы, пунктата костного мозга, биоптата подвздошной кости и лимфоузлов. Основу лечения острых лейкозов составляют химиотерапевтические курсы и сопроводительная терапия.


Острый лейкоз - форма лейкемии, при которой нормальное костномозговое кроветворение вытесняется мало дифференцированными клетками-предшественниками лейкоцитов с их последующим накоплением в периферической крови, инфильтрацией тканей и органов. Термины «острый лейкоз» и «хронический лейкоз» отражают не только длительность течения заболевания, но также морфологическую и цитохимическую характеристику опухолевых клеток. Острый лейкоз является наиболее частой формой гемобластозов: он развивается у 3-5 из 100 тыс. человек; соотношение взрослых и детей - 3:1. При этом у лиц старше 40 лет статистически чаще диагностируется острый миелоидный лейкоз, а у детей - острый лимфобластный лейкоз.
Причины острого лейкоза
Первопричиной острого лейкоза является мутация гемопоэтической клетки, дающей начало опухолевому клону. Мутация кроветворной клетки приводит к нарушению ее дифференцировки на ранней стадии незрелых (бластных) форм с дальнейшей пролиферацией последних. Образующиеся опухолевые клетки замещают нормальные ростки гемопоэза в костном мозге, а в дальнейшем выходят в кровь и разносятся в различные ткани и органы, вызывая их лейкемическую инфильтрацию. Все бластные клетки несут в себе одинаковые морфологические и цитохимические признаки, что свидетельствует в пользу их клонального происхождения от одной клетки-родоначальницы.
Причины, запускающие мутационный процесс, не известны. В гематологии принято говорить о факторах риска, повышающих вероятность развития острого лейкоза. В первую очередь, это генетическая предрасположенность: наличие в семье больных с острым лейкозом практически утраивает риск заболевания у близких родственников. Риск возникновения острого лейкоза повышается при некоторых хромосомных аномалиях и генетических патологиях - болезни Дауна, синдроме Клайнфельтера, Вискотта-Олдрича и Луи-Барра, анемии Фанкони и др.
Вероятно, что активация генетической предрасположенности происходит под действием различных экзогенных факторов. В числе последних могут выступать ионизирующая радиация, химические канцерогены (бензол, мышьяк, толуол и др.), цитостатические препараты, используемые в онкологии. Нередко острый лейкоз становится следствием противоопухолевой терапии других гемобластозов - лимфогранулематоза, неходжкинских лимфом, миеломной болезни. Подмечена связь острых лейкозов с предшествующими вирусными инфекциями, угнетающими иммунную систему; сопутствующими гематологическими заболеваниями (некоторыми формами анемий, миелодисплазиями, пароксизмальной ночной гемоглобинурией и др.).
Классификация острого лейкоза
В онкогематологии общепринята международная FAB-классификация острых лейкозов, дифференцирующая различные формы заболевания в зависимости от морфологии опухолевых клеток на лимфобластные (вызываемые низкодифференцированными предшественниками лимфоцитов) и нелимфобластные (объединяющие остальные формы).
1. Острые лимфобластные лейкозы взрослых и детей:
- пре-В-форма
- В-форма
- пре-Т-форма
- Т-форма
- ни Т ни В-форма
2. Острые нелимфобластные (миелоидные) лейкозы:
- о. миелобластный (вызван неконтрорлируемой пролиферацией предшественников гранулоцитов)
- о. моно- и о. миеломонобластный (характеризуются усиленным размножением монобластов)
- о. мегакариобластный (связан с преобладанием недифференцированных мегакариоцитов - предшественников тромбоцитов)
- о. эритробластный (обусловлен пролиферацией эритробластов)
3. Острый недифференцированный лейкоз.
Течение острых лейкозов проходит ряд стадий:
- I (начальную) - преобладают общие неспецифические симптомы.
- II (развернутую) - характеризуется четко выраженными клиническими и гематологическими симптомами гемобластоза. Включает: дебют или первую «атаку», неполную или полную ремиссию, рецидив или выздоровление
- III (терминальную) - характеризуется глубоким угнетением нормального гемопоэза.

Симптомы острого лейкоза
Манифестация острого лейкоза может быть внезапной или стертой. Типично начало, характеризующееся высокой лихорадкой, интоксикацией, потливостью, резким упадком сил, анорексией. Во время первой «атаки» больные отмечают упорные боли в мышцах и костях, артралгии. Иногда начальная стадия острого лейкоза маскируется под ОРВИ или ангину; первыми признаками лейкемии могут быть язвенный стоматит или гиперпластический гингивит. Довольно часто заболевание обнаруживается случайно при профилактическом исследовании гемограммы или ретроспективно, когда острый лейкоз переходит в следующую стадию.
В развернутом периоде острого лейкоза развиваются анемический, геморрагический, интоксикационный и гиперпластический синдромы.
Анемические проявления обусловлены нарушением синтеза эритроцитов, с одной стороны, и повышенной кровоточивостью - с другой. Они включают бледность кожных покровов и слизистых, постоянную усталость, головокружение, сердцебиение, повышенное выпадение волос и ломкость ногтей и др. Усиливается выраженность опухолевой интоксикации. В условиях абсолютной лейкопении и упадка иммунитета легко присоединяются различные инфекции: пневмонии, кандидоз, пиелонефрит и т. д.
В основе геморрагического синдрома лежит выраженная тромбоцитопения. Диапазон геморрагических проявлений колеблется от мелких единичных петехий и синяков до гематурии, десневых, носовых, маточных, желудочно-кишечных кровотечений и пр. По мере прогрессирования острого лейкоза кровотечения могут становиться все массивнее вследствие развития ДВС-синдрома.
Гиперпластический синдром связан с лейкемической инфильтрацией как костного мозга, так и других органов. У больных острым лейкозом наблюдается увеличение лимфоузлов (периферических, медиастинальных, внутрибрюшных), гипертрофия миндалин, гепатоспленомегалия. Могут возникать лейкозные инфильтраты кожи (лейкемиды), оболочек мозга (нейролейкоз), поражение легких, миокарда, почек, яичников, яичек и др. органов.
Полная клинико-гематологическая ремиссия характеризуется отсутствием внекостномозговых лейкемических очагов и содержанием бластов в миелограмме менее 5% (неполная ремиссия - менее 20%). Отсутствие клинико-гематологических проявлений в течение 5 лет расценивается как выздоровление. В случае увеличения бластных клеток в костном мозге более 20%, их появления в периферической крови, а также выявления внекостномозговых метастатических очагов диагностируется рецидив острого лейкоза.
Терминальная стадия острого лейкоза констатируется при неэффективности химиотерапевтического лечения и невозможности достижения клинико-гематологической ремиссии. Признаками данной стадии служат прогрессирование опухолевого роста, развитие несовместимых с жизнью нарушений функции внутренних органов. К описанным клиническим проявлениям присоединяются гемолитическая анемия, повторные пневмонии, пиодермии, абсцессы и флегмоны мягких тканей, сепсис, прогрессирующая интоксикация. Причиной смерти больных становятся некупируемые кровотечения, кровоизлияния в мозг, инфекционно-септические осложнения.
Диагностика острого лейкоза
Во главе диагностики острых лейкозов стоит оценка морфологии клеток периферической крови и костного мозга. Для гемограммы при лейкемии характерна анемия, тромбоцитопения, высокая СОЭ, лейкоцитоз (реже лейкопения), присутствие бластных клеток. Показателен феномен «лейкемического зияния» - промежуточные стадии между бластами и зрелыми клетками отсутствуют.
С целью подтверждения и идентификации разновидности острого лейкоза выполняется стернальная пункция с морфологическим, цитохимическим и иммунофенотипическим исследованием костного мозга. При исследовании миелограммы обращает внимание увеличение процента бластных клеток (от 5% и выше), лимфоцитоз, угнетение красного ростка кроветворения (кроме случаев о. эритромиелоза) и абсолютное снижение или отсутствие мегакариоцитов (кроме случаев о. мегакариобластного лейкоза). Цитохимические маркерные реакции и иммунофенотипирование бластных клеток позволяют точно установить форму острого лейкоза. При неоднозначности трактовки анализа костного мозга прибегают к проведению трепанобиопсии.
С целью исключения лейкемической инфильтрации внутренних органов производится спинномозговая пункция с исследованием ликвора, рентгенография черепа и органов грудной клетки, УЗИ лимфатических узлов, печени и селезенки. Кроме гематолога, больные острым лейкозом должны быть осмотрены неврологом, офтальмологом, отоларингологом, стоматологом. Для оценки тяжести системных нарушений может потребоваться исследование коагулограммы, биохимического анализа крови, проведение электрокардиографии, ЭхоКГ и др.
Дифференциально-диагностические мероприятия направлены на исключение ВИЧ-инфекции, инфекционного мононуклеоза, цитомегаловирусной инфекции, коллагенозов, тромбоцитопенической пурпуры, агранулоцитоза; панцитопении при апластической анемии, В12 и фолиеводефицитной анемии; лейкемоидных реакций при коклюше, туберкулезе, сепсисе и др. заболеваниях.

Лечение острого лейкоза
Пациентов с острым лейкозом лечат в стационарах онкогематологического профиля. В палатах организуется усиленный санитарно-дезинфекционный режим. Больные с острым лейкозом нуждаются в проведении гигиенической обработки полости рта, профилактики пролежней, туалета половых органов после физиологических отправлений; организации высококалорийного и витаминизированного питания.
Непосредственно лечение острых лейкозов проводится последовательно; основные этапы терапии включают достижение (индукцию) ремиссии, ее закрепление (консолидацию) и поддержание, профилактику осложнений. Для этого разработаны и используются стандартизированные схемы полихимиотерапии, которые подбираются гематологом с учетом морфологической и цитохимической формы острого лейкоза.
При благоприятной ситуации ремиссия обычно достигается в течение 4-6 недель усиленной терапии. Затем, в рамках консолидации ремиссии проводится еще 2-3 курса полихимиотерапии. Поддерживающая противорецидивная терапия осуществляется еще в течение не менее 3-х лет. Наряду с химиотерапией при остром лейкозе необходимо проведение сопроводительного лечения, направленного на предупреждение агранулоцитоза, тромбоцитопении, ДВС-синдрома, инфекционных осложнений, нейролейкемии (антибиотикотерапия, переливание эритроцитарной, тромбоцитарной массы и свежезамороженной плазмы, эндолюмбальное введение цитостатиков). При лейкемической инфильтрации глотки, средостения, яичек и др. органов проводится рентгенотерапия очагов поражения.
В случае успешного лечения достигается уничтожение клона лейкозных клеток, нормализация кроветворения, что способствует индукции длительного безрецидивного периода и выздоровления. Для предупреждения рецидивов острого лейкоза может быть проведена трансплантация костного мозга после предварительного кондиционирования путем химиотерапии и тотального облучения.
По имеющимся статистическим сведениям, использование современных цитостатических средств приводит к переходу острого лейкоза в фазу ремиссии у 60-80% больных; из них у 20-30% удается добиться полного выздоровления. В целом прогноз при острых лимфобластных лейкозах более благоприятен, чем при миелобластных.
Остеогенная саркома у детей
Остеогенная саркома — это высокоагрессивная злокачественная опухоль, клетки которой образуют так называемый опухолевый остеоид (незрелая костная ткань). Это единственная опухоль, возникающая непосредственно из костной ткани.
Остеосаркома составляет 3 % от всех злокачественных новообразований у детей. Частота ее встречаемости 2-3 случая на 1 млн детей и подростков в год. Заболевание чаще всего берет начало на втором десятилетии жизни.
Как правило, опухоль поражает длинные кости конечностей (около 80 % всех случаев). Чаще всего первичный очаг локализуется в бедренной кости (около 45 % случаев), большеберцовой кости (18-20 %) и плечевой кости (10 %). Остальные случаи приходятся на редкие локализации: кости черепа (8 %), кости таза (8 %) (рис. 1).
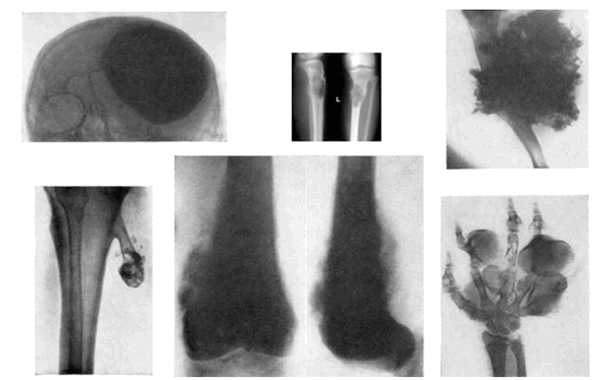
Рис.1: Варианты локализации остеосаркомы
На что родителям необходимо обратить внимание
Боль
Первым значимым симптомом являются нарастающие боли в пораженной конечности. Через некоторое время боли становятся нестерпимыми, лишающими сна, они могут появиться как при нагрузке, так и в покое и не купируются обычными анальгетиками.
Припухлость
Пораженный отдел кости увеличивается в объеме, мягкие ткани над ним становятся припухшими, на коже возникают флебэктазии (сеть мелких расширенных вен).
Нарушение функции пораженной конечности. Ограничение подвижности в рядом расположенном суставе
При локализации остеогенной саркомы в костях нижних конечностей движения в суставах становятся затрудненными, со временем развивается хромота. К позднему симптому данного заболевания можно отнести патологический перелом в зоне первичного очага.
Основная проблема поздней диагностики остеогенной саркомы связана с тем, что длительное время локальная боль связывается с предшествующей травмой конечности. Но при этом выраженность и длительность болевых симптомов не сопоставляется с объёмом травмы.
К сожалению, боль в конечностях у детей и подростков часто остается незамеченной или недооцененной и ассоциируется в первую очередь с «болями роста», в результате чего ребенок длительно получает анальгетическую терапию без эффекта.
Продолжительность болевого синдрома, его выраженный характер, не соотносимый с предшествующими травматическими изменениями, всегда является поводом для расширенного диагностического поиска.
Диагностика
При подозрении на остеогенную саркому диагностический поиск ведут такие специалисты, как детский онколог, детский хирург, патоморфолог, рентгенолог. Окончательный диагноз устанавливается на основании результатов гистологического исследования.
При первой встрече с юным пациентом врач собирает анамнез, уточняет информацию о наличии или отсутствии каких-либо хронических заболеваний опорно-двигательного аппарата, предшествующих травмах, оперативных вмешательствах, наследственных синдромах, семейной наследственной онкологической патологии. Клинический осмотр пациента включает оценку очага пораженной конечности, регионарных лимфатических узлов, физикального статуса (общего состояния больного).
Диагностический поиск состоит из следующих исследований:
- рентгенография зоны поражения;
- компьютерная томография (КТ) с контрастным усилением пораженной опухолью зоны и органов грудной клетки;
- остеосцинтиграфия;
- магнитно-резонансная томография пораженной зоны.
Наиболее распространенным и простым методом диагностики остеогенной саркомы, выполнение которого возможно на амбулаторном этапе обследования, является рентгенографическое исследование пораженной конечности. Не исключены ситуации, когда образование является случайной находкой при рентгенографии, выполненной по поводу травматического повреждения. В таких ситуациях пациенту показано дообследование.
Характерные рентгенологические признаки остеогенной саркомы (рис. 2):
- деструкция и склероз костной ткани в зоне поражения;
- периостальный козырек Кодмена, представляющий из себя отслоенную опухолью надкостницу;
- игольчатый периостит с множественными костными иглами-спикулами;
- очаги патологического костеобразования в мягких тканях (поля оссификации) в области образования;
- патологический перелом пораженной конечности.
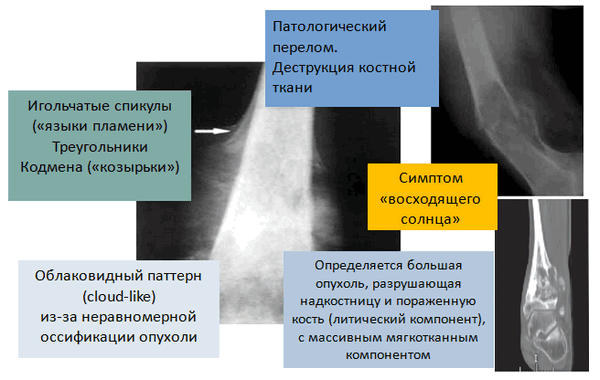
Рис. 2. Рентгенологические признаки остеогенной саркомы
Для более четкой визуализации процесса, уточнения размеров образования, распространения, исключения поражения мягких тканей детям показано выполнение компьютерной томографии. Кроме того, этот метод позволяет выполнить оценку первичной опухоли и выявить наличие отдаленных метастатических очагов.
Сцинтиграфия скелета уже долгое время остается стандартным методом диагностики костных поражений, являясь более чувствительной, чем рентгенологические методы. Она позволяет проводить исследование всего тела человека за небольшой промежуток времени. Данное исследование основано на повышении накопления фосфорных соединений в очаге поражения, что свидетельствует об активности процесса, характерного для злокачественных новообразований (рис. 3).
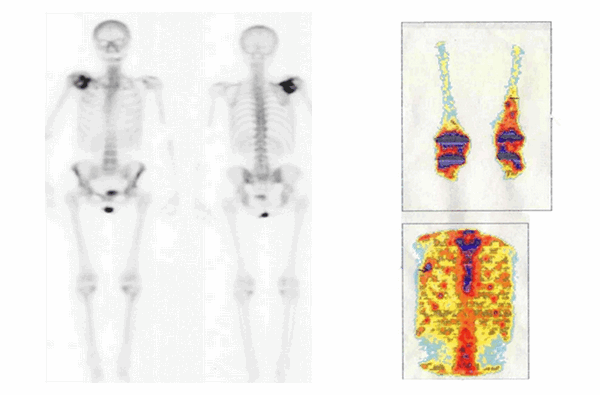
Рис.3. Патологическое накопление радиофармпрепарата (Технеций mTc)
Магнитно-резонансная томография (МРТ) первичного опухолевого очага с захватом смежного сустава является оптимальным методом локального стадирования. МРТ-контроль на фоне системной терапии позволяет оценить динамику процесса и, соответственно, спланировать объем оперативного вмешательства в дальнейшем.
Одним из ключевых этапов диагностики является биопсия образования и последующее гистологическое и иммуногистохимическое исследование полученного материала.
Есть два различных подхода к получению материала: с применением трепан-иглы и открытый тип биопсии. Манипуляция выполняется под КТ или УЗ-навигацией или с применением электронно-оптического преобразователя (рис. 4).
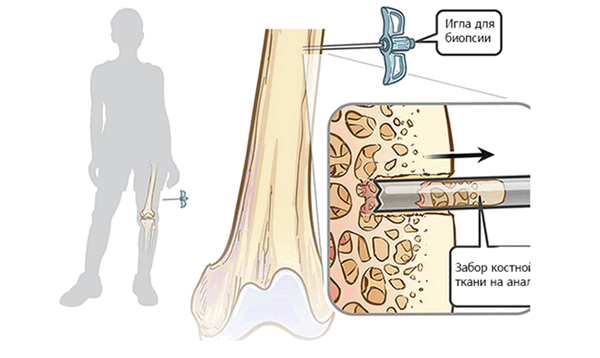
Рис.4: Биопсия с применением трепан-иглы
Классификация
Согласно классификации ВОЗ, выделяют локализованный (местнораспространенный) вариант остеогенной саркомы - 80 % и генерализованный (метастатический) - 20 % случаев. На основании исследования материала, полученного с помощью биопсии, врач патоморфолог дает гистологическую оценку опухоли. Выделяют опухоли центральные (высокой и низкой степени злокачественности), поверхностную, интракортикальную, гнотическую, внескелетную и вторичную - ассоциированную с болезнью Педжета, радиоиндуцированную, как правило, это вариант высокой степени злокачественности.
Помимо гистологической классификации, используется система TNM, которая оценивает размеры опухоли, объем поражения регионарных лимфатических узлов, наличие или отсутствие отдаленных метастазов, степень дифференцировки опухолевой ткани.
На основании данных инструментальных исследований и гистологического заключения проводится стадирование заболевания.
Лечение остеогенной саркомы у детей
Методы лечения остеосаркомы на протяжении последних 20 лет практически не менялись. До настоящего времени основными методами терапии остаются полихимиотерапия и хирургический метод.
Выделяют два варианта хирургического вмешательства:
- органосохраняющий,
- органоуносящий (калечащий).
При отсутствии противопоказаний в большинстве случаев выполняется органосохраняющее лечение, позволяющее помочь ребенку сохранить не только функциональные способности конечности, но и минимизировать косметический дефект. Для этого используются все достижения современной медицины в костной пластике и реконструктивной хирургии.
Эндопротезирование
Эндопротезирование является вариантом органосохраняющего вмешательства. Это операция по замене сустава имплантами, которые имеют анатомическую форму здорового сустава и позволяют выполнять весь объем движений. Чаще используется тотальное эндопротезирование из-за невозможности сохранения сустава (рис. 5).
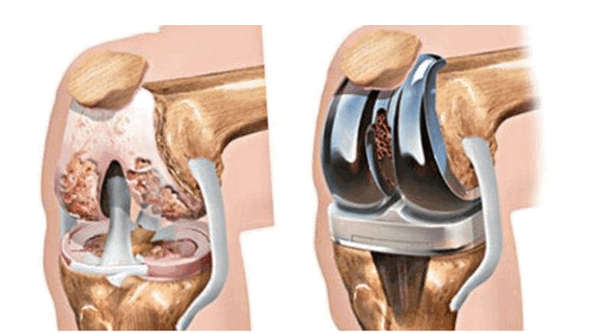
Рис. 5. Тотальное эндопротезирование коленного сустава состоит из трех компонентов: бедренного, большеберцового и надколенникового
Артродезирование
К другим вариантам органосохраняющего вмешательства относится артродезирование. Это хирургическое вмешательство, при котором производится фиксация сустава в постоянном положении. Кости жестко соединяются для полного обездвиживания и скрепляются металлическими фиксаторами (специальные винты, спицы, штифты). Такой сустав обеспечивает опорную и двигательную функцию.
Рис. 6. Артродезирование
Экзопротезирование

Рис.7 Экзопротез верхних конечностей

Рис. 8 Экзопротез нижних конечностей

Рис.9 Экзопротезирование нижней конечности
Ротационная пластика
Ротационная пластика - метод лечения, который является методом выбора по отношению к калечащим операциям ампутации/экзартикуляции. Принцип заключается в резекции пораженной части бедренной кости и ротации голени на 180 о . В этом случае голеностопный сустав берет на себя функцию «коленного сустава» (рис. 10). Показанием к такому виду вмешательства является поражение опухолью дистальной части бедренной кости с выраженным мягкотканным компонентом, когда в опухолевый процесс вовлечены окружающие мягкие ткани и проведение органосохраняющей операции невозможно. При этом необходимым условием для проведения операции является сохранность седалищного нерва.

Рис.10 Ротационная пластика
Химиотерапия
Химиотерапия - это лечение с использованием лекарственных средств, направленных на уничтожение или инактивацию опухолевых клеток.
Лекарственная терапия проводится как до операции (неоадьювантная), так и после операции (адьювантная) с целью уменьшения объема опухоли до хирургического вмешательства и уничтожения субклинических метастазов после.
Существуют пять основных препаратов (цисплатин, адриамицин, метотрексат, ифосфамид, этопозид), которые применяются в различных комбинациях и дозах.
Реабилитация
Реабилитационные мероприятия после хирургического этапа лечения зависят от объема и вида вмешательства. От последнего во многом зависят принципы, длительность и исходы реабилитации.
Для достижения максимального функционального результата необходимо следовать основным принципам реабилитации
- Постепенно увеличивать интенсивность упражнений на область оперативного вмешательства.
- Соблюдать регулярность выполнения упражнений.
- Следует выполнять восстановительную гимнастику, направленную на весь организм.
Реабилитационные мероприятия делятся на несколько этапов, включающих в себя:
- Первый (ранний) период начинается сразу после операции, после удаления дренажной системы. Как правило, это вторые и третьи сутки после операции. Основная задача состоит в том, чтобы упражнения были направлены на минимальную нагрузку в области хирургического вмешательства, при этом с максимальным объемом движений в суставе без нагрузки на мышечные и костные структуры.
- Второй период предполагает постепенное увеличение мышечной активности.
- Третий период направлен на увеличение мышечной массы.
При оперативных вмешательствах на нижних конечностях все этапы реабилитации должны чередоваться с регулярной ходьбой с поэтапным увеличением нагрузки. Первые шаги должны происходить с помощью ходунков, на костылях, с палкой и затем - без опоры.
Прогноз
В прошлом остеогенная саркома относилась к числу злокачественных опухолей с наиболее неблагоприятным прогнозом. Даже при том, что в ходе лечения проводились тяжелые калечащие операции, пятилетняя выживаемость не превышала 5-10 %. В настоящее время в связи появлением новых методов лечения и применением эффективных органосохраняющих операций шансы пациентов на благополучный исход существенно увеличились даже при наличии метастазов в легких. В наши дни общая пятилетняя выживаемость при локализованной остеогенной саркоме составляет более 70 %, в то время как у пациентов с метастатическим вариантом результаты намного хуже (5-летняя общая выживаемость около 35 %).
Прогностически неблагоприятными факторами по-прежнему являются ранее развитие рецидива, множественные очаги и вовлечение плевры (при наличии легочных метастазов).
Список литературы:
- Федеральные клинические рекомендации «Злокачественные новообразования костей и суставных хрящей: остеосаркома, саркома Юинга» (утв. Минздравом России).
- Научно-клинический протокол EURAMOS-1.
- Алиев М.Д. Злокачественные опухоли костей. Саркомы костей, мягких тканей и опухоли кожи 2010; 2:3-8.
- Детская онкология: Клинические рекомендации по лечению пациентов с солидными опухолями. / под редакцией М. Ю. Рыкова, В. Г. Полякова. — М.: ГЭОТАР-Медиа, 2017. -368 с.
- Детская онкология. Национальное руководство / под ред. М Д Алиева [и др.]. — М.: Издательская группа РОНЦ, Практическая медицина, 2012. — 684 с.: ил.

Автор:
Сенчуров Евгений Михайлович
Врач-онколог НМИЦ онкологии им. Н.Н. Петрова
Автор:
Карташова Валерия Владиславовна
ординатор НМИЦ онкологии им. Н.Н. Петрова

Под научной редакцией:
Кулева С.А.
Заведующий детским онкологическим отделением, врач-детский онколог, ведущий научный сотрудник, профессор, доктор медицинских наук, главный внештатный детский специалист-онколог Комитета по здравоохранению Санкт-Петербурга
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Читайте также:
