Передача сигнала с участием протеинкиназы активируемой митогенами (MAPK)
Добавил пользователь Дмитрий К. Обновлено: 22.01.2026
Передача сигнала (сигнальная трансдукция, трансдукция, сигналинг, сигнализация, англ. signal transduction) — в молекулярной биологии термин «Передача сигнала» относится к любому процессу, при помощи которого клетка превращает один тип сигнала или стимула в другой.
Существование сложных многоклеточных организмов возможно благодаря координации биохимических процессов, протекающих в их клетках. Основой такой координации служат межклеточная коммуникация и передача сигнала внутри отдельных клеток. Вместе это даёт возможность одной клетке контролировать поведение остальных.
В большинстве случаев передача сигнала внутри клетки представляет собой цепь последовательных биохимических реакций, осуществляемых ферментами, часть из которых активируется вторичными посредниками. Такие процессы обычно являются быстрыми: их продолжительность — порядка миллисекунд в случае ионных каналов и минут — в случае активации протеинкиназ и липид-опосредованных киназ. Однако в некоторых случаях от получения клеткой сигнала до ответа на него могут проходить часы и даже сутки (в случае экспрессии генов). Пути передачи сигнала, или сигнальные пути, часто бывают организованы как сигнальные каскады (англ. signal cascade): количество молекул белков и других веществ, принимающих участие в передаче сигнала, возрастает на каждом последующем этапе по мере удаления от первоначального стимула. Таким образом, даже относительно слабый стимул может вызывать значительный ответ. Это явление называется амплификацией сигнала. Оригинальный термин en:Signal transduction впервые появился в реферируемых журналах в 1974 году, а в названии статьи фигурировал в 1979 году.
Нарушения в системе передачи сигналов могут привести к развитию рака, аутоиммунных заболеваний и диабета. Понимание механизмов передачи сигнала внутри клетки может привести к разработке методов лечения этих заболеваний и даже созданию искусственных тканей.
Первичные посредники
Первичные посредники — это химические соединения или физические факторы (квант света, звук, внешняя температура, механические воздействия - давление, вибрация, сдвиг и другие), способные активировать механизм передачи сигнала в клетке. По отношению к воспринимающей клетке первичные посредники являются экстраклеточными сигналами. Стоит отметить, что в качестве экстраклеточных стимулов могут выступать и молекулы, в изобилии присутствующие внутри клетки, но находящиеся в норме в очень низкой концентрации в межклеточном пространстве (например, АТФ или глутамат). В зависимости от функций первичные посредники могут быть разделены на несколько групп:
- гормоны
- цитокины
- нейротрансмиттеры
- факторы роста
Рецепторы
Получение клеткой сигнала от первичных посредников обеспечивается особыми белками-рецепторами, для которых первичные посредники являются лигандами. Для обеспечения рецепторной функции молекулы белков должны отвечать ряду требований:
Клеточные рецепторы делятся на следующие классы:
- мембранные
- рецепторные тирозинкиназы
- рецепторы, сопряжённые с G-белками
- ионные каналы
Мембранные рецепторы распознают крупные (например, инсулин) или гидрофильные (например, адреналин) сигнальные молекулы, которые не могут самостоятельно проникать в клетку. Небольшие гидрофобные сигнальные молекулы (например, трийодтиронин, стероидные гормоны, CO, NO) способны проникать в клетку за счёт диффузии. Рецепторы таких гормонов обычно являются растворимыми цитоплазматическими или ядерными белками. После связывания лиганда с рецептором информация об этом событии передаётся дальше по цепи и приводит к формированию первичного и вторичного клеточного ответа.
Механизмы активации рецепторов
Если внешняя сигнальная молекула воздействует на рецепторы клеточной мембраны и активирует их, то последние передают полученную информацию на систему белковых компонентов мембраны, называемую каскадом передачи сигнала. Мембранные белки каскада передачи сигнала подразделяют на:
- белки-преобразователи, связанные с рецепторами
- ферменты-усилители, связанные с белками-преобразователями (активируют вторичные внутриклеточные посредники, переносящие информацию внутрь клетки).
Так действуют рецепторы, сопряженные с G-белками. Другие рецепторы (ионные каналы, рецепторы с протеинкиназной активностью) сами служат умножителями.
Вторичные посредники
Вторичные посредники (англ. second messenger) — это низкомолекулярные вещества, которые образуются или высвобождаются в результате ферментативной активности одного из компонентов цепи передачи сигнала и способствуют его дальнейшей передаче и амплификации. Вторичные посредники характеризуются следующими свойствами: имеют небольшую молекулярную массу и с высокой скоростью диффундируют в цитоплазме; быстро расщепляются и быстро удаляются из цитоплазмы. Ко вторичным посредникам относятся:
- ионы кальция (Ca2+);
- циклический аденозинмонофосфат (цАМФ) и циклический гуанозинмонофосфат (цГМФ)
- инозитолтрифосфат
- липофильные молекулы (например, диацилглицерол);
- оксид азота (NO) (эта молекула выступает и в роли первичного посредника, проникающего в клетку извне).
Иногда в клетке образуются и третичные посредники. Так, обычно ионы Ca2+ выступают в роли вторичного посредника, но при передаче сигнала с помощью инозитолтрифосфата (вторичный посредник) выделяющиеся при его участии из ЭПР ионы Ca2+ служат третичным посредником.
Механизм
Передача сигнала предполагает примерно следующую схему:
Сигнальные пути
Иногда активация рецептора внешним стимулом сразу приводит к ответу клетки. Например, когда нейротрансмиттер ГАМК активирует свой рецептор, входящий в состав ионного канала на поверхности нейрона, канал начинает пропускать ионы хлорида, что приводит к изменению мембранного потенциала всей клетки. В других случаях активация рецептора лишь инициирует цепь событий, передающих регуляторный стимул внутри клетки через более или менее длинную цепь посредников. Такая цепь называется сигнальным путём.
Сигнальный путь Notch относительно короток. Активация этого рецептора позволяет протеазе расщепить его, часть белка может затем попасть в клеточное ядро и выполнять функции регулятора транскрипции. В результате клетка начинает синтезировать другие белки и изменяет своё поведение. Более сложный сигнальный путь инициируют факторы роста. Некоторые из их рецепторов являются киназами и после активации фосфорилируют себя и другие белки, тем самым изменяя способность к межбелковому взаимодействию. Например, эпидермальный фактор роста, связывая свой рецептор, активирует его аутокаталитическое фосфорилирование. Фосфорилированный рецептор может связывать адапторный белок GRB2, передающий сигнал на следующий посредник. Далее это может привести к активации сигнального пути Ras-MAPK/ERK. В нём киназа MAPK/ERK (митоген-активируемая протеинкиназа) может далее активировать фактор транскрипции C-myc и изменять функционирование ряда генов, влияющих на клеточный цикл.
Все под контролем. Твоя MAPK
![]()
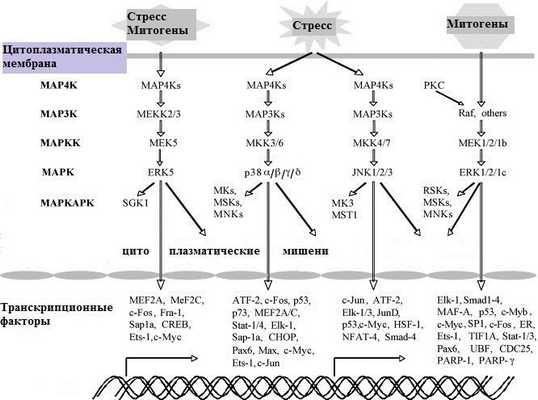
Митоген-активированные протеинкиназы (MAPK, mitogen-activated protein kinase) являются эволюционно консервативными (встречаются у классификационно различных организмов) мультифункциональными сигнальными молекулами, которые играют ключевую роль в преобразовании внеклеточных сигналов во внутриклеточные ответы. У млекопитающих было идентифицировано 14 генов MAP-киназы, которые определяют 7 (известных на сегодняшний день) различных путей MAP-киназы. Многообразие эффектов поражает: они контролируют большое количество фундаментальных клеточных процессов, включая рост, пролиферацию, дифференцировку, движение, стрессовую реакцию, механизмы выживания и апоптоз [1].
Каждый каскад состоит из трех основных киназ (MAP3K, MAPKK и MAPK), а также часто вовлекает дополнительные восходящие (MAP4K) и нисходящие (MAPKAPK) компоненты. Внутри каждого из каскадов сигнал распространяется посредством последовательного фосфорилирования и активации киназ, что в конечном итоге приводит к фосфорилированию целевых регуляторных белков с помощью компонентов MAPK и MAPKAPK.
В настоящее время наиболее изучены четыре различных MAPK-каскада млекопитающих: внеклеточная регулируемая сигналами киназа 1 и 2 (ERK1/2), c-Jun N-терминальная киназа (JNK), p38 и ERK5. Также были идентифицированы другие киназы, которые имеют сходство последовательностей с компонентами перечисленных каскадов MAPK (например, ERK3/4 и ERK7/8).
Каскад ERK1/2 был первым изученным путем MAPK и рассматривается как прототип других киназных каскадов. Он играет центральную роль в передаче сигналов от широкого спектра внеклеточных агентов, которые действуют через различные рецепторы. В большинстве случаев активация таких рецепторов передается несколькими механизмами на небольшую GTPase Ras на плазматических мембранах. В свою очередь, активированный Ras рекрутирует компоненты MAP3K каскада (в основном Raf-1 и B-Raf; Rafs) на плазматическую мембрану, чем вызывает их активацию (рис. 1). После стимуляции ERK1/2, а также компонентов MAPKAPK, фосфорилируются сотни субстратов, ответственных в основном за пролиферацию и дифференцировку, а также морфологию и пластичность нейронов, контроль стрессового ответа и регуляцию апоптоза [2]. При нарушении регуляции этот каскад играет важную роль при различных патологиях: нейродегенеративные заболевания, пороки развития, сахарный диабет и опухолевый рост [3].
![]()
Рисунок 1 | МАРК-сигнальные каскады. Выделены основные стимулирующие факторы, также могут быть множественные дополнительные факторы в различных сочетаниях (суммация).
JNK-каскад был первоначально идентифицирован как регулятор транскрипционного фактора c-Jun и медиатор внутри- или внеклеточного стрессового ответа (стресс-активируемый протеинкиназный (SAPKs) каскад) [4] . Однако, как и остальные MAPK, позже было показано, что он также стимулируется большим количеством стресс-независимых стимулов и рецепторов, включая митогены. Активация происходит путем небольших GTPases (CDC42 и Rac1), которые активируют киназы MAP3K либо напрямую, либо через MAP4K. MAP3K и MAP4K каскады могут быть непосредственно активированы также путем взаимодействия с адапторными белками, такими как TRAF. После активации на уровне MAP3K сигнал идет дальше, фосфорилируя остатки Thr и Ser в петле активации, тем самым активируя киназы уровня MAPKK (MKK4 и MKK7). В свою очередь, эти киназы активируют три компонента на уровне MAPK (JNK1-3; 46 и 54 кДа; JNKs) путем прямого фосфорилирования остатков Tyr и Thr в мотиве Thr-Pro-Tyr их петли активации. Активированные JNKs MAPKAPK фосфорилируют большое количество субстратов (в основном, в ядре, меньшая часть — в цитоплазме). Так происходит контроль апоптоза, иммунного ответа, активности передачи нервного импульса, эффектов инсулина и многое другое. JNKs играют роль в развитии нейродегенеративных заболеваний, включая болезнь Альцгеймера, Паркинсона, боковой амиотрофический склероз и лиссэнцефалию. Также упоминается сахарный диабет, онкопатология [5].
Каскад p38 активируется главным образом на стрессовые сигналы. Эффекторные молекулы аналогичны функционирующим в каскаде JNK. Различия в активации этих двух каскадов опосредованы специфическими каркасными белками, компартментализацией и вариабельными субстратами. Помимо своей роли в реакции на стресс, р38 играют центральную роль в регуляции иммунологических эффектов, апоптоза, клеточного старения, контрольных точек клеточного цикла и регуляции выживания клетки. Это определяет его роль в индукции воспаления, заболеваниях иммунной системы, в том числе аутоиммунных. Кроме того, р38 играет роль в патогенезе сердечно-сосудистых заболеваний: ингибирование его активности оказывает кардиопротекторный эффект. Менее изучен каскад ERK5, который может действовать как фактор транскрипции, что позволяет индуцировать и регулировать пролиферацию, ангиогенез, иммунологические реакции, стрессовый ответ [6].
В ядре клетки МАРК участвуют в регуляции ремоделирования хроматина, что важно для связывания факторов транскрипции с соответствующими промоторами, контролируют ядерную локализацию регуляторных белков, индуцируют ядерно-зависимые точки рестрикции клеточного цикла и модулируют активность ядерных рецепторов.
Источники:Основы биосигнализации: сигнальный путь митоген-активируемой протеинкиназы (MAПК). Лекция 8
Митоген-активируемая протеиникназа (МАП-киназа,
МАПК)
Mitogen-activated protein kinase pathway (MAPK-pathway)
Одним из элементов адаптации метаболизма клеток является
запуск пролиферативных процессов. Быстрый переход к пролиферации актуален в физиологических процессах: иммунный ответ,
регенерация и функционировании стволовых клеток. Пролиферация важна также в процессах роста и формирования тканей и органов.
Митогены (соединения, несущие пролиферативный сигнал):
• цитокины (интерлейкины, интерфероны, ФНО и др.);
• ростовые факторы;
• некоторые гормоны (инсулин);
• медиаторы воспаления;
• некоторые физические факторы.Сигнальный путь (каскад) МАП-киназы - основной путь передачи пролиферативных сигналов. Он действует во всех известных
типах клеток.
Путь МАП-киназы начинается от рецепторов, обладающих
собственной тирозинкиназной активностью. На дистанции от
рецептора до каскада из трёх протеинкиназ, фосфорилирующих и
активирующих транскрипционные факторы, работают ряд
белков-посредников, важнейшим из которых является малый Gбелок (мономер) или белок Ras (Rat sarcoma): Ras/МАП-киназный
путь (Ras/MAPK-pathway).
Путь МАП-киназы «выключен» (неактивен) в полностью дифференцированных и неделящихся клетках. При необходимости
репарации поврежденной ткани МАП-каскад вновь активируется.
Некоторые типы опухолей возникают при нарушении регуляции
каскада (при не «выключении» каскада).
Помимо МАП-киназного пути, эффекты митогенов могут быть
переданы посредством цАМФ (ПКС), JAK - STAT- сигнального
пути и др.Этапы и механизмы формирования
Ras/MAPK - сигнального пути
1. Взаимодействие лиганда (митогена) с рецептором, относящемся к классу рецепторов с собственной тирозин-киназной
активностью. Рецепторы образуют гомодимер (гетеродимер), что
изменяет конформацию цитозольных доменов и сближает их. В
результате открывается собственная тирозин-киназная активность рецептора и происходи аутофосфориирование остатков
тирозина цитозольных доменов.
2. Фосфотирозины становятся докинг-центрами, с которыми
связываются адапторные белки, посредством содержащихся в
них SH2-доменов (Src homology 2). SH2-домены обладают высоким сродством к аминокислотному окружению фосфо-тирозинов.
Таким белком является белок Grb2 (Growth factor receptor-bound
protein 2). Наряду с SH2-доменами, в Grb2 содержатся SH3-домены (Src homology 3). SH3-домены имеют высокое сродство к
последовательности аминокислот в других белках, содержащих
остатки пролина (левозакрученная полипролиновая спираль II
типа).3. Белок Grb2, через свой SH2-домен связан с фосфотирозином
цитозольного домена рецептора. С помощью своего второго домена (SH3-домена), белок Grb2 связывается со следующим белком
«вниз по течению»: SOS (от Son of Sevenless - название мутации
белка GEF у дрозофил) или GEF (guanine nucleotide exchange factor).
Эта способность делает белок Grb2 поливалентным белком.
SOS/GEF обменивает гуаниновые нуклеотиды в составе белка Ras.
Белок Ras (высокогомологичен a-субъединице гетеротримерного G-белка) связан с внутренним слоем плазматической мембраны. В неактивной конформации Ras содержит в нуклеотид-связывающем центре ГДФ (Ras-ГДФ). С помощью белка SOS/GEF ГДФ заменяется на ГТФ и белок Ras переходит в активную конформацию:
Ras-ГТФ. Активированный Ras взаимодействует со следующим
белком «вниз по течению»: с серин-треониновой киназой Raf - с
первой из трёх протеинкиназ МАП-киназного каскада. В результате такого взаимодействия киназа Raf активируется.Инактивация мономерного белка Ras происходит благодаря его
собственной ГТФазной активности: гидролиз ГТФ до ГДФ + Фн в
нуклеотид-связывающем центре. Исходно ГТФ-азная активность
в Ras невелика. Стимулирует ГТФазную активность специальный
белок GAP (GTPase activating protein): повышает GTPазную активность более, чем в 100 раз.
NB: Активированный белок Ras имеет и другие мишени:
- фосфатидилинозитол-3-киназу (PI3K);
- протеинкиназу С;
- другие белки.Участие белка Ras в активации
каскада МАП-киназы
1.
2.
3.
Каскад (сигнальный путь) назван
по имени последней (на схеме № 3)
киназы: митоген активируемой
протеин киназы (МАПК). МАРК -
серин-треониновая протеинкиназа.
МАРК активируется с участием
Киназный лежащей «выше по течению»
каскад
тирозин-треониновой киназы киназы МАР киназы (МАР2К, на
схеме № 2).
Транскрипционный факторТерминология названий протеинкиназ, составляющих
МАРК-сигнальный путь
Ras
Киназа № 1
серин-треониновая
киназа
Киназа № 2
тирозин-треониновая
киназа
В своей активной конформации
(Ras-ГТФ) взаимодействует с
N-концевым доменом Raf и
активирует киназу
Raf
MAP2K
или
киназа МАР-киназы
Киназа № 3
серин-треониновая
киназа
MAPK
=
Транскрипционный
фактор
MEK: Mitogen Extracellular
Signal Regulated
=
Kinase
ERK: Extracellular Signal
Regulated Kinase1
3
2
Этап протеинкиназного
каскада передачи внешнего
регуляторного сигнала,
следующего за активацией
белка Ras.
.
Стадия 1. Связыване Raf с активным Ras
3
1
2
МЕК
Стадия 2. Связывание и фосфорилирование
МЕК белком Raf
3
1
МЕК
Стадия 3. Фосфорилирование и активация
МАПК с участием МЕК
2
1
3
2
3Активация МАРК приводит к её транслокации в ядро и последующему фосфорилированию транскрипционных факторов, которые отвечают за активность генов митоза, т.н. онкогенов (с-fos,
c-mys и др.). Запускается процесс бласттрансформации, т.е. начинется серия митотических делений. Стимулируется рост, дифференцировка клеток и изменяется профиль экспрессии генов.
Разные гормоны запускают МАР-киназные каскады в разных
типах клеток, которые отличаются набором поверхностных рецепторов.
Активированная МАРК таже способна фосфорилировать:
- другие внутриклеточные белки (цитоскелет и др.);
- другие протеинкиназы, влияя на их активность.
Каскад киназ, в котором каждая из киназ, лежащих «ниже по
течению», активируется фосфорилированием с участием киназ,
лежащих «выше по течению» - представляет собой ещё один
способ усиления сигнала.ПРИНЦИП УСИЛЕНИЯ РЕГУЛЯТОРНОГО СИГНАЛА В
КАСКАДЕ ПРОТЕИНКИНАЗ
например, ПКС
(Ras - активатор ПКС)
Raf
MEK
MAP«Выключение» митогенной сигнализации:
• диссоциация комплекса лиганд - рецептор;
• дефосфорилирование цитозольных доменов рецептора клеточными фосфатазами;
• фосфорилирование цитозольных доменов по остаткам серина и
теронина (с участием ПКА и ПКС);
• другие специфические фосфо(тирозин-серин-треонин) фосфатазы удаляют остаток фосфорной кислоты из внутриклеточных
белков (адаптерных и промежуточных протеинкиназ), снимая
этим эффекты их фосфорилирования (активации).Некоторые типы опухолей возникают при нарушении регуляции МАРК-сигнального каскада.
Мутации генов, кодирующих цитоплазматический домен
рецепторов с собственной тирозинкиназной активностью, нарушает:
• тирозин-киназную активность цитозольных доменов рецептора;
• формирование на этом домене докинг-центров.
Эти нарушения вызывает аномальный клеточный ответ и приводят к бесконтрольному росту мутантных клеток.
Многие онкогены вызывают мутацию генов, кодирующих
рецепторы факторов роста.Цитозоль
Два пути передачи
митогенного сигнала
посредством:
1). JAK-STAT- сигнального пути (ветвь а).
В молекуле STAT также присутствуют SH2-домены, распознающие фосфотирозины
и связывающиеся с ними.
2). МАРК-каскада (ветвь б).
Ядро
В разных типах клеток
каскад может быть сопряжен с дополнительными сигнальными путями и активировать различные транскрипционные факторы.Третий путь передачи митогенного сигнала посредством
ядерного транскрипционного фактора kB
(nuclear factor kappa B = NFkB)
Неактивный NFkB (гетеродимер: р105+р50) существует в цитоплазме в
комплексе с белком - ингибитором (IkB). Активация рецепторов факторов
роста и/или цитокинов (посредством активации ПКВ или МАРК) фосфорилирует киназу IkB (IKK). Активированная IKK
фосфорилирует ингибитор (IkB), который
диссоциирует из комплекса, а
NFkB переходит в активное
состояние.
NFkB передаёт внешний
сигнал в ядро очень
быстро. Это обусловлено тем, что неактивный
фактор (в комплексе с
ингибитором) постоянно
присутствует в цитоплазме. Для активации NFkB не
требуется синтезировать
новые белки, достаточно вызвать диссоциацию комплекса NFkB-ингибитор.СИГНАЛЬНЫЕ ПУТИ ИНСУЛИНА
Строение рецептора инсулина и механизм его
активации
Рецептор инсулина изначально является димером: состоит из
2a- и 2b-субъединиц. (Рецепторы факторов роста, в отличие от
рецептора инсулина, димеризуются только после связывания с
лигандом).
Две внеклеточные a-субъединицы рецептора содержат гормонсвязывающий домен. В результате связывания инсулина с ними
рецептор активируется, что приводит к появлению тирозинкиназной активности в его цитозольных b-субъединицах. Это происходит благодаря запуску перекрестного аутофосфорилирования:
одна b-субъединица фосфорилирует вторую b-субъединицу (и
наоборот) по трем остаткам тирозина.
В результате аутофосфорилирования обеих b-субъединиц, в них
происходят конформационные изменения: участок цепи цитозольного домена изменяет своё положение и открывает активный центр
тирозинкиназы.РЕГУЛЯЦИЯ ИНСУЛИНОМ ЭКСПРЕССИИ ГЕНОВ
Активированный рецептор инсулина фосфорилирует по тирозину
молекулу субстрат рецептора инсулина-1 (IRS-1 - insulin receptor
substrate-1). IRS-1 посредством своих фосфотирозинов
связывается с SH2-доменом белка Grb2. Белок Grb2 содержит
второй тип домена - SH3-домен с высоким сродством к областям
других белков, богатых пролином. С помощью этого домена белок
Grb2 связывается с белком SOS/GEF. Комплекс Grb2-SOS/GEF
переводит белок Ras в активную конформацию (Ras-ГТФ). Белок
Ras активирует МАП-киназный каскад.
Активированная ERK (МАПК) проникает в ядро, где фосфорилирует и активирует транскрипционный фактор Elk1. Последний
далее присоединяет белок SRF - (serum response factor - сывороточный фактор ответа) и этот комплекс (Elk1/SRF) активирует гены,
необходимые для деления клетки.Схема
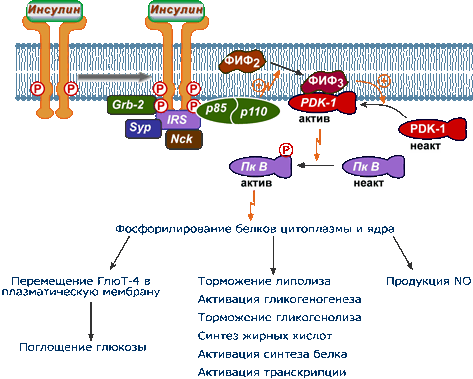
активации гликогенсинтетазы инсулином
ФИ-3К содержит SH2-домен. С её
помощью образуется мембранный
ФИ-3,4,5-трифосфат (ФИФ3). Эта
молекула становится начальным
пунктом собственного каскада
киназ. Сначала активируется киназа
PDK-1 (3-phosphoinositide dependent
protein kinase-1), которая далее
активирует ПКВ. ПКВ фосфорилирует
GSK3 (glycogen synthase kinase-3),
Чем инактивирует её. В результате
гликогенсинтаза остаётся в активном
(нефосфорилированном) состоянии.
Инсулин активирует РР1Схема активации инсулином движения везикул,
содержащих ГЛЮТ4, в плазматическую мембрану
(посредством активации ПКВ)
ПКВ фосфорилирует по 5 остаткам
тирозина белок AS160. Активированный
AS160 посредством GEF переводит в активную конформацию белок Rab (из семейства
малых G-белков). Активный Rab стимулирует перенос ГЛЮТ4 из цитозоля в плазматическую мембрану.Схема
подавления инсулином активности глюконеогенеза
Инсулин
IRS
PI-3K
ПKB
Активированная ПКВ проникает в ядро
В ядре ПКВ фосфорилирует инсулин-респонсивный транскрипционный фактор
FOXO1 (forkhead box protein O1) по остаткам серина/треонина.
В результате этого FOXO1 диссоциирует с инсулин-респонсивных участков
генов, кодирующих ключевые ферменты глюконеогенеза (ФЕП-карбоксикиназа и
глюкозо-6-фосфатаза).
Покинувший ядро фосфорилированный FOXO1 в цитоплазме подвергается
протеолитической деградации.Единичный рецептор, действуя через разные представители
семейства IRS, способен «включить» несколько разных
сигнальных путей.
инсулин
рецептор
IRS -1
цитоплазматическая мембрана
+
+
+
Белок-посредник-1,
содержащий
SH2-домен
Сигнальный
путь 1
IRS -2
IRS -n
+
IRS - 3
Белок-посредник-2,
содержащий
SH2-домен
Белок-посредник-3,
содержащий
SH2-домен
Сигнальный
путь 2
Сигнальный
путь 3
Белок-посредник-n,
содержащий
SH2-домен
Сигнальный
путь NУ инсулина два механизма действия
Рецептор инсулина представляет собой гликопротеин, построенный из двух димеров, каждый из которых состоит из α- и β-субъединиц,(αβ)2. Обе субъединицы кодируются одним геном 19 хромосомы и формируются в результате частичного протеолиза единого предшественника. Период полужизни рецептора составляет 7-12 часов. При присоединении инсулина изменяется конформация субъединиц и они связываются друг с другом, образуя микроагрегаты.
Связывание инсулина с рецептором инициирует ферментативный каскад реакций фосфорилирования . Первым делом аутофосфорилируются тирозиновые остатки на внутриклеточном домене самого рецептора. Это активирует рецептор и ведет к фосфорилированию остатков серина на особом белке, называемом субстрат инсулинового рецептора (IRS или СИР). Таких IRS выделяют четыре типа - IRS‑1, IRS‑2, IRS‑3, IRS‑4. Также к субстратам инсулинового рецептора относят белки Grb-1 и Shc, которые отличаются от IRS аминокислотной последовательностью.
Дальнейшие события могут развиваться по двум направлениям:
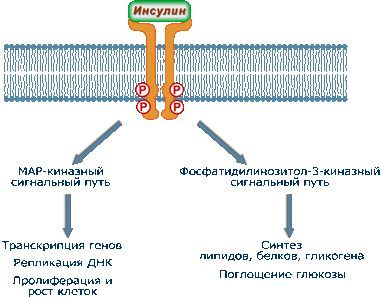
1. Процессы, связанные с активацией фосфатидилинозитол-3-киназы - в основном контролируют метаболические реакции обмена белков, углеводов и липидов (быстрые и очень быстрые эффекты инсулина). Сюда же относятся процессы, которые регулируют активность глюкозных транспортеров (ГлюТ) и поглощение глюкозы.
2. Реакции, связанные с активностью ферментов MAP-киназ - в целом управляют активностью хроматина (медленные и очень медленные эффекты инсулина).
Тем не менее, в клетке присутствуют ферменты, чувствительные к активации и того и другого каскадного пути.
![Обобщенные механизмы и эффекты инсулина]()
Два пути реализации эффектов инсулина
Реакции, связанные с активностью фосфатидилинозитол-3-киназы
После активации IRS-белок и целый ряд вспомогательных белков способствуют закреплению на мембране гетеродимерного фермента фосфатидилинозитол-3-киназы , содержащего регуляторную p85 и каталитическую p110 субъединицы.
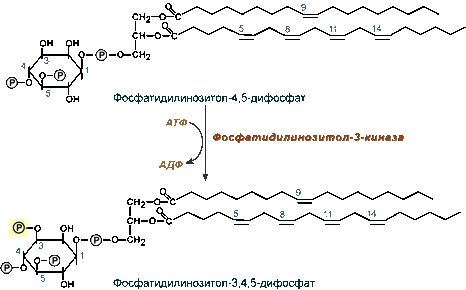
Эта киназа фосфорилирует мембранный фосфатидилинозитол-4,5-дифосфат по 3-му положению до фосфатидилинозитол-3,4,5-трифосфата (PIP3). Считается, что PIP3 может выступать в качестве мембранного якоря для других элементов при действии инсулина.
![Образование фосфатидилинозитол-3-фосфата]()
Действие фосфатидилинозитолдифосфат-3-киназы на фосфатидилинозитол-4,5-дифосфат
Часто эту фосфатидилинозитол-4,5-дифосфат-3-киназу (EC 2.7.1.153), субстратом которой является фосфатидилинозитол-4,5-дифосфат, называют фосфоинозитид-3-киназой. На самом деле название фосфоинозитид-3-киназа применимо в рабочем порядке к трем разным ферментам, фосфорилирующим немного разные фосфолипиды - фосфатидилинозитол, фосфатидилинозитол-4-фосфат, фосфатидилинозитол-4,5-дифосфат.
После образования фосфатидилинозитол-3,4,5-трифосфата (PIP 3 ) происходит активация протеинкиназы PDK-1 , которая вместе с ДНК-протеинкиназой (DNA-PK) дважды фосфорилирует протеинкиназу B ( AKT1 ), которая прикрепляется к мембране также благодаря PIP3.
![фосфоинозитол-3-киназный механизм действия инсулина]()
Фосфатидилинозитол-3-киназный механизм действия инсулина
Фосфорилирование активирует эту протеинкиназу В (АКТ1) , она покидает мембрану и перемещается в цитоплазму и ядро клетки, где фосфорилирует многочисленные белки-мишени (более 100 штук), которые обеспечивают дальнейший клеточный ответ:
- в частности, именно действие протеинкиназы В (АКТ1) приводит к перемещению глюкозных транспортеров ГлюТ-4 на клеточную мембрану и к поглощению глюкозы миоцитами и адипоцитами,
- также, например, активная протеинкиназа В (АКТ1) фосфорилирует и активирует фосфодиэстеразу (ФДЭ), гидролизующую цАМФ до АМФ, в результате чего концентрация цАМФ в клетках-мишенях снижается . Поскольку при участии цАМФ активируется протеинкиназа А, стимулирующая гормон-чувствительную липазу и фосфорилазу гликогена , то в результате действия инсулина в адипоцитах происходит подавление липолиза , а в печени - остановка гликогенолиза .
Реакции активации фосфодиэстеразы
- еще одним примером является действие протеинкиназы В (AKT) на киназу гликогенсинтазы. Фосфорилирование этой киназы инактивирует ее и в результате она не в состоянии действовать на гликогенсинтазу, фосфорилировать и инактивировать ее. Таким образом, влияние инсулина приводит к удержанию гликогенсинтазы в активной форме и к синтезу гликогена.
Практически все метаболические эффекты инсулина связаны с инициацией фосфатидилинозитол-4,5-дифосфат-3-киназного пути.
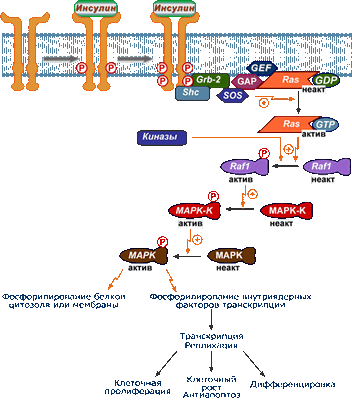
Реакции, связанные с активацией MAP-киназного пути
В самом начале развертывания этого пути в действие вступает еще один субстрат инсулинового рецептора - белок Shc , связывающийся с активированным (аутофосфорилированным) инсулиновым рецептором. Далее Shc-белок взаимодействует с Grb-белком и вынуждает его присоединиться к рецептору.
Также в мембране постоянно присутствует белок Ras , который в спокойном состоянии связан с ГДФ. Поблизости от Ras-белка находятся «вспомогательные» белки - GEF , SOS и белок GAP .
Формирование комплекса белков Shc-Grb активирует группу GEF-SOS-GAP и приводит к замене ГДФ на ГТФ в составе Ras-белка , что вызывает его активацию. Активный комплекс Ras-ГТФ передает активирующий сигнал на протеинкиназу Raf-1 .
При активации протеинкиназы Raf-1 происходит ее присоединение к плазматической мембране, фосфорилирование дополнительными киназами по остаткам тирозина, серина и треонина, а также одновременное взаимодействие с рецептором инсулина.
Далее активированная Raf-1 фосфорилирует и активирует киназу MAPK-K (MEK), которая в свою очередь фосфорилирует следующую киназу МАPК (ERK).
![Последовательность реакций Ras, Raf, MAP, MAPK-kinase]()
MAP-зависимый путь реализации эффектов инсулина
1. После активации МАP-киназа (МАРК) самостоятельно или при участии дополнительных киназ запускает фосфорилирование белков цитоплазмы, что изменяет их активность, например:
- активация фосфолипазы А2 приводит отщеплению от фосфолипидов арахидоновой кислоты, которая далее превращается в эйкозаноиды,
- активация рибосомальной киназы запускает процесс трансляции белков,
- активация протеинфосфатаз приводит к дефосфорилированию многих ферментов.
К примеру активируемая в RAS-MAP-пути протеинкиназа pp90S6 фосфорилирует и активирует протеинфосфатазу, связанную с гранулами гликогена . Далее указанная протеинфосфатаза дефосфорилирует и активирует гликогенсинтазу , начиная синтез гликогена, и дефосфорилирует и инактивирует киназу фосфорилазы и гликогенфосфорилазу , прекращая гликогенолиз.
Одним из белков, связанных с этим механизмом, является транскрипционный фактор CREB ( cAMP-response element-binding protein ). В неактивном состоянии фактор дефосфорилирован и не влияет на транскрипцию. При действии активирующих сигналов фактор связывается с определенными CRE- последовательностями ДНК, усиливая или ослабляя считывание информации с ДНК и ее реализацию. Кроме MAP-киназного пути фактор чувствителен к сигнальным путям, связанным с протеинкиназой А и кальций-кальмодулином.
Инициация MAP-киназного пути преимущественно приводит к регуляции экспрессии разнообразных инсулин-зависимых генов, к клеточной пролиферации и клеточному росту .
Читайте также:
- Схема пути MAPK в реакции эпителия кишечника на бактерии
- Функция почек при болезни Иценко-Кушинга. Диагностика и дифференциальный диагноз болезни Кушинга
- Концепции сексопатологии. Виды врачей сексопатологов.
- Мастоцитоз. Формы мастоцитоза. Типы мастоцитоза.
- Эхокардиографическая характеристика тканей при кардиомиопатии