Пересадка сердца. Врожденные пороки сердца у взрослых
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Пороки сердца: причины появления, симптомы, диагностика и способы лечения.
Определение
Порок сердца определяется как атипичное или аномальное строение его структур (камер, клапанов, крупных сосудов), являющееся следствием нарушений закладки и развития (врожденный порок сердца) либо разнообразных патологических изменений (приобретенный порок сердца). В результате формирования данной патологии нарушается работа сердца и формируется кислородная недостаточность органов и тканей организма, которая в конечном счете может привести к сердечной недостаточности.
Причины появления пороков сердца
У человека кровь, возвращающаяся к сердцу от всех органов и тканей (кровь, бедная кислородом), проходит через правое предсердие и затем через правый желудочек в легочную артерию, а оттуда поступает в легкие. В легких кровь обогащается кислородом, высвобождает углекислый газ и поступает в левое предсердие и левый желудочек, а оттуда перекачивается ко всем органам и тканям через аорту, а затем через артерии более мелкого калибра.
Работоспособность сердечной мышцы зависит от функционирования клапанов, которые при ее сокращении беспрепятственно пропускают кровь в следующий отдел, а при расслаблении не позволяют крови поступать обратно.
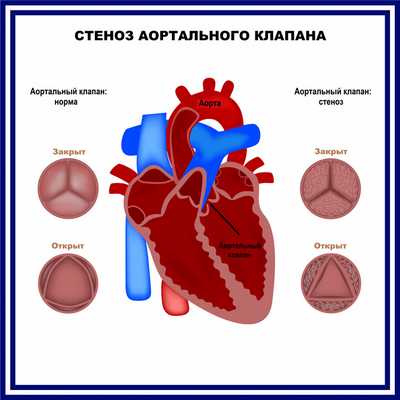
Врожденные пороки сердца весьма разнообразны. Описано более полутора сотен различных вариантов нетипичного строения сердца. Примерно один из 100 младенцев рождается с пороком сердца. Часто встречающимися патологиями сердца, диагностированными в младенчестве и детстве, являются дефекты межпредсердной и межжелудочковой перегородок (отверстия между камерами сердца). Нередко дефекты сочетаются с аномалиями клапанного аппарата сердца или крупных сосудов. Наиболее распространенным врожденным пороком сердца является двустворчатый аортальный клапан, который открывается при каждом сердечном сокращении, давая крови возможность течь от сердца ко всем органам. Нормальный аортальный клапан имеет три створки.
Двустворчатый аортальный клапан обычно не вызывает проблем в младенчестве или детстве, поэтому часто диагностируется только во взрослом возрасте.
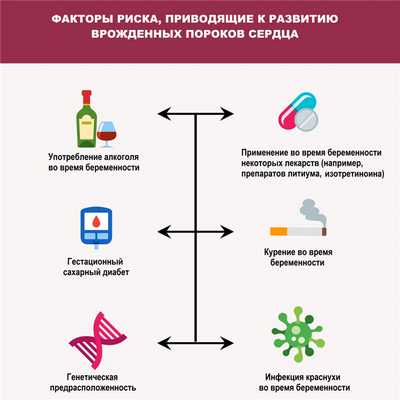
Среди причин развития врожденных пороков сердца выделяют генетические, экологические и инфекционные. Помимо этого, к их формированию могут приводить определенные заболевания (гестационный сахарный диабет, краснуха и системная красная волчанка) у матери, прием некоторых лекарственных препаратов, наркотиков и алкоголя во время беременности и другие факторы.
Приобретенные пороки - это аномалии и дефекты клапанов сердца, его отверстий или перегородок между камерами, отходящих от него сосудов, появившиеся в процессе жизни под воздействием морфологических и функциональных изменений в работе сердца. Митральный клапан страдает чаще, чем аортальный. Реже встречаются патологии трехстворчатого (трикуспидального) клапана и клапана легочной артерии. Заболевания могут манифестировать в любом возрасте под влиянием атеросклероза, кардиосклероза, ишемической, либо гипертонической болезни, ревматизма, системной патологии, травмы, сифилиса и некоторых других причин. Также к клапанным порокам сердца приводят дегенеративные изменения клапанов - при развитии заболевания нарушается их строение и функция, что вызывает перестройку гемодинамики, происходит перегрузка соответствующих отделов сердца, гипертрофия сердечной мышцы, нарушение кровообращения в сердце и в организме в целом.
Классификация заболевания
- пороки «белого» типа, когда нет тенденции к смешиванию артериальной и венозной крови;
- пороки «синего» типа - венозная кровь попадает в артериальное русло, вследствие чего формируется кислородная недостаточность.
- стеноз - в результате патологического процесса возникает деформация тканей клапана и сужается отверстие, через которое кровь поступает в следующий отдел сердца;
- недостаточность клапанов - несмыкание клапанов сердца из-за изменения формы, их укорочения в результате рубцевания пораженных тканей;
- комбинированные и сочетанные пороки сердца:
- комбинированные - при наличии и стеноза, и недостаточности одного клапана;
- сочетанные - при поражении сразу нескольких клапанов.
- дегенеративные, или атеросклеротические (встречаются в 5-6% случаев) - чаще эти процессы развиваются после 40-50 лет, когда происходит отложение кальция на створках пораженных клапанов, что приводит к прогрессированию порока;
- ревматические, формирующиеся на фоне ревматических заболеваний (80% случаев);
- пороки, возникающие как результат воспаления внутренней оболочки сердца (эндокардит);
- сифилитические (в 5% случаев).
Симптомы пороков сердца
К клиническим симптомам пороков сердца относятся одышка, слабость, быстрая утомляемость, отеки нижних конечностей, нарушение сна, перебои в работе сердца, аритмия (чаще тахикардия), изменение цвета кожи (синюшность или бледность), набухание вен шеи и головы, беспричинное беспокойство, давящая боль в области сердца (особенно при физических нагрузках) или между лопатками, в редких случаях - потеря сознания.
Специфические симптомы врожденных пороков сердца зависят от возраста пациента. Поскольку нормальная циркуляция богатой кислородом крови необходима для нормального роста и развития организма, у младенцев может наблюдаться затрудненное или учащенное дыхание, плохой аппетит, потливость или повышенная частота дыхания во время кормления, цианоз губ и/или кожи, необычная раздражительность или отставание в прибавке в весе.
У детей и подростков могут наблюдаться снижение переносимости физических нагрузок, головокружения, обмороки.
Большинство серьезных пороков сердца у детей выявляются на основании симптомов, которые замечают родители, а также на основании отклонений, обнаруживаемых при осмотре врачом. Нарушенный ток крови через сердце обычно проявляется сердечными шумами, которые можно услышать с помощью стетоскопа. Аномальные сердечные шумы зачастую бывают громкими или резкими. Однако в подавляющем большинстве случаев сердечные шумы, отмечаемые в детском возрасте, являются функциональными и не обусловлены пороками сердца.
Выраженность и характер симптомов зависят от расположения пораженного клапана. При пороках клапанов левой половины сердца (митрального и аортального) в первую очередь страдают легкие, так как в их сосудах застаивается кровь, что проявляется одышкой и кашлем. Кроме того, возникают признаки недостаточного кровоснабжения головного мозга и самого сердца, головокружение, обмороки, стенокардия. При наличии цианоза одной из наиболее распространенных патологий является тетрада Фалло (ограничение поступления крови в легкие).
![Стеноз аортального клапана.jpg]()
При нарушении работы клапанов правой половины сердца (трехстворчатого и клапана легочной артерии) происходит застой крови в сосудах большого круга кровообращения, поэтому страдают все органы кроме легких. Развиваются отеки голеней и стоп, асцит (скопление жидкости в брюшной полости), увеличение печени и другое.отставание в прибавке в весе.
Признаки приобретенных пороков зачастую сочетаются с другими заболеваниями сердца, в частности, с ишемической болезнью, что затрудняет их клиническую дифференциацию.
Диагностика пороков сердца
Диагностические мероприятия, проводимые с целью обнаружения порока сердца, требуют комплексного подхода, но всегда начинаются со сбора анамнеза: врач выясняет жалобы пациента, время и обстоятельства их проявления, интенсивность, наследственные факторы. Далее проводится физикальный осмотр, который включает визуальный осмотр, пальпацию, перкуссию (простукивание), аускультацию (выслушивание).
Лабораторные исследования, которые назначают при подозрении на порок сердца:
- клинический анализ крови;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий.
Пересадка (трансплантация) сердца: показания, видео техник, стоимость операции
Первую пересадку сердца в мире человеку сделали в 1965 году, однако она оказалась безуспешной. На протяжении многих лет совершенствовали технику, увеличивали знания в иммунологии и трансплантологии, разрабатывали новые кардиохирургические методики, что позволило значительно улучшить выживаемость и в раннем, и в отдаленном периоде. На сегодня операцию выполняют более рутинно, и она продлевает жизнь человека.
Показания и противопоказания к трансплантации сердца
Пересадка сердца показана при крайне тяжелых заболеваниях, которые не поддаются медикаментозной терапии и приводят к выраженной сердечной недостаточности. Причины подобных состояний:
- дилатационная кардиомиопатия;
- врожденные пороки;
- патология клапанов;
- тяжелые нарушения систолической функции сердца (объем выброса меньше 20%);
- злокачественная рецидивирующая стенокардия;
- атеросклероз коронарных артерий, не подлежащий другим хирургическим вмешательствам;
- новообразования.
Вопрос о пересадке сердца решает консилиум из ведущих специалистов. Там оценивают операционный риск и дальнейший прогноз конкретного больного.
- активный инфекционный процесс;
- системные заболевания (СКВ, ревматоидный артрит);
- СПИД;
- инсулинзависимый диабет с поражением органов или частой декомпенсацией;
- нарушение свертываемости крови;
- ожирение;
- тяжелые заболевания печени, почек, легких;
- амилоидоз;
- злокачественные новообразования;
- психические расстройства;
- атеросклеротическое поражение периферических и/или мозговых артерий;
- выраженная легочная гипертензия;
- повторные инфаркты легкого;
- алкогольная, нарко- и табакозависимость;
- пожилой возраст.
Методики и техника выполнения операции
- общеклинические исследования крови и мочи;
- биохимический анализ крови;
- показатели гликемии;
- группа крови и резус-принадлежность;
- развернутая коагулограмма;
- уровень натрийуретического пептида В-типа;
- клиренс креатинина;
- гормоны щитовидной железы;
- бактериологическое исследование мочи и мокроты;
- иммунологические исследования (HLA-типирование донора по I и II классу, кросс-матч);
- скрининг инфекционной панели (гепатиты, цитомегаловирус, герпес, ВИЧ, туберкулез и прочие).
![Логотип]()
Из инструментальной диагностики пациенту, требующему пересадки, выполняют:
- электрокардиографию;
- эхокардиографию;
- катетеризацию правых отделов с тонометрией;
- рентгенографию органов грудной клетки;
- спирометрию;
- фиброгастродуоденоскопию;
- УЗИ органов брюшной полости и щитовидной железы;
- сканирование сонных артерий и сосудов нижних конечностей;
- коронарографию.
Доктор тщательно собирает анамнез с уточнением сопутствующей патологии, любых трансфузий, оперативных вмешательств, предшествующих трансплантации, беременности.
Накануне пациент подписывает официальные документы о согласии на операцию по пересадке сердца. Запрещается прием пищи и жидкости, поскольку требуется общая анестезия.
Как проходит операция? Доступ к сердцу осуществляют через срединную стернотомию (разрез грудины). Затем пациента присоединяют к аппарату искусственного кровообращения. Высекают части желудочков и предсердий, оставляя достаточный участок ткани для сохранения иннервации, что играет существенную роль в поддержании гомеостаза в послеоперационном периоде.
Одновременно другая группа хирургов готовит трансплантат. После тщательного осмотра, дабы исключить пороки и прочие видимые патологии, немедленно выполняют кардиоплегию. Затем иссекают аорту, полые вены и легочные сосуды, сердце освобождают от остатков перикарда и вынимают из грудной клетки. Орган безотлагательно помещают в консервирующий раствор (+4 °С), чтобы обеспечить холодовую защиту.
Следующий шаг - подшивание трансплантированного органа, воссоединение сосудистого русла и восстановление сердцебиения. После успешного запуска сердца рану ушивают, а на грудину накладывают повязку. Подробнее о процессе операции смотрите в нашем видео о пересадке.
Длительность и качество жизни после пересадки
Первый этап реабилитационного процесса начинается с пребывания пациента в кардиореанимации. Основная задача врачей в этот период - обеспечить адекватное функционирование пересаженного сердца и предотвратить возможные осложнения.
Больной находится под мониторным наблюдением, ему назначают массивную инфузионную терапию, чтобы корректировать гемодинамику, борьбу с нарушениями ритма и отторжением трансплантата.
После отключения искусственной вентиляции легких начинают дыхательную гимнастику. Один из ее вариантов - выдох с сопротивлением: пациенту предлагают дуть в воду через трубочку. Спустя несколько дней инструктор лечебной физкультуры подбирает необходимые упражнения, которые выполняют в постели. Продолжительность и частоту регулирует сам пациент, основываясь на самочувствии.
Второй этап - стационарный. Человека переводят в общую палату. Продолжают ряд диагностических и лечебных процедур, постепенно расширяют двигательный режим под присмотром специалиста ЛФК и кардиолога. Пациенту объясняют необходимость соблюдения санитарного порядка: покидая палату, он надевает маску, часто моет руки. Посещения регулирует медицинский персонал. Длительность госпитализации зависит от восстановительных способностей организма и составляет приблизительно месяц.
Третий этап наступает после выписки и длится до года. Этот срок требует амбулаторного контроля за состоянием больного. Устанавливают план регулярных обследований, продолжают прием лекарств. Пациент должен старательно заниматься дозированными физическими нагрузками. Особенно подходит ходьба, езда на велосипеде, легкий бег, плавание. Основная цель этапа - приспособить сердце к работе в условиях повседневной жизни.
После года от пересадки сердца человек, как правило, возвращается к привычной жизни. Сокращают прием медикаментов, урежают частоту визитов к врачу. Однако нужно поддерживать активность и здоровый образ жизни. Стоит отказаться от алкоголя, курения, не злоупотреблять кофе. Осторожного обращения требует вакцинация.
«Сколько живут после пересадки сердца?» - частый вопрос пациентов, которые готовятся к операции. В России максимальная длительность составляет 17 лет, но в мире зафиксированы цифры и в 20 лет. Более того, любой из больных с показанием в виде трансплантации не имеет никакого шанса на похожий срок выживаемости без вмешательства.
Стоимость операции в России и за рубежом (2018 год)
Средняя цена на трансплантацию сердца в СНГ составляет приблизительно 100 тысяч долларов, тогда как европейские коллеги просят от 200 тысяч евро за одно вмешательство. Последнее время с целью экономии выгодно пользоваться услугами азиатских врачей, которые выполняют пересадку за 50-60 тысяч долларов. Но, по-прежнему лидерами спроса среди наших граждан остаются Израиль и США.
Возможные осложнения
После стабилизации кровообращения наиболее грозное осложнение у больного - отторжение донорского сердца.
- Молниеносное отторжение проявляется в первые часы после операции, обусловлено гуморальными факторами, вызывающими гибель трансплантата.
- Острую форму наблюдают от семи дней до трех месяцев.
- Хронический вариант проявляется через 12 месяцев после операции и обусловлен образованием антител. Это приводит к прогрессивному ухудшению функции органа
К другим частым осложнениям относят:
Основная причина указанных выше проблем - длительный прием иммуносупрессоров. Циклоспорин А задерживает жидкость, спазмирует периферические артерии, стимулирует выработку глюкозы и развивает фиброз почек. Ослабляется иммунная защита организма, что объясняет частые пневмонии, кандидоз, туберкулез и другие заболевания.
Для предупреждения подобных осложнений пациентам, принимающим иммуностатики, при обращении в поликлинику нужно тщательно обследоваться с целью ранней диагностики возможных проблем.
Несмотря на большой спектр побочных реакций, пожизненный прием лекарств обязателен. Отмена или нарушение режима грозят летальным исходом. Корректировать дозы или вносить изменения может только трансплантолог.
Выводы
Трансплантация - операция, разрешающая заменить ослабленное, не выполняющее свои функции сердце, на орган от здорового донора. Вмешательство требует высокой квалификации медицинского персонала, многогранной и продолжительной реабилитации, больших финансовых затрат. Пациентам обязателен пожизненный прием цитостатических препаратов, что обуславливает высокий риск послеоперационных осложнений. Тем не менее пересадка позволила продлить жизнь людям с терминальной сердечной недостаточностью и потому нашла широкое применение в современной кардиохирургии, безусловно, спасая человечество.
Для подготовки материала использовались следующие источники информации.
Прогрессирующая сердечная недостаточность у взрослых с врожденным пороком сердца
Благодаря качеству ухода и современной терапии пациентов с врожденным пороком сердца (Adults with congenital heart disease (ACHD)) ожидается, что> 90% детей, рожденных с ВПС (врожденный порок сердца), доживут до «взрослой жизни». Для этих взрослых сердечная недостаточность (СН) является основной причиной смерти. Достижения в распознавании и лечении этих пациентов продолжают улучшаться. В частности, взрослые с ВПС являются кандидатами как на трансплантацию сердца, так и на поддержку механического кровообращения. Тем не менее, остаются проблемы, которые требуют исследования для улучшения результатов.
![Кубенский Глеб Евгеньевич]()
За последние несколько десятилетий взрослые с врожденным пороком сердца (Adults with congenital heart disease (ACHD) ) стали новым типом популяции пациентов, которые имеют определенные сложности для лечения. Только в Северной Америке распространенность ACHD превышает 1 миллион пациентов. Появление этой группы может быть связано с клиническими достижениями, которые были достигнуты в лечении этих врожденных расстройств, которые проявились еще в детстве, и позволили более 85% детей с диагнозом ВПС дожить до «взрослой жизни». По мере того, как эти пациенты становятся взрослыми, у них могут развиться осложнения, связанные с ВПС. Доминирующим осложнением, с которым сталкивается популяция ACHD, является развитие сердечной недостаточности, и в настоящее время это признается основной причиной смерти пациентов с ACHD.
В современной медицинской практике золотым стандартом лечения сердечной недостаточности на конечной стадии является трансплантация сердца. Это, однако, остается вариантом лечения, который ограничен донорским предложением. За последние несколько десятилетий число операций по пересадке сердца, которые проводились ежегодно в Соединенных Штатах, составляет от 2000 до 2500. Это предложение не соответствует текущим требованиям растущей популяции с сердечной недостаточностью. По мере того как распространенность сердечной недостаточности в популяции ACHD растет, потребность в лечении сердечной недостаточности будет продолжать увеличиваться, что создает дополнительную нагрузку на уже перегруженную систему трансплантации.
В дополнение к проблемам, связанным с донорским снабжением, пациенты с ACHD сталкиваются с дополнительным сложностями, при поиске трансплантации сердца в качестве варианта лечения, из-за их медицинских особенностей, которые в настоящее время не учитываются в руководящих принципах, установленных UNOS. Они включают в себя более молодой возраст, анатомические особенност и сниженную вероятность имплантированного механического вспомогательного устройства по сравнению с кандидатами без ACHD. Это, в свою очередь, приводит к снижению статуса срочности, увеличению времени ожидания и увеличению числа пациентов с ВПС, с клиническим ухудшением. Очевидно, что дальнейшая оценка растущей популяции ACHD необходима для обеспечения эффективных планов лечения для лечения сердечной недостаточности, которые будут учитывать их сложные обстоятельства
Диагноз сердечной недостаточности при ACHD часто бывает трудным, потому что у этой популяции могут быть атипичные признаки и симптомы; тем не менее, диагностика облегчается благодаря регулярному наблюдению, включая анамнез и физикальное обследование, лабораторные и визуальные исследования, а также функциональное тестирование, которое является частью ведения этих пациентов. Как только идентифицируется гемодинамическое повреждение, обычно требуется его хирургическая коррекция. Если гемодинамического поражения нет, пациенты делятся на две группы в зависимости от того, нарушена ли желудочковая функция или нет. Лекарственное коррекция сердечной недостаточности показана, когда имеется нарушение желудочковой функции без значительного гемодинамического поражения или у пациентов с нормальной систолической сократимостью, которые клинически симптоматичны либо с повышенным BNP, либо с низкой толерантностью к физической нагрузке. Показано динамическое наблюдение, если BNP или тестирование с нагрузкой нормальное или у клинически бессимптомных пациентов с нормальной систолической функцией желудочков
3. 1. Медикаментозная коррекция
Как только диагностируется сердечная недостаточность, назначается лечение, состоящее из коктейля, куда входят: диуретики, бета-блокаторы, блокаторы ренин-ангиотензин-альдостероновой системы, антагонисты минералокортикоидных рецепторов, сердечные гликозиды, легочные вазодилататоры, блокаторы кальциевого канала и другие препараты, снижающие постнагрузку, рекомендованные для лечения сердечной недостаточности.
Другой тип вмешательства включает имплантацию кардиовертера-дефибриллятора и сердечную ресинхронизирующую терапию.
3. 2. Хирургическая коррекция
Структурное вмешательство часто требуется у пациентов с ВПС и варьирует от катетерной терапии до трансплантации сердца в зависимости от этиологии ВПС и проявления симптомов в зрелом возрасте. Решение о проведении хирургической коррекции должно быть тщательно взвешено с учетом медикаментозного лечения, так как выживаемость уменьшается с увеличением количества стернотомий. Кроме того, использование препаратов крови может вызывать сенсибилизацию HLA, что влияет на возможность последующей трансплантации сердца. Кардиохирургия включает замену клапана легочной артерии / канала, закрытие дефектов межпредсердной перегородки, аортальные процедуры, восстановление / ревизия тетрады Фалло, преобразование или ревизия восстановления Фонтана и другие репарации / замены клапанов
Помощь механического кровообращения (мechanical circulatory support-MCS) может быть показана для пациентов, у которых развивается острая сердечная недостаточность, резистентная к максимальному медикаментозному лечению. Экстракорпоральная мембранная оксигенация (ЭКМО) рассматривается для пациентов, у которых развивается кардиогенный шок, и часто служит «мостом к принятию решения» в этой группе пациентов. В отличие от стандартной сердечной недостаточности, ЭКМО особенно полезна для пациентов с ACHD, у которых развивается правожелудочковая недостаточность. Использование ЭКМО должно быть ограничено пациентами, у которых не развилась полиорганная недостаточность, поскольку прогноз в этой популяции плохой.
Число имплантаций вспомогательных (механических) желудочков продолжает увеличиваться, хотя концентрируется в относительно небольшом количестве центров. Немного пациентов с подвергаются данному вмешательству, так как имеют тяжелейшие системные нарушения. Подобно терапии ЭКMO, долгосрочная MCS используется в качестве «моста» для трансплантации и редко используется в качестве стандартной терапии. Большинству пациентов имплантируют механический левый желудочек, но существует более высокая доля пациентов по сравнению с приобретенной группой пациентов с сердечной недостаточностью, которым требуется бивентрикулярная поддержка либо с бивентрикулярным протезированием, либо с общим искусственным сердцем. При всех морфологиях чаще используются осевые насосы с непрерывным потоком; тем не менее, в популяции ACHD больше доля пульсирующих насосов, чем при приобретенной сердечной недостаточности.
Трансплантация сердца рассматривается, когда 1-летняя выживаемость составляет менее 80%. Решение о внесении в список для пересадки сердца является более сложным, чем у пациентов с приобретенной сердечной недостаточностью, и факторы, влияющие на это решение, включают анатомические особенности, наличие несердечной терминальной стадии органной недостаточности, прогрессирующий цирроз, степень легочной гипертонии и низкая кардиопульмональная нагрузочная проба. Пациенты с морфологией единственного желудочка представляют особые анатомические и сосудистые проблемы, поскольку они часто требуют дополнительных хирургических процедур во время трансплантации, включая легочную артерию и патологическую реконструктивную венозную систему.
В целом, отбор пациентов имеет решающее значение для успеха трансплантации сердца у взрослых с врожденным пороком сердца
4. Текущие результаты для взрослых с врожденным пороком сердца
4. 1. Механическая поддержка кровообращения
При лечении сердечной недостаточности появление механических вспомогательных устройств стало широко распространенным вариантом для пациентов, которые либо не соответствуют критериям трансплантации, либо в качестве моста к трансплантации. Несмотря на их широкое применение у пациентов без ВПС, вспомогательные устройства с механическим кровообращением не так легко применяются к популяции ACHD, поскольку многие из этих пациентов сталкиваются с анатомическими проблемами, такими как одиночные желудочки, реконструкция сосудов крупных артерий и системные правые желудочки. Сложность анатомических вариантов в дополнение к наличию сопутствующих заболеваний способствует более высокой частоте периоперационных осложнений по сравнению с популяцией без ACHD. Эти нежелательные явления включают более высокую частоту печеночной дисфункции, дыхательной недостаточности, почечной дисфункции, требующей диализа, а также длительные нарушения ритма сердца. Если сравнивать с не- ACHD Cohort, Cedars et al. обнаружили, что ранняя выживаемость в первые 5 месяцев после имплантации была хуже в популяции ACHD, но после этого была сопоставимой, а параметры функционального статуса и качества жизни были одинаковыми в обеих группах. Они связали эти результаты с операционными и периоперационными факторами, уникальными для пациентов с ACHD, в частности с анатомическими проблемами и повышенной вероятностью наличия предыдущих стернотомий. В целом, результаты показывают, что MCS является хорошим вариантом для пациентов с ACHD с прогрессирующей сердечной недостаточностью, несмотря на увеличение периоперационных осложнений и смертности, в качестве моста к трансплантации и может быть жизнеспособным вариантом в качестве терапии назначения в будущем.
4. 2. Трансплантация
Пациенты с ACHD испытывают множество промблем при поиске трансплантации в качестве лечения их сердечной недостаточности. Такие вопросы, как анатомические измеения и иммунный статус, могут существенно повлиять на их отбор к трансплантации миокарда. В итоге в популяции ACHD уровень смертности в списке ожидания выше, чем у пациентов без ACHD. Надо отметить, что пациенты с ACHD, как правило, более молодого возраста и с меньшей вероятностью использовали механические вспомогательные устройства для кровообращения из-за клинических барьеров. В результате они находятся в более длительном периоде ожидания, имеют более высокую смертность во время ожидания пересадки или вообще исключаются из списка. Результаты для пациентов с ACHD, которые успешно трансплантированы, варьируются в зависимости от краткосрочных и долгосрочных сравнений. Краткосрочные результаты для пациентов с ACHD, аналогичные результатам после MCS, хуже, чем по сравнению с пациентами без ACHD: 20-30% смертности при 30-дневной смертности. Этот повышенный уровень смертности потенциально может быть объяснен уникальными проблемами, связанными с популяцией ACHD, такими как анатомические проблемы и более длительное время ишемии во время операции из-за необходимости реконструкции во время пересадки. Одно исследование Paniagua Martn et al. предполагает, что причина этого различия может быть связана с более высокой частотой первичной недостаточности трансплантата у пациентов с ACHD. Несмотря на увеличение периоперационной смертности, долгосрочная выживаемость для пациентов с АБС является выдающейся, со средней выживаемостью более 20 лет]
Независимо от этих данных, результаты для пациентов с ACHD после трансплантации изменяются в зависимости от их начального диагноза. Поскольку существуют различные клинические проявления ACHD, оценка прогностических показателей остается сложной задачей, и поэтому пациентов следует тщательно оценивать перед рассмотрением вопроса о пересадке
Дальнейшее изучение популяции ACHD необходимо для эффективного решения их уникальных медицинских проблем, поскольку эта группа пациентов продолжает расширяться. Это исследование должно проводиться с нескольких точек зрения, чтобы обеспечить адекватное решение разнообразных проблем, представленных этой группой населения. В частности, в этой главе есть четыре области, на которых следует сосредоточить внимание при проведении будущих исследований, чтобы предоставить наиболее полезную информацию для медицинского сообщества:
• Причины увеличения ранней смертности при операциях по пересадке сердца для пациентов с ACHD. После тщательного обзора текущей литературы, становится очевидным, что у пациентов с ACHD имеет место более высокая ранняя смертность после трансплантации сердца по сравнению с пациентами без ACHD.
На данный момент исследования в этой области были сосредоточены на выявлении клинического источника этого контраста смертности. Крайне важно, чтобы усилия исследователей были направлены на поиск корня этого несоответствия, чтобы минимизировать присутствие этого сложного результата. Это даст медицинскому сообществу более точные предикторы смертности при поиске трансплантации сердца в качестве лечения для этих пациентов и даст положительные результаты для тех, кто проходит этот тип медицинского вмешательства.
• Определение подходящего времени / типа вмешательств для использования в этой клинически разнообразной группе. Из-за клинического разнообразия, которое существует в группах пациентов с ACHD, применяющих стандартизированные схемы лечения, остается сложной задачей. Тематические исследования, изучающие, как эффективно управлять различными анатомическими морфологиями, в настоящее время существуют, но этот аспект исследования все еще остается относительно неисследованным, и информация, касающаяся времени, довольно ограничена. Повышение знаний о том, как эффективно подходить к лечению у пациентов с ACHD, с точки зрения того, когда и как вмешиваться, поможет снизить сложность подхода к режиму терапии и предоставит более убедительные доказательства для обеспечения наилучших возможных клинических результатов для этих пациентов.
• Переоценка того, как пациенты с ACHD перечислены в реестрах трансплантатов. В соответствии с текущими рекомендациями пациенты с ACHD находятся в невыгодном положении с точки зрения вероятности их успешной трансплантации. В настоящее время пациенты с ACHD более склонны испытывать более низкий статус листинга с их первоначальным списком, чем пациенты без ACHD. Кроме того, у пациентов с АБС наблюдается высокий уровень исключения из списка после 1 года из-за ухудшения их состояния. Эти пациенты находятся в еще более неблагоприятном положении, поскольку они не могут быть кандидатами на механическое кровообращение из-за анатомических ограничений. Поэтому они не могут использовать размещение этих устройств для продления своего выживания, чтобы успешно достичь трансплантации, или использовать преимущества получения более высокого статуса в списке, связанного с этими интервенционными терапиями. Текущий перечень критериев для трансплантации сердца является причиной серьезного беспокойства при рассмотрении этического и эффективного медицинского лечения пациентов с ACHD. Существует острая необходимость в переоценке настоящих руководящих принципов, которые должны быть приняты для того, чтобы принять во внимание уникальные медицинские проблемы, с которыми сталкивается эта растущая популяция, которая по-прежнему будет полагаться на трансплантацию сердца в качестве одной из своих основных возможностей лечения в будущем.
• Изучение использования MCS в качестве терапии назначения в дополнение к «мосту» к трансплантации. Использование этих устройств, для лечения пациентов с ACHD ранее было сфокусировано на их использовании в качестве «моста» для трансплантационной терапии. Тем не менее, в связи с растущей потребностью в трансплантации сердца крайне важно, чтобы другие варианты терапии были рассмотрены для пациентов с ACHD. Совсем недавно использование MCS рассматривалось как назначение терапии для этой группы пациентов. Текущие исследования показывают, что существует потенциал для реализации этого варианта лечения для различных подгрупп ACHD. Это обеспечило бы эффективный вариант лечения для этих пациентов и сняло бы часть текущей нагрузки на систему трансплантации.
Источник: «Advanced Heart Failure in Adults With Congenital Heart Disease» JACC: Heart Failure Volume 8, Issue 2, February 2020, Pages 87-99 Jonathan N.Menachem MD, Kelly H.Schlendorf MD, Jeremy A.Mazurek MD, David P.Bichell MD, D. Marshall Brinkley MD, Benjamin P.Frischhertz MD, Bret A.Mettler MD, Ashish S.Shah MD, SandipZalawadiya MBВ, Wendy Book MD, Jo Ann Lindenfeld MD
Сочетание трех генных мутаций приводит к смертельной наследственной патологии сердца у человека
Ученые считают, что более распространенные формы заболеваний могут быть результатом сочетания более тонких генетических мутаций, которые действуют вместе. Теперь исследователи использовали технологические достижения, чтобы доказать, что три тонких генетических варианта, унаследованных в семье, работали вместе, чтобы вызвать сердечные заболевания у нескольких братьев и сестер в очень раннем возрасте.
![]()
Врожденные пороки сердца встречаются у 1% живорожденных, и пострадавшим детям может потребоваться многократные операции, пожизненные лекарства или пересадка сердца. У многих пациентов точная причина врожденных пороков сердца неизвестна. Хотя становится все более очевидным, что эти пороки сердца могут быть вызваны генетическими мутациями, неясно, какие гены участвуют и как они взаимодействуют. Генетические мутации, также называемые генетическими вариантами, также могут вызывать нарушение функции сердца, но тип и степень выраженности дисфункции широко варьируются даже среди тех, у кого такая же мутация.
Проект «Геном человека» позволил ученым идентифицировать некоторые редкие случаи заболевания, вызванного тяжелыми мутациями одного гена, но ученые считают, что более распространенные формы заболевания могут быть результатом сочетания более тонких генетических мутаций, которые действуют вместе. Тем не менее, экспериментальное доказательство этой концепции человеческой болезни остается неуловимым - до сих пор.
В статье, опубликованной 31 мая 2019 г. в журнале Science, ученые из Институтов Гладстона и Калифорнийского университета в Сан-Франциско (UCSF) использовали технологические достижения, чтобы доказать, что три тонких генетических варианта, унаследованных в семье, работали вместе, чтобы вызвать сердечные заболевания у нескольких братьев и сестер в очень раннем возрасте.
«Идея о том, что несколько генетических вариантов необходимы для того, чтобы вызывать самые сложные заболевания, существует уже давно, но доказать это было сложно», - говорит Кейси Гиффорд, доктор философии, штатный сотрудник Gladstone, первый автор статьи. «С появлением редактирования генома CRISPR и улучшением технологии плюрипотентных стволовых клеток человека мы почувствовали, что у нас наконец-то появились правильные инструменты для проверки этой гипотезы, как только мы нашли подходящий случай для изучения».
Правильным случаем оказалась семья, в которой несколько детей страдали одной и той же формой тяжелого врожденного порока сердца, что привело к нарушению сократительной функции миокарда. Президент Gladstone и кардиолог UCSF Benioff Children's Hospital, доктор медицинских наук Дипак Шривастава, впервые столкнулись с семьей, когда он лечил двухмесячного ребенка от тяжелой левожелудочковой недостаточности, типа болезни сердца, когда клетки в левом желудочке не созревают полностью и поэтому он (миокард)не может хорошо сокращаться, что приводит к сердечной недостаточности. В то время как этот ребенок выжил после того, как ему потребовалась неотложная поддержка, у нее был брат, который умер в том же состоянии, что и плод, в третьем триместре, и у ее 4-летней сестры также было подобное состояние. Проведя тесты на сердцах обоих родителей, исследователи узнали, что у отца также была более легкая версия болезни у взрослых, в то время как сердце матери было в норме.
«Учитывая тяжесть заболевания у детей и тот факт, что у одного из родителей была бессимптомная форма, мы подозревали, что состояние детей было вызвано сочетанием генов матери и отца», - говорит Шривастава, старший исследователь.
Используя редактирование генома CRISPR, команда Шриваставы создала точно такие же мутации на одной копии каждого гена у мышей. У мышей, у которых была только одна копия двух вариантов отца или варианта матери, не было никаких признаков болезни сердца. Примечательно, что у мышей, у которых были все три варианта, были обнаружены пороки сердца, имитирующие дефекты, наблюдаемые у детей. Произошло не только повреждение структуры и функции сердца, сходное с заболеванием человека, но и изменения в экспрессии сотен других генов, необходимых для развития сердца и коронарной сосудистой сети.
«Наши результаты показывают, что ген, унаследованный от матери, усугубил проблему, вызванную генами отца, что привело к гораздо более тяжелой форме сердечно-сосудистых заболеваний у детей», - объяснил Гиффорд, научный сотрудник Фонда исследования рака Дэймона Руньона.
На последнем этапе исследователи создали индуцированные плюрипотентные стволовые клетки от каждого из членов семьи, а затем превратили стволовые клетки в сердечные клетки. В клетках детей, которые несут все три мутации, были признаки заболевания, в то время как в клетках родителей - нет.
Исследователи говорят, что исследование также отвечает на важный вопрос о том, как люди с одной и той же генной мутацией могут иметь разные формы заболевания. Например, мутации гена MYH7 ранее были вовлечены в несколько различных типов как врожденных, так и взрослых заболеваний сердца. Новые данные свидетельствуют о том, что ген-модификатор, в данном случае, NKX2-5, влияет на эффект вариантов MYH7, чтобы изменить, как проявляется заболевание.
«Эта работа, наконец, дает экспериментальное доказательство того, как ген-модификатор может функционировать, чтобы влиять на процесс заболевания у людей, и как несколько генов работают вместе, чтобы вызвать заболевание человека», - сказал Шривастава, который также является профессором педиатрии и биохимии и биофизики в UCSF. «Это указывает нам на то, как вы могли бы сделать мутацию в гене лучше или хуже в зависимости от того, с чем он сочетается. Это исследование открывает дверь для выявления генетических модификаторов заболевания и использования их в качестве мишеней для разработки новой терапии».
Эндоваскулярное закрытие открытого артериального протока с помощью окклюдера
![Панков Алексей Сергеевич]()
Во внутриутробном периоде ОАП есть у всех, это нормальный компонент кровообращения плода. После первого вдоха родившегося ребенка лёгочные сосуды раскрываются, давление в правом желудочке падает, ОАП постепенно перестает функционировать и закрывается (облитерируется). Облитерация протока происходит в различные сроки. У 1/3 детей он закрывается к двум неделям, у остальных - в течение восьми недель жизни.
Нарушения гемодинамики связаны с аномальным сбросом крови из аорты в лёгочную артерию, так как давление в аорте гораздо выше, чем в лёгочной артерии.
Объём сбрасываемой крови зависит от размеров протока. В результате нарушений кровообращения в большой круг кровообращения поступает меньший, чем положено, объём крови, от чего страдают жизненно важные органы (мозг, почки), скелетная мускулатура. Проходя через сосуды лёгких, эта кровь возвращается в левое предсердие, левый желудочек, которые, испытывая чрезмерную нагрузку, увеличиваются в размерах (гипертрофируются), затем под влиянием всё возрастающего объёма перенасыщенной кислородом крови происходят изменения сосудов лёгких и возникает лёгочная гипертензия.
Проявления и естественное течение порока
Дети рождаются с нормальной массой и длиной тела. Дальнейшие проявления заболевания связаны с размерами протока. Чем короче и шире ОАП, тем больший объём крови сбрасывается по нему и тем более выражена клиника заболевания. При узких и длинных ОАП больные дети ничем не отличаются от здоровых. Единственным признаком, указывающим на наличие ВПС, является шум, выслушиваемый врачом-педиатром над областью сердца. При широких и узких ОАП уже в первые месяцы и даже дни жизни ребенка могут обнаруживаться все симптомы (проявления) порока. У таких детей наблюдается постоянная бледность, при физической нагрузке (натуживание, сосание, крик) отмечается преходящий цианоз (синий оттенок кожи) преимущественно на ногах. Дети отстают в физическом развитии. У них отмечается склонность к повторяющимся бронхитам, пневмониям.
Наиболее тяжёлыми периодами в течении порока являются фаза адаптации в период новорождённости и фаза терминальной лёгочной гипертензии у детей старшего возраста. В эти периоды дети погибают от сердечной недостаточности, нарушений мозгового кровообращения (инсульт), пневмоний, инфекционного эндокардита. Средняя продолжительность жизни при ОАП без оперативного лечения - 25 лет, хотя многие больные при узком и длинном ОАП доживают до пожилого возраста. Если у взрослого пациента с ОАП развиваются признаки декомпенсации кровообращения - также рекомендовано выполнение операции по закрытию протока.
Лечение
Существует два метода лечения ОАП: консервативный, или медикаментозный, и оперативный. Медикаментозное лечение ОАП применяется только в родильном доме у новорождённых в течение двух первых недель жизни, позже оно становится неэффективным. Данный метод далеко не всегда результативен, имеет много противопоказаний, поэтому основным лечением является механическое закрытие протока.
Раньше наиболее распространённым вмешательством была перевязка протока после торакотомии. Сейчас операция перевязки ОАП выполняется очень редко. На ведущие роли вышла эндоваскулярная окклюзия ОАП. Суть вмешательства заключается в окклюзии (закрытии) протока специально изготовленными спиралями и окклюдерами. Методика почти не имеет осложнений, выполняется маленьким детям под наркозом, а подросткам и взрослым - под местной анестезией. Доступ осуществляется пункционным путем, через бедренную артерию. Эффективность операции почти стопроцентная, изредка наблюдается реканализация ОАП, которая впоследствии устраняется таким же образом. При широких и коротких ОАП, когда эндоваскулярная окклюзия ОАП спиралями технически невозможна, применяется закрытие ОАП с помощью специально разработанных окклюдеров, которые также доставляются через бедренную артерию.
Описание клинического случая.
Больная С, 67 лет, поступила в стационарное отделение скорой медицинской помощи 18.09.2017 г. с диагнозом: Врожденный порок сердца: открытый артериальный проток (диаметр 4мм, длина 13 мм). При поступлении предъявляет жалобы на слабость и одышку при ходьбе. В анамнезе ГБ с максимальным повышением АД до 200/100 мм.рт.ст., адаптирована к 140/80 мм.рт.ст. Принимает конкор, амлодипин, торвакард. В течение года отмечает появление одышки при ходьбе. При обследовании по данным ЭХО КГ обнаружен ВПС: открытый артериальный проток, признаки умеренной легочной гипертензии. По данным МСКТ диаметр артериального протока составил 4 мм.
Учитывая ухудшение самочуствия и появление легочной гипертензии, принято решение о выполнении транскатетерного закрытия ОАП.
Описание операции (22.09.2017)
Под местной анестезией пунктированы правые общая бедренная артерия и общая бедренная вена. Диагностический катетер проведен в грудой отдел аорты. Выполнена ангиография, визуализируется открытый артериальный проток, соединяющий аорту и легочную артерию. Далее через интродъюсер в правой ОБВ по проводнику через артериальный проток в нисходящую часть аорты заведен катетер. Катетер заменен на доставляющее устройство окклюдера. Выполнена имплантация окклюдера "Amplatzer Duct Occluder" с расположением дистального диска окклюдера со стороны аорты, проксимального - со стороны легочной артерии. На контрольной ангиографии позиция окклюдера в артериальном протоке оптимальна, отмечается редукция кровотока по артериальному протоку. Получен хороший ангиографический результат.
На следующий день пациентка выписана из стационара в удовлетворительном состоянии.
Читайте также: