Перспективы изучения внеклеточного матрикса и межклеточных контактов
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Цель исследований - изучение новых функций молекул внеклеточного матрикса (ВКМ) в мозге. Эти молекулы вырабатываются нейронами и глиальными клетками и выделяются в зависимости от активности во внеклеточное пространство, где они накапливаются и формируют хорошо заметные структуры, такие как перинейрональные сети. Эти структуры ВКМ регулируют возбудимость нейронов, эффективность межнейронных коммуникаций и могут являться частью долгосрочной памяти.
В рамках проекта создана лаборатория по изучению внеклеточного матрикса мозга. Заведующим лабораторией является профессор, руководитель лаборатории Немецкого Центра Нейродегенеративных Болезней (Германия) Дитятев Александр Эдуардович (h-индекс 37).
Значимость результатов
Получены новые фундаментальные сведения о роли молекул внеклеточного матрикса головного мозга в норме и при различных патологиях (эпилепсия, шизофрения), что открывает новые перспективы для терапевтического лечения этих расстройств.
Работы над проектом выполнялись в тесном сотрудничестве с ведущими европейскими научными центрами по изучению функционирования головного мозга, результаты исследований опубликованы в крупных международных научных периодических изданиях. Ряд талантливых студентов и аспирантов прошли международные научные школы и стажировки в рамках проекта.
Результаты
- Проведены эксперименты по изучению эпилептогенеза, вызванного разрушением ВКМ посредством двух ферментов - гиалуронидазы и гепариназы.
- Разработаны подходы и методы визуализации синаптической пластичности и ассоциированных изменений в матриксе. Выявлена тонкая структура внеклеточного матрикса, окружающего синапсы на дендритах нейронов. Применён метод STORM-микроскопии с супер-разрешением (Stochastic optical reconstruction microscopy) в сочетании с вторичными антителами, мечеными парами флуорофоров, такими как AlexaFluor405-AlexaFluor647 и Cy3-AlexaFluor647.
- Проведено количественное моделирование синаптической динамики с применением математической модели четырёхкомпонентного синапса.
- Изучена роль молекул внеклеточного матрикса в регуляции синаптической пластичности.
- Проведен анализ поведения, характерного для модели шизофрении, вызванной блокадой NMDA рецепторов антагонистом МК801.
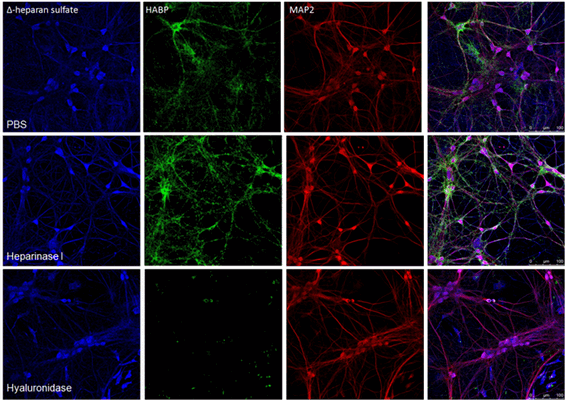
Диссоциированные эмбриональные культуры клеток гиппокампа мыши на 20-й день развития, обработанные ферментами, разрушиющими внеклеточный матрикс - гепариназой I и гиалуронидазой.
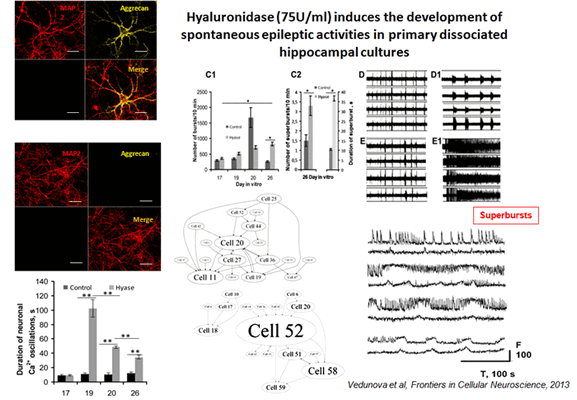
Разрушение внеклеточного матрикса гиалуронидазой (75U / ml) индуцирует развитие спонтанной эпилептической активности в первичных диссоциированных культурах гиппокампа
Рак, шрам и эмбрион
Из школьного курса биологии известно, что все живые организмы состоят из клеток. Но ткани многих многоклеточных организмов, прежде всего животных, состоят не только из клеток, но и из внеклеточного матрикса, который обеспечивает клеткам механическую поддержку, помогает сохранять определенное расположение в пространстве и влияет на многие физиологические показатели.

Клетка на волокнах
Фото: Предоставлено Дмитриемй Багровым и Анастасией Соколовой
Внеклеточный матрикс — это сложное образование, состав и структура которого зависят от функций, выполняемых тканью или органом. У человека и животных он представляет собой волокнистую структуру, состоящую в основном из гиалуроновой кислоты и структурных белков (коллагена, фибронектина, эластина и других). Взаимодействие между клетками и внеклеточным матриксом имеет огромное значение для многих процессов в норме и при патологии.
Это взаимодействие рассматривают с использованием двух основных подходов — биохимического и физического. Первый из них предполагает определение белков, которые участвуют в формировании контактов между клетками и волокнами матрикса, а также способов передачи сигналов через эти белки. Второй подход задает вопросы, как рельеф и механические свойства матрикса влияют на клетки и как клетки могут влиять на матрикс — делать его жестче или мягче, натягивать и т. п. Ученые сравнительно недавно осознали важность физических параметров и долгое время им не уделяли должного внимания из-за того, что их сравнительно сложно измерить и стандартизовать.
Считается, что существует определенный набор механических параметров внеклеточного матрикса, оптимальных для роста клеток: жесткости, пластичности, деформации, механического напряжения и других. Клетки способны регистрировать эти параметры и реагировать на их изменения — этот процесс называется механотрансдукцией. Если жесткость субстрата и напряжение в нем недостаточны, активируются сигнальные пути, ответственные за синтез компонентов внеклеточного матрикса. Кроме того, клетка натягивает субстрат в местах контактов с ним (в так называемых фокальных контактах). Если же жесткость субстрата и напряжение в нем превышают оптимальные значения, клетка снижает передаваемую субстрату нагрузку, уменьшает секрецию компонентов матрикса и выделяет разрушающие его ферменты (например, металлопротеиназы). Передача внешних механических сил через цитоскелет на ядро приводит к активации механочувствительных каналов на поверхности ядерной мембраны, вследствие чего меняется активность внутриядерных образований: происходит сворачивание хроматина, изменяется доступ ключевых белков к сайтам регуляции и транскрипции генов.
Нарушения регуляции этого цикла может быть причиной различных патологий: фиброза (образование рубцов в различных органах), остеопороза, атеросклероза. Особенное значение механические свойства внеклеточного матрикса имеют в контексте онкологических заболеваний. Несмотря на то что отправной точкой образования опухоли является генетический сбой, развитие опухоли определяется в том числе и процессами, происходящими во внеклеточном матриксе.
Рассмотрим этот процесс на примере эпителиальных тканей. В норме эпителиальные клетки имеют полярное строение (клетки имеют «верх» и «низ»), плотно соединены друг с другом и отделены от основной массы матрикса (стромы) базальной мембраной. В строме находятся фибробласты и неактивированные иммунные клетки, а сам внеклеточный матрикс напоминает свободную сеть, сплетенную из коллагена первого и третьего типов, эластина, фибронектина и погруженную в гель протеогликанов. Такая структура обеспечивает устойчивость к различным воздействиям: растяжению, сдавливанию. Фибробласты помимо коллагена вырабатывают белки, его разрушающие,— металлопротеиназы, а также их ингибиторы. Количество этих белков регулируется самими же клетками в ответ на сигналы извне, в том числе механические. Таким образом, за счет постоянной обратной связи поддерживается нормальная структура ткани.
Когда происходит злокачественная трансформация эпителиальных клеток, они начинают секретировать различные факторы роста, которые облегчают активацию и дифференцировку фибробластов. Принимая сигнал «слишком мягко», фибробласты уменьшают количество металлопротеиназ, усиливают секрецию белков внеклеточного матрикса и, следовательно, увеличивают его жесткость. Кроме того, эпителиальные раковые клетки вырабатывают набор сигналов, имитирующих воспаление, что способствует превращению обычных фибробластов в опухоль-ассоциированные. У таких клеток «сломана» биологическая обратная связь. Они постоянно секретируют коллаген и белки, сшивающие его в толстые тяжи, из-за чего жесткость стромы постоянно повышается. Повышение жесткости матрикса, в свою очередь, способствует повышению агрессивности раковых клеток. Неконтролируемый рост клеток приводит к тому, что самые агрессивные начинают искать пути эвакуации. Они разлагают жесткий внеклеточный матрикс своими металлопротеиназами и мигрируют к кровеносным сосудам по тем тяжам, которые выложили для них опухоль-ассоциированные фибробласты. Так происходит метастазирование. Мигрирующие раковые клетки выходят из сосудов в отдаленных органах и начинают вырабатывать сигналы, модифицирующие среду, чтобы развить вторичные опухоли.
Именно поэтому многие опухоли мягких тканей обнаруживают как уплотнения, это часто бывает, например, при раке груди, кожи, предстательной железы и других. Повышенная жесткость опухоли определяется одновременным действием нескольких факторов: быстрого деления клеток, разрастания и уплотнения внеклеточного матрикса, разрастания сети сосудов, в некоторых случаях увеличением давления внеклеточной жидкости. Более жесткие опухоли обычно более устойчивы к химиотерапии, а значит, этот параметр может быть прогностическими и способствовать выбору терапии. На уровне отдельных клеток опухоль не жестче, а мягче: раковые клетки обычно на 20-50% мягче, чем нормальные. Это обычно объясняют тем, что раковые клетки имеют менее развитый актиновый цитоскелет — сеть волокон, которые обеспечивают движение клеток, помогают клеткам поддерживать форму и внутриклеточный транспорт. В здоровых клетках актиновый цитоскелет формирует хорошо заметные протяженные тяжи, а в раковых он сравнительно рыхлый и слабоструктурированный. Проще говоря, раковые клетки при быстром делении не успевают сформировать развитые волокна цитоскелета и меньше нуждаются в нем, чем нормальные клетки.
Как ученые исследуют механотрансдукцию? Для исследования взаимодействия между клеткой и субстратом можно использовать двумерные или трехмерные системы. Двумерные системы используются в клеточной биологии традиционно: клетки обычно выращивают на донышках чашек Петри или планшетов. Однако в последние годы становится ясно, что в таких системах не удается воспроизвести многие биологические особенности, и исследователи переходят к культивированию клеток на гелях. Клетки помещают на поверхность или в объем мягкого геля, который обычно делают на основе коллагена. Варьируя химический состав и условия приготовления геля, можно определить влияние жесткости субстрата на клетки — проследить, как от жесткости субстрата зависят их форма, скорость миграции, скорость деления и другие параметры.
Помимо жесткости на поведение клеток влияет рельеф субстрата. Например, если структура сформирована тяжами, то клетки будут вытягиваться вдоль них. Это явление называют «контактным ориентированием». Оно играет важную роль при формировании органов у эмбриона, затягивании ран и метастазировании. Словно поезд по рельсам, клетки движутся в «пункт назначения» — к месту, где должен быть глаз; в центр раны или в кровеносное русло. Так как не всегда возможно и удобно исследовать контактное ориентирование in vivo — в живых объектах, было предложено использовать подложки, на которых специальными физико-химическими методами сформированы выступы или бороздки. Чтобы более точно имитировать структуру внеклеточного матрикса, используют подложки из тончайших волокон. Их достоинство — возможность визуализировать контакты клетки с индивидуальными волокнами.
Кто рубит коллагеновый лес
Обзор
Автор
Редактор
Статья на конкурс «био/мол/текст»: Окружение, в котором «живет» клетка, влияет на все аспекты ее существования. Поэтому любые изменения в этом окружении неизбежно отразятся и на самой клетке — элементарной единице живого организма. Как говорится, ломать — не строить. Проще всего изменить окружение клетки (кроме прямого физического разрушения) химическим путем, «включив» специальные белки — матриксные металлопротеиназы (ММП). Это семейство протеолитических ферментов, которые специфически разрушают многочисленные компоненты клеточного окружения и тем самым способствуют ряду важных функций организма — от обеспечения миграции клеток до заживления ран.
Обратите внимание!
Эта работа опубликована в номинации «лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Дремучий коллагеновый лес
Ни для кого не секрет (и, честно говоря, это просто следует из названия), что все многоклеточные организмы состоят из клеток. Но для многих невдомек, что эти клетки окружает. Часто клетки в организме ошибочно представляют себе как плотно уложенные кирпичики, накрепко сцементированные между собой.
На самом деле это справедливо (да и то лишь отчасти) для клеток эпителиальной ткани, что выстилает полости нашего тела, слизистые оболочки внутренних органов, дыхательной системы, пищеварительного тракта и мочеполовых путей, а также образует большинство желез организма. В остальных же случаях клетки, как правило, располагаются не так близко друг к другу, а в случае крови (это же тоже ткань, хоть и жидкая!) клетки вообще практически не связаны и относительно свободно переносятся по всему организму, выполняя свои физиологические функции. Некоторые клетки даже могут самостоятельно передвигаться и проникать в ткани, ориентируясь на биологические, химические и физические аттрактанты (примерно так же ориентируются в пространстве одноклеточные эукариоты — протисты).
Можно сказать, что клетки нашего организма (за исключением самых первых в эмбриогенезе — бластомеров) окружены субстанцией, поддерживающей их на определенном месте относительно других клеток организма. Субстанцией, интегрирующей все клетки, ткани и органы нашего тела в отдельные кластеры, а уже затем в единую систему, называемую организмом. Клетки можно сравнить с грибами, растущими в лесу — некоторые, как опята, грузди или лисички, растут скученно (эпителиальная, мышечная ткани), а некоторые — порознь, как боровики и белые грибы (соединительная, нервная ткани) (рис. 1). Как известно из школьного курса биологии, грибы вступают в очень тесный симбиотический контакт с деревьями, поэтому на рост грибов влияет состояние леса, в котором они растут, а рост леса, в свою очередь, зависит от грибов*. Клетки в нашем организме тоже живут в «лесу», который прямо или косвенно влияет на их рост, и который растет благодаря им. Этот лес — внеклеточный матрикс (рис. 2). Быстро пройдемся по видовому разнообразию матрикса.
Внеклеточным матриксом (далее ВКМ) называют все внеклеточные структуры ткани с белками и полисахаридами, входящими в его состав. «Деревья» клеточного леса можно разделить на несколько групп: гликопротеины, протеогликаны и гиалуроновая кислота.
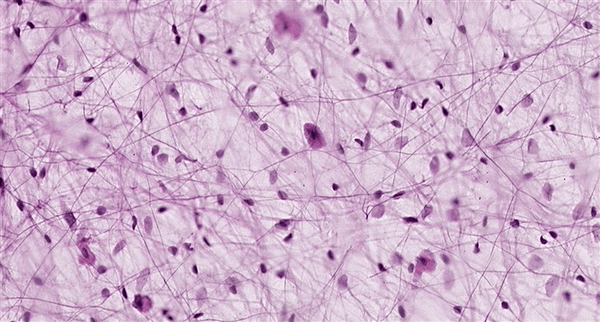
Рисунок 1. «Коллагеновый лес». На фото представлена так называемая рыхлая соединительная ткань. Тонкие нити представляют собой волокнистые компоненты внеклеточного матрикса, а клетки как бы «подвешены» на них. Рисунок с сайта StudyBlue.
Особо стоит выделить гликопротеин под названием коллаген, ведь это самый распространенный белок не только во внеклеточном матриксе, но и во всем организме человека. Можно сказать, что наши клетки действительно живут в самом настоящем «коллагеновом лесу». Коллаген обеспечивает структурную поддержку ткани, придает ей твердость и стойкость. Вторым замечательным гликопротеином ВКМ является эластин. Он, в противоположность коллагену, наоборот придает ткани упругость и растяжимость; находится, соответственно, там, где эта растяжимость больше всего нужна (гладкая мышечная ткань; стенки артерий, легких, связок).
Особняком стоит подкласс гликопротеинов, называемый протеогликанами. Протеогликаны — особые белковые молекулы с очень высокой степенью гликозилирования (насыщенностью углеводами) (около 90-95% массы белка), соединенные с молекулами гликозаминогликанов. Гликозилирование обусловливает исключительную способность протеогликанов накапливать воду и полезные вещества, вроде факторов роста. Они в чем-то похожи на сфагнум — подстилку болота.
Третий основной компонент клеточного леса — гиалуроновая кислота. Ее главное отличие от всех остальных гликозаминогликанов в том, что она не подвергается сульфированию и синтезируются на клеточной стенке. Не обладая большой склонностью к образованию комплексов с другими компонентами ВКМ, гиалуроновая кислота тем не менее выполняет ряд важных функций. Так, гиалуроновая кислота необходима для поддержания гидродинамики тканей, играет важную роль в процессах миграции и пролиферации клеток.
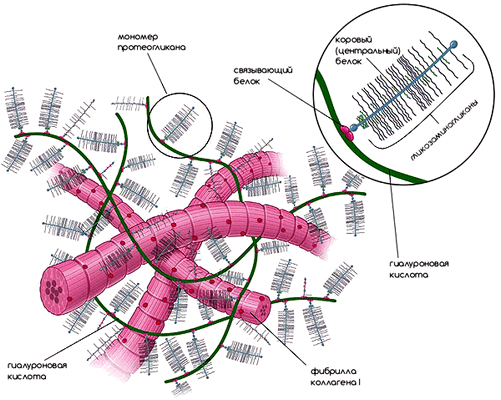
Рисунок 2. Внеклеточный матрикс. Компоненты внеклеточного матрикса органично переплетаются друг с другом и образуют каркас для клеток. Рисунок из [1].
На границе клетка—ВКМ существуют интересные белки — интегрины и фибронектины. Первые как бы находятся и в клетке, и вне ее, называясь трансмембранными, а вторые соединяют внешние концы интегринов. Это те белки, через которые ВКМ может прямо влиять на жизнь клетки (заставить ее делиться, двигаться, умереть и т.д.) [1].
ВКМ выполняет интегрирующую функцию по отношению ко всем клеткам организма. Можно сказать, что ВКМ «склеивает» вместе клетки и органы многоклеточного организма. Даже эпителиальная ткань, чьи клетки словно сшиты и плотно прилегают друг к другу, также интегрирована в общую организменную среду через особую прослойку ВКМ, называемую базальной ламиной.
Не всё так спокойно в коллагеновом лесу
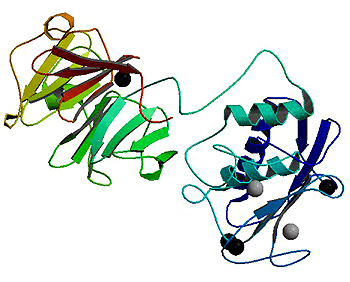
Рисунок 3. Структура коллагеназы ММП-1, полученная методом рентгенкристаллографии. Рисунок с сайта Protein Data Bank.
Коллагеновый лес систематически вырубают. Не подчистую, конечно же, к тому же на месте поваленных деревьев появляются новые (не без участия окружающих клеток), и экологическое равновесие не нарушается. Но зачем кому-то вырубать лес, а главное, кто его вырубает?
ВКМ, конечно, выполняет доброе дело, поддерживая клетки, ткани и органы, но протиснуться сквозь дебри коллагеновых волокон среднестатистической клетке довольно проблематично, а двигаться клеткам порой приходится очень много, особенно тем, что защищают организм от интервентов. Да что там говорить, даже очень активной раковой клетке необходимо как-то метастазировать и буквально прорубать себе путь. Клеткам необходима помощь тех, кто мог бы снаружи разрушать коллаген и прочие молекулы ВКМ и отцеплять клетку от внешних волокон. Эту роль лесорубов в организме многоклеточных животных выполняют несколько крупных семейств молекул, из которых самой многочисленной является семейство матриксных металлопротеиназ (далее ММП) (рис. 3) 2.
В семейство ММП входит более 20 ферментов. Это семейство способно расщеплять почти все компоненты внеклеточного матрикса соединительных тканей. ММП сопровождают нас на протяжении всей нашей жизни — от момента прикрепления эмбриона к матке до самой смерти. Структура ММП незатейлива и мало отличается в целом по группе, однако функции разных ММП могут порой отличаться довольно сильно. Основой протеиназы являются два домена: про-домен и каталитический домен (рис. 4) [2, 6].
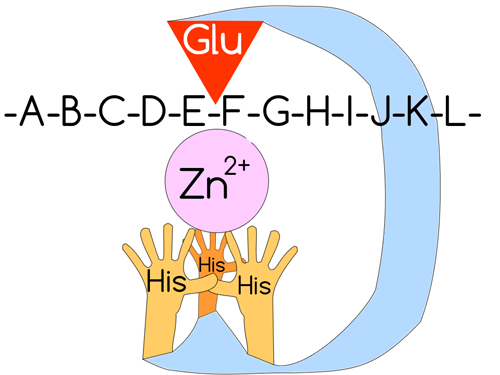
Рисунок 4. Схематическое строение активного центра ММП. Три «гистидиновые руки» удерживают ион цинка и координируют его относительно остатка глутаминовой кислоты. «-A-B-C-D-E-F-G-H-I-J-K-L-» — последовательность аминокислот белка. Суть протеолиза ММП в разрушении пептидной связи — «дефиса» между двумя буквами.
Про-домен нужен ММП чтобы активироваться лишь в нужный для клетки момент. Действительно, если мы начнем беспорядочно рубить коллаген налево-направо, от этого будет мало толку (скорее, организм превратится в бесформенную массу). Поэтому на про-домене также располагается так называемый «цистеиновый переключатель», который предотвращает доступ воды к иону цинка, тем самым оберегая ММП от активации. Каталитический же домен обусловливает собственно реакцию разрушения белка, и в типичной ММП содержит в своем активном сайте ион цинка (Zn 2+ ) (поэтому матриксные металлопротеиназы имеют приставку металло-), который как бы удерживается на весу тремя гистидиновыми «руками», которые координируют цинк [3, 6]. Кратко механизм катализируемой протеолитической реакции изображен на рисунке 5.
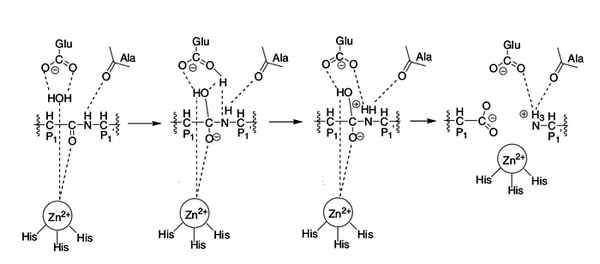
Рисунок 5. Механизм реакции протеолиза при участии ММП. Пептидная связь расщепляемого белка ориентируется на активный цинковый центр. Карбонильная группа атакуется молекулой воды, которая связана водородными связями с глутаминовой кислотой и также сориентирована на активный цинковый центр. Молекула воды жертвует протон остатку глутаминовой кислоты, который переносит его к атому азота расщепляемой пептидной связи [3]. Рисунок из [2].
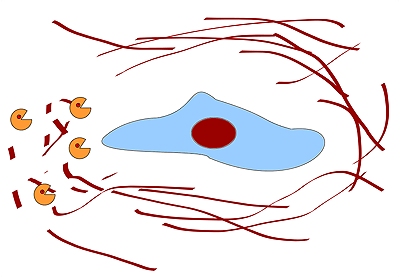
Рисунок 6. ММП разрушают внеклеточный матрикс.
Кроме того, за исключением некоторых представителей, ММП имеют гибкую богатую аминокислотой пролином шарнирную область и карбокси-(C)-концевой гемопексин-подобный домен, чья функция заключается в специфичном распознавании субстрата. Другие домены «протеазоспецифичны» и выполняют специфические функции. Например, четыре мембранные ММП (ММП-14, -15, -16 и -24) имеют так называемый трансмембранный цитозольный домен, который позволяет закрепляться им на поверхности мембраны клетки и «рубить» по мере того, как клетка продвигается вперед [6].
Без дровосеков никуда
Так как ВКМ представлен практически во всех тканях в более или менее выраженной степени, ММП простирают свои цинко-глутаминовые щупальца на все ткани организма. Такое фундаментальное значение определяет роли, выполняемые ММП — как положительные, так и отрицательные.
Миграция клеток
На первый взгляд клетки человека кажутся статичными — движутся разве что форменные элементы крови. Однако на самом деле в организме постоянно происходят миграции клеток (от эпителиальных и мезенхимальных, до нервных и костных), причем на довольно приличные для клетки расстояния.
Замечательным примером служит миграция клеток нервного гребня (рис. 7). Нервный гребень — совокупность клеток позвоночных животных на определенной стадии эмбриогенеза, выделяющаяся из краевых отделов нервного желобка во время его замыкания в нервную трубку. В процессе индивидуального развития организма клетки нервного гребня мигрируют порой в самые неожиданные места и на очень далекие расстояния.
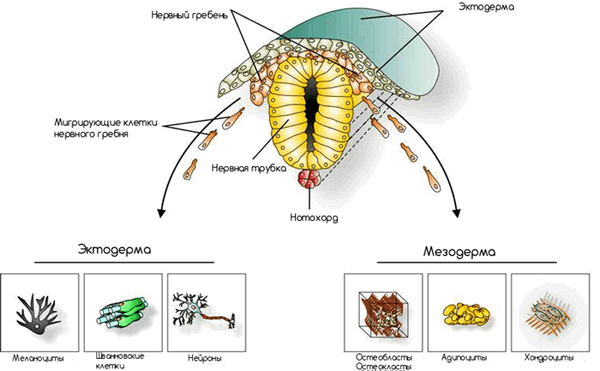
Рисунок 7. Схематическое расположение клеток нервного гребня на этапе эмбриогенеза. Рисунок с сайта Билефельдского университета.
Есть три основных пути миграции:
- Вниз, образуя симпатические и парасимпатические ганглии, вещество надпочечников.
- Также вниз, но с образованием спинальных ганглиев.
- Прямо под эктодерму, радиально в стороны от нервной трубки с образованием меланоцитов (специализированных клеток кожи, вырабатывающих пигмент меланин) [7].
Движение клетки является многоэтапным процессом. Сначала клетка должна сменить свою стратегию поведения с прикрепительного (адгезивного) на миграционный. Затем следует активация двигательной функции цитоскелета клетки, изменение адгезивных сайтов и адгезивных молекул на поверхности клетки и «вырубка» ВКМ для устранения физических барьеров. Отдельная роль отводится хемоаттрактантам (химическим веществам, по которым клетка ориентируется в пространстве), так как именно они будут вести клетку в нужном направлении. Очевидно, что главным препятствием для клетки является тот самый коллагеновый лес, которым она окружена со всех сторон. Ключевая роль здесь отводится ММП, которые как раз и прочищают путь для клетки [2, 4, 6].
ВКМ управляет делением клеток и их запрограммированной смертью
Давно известно, что взаимодействия между ВКМ и молекулами на поверхности клетки регулируют поведение клетки. Опосредованную роль в фундаментальных клеточных процессах, таких как деление, апоптоз (запрограммированная клеточная смерть), дифференцировка и жизнь клетки вообще играют ММП. Хотя исследований на эту тему довольно мало, достоверно известно, что их опосредованная роль заключается в изменении окружения клетки и в специфических взаимодействиях с молекулами на поверхности клетки.
Были проведены эксперименты на разных культурах клеток, и во всех результаты оказались схожими — подавление (ингибирование) ММП приводило к уменьшению пролиферативной активности клеток (они просто меньше делились) и увеличению общего содержания компонентов ВКМ. Можно считать, активность ММП может быть необходима для запуска пролиферативного сигнала.
В то же время ММП могут вызвать запрограммированную смерть клетки — апоптоз. Протеиназы или «неправильные» молекулы ВКМ (т.е. поврежденные или бракованные) могут привести к такому исходу возможно из-за того, что они изменяют сигналы, которые приходят на интегрины [5, 6].
Морфогенез тканей
Морфогенез — возникновение и развитие органов, систем и частей тела организмов в онтогенезе (индивидуальном развитии) и филогенезе (историческом развитии). ММП принимают непосредственное участие в морфогенезе тканей, и неправильное функционирование и пространственное расположение ММП могут существенным образом влиять на процессы тканеобразования, приводя к печальным последствиям. В большинстве случаев возможны вариации активности ММП, что приводит к появлению в процессе онтогенеза различных морфологических структур.
Эксперименты на адипоцитах (клетках жировой ткани), помещенных на базальную мембрану, показали, что они мигрируют и самоорганизуются в большие многоклеточные кластеры. Эти клетки секретируют ММП-2, а ингибирование ММП приводит к подавлению миграции клеток и организации их в трехмерные структуры (рис. 8) [6].
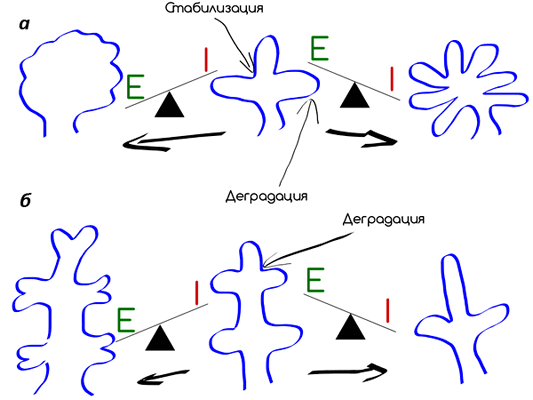
Рисунок 8. «Разветвление» эпителия в процессе морфогенеза зависит от баланса протеиназ и ингибитора протеиназ. а — Подчелюстной железистый эпителий разветвляется с образованием стабилизированных коллагеновых расщелин, сопряженное с ростом эпителия, проникающего дальше. В этом случае высокая активность протеаз приводит к меньшему ветвлению, а высокая активность ингибитора наоборот — к большему ветвлению. б — Эпителий почек ветвится почкованием, которое требует активности протеаз для того, чтобы прорости в окружающую мезенхиму. В этом случае, высокая активность протеаз будет приводить к повышенному уровню ветвления, а высокая активность ингибирования — к пониженному.
Заживление ран
Заживление кожи — комплексный процесс, в который вовлечены несколько подпроцессов: миграция клеток, деградация ВКМ и реорганизация ткани (рис. 9).
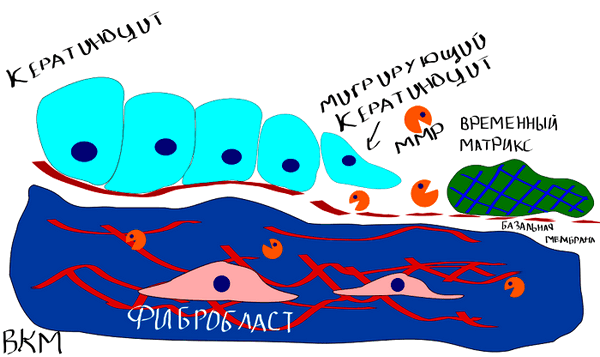
Рисунок 9. Заживление раны на коже. Кератиноциты на самом краю раны должны мигрировать внутрь нее, дабы рана смогла зарасти новыми клетками кожи. Затем богатый фибрином временный матрикс (так называемая «корочка», которая лежит на ране) должен быть разрушен. Дерма также вносит свой вклад в затягивании раны, стягивая ВКМ. Сам же процесс миграции кератиноцитов, как уже можно было догадаться, также опосредован ММП [5, 6].
Заключение
Взаимодействия клеток с внеклеточным матриксом все более интересуют исследователей по всему миру. Очевиден прикладной аспект таких исследований — причиной многих заболеваний является нарушение баланса между деградацией и синтезом компонентов внеклеточного матрикса. Например, характер ремоделирования поврежденных тканей сердца после инфаркта миокарда определяет будущую судьбу человека — нарушение тонкого баланса может повлечь как неправильную работу главной насосной станции нашего тела, так и полную ее остановку. Регуляция процесса ремоделирования сердечной ткани есть перспективное направление исследований в регенеративной медицине*, которое позволит несколько сократить потребность в серьезных хирургических вмешательствах [8].
* — Действительно, в последние годы роль микроокружения в развитии всех клеток (в том числе и раковых) внезапно настолько хорошо осозналась, что и само развитие рака, и потенциальные пути его полного излечения начинают искать не только в «сошедших с ума» клетках, но и в их непосредственном окружении: «Опухолевые разговоры, или Роль микроокружения в развитии рака» [9]. — Ред.
Очевидна роль ремоделирования внеклеточного матрикса при метастазировании опухолей — миграция клеток опухоли на большие расстояния невозможна просто напропалую, опухолевой клетке нужны как ориентиры в пространстве, так и средства для расчистки всего, что попадается ей на пути. Отталкиваясь от этого факта можно заключить, что подавления метастазирования рака можно достичь путем ловких манипуляций характером ремоделирования ВКМ в зоне опухоли [10].
Но за всей прикладной «мишурой» скрывается фундаментальный смысл. Попытки напечатать целый паренхимный (вроде почки, печени, где важна микроструктура) орган «from scratch» не увенчались успехом из-за нерешенной проблемы васкуляризации (построение кровеносной сети внутри органа). Эта проблема может быть решена, если научиться создавать органы так, как они появлялись на начальных этапах нашего индивидуального развития в ходе эмбриогенеза. А здесь уже, несомненно, решающую роль играет динамическое изменение клеточного окружения, естественно, не без участия матриксных металлопротеиназ.
Тот, кто сможет в процессе индукции собрать все частные сведения о построении тканей и органов в нашем теле и сможет объяснить, как все мельчайшие функциональные составные части нашего тела влияют друг на друга и образуют сложнейший из возможных ансамблей в нашей жизни, сможет раскрыть одну из величайших тайн современной биологии.
Лаборатория по изучению внеклеточного матрикса мозга
Общая информация
Лаборатория создана в рамках гранта Правительства Российской Федерации (мегагранта), соглашение № 11.G34.31.001, 2011-2014 гг. «Внеклеточный матрикс мозга как детерминант межклеточных коммуникаций и мишень терапевтических воздействий».
Целью исследований является изучение новых функций молекул внеклеточного матрикса (ВКМ) в мозге. Эти молекулы вырабатываются нейронами и глиальными клетками и выделяются в зависимости от активности во внеклеточное пространство, где они накапливаются и формируют хорошо заметные структуры, такие как перинейрональные сети. Эти структуры ВКМ регулируют возбудимость нейронов, эффективность межнейронных коммуникаций и могут являться частью долгосрочной памяти.
Дерегуляция ВКМ связана с тяжёлыми нарушениями функций мозга, такими как эпилепсия и шизофрения. Понимание основных механизмов может открыть новые перспективы для терапевтического лечения этих расстройств.
Заведующим лабораторией является PhD, профессор Немецкого центра нейродегенеративных заболеваний (Германия) Дитятев Александр Эдуардович (h-индекс 37).
Перспективы изучения внеклеточного матрикса и межклеточных контактов
Рис. 2 Инъекционная форма гидрогелевого миметика БМКГ [21]:
А — общий вид БМКГ в шприце
В — макроструктура БМКГ (оптическая микроскопия, x40)
С — микроструктура БМКГ (сканирующая электронная микроскопия)
В серии работ была доказана эффективность использования БМКГ в качестве матрикса в биомедицинских клеточных продуктах для регенерации поврежденных суставного хряща, печени и поджелудочной железы [23]. На базе АО «БИОМИР сервис» (г. Краснознаменск) налажен выпуск трех видов БМКГ под торговым знаком Сферо ГЕЛЬ («Композиция гетерогенного имплантируемого геля Сферо ГЕЛЬ», рег. уд. № ФСР 2012/13033 от 15.07.2015 г.), отличающихся размером микрочастиц «сшитого» коллагена и вязкостью «несшитого» гидрогеля.
Однако при всех своих неоспоримых преимуществах и доказанной эффективности даже многокомпонентные биомиметики не обладают тканеспецифическими свойствами, т. е. не способны избирательно поддерживать адгезию и пролиферацию клеток конкретной ткани. В последнее время наблюдается большой интерес к тканеспецифическим матриксам, изготовленным путем децеллюляризации, т. е. удаления клеток, их фрагментов и ядерного (генетического) материала из аллогенных или ксеногенных тканей с сохранением структурных, биохимических и биомеханических свойств природного ВКМ [24]. В отличие от гидрогелевых миметиков ВКМ, включая БМКГ, матриксы из децеллюляризованных тканей относятся к группе тканевых миметиков ВКМ, обладающих специфическими (относительно конкретной ткани или органа) свойствами, которые выражаются в сохранении как максимального состава ВКМ ткани, так и его архитектоники.
Рис. 3 АСМ-изображение гетерогенной компоненты БМКГ методом криоСЗМ (сканирующий зондовый микроскоп) после среза при температуре −80° С [22]
Децеллюляризация представляет собой процедуру обработки тканей, обеспечивающую разрушение клеток при максимальном сохранении внеклеточного матрикса, чьи белки, в отличие от клеток, несут незначительное количество антигенов, вызывающих иммуногенность, обеспечивая при этом для культивируемых клеток наиболее биохимически и функционально адекватное микроокружение [25]. Каркасные белки нативных матриксов интегративно содержат в своем составе остатки тканевых структур (гликопротеиды внеклеточного вещества, структурные белки межклеточных контактов и факторы прикрепления клеток), которые позволяют оптимизировать условия для пролонгированной жизнедеятельности прикрепившихся клеток. Заметим, что в качестве тканеспецифического матрикса целесообразно использовать микродисперсный матрикс, что позволяет обеспечить полноту удаления клеток и отмывки от поверхностно-активных веществ, облегчить рецеллюляризацию матрикса клетками за счет увеличения площади для заселения при сохранении объема и имплантировать клеточно-инженерную конструкцию инъекционным способом [26].
На сегодня известно применение децеллюляризации для формирования тканеспецифических матриксов из кровеносных сосудов, сердца или отдельных сердечных клапанов, хряща, печени, легких, жировой ткани, кожи, почек, сухожилий, нервов и поджелудочной железы ксеногенного происхождения [27, 28].
Для децеллюляризации применяется широкий спектр методов: обработка кислотами и щелочами [27, 28], циклическое замораживание и оттаивание [29], экспозиция в гипо и гипертонических растворах [30, 31]. Наиболее эффективны методы децеллюляризации под действием ионных, неионных и цвиттерионных поверхностно-активных веществ (ПАВ), которые удаляют клеточный и ядерный материалы из ткани, растворяя клеточную мембрану, вызывают диссоциацию ДНК и белков [32, 33].
Недавно с использованием комплекса химических и физических способов обработки нами был разработан способ получения тканеспецифического микродисперсного матрикса из децеллюляризованного суставного хряща свиньи с сохранением морфофункциональных свойств ВКМ, обеспечивающий полное удаление из хрящевой ткани клеточных элементов при сохранении морфологии и состава ВКМ (рис. 4) [34].
Диапазон размеров полученных микродисперсных частиц хряща указывает на возможность их инъекционного введения (Заметим, при иммуногистохимическом окрашивании было установлено (см. рис. 6), что все, без исключения, микрочастицы равномерно окрашивались на коллаген II типа, основной тип коллагена суставного хряща (>90% от всего коллагена в суставном хряще). Это свидетельствует о том, что предложенный протокол децеллюляризации суставного хряща [34] позволяет не только обеспечить высокую биосовместимость матрикса, в том числе отсутствие иммуногенности, но и сохранить основной белковый компонент ВКМ.
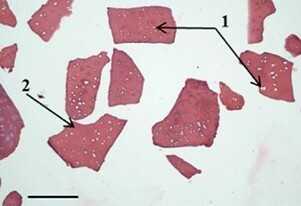
Рис. 4 Микродисперсный матрикс из децеллюляризованного суставного хряща свиньи (тканевой миметик ВКМ) [34]. Оптическая микроскопия. Окрашивание гематоксилином и эозином.
Размер масштабной линейки 200 мкм.
1 — пустые лакуны (без клеток), 2 — ВКМ
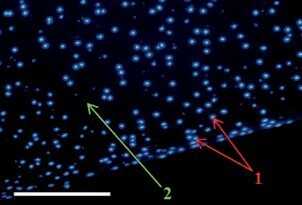
Рис. 5 Нативный суставной хрящ свиньи (А) и микрочастицы суставного хряща свиньи после децеллюляризации (В). Окрашивание DAPI на наличие в ядрах клеток ДНК [34].
3 — пустые лакуны (без клеток и ДНК).
Размер масштабной линейки 200 мкм
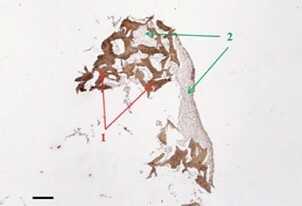
Рис. 6 Пролиферация мультипотентных мезенхимальных стволовых клеток жировой ткани человека (ММСК ЖТч) на поверхности микрочастиц суставного хряща свиньи после децеллюляризации. Иммуногистохимическое окрашивание (коричневое) микрочастиц на коллаген II типа [34].
Размер масштабной линейки 200 мкм.
1 — микрочастицы децеллюляризованного хряща,
2 — клетки. Увеличение х100
Можно предположить, что использование в КИК матрикса из децеллюляризованного суставного хряща свиньи, сохранившего тканевую специфичность за счет внеклеточных белков, которые интегративно содержат в своем составе остатки тканевых структур (гликопротеиды, структурные белки межклеточных контактов и пептидные последовательности для прикрепления клеток), позволит оптимизировать условия для пролонгированной жизнеспособности и функциональной эффективности клеточной компоненты КИК. Отметим, что микронизация децеллюляризованного матрикса предоставляет возможность его инъекционного введения, обеспечивает хорошие условия массообмена для клеточного метаболизма и увеличивает площадь эффективной поверхности для адгезии и пролиферации клеток. Рассмотрим конкретные примеры функциональной активности клеточно-инженерных конструкций на основе БМКГ матрикса (гидрогелевого биомиметика ВКМ) и тканеспецифического микродисперсного из децеллюляризованного хряща свиньи (тканевого миметика ВКМ) для регенерации поврежденных тканей опорно-двигательного аппарата.
Предложенный протокол децеллюляризации суставного хряща позволяет не только обеспечить высокую биосовместимость матрикса, в том числе отсутствие иммуногенности, но и сохранить основной белковый компонент ВКМ.
БИОМИМЕТИКИ В КЛЕТОЧНО-ИНЖЕНЕРНЫХ КОНСТРУКЦИЯХ
ДЛЯ РЕГЕНЕРАЦИИ ПОВРЕЖДЕННОГО СУСТАВНОГО ХРЯЩА
Регенеративная активность КИК хрящевой ткани на основе БМКГ и ММСК ЖТч была исследована на экспериментальной модели адъювантного артрита в переход в остеоартроз коленного сустава кролика [35].
В контроле при введении в сустав физиологического раствора наблюдали изъязвление и слущивание поверхностной пластины, обеднение глубоких слоев клетками, исчезновение колончатого строения, хаотичное расположение хрящевых клеток и очаговое разволокнение хрящевого матрикса (рис. 7В). На 60 сутки после введения в пораженный сустав только БМКГ в препаратах хряща морфологические различия по сравнению с гистологической картиной отрицательного контроля выражены слабо. Тем не менее можно отметить начало формирования колонок-столбиков и несколько более сохранным выглядит поверхностный слой, что свидетельствует о наличии биоактивных свойств БМКГ (рис. 7С). После введения на 60-е сутки в поврежденный сустав КИК хрящевой ткани в препаратах хряща обнаруживаются признаки частичного восстановления структуры хряща, выражающиеся в формировании хондроцитами колонок-столбиков в среднем слое, некотором оживлении поверхностного слоя (увеличение количества клеток), появлении изогенных групп хрящевых клеток в матриксе (рис. 7D). Такая гистологическая картина свойственна структуре нативного гиалинового хряща (рис. 7А). Полученный результат свидетельствует об эффективности применения КИК хрящевой ткани для регенерации суставного хряща.
 | 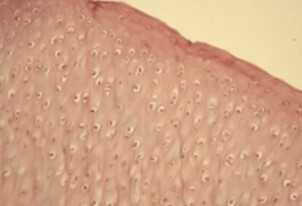 | 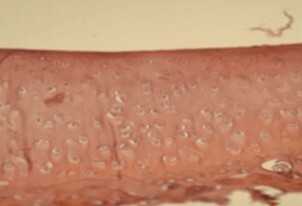 |  |
Рис. 7 Гистологическая структура хряща сустава большой берцовой кости кролика в экспериментальной модели остеоартроза (ОА) на 120-е сутки от начала эксперимента [35]:
А — нативный суставной хрящ;
B — суставной хрящ через 90 суток после моделирования ОА (отрицательный контроль);
C — суставной хрящ на 90-е сутки моделирования ОА и после 60-ти суток внутрисуставного введения матрикса БМКГ;
D — суставной хрящ на 90-е сутки после моделирования ОА и после 60-ти суток внутрисуставного введения КИК хрящевой ткани. Окраска — гематоксилин и эозин. Увеличение х200
Кроме того, была показана потенциальная возможность выращивания из КИК хрящевой ткани жизнеспособного и функционально активного тканевого эквивалента хряща. Как следует из рис. 1, существуют два способа: in vitro в биореакторе или в качестве биореактора использовать живой организм. Нами был выбран путь выращивания тканевого эквивалента (тканеинженерной конструкции) хрящевой ткани в биореакторе [36, 37].
Через 14 суток инкубации в условиях потока в дифференцировочной среде STEMPRO®, в образце КИК хрящевой ткани на основе гидрогелевого миметика БМКГ и ММСК ЖТч наблюдали значительное нарастание клеточной массы с прогрессивным увеличением доли ВКМ, что свидетельствовало не только о пролиферативной, но и высокой функциональной активности клеток. Окрашивание образцов на соединительную ткань по методу Массона позволяло определить во внеклеточном матриксе не только наличие коллагена, но и выявляло структурную организацию матрикса: тонкие синие волокна формировали сеть, окружающую фибробластоподобные клетки (рис. 8А). Сине-зеленое окрашивание альциановым синим ВКМ свидетельствует о начале синтеза клетками гликозаминогликанов (рис. 8А, В) и начале формирования тканеинженерной конструкции ХТч (хрящевой ткани человека). Однако нам не удалось выявить наличие коллагена II типа в наработанном клетками ВКМ.
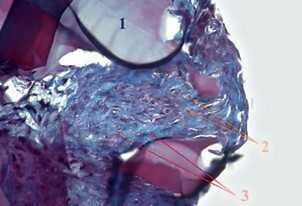
Рис. 8 Гистологическая структура КИК хрящевой ткани на основе гидрогелевого миметика
БМКГ в хондрогенной дифференцировочной среде STEMPRO® в условиях потока на 14-е сутки культивирования [36, 37]:
А — коллагеновые волокна в ВКМ. Окрашивание по методу Массона
В — позитивное окрашивание ВКМ альциановым синим на гликозаминогликаны
1 — БМКГ; 2 — клетка; 3 — ВКМ.
Недавно проведенные исследования показали перспективность использования тканеспецифического микродисперсного матрикса из децеллюляризованного суставного хряща свиньи для формирования тканевого эквивалента хрящевой ткани [34].
На рис. 9 показана гистологическая картина КИК, состоящей из ММСК ЖТч, культивированных в хондрогенной среде в статических условиях на микрочастицах тканеспецифического матрикса из децеллюляризованного суставного хряща свиньи. На 14-е сутки наблюдали высокую пролиферацию клеток, сопровождающуюся наработкой характерного для ткани ВКМ. Клетки образовывали многослойные тяжи и склеивали микрочастицы децеллюляризованного хряща свиньи в единый конгломерат, что говорит о начале формирования тканевого эквивалента хрящевой ткани.
КЛИНИЧЕСКИЕ ПРИМЕРЫ ПРИМЕНЕНИЯ
ГИДРОГЕЛЕВЫХ МИМЕТИКОВ В ТРАВМАТОЛОГИИ И ОРТОПЕДИИ
Биоактивные свойства БМКГ позволили предложить использование его инъекционных форм при лечении гонартрозов [38]. В Федеральном научно-клиническом центре специализированных видов медицинской помощи и медицинских технологий ФМБА России было проведено российское проспективное двойное слепое плацебо-контролируемое и рандомизированное исследование результатов внутрисуставного введения БМКГ (композиция гетерогенного имплантируемого геля Сферо®ГЕЛЬ, АО «БИОМИР сервис», Россия) 30 пациентам с первичным гонартрозом II и III стадий в составе комплексной терапии заболевания. Было достоверно установлено его положительное действие в течение не менее 3 месяцев наблюдений, которое выразилось в уменьшении боли и улучшении функциональной активности суставов при хорошей переносимости препарата [39].
Сравнительный анализ разных схем лечения первичного остеоартроза коленных суставов продемонстрировал лучшую по всем показателям эффективность комбинированного внутрисуставного введения биополимерного гетерогенного гидрогеля и препарата гиалуроновой кислоты (ГК). Длительность наблюдения составила 12 месяцев [40]. Пациентам с гонартрозом II-III стадий по Kellgren-Lawrence при применении схем только с гиалуронатом или только с БМКГ необходимо было их повторять каждые 5-6 месяцев, а при использовании комбинации этих препаратов — каждые 8-12 месяцев. Кроме того, при комбинированной схеме лечения ОА значительно снижалась потребность пациентов в приеме нестероидных противовоспалительных препаратов (НПВП), что сказывалось на уменьшении количества нежелательных явлений, вызванных приемом данных препаратов, и тем самым улучшало качество жизни больных.
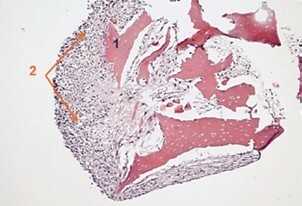
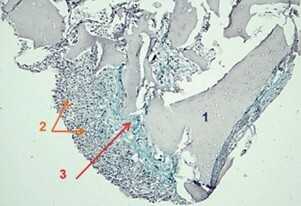
Рис. 9 Хондрогенная дифференцировка ММСК ЖТч при культивировании (14 суток) на микрочастицах тканеспецифического матрикса из децеллюляризованного суставного хряща свиньи [34]:
А — окрашивание гематоксилином и эозином
В — окрашивание альциановым синим на гликозаминогликаны
1 — тканеспецифический матрикс из децеллюляризованного суставного хряща свиньи;
3 — наработанный клетками ВКМ. Увеличение х100
Проведенные экспериментальные исследования in vitro и in vivo, доказывающие стимулирующее влияние КИК хрящевой ткани с матриксом из биополимерного гидрогелевого миметика на физиологическую регенерацию поврежденного суставного хряща, демонстрируют перспективность применения таких БМКП в травматологии и ортопедии. Высокая способность тканеспецифического микродисперсного матрикса из децеллюляризованного суставного хряща свиньи (тканевого миметика ВКМ) поддерживать адгезию, пролиферации и дифференцировку ММСК ЖТч в хондрогенном направлении дают возможность перейти к разработке технологий формирования («выращивания») из КИК на основе тканеспецифического матрикса и аутологичных ММСК тканевых эквивалентов хряща для реконструктивной и пластической хирургии. Результаты экспериментов in vitro и in vivo, а также опыт клинического применения композиции Сферо®ГЕЛЬ показывают, что введение биоактивного многокомпонентного биополимерного гидрогеля в общую схему лечения оказывает положительное влияние на процессы восстановления поврежденных тканей опорно-двигательного аппарата (суставы, связки, сухожилия, мышцы и кости).
Читайте также:
- Статьи по диагностике, лечению косоглазия
- Желтая лихорадка. История и возбудитель желтой лихорадки
- Слои головного мозга при облучении. Изменения нервных волокон при лучевой болезни
- Диастолический период желудочков сердца. Период расслабления. Период наполнения. Преднагрузка сердца. Закон Франка—Старлинга.
- Инсультоподобные состояния у детей. Паралич Тодда
