PH и скорость реакции. Значение pH для реакции.
Добавил пользователь Алексей Ф. Обновлено: 01.02.2026
Водородный показатель - рН - это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр.
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogeni - сила водорода, или pondus hydrogenii - вес водорода.
Несколько меньшее распространение получила обратная pH величина - показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH:
В чистой воде при 25°C концентрации ионов водорода ([H + ]) и гидроксид-ионов ([OH - ]) одинаковы и составляют 10 -7 моль/л, это напрямую следует из константы автопротолиза воды Кw , которую иначе называют ионным произведением воды:
Кw = [H + ] · [OH - ] =10 -14 [моль 2 /л 2 ] (при 25°C)
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания - наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H + ] > [OH - ] говорят, что раствор является кислым, а при [OH - ] > [H + ] - щелочным.
Для определения значения pH растворов широко используют несколько способов.
1) Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы - органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах - либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы (см. Таблица 1, занятие 2).
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
2) Аналитический объёмный метод - кислотно-основное титрование - также даёт точные результаты определения общей кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности - момент, когда титранта точно хватает, чтобы полностью завершить реакцию, - фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется общая кислотность раствора.
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред (Табл. 2).
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем.
3) Использование специального прибора - pH-метра - позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов, отличается удобством и высокой точностью, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
С помощью рН-метра измеряют концентрацию ионов водорода (pH) в растворах, питьевой воде, пищевой продукции и сырье, объектах окружающей среды и производственных систем непрерывного контроля технологических процессов, в т. ч. в агрессивных средах.
рН-метр незаменим для аппаратного мониторинга pH растворов разделения урана и плутония, когда требования к корректности показаний аппаратуры без её калибровки чрезвычайно высоки.
Прибор может использоваться в лабораториях стационарных и передвижных, в том числе полевых, а также клинико-диагностических, судебно-медицинских, научно-исследовательских, производственных, в том числе мясо-молочной и хлебопекарной промышленности.
Последнее время pH-метры также широко используются в аквариумных хозяйствах, контроля качества воды в бытовых условиях, земледелия (особенно в гидропонике), а также - для контроля диагностики состояния здоровья.
Таблица 2. Значения рН для некоторых биологических систем и других растворов
| Система (раствор) | рН |
| Двенадцатиперстная кишка | 7,0 - 7,8 |
| Желудочный сок | 1,6 - 1,8 |
| Кровь человека | 7,35 - 7,45 |
| Ликвор | 7,5 |
| Моча | 4,8 - 7,5 |
| Мышечная ткань | 6,7 - 6,8 |
| Панкреатический сок | 8,3 |
| Пот | 4,0 - 8,0 |
| Почки | 6,6 - 6,9 |
| Протоплазма клеток | 6,4 - 7,0 |
| Связки | 7,2 |
| Слёзы | 7,4 |
| Слюна | 6,35 - 6,85 |
| Тонкая кишка | 6,2 - 7,3 |
| Молоко | 6,6 - 6,9 |
| Морская вода | 8,0 |
| Белок куриного яйца | 8,0 |
| Апельсиновый сок | 2,6 - 4,4 |
| Томатный сок | 4,3 |
| Кофе | 5,0 |
| Чай | 5,5 |
Контрольные вопросы
1. Уравнение ионного произведения воды, его анализ.
2. Водородный и гидроксильный показатели среды.
3. Характеристика кислотности сред по величине pH.
4. Биологическое значение водородного показателя.
Типовые задачи
Задача 1. Рассчитать рН раствора соляной кислоты с молярной концентрацией вещества в растворе С(НСl) = 0,001 моль·дм -3 .
Задача 2. Рассчитать pH раствора гидроксида калия с молярной концентрацией вещества в растворе C(KOH) = 1,5·10 -2 моль·дм -3 .
С(KOH) = 1,5·10 -2 моль·дм -3 KOH ? K + + OH - , т.к. ? = 1, то
[OH - ] = [KOH] = 1,5·10 -2 моль·дм -3
pOH = -lg1,5·10 -2 = 1,82
pH + pOH = 14 ? pH = 14 - pOH
pH = 14 - 1,82 = 12,18.
Задача 3. pH желудочного сока равен 1,65. Определить концентрации ионов [H + ] и [OH - ] в желудочном соке.
pH = 1,65 pH = -lg [H + ]
lg [H + ] = -pH ? [H + ] = 10 - pH
[H + ] - ? [H + ] = 10 -1,65 = 0,0224 моль·дм -3 = 2,24·10 -2 моль·дм -3
[OH - ] - ? [H + ] · [OH - ] = 10 -14
Ответ: [H + ] = 2,24·10 -2 моль?дм -3 ; [OH - ] = 4,46·10 -13 моль?дм -3 .
Тестовые задания для самоконтроля
Выберите правильный вариант ответа
01. КОНЦЕНТРАЦИЯ ИОНОВ ОН — (МОЛЬ/ДМ 3 ) В РАСТВОРЕ ПРИ рН = 2,00 РАВНА ________МОЛЬ/ДМ 3
02. ЗНАЧЕНИЯ С(ОН — ) И С(Н + ) В РАСТВОРЕ ПРИ рН = 5,0 СОСТАВЛЯЮТ______ МОЛЬ/ДМ 3
03. ЗНАЧЕНИЯ С(ОН — ) И С(Н + ) В РАСТВОРЕ ПРИ рОН = 6,0 СОСТАВЛЯЮТ ______ МОЛЬ/ДМ 3
04. УКАЖИТЕ рН СОЛЯНОЙ КИСЛОТЫ С КОНЦЕНТРАЦИЕЙ 0,1 МОЛЬ/Л И ВОДНОГО РАСТВОРА ГИДРОКСИДА КАЛИЯ С КОНЦЕНТРАЦИЕЙ 1,0 МОЛЬ/Л, СЧИТАЯ, ЧТО УКАЗАННЫЕ ВЕЩЕСТВА ДИССОЦИИРУЮТ ПОЛНОСТЬЮ
05. В РАСТВОРЕ АЗОТНОЙ КИСЛОТЫ С рН = 2 КОНЦЕНТРАЦИЯ ВЕЩЕСТВА ПРИ α = 100% РАВНА _____ МОЛЬ/ДМ 3
06. рН РАСТВОРА ГИДРОКСИДА БАРИЯ РАВЕН 13, КОНЦЕНТРАЦИЯ ОСНОВАНИЯ В НЕМ ПРИ α =100% РАВНА ______ МОЛЬ/ ДМ 3
07. РАСТВОР, В 500 МЛ КОТОРОГО РАСТВОРЕНО 1,825 г HCl, ИМЕЕТ рН, РАВНЫЙ
08. УКАЖИТЕ рН 0,003 МОЛЯРНОГО РАСТВОРА СОЛЯНОЙ КИСЛОТЫ
Контрольные задания
09. Рассчитать рН и рОН слюны, если концентрация ионов водорода в ней составляет 1,78·10 -7 моль·дм -3 .
10. Физиологическое значение рН крови 7,36. Определить концентрацию ионов [H + ] и [OH - ] в крови.
11. Рассчитать рН раствора соляной кислоты с концентрацией 0,03 моль/дм 3 и водного раствора гидроксида калия с концентрацией 0,12 моль/дм 3 , считая, что указанные вещества диссоциируют полностью.
12. Определите рН кишечного сока, если концентрация гидроксид- анионов ОН - в составе кишечного сока составляет 2,3·10 -6 моль·дм -3 .
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. - 5-е изд., стер. - М.: Высш.шк., 2005. - С. 66 - 76, 101 - 107.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. - М. : Высш. шк., 2008. - С.45-50.
1.8. Буферные системы
Свойством всех живых организмов является постоянство рН биологических жидкостей, тканей и органов. Это постоянство поддерживается их буферными системами и необходимо для обеспечения нормальной деятельности ферментов, регулирования осмотического давления и других показателей.
Знания по теме «Буферные «системы» необходимы для понимания механизма их действия, количественной оценки способности буферных систем связывать посторонние кислоты и щелочи, понимания их взаимосвязи и роли в поддержании кислотно-основного гомеостаза.
Кроме того, важно уметь готовить буферные растворы для последующего использования их в различных медико-биологических, химических и клинических исследованиях.
Буферными называют системы, состоящие из двух сопряженных компонентов, способных до определенного предела противодействовать изменению рН среды при добавлении к ним небольших количеств кислоты и щелочи, а также при разбавлении раствора или концентрировании.
Способность буферных систем сохранять постоянство pH называется буферным действием.
По составу, с точки зрения протонной теории, буферные системы делят на кислые и основные.
Кислые буферные системы состоят из слабой кислоты и сопряженного с ней избытка сильного основания, создаваемого солью этой кислоты.
Например: Ацетатная буферная система - кислая буферная система, состоит из:
3СООН - слабая кислота;
СН3СООNa - растворимая соль (содержит сопряженное сильное основание СН3СОО - ).
Аммиачная буферная система - основная буферная система, состоит из:
4ОН - слабое основание;
NН4Сl -растворимая соль (содержит сопряженную сильную кислоту NН4 + ).
Буферные системы в растворенном состоянии образуют буферные растворы.
Буферные растворы, в отличие от буферных систем, могут быть многокомпонентными.
Кровь относят к буферным растворам.
Водородный показатель среды буферного раствора рассчитывают по уравнению Гендерсона-Гассельбаха:
pH = pKa + lg[соль]/[кислота]
pH - водородный показатель среды буферного раствора,
pKa - показатель константы кислотности слабой кислоты,
[соль]/[кислота]- количества соли и кислоты в момент равновесия; буферное соотношение.
В рабочем виде:- C (1/z с), C (1/z к) - исходные молярные концентрации эквивалентов соли и кислоты, моль·дм -3 ;
- V (с), V (к) - объемы растворов соли и кислоты соответственно, см 3 .
Величину, характеризующую способность буферной системы противодействовать смещению реакции среды при добавлении кислот и щелочей, называют буферной емкостью (B). Буферную ёмкость можно определить по кислоте или по основанию.
Буферная ёмкость показывает сколько моль-эквивалентов сильной кислоты или щелочи следует добавить к 1 дм 3 буферного раствора, чтобы изменить его рН на единицу.
B - буферная ёмкость, моль дм -3 ;
C(1/z кисл.; осн.) - молярная концентрация эквивалента добавляемой кислоты или основания;
V(кисл.; осн.) - объем раствора добавляемой кислоты или основания, см 3 ;
?pH - изменение pH;
V (буф.)- объем буферного раствора, см 3 .
Для сохранения оптимальных условий обменных процессов необходимо постоянство pH внутренних сред организма. Постоянство кислотности сред, наряду с физиологическими механизмами поддерживается буферными системами организма.
1. Буферные системы, их состав, свойства, классификация. Механизм буферного действия. Буферные растворы
2. Уравнение кислых буферных систем Гендерсона-Гассельбаха, его вывод и анализ. Зона буферного действия.
3. Буферная емкость. Факторы, влияющие на величину буферной емкости.
4. Биологическая роль буферных систем. Буферные системы крови: гемоглобиновая, оксигемоглобиновая, белковая, водородкарбонатная, фосфатная, эфиры глюкозы и фосфорной кислоты различной степени замещенности.
5. Роль водородкарбонатной буферной системы в поддержании постоянства рН крови. Ацидоз. Алкалоз. Щелочной резерв крови.
Задача 1. Рассчитайте рН ацетатного буферного раствора, приготовленного из 80 мл 0,1 н раствора СН3СООН и 20 мл 0,1 н раствора СН3СООNa. КД (СН3СООН) = 1,74 · 10 - 5 .
| Дано: | Решение: |
| С (СН3СООН) = 0,1 н | 1. Находим рКкислоты: рКкислоты = - lgКД = - lg 1,74 · 10 - 5 = 4,76 |
| Vр (СН3СООН) = 80 мл = 0,08 л | |
| С (СН3СООNa) = 0,1 н | 2. Находим рН ацетатного буферного раствора: |
| Vр (СН3СООNa) = 20 мл | |
| КД (СН3СООН) = 1,74 · 10 - 5 | CC · VC 0,02 · 0,1 рН = рКкислоты + lg ----------- = 4,76 + lg -------------- = 4,16 CК · VК 0,08 · 0,1 |
| -------------------------------------- | |
| рН = ? | |
| Ответ: рН = 4,16 |
Задача 2. Рассчитать рН оксалатной буферной системы, состоящей из100 см 3 раствора щавелевой кислоты с концентрацией С(1/2 Н2С2О4)=0,5 моль·дм -3 и 150 см 3 растворы оксалата натрия с концентрацией С(1/2 Na2C2O4)=0,25 моль·дм -3 ,если КД (Н2С2О4)=5,6·10 -2 .
С(1/2Na2C2O4) = 0,25 моль·дм - 3 рН = 1,25 + lg(0,25·150)/(0,5·100 )= 1,125.
Задача 2. Рассчитайте объемы (см 3 ) 0,1М СН3СООН и 0,1 М СН3СООNa, необходимые для приготовления 100 см 3 буферного раствора с рН = 4,0. рК (СН3СООН) = 4,76
| Дано: | Решение: |
| C(СН3СООН) = 0,1моль/дм 3 | 1. По уравнению Гендерсона-Гассельбаха : |
| C(СН3СООNa) = 0,1моль/дм 3 | рН = рК + lg (Cс·Vс)/(Cк·Vк) |
| Vбуф. = 100 см 3 | lg(Cс·Vс)/(Cк·Vк) = pH - pK |
| рН = 4,0 | 2. Подставим данные: |
| рК (СН3СООН) = 4,76 | lg(0,1·Vс)/(0,1·Vк) = 4 - 4,76 = -0,76 |
| V(СН3СООН) = ? V(СН3СООNa) = ? | 3. Vс + Vк = 100 см 3 lg Vс/(100 -Vc) = -0,76 |
| Vс/(100 -Vc) = 10 -0,76 = 0,174 Vc = 14,84 см 3 Vк = 100 - 14,84 = 85,16 см 3 | |
| Ответ: V(СН3СООН) = 85,16 см 3 ; V(СН3СООNa) = 14,84 см 3 |
Задача 3. Рассчитайте рН фосфатного буфера, состоящего из 100 см 3 0,01 моль/дм 3 NaH2PO4 и 20 см 3 0,1 моль/дм 3 Na2HPO4. Как изменится рН при добавлении к этой смеси 30 мл раствора NaOH с молярной концентрацией С(NaОН) = 0,02 моль/дм 3 ?
| Дано: | Решение: |
| C(NaH2PO4) = 0,01моль/дм 3 | 1. По уравнению Гендерсона-Гассельбаха : |
| C(Na2HPO4) = 0,1моль/дм 3 | рН = рК(H2PO4 - ) + lg (Cс·Vс)/(Cк·Vк) |
| V(NaH2PO4) = 100 см 3 | pK (H2PO4 - ) = - lg1,6·10 - 7 = 6,8 |
| V(Na2HPO4) = 20 см 3 | 2. Подставим данные: |
| V(NaOН) = 30 см 3 | pH = 6,8 + lg(0,1·20)/(0,01·100) = 6,8 + lg2 = 7,1 |
| C(NaОН) = 0,02моль/дм 3 | 3. Роль соли (основания) в буфере выполняет Na2HPO4, а роль кислоты - NaH2PO4 H2PO4 - + OH - ↔ HPO4 2- + H2O; HPO4 2- + Н + ↔ H2PO4 - кислота основание |
| КД (Н2РО - 4)=1,6·10 -7 рН = ? | |
| При добавлении NaOH в буфере уменьшится количество кислоты NaH2PO4 и увеличится количество соли Na2HPO4. Расчет ведем в миллимолях(ммоль) n(NaOH) = 30 мл · 0,02 = 0,6ммоль | |
| рН = 6,8 + lg(2+0,6)/(1-0,6) = 6,8 + lg(2,6/0,4) = 7,615 | |
| Ответ: рН = 7,615 |
Задача 4. Рассчитайте буферную емкость по кислоте, если при добавлении к 100 см 3 гидрокарбонатного буфера с рН = 6,5 10 см 3 раствора НСl с молярной концентрацией эквивалента С(НСl) = 0,1 моль/дм 3 изменился до 6,3.
| Дано: | Решение: |
| C(НСl) = 0,1 моль/дм 3 | 1. По уравнению: |
| V(НСl) = 10 см 3 | Bк = V(HCI)·С(НСl) /Vбуф. ·ΔpH |
| Vбуф. = 100 см 3 | Bк = 10 · 0,1 / 100 · (6,5 - 6,3) = 0,05 моль/дм 3 |
| рН1 = 6,5 | |
| рН2 = 6,3 | |
| Вк = ? | |
| Ответ: Bк = 0,05 моль/дм 3 |
01. ВЫБЕРИТЕ БУФЕРНУЮ СИСТЕМУ
02. УКАЖИТЕ КАК НАЗЫВАЕТСЯ СДВИГ РЕАКЦИИ СРЕДЫ ОРГАНИЗМА В ЩЕЛОЧНУЮ СТОРОНУ
Влияние рН среды на скорость ферментативной реакции.
Ферменты как белки, обладают амфотерными свойствами, и заряд молекулы фермента зависит от среды, в которой фермент находится. Меняя реакцию среды, можно добиться как активации, так и угнетения активности ферментов. Для каждого фермента имеется свой оптимум рН - узкий диапазон значений рН, в котором фермент наиболее активен. Для большинства ферментов оптимум рН лежит в пределах от 4 до 7. Влияние рН на активность ферментов обусловлено несколькими факторами.
-контакт фермента с субстратом зависит от степени ионизации функциональных групп аминокислотных остатков, входящих в субстратный участок активного центра фермента, т. к. кислые и основные группы аминокислот активного центра участвуют в связывании субстрата;
-превращение фермент-субстратного комплекса в комплекс фермент-продукты реакции может происходить только при определенной ионизации комплекса, т.к. функциональные группы, входящие в состав каталитического центра, работают тоже от степени ионизации этих групп;
- в некоторых ферментативных реакциях водородные или гидроксильные ионы аминокислот каталитического участка активного центра могут участвовать непосредственно в реакциях, протекающих на активном центре фермента;
-большинство субстратов имеют кислотные и основные группы, на ионизацию которых влияет рН среды. Вероятно, при оптимальном значении рН субстрат и функциональные группы активного центра находятся в реакционноспособном состоянии;
-ферменты наиболее активны при рН близкой их ИЭТ, когда заряд молекулы приближается к 0, так как при этом фермент имеет наименьшую степень диссоциации, и связь апофермента и кофермента более прочная.
Знание зависимости скорости ферментативной реакции от рН среды имеет практическое значение. Например, при исследовании активности какого-либо фермента в лаборатории необходимо учитывать оптимальное значение рН среды для данного фермента. Также необходимо знать, что некоторые ферменты проявляют максимальную свою активность в резко-кислой среде (пепсин) или же в щелочной среде (трипсин, химотрипсин).
Зависимость скорости ферментативной реакции от рН.
Скорость ферментативных реакций значительно зависит от кислотности среды, в которой они протекают. Для каждого фермента имеется определенное значение рН, при котором наблюдается наибольшая скорость реакции - рН-оптимум. При отклонении в любую сторону от этого значения рН резко уменьшается ферментативная активность. Важно подчеркнуть, что величина рН-оптимума у разных ферментов колеблется в большом диапазоне значений рН, в то время как температурный оптимум для большинства ферментов составляет 37-40 ° С. В качестве примера (см. рис. 4) можно привести значения рН-оптимума следующих ферментов:
пепсин желудочного сока - 1,0-2,0;
| |
щелочная фосфатаза плазмы крови - 9,0-10,0
Рис. 4. Зависимость скорости ферментативной реакции от рН
(1 - пепсин, 2 - амилаза, 3 - щелочная фосфатаза )
Влияние кислотности среды на скорость ферментативных реакций обусловлено тем, что при изменении кислотности меняется конформация всей белковой молекулы фермента и, в том числе, изменяется конформация активного центра и способность его осуществлять катализ. При рН-оптимуме фермент находится в оптимальной для проявления каталитических свойств конформации. При небольшом отклонении величины кислотности от рН-оптимума наблюдается незначительное изменение конформации, носящее обратимый характер. При значительном отклонении от рН-оптимума (в сильно кислой и сильно щелочной среде) происходит необратимая денатурация ферментного белка, приводящая к полной утрате каталитической активности.
При работе с ферментами в лабораторных условиях в реакционную среду вводят буферные растворы, рН которых соответствует рН-оптимуму изучаемых ферментов.
Факторы, влияющие на скорость ферментативных реакций
Для изучения влияния какого-либо фактора на скорость реакции все прочие факторы должны оставаться неизменными и по возможности иметь оптимальное значение. Измерять следует только начальные скорости, как указано выше.
Концентрация фермента
При высокой концентрации субстрата и при постоянстве других факторов, таких, например, как температура и pH, скорость ферментативной реакции пропорциональна концентрации фермента (рис. 4.6). Катализ осуществляется всегда в условиях, когда концентрация фермента гораздо ниже концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и скорость ферментативной реакции.

Концентрация субстрата
При данной концентрации фермента скорость ферментативной реакции возрастает с увеличением концентрации субстрата (рис. 4.7). Теоретическая максимальная скорость реакции Vmax никогда не достигается, но наступает момент, когда дальнейшее увеличение концентрации субстрата уже не влечет за собой сколько-нибудь заметного изменения скорости реакции.
Это следует объяснить тем, что при высоких концентрациях субстрата активные центры молекул фермента в любой данный момент оказываются практически насыщенными. Таким образом,
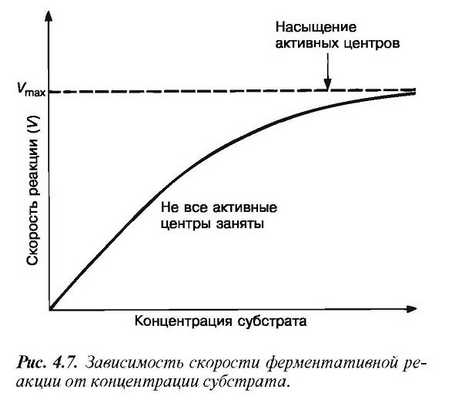
сколько бы ни было в наличии избыточного субстрата, он может соединиться с ферментом лишь после того, как образовавшийся ранее фермент- субстратный комплекс диссоциирует на продукт и свободный фермент.
Температура
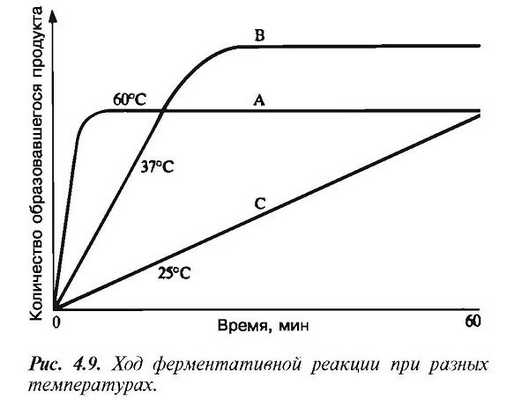
С повышением температуры ускоряется движение молекул, вследствие чего у молекул субстрата и фермента оказывается больше шансов столкнуться друг с другом. В результате увеличивается и вероятность того, что реакция произойдет. Температура, обеспечивающая максимальную активность, называется оптимальной температурой.
Если температура поднимается выше этого уровня, скорость ферментативной реакции снижается, несмотря на увеличение частоты столкновений. Происходит это вследствие разрушения вторичной и третичной структур фермента, иными словами, вследствие того, что фермент претерпевает денатурацию (рис. 4.8).

Молекула фермента развертывается и его активный центр постепенно утрачивает присущую ему форму. Наиболее чувствительны к воздействию высокой температуры водородные связи и гидрофобные взаимодействия. Температурный оптимум для большинства ферментов млекопитающих лежит в пределах 37—40 °C.
Существуют, однако, ферменты с более высоким температурным оптимумом; у бактерий, живущих в горячих источниках, он может, например, превышать 70 °C. Именно такие фер- менты используются в качестве добавок к стиральным порошкам для стирки в горячей воде. Когда температура приближается к точке замерзания или оказывается ниже ее, ферменты инактивируются, но денатурации при этом не происходит.
С повышением температуры их каталитическая активность вновь восстанавливается. В наше время для длительного хранения пищевых продуктов широко используют такой способ, как быстрое их замораживание. Оно предотвращает рост и размножение микроорганизмов, а также инактивирует их пищеварительные ферменты, так что они оказываются уже не в состоянии вызвать разложение пищевых продуктов.
Инактивируются также и ферменты, находящиеся в самих пищевых продуктах. Замороженные продукты необходимо хранить при низких температурах, не допуская их размораживания. Последнее следует делать непосредственно перед приготовлением пищи.
Температурный коэффициент Q10 Влияние температуры на скорость ферментативной реакции может быть выражено через температурный коэффициент Q10:
Q10 = Скорость реакции при х °С / Скорость реакции при (х + 10) °С
При постоянной температуре любой фермент, как правило, работает наиболее эффективно в узких пределах pH. Оптимальным считается то значение pH, при котором реакция протекает с максимальной скоростью (рис. 4.10 и табл. 4.1).
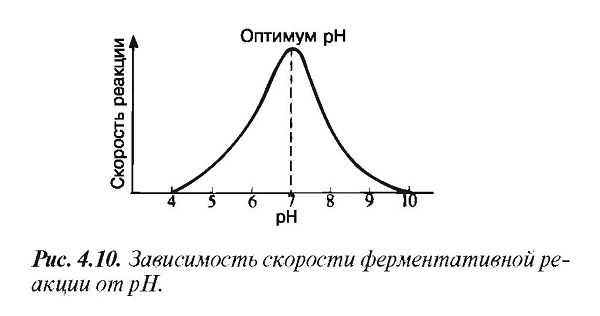

При более высоких и более низких pH активность фермента снижается. С понижением pH возрастает кислотность и увеличивается концентрация Н+-ионов. Увеличивается, следовательно, количество положительных зарядов в среде. Сдвиг pH меняет заряд ионизированных кислотных и основных групп, что ведет к разрушению ионных связей, участвующих в поддержании специфичной формы молекул фермента (разд. 3.5.3).
В результате изменяется форма молекул фермента и в первую очередь форма его активного центра. При слишком резких сдвигах pH фермент денатурирует.
Литература. Биология : в 3 т. Т. 1 / Д. Тейлор, Н. Грин, У. Стаут ; под ред. Р. Сопера
Водородный показатель pH

Буквы pH можно встретить на баночке с кремом для лица, в результатах медицинских анализов, отчете эколога или инженера-технолога. Давайте узнаем, что это за вездесущий показатель, как его рассчитать и применять.
· Обновлено 25 октября 2022
Что такое водородный показатель pH и зачем он нужен
Водные растворы веществ могут быть кислыми, нейтральными или щелочными. Кислотность среды зависит от концентрации положительно заряженных ионов водорода (H + ) и отрицательно заряженных гидроксид-ионов (OH − ) относительно друг друга.
Если в растворе [H + ] > [OH − ], то его называют кислотным,
если [OH − ] > [H + ] — щелочным,
если [H + ] = [OH − ] — нейтральным.
В нейтральном растворе концентрация Н + и ОН − ничтожно мала, поскольку эти ионы активно взаимодействуют друг с другом с образованием малодиссоциирующего соединения Н2О. Поэтому в нейтральном растворе присутствуют только те ионы водорода и гидроксид-ионы, которые образовались в результате обратимой диссоциации:
Константа диссоциации имеет незначительную величину и равна:
Концентрация воды практически не изменяется в растворе, поэтому мы можем упростить выражение константы диссоциации воды:
Получившееся выражение называют ионным произведением воды. Эта величина постоянна при заданной температуре (для T = 22-25 °С Kw = 10 −14 ) для воды и ее растворов.
Концентрация ионов H + и OH − при комнатной температуре всегда одинакова и равняется:
[H + ] = [OH − ] = 10 −7 моль/л.
Для характеристики кислотности среды более удобно использовать водородный показатель pH (читается «пэ аш»), который равен десятичному логарифму величины [H+] с отрицательным знаком. Формула расчета pH:
Название величины указывает на то, что кислотность или щелочность среды можно выразить через концентрацию только ионов водорода.
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

Расчет водородного показателя для растворов разной кислотности
Попробуем посчитать pH для чистой воды и нейтральных водных растворов:
pH= −lg[H + ] = −lg10 −7 = −(−7) = 7.
Для нейтральных водных растворов и чистой воды pH = 7.
Рассчитаем значения водородного показателя для раствора сильной одноосновной кислоты (например, HCl) концентрации 1 моль/л. Концентрация ионов водорода Н + равняется также 1 моль/л. Подставим значения в ионное произведение воды, которое сохранит свое значение 10 −14 и в этом растворе:
Кw = [H + ][ОН − ] = [1 моль/л] × [ОН − ] = 10 −14 .
В таком случае [Н + ] = 10 0 (так как 10 0 = 1 моль/л).
Тогда рН = −lg10 0 = 0.
Для растворов сильных кислот pH = 0.
Рассчитаем значения водородного показателя для раствора сильного основания (например, KOH) концентрации 1 моль/л. Ионное произведение воды принимает вид:
Кw = [Н + ][1 моль/л] = 10 −14 .
Кw = [Н+][10 0 моль/л] = 10 −14 .
Следовательно, рН = −lg10 −14 = 14.
Для растворов сильных оснований pH = 14.
Таким образом, значения pH могут варьироваться в интервале от 0 до 14. Чем меньше рН, тем выше кислотность среды. И наоборот: чем больше рН, тем выше щелочность среды.
Сильнокислотные свойства раствора характерны для pH = 0-3, а сильнощелочные — для pH = 12-14.
Значения pH в зависимости от характера среды:
в нейтральных водных растворах pH = 7;
в кислотных — pH < 7;
в щелочных — pH > 7.
Водородный показатель в быту и производстве
В быту нейтральной средой принято считать диапазон pH = 5-8,5. Растворы такой кислотности (или щелочности) безопасны для кожи и слизистых человека. Ниже приведены pH некоторых веществ, которые мы встречаем в повседневной жизни:

Водородный показатель имеет важное значение во многих отраслях:
в косметологии многие продукты проходят проверку на оптимальное значение pH для безопасности кожи;
в сельском хозяйстве кислотность среды определяют для выращивания сельскохозяйственных культур;
в экологии изменение кислотности дождевых вод, рек, озер свидетельствует об ухудшении экологических условий и т. д.
Запоминать теорию проще, если она подкреплена примерами из реальной жизни. Ученики онлайн-курсов по химии в Skysmart на каждом уроке узнают что-то новое об окружающем мире и учатся применять знания на практике.
Методы определения водородного показателя раствора
Характер среды (кислый, нейтральный или щелочной) определяют с помощью индикатора.
Индикаторы — вещества, которые изменяют окраску раствора при различных значениях pH.
Чтобы определить характер среды, в исследуемый раствор достаточно добавить несколько капель водно-спиртового раствора индикатора — и окраска последнего изменится.
На практике наиболее распространены несколько индикаторов: метилоранж, лакмус и фенолфталеин. Окраска этих индикаторов в кислой, нейтральной и щелочной среде представлена в таблице:
Определение pH среды с помощью индикатора — быстрый и наглядный метод, но для определения более точного значения pH используют универсальный индикатор.
Универсальный индикатор представляет собой смесь высушенных веществ, нанесенных на бумагу. С его помощью можно определить характер среды в широком диапазоне pH — от 1 до 14.
Для измерения водородного показателя pH на бумажную полоску наносят исследуемый раствор, а затем сравнивают цвет индикатора с эталонной шкалой.

Помимо определения характера среды, с помощью индикатора можно отследить изменение концентрации компонента в растворе. Например, реакция нейтрализации (реакция между кислотой и щелочью) протекает без каких-либо признаков (выпадения осадка или выделения газа). Но если к раствору кислоты добавить индикатор лакмус, раствор окрасится в красный, а после добавления к нему щелочи — в фиолетовый. Изменение окраски индикатора подтвердит протекание реакции нейтрализации.
Использование специального прибора pH-метра позволяет измерять значения pH в более широком интервале и с большей точностью (до 0,01 единицы pH) по сравнению с индикаторами.
Работа pH-метра основана на измерении электродвижущей силы (ЭДС), которая создается электродами после погружения в раствор.
Вопросы для самопроверки
Какие значения pH характерны для кислой, нейтральной и щелочной среды?
В каких областях науки и производства необходимо измерять значения pH раствора вещества? Приведите несколько примеров.
Что такое индикатор? Как определить с его помощью характер среды?
В чем преимущества универсального индикатора?
Как называется прибор для более точного определения водородного показателя среды? Приведите его преимущества.
Читайте также:
