Посев на поверхность агара. Проблемы возникающие при подсчете жизнеспособных клеток.
Добавил пользователь Владимир З. Обновлено: 22.01.2026
Во избежание загрязнения при введении небольшого количества микроорганизмов в питательную среду — инокуляции (или посева) — необходимо использовать асептические методы. Процедуры посева различаются в зависимости от типа среды (жидкой или твердой).
12.4.1. Посев на твердую среду
Посев штрихом, или посев разведением
Метод представлен на рис. 12.4. Он применяется для выделения чистых колоний бактерий из смеси бактерий. Для посева используют проволочную петлю, которую сначала нужно прокалить, как показано на рис. 12.4,А, чтобы простерилизовать. Затем с помощью петли берут тонкую пленку жидкой суспензии или небольшое количество твердого материала, содержащего исследуемые микроогранизмы, из предварительно выращенной культуры или другого источника микроорганизмов. Петлей мягко проводят по поверхности среды, делая серии штрихов. После каждой серии штрихов чашку немного поворачивают, так чтобы в каждой новой серии распределялись бактерии из предыдущей серии штрихов, истощая таким образом штрихи до отдельных бактерий (рис. 12.4). (Не надейтесь что-нибудь увидеть на финальных штрихах до окончания времени инкубации!) Когда метод отработан, штрихи можно делать очень быстро.
С помощью этого метода можно выделять бактерии из естественных мест обитания, например из почвы, молока, воды. Образцы твердых субстанций, таких как почва, лучше суспендировать в небольшом количестве воды, либо предварительно проинкубировать в жидкой среде. Безопасным источником для рутинной работы является пастеризованное молоко. Перед тем как проводить эксперименты с бактериями или грибами, следует ознакомиться с инструкциями и правилами безопасности, чтобы снизить до минимума риск культивирования вредных организмов.
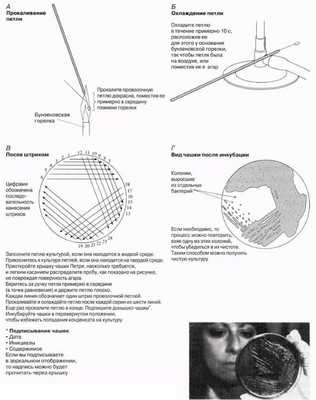
Рис. 12.4. Посев штрихом, или разведение культуры.
Посев на поверхность агара
Этот метод проиллюстрирован на рис. 12.5. Он удобен для посева микроорганизмов из жидкой суспензии на твердую среду. Метод применяется для определения числа жизнеспособных клеток в пробе после серийных разведений (см. разд. 12.6.1). Его можно использовать также для получения сплошного «газона» микроорганизмов на поверхности агара после густого посева. Это удобно при анализе активности ингибиторов, таких как антибиотики или дезинфицирующие вещества, которые добавляют в сделанные в агаре углубления либо наносят на диски из фильтровальной бумаги, размещенные на поверхности агара. Ингибитор диффундирует через агар, образуя зону подавления роста вокруг отверстий или дисков фильтровальной бумаги, которая видна после инкубации. Диаметр зоны может служить мерой степени ингибирования.
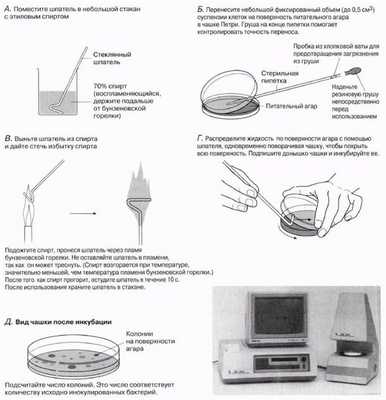
Рис. 12.5. Посев на поверхность агара.
Этот метод, альтернативный методу посева на поверхность агара, используется для инокуляции клеток из жидкой культуры, а также для подсчета жизнеспособных клеток. Поскольку клетки распределены по всей среде, а не только по поверхности агара, можно подсчитать гораздо большее их количество — до 1000 колоний на чашку. Однако размеры выросших колоний значительно меньше (рис. 12.6).
Определенный объем (до 0,5 см 3 ) клеточной суспензии вносят в подходящий объем (около 15—20 см 3 ) простерилизованного расплавленного в небольшом флаконе питательного агара, который предварительно был охлажден до 45—50 °С в водяной бане. Снимают крышку и перед добавлением клеточной суспензии прожигают горлышко флакона, как показано на рис. 12.3, A и Б. Суспензию клеток тщательно перемешивают с питательным агаром, поворачивая (не встряхивая) назад и вперед зажатый в ладонях флакон (рис. 12.6, А). Затем выливают смесь в стерильную чашку Петри, как показано на рис. 12.3, В. Подписывают донышко чашки и инкубируют ее. После инкубации чашка выглядит, как показано на рис. 12.6, Б.
Рис. 12.6. Посев заливкой.
Метод используют для культивирования анаэробных организмов или организмов, растущих при низкой концентрации кислорода (микроаэрофилов). Обычно используют пробирку с питательной агаризованной средой. Благодаря небольшой поверхности и достаточно большой глубине агара в пробирке по сравнению с чашкой доступ кислорода внутрь агара ограничивается. Посев производят прямой проволочкой (без петли), или бактериологической иглой. Небольшое количество культуры (твердой или жидкой) берут кончиком иглы и затем вертикально прокалывают ею агар (рис. 12.7). Культура растет в агаре во все стороны от линии прокола.
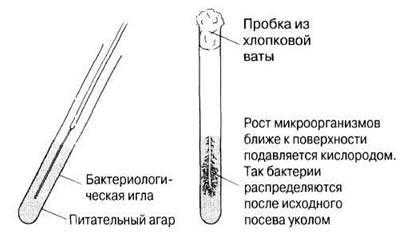
Рис. 12.7. Посев уколом.
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
ОБЩАЯ И ПИЩЕВАЯ МИКРОБИОЛОГИЯ ЧАСТЬ I - Л. В. Красникова - 2016
Число клеток микроорганизмов в единице объема или массы продукта можно определить либо непосредственным их подсчетом под микроскопом, либо путем подсчета колоний, выросших на питательных средах при посеве разведений продукта, или другими методами.
Кроме того, в микробиологической практике часто определяют биомассу - массу сухого вещества клеток, выраженную в граммах, выросшую в определенном объеме питательной среды. Непосредственный подсчет клеток проводят в счетных камерах, на фиксированных окрашенных мазках и на мембранных фильтрах. При непосредственном подсчете микроорганизмов под микроскопом учитывают, как живые, так и мертвые клетки, что дает завышенные результаты о числе жизнеспособных клеток в субстрате.
10.1. Подсчет клеток микроорганизмов в камере Горяева
Цель работы: произвести подсчет клеток суспензии дрожжей в камере Горяева.
В камерах Горяева, Тома-Цейса и других можно произвести подсчет только крупных клеток микроорганизмов - дрожжей, одноклеточных водорослей, конидий грибов и некоторых крупных бактерий.
Счетная камера Горяева представляет собой толстое предметное стекло, разделенное четырьмя прорезями на три поперечные площадки. Центральная площадка продольной прорезью делится пополам. На каждой половинке выгравирована сетка. Площадь квадрата сетки и глубина камеры указаны на предметном стекле и равны соответственно 1/25 (большой квадрат) и 1/400 мм 2 (малый квадрат). Глубина камеры равна 0,1 или 0,2 мм.
Суспензию дрожжей перед подсчетом клеток разбавляют водой в зависимости от предполагаемой их концентрации. На поверхность сетки камеры Горяева наносят небольшую каплю исследуемой суспензии микроорганизмов, накрывают специальным шлифованным покровным стеклом и притирают его к боковым площадкам до появления так называемых Ньютоновых колец. Подсчет клеток рекомендуется начинать не раньше, чем через 3-5 мин после заполнения камеры, чтобы клетки осели и расположились в одной плоскости. Клетки подсчитывают с объективом 8х или 40х. Для получения достоверных результатов подсчет следует проводить в 10 больших или 20 маленьких квадратах сетки, перемещая последние по диагонали, при этом количество клеток в большом квадрате не должно превышать 20, а в малом - 10. В противном случае суспензию следует развести водопроводной водой.
Количество клеток в 1 см суспензии вычисляют по формуле
С = а • 1000 • n/hS,
где С - число клеток в 1 см 3 суспензии; а - среднее число клеток в квадрате сетки; 1000 мм2 = 1 см 3 ; n - разведение исходной суспензии; h - глубина камеры в мм; S - площадь квадрата сетки в мм 2 .
10.2. Непосредственный подсчет клеток под микроскопом (метод Виноградского-Брида)
Цель работы: произвести подсчет клеток лактобацилл в кисломолочном продукте.
Преимущество этого метода, по сравнению с учетом клеток в счетной камере, заключается в возможности подсчитывать клетки микроорганизмов малых размеров, так как подсчет проводят с использованием иммерсионного объектива.
Препарат готовят следующим образом. Хорошо обезжиренное предметное стекло помещают на миллиметровую бумагу, на которой отмечают квадрат площадью 4 см 2 , и обводят его стеклографом или тушью. Готовят суспензию микроорганизмов, для чего 1 см 3 кисломолочного продукта вносят в пробирку с 9 см физиологического раствора (n = 10). Затем на предметное стекло наносят микропипеткой строго определенный объем исследуемой суспензии микроорганизмов (обычно 0,01 или 0,02 см 3 ). Тщательно распределяют суспензию бактериологической петлей по всей площади квадрата, отмеченного на стекле. Препарат подсушивают на воздухе, фиксируют в пламени спиртовки, окрашивают в течение 2 мин метиленовым синим, промывают водой и осушают фильтровальной бумагой. На препарат наносят каплю кедрового масла и рассматривают с иммерсионным объективом. Чтобы результат был достоверным, подсчет числа клеток рекомендуется проводить не менее чем в 20 полях зрения. Общее количество подсчитанных клеток должно быть не менее 600. В мазке микроорганизмы распределяются неравномерно: в центре их содержится больше, чем по краям. Поэтому для получения среднего значения следует вести подсчет по диаметру мазка, смещая поле зрения от одного конца диаметра к другому.
где С - число клеток в 1 см 3 суспензии; а - среднее число клеток в одном поле зрения; S - площадь приготовленного мазка (400 мм 2 ); n - разведение исходной суспензии; s - площадь поля зрения (0,02 мм 2 ; V - объем нанесенной на предметное стекло суспензии микроорганизмов (0,01 или 0,02 см 3 ).
10.3. Прямой подсчет количества микроорганизмов флуоресцентным методом
Флуоресцентная микроскопия основана на способности некоторых биологических объектов люминесцировать, т. е. светиться при освещении ультрафиолетовым или синим светом вследствие того, что свет люминесценции обладает большей длиной волны, чем поглощенный (правило Стокса). При этом объекты будут светиться желто-зеленым или оранжевым светом. Это собственная или первичная люминесцения. Поскольку большинство микроорганизмов не обладает собственной люминесценцией, существует несколько способов их обработки для наблюдения в люминесцентном микроскопе. Прежде всего это окрашивание их специальными красителями флуорохромами - сильно разбавленными растворами флуоресцирующих красителей. Из синтетических флуорохромов наилучшие результаты дают акридин желтый или оранжевый, корифосфин, примулин, родамин. Такой вид люминесцении в отличие от первичной носит название наведенной (вторичной).
Люминесцентная микроскопия по сравнению с обычной позволяет:
✵ сочетать цветное изображение и контрастность объектов;
✵ исследовать как прозрачные, так и непрозрачные живые объекты;
✵ изучать морфологию как живых, так и мертвых клеток микроорганизмов;
✵ исследовать клеточные микроструктуры, избирательно поглощающие различные флуорохромы, и определять функциональноморфологические изменения клеток;
✵ исследовать различные жизненные процессы в динамике их развития.
Микробные клетки окрашивают акридиновым оранжевым и концентрируют их на фильтрах методом центрифугирования или фильтрования. В проходящем свете с длиной волны 450 нм живые бактерии светятся зеленым светом, а мертвые - оранжево-красным. Подсчет численности бактериальных клеток в ходе микроскопирования ведется одновременно по отдельным морфологическим признакам, что дает возможность охарактеризовать как состав сообщества, так и общую численность микроорганизмов (кл/см 3 ) в исследуемом объекте.
Люминесцентная микроскопия широко используется в медицинской микробиологии для диагностики возбудителей туберкулеза, дифтерии, гонореи, возвратного тифа и др.
Разработан ГОСТ Р 52415-2005 Молоко натуральное коровье - сырое. Люминесцентный метод определения количества мезофильных аэробных и факультативно анаэробных микроорганизмов.
В настоящее время для исследований применяют следующие модели люминесцентных микроскопов, выпускаемых отечественной промышленностью: ЛЮМАМ 3-8, МЛД-2, ЕС БИМАМ Р—11, ЕС БИМАМ Р—13.
К главным недостаткам люминесцентной микроскопии относятся низкое разрешение при подсчете мелких бактериальных клеток (размером менее 1 мкм) и, следовательно, пропуск их большей части, большое напряжение зрения при подсчете мелких клеток, а также затемненные условия микроскопирования.
10.4. Метод проточной цитометрии
Проточная цитометрия (ПЦ) является современной технологией быстрого оптического измерения параметров клетки, ее органелл и происходящих в ней процессов. Принцип метода ПЦ основан на регистрации флюоресценции и светорассеяния от каждой отдельно взятой клетки. Клеточная суспензия, предварительно меченная флюоресцентными красителями, под давлением подается в проточную ячейку, где за счет гидродинамического фокусирования клетки, находясь в ламинарном потоке, выстраиваются в цепочку друг за другом. В момент пересечения клеткой лазерного луча высокочувствительные детекторы регистрируют интенсивность ее флюоресценции и рассеянное лазерное излучение. В ходе анализа учитывается также уровень флюоресценции химических соединений, входящих в состав клетки (аутофлюоресценция). Полученный сигнал подается в компьютер, обрабатывается, и полученные данные отображаются в виде различных графиков или гистограмм. Аппарат для проведения ПЦ позволяет определять до 5-10 различных параметров клетки, таких как размер, активность ферментов, содержание белков, ДНК, липидов, антигенных веществ.
Метод ПЦ находит самое различное применение, начиная от простого подсчета клеток и определения их жизнеспособности и заканчивая более сложными исследованиями в иммунологии, онкологии, цитологии, гематологии, фармакологии.
10.5. Определение количества микроорганизмов методом мембранного фильтрования
Сущность метода состоит в том, что определенный объем исследуемой пробы (питьевой воды, стойких безалкогольных напитков, пастеризованного пива) фильтруют через мембранные фильтры с размером пор от 0,15 до 0,25 мкм (см. раздел 10.3). Осевшие на фильтре микроорганизмы окрашивают и подсчитывают под микроскопом с применением окулярного сетчатого микрометра в нескольких полях зрения на определенной площади препарата. Подсчет численности бактериальных клеток в ходе микроскопирования ведется одновременно по отдельным морфологическим группам, что дает возможность охарактеризовать как состав микробного сообщества, так и (после суммирования данных) общую численность микроорганизмов в исследуемом объекте.
10.6. Определение количества микроорганизмов методом подсчета колоний (чашечный метод)
Цель работы: определить количество мезофильных аэробных и факультативно анаэробных микроорганизмов в пищевом продукте.
Чашечный метод широко применяется для определения численности жизнеспособных клеток микроорганизмов в различных естественных субстратах и в лабораторных культурах. В основе метода лежит принцип Коха, согласно которому каждая колония является потомством одной клетки. Однако необходимо учитывать, что для микроорганизмов, образующих цепочки или другие скопления клеток, результаты всегда несколько занижены. Поэтому при использовании чашечного метода результат выражают не числом клеток в единице массы или объема, а количеством колониеобразующих единиц (КОЕ). В отличие от прямого подсчета клеток под микроскопом этот метод дает возможность определить только число жизнеспособных клеток.
Определение чашечным методом числа микроорганизмов включает следующие этапы: отбор проб и подготовку их к анализу, приготовление разведений микробной суспензии, посев в чашки Петри на плотную среду, инкубацию посевов при оптимальной температуре, подсчет выросших колоний и обработку результатов.
В качестве питательной среды для учета бактерий используют мясопептонный агар, на котором могут расти только сапрофитные аэробные и факультативно анаэробные бактерии, но неспособны расти строго анаэробные. Дрожжи и мицелиальные грибы обычно выращивают на сусло-агаре.
10.7. Учет живых микроорганизмов методом предельных разведений
Метод предельных разведений применяется для установления количества микроорганизмов отдельных физиологических групп (молочнокислых, уксуснокислых бактерий, кишечных палочек и др.). Сущность метода состоит в том, что делается ряд десятикратных разведений исследуемого материала. Количество разведений готовится в зависимости от предполагаемого содержания бактерий в исследуемом объекте таким образом, чтобы в последних разведениях данных бактерий не было. Материалом, взятым из приготовленных разведений, засевают определенное число пробирок с питательной средой. После инкубации при оптимальной температуре визуально устанавливают, в каком наименьшем количестве исследуемого материала еще находятся представители данной группы микроорганизмов.
Если для определения числа живых микроорганизмов используют бульонную питательную среду, то после инкубации пробирки, в которых размножились микроорганизмы, окажутся мутными, а пробирки, засеянные разведениями, в которых уже не содержалось жизнеспособных микроорганизмов, останутся прозрачными. Доля пробирок, оказавшихся мутными при посеве культуры данного разведения, зависит от числа живых клеток в неразведенной культуре. По числу мутных пробирок в группах, засеянных суспензиями трех последовательных разведений, определяют с помощью соответствующих таблиц наиболее вероятное число (НВЧ) клеток микроорганизмов.
10.8. Нефелометрический метод определения биомассы
Нефелометрический (турбидиметрический) метод определения биомассы нашел широкое применение в лабораторных микробиологических исследованиях, поскольку позволяет быстро и довольно точно определить концентрацию клеток в суспензии микроорганизмов.
Нефелометрический метод основан на рассеивании пучка света взвешенными в жидкой фазе частицами. Данный метод пригоден лишь для тех микроорганизмов, рост которых вызывает равномерное помутнение среды и при этом не происходит образования мицелия, пленок и других скоплений. Питательная среда, в которой культивируют микроорганизмы, должна быть оптически прозрачной.
Светорассеяние, вызываемое микроорганизмами, выросшими в питательном бульоне, наиболее удобно измерять с помощью фотоэлектроколориметра (ФЭК) или спектрофотометра (СФ) при длине волны от 540 до 650 нм, при которой поглощение света данной суспензией является минимальным.
Зависимость между интенсивностью падающего света (l0) и прошедшего света I (т.е. света, не рассеянного культурой) при малых концентрациях бактерий подчиняется закону Ламберта-Бера:
где ε - коэффициент экстинкции, l - толщина слоя суспензии, с -концентрация бактерий. Из этого соотношения следует:
График зависимости lg (lо/l) от с (концентрации бактерий) имеет вид прямой, угол наклона которой определяется произведением εl. Таким образом, изменение оптической плотности, вызываемое изменением концентрации бактерий на одну единицу, зависит от толщины слоя суспензии l и свойств суспензии, характеризуемых коэффициентом ε.
При высоких концентрациях бактерий закон Ламберта-Бера теряет свою силу.
Для определения числа бактерий нефелометрическим методом строят калибровочные кривые зависимости между величиной светорассеяния и числом клеток (или сухой биомассы в единице объема среды). Для построения калибровочной кривой измеряют на ФЭК или СФ величину светорассеяния суспензии с различным содержанием клеток и в каждой из них определяют количество клеток и биомассы. Полученную зависимость выражают графически, откладывая на оси ординат показания ФЭК, а на оси абсцисс - количество клеток, содержащееся в 1 см 3 суспензии, или биомассу в 1 дм 3 культуральной среды. Для каждого микроорганизма необходимо строить свою калибровочную кривую.
Контрольные вопросы
1. Какие методы определения количества микроорганизмов в различных объектах вам известны?
2. С какой целью готовят серию разведений исследуемого объекта для определения общего количества микроорганизмов при использовании чашечного метода? Что такое КОЕ?
3. Все ли бактерии, находящиеся в исследуемом продукте, учитываются чашечным методом?
4. Какие питательные среды используют для определения в продукте количества бактерий и грибов (дрожжей и плесеней)?
5. Каковы достоинства и недостатки флуоресцентного метода подсчета микроорганизмов?
6. В чем заключается сущность метода проточной цитометрии?
7. На чем основан нефелометрический метод определения количества бактерий или биомассы в суспензии?
БИОЛОГИЯ Том 2 - руководство по общей биологии - 2004
В предыдущем разделе мы проанализировали типичную кривую роста бактерий. Можно ожидать, что такая же кривая характеризует рост дрожжей (одноклеточных грибов) или рост любой культуры микроорганизмов.
При анализе роста бактерий или дрожжей мы можем либо непосредственно подсчитывать число клеток, либо измерять некоторые параметры, зависимые от числа клеток, например мутность раствора или выделение газа. Обычно небольшое количество микроорганизмов засевают в стерильную питательную среду и выращивают культуру в инкубаторе при оптимальной температуре роста. Остальные условия должны быть как можно более близкими к оптимальным (разд. 12.1). Рост следует измерять от момента инокуляции.
Обычно в научных исследованиях придерживаются хорошего правила — проводить эксперимент в нескольких повторах и ставить контрольные пробы, где это можно и нужно. Некоторые методики измерения роста требуют определенного навыка и даже в руках специалистов они не очень точны. Поэтому имеет смысл ставить, если возможно, две пробы (один повтор) в каждом эксперименте. Контрольная проба, в которой к питательной среде не добавляли микроорганизмы, покажет, действительно ли вы работаете стерильно. Имея достаточный опыт, можно в совершенстве овладеть всеми описанными методами, поэтому мы советуем сначала попрактиковаться в них, прежде чем они будут использованы в работе над проектом.
Определить число клеток можно двумя способами, а именно, подсчитывая либо число жизнеспособных клеток, либо общее число клеток. Число жизнеспособных клеток — это число только живых клеток. Общее число клеток — это суммарное число как живых, так и мертвых клеток; обычно этот показатель определить легче.
12.6.1. Число жизнеспособных клеток
Иногда важно знать число жизнеспособных клеток. Например, можно оценить эффективность гибели определенных бактерий при пастеризации молока, измеряя количество жизнеспособных бактерий до и после пастеризации. В промышленном производстве только живые клетки участвуют в процессе, поэтому и здесь важно знать число живых клеток в культуре. Количество жизнеспособных клеток можно подсчитывать на чашках, где культура распределена по поверхности агара или внесена в агар; число жизнеспособных клеток дрожжей можно подсчитывать, используя метод гемоцитометрии.
Этот метод был уже описан в разд. 12.4.1 (рис. 12.5). Небольшой известный объем культуры наносят на поверхность питательного агара в чашке Петри. Недостатком этого метода является то, что часть культуры остается на поверхности шпателя и в пипетке, поэтому невозможно подсчитать число клеток с высокой точностью. Однако часто это бывает не важно.
Метод основан на том, что каждая бактерия через определенный период времени, например через два дня, даст одиночную колонию. Таким образом, число бактерий в исходной добавленной пробе равно числу колоний, выросших после инкубации. Невооруженным глазом различимы только колонии, состоящие из 100 000 и более клеток. Обычно колонии содержат несколько миллионов бактерий.
При условии, что проба содержит не слишком много и не слишком мало бактерий, число колоний можно легко подсчитать, причем для предосторожности лучше не открывать крышку чашки Петри при подсчете. Обычно требуется приготовить серии разведений, так чтобы в одной из серий оказалось идеальное число колоний. Серии разведений — это серии последовательных равномерных разбавлений одного образца (рис. 12.9). Когда найдено подходящее разведение, эксперимент повторяют при данном разведении для повышения точности и воспроизводимости результатов. В эксперименте 12.3 из разд. 12.9.2 число бактерий в пробах молока было установлено с использованием этого метода. Некоторые ограничения метода обсуждаются в конце данного раздела.
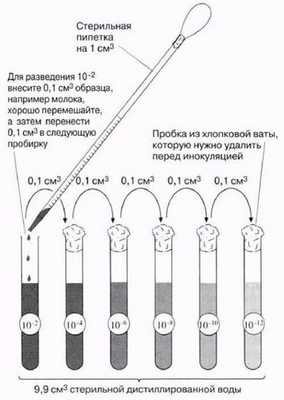
Рис. 12.9. Приготовление серийных разведений.
Этот метод уже был описан в разд. 12.4.1 (рис. 12.6). Принципиально он не отличается от посева на поверхность агара, но в данном случае пробу смешивают с питательным агаром перед заливкой чашек, так что колонии распределяются по всему объему среды, а не растут только по поверхности.
Подсчет жизнеспособных клеток дрожжей можно проводить с помощью гемоцитометра и метиленового синего. Этот метод более детально описан в следующем разделе.
Проблемы, возникающие при подсчете жизнеспособных клеток
С подсчетом жизнеспособных клеток связан ряд проблем.
1. Некоторые бактерии образуют цепочки или группы клеток, например, стрептококки и стафилококки (рис. 2,10). Каждая группа клеток дает начало только одной колонии. Поэтому иногда результаты подсчета жизнеспособных клеток выражаются не как число бактерий, а как число колониеобразующих единиц.
2. Если присутствует несколько типов бактерий, как, например, в пробах почвы, молока или воды, то условия роста будут не в равной степени благоприятны для каждого типа. Поэтому некоторые бактерии растут гораздо быстрее других, и число видимых колоний будет неадекватно числу бактерий в пробе.
Подсчет жизнеспособных клеток
Обычно подсчитывают число колоний, образованных жизнеспособными клетками в благоприятных для роста условиях.
1. Метод посева в агар: пробу вносят пипеткой в пустую стерильную чашку Петри, в которую затем вливают расплавленный, но остуженный до 45 °С агар; содержимое осторожно перемешивают и дают агару остыть. После инкубирования подсчитывают число колоний в толще питательной среды и на поверхности.
2. Метод посева на поверхность агара: небольшие (0,1 мл) объемы разбавленной культуры вносят пипеткой непосредственно на поверхность затвердевшего агара в чашке Петри и затем клетки распределяют по поверхности с помощью стеклянного или тефлонового шпателя.
3. Метод посева в многослойный агар: похож на предыдущий. Отличается тем, что на верхний слой засеянного застывшего агара наливают пипеткой дополнительный слой стерильного агара.
Применение всех этих методов предусматривает подсчет клеток одного вида из гомогенных суспензий; эти методы непригодны для подсчета клеток разных видов из смешанных популяций.
Занятие 8
Химиотерапия инфекционных болезний.
Механизмы антимикробного действия.
Методы изучения антибиотикочувствительности
• знать:
- антибиотики, источники и методы получения;
- классификацию антибиотиков по спектру и механизму действия;
- проводить тесты на определение чувствительности к антибиотикам методом диффузии в агар и серийных разведений;
- составлять и комментировать антибиотикограмму.
Вопросы для проверки исходного уровня знаний
1. Понятие о химиотерапии и химиотерапевтических препаратах. Основные принципы химиотерапии инфекционных болезней.
2. Антибиотики: классификация по источнику и способу получения, химической структуре и спектру действия.
3. Механизм действия ингибиторов синтеза компонентов клеточной стенки.
4. Механизм действия полимиксинов, полиеновых антибиотиков.
5. Механизмы действия ингибиторов синтеза белка.
6. Механизмы действия ингибиторов транскрипции и синтеза нуклеиновых кислот.
7. Осложнения антибиотикотерапии, их предупреждение.
8. Механизмы лекарственной устойчивости возбудителей инфекционных болезней. Пути преодоления лекарственной устойчивости.
Техника посева микроорганизмов
Посев на жидкую питательную среду. Пробирку с исследуемым материалом и пробирку с питательной средой держат слегка наклонно в левой руке между большим и указательным пальцами так, чтобы края пробирок были на одном уровне (пробирка с исследуемым материалом должна быть первой по отношению к работающему). В правую руку берут бактериологическую петлю (иглу или пипетку) как писчее перо. Пробки от пробирок прижимают мизинцем к ладонной поверхности правой кисти, в зоне пламени горелки пробирки открывают, края пробирок обжигают. Петлю вертикально прокаливают в пламени горелки. Простерилизованную петлю (иглу, пипетку) вводят через пламя горелки в пробирку с посевным материалом. Петлю охлаждают, забирают небольшое количество материала, переносят в пробирку со стерильной питательной средой. Материал стряхивают в среду или, слегка погружая в жидкость петлю, растирают посевной материал по стенке пробирки не касаясь среды держателем, после чего смывают его средой. Края пробирок и пробки вновь проводят над пламенем горелки, закрывают пробирки пробками, стерилизуют петлю и ставят ее в штатив или стакан. При посеве материала с помощью пипетки использованную пипетку опускают вниз концом в банку с дезинфицирующим раствором.
Посев на плотную питательную среду. Посевы выполняют разными способами. Эти способы основаны на том, что микроорганизмы иммобилизуются на поверхности или в глубине питательной среды.
Посев в пробирку. Материал, забранный петлей, опускают до дна пробирки со скошенным агаром, погружают в конденсационную жидкость и зигзагообразными движением петли проводят снизу вверх, слегка касаясь поверхности среды (посев штрихом). При посеве материала уколом в столбик среды, петлей с материалом или иглой прокалывают вертикально центру пробирки питательную среду, петлю или иглу вынимают, прожигают. (Правила работы с пробирками и петлей при посеве в пробирку с плотной средой аналогичны правилам при посеве на жидкие питательные среды).
Посев на чашку Петри. Чашку берут в левую руку, большим пальцем левой руки слег приподнимают крышку, чтобы в образовавшуюся щель свободно проходили петля или шпатель, обжигают на пламени горелки края чашки в зоне щели, вносят посевной материал на поверхность питательной среды, затем растирают его при помощи стеклянного шпателя или бактериологической петли.
1. Посев штрихом. Посевной материал втирают петлей в поверхность среды у края чаш избыток снимают, проколов агар. Оставшийся материал растирают параллельными штрихами по поверхности среды.
2. Посев петлей на секторы: дно чашки расчерчивают на секторы, посев производят зигзагообразными движениями от края чашки к центру так, чтобы штрихи с одного сектора не переходили на другой.
3. Дробный посев: бактериологической петлей с посевным материалом несколько раз делают параллельные штрихи в одном секторе чашки Петри, петлю прожигают в пламени горелки, дают остыть и часть материала из первого сектора (А) распределяют во втором секторе (В) аналогичным способом, затем в третьем (С) и четвертом (Д) секторах.
Посев шпателем. Материал наносят на поверхность среды петлей или пипеткой, затем стеклянным или металлическим шпателем тщательно втирают по всей поверхности агара, вращая полуоткрытую чашку. После посева стеклянный шпатель помещают в дезинфицирующий раствор, металлический — прокаливают в пламени горелки.
Посев тампоном. Тампон с исследуемым материалом вносят в чашку и круговыми движениями втирают его содержимое в поверхность среды, одновременно вращая тампон и чашку.
Посев газоном. 1 мл исследуемого материала (жидкая бульонная культура или взвесь микробов в физиологическом растворе) наносят пипеткой на поверхность среды и тщательно распределяют жидкость по всей поверхности чашки. Избыток материала отсасывают пипеткой и вместе с ней помещают в дезинфицирующий раствор.
Посев уколом. Посев уколом в агар столбиком (прямой агар) применяется для выращивания анаэробов или выявления характерного признака микроба, так как рост по уколу типичен для ряда бактерий. Посев уколом в полужидкий агар практикуется также с целью длительного хранения культур. При посеве уколом в столбик желатина наблюдается разжижение ее бактериями, обладающими протеолитическим ферментом. Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку, как обычно, вынимают пробку и обжигают край пробирки, и в центре столбика питательной среды сверху вниз почти до самого дна пробирки вкалывают петлю с находящимся на ней материалом.
Читайте также:
- Как бросить пить пиво? Пиво хуже водки
- Примеры узловой гемангиобластомы диска зрительного нерва
- Операция при повреждении мочевого пузыря. Санация и дренирование брюшной полости.
- Рентгтенограмма, КТ, МРТ при добавочных мышцах голеностопного сустава и стопы
- Фазы менструального цикла. Последовательность изменений при менструальном цикле
