Операция при повреждении мочевого пузыря. Санация и дренирование брюшной полости.
Добавил пользователь Владимир З. Обновлено: 22.01.2026
ФГБОУ ВО «Пермский государственный медицинский университет им. акад. Е.А. Вагнера» Минздрава России, Пермь, Россия
Интракорпоральный ручной шов мочевого пузыря при его разрывах
Журнал: Эндоскопическая хирургия. 2016;22(6): 19‑22
Цель. Изучение возможностей интракорпорального ручного шва травматического разрыва мочевого пузыря в ходе видеолапароскопии. Материал и методы. За последние 10 лет в клинике факультетской хирургии с курсом урологии на базе ГКБ №2 Перми мы наблюдали 36 больных с внутрибрюшинным разрывом мочевого пузыря в возрасте от 14 до 74 лет. Мужчин было 22, женщин — 14. У всех пострадавших разрыв был полным, проникающим в брюшную полость. Большинство пациентов получили травму от удара по животу, 4 пациента вследствие дорожно-транспортного происшествия получили сочетанную травму с переломом костей таза. Изолированное повреждение мочевого пузыря диагностировано у 24 пострадавших, у 12 — имелась сочетанная травма: у 4 — с разрывом тонкой кишки, у 2 — печени, у 2 — селезенки, у 4 — с переломом костей таза. Выполнены диагностические процедуры: катетеризация мочевого пузыря одноразовым катетером, обзорный снимок брюшной полости и малого таза, ретроградная цистография в 2—3 проекциях, УЗИ мочевого пузыря и брюшной полости на аппаратах фирмы «Алока» (Япония). Результаты. Лапаротомия с ушиванием стенки мочевого пузыря традиционным методом [1—3] выполнена у 30 пациентов. Средняя продолжительность открытой операции составила 83,0±5,1 мин. Из 30 больных умерли 3 (10,0%) пациента: они были поздно госпитализированы с уже развившимся перитонитом и полиорганной недостаточностью, минуя видеолапароскопию им сразу выполнялась лапаротомия. После открытого хирургического вмешательства отмечены продолжительные сроки реабилитации, послеоперационный койко-день составил в среднем 19,8±2,5, к работе пациенты приступили лишь через 36,2±4,2 дня после травмы. Выводы. Лапароскопическое ушивание разрыва мочевого пузыря показано в первые 12 ч с момента травмы, при изолированном разрыве длиной не более 8 см, отсутствии перитонита или умеренно выраженном местном перитоните. Это современное миниинвазивное вмешательство не удлиняет время операции, имеет хорошие ближайшие и отдаленные результаты, в 1,9 раза уменьшает сроки реабилитации по сравнению с открытым лапаротомическим ушиванием мочевого пузыря.
Тяжелой и распространенной травмой живота является повреждение мочевого пузыря [1, 2]. По статистике, хирургическую помощь чаще всего приходится оказывать не урологам, а хирургам, поскольку большинство пострадавших, особенно с сочетанными травмами мочевого пузыря, доставляются в хирургические отделения [3].
При внутрибрюшинных разрывах мочевого пузыря до сих пор преобладают открытые операции, которые дают высокую летальность, достигающую 18—45%; у 18—57% оперированных развиваются послеоперационные осложнения, а средняя продолжительность госпитализации составляет 23—30 дней [1, 3].
Первый случай лапароскопического ушивания ятрогенного повреждения стенки мочевого пузыря в ходе гинекологической операции зафиксирован в 1990 г. [4]. Впервые травматический внутрибрюшинный разрыв мочевого пузыря в ходе лапароскопии ушили C. Iselin и соавт. [5] в 1996 г. Несмотря на давность первого опыта, миниинвазивный лапароскопический способ ушивания разрыва мочевого пузыря до сих пор не получил большого распространения. В литературе приводятся, как правило, единичные наблюдения [6—10]. Так, A. Figueiredo и соавт. [7] сообщили о 20-летней женщине, которая ударилась при падении со второго этажа о поверхность земли и получила разрыв купола мочевого пузыря длиной 5 см; во время лапароскопии установили диагноз и произвели ушивание дефекта стенки пузыря.
Возможности миниинвазивного видеолапароскопического метода лечения разрывов мочевого пузыря изучены недостаточно. Техника такого эндовидеохирургического вмешательства несовершенна, не определены показания и противопоказания к этому методу, не изучены отдаленные результаты эндовидеохирургического ушивания разрыва мочевого пузыря. Все эти упущения свидетельствуют об острой актуальности проблемы.
Цель настоящего исследования — изучение возможностей интракорпорального ручного шва (ИРШ) травматического разрыва мочевого пузыря в ходе видеолапароскопии.
Материал и методы
За последние 10 лет в клинике факультетской хирургии с курсом урологии на базе ГКБ № 2 Перми наблюдали 36 больных с внутрибрюшинным разрывом мочевого пузыря в возрасте от 14 до 74 лет. Мужчин было 22, женщин — 14. У всех пострадавших разрыв был полным, проникающим в брюшную полость. Большинство пациентов получили травму от удара по животу, 4 пациента вследствие дорожно-транспортного происшествия получили сочетанную травму с переломом костей таза. Изолированное повреждение мочевого пузыря диагностировано у 24 пострадавших, у 12 имелась сочетанная травма: у 4 — с разрывом тонкой кишки, у 2 — печени, у 2 — селезенки, у 4 — с переломом костей таза.
Только 6 больных поступили в первые 6 ч с момента травмы, еще 4 — в срок от 7 до 12 ч. При этом у 4 больных перитонит не успел развиться, а у 6 — были явления местного перитонита, захватывающего 1—2 анатомические области брюшной полости. Остальные больные поступили поздно: 10 — через 13—24 ч; 16 — через 25—72 ч с наличием разлитого перитонита. Состояние 24 пострадавших было тяжелым, 12 — средней тяжести.
Выполнены диагностические процедуры: катетеризация мочевого пузыря одноразовым катетером, обзорный снимок брюшной полости и малого таза, ретроградная цистография в 2—3 проекциях, УЗИ мочевого пузыря и брюшной полости на аппаратах фирмы «Алока» (Япония).
При ясности диагноза внутрибрюшинного разрыва мочевого пузыря по данным перечисленных исследований безотлагательно выполняли лапаротомию (20 больных). При неясном диагнозе производили диагностическую видеолапароскопию (16 больных). Видеолапароскопия выполнялась в специально оборудованной операционной при полной готовности к последующей срочной лапаротомии, которая производилась здесь же. По показаниям диагностическая видеолапароскопия сразу переходила в эндохирургическое вмешательство. Для видеолапароскопических диагностических и лечебных вмешательств использовали видеоэндоскопическую стойку Full HD, а также инструменты и оборудование фирмы «Karl Storz».
Во время видеолапароскопии разрыв мочевого пузыря диагностирован у всех 16 обследованных больных. Рана была сквозной, одиночной, имела размеры от 1 до 12 см, располагалась на внутрибрюшинной части пузыря, как правило, в продольном (сагиттальном) направлении. Кроме того, в области поврежденного мочевого пузыря, в малом тазу и нижнем этаже брюшной полости при эндоскопическом осмотре обнаруживали небольшие сгустки крови и жидкую кровь, гиперемию и отложение пленок фибрина на брюшине и серозе кишечных петель. В брюшной полости отмечено различное количество выпота, смешанного с мочой. Только у 4 пациентов при видеолапароскопии не было выявлено перитонита, у 2 пациентов отмечены явления местного перитонита, а у 10 пациентов развился распространенный гнойный перитонит, захватывающий от 3 до 9 анатомических областей. Выявление указанных изменений определяло выбор лечебной тактики (переход с диагностической на лечебную видеолапароскопию или лапаротомию).
Кроме того, у 8 больных при видеолапароскопии зафиксирована сочетанная травма органов брюшной полости (разрывы печени — у 2, селезенки — у 2, тонкой кишки — у 4). При тяжелой сочетанной травме переходили с диагностической видеолапароскопии на лапаротомию.
Результаты и обсуждение
Внутрибрюшинный проникающий разрыв мочевого пузыря является абсолютным показанием к срочному хирургическому лечению [1—3]. Известно, что чем раньше выполняются операции, тем ниже летальность [1—3]. Поэтому при установлении диагноза традиционными методами (например, методом ретроградной цистографии), наличии разлитого перитонита и сроке свыше 24—36 ч после травмы сразу выполняли лапаротомию (20 больных), не прибегая к видеолапароскопии, которая неоправданно удлиняла бы в данной ситуации срок обследования.
В связи с тем, что у 10 поздно госпитализированных больных (16—36 ч с момента травмы) во время видеолапароскопии были обнаружены явления распространенного гнойного перитонита, занимающего от 3 до 9 анатомических областей, а также у 8 из них — сочетанная травма органов брюшной полости и у 1 — очень большие размеры разрыва (12 см), сразу после эндоскопического осмотра в этой же специально оборудованной операционной перешли на открытую операцию — лапаротомию.
Таким образом, лапаротомия с ушиванием стенки мочевого пузыря традиционным методом [1—3] выполнена у 30 пациентов. Средняя продолжительность открытой операции составила 83,0±5,1 мин. Из 30 больных умерли 3 (10,0%) пациента: они были поздно госпитализированы с уже развившимся перитонитом и полиорганной недостаточностью, минуя видеолапароскопию им сразу выполнялась лапаротомия. После открытого хирургического вмешательства отмечены продолжительные сроки реабилитации, послеоперационный койко-день составил в среднем 19,8±2,5, к работе пациенты приступили лишь через 36,2±4,2 дня после травмы.
По предыдущим 25-летним наблюдениям, охватывающим более 280 больных с повреждением мочевого пузыря, мочевой химический (асептический) перитонит начинает переходить в гнойный с выраженными морфологическими изменениями, как правило, через 12 ч после разрыва пузыря. Это соответствует данным литературы [1—3]. Поэтому считаем, что на сегодняшнем этапе внедрения ИРШ мочевого пузыря, чтобы не дискредитировать этот метод, целесообразно его применять в первые 12 ч с момента травмы, когда морфологические изменения ушиваемых тканей позволяют надеяться на состоятельный герметичный шов.
Учитывая все положения, изложенные выше, видеолапароскопическое ушивание мочевого пузыря считаем показанным в первые 12 ч с момента травмы, при изолированном разрыве мочевого пузыря длиной до 8 см, отсутствии перитонита или умеренно выраженном местном перитоните, захватывающем не более 1—2 анатомических областей, т. е. локализующемся в области разрыва.
Такие условия имелись у 6 пациентов, у которых диагностическая видеолапароскопия сразу перешла в лечебную с выполнением ИРШ мочевого пузыря.
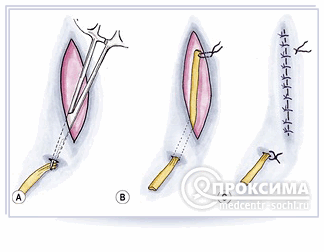
Разработанная и примененная нами оперативная техника заключалась в следующем. Вмешательство проводилось под эндотрахеальным наркозом. Положение больного по Тренделенбургу. Мониторы удобнее всего располагать у ножного конца стола. Устанавливаем следующие троакары: а) два 5 мм троакара в правой и левой подвздошных областях, на границе нижней и средней трети линии, соединяющей пупок и переднюю верхнюю ость подвздошной кости; правый порт используем для иглодержателя, левый — для второго рабочего граспера; б) 10 мм троакар в левой нижней точке Калька используется для лапароскопа; в) 10 мм порт в области пупка используется для принимающего граспера и введения нити в брюшную полость. Хирургу, если он правша, удобнее располагаться справа от больного. Перед наложением ИРШ необходимо тщательно эвакуировать всю жидкость из брюшной полости (выпот, мочу, кровь). Целесообразно использовать хирургическую нить синего оттенка для ее лучшей визуализации. Шовный материал должен быть отличного качества, хорошо удерживать первую петлю узла. Для ИРШ мочевого пузыря необходимо использовать только рассасывающийся шовный материал, так как на нерассасывающихся нитях, как правило, инкрустируются соли с последующим формированием лигатурного камня. Дефект мочевого пузыря, в зависимости от величины разрыва и состояния краев пузырной раны, ушиваем в один (у 4 больных) или два (у 2 больных) ряда непрерывным швом атравматической нитью викрил-000. Узлы формируем интракорпорально. При выполнении ИРШ мочевого пузыря большое значение имеет расположение вкола и выкола иглы. Первый вкол иглы необходимо производить со стороны серозной оболочки мочевого пузыря в сторону слизистой (снаружи внутрь), выкол же — со стороны слизистой, т. е. изнутри наружу. В этом случае сформированный узел не попадет в полость мочевого пузыря, и возможность инкрустации солей на нитях отсутствует. Края разрыва брюшины нужно обязательно подхватывать нитями пузырного шва, так как листок брюшины обладает хорошими пластическими свойствами и улучшает герметизацию ушитой раны.
В нашем случае у всех 6 больных удалось надежно ушить раны, длина которых составляла от 1 до 6 см. А.А. Степнов и соавт. [6] сообщили об успешном ушивании разрыва мочевого пузыря длиной 8 см. В литературе мы не нашли случаев лапароскопического ушивания разрывов мочевого пузыря размером свыше 8 см [4—10].
После наложения ИРШ проводили гидродинамическую пробу на герметичность путем введения 500 мл раствора фурацилина 1:5000 в мочевой пузырь через уретральный катетер и под визуальным контролем по видеомонитору. Просачивание красителя в брюшную полость через сформированный пузырный шов не обнаружено ни в одном случае. У женщин применяем глухой шов мочевого пузыря с дренированием уретральным катетером Фоли в течение 7 сут. У мужчин считаем необходимым наложение троакарной цистостомии, что выполняется сразу после пробы на герметичность. Эта манипуляция безопасна, ибо осуществляется под видеоконтролем. Передняя (внебрюшинно расположенная) стенка ушитого переполненного (500 мл) мочевого пузыря пунктируется через переднюю брюшную стенку 5 мм троакаром. Место вкола — по средней линии на 2 см выше лона. Ошибочное проникновение конца троакара в брюшную полость тотчас обнаруживается по монитору, и направление пункции корректируется. Через троакар в полость мочевого пузыря устанавливается надлобковый трубчатый дренаж, который фиксируется швом к коже и удаляется через 10—12 сут. В конце операции производится санация брюшной полости с дренированием ее двумя трубчатыми дренажами (один подводится к шву мочевого пузыря, другой устанавливается в глубину малого таза). Накладываем швы на кожные ранки. Средняя продолжительность лапароскопической операции составила 82,5 мин и практически не отличалась от продолжительности открытого хирургического вмешательства. Техника ИРШ при разрыве мочевого пузыря приведена на рис. 1—5 ().
В раннем послеоперационном периоде использовали положение по Фовлеру с приподнятым головным концом кровати. У всех 6 больных послеоперационный период протекал гладко, послеоперационных осложнений и летальных исходов не было. После удаления уретрального дренажа или цистостомы восстанавливалось самостоятельное мочеиспускание. Контрольные анализы мочи при выписке были в норме. Послеоперационный койко-день составил 12,3 дня, сократившись в 1,6 раза по сравнению с ушиванием мочевого пузыря во время лапаротомии. Больные приступили к работе в среднем через 19,2 дня после травмы, т. е. сроки реабилитации уменьшились в 1,9 раза по сравнению с открытым ушиванием разрыва мочевого пузыря.
Контрольное обследование проведено в сроки от 1 года до 9 лет после операции ИРШ мочевого пузыря. При этом у всех оперированных жалобы отсутствовали. Мочеиспускание было ненарушенным, анализы мочи в пределах нормы. УЗИ мочевого пузыря и брюшной полости патологии не выявило, объем мочевого пузыря достигал 450—500 мл, не имел деформаций, остаточной мочи не было.
Выводы
Лапароскопическое ушивание разрыва мочевого пузыря показано в первые 12 ч с момента травмы, при изолированном разрыве длиной не более 8 см, отсутствии перитонита или умеренно выраженном местном перитоните. Это современное миниинвазивное вмешательство не удлиняет время операции, имеет хорошие ближайшие и отдаленные результаты, в 1,9 раза уменьшает сроки реабилитации по сравнению с открытым лапаротомическим ушиванием мочевого пузыря.
Ушивание разрыва мочевого пузыря
Является экстренной урологической операцией при выявленном разрыве мочевого пузыря. В большинстве случаев разрыв мочевого пузыря является последствием травмы живота (падение с высоты, автотравма и т. д. ), хотя нередко встречаются и ятрогенные повреждения (в ходе эндоскопических операций на мочевом пузыре - ТУР, цистолитотрипсия, уретеролитоэкстракция). Суть вмешстельства состоит в осуществлении хорошего доступа к передней и при необходимости боковым стенкам мочевого пузыря нижнесрединным доступом. При внебрюшинном разрыве, как правило вскрытия брюшной полости не требуется, при внутрибрюшинном - выполняется лапаротомия. При выявлении сочетанного повреждения органов брюшной полости в операционной бригаде принимает участие хирурги, при травме костей таза - травматологи. После выявления места разрыва мочевого пузыря, при необходимости иссекаются нежизнеспособные участки стенки и производится ушивание дефекта стенки мочевого пузыря. Обязательным этапом в операции явялется адекватное дренирование мочевого пузыря: у мужчин это катетер и цистостома, у женщин возможно ограничиться уретральным катетером достаточного диаметра. Также обязательным является дренирование околопузырной клетчатки в зависимости от локализации разрыва. ПРи отсутствии сочетанных повреждений органов брюшной полости и костей таза восстановление пациента и заживление ран происходит довольно быстро. Больной может быть активизирован на следующий день, дренажи из клетчатки удаляются по мере уменьшения отделяемого. При ранней диагностике, операции и герметичном ушивании дренажи, как правило, можно удалить на 2-3 сутки. Дренирование самого мочевого пузыря цистостомой у мужчин и катетером у женщин продолжается от 10 до 14 суток. Обычно этого времени достаточно для полного заживления места ушитого разрыва, и при контрольной цистографии выхода контрастного вещества за пределы мочевого пузыря уже не наблюдается. При необходимости дренижи в мочевом пузыре можно оставить на более длительный срок.
Протокол лечения пациентов с перитонитом
По степени распространенности воспалительного процесса в брюшной полости выделяют:
1. Отграниченный (местный) перитонит (занимает до 2-х из девяти анатомических областей брюшной полости).
2. Распространенный перитонит (занимает три и более анатомических области живота):
По характеру экссудата: серозный, серозно-фибринозный и гнойный перитонит.
Диагностика.
Диагноз перитонита должен быть установлен на основании первичного физикального обследования.
В ходе обследования пациента в приемном отделении на основании клинико-инструментального обследования следует установить возможные причины перитонита.
В приемном отделении в экстренном порядке производят общий клинический анализ крови, биохимический анализ крови, коагулограмму, общий анализ мочи; определяют группу крови и резус-фактор; выполняются ЭКГ, рентгенография грудной клетки в прямой проекции и обзорная рентгенография брюшной полости (у лежачих больных - в латеропозиции), УЗИ брюшной полости (оценка наличия газа и жидкости в брюшной полости, дилатация кишечных петель, перистальтика); по показаниям проводятся консультации врачами терапевтических специальностей.
Лечебная тактика.
Диагноз перитонита является показанием к экстренному оперативному вмешательству. Больной подлежит экстренному оперативному вмешательству в течение 1 часа с момента установления диагноза.
Больным с выраженными явлениями интоксикации, синдромными расстройствами и с тяжелыми сопутствующими заболеваниями показано проведение кратковременной (в течение 1,5-2 часов) предоперационной подготовки в условиях реанимационного отделения. Вопрос о необходимости и объеме предоперационной подготовки больного к хирургическому вмешательству решается совместно хирургом и анестезиологом.
Любое оперативное вмешательство по поводу перитонита необходимо выполнять под эндотрахеальным наркозом.
Доступ.
- при клинической картине отграниченного перитонита,
- при необходимости проведения дифференциального диагноза (острый панкреатит, мезентериальный тромбоз),
- в случае диагностированных до операции аппендицита, холецистита и перфоративной язвы.
- при клинической картине распространенного перитонита,
- при лапароскопической находке, исключающей возможность выполнения оперативного приема лапароскопическим доступом, показано выполнение конверсии к срединной лапаротомии.
Хирургическая тактика.
Обязательными этапами оперативного вмешательства при перитонита являются:
- Забор материала для микробиологического исследования;
- Полная и планомерная ревизия брюшной полости;
- Эвакуация экссудата;
- Устранение источника перитонита;
- Санация брюшной полости;
- Назо-интестинальная интубация - по показаниям;
- Дренирование брюшной полости;
- Формирование лапаростомы для последующих программных санаций - по показаниям.
Радикальное устранение источника перитонита предусматривает:
- удаление воспаленного органа (аппендэктомия, холецистэктомия);
- герметичное ушивание перфораций и свежих сквозных ранений полых органов;
- резекцию органа (при язве, опухоли, травмах или нарушении мезентериальногокровобращения); - формирование колостомы (илеостомы) для выключения из пассажа пораженных участков толстой кишки.
При отсутствии условий для радикальной ликвидации источникаинфицирования возможна его локализация (отграничение тампонами в брюшной полости), экстраабдоминизация органа.
Формирование межкишечных анастомозов на воспаленных участках кишечных петель при гнойном перитоните противопоказано. В таких случаях целесообразно выведение концевых кишечных стом, включая, при необходимости и тощую кишку.
Наложение кишечного шва и формирование межкишечных анастомозов допустимо на невоспаленных участках кишки при отграниченных формах гнойного перитонита. Межкишечный анастомоз формируется по типу «бок в бок», диаметр его должен быть больше диаметра кишки.При наложении швов на ободочной и прямой кишках целесообразно операцию дополнить формированием временной разгрузочной колостомы.
При правосторонней гемиколэктомии вопрос о формировании первичного илеотрансверзоанастомоза или формировании илеостомы решается индивидуально в зависимости от состояния стенки подвздошной кишки.
При резекции левой половины толстой кишки формируется одноствольная колостома.
При выраженном парезе и расширении кишечных петель более 4-5 см показано проведение декомпрессии пищеварительной трубки путем назоинтестинальной интубации на всем протяжении тонкой кишки широким 2-х канальным (неприсасывающимся) силиконовым зондом.Одновременно с установкой назо-интестинального зонда устанавливается назо-гастральный зонд.
Промывание брюшной полости необходимо производить до «чистой воды» растворами хлорида натрия 0,9%, раствором гипохлорита натрия, водным раствором хлоргексидина (0,05%).
Дренирование брюшной полости проводится становленными через контрапертуры дренажными трубками (желательно двухканальными силиконовыми дренажами или дренажами типа «галльский крест») с рациональным их размещением в предполагаемых местах скопления экссудата (при распространенном перитоните - в поддиафрагмальные, подпеченочные области, левый боковой канал, малый таз).
Введение тампонов в брюшную полость допустимо только при невозможности радикального устранения источника перитонита и в целях гемостаза.
Варианты завершения операции:
- Оперативное вмешательство с полным устранением источника может быть завершено дренированием и ушиванием брюшной полости наглухо. При появлении первых признаков прогрессирования перитонита или внутрибрюшных осложнений, требующих хирургической коррекции проводится релапаротомия «по требованию»;
- Оперативное вмешательство завершается формированием лапаростомы с последующими программыными санациями по следующим показаниям:
· распространенный фибринозно-гнойный или каловый перитонит;
· признаки анаэробного инфицирования брюшной полости;
· тяжелый абдоминальный сепсис, септический шок;
· основное заболевание (его осложнение), не позволяющее одномоментно ликвидировать или локализовать источник перитонита;
· сопутствующее заболевание или состояние, не позволяющее выполнить адекватный объем операции;
· синдром интраабдоминальной гипертензии;
· состояние лапаротомной раны (гнойно-некротический процесс), не позволяющее ушить брюшную полость.
Показания к релапаротомии «по требованию»:
· прогрессирование перитонита (неустраненный первичный источник, появление нового источника, недиагностированный источник, третичный перитонит);
· осложнение основного заболевания, требующее хирургической коррекции (абсцесс, флегмона, кровотечение в брюшную полость или ЖКТ, ранняя спаечная кишечная непроходимость);
· возникновение или осложнение в послеоперационном периоде конкурирующего заболевания, требующего хирургического вмешательства (кровотечение из гастродуоденальных язв, деструктивный панкреатит, перфорация острых и стресс-язв, острое нарушение мезентериального кровотечения);
· осложнения, связанные с нарушением техники хирургического вмешательства, манипуляции (ятрогенные повреждения, несостоятельность ЖКА, несостоятельность культи или кровотечение вследствиесоскальзывание лигатуры, клипсы, инородные тела брюшной полости).
Релапаротомия «по программе» или этапная санация брюшной полости производится через 24-48 часов после первичной операции. Этапные санации включают в себя снятие временных швов с лапаротомной раны, ревизию брюшной полости, эвакуацию экссудата, промывание брюшной полости растворами антисептиков, закрытие лапаротомной раны. При формировании лапаростомы и выполнения этапных санаций рекомендуется:
- изоляция органов брюшной полости от париетальной брюшины и лапаротомной раны перфорированной полиэтиленовой пленкой;
- сведение краев операционной раны отдельными редкими кожными швами с оставлением диастаза краев раны в 5 - 10 см; после каждой санации швы накладывать в новых местах;
Критерии окончания режима программируемых санаций:
· гарантированная ликвидация или локализация источника перитонита;
· отсутствие неудалимых очагов некроза и гнойных очагов;
· прозрачный серозный экссудат;
· наличие перистальтики тонкой кишки;
· отсутствие распространенного гнойно-некротического поражения операционной раны или передней брюшной стенки, исключающее возможность одномоментной хирургической коррекции.
Антибактериальная терапия начинаться непосредственно после установления диагноза перитонита. Первая доза антибактериального препарата вводится перед оперативным вмешательством. До получения результатов микробиологического исследования экссудата брюшной полости применяется "эмпирическое" назначение антибиотиков со спектром действия, включающим грамотрицательные бактерии в сочетании с анаэробными микроорганизмами:
- цефалоспорины (цефоперазон 4 г/сутки) + аминогликозиды (тобрамицин, сизомицин, амикацин 150 мг - 2 г/сутки) + метронидазол (1500 мг/сутки);
- офлоксацины (ципрофлоксацин 800 мг/сут) + метронидазол (1500 мг/сутки);
- карбаценемы (меропенем 3-6 г/сутки) в виде монотерапии.
После получения результатов микробиологических исследований необходима коррекция антибиотикотерапии по чувствительности микрофлоры.
Патогенетическая посиндромная терапия.
1. Инфузионно-трансфузионная терапия проводится с целью ликвидации дефицита жидкости и электролитов, коррекции КЩС с учетом показателей гомеостаза, гемодинамики, темпа диуреза в режиме умеренной гемодилюции (Ht 27-32%), при необходимости - форсированный диурез. Суточный объем инфузии 3000-3500 мл/сутки при темпе диуреза 80-100 мл/час. При восполненном ОЦК в отсутствие гипопротеинемии и снижении диуреза - стимуляция фуросемидом до 2 мг/кг/сутки. Коррекция анемии препаратами крови - при снижении гемоглобина ниже 100 г/л.
2. Коррекция метаболических нарушений:
- нормализация белкового и углеводного обменов;
- использование энергетических материалов в виде растворов декстрозы, концентрированной глюкозы (с введением адекватного количества инсулина), солей калия, коферментов (витаминов);
- введение антигистаминных средств;
- введение ингибиторов протеаз.
3. Коррекция агрегатного состояния крови, профилактика ДВС-синдрома:
- улучшение реологии крови путем создания гемодилюции и применения дезагрегантов (трентал 30-50 мл/сутки, курантил 6-8 мл/сутки, ацетилсалициловая кислота 0,5 г/сутки);
- гепаринотерапия (наиболее рационально постоянно дозированное введение гепарина 20000-30000 ед./сутки под контролем АЧТВ и тромбинового времени);
- препараты крови, содержащие факторы свертывания и фибринолиза;
- профилактика цитотоксического эффекта, мембраностабилизирующий эффект - даларгин (0,6-0,8 мг/сутки), дексазон 16-32 мг/сутки.
4. Коррекция иммунологического статуса:
- пассивная иммунизация гипериммунными плазмами и сыворотками;
- использование иммуномодуляторов (т-активин, тималин, миелопид) и препаратов неспецифической иммунокоррекции (дибазол, аскорбиновая кислота);
- ультрафиолетовая и лазерная обработка крови.
5. Постоянная декомпрессия тонкого кишечника при малых цифрах разряжения (10-20 мм. вод. ст.) с проведением кишечного лаважа растворами электролитов (СЭР - солевым электролитным раствором) в объеме 1000-1500 мл/сутки.
6. Коррекция состояния сердечно-сосудистой системы:
7. Респираторная терапия, профилактика бронхолегочных осложнений:
8. Активные методы детоксикации следует использовать при II и III степени эндогенной интоксикации:
- методом выбора считать проведение плазмафереза с момента стабилизации гемодинамики (целесообразен забор плазмы 500-1000 мл с возмещением адекватным количеством донорской плазмы и альбумина);
- в случае выраженной нефропатии целесообразно проведение гемодиализа или гемодиафильтрации;
- УФО крови (объем облученной крови 300-500 мл).
9. Обезболивание в послеоперационном периоде:
- перидуральная анальгезия растворами анестетиков, наркотических анальгетиков;
- традиционное обезболивание: наркотические и ненаркотические анальгетики.
10. Коррекция энергетического потенциала путем:
- регуляции кислородного и углеводного обменов (адекватная функция дыхания, улучшение микроциркуляции, снятие инсулиновой резистентности);
Перевязка (послеоперационная) с заменой дренажа
Дренаж - это устройство в виде вакуумного аспиратора и вводимых в послеоперационный шов или рану силиконовых трубок, предназначенное для отвода гнойного содержимого наружу. Такая система устанавливается на теле пациента снаружи. Её главная задача - извлечение сформировавшегося в повреждённых тканях экссудата и предотвращение развития лимфореи (нагромождение определённого количества серозной жидкости, в состав которой входит лимфа, секретируемая повреждёнными тканями в ране). Лимфорея не только кардинально тормозит процесс рубцевания, но часто провоцирует нежелательные осложнения.
Для чего проводится послеоперационная перевязка с заменой дренажа?

В послеоперационный период перевязка с заменой дренажа назначается в профилактических целях для предотвращения процессов, провоцирующих воспаление и раздражение тканей и кожного покрова. В основе процедуры лежит применение хирургических дренажей, способствующих заживлению вскрытой в ходе операции полости, которые оказывают антибактериальный эффект от наружных травм и вирусной инфекции. Само собой это очень важная процедура, незаменимая в основном после сложнейших оперативных вмешательств.
Замена дренажа происходит, когда имеет место риск попадания инфекции в полость раны, когда возникает кровотечение либо скопление других послеоперационных экссудатов. За счёт его повторной установки осуществляется процесс отхождения кровяных сгустков либо лимфы из очага раны. В случае если происходит нагноение операционного шва, дренаж способствует выведению гнойных сгустков, провоцирующих размножение микроорганизмов и бактерий.
Преимущественно в виде дренажа используются слоистые повязки из марли, реже применяются силиконовые, тефлоновые и латексные повязки. Разновидность дренажа выбирает хирург, проводящий операцию, с учётом степени повреждения и возможного заражения вскрытого очага. Какой бы дренаж не устанавливался, изначально он обрабатывается, как и рана, специфическими антисептиками, обеспечивая быстрое рубцевание раны.
Кроме того, послеоперационная перевязка с заменой дренажа необходима при мониторинге состояния здоровья больного после проведённой операции - объём, тип, характер выделяемого экссудата свидетельствуют о степени заживления раны.
Отвод лишнего экссудата обеспечивает более быстрое затягивание послеоперационных полостей, уменьшает отёчность тканей. Вместе с тем сокращается и опасность воспаления.
Период устранения дренажа регулируется индивидуально для каждого пациента, поскольку на нём сказываются определённые факторы. В большинстве случаев дренаж удаляется на 3-5 послеоперационный день.
Когда делают послеоперационную перевязку с заменой дренажа?

Показаниями к замене дренажа при перевязке могут быть:
- высыхание его наружного конца;
- повышение у больного температуры;
- чрезмерное заполнение гнойным содержимым полости раны или вскрытого очага;
- усугубление общего состояния здоровья пациента;
- обильные потери фибрина, который способствует закупорке выходного отверстия раны.
Подготовка к процедуре
Алгоритм подготовительного этапа по замене дренажа при послеоперационной перевязке включает:
- Гигиеническое очищение рук медперсоналом.
- Использование перчаток во время выполнения процедуры.
- Идентификацию пациента.
- Представление, объяснение больному задачи и последовательности предстоящей манипуляции.
- Получение добровольного согласия пациента на процедуру.
- Получение от пациента информации относительно того, приносит ли ему дренаж какой-либо дискомфорт (в том случае, когда больной находится в сознании).
- Повторная гигиеническая обработка рук антисептиком, их осушение.
- Подготовка всех необходимых для манипуляции средств.
- Подготовка ёмкости с дистиллированной водой или физиологическим раствором.
- Подготовка дренажной системы (трубки для отведения гнойного содержимого должны быть стерильны и правильно подобраны по размеру).
- Замена старого дренажа новым.
- Закрытие раны чистой стерильной повязкой.
Как проводится перевязка (послеоперационная) с заменой дренажа?
Различают два вида дренажа. Первый (активный) используется для отхождения гнойной жидкости через специальное отверстие либо путём отсасывания в специальную трубку в направлении снизу вверх. Второй тип (пассивный) устанавливается в направлении сверху вниз.
Установка той или иной разновидности дренажа подбирается в зависимости от состояния здоровья пациента, трудностей, с которыми пришлось столкнуться в ходе проведении оперативного вмешательства, степени тяжести патологии, присутствия / отсутствия симптомов воспаления.
Отсутствие либо некорректность установки по какой-либо причине дренажа значительно увеличивают срок заживления раны, что впоследствии может поспособствовать проникновению в операционный шов (рану) инфекции, микробов, представляющих повышенную опасность для больного в послеоперационный период.
Последовательность этапов смены дренажа во время перевязочной процедуры:
- подготовка средств, предназначенных для обработки раны;
- дезинфекция рук тёплым мыльным раствором накануне и после манипуляции, последующая их обработка антисептиком;
- устранение старой перевязки и дренажа;
- очищение полости раны антисептиком или, например, 0,9 %-ным солевым раствором;
- введение антибиотиков (при необходимости);
- установка нового дренажа с последующей стерильной перевязкой.
В некоторых случаях с целью обеспечения быстрого рубцевания поражённого участка врач может назначить пациенту приём антибактериальных и противовоспалительных лекарственных средств, подобрать курс физиотерапии, рекомендовать обработку раны специальными полиэтиленоксидными гелями и мазями.
Уход за послеоперационной раной

Рана, образовавшаяся после оперативного вмешательства, относится к резаным. Надлежащий уход и послеоперационное восстановление по времени занимает в среднем 14-21 день.
После проведения операции рекомендуется тщательно очищать рану асептическим раствором, вовремя менять перевязки, осуществлять визуальное наблюдение за признаками заражения. Грамотная обработка раны обеспечивает её быстрое и своевременное заживление.
Рекомендации по уходу за очагом раны
Чтобы предотвратить распространение инфекции в послеоперационной полости и обеспечить её заживление важно держать послеоперационную полость в сухости и чистоте.
Смену дренажа в период послеоперационной обработки раны следует проводить с учётом степени тяжести раны, памятки относительно использования средства по уходу за ней, советов врача.
Ни в коем случае нельзя постоянно держать рану закрытой до момента снятия врачом швов.
Не стоит слишком часто делать перевязку, однако сменить её необходимо, когда она просочилась кровью либо гнойным отделяемым, загрязнилась либо отпала от раны.
Послеоперационный мониторинг осуществляется:
- При болезненности раны (в этом случае больному рекомендуется принимать назначенные доктором обезболивающие).
- С целью устранения болевых ощущений и отёчности вокруг раны.
- Когда, например, необходима фиксация верхней / нижней конечности в приподнятом положении после проведения операции на руке / ноге.
- Когда нужно, чтобы на ране какое-то время находился обёрнутый марлей (бинтом, стерильной салфеткой) холодный мешок в течение каждых 20 минут на протяжении двух часов.
Как при обработке раны с постхирургическим наложением швов, так и в период после удаления швов существует высокий риск раскрытия раны. В этот период соблюдайте особую осторожность и аккуратность при перевязке и смене дренажа, в частности при обработке послеоперационных полостей, размещённых на подвижных участках тела: максимально устраните напряжение в области шва / раны, чтобы они не разошлись, на протяжении 14 дней с момента хирургического вмешательства исключите физические нагрузки и подъём тяжестей. Соблюдайте рекомендации доктора.
Помните, что свежая незарубцевавшаяся рана какое-то время может быть гиперчувствительной, закостеневшей, онемевшей, чуть возвышенной над поверхностью кожи. Также она может выглядеть отёкшей, покрасневшей, в то время как вокруг неё может наблюдаться зуд. Подобная симптоматика является нормальной реакцией в послеоперационный период заживления.

Обратитесь за помощью к специалисту в случае:
ОБРАТИТЕ ВНИМАНИЕ!
Рубцевание и заживление раны занимает от нескольких недель до месяца. Всё это время она очень чувствительна. Этот факт следует учитывать при её обработке.
Очень важно защищать послеоперационную область, в которой установлен дренаж, от внешнего травмирования, избегать трения об узкую одежду.
Перевязку и замену дренажа осуществлять по мере необходимости. В период заживления раны допускается её покрытие перевязочным материалом с предварительной обработкой антисептиком.
Вскрытие и дренирование лигатурного свища
Большинство хирургических вмешательств заканчивается наложением швов. В ряде случаев вокруг шовных нитей, лигатур, развивается гнойное воспаление с последующим формированием свищей, которые необходимо удалять.
Лигатурный свищ, согласно статистическим данным, диагностируется у 5% пациентов, перенесших различные хирургические операции. Определенно чаще возникает после оперативных вмешательств, проводимых на полых органах малого таза и брюшной области, что вызвано высокими рисками инфицирования окружающих здоровых тканей даже при неукоснительном соблюдении требований асептики. Так, распространенность глубоко лигатурного свища после гинекологических операций составляет 9%, после вмешательств в связи с язвенной болезнью желудка и двенадцатиперстной кишки - 7,8%.
Характерные особенности глубоких лигатурных свищей:
- возникают в абсолютно любой части человеческого тела;
- образуются во всех видах ткани (мышечная ткань, эпидермис);
- возникают в любое время после проведения оперативного вмешательства;
- имеют разное течение клинической картины (отторжение швов может протекать как с заживлением раны, так и с интенсивным развитием воспалительного процесса и нагноением раневой области);
- образуются при любом материале лигатурных нитей.
Лигатурные свищи при использовании разных видов шовного материала
Глубокие лигатурные свищи образуются преимущественно при отторжении организмом нерассасывающихся лигатурных нитей, однако зафиксированы случаи развития данной патологии и при применении рассасывающегося шовного материала. Чаще всего патологическое состояние вызывается шелковыми, капроновыми и лавсановыми нитями. Реже лигатурные свищи вызываются проленовыми или викриловыми нитями.
- Реакция иммунного отторжения. Для иммунных клеток нить, которую они рассматривают в качестве инородного, потенциально опасного тела, выступает в качестве мишени. В этой связи шовный материал не покрывается капсулой.
- Прошивание полого органа. Возникает при нарушении техники проведения оперативного вмешательства, в ходе которого нить попадает в просвет полого органа. В результате контакта с содержимым органа, которое априори является нестерильным, происходит инфицирование нити с последующим распространением патогенных микроорганизмов по всей ее длине.
Возможные осложнения глубокого лигатурного свища:
- Абсцесс. Гнойное воспаление тканей, приводящее к образованию гнойной полости.
- Флегмона. Протекающий в жировой клетчатке гнойный процесс, склонный к стремительному распространению на окружающие здоровые ткани.
- Сепсис. Второе название - заражение крови. Представляет собой инфекционное заболевание, характеризующееся проникновением патогенных микроорганизмов из первичного очага инфекции в кровяное русло.
Показания к вскрытию

Образованию свища предшествует воспалительное уплотнение вокруг шовного материала, обусловленное миграцией лейкоцитов и усиленным образованием коллагена. Затем на фоне уплотнения образуется небольшая замкнутая полость с серозным экссудатом, воспалительным выпотом. На фоне воспаления отмечается покраснение и отек кожи, местное повышение температуры, нередко - повышением температуры тела и ухудшение общего состояния.
Затем полость самопроизвольно вскрывается с образованием свищевого хода, который включает в себя фрагмент лигатуры. Через свищевой ход выделяется серозный экссудат. Спустя некоторое время экссудат становится гнойным. Образованию свищей способствуют:
- несоблюдение правил асептики;
- индивидуальная непереносимость шовного материала;
- обменные расстройства - сахарный диабет, авитаминозы, общее истощение (кахексия) с дефицитом белка;
- сопутствующие тяжело протекающие заболевания внутренних органов;
- иммунодефицитные состояния или наоборот, высокая иммунореактивность;
- общее тяжелое состояние пациента;
- пожилой возраст.
Сроки формирования лигатурных свищей варьируют в широких пределах, от нескольких месяцев до нескольких лет, и даже до года после операции. Свищи могут развиваться повсеместно: на коже и на слизистых оболочках, а также в подкожном слое, мышцах, фасциях, и на внутренних органах. При этом частота их возникновения не зависит от лигатурного материала.
В некоторых случаях свищевые ходы закрываются самопроизвольно без лечения, что может быть истолковано как заживление свища. Однако спустя некоторое время свищ рецидивирует, его ход открывается, и гной вновь выходит наружу. Хроническое гнойное воспаление может полечь за собой формирование гнойных очагов - абсцессов и флегмон с дальнейшим развитием сепсиса.
Если лигатурный свищ возник на брюшной стенке после операции на органах брюшной полости, возможна эвентерация - расхождение швов и выпадение наружу внутренних органов. Все это указывает на невозможность самостоятельного излечения лигатурного свища и необходимость хирургического вмешательства.
Методика

Сначала врач осматривает место болезни и оценивает характер и протяженность гнойного воспаления, наличие гнойных очагов и затеков. С этой целью иногда прибегают к фистулографии - в свищевые ходы вводят рентгенконтрастное вещество, а затем выполняют рентгенографию.
Вскрытие свища осуществляется под местной анестезией. После предварительной обработки кожи антисептиком врач рассекает рану и удаляет имеющийся шовный материал. Попутно коагулируют кровоточащие сосуды. Свищевое образование вместе со стенками и ходами удаляют полностью в пределах здоровых тканей. Имеющиеся гнойные затеки обязательно вскрывают. Образовавшуюся рану полностью промывают растворами антисептиков и дренируют.
Вторичные отсроченные швы накладывают лишь после того как прекратится отхождение серозного и гнойного отделяемого по дренажам. До этого времени проводятся ежедневные перевязки со сменой дренажей, пациент принимает антибиотики, противовоспалительные и общеукрепляющие средства, витамины.
Лигатурный свищ далеко не всегда обусловлен нарушением асептики, неправильной техникой наложения швов, и другими врачебными ошибками. Поэтому даже грамотное удаление свища не всегда гарантирует от рецидивов.
Особенности лечения
Чем более длительнее период существования глубокого лигатурного свища, тем сложнее добиться полного излечения пациента. Для эффективности лечения, наряду с проведением оперативно вмешательства, показано проведение комплексной терапии с использованием препаратов различных групп:
- антибактериальные средства;
- местные антисептики;
- ферментативные препараты, направленные на деструкцию омертвевших тканей.
Нередко в дополнении к оперативному и медикаментозному методам терапии специалист назначает проведение физиотерапевтических процедур:
- УВЧ-терапия. Процедура оказывает благоприятное воздействие на процессы микроциркуляции лимфы и крови, что позволяет добиться снижения отека и предотвращает распространение инфекции.
- Кварцевание поверхности раны. Процесс кварцевания оказывает пагубное воздействие на представителей патогенной микрофлоры, тем самым способствуя достижению стойкой ремиссии. Однако данный метод физиотерапии не может гарантировать полное выздоровление пациента.
Особенности послеоперационного периода

В послеоперационном периоде важно строго соблюдать все данные врачом рекомендации. Послеоперационная рана должна подлежать регулярной обработке антисептиками и медикаментами, ускоряющими регенерацию тканей. Кроме того, в это время необходимо:
- принимать назначенные врачом лекарственные препараты;
- выполнять перевязку раневой области;
- контролировать чистоту повязки (загрязненная повязка может стать причиной инфицирования раны);
- не допускать попадания на рану воды (при намокании повязки показана незамедлительная перевязка);
- посещать врача для оценки состояния процесса заживления раневой области;
- соблюдать диету, рекомендованную специалистом;
- отказаться от посещения бассейна, сауны, бани, солярия;
- исключить физическую активность;
- воздержаться от употребления спиртных напитков.
Когда требуется врачебная помощь?
В послеоперационном периоде пациенту необходимо особенно внимательно относится к своему состоянию, ведь любые негативные изменения могут свидетельствовать о течении воспалительного процесса. К числу общих тревожных симптомов относятся:
- повышение показателей температуры тела;
- слабость, головокружение, обмороки;
- рвота, тошнота.
Также пациенту надлежит следить за состоянием послеоперационной раны. Негативными проявлениями в этот период считаются:
- покраснение кожи в области раны;
- отечность пораженной зоны;
- гнойные или кровяные выделения из раны;
- усиливающаяся боль в области раны;
- расхождение медицинских швов.
Сколько длится период заживления и когда показано снятие швов
Снятие медицинских швов производится исключительно при условии полного заживления раневой области, которое диагностируется при плотном срастании краев раны. На продолжительность периода заживления оказывают влияние такие факторы как:
Читайте также:
