Посев в жидкую среду. Рост бактерий.
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Цель занятия. Освоить технику посева микроорганизмов на плотные и жидкие питательные среды и методы выделения чистых бактериальных культур. Ознакомить студентов с основными культуральными характеристиками микроорганизмов и методами определения количества бактерий.
Оборудование и материалы. Бульонные и агаровые культуры В. cereus, Е. coli и S. aureus в пробирках и в чашках Петри, смешанная бульонная культура Е. соli и S. aureus, стерильные МПА и МПБ в пробирках, чашках Петри, солевой МПА (8 % хлорида натрия) в чашках Петри, стеклянные шпатели, стерильные пипетки Пастера, бактериологические петли.
Культура микроорганизмов — это популяция (расплодка) клеток на питательной среде. Посев и пересев культур микроорганизмов на питательные среды — наиболее частый методический прием, который используют для первичного выделения микроорганизма из какого-либо объекта, а также для поддержания культур в жизнеспособном состоянии в лабораторных условиях.
Чистая культура — это популяция бактерий одного вида или биологического варианта (биовара), выращенная на питательной среде.
Штаммы — чистые культуры микроорганизмов одного вида, выделенные из разных объектов или из одного и того же объекта, но в разное время.
Колония — макроскопически видимое скопление клеток микроорганизма на поверхности или внутри плотной питательной среды, образовавшихся в результате размножения одной жизнеспособной клетки. По этой причине колонию обычно рассматривают как чистую культуру микроорганизма.
Посев на жидкую питательную среду. Пробирку с исследуемым материалом и пробирку с питательной средой держат в левой руке, в правую руку берут бактериологическую петлю или пипетку и'пробки от пробирок (рис. 37). Над пламенем горелки обжигают края пробирок, бактериологическую петлю (пипетку) вводят в пробирку с материалом, переносят материал в пробирку со стерильной питательной средой и стряхивают с петли в среду, не смачивая при этом петледержатель. Края пробирок вновь проводят над пламенем горелки, закрывают пробирки пробками, стерилизуют петлю и ставят ее в штатив. Использованную пипетку опускают концом вниз в банку с дезинфицирующим раствором.
Посев на плотную питательную среду. Выполняют разными способами.
При посеве в пробирку: 1) пробирки с засеваемой микробной культурой и питательной средой (МПА) берут в левую руку, пробирку с МПА держат скошенной поверхностью среды вверх. В открытую у пламени пробирку с микробной культурой (или другим материалом) вводят простерилизованную бактериологическую петлю, слегка прикасаясь петлей к поверхности среды (материала), берут материал, переносят его в пробирку со стерильной питательной средой. Петлю опускают до дна пробирки, погружают в конденсационную жидкость и зигзагообразным движением проводят снизу вверх по поверхности среды (посев «штрихом») (рис. 38). Пробирки закрывают пробками, петлю прожигают. Пробирки с посевами ставят в термостат; 2) при посеве уколом в столбик среды пробирку с плотной (нескошенной) средой берут в левую руку, над пламенем горелки извлекают из пробирки пробку, петлей с материалом прокалывают вертикально по центру пробирки питательную среду, петлю вынимают, прожигают, пробирку с засеянной средой закрывают пробкой (рис. 39).
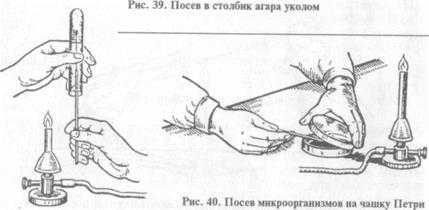
При посеве на чашку Петри: чашку берут в левую руку, большим пальцем левой руки слегка приподнимают крышку, обжигают на пламени горелки края чашки в зоне щели, вносят посевной материал на поверхность питательной среды, затем растирают его при помощи стеклянного шпателя или бактериологической петли (рис. 40).
Посев на полужидкую питательную среду. Выполняют методом укола в столбик питательной среды.
Выделение чистых культур микроорганизмов. При бактериологическом исследовании искомый микроорганизм обнаруживают в материале, как правило, в смеси с бактериями других видов. Классическими методами бактериологии возможно идентифицировать микроорганизм только при условии, что он находится в виде чистой культуры.
Методы, основанные на механическом разобщении клеток. Эти методы наиболее часто применяют при выделении чистых культур микроорганизмов.
Метод Пастера (метод разведений): из исследуемого материала готовят ряд последовательных, чаще десятикратных разведений на стерильной жидкой питательной среде в пробирках или колбах (10 -1 …10 -10 ). Предполагают, что количество микробных клеток в каждом последующем разведении будет меньше, чем в предыдущем, и в какой-то из пробирок останется только одна микробная клетка, которая и даст/начало чистой культуре Микроорганизма. Однако для успешного применения этого метода необходимо, чтобы искомый микроорганизм в материале количественно преобладал над сопутствующими видами.
Метод Коха (метод заливок): исследуемый материал в небольшом количестве вносят в пробирку с расплавленным и охлажденным до 45. 50 "С МПА, перемешивают, затем каплю питательной среды переносят во вторую пробирку с расплавленным МПА и т. д. Количество разведений зависит от предполагаемой численности микроорганизмов в исследуемом материале. Затем содержимое каждой пробирки выливают в стерильные чашки Петри, после затвердения среды посевы помещают в термостат. Фиксированные в плотной среде микробные клетки при размножении формируют колонии, из которых можно отвить (пересеять) чистую культуру микроорганизма.
Метод Дригальского: берут три—пять чашек Петри с плотной питательной средой. В одну из чашек вносят посевной материал и распределяют его шпателем по поверхности питательной среды. Не обжигая шпатель, оставшийся на нем материал последовательно растирают на поверхности среды во второй, третьей и остальных чашках. В последних чашках Петри после инкубирования в термостате обычно наблюдают формирование изолированных колоний бактерий.
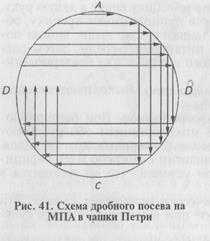
Более экономичен следующий способ получения изолированных колоний. Бактериологической петлей с посевным материалом несколько раз делают параллельные штрихи в одном секторе чашки Петри с питательным агаром (рис. 41). Пет- о лю прожигают в пламени горелки, дают остыть и часть материала из первого сектора <А) аналогичным образом распределяют во втором секторе (В), затем в третьем (С) и четвертом (Д) секторах. Даже при рассеве бактериальной массы из колоний в секторе Д при таком способе получают рост изолированных колоний.
Методы, основанные на биологических особенностях микроорганизмов. Направлены на подавление роста сопутствующей микрофлоры.
Прогревание: при выделении чистой культуры споро-образующего вида бактерий исследуемый материал прогревают при 80 °С 20 мин или кратковременно кипятят. Вегетативные клетки сопутствующей микрофлоры в этих условиях погибают, а споры искомого микроорганизма сохраняют жизнеспособность и прорастают после посева на питательные среды.
Использование селективных питательных сред, которые содержат вещества, подавляющие рост сопутствующей микрофлоры (антибиотики, красители и т. д.), — частый прием при исследовании контаминированного материала. Однако необходимо учитывать, что селективные факторы часто находятся не в бактерицидных, а в бактериостатических концентрациях, поэтому клетки сопутствующих микроорганизмов не растут, но остаются жизнеспособными на поверхности питательной среды и при отвивке колоний исследуемой культуры на обычные среды могут быть причиной получения смешанной культуры.
Биопроба — заражение чувствительных лабораторных животных — метод, с помощью которого не только выделяют возбудитель из патологического материала, но также изучают вирулентность чистой культуры. Организм животного с его защитными факторами служит биологическим «фильтром», который уничтожает сопутствующую непатогенную микрофлору, но не способен подавить размножение вирулентных бактерий, что позволяет достаточно легко выделить возбудитель в чистой культуре из тканей погибшего или убитого с диагностической целью животного.
При выделении чистых культур некоторых видов бактерий используют их другие биологические особенности. Например, способность микроорганизма расти при низких (листерии) или высоких (термофильные бактерии) температурах, которые лежат за пределами температурных диапазонов сопутствующих видов бактерий. Для выделения культуры P. vulgaris используют способность данного вида давать ползучий рост (роение) на поверхности плотной питательной среды. С этой целью материал, содержащий P. vulgaris, засевают в конденсационную воду на дне пробирки со скошенным МПА, не касаясь поверхности среды. Сопутствующая микрофлора растет в нижней части питательной среды, а протей в виде прозрачной пленки распространяется вверХ.
Для выделения С. tetani материал засевают точечно на плотную питательную среду в чашках Петри и после выращивания отвивают культуру с периферии ползучего роста.
Культуральные свойства микроорганизмов. В процессе идентификации наряду с другими свойствами у микроорганизмов изучают культуральные признаки — особенности роста на плотных, жидких и полужидких питательных средах при определенных условиях.
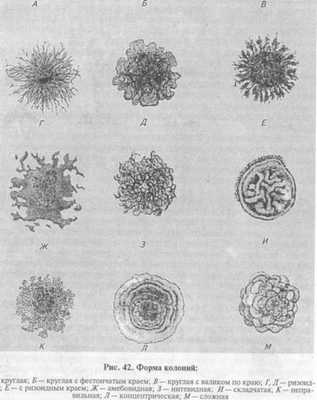
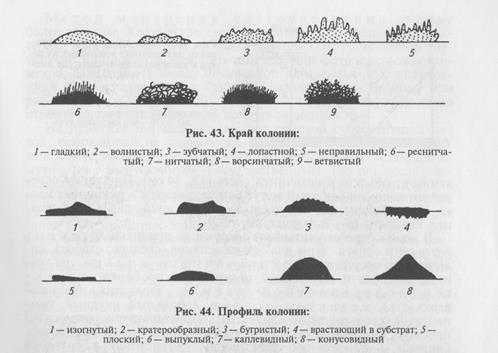
На плотных средах изучают колонии микроорганизмов. Бактерии каждого вида формируют колонии с определенными признаками, которые обычно учитывают при идентификации. Размер колоний: крупные — диаметром 4. 6 мм и более, средние—2. 4 мм, мелкие — 1. 2мм и точечные колонии диаметром менее 1 мм. Форма колоний может быть правильной круглой, неправильной (амебовидной, розеткообразной), корневидной (рис. 42). Цвет зависит от способности микроорганизма образовывать пигмент: белый, желтый, красный, сине-зеленый и т. д. Бактерии, не синтезирующие пигмент, формируют бесцветные колонии. Учитывают характер поверхности, которая может быть шероховатой, блестящей, матовой, сухой, влажной, гладкой, радиально или концентрически исчерченной. Края колонии могут быть ровными, волнистыми, зазубренными, бахромчатыми, их исследуют невооруженным глазом и под малым увеличением микроскопа (рис. 43). Рельеф (профиль) определяют, рассматривая колонию сбоку; различают плоские, конусообразные, куполообразные, плоские с конусовидным центром или углублением в центре колонии, с утолщенными (валикообразными) краями (рис. 44). Учитывают прозрачность колонии: непрозрачная, полупрозрачная, прозрачная. Структура может быть однородной, зернистой, волокнистой и т.д. (рис. 45). Ее выявляют при слабом увеличении микроскопа. Консистенция может быть пастообразной, слизистой, плотной (сухой) и т.д.; ее определяют, дотрагиваясь до колонии бактериологической петлей. Колонии некоторых видов врастают в толщу питательной среды, что также определяют при помощи бактериологической петли. Запах: многие виды бактерий в процессе роста на питательных средах выделяют специфические ароматические вещества.
Ценную дополнительную информацию об особенностях строения колоний дает их изучение в косопадающем пучке света (рис. 46). Культуры на прозрачной агаровой среде в чашках Петри помещают на предметный столик бинокулярной лупы. Между бинокулярной лупой и источником света помещают зеркало от микроскопа вогнутой стороной вверх таким образом, чтобы лучи, отраженные от него, попадали в плоскость изучаемого объекта под углом 40. 45°. Зеркало устанавливают на равном удалении от объекта и источника света (12. 14 см). При таком освещении колонии бактерий могут быть окрашены в различные цвета. Цвет зависит как от видовых особенностей, так и от состояния культуры (S-, R-формы, см. тему 12).
В жидких средах учитывают следующие признаки: степень помутнения среды (интенсивное, среднее, слабое), наличие или отсутствие пристеночного кольца на границе мениска и внутренней поверхности пробирки, характер поверхностной пленки (толщина, цвет, поверхность), характер осадка (обильный, скудный, компактный, хлопьевидный, слизистый). При характеристике осадка пробирку слегка встряхивают и учитывают результат: осадок разбивается в гомогенную равномерную суспензию; образуются мелкие или крупные хлопья, глыбки; слизистый осадок при встряхивании обычно поднимается в виде косички. Пигментообразующие микроорганизмы вызывают окрашивание питательной среды и осадка (желтое, зеленоватое, красное и т. д.).
Определение количества бактерий. При характеристике развития микробной популяции, санитарной оценке кормов, продуктов питания, при вычислении показателя вирулентности микроорганизма необходимо устанавливать количество микробных клеток в единице объема того или иного материала.
Определение общего количества микроорганизмов. Можно применять метод прямого счета и метод измерения светорассеяния.
Метод прямого счета: бактерии подсчитывают в камерах Горяева, Тома или в окрашенных мазках. В последнем случае 0,01 мл бактериальной суспензии микропипеткой наносят на предметное стекло и равномерно распределяют на 1 см2. Мазок фиксируют, окрашивают и подсчитывают клетки в 10. 15 полях зрения по диагонали квадрата. Определяют среднее число клеток в одном поле зрения. Делят 1 см 2 на площадь поля зрения, которую измеряют методом микрометрии (см. тему 1), затем частное умножают на среднее число микробных клеток в поле зрения, получают их количество в 0,01 мл взвеси бактерий.
Метод измерения светорассеяния считают более точным. Количество света, рассеиваемого суспензией бактерий, пропорционально их концентрации. Этот показатель достаточно точно можно измерить при помощи фотоэлектроколориметра. Зависимость между оптической плотностью и концентрацией клеток различна для бактерий разных видов. Поэтому при работе с таким прибором для каждого вида бактерий необходимо строить свою калибровочную кривую зависимости.
На практике широко используют простой субъективный метод, основанный на визуальном сравнении мутности исследуемой бактериальной суспензии с так называемым «стандартом мутности», выпускаемым Государственным научно-исследовательским институтом стандартизации и контроля биологических препаратов им. Л. А. Тарасевича. Стандарт представляет собой взвешенные в воде частицы стекла «Пирекс» и состоит из трех запаянных пробирок-эталонов (5, 10 и 20 международных единиц). Мутность стандарта на 10 ед. соответствует следующим концентрациям: для бактерий кишечной группы — 0,93*10 9 кл/мл; коклюшной группы — 11 • 10 9 кл/мл; для бруцеллезных бактерий — 1,7 • 10 9 кл/мл; туляремийных микробов — 5 • 10 9 кл/мл.
Мерной пипеткой вносят 0,1. 0,5 мл исследуемой бактериальной суспензии в пустую пробирку, соответствующую по диаметру и толщине стенок пробирке «стандарта мутности». К суспензии добавляют физиологический раствор до оптической плотности стандарта на 10 ед. Физиологический раствор вносят небольшими мерными порциями, записывая его количество и сравнивая мутность опытной и стандартной пробирок невооруженным глазом на фоне специальной шрифтовой таблицы. Зная, во сколько раз развели исследуемую бактериальную суспензию, чтобы уравнять ее оптическую плотность со стандартом, можно рассчитать содержание микробных клеток в 1 мл исходной суспензии.
Например, в пробирку поместили 0,1 мл суспензии бактерий, содержащей неизвестное количество клеток. Для уравнивания оптической плотности исследуемой суспензии со стандартом мутности 10 ед. в пробирку добавили 0,9 мл физиологического раствора, т. е. исходную суспензию развели в 10 раз. Известно, что суспензия данного вида бактерий при оптической плотности 10 ед. содержит 1,3*10 9 кл/мл. Следовательно, концентрация исследуемой суспензии составляет 1,3*10 10 кл/мл.
При работе с бактериями, для которых нет данных о содержании микробных клеток в 1 мл относительно «стандарта мутности», необходимо предварительно методом прямого счета определить их количество в суспензии, например, оптической плотностью 10 ед.
Определение количества живых микроорганизмов. Метод основан на выводе, что бактериальная колония — это результат деления единичной клетки на плотной питательной среде (исключение составляют бактерии, образующие цепочки из клеток).
Мерной пипеткой объемом 1 мл добавляют 1 мл культуры Е. coli в бактериологическую пробирку с 9 мл стерильного физиологического раствора, подогретого до 37. 38 °С (разведение 10-1). Далее аналогичным способом готовят разведения культуры от 10 -2 до 10 -8 . Для каждого разведения используют новую пипетку того же объема и класса. Из пяти последних пробирок суспензию бактерий по 0,1 мл наносят на поверхность подсушенного МПА в две чашки Петри. Внесенный материал стерильным шпателем распределяют по поверхности питательной среды. Посевы инкубируют при 37. 38 ºС 24 ч.
Учет результатов: в чашках Петри, где выросло более 150. 300 и менее 10 колоний, результаты не учитывают. Выбирают чашки Петри с параллельными посевами (из одного разведения), содержащими 10. 150 колоний. Подсчитывают колонии на чашках из одного разведения, суммируют, определяют среднее число колоний и с учетом степени разведения рассчитывают содержание жизнеспособных клеток (колониеобразующих единиц) в 1 мл исходной суспензии бактерий.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Провести пересев бульонной и агаровой культур бактерий на скошенный МПА и в МПБ в пробирках.
2. Провести посев смешанной бульонной культуры на МПА в чашках Петри по методу Дригальского.
3. Описать характер роста Е. coli, S. aureus, В. cereus на МПА (колонии) и в МПБ.
4. Определить количество микробных клеток в 1 мл бульонной культуры Е. coli методом прямого счета и при помощи стандарта мутности.
5. Провести посев бульонной культуры Е. coli на МПА в чашках Петри с целью определения количества жизнеспособных клеток.
Контрольные вопросы
1. Что такое культура, смешанная культура, чистая культура, штамм и колония бактерий?
2. Какие методы применяют для получения чистых культур микроорганизмов?
3. Какие культуральные признаки учитывают при идентификации бактерий?
4. Какими методами определяют общее число микроорганизмов и количество жизнеспособных клеток?
Ростовые свойства питательных сред
Ростовые свойства питательных сред определяют их качество. Для определения используют микроорганизмы и стандартные питательные среды (готовые к употреблению, имеющие сертификат производителя, прошедшие аттестацию в специальной лаборатории).
Ростовые свойства - это способность среды обеспечивать рост соответствующих микроорганизмов с нужной эффективностью. В таблице представлены тест-микроорганизмы и условия инкубации для ростовых свойств.
АТСС 6633 или Bacillus cereus АТСС 10702;
Escherichia coli АТСС 25922;
Candida albicans NCTC 885-653 или Candida albicans ATCC 10231;
Aspergillus niger ATCC 9642
Bacillus cereus ATCC 10702
Escherichia coli ATCC 25922;
Salmonella abony IHE 103/39
Штаммы-ассоцианты: Escherichia coli ATCC 25922
Salmonella abony ІНЕ 103/39;
(P. aeruginosa ТИСК 453)
Salmonella abony IHE 103/39;
Bacillus cereus ATCC 10702 или Bacillus subtilis ATCC 6633;
Pseudomonas aeruginosa ATCC 9027
(P. aeruginosa ТИСК 453) Escherichia coliATCC 25922
Staphylococcus epidermidis АТСС 14990
Pseudomonas aeruginosa АТСС 9027
(Р. aeruginosa ГИСК 453) Escherichia coliАТСС 25922
Salmonella abony ІНЕ 103/39
Цитратный агар Симмонса Среда № 14 для идентификации Е. coli
- АТСС - Американская коллекция типовых культур (American Type Culture Collection), США
- ГИСК - Всероссийский музей патогенных бактерий ТИСК им. Л.А. Тарасевича, Россия
- 1НЕ - Институт гигиены и эпидемиологии, Прага, Чехия
- ССМ - Чешская коллекция микроорганизмов
Ростовые свойства агаризованных сред
Исследуемую и стандартную среду на основе агар-агар разливают по чашам Петри. Используют емкости диаметром 90 мм, наливая в них по 15 мл состава. После застывания агар подсушивают.
Засев проводят поверхностным методом, используя 0,1 мл рабочей взвеси с концентрацией 103КОЕ/мл. засевание проводят троекратно.
После инкубации описывают морфологические особенности колоний, а для определения коэффициента прорастания используют формулу:
K=N/N0, где
N и N0 - среднее арифметическое число колоний на чашах с исследуемой и стандартной средами соответственно.
Годной к употреблению считается среда, если коэффициент прорастания составляет 0,7 по сравнению со стандартным образцом.
Ростовые свойства жидких сред
Жидкие среды (исследуемые и стандартные) разливают в пробирки объемом по 10 мл. тест-микроорганизмы засевают в три пробирки с каждой средой. Определение роста осуществляется визуальным способом по уровню помутнения состава или изменению его цвета. Описание морфологических особенностей колоний проводят после инкубации, которая проводится на основе пересева на агаризованную среду.
Коэффициент прорастания рассчитывают по аналогичной формуле. Жидкая среда считается годной к использованию, если коэффициент прорастания составляет от 0,7 по сравнению со стандартной средой.
Требования к ростовым свойствам

Как для агаризованной, так и для жидкой питательной среды коэффициент прорастания должен составлять не менее 0,7 по сравнению с стандартной питательной средой.
Важным параметром оптимального роста является отсутствие в среде посторонних микроорганизмов. Для этого составам должна быть обеспечена стерильность. Для определения стерильности обязательно проводят контроль всей партии, выбирая для этого не менее 10%емкостей. При обнаружении микробного роста в процессе контроля стерильности, хотя бы в одной их емкостей, испытывают на стерильность все емкости в партии.
Для обеспечения оптимальных ростовых свойств важно также обеспечить правильные условия хранения. Для хранения сухих питательных сред используют сухое темное место. Температура окружающей среды должна составлять от 2 до 30 градусов по Цельсию. Емкости должны быть герметично закрыты. После вскрытия на таре пишут дату, а также хранят не дольше указанного срока годности при комнатной температуре.
Питательные среды, приготовленные из сухих составов, могут храниться 1 месяц при комнатной температуре и не более трех месяцев при температуре 5-6°С. Среды, разлитые по чашкам, хранятся не дольше семи дней при аналогичных температурных условиях.
Внимание! Компания Медика Групп занимается продажей автоматических микробиологических анализаторов и флаконов с питательными средами, но не оказывает услуги по сбору или расшифровке результатов анализов крови.
Технология получения бактериальных концентратов
ОСОБЕННОСТИ ТЕХНОЛОГИИ ПОЛУЧЕНИЯ БАКТЕРИАЛЬНЫХ КОНЦЕНТРАТОВ

Информация специализированная
Основной задачей технологии производства бактериальных препаратов на основе живых микроорганизмов заключается в обеспечении таких условий получения и переработки микробной массы, при которых в готовой продукции сохранилось бы максимальное число жизнеспособных клеток и не утрачивались бы их полезные свойства.
В зависимости от способа консервирования различают жидкие, замороженные и сухие бактериальные препараты
СУХИЕ ПРЕПАРАТЫ. Достоинством сухих препаратов («Бифиформ», «Линекс», «Бактисубтил» и др.) следует считать то, что бактерии находятся как бы в состоянии спячки. Поэтому они не так чувствительны к перепадам температурного режима, их проще хранить. Однако, в случае использования сухих препаратов или сухих заквасок прямого внесения, не всегда можно говорить о получении эффективного продукта питания, так как большинство штаммов молочнокислых бактерий при сушке значительно изменяют свою активность, находясь в глубоком анабиозе и восстанавливают её только лишь после 3—5 делений после попадания в благоприятную для размножения среду. Им требуется порядка (8—10) часов для перехода к активному физиологическому состоянию, однако к этому времени большая их часть уже может быть естественным образом элиминирована из кишечника. Для того чтобы хоть какая-то часть бактерий закрепилась в кишечнике, их концентрация в сухих препаратах должна быть не менее, чем 10 10-12 живых бактерий в 1 грамме сухого порошка. Столь высокую концентрацию живых бактерий получить в условиях распылительной сушки или лиофилизации практически невозможно, т. к. от 10-25% популяций бактерий - пробиотиков гибнет, а сохранившие жизнеспособность бактерии резко снижают свою пролиферативную активность, в результате чего основная доля бактерий - пробиотиков при их назначении проходит через кишечник человека и животных транзитом, оказывая лишь минимальное лечебно-профилактическое действие и не проявляя способности к колонизации (заселению) данной экологической ниши. Недостатком также следует считать высокую себестоимость производства сухих концентратов вследствие того, что оборудование для сушки (лиофилизации), располагающееся в технологической цепочке производства концентрата, настолько дорогостоящее, что далеко не каждое предприятие может позволить себе его закупить.
ЖИДКИЕ ПРОБИОТИКИ. В отличие от сухих, в жидких пробиотиках бактерии постоянно находятся в активном состоянии. Главное достоинство жидких пробиотиков заключается в том, что бактерии в них находятся в живой биологически активной форме. Свое благотворное воздействие они оказывают незамедлительно — сразу после приема препарата, что выгодно отличает жидкие пробиотики от аналогичных сухих препаратов.
Кроме живых бактерий, жидкие пробиотики содержат продукты их жизнедеятельности: весьма полезные для организма человека биологически активные вещества: незаменимые аминокислоты, органические кислоты, витамины, интерфероностимулирующие и иммуномодулирующие вещества. Указанные метаболиты синтезируются пробиотическими микроорганизмами не только в специально подобранной питательной среде, но и в иных пищевых средах, а также в кишечнике человека.
Жидкие пробиотики благодаря своим поистине уникальным лечебным, профилактическим, общеукрепляющим действиям охватывают практически все области медицины. Длительная апробация в ведущих клиниках во многих регионах России показала высокую эффективность их применения в гастроэнтерологии, проктологии, акушерстве и гинекологии, педиатрии, хирургии и травматологии, фтизиатрии, дерматовенерологии, онкологии, в спортивной медицине, косметологии, в гидроколонотерапии и других областях.
Жидкие пробиотики одинаково полезны и безопасны и для взрослых, и для детей. Жидкие пробиотики намного дешевле сухих препаратов (по количеству содержащихся в них живых бактерий), что объясняется отлаженными технологиями культивирования и отсутствием стадии сушки. Комплексное использование жидких пробиотиков дает возможность более результативно стабилизировать микрофлору кишечника, обмен веществ и укрепить иммунитет.
ТЕХНОЛОГИЧЕСКИЙ ЦИКЛ ПОЛУЧЕНИЯ БАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ

Цикл получения бакконцентратов состоит из приготовления питательной среды и инокулята, накопления биомассы бактерий, выделения и концентрирования биомассы.
Анализ технологии производства бактериальных препаратов показал, что перспективным является совершенствование первых - базовых этапов, которые должны лечь в основу разработки последующих стадий. Поэтому важное значение имеет этап накопления биомассы микроорганизмов, эффективность которого в большей степени зависит от условий культивирования и активности посевного материала.
Одним из наиболее распространенных приемов интенсификации роста бактерий является оптимизация состава питательных сред. Идеальный бактериальный препарат должен готовиться с использованием стандартной питательной среды.
Молочнокислые бактерии различаются по потребности в стимуляторах роста, в связи с этим предложены различные питательные среды для выращивания мезофильных, термофильных молочнокислых стрептококков и ацидофильных палочек. В качестве источника углерода они могут использовать моно- и дисахариды, органические кислоты. На обычных питательных средах они не развиваются, а растут на средах с добавлением аминокислот, гидролизатов белков мяса, лактоальбумина, казеина, различных видов муки. Положительно влияет на рост микроорганизмов добавление кукурузы, моркови, картофеля, дрожжевого автолизата, а так же некоторые пептиды, пурины, жирные кислоты.
Размножение бифидобактерий обусловлено наличием факторов роста. Многие виды нуждаются в биотине, пантотеновой кислоте, цистеине, аминосахарах, коферменте А, олигосахарах, некоторых ненасыщенных жирных кислотах и др. В синтетических средах бифидобактериям для роста необходимы железо, магний, фосфаты, хлориды калия и натрия, в некоторых случаях марганец.
Молоко как среду накопления клеток молочнокислых бактерий, без специальной предварительной обработки использовать невозможно из-за коагуляции белков, что очень затрудняет отделение клеток. В связи с этим были проведены многочисленные исследования по использованию для накопления биомассы жидкой среды, состоящей из стандартных компонентов, а также молочной сыворотки с добавлением необходимых факторов роста. В качестве стимуляторов роста различными авторами было рекомендовано использовать дрожжевой автолизат, кукурузный экстракт, микроэлементы.
При культивировании анаэробных микроорганизмов необходимы компоненты для уплотнения среды. В большинстве случаев для этих целей применяют агар-агар. В качестве альтернативного решения, для снижения затрат и повышения функциональных характеристик готового продукта, представляется возможным частичная или полная замена агара на полисахариды растительного происхождения со способностью к гелеобразованию.
В процессе производства бактериальных препаратов важным этапом является культивирование микроорганизмов. Основными факторами, ограничивающим рост микроорганизмов в периодических процессах являются исчерпание питательных сред и накопление в культуральной среде токсических продуктов метаболизма. Поэтому в микробиологической практике находят режимы дробной подачи некоторых субстратов в зону роста.
Однако проблема сохранения жизнеспособности и основных свойств микробов при производстве бактериальных препаратов состоит не только в подборе комплекса питательных веществ для их роста. Важную роль при этом отводится условиям культивирования бактерий.
Цикл развития культуры начинается с засева среды. Засев осуществляется в таком количестве, которое обеспечивает начало роста микроорганизмов с минимальной задержкой. Для многих молочнокислых бактерий активный «омоложенный» посевной материал применяется в количестве 1-3% от объема среды. Посевной материал, попав в свежую полноценную среду, постепенно начинает размножаться. Через определенное время в стационарной фазе масса клеток в питательной среде достигает максимального уровня.
Немаловажную роль для роста бактерий играют буферные свойства среды. Для поддержания оптимальной для роста буферной емкости среды используют натриевые или калиевые соли лимонной, фосфорной или уксусной кислот.
Следующим необходимым этапом при получении бактериальных препаратов является отделение биомассы от культуральной среды. Для этой цели используют сепараторы или бактофуги. При этом эффект выделения бактериальных клеток из культуральной жидкости определяется формой клеток, плотностью питательной среды, режимом бактериотделения.
Существенно влияет на активность полученных препаратов и на их стойкость продолжительность выращивания клеток перед их отделением.
Многие исследователи рекомендуют отделять клетки в конце логарифмической, перед началом стационарной фазы роста, что обеспечивает максимальный выход клеток и их стойкость. Затем в зависимости от выбранного способа консервирования биомассы производится розлив во флаконы и хранение, замораживание или высушивание.
Необходимо отметить, что спектр видов бактериальных препаратов, постоянно расширяется. Это связано со стремлением улучшить органолептические свойства продуктов, повысить их функциональные качества.
Одним из перспективных направлений является разработка новых поливалентных и комбинированных препаратов с иммобилизованными пробиотическими бактериями различных таксономических групп. Пока выпускаются только два сорбированных пробиотика бифидумбактерин форте и пробифор, представляющих собой высушенную микробную массу живых бифидобактерий, иммобилизованных на активированном угле. Механизм терапевтического действия этих препаратов отличается тем, что искусственно созданные сорбированные на частичках угля микроколонии бифидобактерий находятся в ином физико-химическом состоянии, что обеспечивает более интенсивное их взаимодействие с пристеночным слоем слизистой кишечника и заселение кишечника бифидобактериями, что существенно повышает их антагонистическую активность.
Поиск и применение новых технологических приёмов для повышения функциональных показателей пробиотиков является одной из главных задач биотехнологии. В настоящее время наряду с биологической активностью ингредиентов для создания препаратов необходимо оценивать и источник их выделения. Применение натуральных пищевых волокон состоящих в комплексе с биологически ценными веществами для стимулирования активности и жизнеспособности бифидобактерий позволит повысить пробиотические свойства бактериального концентрата и их устойчивость при технологической обработке и длительном хранении.
Некоторые технологии получения бакконцентратов:
Работа 8. Количественный учет микроорганизмов почвы методом предельных разведений на жидких питательных средах
Микроорганизмы играют важную роль в процессе формирования почвы. Численность микроорганизмов в почве во многом определяет ее плодородие. Изучение микроорганизмов почвы дает надежные результаты лишь в том случае, если правильно взяты почвенные образцы. До взятия почвенных образцов следует сделать описание района исследования, указав характер рельефа, растительность и агротехнику. Необходимо дать подробную характеристику почв.
При исследовании микроорганизмов в почвенных горизонтах делают почвенный разрез. Вертикальную стенку почвенного разреза зачищают каждый раз перед взятием образцов почвы. При изучении микрофлоры участка определенной площади готовят смешанные образцы почвы, отбирая пробы по диагонали участка на определенной глубине от поверхности. Микроорганизмы в почве распространены неравномерно, поэтому важно анализировать большое число почвенных образцов. По Н. А. Красильникову, рекомендуется на участке площадью 100 м 2 анализировать три образца почвы, каждый из которых состоит из трех проб.
Почвенные образцы берут в стерильные пергаментные пакеты или стеклянные банки, закрытые ватно-марлевыми пробками. Для отбора почвенных образцов удобно использовать металлические совки, садовые ножи или небольшие лопаты, иногда почвенный бур.
Оборудование протирают ватным тампоном, смоченным спиртом, и обжигают на пламени. Для количественного учета почвенных микроорганизмов и грубого качественного анализа допустимо совки и ножи обтирать многократным втыканием их в исследуемый почвенный горизонт.
Каждый образец почвы сопровождают этикеткой, где указывают дату взятия образца, район участка и горизонт.
Для взятия пробы почвы стерильным ножом снимают верхний слой почвы (1,5—2,0 см), который может быть загрязнен посторонней микрофлорой. Далее совком или лопатой берут 100—200 г почвы и насыпают в пакет или банку.
При изучении микроорганизмов пахотных почв образцы берут на всю глубину пахотного слоя. При изучении микроорганизмов на разной глубине пробы почвы берут по генетическим горизонтам из почвенного разреза. В горизонте делают нишу и из нее извлекают почвенную пробу, начиная с нижнего горизонта к верхнему.
Почвенные образцы желательно анализировать в тот же день, так как количество микроорганизмов в них может изменяться. Если почвенные образцы невозможно проанализировать в тот же день, рекомендуется высушить образцы почвы при 30°С. Однако следует иметь в виду, что в сухих образцах численность микроорганизмов резко падает и соотношение отдельных физиологических групп микроорганизмов значительно меняется.
Работа 7. Выделение и количественный учет микроорганизмов почвы на твердых питательных средах
Общее количество микроорганизмов в почве свидетельствует об интенсивности биохимических процессов, протекающих в почве и определяющих накопление элементов корневого питания растений. Количество микроорганизмов в почве определяют методом посева почвенной суспензии на питательные среды либо прямым микроскопическим счетом клеток на препаратах.
Метод посева почвенной суспензии на твердые питательные среды (МПА, КАА, среду Эшби, среду Чапека) позволяет учесть общее количество микроорганизмов и получить на пластинке с агаром изолированные колонии для выделения микроорганизмов в чистую культуру.
Микроорганизмы, выделенные в чистую культуру, в дальнейшем могут быть всесторонне изучены и идентифицированы. В этом прежде всего заключается ценность этого метода. Однако в лабораторной практике микробиологии нет универсальной питательной среды, на которой развивались бы все почвенные микроорганизмы. Даже применение наиболее универсальных питательных сред позволяет учесть лишь незначительную часть микронаселения почвы (0,1—1,0%).
Сущность метода заключается в нанесении почвенной суспензии микроорганизмов на поверхность твердой питательной среды. Количество микроорганизмов определяют по числу развившихся колоний, учитывая, что одна микробная клетка дает начало одной колонии. Таким образом, метод позволяет учесть лишь микроорганизмы, способные развиться на данной питательной среде, результаты же общей численности микроорганизмов получаются заниженные.
Материалы и оборудование
Весы, разновесы, часовое стекло, скальпель, ступка, резиновая перчатка, колба со стерильной дистиллированной водой, пипетки на 10 мл и 1 мл, микропипетки на 0,1 мл, пробирки, колба объемом 250 мл, колба с питательной средой, чашки Петри, стеклянные шпатели.
Ход работы
Приготовление почвенной суспензии Для приготовления разведений почвенной суспензий готовят ряд пробирок с 9 мл стерильной дистиллированной воды, колбу, содержащую 90 мл стерильной воды, и вторую колбу, стерильную, сухую, объемом 250 мл.
Для диспергирования почвенных агрегатов и десорбции клеток микроорганизмов с поверхности почвенных частиц почву обрабатывают ультразвуком (установка УЗДН-1, 15 кГц,0,ЗА), растирают или встряхивают на пропеллерной мешалке. Такая предварительная обработка почвы позволяет учесть значительно большее количество микроорганизмов (Мишустин, 1975). Наиболее доступным приемом предварительной обработки почвы, дающим хорошие результаты, считается растирание почвенного образца.
Исследуемую почву высыпают на стерильное стекло. Стекло заранее протирают спиртом и обжигают на пламени. Почву тщательно перемешивают шпателем, удаляя механические частицы и корни растений. Соблюдая стерильность, на часовом стекле отвешивают 10 г. почвы и переносят ее в стерильную ступку.
Навеску почвы в ступке увлажняют до пастообразного состояния, добавляя 2—3 мл воды из первой колбы, содержащей 90 мл стерильной воды, и растирают 5 мин пальцем в резиновой перчатке. После растирания почву из ступки переносят с помощью воды во вторую сухую колбу, получают первое разведение - 1/10.
Почвенную суспензию в колбе встряхивают в течение 5 мин, дают отстояться 30 с и далее стерильной пипеткой переносят 1 мл почвенной суспензии из колбы в пробирку ¹ 1 с 9 мл стерильной дистиллированной воды, получают второе разведение—1/100. Подобным образом готовят ряд последующих разведений почвенной суспензии—1/1000, 1/10000, 1/100000 и более в зависимости от предполагаемой численности микроорганизмов, учитывая тип почвы, генетический горизонт, сезон года,
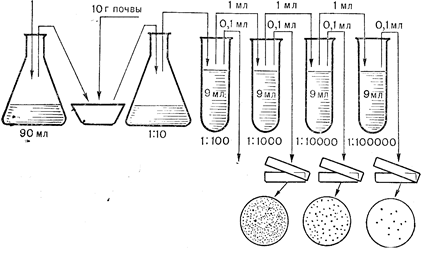
350 колоний 70 колоний 12колоний
Рис. 17. Схема приготовления разведений и высева почвенной суспензии на твердые питательные среды.
влажность почвенной пробы и т.д. Для приготовления каждого нового разведения почвенной суспензии следует пользоваться новой стерильной пипеткой (рис. 17).
Посев. Для выделения и количественного учета бактерий почвенную суспензию высевают на одну из питательных сред МПА, КАА, почвенный агар, среду Эшби; для учета актиномицетов используют КАА или среду Чапека; для выделения и количественного учета грибов и дрожжей применяют СА или модифицированную среду Чапека.
Питательную среду, расплавленную на водяной бане, соблюдая стерильность, разливают в чашки Петри слоем 0,5—0,8 см. Для высева на каждое разведение почвенной суспензии готовят по 3—5 чашек Петри. После застывания среды для удаления капель воды с крышек и появления муаровой поверхности на агаре чашки Петри подсушивают в термостате при температуре 60—70°С. На крышке чашки Петри пишут этикетку, указывая номер почвенной пробы, дату посева, разведение и повторность.
Для выделения почвенных микроорганизмов обычно проводят поверхностный посев почвенной суспензии на питательную среду. Предварительно до посева отбирают пипетки на 1 мл с одинаковым числом капель жидкости, так как размер капель из разных пипеток может отличаться, что приведет к ошибке в подсчете микроорганизмов. На каждое новое разведение почвенной суспензии следует приготовить новую стерильную пипетку и новый стерильный шпатель.
Стерильной пипеткой на 1 мл наносят каплю почвенной суспензии из соответствующего разведения по центру питательной среды в чашке Петри и тщательно растирают ее стеклянным шпателем по всей поверхности агаровой пластинки. Для посева почвенной суспензии удобно пользоваться микропипетками на 0,1—0,2 мл. Засеянные чашки Петри переворачивают средой вверх и помещают в термостат при температуре 28—30°С.
Колонии бактерий на чашках Петри подсчитывают через 3—5 суток, грибов и дрожжей—через 5—7, актиномицетов— через 7—15. Наиболее точный результат получается при развитии на чашке Петри 50—200 колоний бактерий и актиномицетов и 30—50 колоний грибов. Следует иметь в виду, что при очень большом и очень малом количестве колоний на чашках Петри могут быть значительные ошибки при подсчете микроорганизмов. Обычно почвенную суспензию высевают из 3—4 последовательных разведений на 3—5 чашек Петри из каждого разведения. Для учета грибов почвенную суспензию высевают из разведений на 1—2 порядка ниже, чем для учета бактерий и актиномицетов.
Подсчет колоний микроорганизмов на чашках Петри Для удобства подсчета колоний микроорганизмов дно чашки Петри разделяют тушью или чернильной пастой на секторы или сегменты. Если питательная среда прозрачна, колонии подсчитывают в проходящем свете со дна чашки; в случае непрозрачной питательной среды колонии микроорганизмов подсчитывают непосредственно с поверхности агара. Учтенные колонии отмечают точками на стекле. Для подсчета мелких колоний пользуются ручной лупой. Чашки Петри, в которых развилась масса колоний микроорганизмов, обрабатывают специальным прибором для счета микробных колоний, выпускаемым медицинской промышленностью СССР.
Подсчитав число колоний микроорганизмов, развившихся на чашках Петри по всем повторностям соответствующего разведения, определяют средние число колоний на чашке и далее пересчитывают количество микроорганизмов на 1 г. воздушно-сухой почвы по формуле:
где а— число клеток микроорганизмов в 1 г. воздушно-сухой почвы, б—среднее число колоний микроорганизмов на чашке Петри, в—соответствующее разведение, г—количество капель в 1 мл жидкости в пипетке, д—навеска почвы, взятой для анализа.
Для большей точности учета численности микроорганизмов параллельно микробиологическому анализу определяют процент влажности почвенной пробы и окончательное количество микроорганизмов рассчитывают на 1 г абсолютно сухой почвы.
Работа 8. Количественный учет микроорганизмов почвы методом предельных разведений на жидких питательных средах
Метод предельных разведений обычно используют при групповом анализе почвенных микроорганизмов для количественного определения аммонификаторов, нитрификаторов, денитрификаторов, клетчаткоразрушающих бактерий и др. Данный метод требует особо тщательного соблюдения правил стерильности как при приготовлении разведений почвенной суспензии, так и при посеве суспензии на питательные среды, так как каждая случайно занесенная клетка может привести сразу к значительной ошибке в численности микроорганизмов.
Весы, разновесы, часовое стекло, скальпель, ступка, резиновая перчатка, колба со стерильной дистиллированной водой, пипетки на 10 мл и 1 мл, пробирки, две колбы объемом 250 мл, питательная среда.
Для количественного учета микроорганизмов методом предельных разведений на жидких питательных средах навеску исследуемой почвы подвергают растиранию в ступке, а затем готовят ряд последовательных разведений почвенной суспензии точно так же, как при посеве на твердые питательные среды (см. работу 23).
Приготовленную почвенную суспензию высевают в пробирки или колбы с питательной средой, соответствующей данной физиологической группе микроорганизмов. Так, для количественного учета аммонификаторов обычно пользуются пептонной водой, учета нитрификаторов—средой Виноградского, учета денитрификаторов—средой Гильтэя, учета клетчаткоразрушающих аэробов—средой Гетчинсона, учета клетчаткоразрушающих анаэробов—средой Имшенецкого, для учета маслянокислых бактерий—средой Виноградского. Состав и приготовление питательных сред приведены в работах при изучении микроорганизмов отдельных физиологических групп.
Для учета микроорганизмов, характеризующихся высокой численностью (аммонификаторы, денитрификаторы, маслянокислые бактерии), почвенную суспензию рекомендуется высевать из разведений 1/1000 и выше; для учета микроорганизмов, сравнительно мало распространенных (нитрификаторы, клетчаткоразрушающие бактерии), посев почвенной суспензии проводят из первых 2—4 разведений—1/10, 1/100, 1/1000, 1/10000. В каждую пробирку или колбу с питательной средой стерильной пипеткой высевают по 1 мл почвенной суспензии из соответствующего разведения. Суспензией каждого разведения засевают 3—5 пробирок или колб.
Засеянные пробирки или колбы помещают в термостат для инкубации при температуре, оптимальной для данной физиологической группы микроорганизмов.
Количество микроорганизмов, развившихся на питательных средах, определяют по таблице Мак-Креди, составленной на основании методов вариационной статистики.
Для определения числа микроорганизмов в засеянных пробирках или колбах составляют так называемую числовую характеристику. Она состоит из трех цифр. Первая цифра соответствует числу пробирок последнего разведения, в котором еще обнаруживается рост микроорганизмов в пробирках всех повторностей. Следующие две цифры обозначают число пробирок с ростом микроорганизмов в двух последующих разведениях. Если рост микроорганизмов обнаружен более чем в двух последующих разведениях, число этих пробирок прибавляют к последней цифре.
По трехзначной числовой характеристике в таблице Мак-Креди находят вероятное число микроорганизмов в 1 мл разведения, принятого за первую цифру числовой характеристики. Умножив это вероятное число микроорганизмов на соответствующее разведение, получают количество клеток микроорганизмов в 1 г. исследуемой почвы. Для большей точности получаемых результатов содержание клеток микроорганизмов пересчитывают на 1 г. абсолютно сухой почвы, учитывая процент влажности почвы.
Числовая характеристика — 321.
Вероятное число микроорганизмов по таблице Мак-Креди — 15,0.
Число микроорганизмов в 1 г. воздушно-сухой почвы: 15´100 = 1500.
Числовая характеристика — 502
Вероятное число микроорганизмов по таблице Мак-Креди — 4,0.
Число микроорганизмов в 1 г. воздушно-сухой почвы: 4 ´ 1000 =4000.
Приводим таблицу Мак-Креди для быстрой обработки результатов учета микробов по методу предельных разведений
Наиболее вероятное число микробов при заражении сред в параллельных пробирках
Рост и размножение бактерий. Фазы размножения популяций бактерий в живой питательной среде в стационарных условиях.
Жизнедеятельность бактерий характеризуется ростом — формированием структурно-функциональных компонентов клетки и увеличением самой бактериальной клетки, а также размножением — самовоспроизведением, приводящим к увеличению количества бактериальных клеток в популяции.
Бактерии размножаются путем бинарного деления пополам, реже путем почкования. Актиномицеты, как и грибы, могут размножаться спорами. Актиномицеты, являясь ветвящимися бактериями, размножаются путем фрагментации нитевидных клеток. Грамположительные бактерии делятся путем врастания синтезирующихся перегородок деления внутрь клетки, а грамотрицательные — путем перетяжки, в результате образования гантелевид-ных фигур, из которых образуются две одинаковые клетки.
Делению клеток предшествует репликация бактериальной хромосомы по полуконсервативному типу (двуспиральная цепь ДНК раскрывается и каждая нить достраивается комплементарной нитью), приводящая к удвоению молекул ДНК бактериального ядра — нуклеоида.
Репликация ДНК происходит в три этапа: инициация, элонгация, или рост цепи, и терминация.
Размножение бактерий в жидкой питательной среде.Бактерии, засеянные в определенный, не изменяющийся объем питательной среды, размножаясь, потребляют питательные элементы, что приводит в дальнейшем к истощению питательной среды и прекращению роста бактерий. Культивирование бактерий в такой системе называют периодическим культивированием, а культуру — периодической. Если же условия культивирования поддерживаются путем непрерывной подачи свежей питательной среды и оттока такого же объема культуральной жидкости, то такое культивирование называется непрерывным, а культура — непрерывной.
При выращивании бактерий на жидкой питательной среде наблюдается придонный, диффузный или поверхностный (в виде пленки) рост культуры. Рост периодической культуры бактерий, выращиваемых на жидкой питательной среде, подразделяют на несколько фаз, или периодов:
1.лаг-фаза;
2.фаза логарифмического роста;
3.фаза стационарного роста, или максимальной концентрации
4.фаза гибели бактерий.
Эти фазы можно изобразить графически в виде отрезков кривой размножения бактерий, отражающей зависимость логарифма числа живых клеток от времени их культивирования.
Лаг-фаза — период между посевом бактерий и началом размножения. Продолжительность лаг-фазы в среднем 4—5 ч. Бактерии при этом увеличиваются в размерах и готовятся к делению; нарастает количество нуклеиновых кислот, белка и других компонентов.
Фаза логарифмического (экспоненциального) роста является периодом интенсивного деления бактерий. Продолжительность ее около 5— 6 ч. При оптимальных условиях роста бактерии могут делиться каждые 20—40 мин. Во время этой фазы бактерии наиболее ранимы, что объясняется высокой чувствительностью компонентов метаболизма интенсивно растущей клетки к ингибиторам синтеза белка, нуклеиновых кислот и др.
Затем наступает фаза стационарного роста, при которой количество жизнеспособных клеток остается без изменений, составляя максимальный уровень (М-концентрация). Ее продолжительность выражается в часах и колеблется в зависимости от вида бактерий, их особенностей и культивирования.
Завершает процесс роста бактерий фаза гибели, характеризующаяся отмиранием бактерий в условиях истощения источников питательной среды и накопления в ней продуктов метаболизма бактерий. Продолжительность ее колеблется от 10 ч до нескольких недель. Интенсивность роста и размножения бактерий зависит от многих факторов, в том числе оптимального состава питательной среды, окислительно-восстановительного потенциала, рН, температуры и др.
Размножение бактерий на плотной питательной среде.Бактерии, растущие на плотных питательных средах, образуют изолированные колонии округлой формы с ровными или неровными краями (S- и R-формы), различной консистенции и цвета, зависящего от пигмента бактерий.
Пигменты, растворимые в воде, диффундируют в питательную среду и окрашивают её. Другая группа пигментов нерастворима в воде, но растворима в органических растворителях. И, наконец, существуют пигменты, не растворимые ни в воде, ни в органических соединениях.
Наиболее распространены среди микроорганизмов такие пигменты, как каротины, ксантофиллы и меланины. Меланины являются нерастворимыми пигментами черного, коричневого или красного цвета, синтезирующимися из фенольных соединений. Меланины наряду с каталазой, супероксидцисмутазой и пероксидазами защищают микроорганизмы от воздействия токсичных перекисных радикалов кислорода. Многие пигменты обладают антимикробным, антибиотикоподобным действием.
Читайте также:
