Постхолецистэктомический синдром. Повторные операции на желчных путях
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Что такое Дисфункция сфинктера Одди (постхолецистэктомический синдром) -
Выделяют 3 группы патологических состояний органов пищеварительной системы у больных после холецистэктомии:
I. Функциональные расстройства сфинктера Одди (вследствие потери функционирующего желчного пузыря). II. Билиарная гипертензия с наличием органического препятствия току желчи:
- Холедохолитиаз:
- рецидивный (5-20 %),
- резидуальный (5-10 %).
Сопутствующие заболевания пищеварительного тракта, имеющиеся до холецистэктомии или развившиеся после нее:
- хронический панкреатит (60-65 %);
- язвенная болезнь желудка и двенадцатиперстной кишки (30-40 %);
- грыжи пищеводного отверстия диафрагмы (45-50 %),
- активный гастродуоденит (35-45 %);
- дискинезия тонкой и/или толстой кишки (40-80 %).
Согласно Римскому консенсусу по функциональным расстройствам органов пищеварения, вместо терминов "постхолецистэктомический синдром (ПХЭС)", "билиарная дискинезия" в качестве диагноза рекомендуется использовать термин "дисфункция сфинктера Одди (ДСО)".
Определение. Под термином ПХЭС (ДСО) понимают развившуюся после оперативного лечения дисфункцию сфинктера Одди, обусловленную нарушением сократительной функции сфинктера общего желчного протока, тонуса панкреатического протока или общего сфинктеРа, что препятствует нормальному оттоку желчи и панкреатического секрета в двенадцатиперстную кишку при отсутствии в нем органических препятствий
Распространенность. ПХЭС (ДСО) встречается у 1030 % пациентов после удаления желчного пузыря и характеризуется болью, сходной с билиарной, у больных после перенесенной холецистэктомии.
Что провоцирует / Причины Дисфункции сфинктера Одди (постхолецистэктомического синдрома):
Существует несколько причин ДСО. изменение состава желчи, нарушение ее пассажа, дискинезия сфинктера печеночноподжелудочной ампулы; избыточный бактериальный рост в кишечнике, качество оперативного вмешательства и др. Нарушения функции сфинктера могут быть связаны с наличием дискинезий (преимущественно спазм) или сочетаться со структурными нарушениями, в частности со стенозом.
Известно, что удаление пузыря по поводу ЖКБ не избавляет больного от обменных нарушений, в том числе от печеночноклеточной дисхолии. Установлено, что в слизистой оболочке пузыря и пузырного протока вырабатывается холецистокинин, тормозящий сокращение желчного пузыря и способствующий повышению тонуса сфинктера Одди. В норме при наполнении желчного пузыря происходит рефлекторное расслабление сфинктера Одди. Многочисленными исследованиями доказано уменьшение реакции СО на холецистокинин после холецистэктомии. Холецистэктомия может предрасполагать к гипертонусу сфинктера Одди, расширению вне и внутрипеченочных желчных протоков. В ряде случаев после операции возможно снижение тонуса сфинктера Одди и поступление в кишечник, вне зависимости от фазы пищеварения, недостаточно концентрированной желчи. Данное обстоятельство может способствовать инфицированию желчи и развитию в желчных протоках воспалительного процесса. В норме желчный пузырь посредством гормоноподобного вещества активизирует панкреатическую липазу. При удалении пузыря нарушается его регулирующее влияние на деятельность поджелудочной железы, что проявляется относительной липазной недостаточностью и в конечном итоге - нарушением процесса пищеварения. Таким образом, после холецистэктомии наблюдается выключение физиологической роли желчного пузыря, что проявляется нарушением пассажа желчи и расстройством процессов пищеварения.
Патогенез (что происходит?) во время Дисфункции сфинктера Одди (постхолецистэктомического синдрома):
Анализируя характер функциональных нарушений, необходимо остановиться на особенностях анатомического строения сфинктера Одди. Он включает:
- сложную мышцу сосочка двенадцатиперстной кишки, состоящую из: а) мышцысжимателя основания сосочка,
- мышцыдилататора соска;
- мышцысжимателя соска, или сфинктера Вестфаля;
- собственный сфинктер общего желчного протока;
- собственный сфинктер протока поджелудочной железы.
Симптомы Дисфункции сфинктера Одди (постхолецистэктомического синдрома):
Особенности клинических проявлений. Основными признаками дисфункции сфинктера Одди являются боль в правом верхнем квадранте брюшной полости, диспепсические симптомы. Клинические проявления зависят от вовлечения в процесс структуры сфинктера При изолированной дисфункции сфинктера холедоха вовлекаются желчные протоки (билиарный тип), при нарушении функции сфинктера панкреатического протока - панкреатические (панкреатический тип), а при патологии общего сфинктера - сочетанные билиарнопанкреатические боли (сочетанный тип). При дисфункции сфинктера по билиарному типу болевой синдром локализуется в эпигастрии или правом подреберье с иррадиацией в спину, правую лопатку. Панкреатический тип характеризуется болью в левом подреберье с иррадиацией в спину, уменьшающейся при наклоне туловища вперед, при этом отсутствуют очевидные причины приступа (конкременты, алкоголь). Сочетанному типу свойственна боль опоясывающего характера. Для дисфункции сфинктера Одди характерны рецидивирующие приступы сильных или умеренных болей продолжительностью более 20 мин, возникающих после приема пищи или в ночные часы и сопровождающихся тошнотой или рвотой. Боли повторяются в течение 3 и более мес.
О дисфункции сфинктера Одди у больных, перенесших холецистэктомию, можно предположить при наличии болевого синдрома в эпигастрии в случаях, если не выявляются другие причины, способные объяснить их происхождение (сопутствующие заболевания, структурные изменения билиарных и панкреатических протоков); при наличии идиопатического рецидивирующего панкреатита, рецидивирующих билиарных коликах у больных с наличием неизмененного желчного пузыря и холедоха.
У ряда лиц после холецистэктомии возникают симптомы, свидетельствующие о нарушении процесса пищеварения и моторных расстройствах тонкой или толстой кишки.
Ведущие патогенетические факторы формирования клинических симптомов у больных после холецистэктомии, основными из которых являются:
- синдром раздраженного кишечника с наличием гипо или гипермоторной или спастической дискинезии;
- воспалительные процессы слизистой оболочки кишечника (дуоденит, энтерит, колит) в сочетании с моторными нарушениями.
Диагностика Дисфункции сфинктера Одди (постхолецистэктомического синдрома):
Особенности диагностики. Для исключения органической патологии оилиарной системы используют ряд скрининговых и уточняющих методов. К непрямым методам, позволяющим предположить дисфункцию сфинктера Одди, относят исследование в крови содержания билирубина, активности щелочной фосфатазы, аминотрансфераз, амилазы и липазы, проводимое во время или не позже 6 ч после окончания болевого приступа, а также в динамике. Дисфункция сфинктера подтверждается транзиторным их повышением в 2 раза и более или не менее чем при двух последовательных болевых приступах. Большое значение в диагностике дисфункции имеет провокационный морфинопростигминовый тест. Расширение холедоха и главного панкреатического протока, свидетельствующее о нарушении тока желчи и панкреатического сока на уровне сфинктера Одди, определяется при проведений УЗИ органов брюшной полости. Вместе с тем необходимо погнить, что у 34 % лиц, перенесших холецистэктомию, при отсутствии клинической симптоматики имеется расширение общего желчного протока. В диагностике дисфункции сфинктера Одди используется динамическое УЗИ диаметра общего желчного протока с применением жирных завтраков, стимулирующих выработку эндогенного холецистокинина и увеличивающих холерез. При этом после пробного завтрака измерение холедоха проводится в течение 1 ч каждые 15 мин. Увеличение его диаметра на 2 мм и более может свидетельствовать о наличии неполной обтурации холедоха в результате дисфункции сфинктера Одди или органической патологии билиарной системы.
Изменение диаметра панкреатических протоков определяется при проведении пробы с секретином. У здорового человека после введения 1 мг/кг секретина при УЗИ в течение 30 мин отмечается расширение панкреатического протока с последующим его уменьшением до исходного уровня. Расширение протока в течение более чем 30 мин указывает на нарушение его проходимости. Важным в диагностике дисфункции сфинктера является компьютерная томография гепатодуоденального отдела ЖКТ. К инвазивным непрямым методам оценки функции сфинктера Одди относится эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ). Косвенными признаками повышения его тонуса являются увеличение диаметра холедоха более 12 мм и задержка контраста в холедохе свыше 45 мин. На дисфункцию сфинктера главного панкреатического протока указывает его расширение более 5 мм, а также замедление эвакуации контраста из протока.
Прямым методом, подтверждающим дисфункцию сфинктера, является манометрия. При проведении манометрии возможно раздельное канюлирование холедоха и вирсунгова протока с манометрией их сфинктеров. Это дает возможность выделить соответствующий тип расстройств, установить причину рецидивирующих панкреатитов после холецистэктомии и папиллотомии.
В то же время манометрическое исследование сфинктера Одди доступно не всем медицинским учреждениям, где проводится ЭРХПГ. Это стимулирует интерес к использованию неинвазивных методов исследования функции сфинктера Одди.
Для исключения органической патологии сфинктера Одди используется проба с гладкомышечным релаксантом. На наличие функциональных расстройств указывает снижение базального давления после введения релаксантов. В то же время манометрия сфинктера не всегда является информативной, что послужило поводом для разработки критериев, учитывающихся при выборе тактики лечения данного состояния.
Признаки дисфункции сфинктера Одди
- Классический приступ билиарных или панкреатических болей
- Изменение активности печеночных и/или панкреатических ферментов (двукратное увеличение)
- Замедление выведения контрастного вещества из холедоха при ЭРХПГ (более 45 мин)
- Расширение холедоха (более 12 мм) или главного панкреатического протока
Выделяют несколько вариантов дисфункции сфинктера Одди, что необходимо учитывать при выборе тактики ведения указанной категории больных.
При панкреатическом типе большое значение отводится двукратному повышению в сыворотке крови активности панкреатических ферментов в период двух последовательных приступов болей, а также расширению панкреатического протока более 5 мм.
Больным с первым вариантом дисфункции сфинктера Одди и высокой вероятностью развития стеноза (более 70 %) показана эндоскопическая сфинктеротомия без предварительного манометрического исследования, что способствует уменьшению частоты осложнений.
Больным со вторым вариантом показана медикаментозная терапия. При отсутствии эффекта необходимо проведение манометрического исследования.
У лиц с признаками дисфункции сфинктера Одди при третьем варианте причины болевого синдрома чаще обусловлены его дискинезией Манометрическое исследование сфинктера в данном случае не показано.
В диагностике патологии кишечника используются рентгенологическое исследование желудка, двенадцатиперстной и тонкой кишки, эндоскопическое исследование ЖКТ со взятием биоисийного материала слизистых.
Для подтверждения избыточного бактериального роста в кишечнике используются аспирация и посев содержимого кишечника, кала, исследование концентрации ионов водорода в выделяемом натощак воздухе, проведение дыхательных тестов с лактулозой или глюкозой. Наиболее простым и информативным тестом служит улучшение состояния больного после антибактериальной терапии.
Лечение Дисфункции сфинктера Одди (постхолецистэктомического синдрома):
Лечение ДСО. Терапия больных с дисфункцией сфинктера Одди направлена на нормализацию поступления желчи и панкреатического секрета из желчных и панкреатических протоков в двенадцатиперстную кишку путем коррекции химического состава желчи, проходимости сфинктера Одди, микроэкологии кишечника, моторики тонкой кишки и процессов пищеварения.
Лечение включает в себя:
- расширение режима;
- диетотерапию;
- фармакотерапию.
Существенное место в лечении занимает диетотерапия. Основным принципом диеты является питание с частыми приемами небольших порций пищи (4х разовое питание) с последним приемом непосредственно перед сном, что способствует регулярному опорожнению желчных путей, устранению застоя желчи. Необходимы ограничение (но не полное исключение) продуктов, содержащих холестерин (жиры животного происхождения), жирные кислоты (жиры, прошедшие термическую обработку свыше 100 °С, жареные продукты), медленное снижение массы тела, добавление в пищевой рацион пищевых волокон в виде продуктов растительного происхождения или пищевых добавок (отруби). Овощи и фрукты лучше использовать после термической обработки. Необходимо стремиться к обеспечению ежедневного эффективного стула.
Для снятия спазма сфинктера Одди используются препараты, обладающие спазмолитическим эффектом. Препаратом выбора является дюспаталин по 200 мг 2 раза в день утром и вечером в течение 24 нед. Его антиспастическое действие обусловлено снижением проницаемости клеток гладкой мускулатуры для катионов натрия и замедлением процесса деполяризации, уменьшением оттока катионов калия, что предотвращает развитие гипотонии. У больных с ДСО монотерапия данным препаратом нормализует работу сфинктера Одди, приводит к снижению интенсивности или исчезновению болей, а также уменьшению явлений диспепсии.
Для лиц после холецистэктомии, с целью нормализации оттока желчи, наряду с проходимостью сфинктера Одди, важное значение имеет уровень давления в двенадцатиперстной кишке. В случае, если уровень давления превышает секреторное давление желчи и панкреатического сока, последние будут депонироваться в желчных и панкреатических протоках с соответствующими последствиями. Основным механизмом развития дуоденальной гипертензии является избыточное содержание жидкости и газа в результате бродильногнилостных процессов, обусловленных микробной контаминацией в просвете двенадцатиперстной кишки.
С целью деконтаминации двенадцатиперстной кишки проводятся один или два курса антибактериальной терапии со сменой препаратов. Антибактериальные препараты подбирают, как правило, эмпирически.
Препаратами выбора являются:
- тетрациклин 0,25 г 4 раза в день; доксициклин 0,1 г 2 раза в день;
- ципрофлоксацин 0,25 г 2 раза в день, цефалексин 0,25 г 4 раза в день;
- бисептол 0,960 г 2 раза в день;
- фуразолидон 0,1 г 3 раза в день;
- метронидазол 0,5 г 2 раза в день;
- энтерол 24 капе, в сутки, бактисубтил 12 капе. 34 раза в день.
После антибактериальной терапии показаны пробиотики, содержащие нормальные штаммы кишечной флоры, - бифиформ по 1 капе. 2 раза в День в течение 2 нед; пребиотики, способствующие росту нормальной флоры, - хилакфорте 60 кап. 3 раза в день в течение 1 нед, затем По 30 кап. 3 раза в день в течение 2 нед.
При наличии запоров принимают дюфалак по 12 ст. л. 1 раз в день для нормализации стула. В пребиотической дозе препарат оказывает избирательное действие на рост бифидо и лактобактерий.
Используют алюминийсодержащие антациды (алюгастрин, алюмаг маалокс, фосфалюгель, смекта и др.) по 1 дозе через 1 ч после еды и перед сном в течение 57 дней. Ферментные препараты: креон, панцитрат мезимфорте и др. - назначают во время еды на протяжении 10 дней и более.
Известно, что удаление желчного пузыря по поводу ЖКБ не избавляет больного от обменных нарушений, в том числе от печеночноклеточной дисхолии, определяющей литогенность желчи, в связи с чем целесообразно использование препаратов урсо и хенодезоксихолевой кислот на ночь.
При вовлечении в патологический процесс печени показаны гептрал, гепатофальк, LIV52 и др.
Отсутствие эффективности проводимых терапевтических мероприятий служит показанием к повторному оперативному вмешательству. Абсолютными показаниями к оперативному лечению являются:
- стеноз сфинктера Одди;
- рецидивирующие панкреатиты;
- отсутствие эффекта от консервативной терапии ДСО.
Прогноз постхолецистэктомического синдрома благоприятен. При соблюдении правильной диеты, режима, проведения соответствующей медикаментозной терапии клинические проявления исчезают.
К каким докторам следует обращаться если у Вас Дисфункция сфинктера Одди (постхолецистэктомический синдром):
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Дисфункции сфинктера Одди (постхолецистэктомического синдрома), ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Постхолецистэктомический синдром
Постхолецистэктомический синдром - специфический симптомокомплекс, обусловленный перенесенной холецистэктомией и связанными с этим изменениями функционирования желчевыделительной системы. К проявлениям постхолецистэктомического синдрома относятся рецидивирующие болевые приступы, диспепсические расстройства, диарея и стеаторея, гиповитаминоз, снижение массы тела. Для выявления причин синдрома проводится УЗИ и МСКТ брюшной полости, фиброгастродуоденоскопия, РХПГ. Лечение постхолецистэктомического синдрома может быть консервативным (щадящая диета, прием спазмолитиков и ферментов) и хирургическим (дренирование желчных протоков, эндоскопическая сфинктеропластика и др.).
МКБ-10
Общие сведения
Постхолецистэктомический синдром - это комплекс клинических симптомов, развивающийся вследствие оперативного удаления желчного пузыря. В группу пациентов с постхолецистэктомическим синдромом не входят больные, у которых проведена холецистэктомия с погрешностями, остались камни в желчных протоках, развился послеоперационный панкреатит, сопровождающийся сдавлением общего желчного протока, холангит.
Постхолецистэктомический синдром встречается в среднем у 10-15% пациентов (при этом в разных группах этот показатель доходит до 30%). У мужчин он развивается практически в два раза реже, чем у женщин. Постхолецистэктомический синдром может развиться сразу после проведения оперативного удаления желчного пузыря, а может проявиться спустя длительное время (несколько месяцев, лет).
Причины
Основным патогенетическим фактором развития постхолецистэктомического синдрома является нарушение в билиарной системе - патологическая циркуляция желчи. После удаления желчного пузыря, являющегося резервуаром для вырабатываемой печенью желчи и участвующего в своевременном достаточном ее выделении в двенадцатиперстную кишку, привычный ток желчи изменяется. В некоторых случаях нормальное снабжение кишечника желчью не удается обеспечить. Окончательный механизм этих нарушений еще недостаточно изучен.
Факторами, способствующими развитию постхолецистэктомического синдрома, могут быть имеющие место дискинезии желчевыводящих путей, спазм сфинктера Одди (мышечного образования в месте впадения общего желчного протока в двенадцатиперстную кишку), оставшийся после операции пузырный проток значительной длины. Иногда причинами возникновения этого синдрома может быть выраженная послеоперационная боль и скопление жидкости в области произведенной операции. Только в 5% случаев причину развития постхолецистэктомического синдрома выявить не удается.
Симптомы постхолецистэктомического синдрома
Данный симптомокомплекс может проявляться сохранением клинических проявлений, имевших место до операции, в той или иной степени выраженности (чаще всего менее выраженных, но иногда отмечают и усиление дооперационной клиники). Иногда после холецистэктомии возникают новые симптомы.
Основной симптом - болевой. Боль может быть как режущей, так и тупой, различной степени интенсивности. Встречается приблизительно в 70% случаев. Вторым по распространенности является диспепсический синдром - тошнота (иногда рвота), вздутие и урчание в животе, отрыжка с горьким привкусом, изжога, диарея, стеаторея. Секреторные нарушения приводят к нарушению всасывания пищи в 12-перстной кишке и развитию синдрома мальабсорбции. Следствием этих процессов служат гиповитаминоз, снижение массы тела, общая слабость, ангулярный стоматит.
Также может подниматься температура тела, возникать желтуха (иногда проявляется только субиктеричностью склер). Постхолецистэктомический синдром может принимать различные клинические формы, проявляясь ложными и истинными рецидивами камнеобразования холедоха, стриктурами общего желчного протока, стенозирующим папиллитом, спаечным процессом в подпеченочном пространстве, холепанкреатитом, билиарными гастродуоденальными язвами.
Диагностика
В ряде случаев диагностирование развивающегося постхолецистэктомического синдрома бывает затруднено сглаженной, слабо выраженной клинической картиной. Для получения полноценной медицинской помощи пациенту в послеоперационном периоде и в дальнейшей жизни без желчного пузыря необходимо внимательно относиться к сигналам своего организма и однозначно сообщать об имеющихся жалобах своему врачу. Необходимо помнить, что постхолецистэктомический синдром - это состояние, требующее выявления причин его возникновения и соответствующей этиологической терапии.
Для выявления состояний, приведших к развитию постхолецистэктомического синдрома, назначают лабораторные исследования крови, чтобы обнаружить возможный воспалительный процесс, а также инструментальные методики, направленные на диагностирование патологий органов и систем, как непосредственно оказывающих влияние на работу билиарной системы, так и опосредованно действующих на общее состояние организма.
Спиральная компьютерная томография (МСКТ) и магнитно-резонансная томография (МРТ печени) максимально точно визуализирует состояние органов и сосудов брюшной полости, также информативной методикой является УЗИ брюшной полости. Эти методы могут выявить присутствие конкрементов в желчных протоках, послеоперационное воспаление желчных путей, поджелудочной железы.
При рентгенографии легких исключают заболевания легких и средостения (которые могут быть причиной болевого синдрома), рентген желудка с контрастным веществом может помочь выявить наличие язв и непроходимости в желудочно-кишечном тракте, рефлюкса.
Для исключения происхождения симптомов в результате иных заболеваний пищеварительного тракта, производят эндоскопическое исследование желудка (гастроскопия) и двенадцатиперстной кишки (фиброгастродуоденоскопия). Нарушения в циркуляции желчи выявляют с помощью радионуклеидного исследования - сцинтиграфии. При этом в организм вводится специфический маркер, который скапливается в желчи.
Одним из самых информативных методов, позволяющих изучить состояние протоков билиарной системы является РХПГ (эндоскопическая ретроградная панкреатохолангиография). В ходе этого исследования выявляются нарушения тока желчи, отмечают состояние желчных путей, протоков, ампулы Фатерова сосочка, выявляют мелкие конкременты, отмечают скорость выделения желчи. Также можно произвести манометрию сфинктера Одди и общего желчного протока.
Во время проведения РХПГ возможно осуществить некоторые лечебные мероприятия: удалить имеющиеся в протоках камни, расширить просвет желчных путей в местах сужений, произвести сфинктеротомию при стойком спазме. Однако стоит помнить, что в некоторых случаях эндоскопия желчных протоков способствует возникновению панкреатита. Для исключения патологии сердца используют ЭКГ.
Лечение постхолецистэктомического синдрома
Методы лечения постхолецистэктомического синдрома напрямую зависят от причин его развития. В том случае, если данный синдром является следствием какой-либо патологии органов пищеварения, лечение осуществляют согласно рекомендациям по терапии данной патологии.
Лечение, как правило, включает в себя щадящую диету: соблюдение режима питания - еда небольшими порциями 5-7 раз в день, пониженное суточное содержание жиров (не более 60 грамм), исключение жареных, кислых продуктов, острой и пряной пищи, продуктов, обладающих желчегонной активностью, раздражающих слизистые оболочки элементов, алкоголя. При выраженном болевом синдроме для его купирования применяют дротаверин, мебеверин. Лекарственные средства назначаются гастроэнтерологом в соответствии с принципами медикаментозного лечения основной патологии.
Хирургические методы лечения направлены на дренирование и восстановление проходимости желчных протоков. Как правило, проводится эндоскопическая сфинктеропластика. При неэффективности производят диагностическую операцию для детального изучения брюшной полости на предмет вероятных причин развития синдрома.
Профилактика и прогноз
В качестве профилактики постхолецистэктомического синдрома можно отметить меры по своевременному выявлению различных сопутствующих заболеваний, могущих послужить причиной развития нарушений циркуляции желчи: полное и тщательное комплексное обследование печени, поджелудочной железы, желчевыводящих путей, пищеварительного тракта, сосудистой системы брюшной полости при подготовке к операции.
Прогноз излечения от постхолецистэктомического синдрома связан с излечением от основного заболевания, послужившего причиной развития симптомокомплекса.
Состояние после холецистэктомии: взгляд гастроэнтеролога
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!
![Состояние после холецистэктомии: взгляд гастроэнтеролога]()
Ю.А. КУЧЕРЯВЫЙ, ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Холецистэктомия - одно из наиболее часто выполняемых хирургических вмешательств в России и мире. Жалобы на боли и диспепсию возникают как минимум у половины пациентов, перенесших такую операцию. Постхолецистэктомический синдром (ПХЭС) - полиэтиологический синдром, за которым могут стоять функциональные и органические причины. Около половины случаев боли и диспепсии после холецистэктомии связаны с органическими заболеваниями (стриктура дистального отдела холедоха, рак поджелудочной железы и желудка, острый панкреатит и др.). Остальные случаи обусловлены функциональными причинами, включая дисфункцию сфинктера Одди и функциональные нарушения моторики кишечника.Желчнокаменная болезнь (ЖКБ) в последние несколько десятилетий стала одним из самых распространенных органических заболеваний человека (10-15% в популяции взрослых), по поводу которого проводится большое количество плановых и экстренных хирургических вмешательств во всем мире [30]. Только в США ежегодно выявляется около 1 млн новых случаев ЖКБ, затраты на лечение этого заболевания превышают 6 млрд долл. в год [10]. В России ежегодно выполняется около 200 тыс. холецистэктомий в основном, лапароскопическим путем [1].
Общеизвестно, что только у 20% пациентов ЖКБ проявляется симптомами [33]. В случае симптомного течения ЖКБ хирургическое вмешательство способствует купированию симптоматики в 53,081,5% случаев [20, 29], уменьшению выраженности диспепсии и билиарной боли - в 56 и 72% случаев соответственно [6]. К сожалению, немалое число пациентов (40,4%) не отмечают облегчения после холецистэктомии [22]. Ориентируясь на результаты крупных исследований, можно заключить, что симптомы боли и диспепсии после холецистэктомии персистируют с большой вариабельностью частот (от 5,6 до 57,3%) [15, 23, 26, 37, 38]. Подобный разброс частот персистирования постхолецистэктомических жалоб главным образом зависит от дизайна исследования. Что интересно, особенно в аспекте частого бессимптомного течения ЖКБ, достаточно часто жалобы со стороны желудочно-кишечного тракта появляются впервые только после оперативного лечения ЖКБ (12,038,6%) [15, 23, 26, 37, 38]. Таким образом, до половины пациентов, перенесших холецистэктомию, в разные сроки от момента перенесенной операции демонстрируют жалобы на боли в животе и симптомы желудочной и кишечной диспепсии, объясняемые как органическими, так и функциональными причинами [10].
Дефиниция постхолецистэктомического синдрома (ПХЭС). «ПХЭС» является только на первый взгляд простой проблемой, сложности понимания синдрома начинаются уже с самого определения. Первые работы, так или иначе описывающие патологические состояния у больных после перенесенной холецистэктомии, появились за рубежом достаточно давно - в конце 1930-х гг. [13, 18, 26]. Наиболее знаковой является первая серия наблюдений, представленная J. Hellstrom в 1938 г., которая опиралась на данные K.K. Nygaard и насчитывала 141 пациента. Так, 30% из включенных в серию наблюдений больных после удаления желчного пузыря имели абдоминальные боли спастического типа, аналогичные тем, что были до хирургического вмешательства. Только у 9 пациентов удалось выявить холедохолитиаз, еще реже был диагностирован острый панкреатит. Причины болей в остальных случаях авторам объяснить не удалось, а выявленные боли автор назвал «постхолецистэктомической коликой» [18]. Следующая крупнейшая серия наблюдений была представлена H. Doubilet только устным докладом на заседании Хирургической секции Нью-Йоркской академии медицины в апреле 1943 г. [11], что было подробно представлено в последующем обзоре R. Colp [9]. Серия насчитывала 253 пациента, перенесших холецистэктомию и наблюдавшихся в сроки от 1 до 7 лет.
Автор сообщает, что 40% наблюдаемых больных характеризовались послеоперационной симптоматикой, часто имевшей сходство с проявлениями до хирургического вмешательства. Именно в этих двух работах [9, 11] впервые встречается термин «ПХЭС», объясняющий комплекс различных расстройств после холецистэктомии, большая часть из которых ввиду отсутствия органических причин (культя пузырного протока, резидуальный холедохолитиаз и т. д.), по признанию авторов, являются функциональными, сопровождаясь рецидивными болями по типу «колик», в основе которых лежит дискинезия сфинктерного аппарата билиарного тракта, кишечника и пограничные расстройства психики у некоторых больных. Что интересно, еще тогда, в открытом наблюдательном исследовании, было отмечено, что чаще ПХЭС развивается при удалении функционирующего желчного пузыря (бескаменный холецистит, или калькулезный холецистит без выраженного фиброза стенки желчного пузыря) [9, 11]. Выявленные факты легли в основу эмпирического применения нитратов и атропина для купирования спазма, лежащего в основе ПХЭС, при отсутствии органических причин боли после холецистэктомии [9]. Ряд простых описательных исследований тех лет позволил разработать показания и обсуждать теоретические возможности папиллотомии, опираясь на экспериментальные работы начала прошлого века.
В дальнейшем термин ПХЭС закрепился в научной литературе и регулярно встречался в работах 19401970-х гг. [8, 31, 3436], число которых к середине 1970-х достигло 100. Интересно, что первая реферируемая в международных базах данных отечественная работа [4] продемонстрировала свое скептическое отношение к этому термину. Что еще более любопытно, с конца 1960-х гг. число англоязычных статей на тему ПХЭС в наиболее авторитетных журналах начинает падать практически до нуля к 1980-м гг., в то время как число работ из Восточной Европы и СССР увеличивается значительно. Уже в 1980-х гг. в авторитетных англоязычных журналах термин ПХЭС заменяют на «постхолецистэктомическую боль» [7, 32], «папиллярную дисфункцию» [5] и даже используют терминологию 1930-х гг. - «билиарная дискинезия» [21].
На сегодняшний день абсолютно понятно, что сложность изучения и верификации постхолецистэктомических расстройств, схожесть симптоматики при органических изменениях и функциональных нарушениях привели к тому, что термин «ПХЭС» в странах Запада уже к середине 1980-х гг. перестал использоваться. В международной практике унифицированного термина «ПХЭС» до сих пор нет, поскольку невероятно сложно определить точный механизм и первопричину боли и диспепсии, возникающие в разные временные отрезки после проведенной холецистэктомии. Однако, как это ни парадоксально, термин ПХЭС вошел в МКБ-10 и был чрезвычайно популярен в СССР, а в дальнейшем, вплоть до настоящего времени и в России. Широкое признание этого термина в 19701980-е гг. в СССР было неслучайно ввиду растущего роста холецистэктомий и недостаточного представления о возможных последствиях вмешательства от функциональной дезадаптации билиарного тракта и даже всей системы пищеварения до грубых органических изменений.
Сегодня под «постхолецистэктомическим синдромом» мы должны понимать множество различных заболеваний и состояний, которые возникают у больных после холецистэктомии и теоретически могут быть связаны с ней. Именно невозможность объединения органических изменений и функциональных расстройств под чертой единого диагноза привела к исчезновению термина за рубежом, где любые отклонения у пациента после холецистэктомии, теоретически связанные с ней, рассматриваются как «состояние после холецистэктомии» [19, 24]. По клиническим показаниям в группах риска и при наличии маркеров органических изменений осуществляется диагностический поиск причины, в противном случае устанавливается диагноз «дисфункция сфинктера Одди» согласно Римским критериям III пересмотра [12, 17, 27, 28].
Для объективного представления о структуре нозологий, являющихся причиной гастроинтестинальных симптомов после холецистэктомии, следует обратиться к недавним клиническим исследованиям. Так, в недавней работе, проведенной в Румынии, были обследованы пациенты с симптомами боли и диспепсии после удаления желчного пузыря. Всем пациентам проводилось исследование ряда биохимических показателей крови - билирубина, щелочной фосфатазы, а также трансабдоминальное и эндоскопическое УЗИ, ЭРХПГ и манометрия, т. е. полный объем методов, позволяющих исключить грубую органическую патологию гепатопанкреатобилиарной зоны. Авторам удалось показать, что большая часть пациентов так или иначе имела органическую патологию холедохолитиаз, культю пузырного протока. Дисфункция сфинктера Одди и большой комплекс небилиарных причин, включая синдром раздраженного кишечника (СРК), также имело достаточно большую долю [14].
В другом исследовании, проведенном в Великобритании с целью оценки частоты диареи у пациентов после холецистэктомии, было сообщено, что у 17% отмечается впервые появившаяся диарея. Как один из наиболее достоверных факторов риска развития диареи авторы приводят молодой возраст [16]. С одной стороны, именно у пациентов молодого и среднего возраста наиболее часто встречаются функциональные расстройства, включая СРК. Одной из причин вторичных функциональных нарушений со стороны кишечника после холецистэктомии является мальабсорбция желчных кислот и развитие секреторной диареи за счет избыточного и асинхронного поступления неконцентрированной желчи в просвет кишечной трубки. В основе патофизиологии секреторной диареи лежит и ускоренный пассаж содержимого по тонкой и толстой кишке, сопровождающийся гипермоторикой гладкой мускулатуры кишечника. Усиленная моторика и спазм с появлением боли - очень близкие в патофизиологическом плане состояния. Висцеральная гиперчувствительность, спазм (боль) и диарея формируют СРК-подобную симптоматику у некоторых больных после холецистэктомии. Психосоматический фон у части таких пациентов является фактором риска закрепления симптоматики.
Важно отметить еще одну работу, оценивающую качество жизни пациентов после холецистэктомии с использованием опросника Gastrointestinal Quality of Life (GQL) у 158 пациентов, которым была запланирована холецистэктомия. Помимо этого, у всех пациентов определялось и наличие критериев СРК до хирургического вмешательства. Оказалось, что у 32 пациентов имел место СРК до холецистэктомии. Контроль за этими пациентами через 6, 12 нед. и 2 года после удаления желчного пузыря показал, что оперативное лечение улучшает качество жизни пациентов средний балл увеличился значительно через 6 нед. после операции, картина сохранялась и через 3 мес. Однако через 2 года после операции авторами отмечено ухудшение качества жизни, по всей видимости, как раз за счет развития у части пациентов тех или иных отклонений, которые можно обозначить как ПХЭС. Важно, что у больных, страдавших СРК до холецистэктомии, качество жизни ухудшалось сразу после операции. Вероятно, это происходило за счет усугубления симптоматики СРК в силу описанных выше механизмов. У таких больных наличие каждого симптома Маннинга уменьшало качество жизни на 5 баллов по сравнению с основной группой (статистически достоверно). Соответствие критериям СРК по Римским критериям II уменьшало качество жизни на 12 баллов в сравнении с общей группой пациентов [19]. Таким образом, если пациент страдал СРК до оперативного вмешательства, то, весьма вероятно, этот синдром не исчезал, а сохранялся и даже, возможно, усугубляется после холецистэктомии. Именно у такого пациента с большей вероятностью можно ожидать повторные визиты к хирургу и гастроэнтерологу после операции с жалобами на симптомы боли и диспепсии, расстройства стула и ухудшение качества жизни.
Патофизиология ПХЭС. Исходя из множества органических и функциональных причин боли и диспепсии после холецистэктомии, в патофизиологии ПХЭС необходимо выделить 5 основных блоков факторов с разной патофизиологией, но рядом общих механизмов:
- боли, диспепсия и прочие симптомы, обусловленные органической патологией, связанной с ЖКБ и/или холецистэктомией (культя пузырного протока, холедохолитиаз, острый билиарный панкреатит, стриктуры холедоха и большого дуоденального сосочка и др.);
- клинические проявления другой органической патологии, теоретически не связанной с холецистэктомией (опухоли de novo органов пищеварения);
- дисфункция (спазм) сфинктера Одди, имевший место исходно или появившийся/усугубившийся после холецистэктомии (т. н. истинный ПХЭС);
- нарушение пищеварения вследствие изменения свойств и выделения желчи, получившее название «билиарная недостаточность». Пусть данный термин не является пока общепринятым, но дефицит эффектов желчи и асинхронизм ее выделения могут способствовать развитию различных патологических состояний, определяющих клиническую картину постхолецистэктомических расстройств (экзокринная панкреатическая недостаточность, дуоденогастральный рефлюкс, синдром избыточного бактериального роста в тонкой кишке и др.);
- другие функциональные нарушения органов пищеварения (СРК, функциональная диспепсия, гастроэзофагеальная рефлюксная болезнь).Итак, утрата желчного пузыря с потерей его функций и развитием вследствие этого дисфункции сфинктера Одди приводит к снижению качества и количества оттекающей желчи и панкреатического секрета в двенадцатиперстную кишку, что не всегда полноценно компенсируется работой других органов пищеварения. В связи с этим создаются реальные условия для нарушения процесса пищеварения. Отчасти патогенез ПХЭС обусловлен выпадением функций желчного пузыря - отсутствие эвакуаторной и концентрационной функций будет определять нарушение процессов липолиза в тонкой кишке, уменьшение бактерицидных свойств желчи. Непрерывное желчеистечение также будет влиять на дисфункцию пищеварения, а также на формирование билиарных рефлюксов и развитие гипертонуса сфинктера Одди.
Под влиянием измененной микрофлоры тонкой кишки желчные кислоты подвергаются преждевременной деконъюгации, что сопровождается повреждением слизистой оболочки, развитием дуоденита, рефлюкс-гастрита и эзофагита. В свою очередь дуоденит сопровождается дуоденальной гипертензией и дискинезией двенадцатиперстной кишки, что способствует персистированию патологических рефлюксов, теоретическому повышению риска развития острого и хронического панкреатита [2, 3].
Клиническая картина
Таким образом, болевой синдром после холецистэктомии, являющийся главной причиной снижения качества жизни больных после операции, исходит из многогранной патофизиологии ПХЭС, представленной выше. Основная причина болевого синдрома - функциональная перестройка сфинктерного аппарата желчных путей после холецистэктомии.
На сегодняшний день Римским консенсусом хорошо представлена клиника трех типов дисфункции сфинктера Одди: билиарный, панкреатический и смешанный тип.
При изолированной дисфункции сфинктера холедоха возникают билиарные боли, локализующиеся в эпигастральной области или правом подреберье с иррадиацией в спину, правую лопатку. При преимущественном поражении сфинктера панкреатического протока появляются панкреатические боли, локализующиеся в эпигастрии и левом подреберье, иррадирующие в поясничную область. При спазме общего сфинктера отмечаются сочетанные билиарнопанкреатические боли, часто описываемые как «опоясывающие».
Лечебная тактика
В основе подходов к лечению лежит своевременное и правильное установление причины боли и диспепсических расстройств после холецистэктомии. Первоочередная задача - исключение органической патологии ЖКТ, которая может служить причиной жалоб - холедохолитиаз, билиарные стриктуры, опухолевое поражение и прочие альтернативные причины боли. Наличие подобных изменений диктует необходимость хирургического лечения. При отсутствии органических причин для симптоматики в сочетании с рядом косвенных признаков, указывающих в пользу функционального характера болей, представленных ниже, следует думать о функциональном характере боли:
- текущие симптомы имели место и до операции и в послеоперационном периоде появились вновь, с той же или большей выраженностью;
- имеется длительное непрогрессирующее течение;
- применение психотропных препаратов до операции;
- соответствие жалоб критериям функциональных расстройств ЖКТ (дисфункция сфинктера Одди, СРК).Признание факта функциональных расстройств является показанием к консервативному лечению, которое, как правило, всегда комбинированное, и обязательно включает спазмолитические средства. Дополнительно могут назначаться средства для лечения синдрома избыточного бактериального роста, дуоденогастрального рефлюкса, панкреатические ферменты и др. Унифицированных схем фармакотерапии не существует вследствие частого сочетания различных функциональных расстройств в самых разных комбинациях, способных чередоваться во времени, наличия необязательных, но частых сопутствующих синдромов (СИБР и др.). Следует признать, что в случае доказанной дисфункции сфинктера Одди, резистентной к консервативному лечению в течение 3 мес., возможно эндоскопическое лечение (папиллотомия и стентирование).
Выбор спазмолитика осуществляется в рутинной практике эмпирическим путем, т. к. верифицировать тип моторных нарушений и провести фармакологические пробы с разными препаратами невозможно. Более того, за счет комбинации функциональных расстройств у одного больного трудно бывает разделить жалобы, обусловленные дисфункцией сфинктера Одди, СИБРом, дуоденогастральным рефлюксом, сопутствующим СРК. Поэтому выбираются средства, способные ликвидировать спазм как в билиарном тракте, так и в кишечнике.
![Постхолецистэктомический синдром]()
Постхолецистэктомический синдром (ПХЭС) - это целый комплекс симптомов, которые проявляются у человека после того, как ему провели удаление желчного пузыря. Для этого состояния характерны приступы боли, проблемы с пищеварением, диарея, понижение массы тела и др.
Согласно медицинской статистике, постхолецистэктомический синдром, код по МКБ-10 которого — K91.5, проявляется у 5-40% пациентов. Специалисты предполагают, что такое состояние является либо продолжением болезни, которая и привела к оперативному вмешательству, либо следствием операции. Как правило, удаление желчного пузыря не приводит к серьезным негативным последствиям для работы желчных путей. Около 10% случаев желчной колики являются следствием нарушений сфинктера Одди - как структурных, так и функциональных. Термин «дисфункция сфинктера Одди» также применяется вместо определения «постхолецистэктомический синдром».
О том, как может проявляться постхолецистэктомический синдром, когда происходит спазм сфинктера Одди и как правильно действовать, чтобы устранить неприятные признаки, речь пойдет в этой статье, где описаны симптомы и лечение постхолецистэктомического синдрома.
Патогенез
У основной части больных с этим синдромом отмечаются функциональные моторные расстройства. Неотъемлемая часть патогенеза желчекаменной болезни - моторные нарушения желчного пузыря и сфинктерного аппарата желчевыводящих путей.
Вследствие удаления желчного пузыря отмечается нарушение функции сфинктерного аппарата желчных путей. Развитие боли после операции, как правило, связано с увеличением давления в билиарном тракте, что связано с нарушениями функции сфинктера Одди.
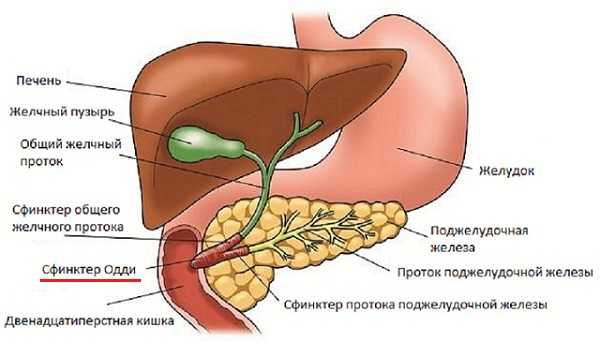
В организме сфинктер Одди обеспечивает анатомическую и физиологическую связь между желчевыводящими путями, поджелудочной железой и двенадцатиперстной кишкой.
Физиологический контроль сфинктера Одди определяется рядом гормональных и нервных стимулов. В частности, важная роль в этой регуляции отводится гастроинтестинальным гормонам. Особое значение имеет холецистокинин (панкреозимин) и секретин.
Когда желчный пузырь сокращается и синхронно расслабляется сфинктер Одди, концентрированная желчь поступает в двенадцатиперстную кишку. В это время происходит выделение панкреатического сока под действием холецистокинина, что обеспечиваются все условия для расщепления пищи. Если происходит спазм сфинктера этот процесс нарушается.
Желчный пузырь непосредственно задействован в модуляции ответа сфинктера Одди на влияние гастроинтестинальных гормонов. После удаления желчного пузыря реакция сфинктера Одди в ответ на холецистокинин снижается.
![Сфинктер Одди]()
О том, как изменяется функциональное состояние сфинктера Одди после холецистэктомии, существуют разные мнения. В частности, есть теория, что после операции повышается тонус и расширяется общий желчный проток. Также есть мнение, что вследствие холецистэктомии проявляется недостаточность сфинктера Одди, так как он не может длительнее время выдерживать высокое давление желчи. Противоречия, которые отмечаются в описании состояния сфинктера Одди, связаны с тем, что его функции исследовались в разные сроки после проведения холецистэктомии.
Классификация
В современной медицине отсутствует общепринятая классификация постхолецистэктомического синдрома. В зависимости от причины, по которой проявляются такие симптомы, в своей практике медики определяют это состояние широко, применяя такую классификацию:
- Рецидивы образования камней общего желчного протока - как ложные, так и истинные.
- Стенозирующий дуоденальный папиллит.
- Стриктуры общего желчного протока.
- Ограниченный перитонит в хронической форме.
- Холепанкреатит.
- Вторичные гастродуоденальные язвы — билиарные или гепатогенные.
Однако Римские критерии II 1999 года, а также Римские критерии III 2006 года ограничивают рамки «ПХЭС» дисфункцией сфинктера Одди, возникшей после холециетэктомии. Применяется следующая классификация дисфункции сфинктера Одди:
Дисфункция сфинктера Одди по билиарному типу. Определяется три типа этой разновидности:
- Билиарный тип I - проявляются типичные приступы боли продолжительностью 20 и больше минут; общий желчный проток расширяется больше, чем на 12 мм; при проведении эндоскопической ретроградной панкреатохолангиографии выведение контрастного вещества замедляется больше, чем на 45 минут; отмечается превышение нормы трансаминаз и/или щелочной фосфатазы.
- Билиарный тип II - проявляются приступы болей билиарного типа; до 63% пациентов имеют манометрическое подтверждение сфинктера Одди. При этом возможны и структурные, и функциональные нарушения.
- Билиарный тип III - проявляются приступы болей билиарного типа без объективных нарушений. Манометрическое подтверждение сфинктера Одди отмечается только у 12-28% пациентов. Как правило, дисфункция имеет функциональную природу.
Дисфункция сфинктера Одди по панкреатическому типу. Панкреатический тип проявляется эпигастральной болью, которая характерна для панкреатита. Боль отдает в спину и уменьшается, когда пациент наклоняется вперед. У больного значительно повышается сывороточная амилаза и липаза. При манометрии определяется дисфункция сфинктера Одди в 39-90% случаях.
Дисфункция сфинктера Одди по смешанному типу. Смешанный тип характеризуется опоясывающей болью, или боль локализуется в эпигастрии. Также проявляются другие признаки, характерные как для билиарного, так и для панкреатического типов.
Чаще всего признаки ПХЭС проявляются вследствие таких причин:
- Камни в желчевыводящих протоках (холедохолитиаз). Это могут быть как рецидивы желчнокаменной болезни, когда происходит повторное образование камней, так и ложные рецидивы с оставшимися конкрементами. В большинстве случаев остаются именно те камни, которые не были удалены во время первой операции.
- Органические и функциональные изменения большого дуоденального сосочка (БДС). Эта причина приводит к появлению болей, температуры и желтухи после удаления желчного пузыря. После такого вмешательства у большинства больных на некоторое время усиливается тонус сфинктера БДС. Но при отсутствии патологических изменений тонус постепенно приходит в норму. Примерно у четверти прооперированных людей отмечается стеноз БДС. Сначала развивается отек, после чего, при продолжительной травматизации при прохождении камней, отмечается его сужение.
- Повреждения желчных протоков и стриктуры. Сужение протока происходит или вследствие изменений стенки, связанных с воспалением, или является следствием нахождения там камня. Иногда на это влияют внешние причины. . При плохом высвобождении желчиона застаивается в желчевыводящих путях. Как следствие, создаются условия для восходящего распространения инфекции. При холецистэктомии происходит удаление только одного очага инфекции, но протоки могут остаться инфицированными.
- Особенности проведения операции. Рецидив болей развивается в том случае, если в оставленной части желчного пузыря или культе содержатся камни или сгущенная желчь.
- Опухоли желчных протоков. Их могут не обнаружить в процессе операции или они появляются позже.
- Болезни двенадцатиперстной кишки. У людей с болезнями желчевыводящих путей часто отмечаются отек и гиперемия слизистой оболочки двенадцатиперстной кишки, ее атрофия, нарушения моторной функции.
- Панкреатит в хронической форме. Часто встречается у людей, которые перенесли холецистэктомию. При технически правильно проведенной холецистэктомии отток панкреатического сока улучается и восстанавливается внешнесекреторная функция железы. Но если фиброзные изменения ярко выражены, то после операции панкреатит может проявиться как самостоятельная болезнь.
- Другие причины. Рецидив болей после проведенной операции могут спровоцировать дисбактериоз, колит, нарушение кишечного всасывания, гемолитическая болезнь, а также заболевания почек, толстой кишки, позвоночника. Боли, не связанные с изменениями желчевыводящей системы, тоже могут восприниматься как ПХЭС.
Основные симптомы спазма сфинктера Одди - это проявление приступов сильных или средней интенсивности болей, которые продолжаются более 20 минут и проявляются на протяжении больше чем трех месяцев. Также проявляются диспепсические и невротические расстройства. Беспокоит тяжесть в правом подреберье. Как правило, боль постоянная. Иногда приступы сначала проявляются редко и длятся несколько часов, а потом, в промежутках между приступами, боль вообще не ощущается. У некоторых больных со временем частота приступов и интенсивность болей увеличивается. Связь приступов с приемом пищи у всех проявляется по-разному. Но наиболее часто боль беспокоит через 2-3 часа после еды.
Иногда, в тяжелых случаях, боль длительна и упорна, она сочетается со рвотой и тошнотой, а также с мучительными приступами изжоги.
Если причины ПХЭС связаны с истинным рецидивом образования камней желчного протока, то неприятные симптомы появляются не раньше, чем через несколько лет после проведенной операции. В таком случае развиваются следующие признаки:
- Боль в правом подреберье и в правой части эпигастральной области — как правило, монотонная, реже в виде приступов. В большинстве случаев боль менее сильная, чем до проведения операции.
- Нарушения циркуляции желчи, что подтверждает диагностика.
- Инфекционно-воспалительный процесс, который развивается вследствие нарушения циркуляции желчи. Он проявляется лихорадкой, плохим самочувствием. У больного повышается СОЭ. Если развивается гнойный холангит, симптомы усугубляются.
- При ложном рецидиве камнеобразования желчного протока проявления аналогичны истинному рецидиву. Но при таком состоянии симптомы появляются раньше — примерно через 2 года после операции.
Анализы и диагностика
![Анализы и диагностика]()
Люди, которым была проведена холецистэктомия, находятся на диспансерном наблюдении у специалиста с целью раннего определения неблагоприятных результатов, а также обеспечения важных профилактических мероприятий и контроля выполнения рекомендаций пациентом.
В процессе диагностики проводится ряд исследований и лабораторных анализов. Врач обязательно изучает анамнез, проводит опрос и осмотр пациента. Для установления диагноза проводят:
- Общий анализ крови.
- Биохимический анализ крови, в процессе которого определяются биохимические маркеры синдрома холестаза-цитолиза.
- Анализ мочи.
- Электрокардиография.
- Рентгеноскопия грудной клетки.
- Ультразвуковое исследование.
- ФГДС.
- КТ, МРТ.
В процессе обследования больных, которые жалуются на признаки ПХЭС, используется принцип поиска причин таких проявлений от более простых к сложным, а также использования методик от неинвазивных к более травматичным, но позволяющим получить важную информацию.
Еще один важный момент касается хирургической настороженности при таких симптомах: она должна быть тем больше, чем меньше времени прошло от операции.
Как правило, после лабораторных анализов обследование таких больных начинают с проведения УЗИ брюшной полости, которое дает возможность исключить анатомические изменения органов и перейти к более целенаправленным обследованиям.
Однако, несмотря на то, что возможности современной диагностики достаточно широкие, у определенного количества людей не удается выяснить причину неприятных симптомов после перенесенной холецистэктомии.
Очень важно, чтобы лечение постхолецистэктомического синдрома было комплексным и направлялось на устранение причин проявления неприятных симптомов. Пациенту, который перенес удаление желчного пузыря, необходимо помнить, что правильное питание, четкий режим приема пищи, физическая активность - это важнейшие условия успешной реабилитации после хирургической операции. Также при проявлении болей и других неприятных симптомов проводится медикаментозное лечение.
Читайте также: