Потери лекарства в зависимости от метода поступления - пресистемная элиминация
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Фармация — отрасль постоянно развивающаяся, ищущая новые формулы и формы. Создание принципиально новых лекарственных субстанций сопряжено с огромными временными и материальными затратами. В среднем вывод на рынок нового препарата занимает 12-14 лет, а доля потенциально эффективных молекул в общей массе составляет 1:10 000 [1]. Есть и второй путь развития — использование хорошо известных субстанций в новых лекарственных формах с повышенной эффективностью, улучшенной биодоступностью и минимизированными побочными эффектами. Мы решили подробней остановиться на этой инновационной стороне фармакологической отрасли и осветить ее в цикле материалов о современных лекарственных формах, которые уже есть в наших аптеках или вот-вот появятся в ассортименте. И начнем мы погружение в интересный мир современных фармтехнологий с понятия, которое уже знакомо провизорам и фармацевтам, — модифицированного высвобождения лекарственных веществ.
Где действующее вещество, Лебовски?
Наверное, самой ранней попыткой создания лекарственной формы (ЛФ) с регулируемым высвобождением стала работа профессора Израэля Лебовски, который в 1938 году предложил использовать пероральные пеллеты, покрытые оболочкой, обеспечивающей пролонгированное высвобождение действующего вещества. Так же как и современные фармакологи, Лебовски хотел создать идеальное лекарство, быстро проникающее в зону действия в оптимальной концентрации и сохраняющееся в необходимой дозе определенный период времени, достаточный для достижения терапевтического эффекта [2]. Безусловно, с 30‑х годов прошлого века технологии ушли далеко вперед, но принцип, задекларированный Лебовски, остался неизменным.
Современные препараты с модифицированным высвобождением характеризуются в первую очередь изменением механизма и характера высвобождения лекарственного вещества. Они могут быть предназначены для разных путей введения — перорального, парентерального, имплантационного, трансдермального, ингаляционного и других.
Пероральные лекарственные формы с модифицированным высвобождением могут обозначаться различными английскими и русскими терминами [1].
Таблица 1: Термины для ЛФ с модифицированным высвобождением
Технологии модифицированной доставки
Для модификации высвобождения и доставки лекарственного вещества применяются различные методы [3].
Таблица 2: Методология модификации высвобождения
| Физические методы | Использование вспомогательных веществ, изменяющих растворимость, всасывание, распределение, элиминацию; использование физических сил - диффузии, осмоса, гидродинамики, аэродинамики и так далее |
| Химические методы | Образование солей, комплексов, добавление или замена функциональных химических групп в молекуле лекарственного вещества, конъюгация (биосинтез, - прим. ред.) с веществом-носителем |
| Технологические методы | Производство наноразмерных лекарственных форм - создание матриц, однослойных или многослойных оболочек, резервуаров, микросфер, липосом, наночастиц; микрогранулирование, микрокапсулирование |
| Применение таргетных инновационных препаратов | Обеспечение наноразмерного воздействия на биомишень и достижение оптимального терапевтического эффекта |
При использовании разных технологий модифицированного высвобождения можно получить пероральные лекарственные формы двух типов:
- Формы матриксного (монолитного) типа — представляют собой медленно распадающиеся матриксные монолитные таблетки.
- Формы резервуарного типа, содержащие осмотические насосы или микрокапсулы с собственными распадающимися оболочками.
В монолитных формах модификацию высвобождения обеспечивает медленно распадающееся вещество полимерной природы, которое способно к разрушению или набуханию с образованием пор. В качестве матриц часто используются [2, 3]:
- гидрогели — при их набухании образуются ячейки или поры определенного размера, обеспечивающие замедленное высвобождение лекарственного вещества;
- ионообменные резины — гидрофобные матрицы, плохо растворимые в воде;
- восковые матрицы;
- полимерные матрицы и т. д.
В резервуарных формах модифицированное высвобождение обеспечивают оболочки — прессованные, многослойные, кишечнорастворимые и другие. Их прессование позволяет включать лекарственное вещество как в ядро таблетки, так и в оболочку в качестве второго слоя. Яркий пример резервуарной формы — прессованная таблетка (coat-core). Она содержит две фазы лекарственного вещества, которые растворяются в определенное время: вещество, входящее в состав оболочки, — в первые 12 часов после приема, а содержимое в ядре — в следующие 12 часов после приема таблетки.
Рассмотрим самые распространенные формы модифицированного высвобождения более подробно.
Кишечнорастворимые оболочки
Очень популярной формой модификации высвобождения активного вещества является форма резервуарного типа с кишечнорастворимыми оболочками. Она может обеспечивать решение сразу нескольких задач:
- защита лекарственного вещества от кислой среды желудка;
- защита слизистой оболочки желудка от повреждающего действия лекарственного вещества;
- целенаправленное высвобождение препарата в тонком кишечнике;
- повышение абсорбции действующего вещества в первичном месте всасывания и др.
Для создания кишечнорастворимых оболочек используются pH-чувствительные полимеры, растворимые при pH >5. Благодаря способности растворяться в среде с четко установленным водородным показателем они остаются устойчивыми в кислой среде желудка, но быстро растворяются в тонком кишечнике.
Осмотические системы
Внешне осмотические системы выглядят, как обычные таблетки, однако представляют собой резервуар для лекарственных компонентов и осмотического вещества. Он имеет отверстие диаметром 300-500 мкм, сформированное с помощью лазерного луча. Сам резервуар окружает полупроницаемая оболочка. После приема таблетки вода проникает через нее, и лекарственное вещество частично растворяется с образованием суспензии. При этом создается осмотическое давление. Для его повышения иногда в состав препарата вводятся осмотические агенты — хлорид натрия, хлорид калия, ксилит [4]. Осмотическое давление обеспечивает выведение лекарственной суспензии из резервуара через отверстие со скоростью, равной скорости проникновения в систему жидкости.
В некоторых современных осмотических системах используются несколько слоев-оболочек: наружный, имеющий поры, и внутренний, «толкающий». Он состоит из материала, расширяющегося в присутствии воды и за счет этого выталкивающего слой лекарственного вещества из отверстия с контролируемой скоростью.
Все пероральные осмотические системы очень стабильны в желудочно-кишечном тракте, не реагируют на колебания pH, моторику кишечника, прием пищи и другие факторы.
Системы множественных микрогранул, или пеллет
Лекарственные формы этого типа имеют множество микрогранул, размещенных в матриксе и заключенных в таблетку или макрокапсулу (спансулу). Пеллеты (от англ. рellet — «шарик», «гранула», «дробинка») представляют собой частицы лекарственного вещества малого размера — микрогранулы, микросферы, мини-таблетки и так далее. Они могут быть как готовой лекарственной формой, так и промежуточным этапом в производстве готовой формы.
Чаще всего пеллеты производят путем компактирования и нанесения лекарственного вещества на фармакологически инертные микросферы, к которым предъявляется ряд требований [5]:
- гладкая поверхность и форма, приближающаяся к сферической;
- размер 600-1000 мкм;
- строго выверенная дозировка лекарственного вещества.
Пеллетам свойственна высокая текучесть, поэтому их легко компактировать до однородного состояния. Лекарственная форма с множеством пеллет может включать микросферы с разными активными и вспомогательными веществами, что позволяет объединять в одном препарате два и более действующих компонентов. При этом они могут быть как совместимыми, так и несовместимыми, а также всасывающимися в одном или разных отделах ЖКТ [5].
Лекарственная форма с системой множественных пеллет имеет ряд преимуществ: таблетки, созданные по этой технологии, можно делить, в их составе можно комбинировать два и более лекарственных препарата, в том числе и несовместимых. Это позволяет повысить профиль безопасности лекарственного средства и его эффективность.
Типы модифицированного высвобождения
Лекарственные формы с модифицированным высвобождением различаются по ряду критериев:
- По степени управления процессом высвобождения — контролируемое, пролонгированное (или замедленное) высвобождение.
- По кинетике высвобождения — непрерывное, прерывистое, отсроченное, пульсирующее.
- По модификации терапевтического эффекта — времени наступления эффекта, его продолжительности, выраженности.
Для препаратов с контролируемым высвобождением свойственно изменение времени высвобождения активного ингредиента в соответствии с характеристиками терапевтического эффекта. Препараты с этой формой выпуска должны отвечать следующим требованиям:
- процесс высвобождения действующего вещества должен описываться известным видом математической зависимости;
- высвобождение активного ингредиента должно проходить по заданной программе с заранее известной скоростью;
- высвобождение не должно зависеть от действия различных физиологических и патологических факторов — приема пищи, действия пищеварительных ферментов и так далее.
При соблюдении всех этих условий процесс высвобождения становится предсказуемым, точным по скорости, продолжительности и месту высвобождения, что позволяет прогнозировать терапевтический эффект. Если какое‑то из этих условий не выполняется, лекарственная форма является пролонгированной.
Из лекарственных форм с пульсирующим или прерывистым высвобождением лекарственное вещество высвобождается в определенное время или через определенный период времени в необходимом месте и требуемой дозировке. Как правило, такие формы имеют резервуарный тип устройства, а механизм высвобождения обеспечивают оболочки, осмотические системы и другие технологические приемы. Период высвобождения регулируется толщиной, пористостью оболочки или свойствами полимерной «пробки».
В системы с модифицированным пульсирующим высвобождением под полупроницаемую наружную оболочку вводят слой полимера, обеспечивающего период плато с заданной продолжительностью (примерно 4-5 часов), и отсроченное время действия препарата. Чтобы обеспечить повторное высвобождение, применяют многослойные системы или системы со множественными пеллетами.
Модифицированные формы: день сегодняшний
Создание лекарственных форм с модифицированным высвобождением позволяет контролировать процесс доставки активных компонентов, управлять терапевтическим эффектом, улучшить переносимость лекарственных препаратов, повысить приверженность к терапии и достичь оптимального по выраженности и продолжительности эффекта. На сегодняшний день фармкомпаниям удалось создать формы с модифицированным высвобождением для ряда препаратов, применяющихся для лечения сердечно-сосудистых заболеваний, сахарного диабета, а также антибиотиков, ферментов и гормональных лекарственных средств.
Таблица 3: Примеры препаратов, имеющих ЛФ с модифицированным высвобождением
- Нифедипин
- Верапамил
- Дилтиазем
- Фелодипин
- Метопролол
- Индапамид
- Изосорбида динитрат
- Триметазидин
- Пентоксифиллин
- Кларитромицин
- Карбамазепин
- Вальпроевая кислота
- Гликлазид
- Диклофенак
- Трамадол
- Нифедипин
- Изосорбида мононитрат
- Нифедипин
- Нифедипин
- Дилтиазем
- Метопролол
- Изосорбида мононитрат
- Верапамил
- Нифедипин
- Доксазозин
- Глипизид
- Гидроморфин
Широкие возможности, которые открывают для фармакотерапии лекарственные формы с модифицированным высвобождением, стали мощным катализатором дальнейшего развития инновационных технологий и появления ультрасовременных нано- и таргетных препаратов. Но об этом — в следующей статье.
Пресистемная элиминация
При приеме препарата внутрь, кроме биологических мембран, стоящих на пути из просвета кишечника в кровь, имеется еще один фактор, ограничивающий поступление лекарства в системный кровоток - печеночный метаболизм. Лекарственное вещество, поступая из ЖКТ по воротной вене в печень, может подвергнуться ферментативному разрушению, в связи с чем в системный кровоток попадает лишь часть (иногда незначительная часть) принятой дозы. Данный феномен носит название«эффект первого прохождения через печень». Так, некоторые лекарственные средства, обладая высокой абсорбцией, попадают в системный кровоток в очень небольшом количестве, не оказывающем терапевтического эффекта. Этот эффект характерен для быстро метаболизирующихся (см. фазу биотрансформации) средств и при значительной выраженности исключает возможность приема соответствующего препарата внутрь (например, антиаритмик лидокаин). В других случаях его можно корригировать увеличением дозы, которая оказывается значительно выше, чем при внутривенном введении (верапамил, морфин, пропранолол). Весьма демонстративным в этом плане является пример нитроглицерина. Эффект первого прохождения через печень у этого препарата достигает 85-97% дозы, что объясняет необходимость его назначения «в обход» печени (сублингвально или внутривенно) и делает бессмысленным нередко встречающееся назначение внутрь «капель Вотчала» (раствор нитроглицерина в ментоле).
Часть введенной дозы, достигшая системного кровотока, является важнейшей характеристикой препарата. Последняя обозначается как «биодоступность» и по определению ВОЗ понимается как степень и скорость, с которой вещество или его активная часть доставляется из лекарственной формы в системный кровоток. При внутривенном введении биодоступность принимается за 100%. При приеме внутрь она зависит от ряда факторов: устойчивости лекарства к действию соляной кислоты желудочного сока, активности разрушения препарата ферментами в просвете и стенке кишечника, выраженности эффекта первого прохождения через печень, то есть от потерь вследствие, так называемой,пресистемной элиминации.
Пресистемная элиминация зависит не только от препарата, но и от ряда факторов организма пациента и условий применения лекарства. На пресистемную элиминацию влияют взаимодействия с пищей и другими лекарственными средствами (см. гл. 9), скорость эвакуации из желудка, моторная функция кишечника, состояние функции печени и портального кровообращения. При нарушении функции печени (при циррозе), а также при развитии системы анастомозов между воротной веной и полыми венами (при портальной гипертензии) лекарственное средство попадает в системный кровоток, минуя печень. При этом снижается эффект первого прохождения через печень, что может вести к передозировке лекарства несмотря на назначение терапевтической дозы.
Кроме перечисленных факторов на биодоступность влияют еще и особенности технологии приготовления лекарственной формы. Поэтому биодоступность одного и того же активного вещества, выпускаемого в разных лекарственных формах или в лекарствах различных производителей, может колебаться в широких пределах. Однако такие колебания существенно затрудняют эффективное и безопасное дозирование лекарственных средств. В связи с этим перед регистрацией лекарства необходимо провести исследование биодоступности нового препарата в сравнении с эталонным лекарственным средством. В результате получается информация о сравнительной биодоступности или о биоэквивалентности.
18. Вводная (загрузочная) доза. Терапевтический смысл, расчет по фармакокинетическим параметрам, условия и ограничения ее использования.
Терапевтический смысл: вводная доза быстро обеспечивает действующую терапевтическую концентрацию ЛС в крови, что позволяет, например, быстро купировать приступ БА, аритмии и т.д.
Вводная доза может быть введена за один раз лишь тогда, когда игнорируется процесс распределения вещества
Ограничение использования ВД: если распределение ЛС происходит значительно медленнее, чем его поступление в кровь, введение сразу всей загрузочной дозы (особенно внутривенно) создаст концентрацию значительно выше терапевтической и обусловит возникновение токсических эффектов. Условие использования ВД: поэтому введение нагрузочных доз всегда должно быть медленным или дробным.
19. Поддерживающие дозы, их терапевтический смысл и расчет для оптимального режима дозирования.
Поддерживающая доза - доза ЛС, вводимая систематически, которая заполняет объем клиренса, т.е. тот фрагмент Vd, который очищается от ЛС за интервал T: ПД=(Css*Cl*T)/F.
Терапевтический смысл: ПД компенсирует потери с клиренсом за интервал между введениями препарата.
Расчет для оптимального дозирования ЛС (для быстрого купирования приступа):
1. Рассчитываем ВД: ВД=(Css*Vd)/F
2. Выбираем интервал введения T (обычно большинство ЛС назначается с интервалом, близким к t1/2) и рассчитываем ПД: ПД=(Css*Cl*T)/F
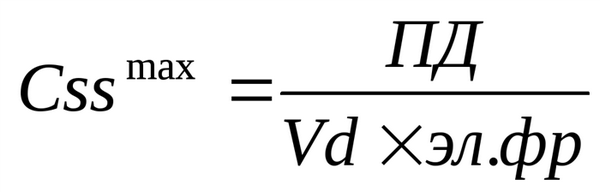
3. Проверяем, не выходят ли колебания ЛС в крови за пределы терапевтического диапазона путем расчета Cssmax и Сssmin: ; Css min = Css max × (1 - эл. фр.). Разница между Cssmax и Сssmin не должна превышать двух Css.
Элиминируемая фракция находится по графику (см. в.16) или по формуле:
4. Если при выбранном нами интервале введения ЛС его колебания выходят за пределы терапевтического диапазона, меняем T и повторяем расчет (пункт 2 - пункт 4)
NB! Если ЛС не предназначено для купирования неотложных состояний или принимается в
таблетках, ВД не рассчитывается.
20. Индивидуальные, возрастные и половые различия фармакокинетики лекарств. Поправки для расчета индивидуальных значений объема распределения лекарств.
1. Возрастные различия фармакокинеткики лекарств.
1. Роговой слой кожи тоньше, поэтому при накожном применении ЛС всасываются лучше. Абсорбция ЛС при ректальном применении также лучше.
2. Объем жидкости в организме детей 70-80%, тогда как у взрослых только 60%, поэтому Vd гидрофильных ЛС у них больше и требуются более высокие дозы.
3. У новорожденного уровень альбумина в плазме ниже, чем у взрослых, поэтому связывание ЛС с белком у них менее интенсивное
4. У новорожденных низкая интенсивность систем цитохрома Р450 и конъюгирующих ферментов, но высокая активность метилирующих систем.
5. Скорость клубочковой фильтрации в почках детей до 6 мес составляет 30-40% скорости взрослых, поэтому почечная эксркеция лекарств снижена.
1. Отмечается снижение концентрации альбумина в плазме крови и фракция лекарства, связанная с белком
2. Уменьшается содержание воды в организме с 60% до 45%, поэтому увеличивается кумуляция липофильных лекарств.
3. Скорость клубочковой фильтрации может падать до 50-60% от скорости зрелого пациента, поэтому почечная элиминация лекарств резко ограничивается.
2. Половые различия в действии лекарств. Для женщин характерна меньшая масса тела, чем для мужчин, поэтому и величина доз лекарства для них должна находиться, как правило, у нижней границы диапазона терапевтических доз.
3. Патологические состояния организма и действие лекарств
а) заболевания печени: F ЛС из-за выключения пресистемного метаболизма, фракция несвязанного ЛС из-за недостатка синтеза альбуминов, пролонгируются эффекты ЛС из-за их биотрансформации.
б) патология почек: замедляется элиминация ЛС, которые выводятся через почки
4. Генетические факторы - дефицит тех или иных ферментов метаболизма ЛС может способствовать пролонгированию их действия (псевдохолинэстераза и т.д.)
Поправки для расчета индивидуальных значений объема распределения ЛС:
а) при ожирении липофобные ЛС не растворимо в жировой ткани необходимо вычислить идеальный вес по росту (формула Брока: идеальный вес = рост (в см) - 100) и пересчитать Vd на идеальный вес по росту.
б) при отеках нужно вычислить избыточный объём воды = избыточный вес - идеальный, Vd надо увеличивать на литр каждого избыточного килограмма воды.
Зависимость основных фармакокинетических параметров от различных факторов:
1. Всасывание ЛС: при возраста абсорбция ЛС, его метаболизм в ходе пресистемной элиминации, изменяется биодоступность ЛС.
2. Объем распределения Vd: с возрастом и при ожирении, при отеках
3. Период полувыведения: изменяется с возрастом и при ожирении (т.к. уменьшается Vd)
Передовая фармакология: не теряйте
Таблетки, капсулы, сиропы и другие препараты, применяемые per os, заслуженно считаются самыми удобными лекарственными формами. Однако, нередко значительная доля лекарственного средства «теряется» при прохождении через пищеварительный тракт. Например, биодоступность некоторых цефалоспориновых антибиотиков едва достигает 50 %. С каждым днем всё больше ученых работает над созданием форм, позволяющих достичь оптимальной биодоступности, по возможности приближенной к 100 %. О самых удачных попытках и самых современных препаратах, которые вот-вот появятся в продаже или уже применяются, читайте в нашей новой статье из цикла материалов об инновационных лекарственных формах.
Per os: путь в кровоток
Прежде чем приступить к описанию технологических процессов и приемов, способных изменить биодоступность, давайте вспомним, какой путь проходит пероральный препарат от момента приема таблетки до поступления вещества в системный кровоток.
Прежде всего лекарство подвергается воздействию кислой среды желудка (pH 2-4) и протеолитических ферментов. Некоторые препараты всасываются в кровь именно в желудке, например, мизопростол, антихеликобактерные средства и др. Однако, большинство ЛС расщепляется в тонком кишечнике. Именно там, при pH 6-7, препараты подвергаются воздействию желчных кислот, а также панкреатических ферментов (включая липолитические). Молекулы лекарства, растворяясь в среде кишечника, всасываются в его стенки, в основном — через клетки эпителия, энтероциты. Затем путем диффузии и/или под действием ряда белковых транспортеров и ферментов препарат выходит из клеток и поступает в системную циркуляцию: через портальную вену и печень или непосредственно в лимфатическую систему [1].
В целом биодоступность включает три составляющие:
- Абсорбируемая часть активного вещества — основная составляющая, определяющая биодоступность лекарственного средства.
- Часть препарата, не подвергшаяся метаболизму в ЖКТ.
- Часть препарата, не подвергшаяся эффекту первого прохождения через печень.
Оставшаяся часть лекарственного средства — и не растворившегося, и растворившегося, но не абсорбированного — продвигается в толстый кишечник и, как правило, выводится (за исключением препаратов, которые расщепляются именно в толстой кишке, наподобие сульфасалазина). С учетом того, на каком участке ЖКТ происходит метаболизм лекарственного препарата, и используют различные методы повышения биодоступности. Рассмотрим самые известные на сегодняшний день.
Флотирующие формы
Флотирующие системы доставки лекарств (ФСДЛ — от англ. Floating Drug Delivery Systems) работают за счет способности поддерживать препарат во флотирующем, «плавучем» состоянии на поверхности жидкости в верхнем отделе желудка. В таком виде препарат не подвергается воздействию перистальтических сокращений, и его высвобождение из желудка в кишечник становится управляемым.
Флотирование препарата достигается за счет введения в лекарственную форму специальных компонентов-носителей: полистирола, капсул с воздухом, набухающих гелей и др. [2].
Флотирующие системы — удачный способ увеличить биодоступность ряда препаратов, а именно [3]:
- препаратов, имеющих низкую абсорбцию в ЖКТ (леводопа, фуросемид, рибофлавин);
- средств, действующих именно в желудке (мизопростол, антациды);
- препаратов, неустойчивых в тонком или толстом кишечнике (каптоприл, метронидазол);
- препаратов, нарушающих состав микрофлоры (антибиотики);
- препаратов, плохо растворимых при высоких значениях pH, которые достигаются в кишечнике (диазепам, верапамил, хлордиазепоксид);
- препаратов, максимальная концентрация которых должна достигаться именно в желудке, например, средства для лечения хеликобактерной инфекции (тетрациклин, метронидизол, кларитромицин).
Флотирующие системы уже сегодня разработаны для различных пероральных лекарственных форм (2).
Таблица: Препараты, имеющие лекарственную форму «флотирующая система»
| Лекарственная форма | Препараты |
| Таблетки | Хлорфенирамина малеат, теофиллин, фуросемид, ципрофлоксацин, капторил, ацетилсалициловая кислота, нимодипин, амоксициллин, верапамил, изосорбида динитрат, изосорбида мононитрат, ацетаминофен, ампициллин, циннаризин, дилтиазем, фторурацил, преднизолон |
| Капсулы | Никардипин, хлордиазепоксид, фуросемид, мизопростол, диазепам, пропранолол, уродезоксихолевая кислота |
| Микросферы | Аспирин, гризеофульфин, кетопрофен, ибупрофен, терфенадин |
| Гранулы | Индометацин, диклофенак, преднизолон |
| Пленки | Циннаризин |
Основное преимущество флотирующих систем — возможность обеспечить оптимальный метаболизм и биодоступность для ряда лекарственных препаратов. Есть у этих форм и недостатки. Так, эта форма не подходит для препаратов, которые плохо растворяются или нестабильны в ЖКТ. Кроме того, чтобы обеспечить флотирующий эффект, необходимо запивать лекарство большим объемом жидкости — только при таком условии система работает эффективно.
Повышение межклеточной проницаемости препарата
Чтобы увеличить абсорбцию препарата из просвета кишечника в лимфу и далее в кровоток, в состав могут вводить энхансеры — вещества, расширяющие межщелевые контакты, представляющие собой соединения между клетками. Их доля на поверхности кишечного эпителия очень мала — менее 0,1 % от общей площади. Тем не менее известно, что парацеллюлярным путем, в отличие от энтероцитов, могут поглощаться не только растворенные вещества, но и более крупные молекулы, например, белковые [3].
Энхансерами могут служить различные вещества, повышающие уровень ионов кальция внутри клетки: жирные кислоты, глицериды, ацилкарнитины, хитозаны, капрат натрия и др.
Применение энхансеров перспективно прежде всего для пероральных гидрофильных веществ, имеющих низкую биодоступность из‑за слабого сродства к гидрофобной мембране клеток кишечника. Плотные контакты на апикальной стороне энтероцитов не позволяют гидрофильным препаратам проникать внутрь клеток, и поступить в кровоток препараты этой группы могут только через межклеточный путь [3].
Благодаря введению энхансеров в формулу гидрофильного препарата появляется возможность применения лекарственных средств с высокой эффективностью, которые не могут быть использованы перорально в обычных формах из‑за практически нулевой биодоступности [3].
Повышение клеточной абсорбции лекарственного препарата
Существует ряд технологий, обеспечивающих создание лекарственных форм препаратов с изначально низкой пероральной биодоступностью.
Гидрогели
Полимерные гидрогели представляют собой трехмерные сети, состоящие из «сшитых» гидрофильных компонентов. В определенных условиях окружающей среды они могут впитывать большое количество воды или биологических жидкостей, оставаясь нерастворимыми. Физическая целостность гидрогелей поддерживается за счет физических и/или химических поперечных связей [4].
Гидрогели используются в качестве инертной матрицы для контролируемого выделения активного вещества. Оно не связывается с гидрогелем химическими связями, и скорость выделения зависит только от природы и строения гидрогеля.
Поскольку трехмерная структура гидрогелей позволяет контролировать транспорт растворенных веществ, они становятся оптимальными носителями для доставки высокомолекулярных активных веществ, таких как пептиды и белки. Кроме того, гидрогели способны изменяться за счет гидрофильного/гидрофобного баланса, что дает возможность регулировать перенос активного компонента.
Еще более широкие возможности повышения биодоступности открывает использование полимеров, изменяющих степень набухания в зависимости от параметров окружающей среды, в частности, температуры, pH или химического состава. Это обеспечивается за счет использования pH-чувствительных гидрогелей, которые не набухают в кислой среде желудка. Благодаря этому препарат остается в геле, защищенным от разрушения протеолитическими ферментами. В основной или нейтральной среде кишечника комплекс «гидрогель-активное вещество» диссоциирует, гель набухает и препарат высвобождается. Именно такая форма разрабатывается для перорального инсулина [4, 5].
Кроме того, изучаются гидрогели с ингибиторами ферментов. Они тоже рассматриваются в качестве потенциальной формы для перорального введения инсулина. Такая матрица обеспечивает ингибирование протеолитических ферментов желудка и одновременно — прилипание частиц гидрогеля к стенкам тонкого кишечника [5]. Фармакокинетика инсулина в форме гидрогеля в эксперименте сопоставима с таковой при введении инъекционного нативного инсулина.
Эмульсии
Эмульсии защищают активный компонент от химического и ферментативного разрушения в тонком кишечнике. Их липидная фаза состоит из жирных кислот триглицеридов со средней длиной цепи. Абсорбция препарата в таких формах зависит от типа эмульгатора, размера частиц дисперсной фазы, pH, растворимости действующего вещества и других параметров.
Применение в фармацевтике нашли микроэмульсии — термодинамически стабильные изотропные дисперсии раствора лекарственного вещества в ПАВ. Они образуются путем смешивания липофильных и гидрофильных компонентов, ПАВ и со-ПАВ. Благодаря этой технологии удается защитить действующее вещество от ферментативной и химической деградации в тонком кишечнике. Однако, такая форма является химически нестабильной при длительном хранении [6].
Одним из самых популярных и коммерчески обоснованных способов создания эмульсионных форм с повышенной биодоступностью является производство самоэмульгирующихся систем доставки лекарств. Они представляют собой изотропную смесь натуральных или синтетических масел, твердых или жидких поверхностно-активных веществ или одного (нескольких) гидрофильных растворителей и ко-растворителей/сурфактантов [7].
При контакте с водной средой, такой как жидкости пищеварительного тракта, самоэмульгирующиеся системы образуют тонкие эмульсии типа «масло в воде» или микроэмульсии. Мелкие капельки масла быстро перемещаются из желудка в кишечник, что обеспечивает оптимальное перемещение препарата по пищеварительному тракту, сводя к минимуму раздражение, часто встречающееся при длительном контакте между обычными лекарственными препаратами и стенкой кишечника [7].
Самоэмульгирующиеся системы, в отличие от обычных эмульсий, являются физически стабильными, позволяющими регулировать степень абсорбции и профиль концентрации препарата в плазме. Еще одно их преимущество — способность обеспечивать большую межфазную поверхность для распределения лекарственного препарата между фазами «масло» и «вода» [7].
Формы с микро- и наночастицами
Лекарственные формы, представляющие собой микрочастицы, — современные формы продолжительного действия с увеличенной биодоступностью и благоприятным профилем безопасности. Микрочастицы создаются на основе биосовместимых и биоразлагаемых полимерных композиций, мицелл и липосом. Лекарственное вещество, не образующее ковалентных связей с носителем, может быть распределено в «матрице» частицы капсулировано, интегрировано в ее отдельных частях (например, по типу комплекса «гость — хозяин»), или адсорбировано на ее поверхности.
Активация лекарственного вещества в формах с микрочастицами происходит при разрыве химической связи «полимер — лекарственное вещество». Зная природу и свойства такой связи, а также характер поведения полимера в организме, можно регулировать выделение лекарственного вещества и его биодоступность.
Наночастицы, которые также применяются в составе систем адресной доставки, представляют собой высокодисперсные частицы диаметром менее 100 нм. Установлено, что наноразмерные частицы абсорбируются через кишечный эпителий полностью. Протеины и пептиды, инкапсулированные в наночастицы, менее чувствительны к ферментативному разрушению за счет связи с полимерами и лучше абсорбируются в ЖКТ (5).
Наночастицы широко используют для создания противоопухолевых препаратов. Так, впервые применение нанопрепаратов с наночастицами было разрешено FDA* в 1995 году, когда была одобрена регистрация препарата доксорубицин [6]. Еще один яркий пример формы с наночастицами — транспортная форма противоопухолевого препарата паклитаксел [8].
Липосомы
В качестве средств целенаправленной доставки лекарственных веществ к органам-мишеням используют липосомы — везикулы с гидрофильным ядром, окруженным одним или несколькими липидными бислоями размером 50-1000 нм. Обычно они состоят из фосфолипидов, имеющих гидрофильную головку, обладающую сродством к молекулам воды, и неполярные углеводородные цепи гидрофобного характера. Благодаря этим свойствам фосфолипидные молекулы самопроизвольно образуют бислойные липидные мембраны.
Форма и размер образующихся в воде липосом зависят от множества факторов, в том числе кислотности среды, присутствия солей и т. д.
Липосомы менее стабильны по сравнению с микрочастицами, однако считаются перспективным и безопасным способом доставки лекарственного вещества [5]. Резистентность этой формы может быть увеличена за счет покрытия поверхности полиэтиленгликолем (ПЭГ) или муцином [5].
Важным свойством липосом является возможность включить в их состав широкий спектр активных веществ — от неорганических ионов и низкомолекулярных органических соединений до крупных белков и нуклеиновых кислот. Липосомы заполняют антибиотиками, гормонами, ферментами, иммуномодуляторами, цитостатиками, противовирусными, противогрибковыми и противоопухолевыми препаратами, витаминами и вакцинами [9]. Уже сегодня на рынке представлены липосомальные противоопухолевые препараты — даунорубицин, доксорубицин. Ученые предлагают включать в липосомы фрагменты белков вирусных оболочек для внутриклеточной доставки лекарств и ДНК. Изучается использование липосомального гемоглобина в качестве кровезаменителя, липосомальной формы «биоэнергетических» субстратов, в частности, — АТФ и других инновационных препаратов [10], которые смогут открыть новые возможности лечения самых разных заболеваний.
* Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Фармакокинетика. Часть II: всасывание, распределение, выведение

Всасывание - это процесс поступления ЛС из места введения в кровь. Всасывание лекарственного вещества зависит от пути введения его в организм, лекарственной формы, физико-химических свойств (растворимости в липидах или гидрофильности вещества), а также от интенсивности кровотока в месте введения.
ЛС, принятые перорально, подвергаются всасыванию, проходя через слизистую оболочку желудочно-кишечного тракта, что определяется их растворимостью в липидах и степенью ионизации. Различают 4 основные механизма всасывания: диффузия, фильтрация, активный транспорт, пиноцитоз.
Пассивная диффузия осуществляется через клеточную мембрану. Всасывание происходит до тех пор, пока концентрация лекарственного вещества по обе стороны биомембраны не сравняется. Подобным образом всасываются липофильные вещества (например, барбитураты, бензодиазепины, метопролол и др.), причем чем выше их липофильность, тем активнее их проникновение через клеточную мембрану. Пассивная диффузия веществ идет без затраты энергии по градиенту концентрации.
Облегченная диффузия - это транспорт лекарственных веществ через биологические мембраны с участием молекул специфических переносчиков. При этом перенос лекарства осуществляется также по градиенту концентрации, но скорость переноса при этом значительно выше. Например, таким образом всасывается цианокобаламин. В осуществлении его диффузии участвует специфический белок - гастромукопротеид (внутренний фактор Кастла), образующийся в желудке. Если продукция этого соединения нарушена, то снижается всасывание цианокобаламина и, как следствие этого, развивается пернициозная анемия.
Фильтрация осуществляется через поры клеточных мембран. Этот механизм пассивного всасывания идет без затраты энергии и осуществляется по градиенту концентрации. Характерен для гидрофильных веществ (например, атенолол, лизиноприл и др.), а также ионизированных соединений.
Активный транспорт осуществляется с участием специфических транспортных систем клеточных мембран. В отличие от пассивной диффузии и фильтрации активный транспорт процесс энергозатратный и способен осуществляться против градиента концентрации. В данном случае несколько веществ могут конкурировать за один и тот же транспортный механизм. Способы активного транспорта обладают высокой специфичностью, поскольку сформировались в процессе длительной эволюции организма для обеспечения его физиологических потребностей. Именно эти механизмы являются основными для осуществления доставки в клетки питательных веществ и выведения продуктов обмена.
Пиноцитоз (корпускулярная абсорбция или пенсорбция) представляет также разновидность всасывания с затратой энергии, осуществление которого возможно против градиента концентрации. При этом происходит захват лекарственного вещества и инвагинация клеточной мембраны с образованием вакуоли, которая направляется к противоположной стороне клетки, где происходит экзоцитоз с высвобождением лекарственного соединения.
РАСПРЕДЕЛЕНИЕ ЛС В ОРГАНИЗМЕ: БИОЛОГИЧЕСКИЕ БАРЬЕРЫ
Попадая в системный кровоток, ЛС начинает распределяться по различным органам и тканям организма. Большинство лекарств распределяются по организму неравномерно. Характер распределения определяется многими условиями: растворимостью, комплексообразованием с белками плазмы крови, интенсивностью кровотока в отдельных органах и т.д. С учетом этого наибольшие концентрации лекарственного вещества в первые минуты после абсорбции создаются в органах, имеющих наиболее активное кровоснабжение, таких как сердце, печень, почки. Медленнее препараты проникают в мышцы, кожу, жировую ткань. Однако действие лекарственных веществ на тот или иной орган или ткань определяется главным образом не его концентрацией, а чувствительностью к ним этих образований. Сродство лекарственных веществ к биологическим субстратам и определяет специфичность их действия.
Существуют определенные трудности для проникновения лекарственных соединений через гематоэнцефалический барьер (ГЭБ), что связано со спецификой строения капилляров мозга. Через ГЭБ хорошо проникают липофильные соединения, а вот гидрофильные не в состоянии его преодолеть. При некоторых заболеваниях мозга (менингит, травма и т.п.) проницаемость ГЭБ повышается, и через него могут проникать значительно большие количества ЛС.
Проникновению лекарств в мозг способствует также нарастание уровня остаточного азота крови, т.к. при этом повышается проницаемость ГЭБ и увеличивается свободная фракция лекарственного вещества, вытесненного из комплекса с белком. У новорожденных и детей грудного возраста проницаемость ГЭБ значительно выше, чем у взрослых, поэтому у них даже плохо растворимые в липидах вещества скорее и легче преодолевают «пограничный барьер» и обнаруживаются в более высоких концентрациях в тканях мозга. Еще более высокая проницаемость ГЭБ характерна для плода, поэтому концентрация некоторых ЛС в ликворе плода может достигать таких же значений, как и в материнской крови, что способно привести к патологии головного мозга ребенка.
Избирательная проницаемость характерна и для плацентарного барьера. Через него легко проходят липофильные вещества. Соединения со сложной структурой, высокомолекулярные, белковые вещества через плацентарный барьер не проникают. В то же время его проницаемость значительно изменяется по мере нарастания срока беременности.
Некоторые ЛС имеют повышенное сродство к определенным тканям организма, а поэтому в них происходит их накопление и даже фиксация на продолжительное время. Например, тетрациклины накапливаются в костной ткани и зубной эмали и остаются там в течение длительного времени. Липофильные соединения создают высокие уровни концентрации в жировой ткани и могут задерживаться в ней.
СВЯЗЫВАНИЕ ЛС С БЕЛКАМИ КРОВИ И ТКАНЕЙ
Попав в системный кровоток, ЛС присутствуют там в двух фракциях - свободной и связанной. Лекарства способны взаимодействовать и формировать комплексы с альбуминами, в меньшей степени - с кислыми альфа1-гликопротеинами, липопротеинами, гамма-глобулинами и форменными элементами крови (эритроцитами и тромбоцитами).
Связь лекарственного вещества с белками плазмы приводит к тому, что проникновение его в различные органы и ткани резко снижается, ибо через клеточные мембраны проходит лишь свободный препарат. Ксенобиотики, связанные с белком, не взаимодействуют с рецепторами, ферментами и не проникают через клеточные барьеры. Свободная и связанная фракции ЛС находятся в состоянии динамического равновесия - по мере снижения фракции свободного вещества лекарственное средство высвобождается из связи с белком, в результате чего концентрация вещества снижается.
Связывание лекарственных веществ с белками плазмы крови оказывает влияние на распределение их в организме, скорость и длительность действия. Если ЛС обладает низкой способностью комплексообразования с белками плазмы (? 50%), оно быстро распределяется в организме, достигает того органа или системы, на который должно проявить свое действие, и вызывает достаточно быстрый терапевтический эффект. Однако подобные лекарства быстро удаляются из организма, с чем связано их непродолжительное действие. Напротив, вещества, обладающие высоким сродством к белкам плазмы (? 90%), долгое время циркулируют в кровеносном русле, плохо и медленно проникают и накапливаются в тканях, а поэтому терапевтические уровни их в тканях создаются медленно и эффект развивается постепенно. Но такие вещества медленно элиминируют из организма, тем самым обеспечивая продолжительное лечебное действие. На этом, например, основано получение сульфаниламидных средств с пролонгированным эффектом.
ВЫВЕДЕНИЕ ЛС. БИОТРАНСФОРМАЦИЯ
Выведение (элиминация) ЛС - это сложный процесс удаления лекарства из организма, включающий в себя его нейтрализацию (биотрансформацию или метаболизм) и собственно экскрецию.
При характеристике элиминации различают пресистемную элиминацию и системную элиминацию. Как мы уже указывали («РА», 2006, №8), пресистемный метаболизм, или эффект первичного прохождения, - это биотрансформация лекарственного вещества при первичном прохождении печени после его всасывания. Системная элиминация - удаление ксенобиотика после его попадания в системный кровоток.
Биотрансформация (метаболизм) - комплекс физико-химических и биологических превращений ЛС, в результате которого образуются гидрофильные соединения, легче выводимые из организма и, как правило, проявляющие менее выраженное фармакологическое действие (либо полностью его лишенные). Поэтому в процессе метаболизма лекарственные вещества обычно теряют свою активность, но становятся более удобными для удаления из организма почками. Некоторые высокогидрофильные ионизированные соединения (например, хондроитин, глюкозамин и др.) могут не подвергаться в организме биотрансформации и выводиться в неизмененном виде.
В то же время имеется небольшое количество препаратов, биотрансформация которых приводит к образованию более активных метаболитов, чем исходное соединение. На эффекте первичного прохождения основано действие пролекарств (например, дезлоратадина, фамцикловира, периндоприла и др.), т.е. веществ, которые превращаются в фармакологически активные ЛС только после пресистемного метаболизма. Биотрансформация лекарств может осуществляться в печени, стенке кишечника, почках и других органах.
Различают метаболические реакции лекарственных веществ двух типов - несинтетические и синтетические.
Несинтетические реакции в свою очередь бывают:
- микросомальные - катализируемые ферментами эндоплазматического ретикулума;
- немикросомальные - катализируемые ферментами иной локализации (реакции окисления, восстановления и гидролиза).
В основе синтетических реакций лежит конъюгация лекарственных веществ с эндогенными соединениями или химическими группировками (глюкуроновая кислота, глутатион, сульфаты, глицин, метильные группы и др.). В процессе конъюгации, например, происходит метилирование гистамина и катехоламинов, ацетилирование сульфаниламидов, комплексообразование с глюкуроновой кислотой морфина, взаимодействие с глутатионом парацетамола и др. В результате синтетических метаболических реакций молекула препарата становится более полярной и легче выводится из организма.
МАГИСТРАЛЬНЫЕ ПУТИ ЭЛИМИНАЦИИ
Лекарственные вещества и их метаболиты покидают организм различными путями, основными из которых являются почки и ЖКТ (с калом). Меньшую роль играет выведение с выдыхаемым воздухом, потом, слюной, слезной жидкостью.
Почки выводят лекарственные вещества путем клубочковой фильтрации и канальцевой секреции, хотя большое значение имеет и процесс реабсорбции веществ в почечных канальцах.
При почечной недостаточности клубочковая фильтрация значительно понижается, что приводит к замедлению выведения ЛС из организма и увеличению его концентрации в крови. В связи с этим при прогрессирующей уремии дозу таких веществ во избежание развития токсических эффектов следует снижать. Выведение лекарственных средств почками зависит от рН мочи. Поэтому при щелочной реакции мочи быстрее выводятся вещества со слабокислыми свойствами, а при кислой реакции мочи - с основными.
Ряд препаратов (пенициллины, тетрациклины, дифенин и др.) в неизмененном виде или в форме метаболитов поступают в желчь, а затем в составе желчи выделяются в двенадцатиперстную кишку. Часть препарата с содержимым кишечника выводится наружу, а часть подвергается повторной абсорбции и снова поступает в кровь и печень, затем в желчь и опять в кишечник. Подобный цикл получил название энтерогепатической циркуляции.
Газообразные и летучие вещества могут выводиться легкими. Этот способ выведения характерен, например, для ингаляционных наркотизирующих веществ.
Препараты могут выделяться из организма слюнными железами (иодиды), потовыми железами (дитофал), железами желудка (хинин), слезными железами (рифамицин).
Большое значение имеет способность некоторых лекарственных средств выводиться с молоком лактирующих женщин. Обычно концентрация препарата в молоке недостаточна, чтобы оказать неблагоприятное действие на новорожденного. Но есть и такие ЛС, которые создают достаточно высокие концентрации в молоке, что может представлять опасность для ребенка. Информация относительно выведения различных лекарств с молоком весьма скудная, поэтому назначать препараты кормящим женщинам надо с особой осторожностью.
Наконец, необходимо указать, что интенсивность выведения лекарств из организма может быть описана количественными параметрами, служащими немаловажным элементом в оценке эффективности препаратов. К таким параметрам относятся:
а) период полувыведения (Т1/2) - время, необходимое для снижения концентрации лекарственного средства в плазме крови в 2 раза. Этот показатель находится в прямой зависимости от константы скорости элиминации;
б) общий клиренс лекарственного средства (Clt) - объем плазмы крови, очищаемый от лекарственного вещества за единицу времени (мл/мин.) за счет выведения почками, печенью и т.д. Общий клиренс равняется сумме почечного и печеночного клиренса;
в) почечный клиренс (Clr) - выведение лекарства с мочой;
г) внепочечный клиренс (Cler) - выведение лекарства иными путями (прежде всего с желчью).
Читайте также:
- Средства транспортировки раненых в бою. Мониторинг
- Редкие причины рецидивирующих кратковременных головокружений
- Особенности строения клеток растений
- Жертвы маркетинга. Как не поддаваться на провокации и избежать невыгодных покупок?
- Закон поддержания постоянства рН. Компенсаторные механизмы pH плазмы и эритроцитов
