Закон поддержания постоянства рН. Компенсаторные механизмы pH плазмы и эритроцитов
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Активная реакция крови (рН), обусловленная соотношением в ней водородных (Н⁺) и гидроксильных (ОН ⁻) ионов, является одним из жестких параметров гомеостаза, так как только при определенном РН возможно оптимальное течение обменавеществ .
Кровь имеет слабо щелочную реакцию. рН артериальной крови равен 7,4; рН венозной крови вследствие большого содержания в ней углекислоты составляет 7,35. Внутри клеток рН несколько ниже (7,0—7,2), что зависит от образования в них при метаболизме кислых продуктов. Крайними пределами изменений рН, совместимыми с жизнью, являются величины от 7,0 до 7,8. Смещение рН за эти пределы вызывает тяжелые нарушения и может привести к смерти. У здоровых людей рН крови колеблется в пределах 7,35—7,40. Длительное смещение рН у человека даже на 0,1—0,2 может оказаться гибельным.
В процессе метаболизма в кровь непрерывно поступают углекислота, молочная кислота и другие продукты обмена, изменяющие концентрацию водородных ионов. Однако рН крови сохраняется постоянным, что объясняется буферными свойствами плазмы и эритроцитов, а также деятельностью легких и органов выделения, удаляющих из организма избыток СО ₂, кислот и щелочей.
Буферные свойства крови обусловлены тем, что в ней содержатся:
- буферная система гемоглобина;
- карбонатная буферная система;
- фосфатная буферная система;
- буферная система белков плазмы.
Буферная система гемоглобина самая мощная. На ее долю приходится 75 % буферной емкости крови. Эта система состоит из восстановленного гемоглобина (ННв) и его калиевой соли (КНв). Буферные свойства ННв обусловлены тем, что он, будучи более слабой кислотой, чем Н₂СО₃, отдает ей ион К ⁺, а сам, присоединяя ионы Н⁺, становится очень слабо диссоциирующей кислотой. В тканях система гемоглобина крови выполняет функции щелочи, предотвращая закисление крови вследствие поступления в нее СО₂ и Н⁺- ионов. В легких гемоглобин крови ведет себя как кислота, предотвращая защелачивание крови после выделения из нее углекислоты.
Карбонатная буферная система (Н ₂СО₃+NaНСО₃) по своей мощности занимает второе место после системы гемоглобина. Она функционирует следующим образом: NaHCO₃ диссоциирует на ионы Na ⁺ и НСО ⁻. При поступлении в кровь более сильной кислоты, чем угольная, происходит реакция обмена ионами Na⁺ с образованием слабодиссоциирующей и легкорастворимой Н₂СО₃. Таким образом предотвращается повышение концентрации Н ⁺-ионов в крови.
Увеличение в крови содержания угольной кислоты приводит к тому, что ее ангидрит — углекислый газ — выделяется легкими. В результате этих процессов поступление кислоты в кровь приводит лишь к небольшому временному повышению содержания нейтральной соли без сдвига рН. В случае поступления в кровь щелочи она реагирует с угольной кислотой, образуя бикарбонат NaHCCb и воду. Возникающий при этом дефицит угольной кислоты немедленно компенсируется уменьшением выделения СО2 легкими.
Хотя в исследованиях in vitro удельный вес бикарбонатного буфера по сравнению с гемоглобином слабее, в действительности же его роль в организме весьма ощутима. Это обусловлено тем, что связанное с действием этой буферной системы усиленное выведение СО2 легкими и выделение NaCl мочой — весьма быстрые процессы, почти мгновенно восстанавливающие рН крови.
Фосфатная буферная система образована дигидрофосфатом (ЫаНгРС^) и гидрофосфатом (Na2HPC>4) натрия. Первое соединение слабо диссоциирует и ведет себя как слабая кислота. Второе соединение обладает щелочными свойствами. При введении в кровь более сильной кислоты она реагирует с ЫаНгРО4, образуя нейтральную соль и увеличивая количество, малодиссоциирующего дигидрофосфата натрия. В случае введения в кровь сильной щелочи она реагирует с дигидрофосфатом натрия, образуя слабо щелочной гидрофосфат натрия. рН крови изменяется при этом незначительно. В обоих случаях избыток дигидрофосфата или гидрофосфата натрия выделяется с мочой.
Белки плазмы играют роль буферной системы благодаря своим амфотерным свойствам. В кислой среде они ведут себя как щелочи, связывая кислоты. В щелочной среде белки реагируют как кислоты, связывающие щелочи.
В поддержание рН крови, помимо легких, участвуют почки, удаляющие из организма избыток как кислот, так и щелочей. При сдвиге рН крови в кислую сторону почки выделяют с мочой увеличенное количество кислой соли NahbPC^. При сдвиге в щелочную сторону почки увеличивают выделение щелочных солей: №гНРСи и №гСОз. В первом случае моча становится резко кислой, во втором — щелочной (рН мочи в норме колеблется от 4,7 до 6,5, а при нарушениях кислотно-щелочного равновесия крови может изменяться в пределах 4,5—8,5).
Выделение небольшого количества, молочной кислоты осуществляется также потовыми железами.
Буферные системы имеются и в тканях, где они сохраняют рН на относительно постоянном уровне. Главными буферами тканей являются клеточные белки и фосфаты. В процессе метаболизма кислых продуктов образуется больше, чем щелочных, поэтому опасность сдвига рН в сторону закисления более велика. В соответствии с этим буферные системы крови и тканей более устойчивы к действию кислот, чем щелочей. Так, для сдвига рН плазмы крови в щелочную сторону требуется прибавить к ней в 40—70 раз больше NaOH, чем к чистой воде. Для сдвига же рН в кислую сторону необходимо добавить к плазме в 300—350 раз больше НС1, чем к воде. Щелочные соли слабых кислот, содержащиеся в крови, образуют так называемый щелочной резерв крови . Величину его определяют по тому количеству миллилитров углекислоты, которое может быть связано 100 мл крови при давлении СО2, равном 40 мм рт. ст., т.е. примерно соответствующем его давлению в альвеолярном воздухе.
Постоянное соотношение между кислотными и щелочными эквивалентами позволяет говорить о кислотно-щелочном равновесии крови.
Несмотря на наличие буферных систем и хорошую защищенность организма от возможных изменений рН, все же иногда при некоторых условиях наблюдаются небольшие сдвиги активной реакции крови. Сдвиг рН в кислую сторону называется ацидозом, сдвиг в щелочную сторону — алкалозом.
Изменения щелочного резерва крови и небольшие колебания ее рН всегда происходят в капиллярах большого и малого кругов кровообращения. Так. поступление СОа в кровь тканевых капилляров закисляет венозную кровь на 0,01—0,05 по сравнению с артериальной кровью. Противоположный сдвиг рН наблюдается в легочных капиллярах вследствие перехода ССЬ в альвеолярный воздух.
Чурсин В.В. Клиническая физиология кровообращения (методические материалы к лекциям и практическим занятиям)
Чурсин В.В. Клиническая физиология кровобращения. Методические материалы к практическим и семинарским занятиям, - 2011. - 44 с.
Содержит информацию о физиологии кровообращения, нарушениях кровообращения и их вариантах. Также представлена информация о методах клинической и инструментальной диагностики нарушений кровообращения.
Данные материалы являются переработанным вариантом предыдущих изданий (1999г., 2003г.), первым автором которых являлся В.Ф.Туркин - доцент кафедры анестезиологии и реаниматологии АГИУВ.
Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Введение
Академик В.В.Парин (1965г.) дает такое пояснение: «Клиническая физиология исходит из положения, что в организме при болезни многие возникающие реакции являются приспособительными. Под влиянием чрезвычайных раздражителей приспособительные реакции резко изменяются и, приобретая опасное для организма значение, становятся реакциями патологическими. Переход приспособительных реакций в патологические является узловым звеном в патогенезе заболеваний. А его детальное изучение является одной из главных задач клинической физиологии кровообращения».
Исходя из этого пояснения, можно отметить, что значение клинической физиологии любой системы предполагает:
Более образно это можно представить в следующем виде (рисунок 1).
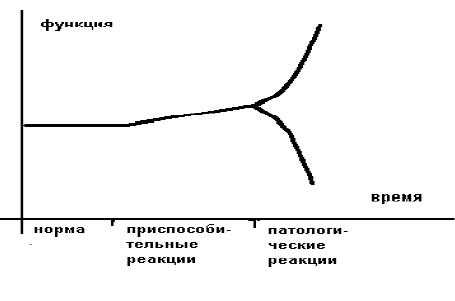
Приспособительные реакции обеспечивают компенсацию, а патологические реакции обуславливают декомпенсацию страдающего органа или страдающей системы. В общем виде отличием (границей) между нормой и приспособлением является изменение свойств приспосабливающего органа или приспосабливающейся системы.
Границей между приспособлением и патологией является резкое изменение ("излом") приспособительной реакции по направлению и величине.
Различают срочные приспособительные реакции и долговременные. Врачам интенсивной терапии чаще приходится иметь дело с острыми расстройствами, поэтому необходимы знания срочных приспособительных реакций и их переход в патологические.
Кровообращение - определение, классификация
Кровообращение - это непрерывное движение (обращение) крови по замкнутой системе, именуемой сердечно-сосудистой.
- 2 - аорта и крупные артерии, имеют много эластических волокон, представляются как буферные сосуды, благодаря им резко пульсирующий кровопоток превращается в более плавный;
- 3 - прекапиллярные сосуды, это мелкие артерии, артериолы, метартериолы, прекапиллярные жомы (сфинктеры), имеют много мышечных волокон, которые могут существенно изменить свой диаметр (просвет), они определяют не только величину сосудистого сопротивления в малом и большом кругах кровообращения (поэтому и называются резистивными сосудами), но и распределение кровопотока;
- 4 - капилляры, это обменные сосуды, при обычном состоянии открыто 20-35% капилляров, они образуют обменную поверхность в 250-350 кв.м., при физической нагрузке максимальное количество открытых капилляров может достигать 50-60%;
- 5 - сосуды - шунты или артериоло-венулярные анастомозы, обеспечивают сброс крови из артериального резервуара в венозный, минуя капилляры, имеют значение в сохранении тепла в организме;
- 7 - вены, крупные вены, они обладают большой растяжимостью и малой эластичностью, в них содержится большая часть крови (поэтому и называются емкостными сосудами), они определяют "венозный возврат" крови к желудочкам сердца, их заполнение и (в определенной мере) ударный объём (УО).
Объем циркулирующей крови (ОЦК)
Вопрос объема имеет важное значение. Прежде всего потому, что определяет наполнение камер сердца и таким образом влияет на величину УО.
По классическому представлению ОЦК составляет у мужчин 77 и у женщин 65 мл/кг массы тела 10%. В среднем берётся 70 мл/кг.
Необходимо чётко представлять, что ОЦК является «жидким слепком сосудистой системы» - сосуды не бывают полупустыми. Ёмкость сосудистой системы может изменяться в достаточно больших пределах, в зависимости от тонуса артериол, количества функционирующих капилляров, степени сдавления вен окружающими тканями («наполненность» интерстиция и тонус мышц) и степенью растянутости свободно расположенных вен брюшной полости и грудной клетки. Разница в ОЦК, определяемая изменением состояния вен, предположительно составляет примерно 500-700 мл у взрослого человека (А.Д.Ташенов, В.В.Чурсин, 2009г.). Мнение, что венозная система может вместить, кроме ОЦК, еще 7-10 литров жидкости, можно считать ошибочным, так как излишняя жидкость достаточно быстро перемещается в интерстиций. Депо ОЦК в организме является интерстициальное пространство, резервная-мобильная емкость которого составляет примерно ещё 1 литр. При патологии интерстиций способен принять около 5-7 литров жидкости без формирования внешне видимых отеков (А.Д.Ташенов, В.В.Чурсин, 2009г.).
Особенностью интерстициальных отеков при некорректной инфузионной терапии является то, что жидкость при быстром поступлении в организм прежде всего уходит в наиболее «мягкие» ткани - мозг, легкие и кишечник.
Последствием этого является наиболее наблюдаемые недостаточности - церебральная, дыхательная и кишечная.
Физиологи на сегодняшний день считают, что практически у среднего человека номинальной величиной ОЦК принимается 5 литров или 5000 см 3 . В ОЦК различают две составных части: объем заполнения (U) и объем растяжения (V) сосудистой системы. U составляет 3300 см., V составляет 1700 см 3 . Последний, объем растяжения имеет непосредственное отношение к давлению крови и скорости объемного потока крови в сосудах.
Избыточная, особенно быстрая, инфузия растворов ведет к увеличению объема, прежде всего в сосудах легких, чем в других органах. При быстрой инфузии, особенно крупномолекулярных растворов (декстраны, ГЭК, СЗП, альбумин) жидкость не успевает переместиться в интерстиций, и при этом жидкость депонируется в первую очередь в легочных венах. Имеются сведения о том, что легочные вены могут дополнительно вместить еще примерно 53% общего легочного объема крови. При дальнейшей избыточной инфузии в действие вступает рефлекс Китаева. При этом рефлексе импульсы с рецепторов перерастянутых легочных вен, возбуждающе действуя на мускулатуру легочных артериол, суживают их, предотвращая таким образом переполнение легочных венозных сосудов.
Из-за спазма легочных артериол при дальнейшей избыточной инфузии наступает объемная перегрузка правых отделов сердца, в первую очередь правого желудочка. При его чрезмерной перегрузке в действие вступает рефлекс Ярошевича. Импульсы с рецепторов легочных артерий, возбуждающе действуя на мускулатуру в устьях полых вен, суживают их, предотвращая таким образом переполнение правых отделов сердца.
Здесь граница, за которой далее приспособление может перейти в патологию. В случае продолжения избыточной инфузии - вследствие избыточного давления в правом предсердии и его перерастяжения возникают следующие условия.
Во-первых ухудшается отток в правое предсердие значительной части крови из коронарных вен. Затруднение оттока по коронарным венам приводит к затруднению притока крови по коронарным артериям и доставки кислорода к миокарду (боль в области сердца).
Во-вторых, может возникнуть рефлекс Бейнбриджа (подробнее - раздел регуляции кровообращения), он вызывает тахикардию, которая всегда увеличивает потребность миокарда в кислороде.
У лиц со скрытой коронарной недостаточностью (что почти никогда не выявляется у больных перед операцией из-за недостаточного обследования) и у лиц с явной ишемической болезнью сердца (ИБС) все это может обусловить возникновение острой коронарной недостаточности вплоть до возникновения острого инфаркта миокарда (ОИМ) с дальнейшим развитием острой сердечной лево-желудочковой недостаточности (ОСЛН).
Если компенсаторные возможности коронарного кровообращения не скомпрометированы и не реализуется рефлекс Бейнбриджа, то дальнейшая объемная перегрузка приводит к растяжению полых вен. При этом с рецепторов, расположенных в устьях полых вен, импульсация поступает к центрам осморегуляции в гипоталамусе (супраоптическое ядро). Уменьшается секреция вазопрессина, приводящая к полиурии (выделению мочи более 2000 мл/сут), что отмечается утром дежурным врачом (и, как правило, безотчётливо) - больной спасает себя. Хорошо, если у больного регуляция водного баланса не нарушена и почки функционируют, в противном случае больной будет «утоплен» с благими намерениями.
Не затрагивая вопросов о «хроническом» уменьшении ОЦК, когда это обусловлено хроническим уменьшением потребления жидкости, коснемся вопроса уменьшения ОЦК, обусловленного именно острой кровопотерей, с чем чаще всего имеют дело врачи анестезиологи-реаниматологи.
По современным представлениям отмечаются следующие приспособительные изменения функции сердечно-сосудистой системы.
Когда ОЦК снижается на 10-20%, то такая кровопотеря представляется компенсируемой. При этом первой приспособительной реакцией является уменьшение емкости венозных сосудов за счёт сдавления их окружающими тканями. Вены из округлых становятся сплющенными или почти полностью спадаются, и таким образом емкость сосудов приспосабливается к изменившемуся объему циркулирующей крови. Венозный приток крови к сердцу и его УО поддерживаются на прежнем уровне. Компенсаторную реакцию организма можно сравнить с ситуацией, когда содержимое неполной 3-х литровой банки переливают в 2-х литровую и она оказывается полной.
Компенсаторным механизмом является и перемещение жидкости из интерстиция за счёт уменьшения венозного давления и увеличения скорости кровотока (укорочения времени изгнания даже без развития тахикардии) - жидкость как бы засасывается из интерстиция. Этот компенсаторный механизм можно наблюдать у доноров при донации, когда экстракция 500 мл крови не приводит к каким-либо изменениям кровообращения.
С уменьшением ОЦК до 25-30% (а это уже потеря растягивающей части ОЦК - V) кровопотеря представляется не компенсируемой за счёт критического уменьшения ёмкости венозной системы. Начинает уменьшаться венозный приток к сердцу и страдает УО. При этом развивается приспособительная (компенсаторная) тахикардия. Благодаря ей поддерживается достаточный уровень сердечного выброса (СВ за минуту = МСВ) за счёт уменьшенного УО и более частых сердечных сокращений. Одновременно с тахикардией развивается сужение периферических артериальных сосудов - централизация кровообращения. При этом ёмкость сосудистой системы значительно уменьшается, подстраиваясь под уменьшенный ОЦК. При сниженном УО и суженных периферических артериальных сосудах поддерживается достаточный уровень среднего артериального давления (АДср) в сосудах, направляющих кровь к жизненно важным органам (мозг, сердце и лёгкие). Именно от величины АДср зависит степень перфузии того или иного органа. Таким образом, развивается приспособительная централизация кровообращения за счет уменьшения кровоснабжения периферических тканей (кожа, скелетные мышцы и т.д.). Эти ткани могут переживать ишемию (I фазу нарушения микроциркуляции) и кислородную недостаточность в течение более продолжительного времени.
Эта реакция аналогична процессу воспаления, при котором организм, образуя грануляционный вал и отторгая омертвевшее, жертвует частью во имя сохранения целого.
Когда ОЦК снижается более чем на 30-40% и восполнение кровопотери задерживается, то такая кровопотеря переходит в разряд некомпенсированной и может стать необратимой. При этом несмотря на тахикардию, СВ уменьшается и снижается АДср. Из-за недостаточного транспорта кислорода в организме усиливается метаболический ацидоз. Недоокисленные продукты метаболизма парализуют прекапиллярные сфинктеры, но периферический кровоток не восстанавливается из-за сохраняющегося спазма посткапиллярных сфинктеров.
Развивается II фаза нарушений микроциркуляции - застойной гипоксии. При этом за счёт ацидоза повышается проницаемость капилляров - плазматическая жидкость уходит в интерстиций, а форменные элементы начинают сладжироваться, образуя микротромбы - развивается ДВС-синдром. К моменту, когда на фоне нарастающего ацидоза парализуются и посткапиллярные сфинктеры (III фаза нарушений микроциркуляции) капиллярное русло уже необратимо блокировано микротромбами.
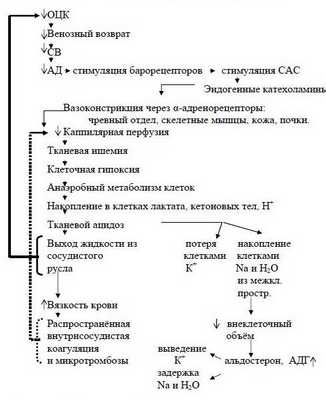
Наступает несостоятельность тканевой перфузии. Во всех случаях затянувшегося синдрома малого СВ присоединяется преренальная анурия. Всё это клиническая форма шока с классической триадой: синдром сниженного СВ, метаболический ацидоз, преренальная анурия. При этом во многих органах, как отмечает профессор Г.А.Рябов, "наступают необратимые изменения и даже последующее восполнение кровопотери и восстановление ОЦК не всегда предотвращает смертельный исход из-за осложнений, связанных с необратимыми изменениями в некоторых органах" - развивается полиорганная недостаточность (ПОН) или мультиорганная дисфункция (МОД).
Последовательность в нарушениях гомеостаза при кровопотере схематически представлена на рисунке 2 (Р.Н.Лебедева и сотр., 1979 г.).
Таким образом, при абсолютном снижении ОЦК практически любого происхождения границей перехода приспособления в декомпенсацию является увеличение частоты сердечных сокращений (ЧСС) с одновременным снижением СВ и АДср.
Данное положение не применимо к случаям, когда имеется относительное уменьшение ОЦК за счет патологической вазодилятации.
Следует учитывать и то, что очень часто острая кровопотеря сопровождается болью и это вносит разлад в последовательность компенсаторных механизмов - раньше чем нужно и в большем количестве выбрасываются эндогенные катехоламины. Централизация развивается быстрее и времени на спасение больного остается меньше.
Закон поддержания постоянства рН. Компенсаторные механизмы pH плазмы и эритроцитов
1 ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России

3. Гусев Г.П. Роль почки в регуляции кислотно-щелочного баланса // Физиология почки: Руководство по физиологии. - Л., 1972. - С. 142-168.
4. Жалко-Титаренко В.Ф. Водно-электролитный обмен и кислотно-основное состояние в норме и патологии. - Киев, 1989.
6. Лосев Н.И., Войнов В.А. Физико-химический гомеостаз организма // Гомеостаз / Под ред. П.Д. Горизонтова. - М., 1981. - С. 186-240.
7. Малышев В.Д. Кислотно-основное состояние и водно-электролитный баланс в интенсивной терапии: Учебное пособие. - М.: ОАО «Издательство «Медицина», 2005. - 228 с.
9. Тавс Г. Газы крови и кислотно-щелочное равновесие // Физиология человека. Т.3 / Под ред. Р. Шмидта и Г. Тавса. - М., 1986. - С. 241-268.
10. Хейтц У., Горн М. Водно-электролитный и кислотно-основный баланс: краткое руководство. - М.: БИНОМ. Лаборатория знаний, 2009. - 359 с.
11. Хруска К. Патофизиология кислотно-основного обмена // Почки и гомеостаз в норме и патологии. - М., 1987. - С. 170-216.
Кислотно-основное состояние (КОС) организма является одним из важнейших и наиболее строго стабилизируемых параметров гомеостаза. От соотношения водородных и гидроксильных ионов во внутренней среде организма зависят активность ферментов, гормонов, интенсивность и направленность окислительно-восстановительных реакций, процессы обмена белков, углеводов и жиров, функции различных органов и систем, постоянство водного и электролитного обмена, проницаемость и возбудимость биологических мембран и т.д. Активность реакции среды влияет на способность гемоглобина связывать кислород и отдавать его тканям.
Активную реакцию среды принято оценивать по содержанию в жидкостях ионов водорода.
Величина рН является одним из самых «жестких» параметров крови и колеблется у человека в норме в очень узких пределах - рН артериальной крови составляет 7,35-7,45; венозной - 7,32-7,42. Более значительные изменения рН крови связаны с патологическими нарушениями обмена. В других биологических жидкостях и в клетках рН может отличаться от рН крови.
Сдвиги рН крови за указанные границы приводят к существенным сдвигам окислительно-восстановительных процессов, изменению активности ферментов, прницаемости биологических мембран, обусловливают нарушения со стороны функции сердечно-сосудистой, дыхательной и других систем; сдвиг на 0,3 может вызвать коматозные состояния, а на 0,4 - зачастую несовместим с жизнью.
Кислотно-основное состояние поддерживается мощными гомеостатическими механизмами. В их основе лежат особенности физико-химических свойств буферных систем крови и физиологические процессы, в которых принимают участие системы внешнего дыхания, почки, печень, желудочно-кишечный тракт и др.
Химические буферные системы образуют первую линию защиты против изменений рН жидкости организма, действуют для быстрого их предотвращения.
Буферной системой называют смеси, которые обладают способностью препятствовать изменению рН среды при внесении в нее кислот или оснований. Буферные системы не удаляют H+ из организма, а «связывают» его своим щелочным компонентом до окончательного восстановления КОС. Буферными свойствами обладают смеси, которые состоят из слабой кислоты и ее соли, содержащей сильное основание, или из слабого основания и соли сильной кислоты.
Наиболее емкими буферными системами крови являются бикарбонатный, фосфатный, белковый и гемоглобиновый. Первые три системы особенно важную роль играют в плазме крови, а гемоглобиновый буфер, самый мощный, действует в эритроцитах.
Бикарбонатный буфер является наиболее важной внеклеточной буферной системой и состоит из слабой угольной кислоты Н2СО3 и соли ее аниона - сильного основанияВ нормальных условиях (при рН крови около 7,4) в плазме бикарбоната в 20 раз больше, чем углекислоты.
Емкость бикарбонатной системы составляет 53 % всей буферной емкости крови. При этом на бикарбонат плазмы приходится 35 % и на бикарбонат эритроцитов 18 % буферной емкости.
При образовании в плазме избытка кислореагирующих продуктов ионы водорода соединяются с анионами бикарбоната ( Бикарбонатный буфер способен нейтрализовать и избыток оснований. В этом случае ионы ОНˉ будут связаны углекислотой и вместо самого сильного основания ОНˉ образуется менее сильноеДо тех пор, пока количество угольной кислоты и бикарбоната натрия изменяется пропорционально и соотношение между ними сохраняется 1:20, рН крови остается в пределах нормы.
Фосфатный буфер представлен солями одно- и двузамещенных фосфатов. Фосфатная буферная система обеспечивает 5 % буферной емкости крови, является основной буферной системой клеток.
Однозамещенная соль обладает кислыми свойствами, так как при диссоциации дает ион ; . Двузамещенный фосфат обладает свойствами основания, так как диссоциирует с образованием иона + Н+ ⇒При нормальном рН в плазме соотношение фосфатных солей NаН2РО4: Nа2НРО4 = 1:4. Этот буфер имеет значение в почечной регуляции КОС, а также в регуляции реакции некоторых тканей. В крови же его действие главным образом сводится к поддержанию постоянства и воспроизводства бикарбонатного буфера.
Белковая буферная система является довольно мощным буфером, который способен проявлять свои свойства за счёт амфотерности белков. Белковая буферная система обеспечивает 7 % буферной емкости крови. Белки плазмы крови содержат достаточное количество кислых и основных радикалов, поэтому эта буферная система действует в зависимости от среды, в которой происходит диссоциация белков.
Гемоглобиновый буфер является самой емкой буферной системой. На ее долю приходится до 75 % всей буферной емкости крови. Свойства буферной системы гемоглобину придает главным образом его способность постоянно находиться в виде двух форм - восстановленного (редуцированного) гемоглобина ННb и окисленного (оксигемоглобина) НbО2.
Гемоглобиновый буфер, в отличие от бикарбонатного, в состоянии нейтрализовать как нелетучие, так и летучие кислоты. Окисленный гемоглобин ведёт себя как кислота, увеличивая концентрацию ионов водорода, а восстановленный (дезоксигенированный) - как основание, нейтрализуя H+.
Гемоглобин является классическим примером белкового буфера и эффективность его достаточно высока. Гемоглобин в шесть раз более эффективен как буфер, чем плазменные протеины.
Переход окисленной формы гемоглобина в восстановленную форму предупреждает сдвиг рН в кислую сторону во время контакта крови с тканями, а образование оксигемоглобина в легочных капиллярах предотвращает сдвиг рН в щелочную сторону за счет выхода из эритроцитов СО2 и иона хлора и образования в них бикарбоната.
Система аммиак/ион аммония (NH3/NH4+) - действует преимущественно в моче.
Помимо буферных систем в поддержании постоянства рН активное участие принимают физиологические системы, среди которых основными являются легкие, почки, печень, желудочно-кишечный тракт.
Система дыхания играет значительную роль в поддержании кислотно-щелочного баланса организма, однако для нивелирования сдвига рН крови им требуется 1-3 минуты. Роль легких сводится к поддержанию нормальной концентрации углекислоты, и основным показателем функционального состояния легких является парциальное напряжение углекислого газа в крови. Легочные механизмы обеспечивают временную компенсацию, так как при этом происходит смещение кривой диссоциации оксигемоглобина влево и уменьшается кислородная емкость артериальной крови.
При устойчивом состоянии газообмена легкие выводят углекислого газа около 850 г в сутки. Если напряжение углекислого газа в крови повышается сверх нормы на 10 мм рт. ст., вентиляция увеличивается в 4 раза.
Роль почек в регуляции активной реакции крови не менее важна, чем деятельность дыхательной системы. Почечный механизм компенсации более медленный, чем респираторный. Полноценная почечная компенсация развивается только через несколько дней после изменения pH.
Экскреция кислот при обычной смешанной пище у здорового человека превышает выделение оснований, поэтому моча имеет кислую реакцию (рН 5,3-6,5) и концентрация в ней ионов водорода примерно в 800 раз выше, чем в крови. Почки вырабатывают и выделяют с мочой количество ионов водорода, эквивалентное их количеству, непрерывно поступающему в плазму из клеток организма, совершая при этом замену ионов водорода, секретируемых эпителием канальцев, на ионы натрия первичной мочи. Этот механизм осуществляется с помощью нескольких химических процессов.
Первым из них является процесс реабсорбции натрия при превращении двузамещенных фосфатов в однозамещенные. При истощении фосфатного буфера (при рН мочи ниже 4,5) реабсорбция натрия и бикарбоната осуществляется за счет аммониогенеза.
Второй процесс, который обеспечивает задержку натрия в организме и выведение излишка ионов водорода, - это превращение в просвете канальцев бикарбонатов в угольную кислоту.
Третьим процессом, который способствует сохранению натрия в организме, является синтез в дистальных почечных канальцах аммиака (аммониогенез) и использование его для нейтрализации и выведения кислых эквивалентов с мочой.
Образовавшийся свободный аммиак легко проникает в просвет канальцев, где, соединяясь с ионом водорода, превращается в плохо диффундирующий аммонийный катионВ общем итоге концентрация водородных ионов в моче может превышать концентрацию водородных ионов в крови в несколько сотен раз.
Это свидетельствует об огромной способности почек выводить из организма ионы водорода.
Почечные механизмы регуляции КОС не могут скорректировать рН в течение нескольких минут, как респираторный механизм, но они функционируют в течение нескольких дней, пока рН не вернется к нормальному уровню.
Регуляция КОС с участием печени. Печень окисляет до конечных продуктов недоокисленные вещества крови, оттекающей от кишечника; синтезирует мочевину из азотистых шлаков, в частности из аммиака и из хлорида аммония, поступающих из желудочно-кишечного тракта в кровь портальной вены; печени присуща выделительная функция и поэтому при накоплении в организме избыточного количества кислых или щелочных продуктов метаболизма они могут выделяться с желчью в желудочно-кишечный тракт. При избытке кислот в печени усиливается их нейтрализация и одновременно тормозится образование мочевины. Неиспользованный аммиак нейтрализует кислоты и увеличивает выведение аммонийных солей с мочой. При возрастании количества щелочных валентностей мочекинообразование возрастает, а аммониогенез снижается, что сопровождается уменьшением выведения с мочой аммонийных солей.
Концентрация водородных ионов в крови зависит также от деятельности желудка и кишечника. Клетки слизистой желудка секретируют соляную кислоту в очень высокой концентрации. При этом из крови ионы хлора выделяются в полость желудка в соединении с ионами водорода, образующимися в эпителии желудка с участием карбоангидразы. Взамен хлоридов в плазму в процессе желудочной секреции поступает бикарбонат.
Поджелудочная железа активно участвует в регуляции рН крови, так как она генерирует большое количество бикарбоната. Образование бикарбоната тормозится при избытке кислот и усиливается при их недостатке.
Кожа может в условиях избытка нелетучих кислот и оснований выделять последние с потом. Это имеет особое значение при нарушении функции почек.
Костная ткань. Это наиболее медленно реагирующая система. Механизм ее участия в регуляции рН крови состоит в возможности обмениваться с плазмой крови ионами Са2+ и Na+ в обмен на протоны Н+. Происходит растворение гидроксиапатитных кальциевых солей костного матрикса, освобождение ионов Са2+ и связывание ионов НРО42- с Н+ с образованием дигидрофосфата, который уходит с мочой. Параллельно при снижении рН (закисление) происходит поступление ионов H+ внутрь остеоцитов, а ионов калия - наружу.
Оценка кислотно-основного состояния организма
При изучении кислотно-щелочного баланса наибольшее значение имеет исследование крови. Показатели в капиллярной крови близки к показателям артериальной. В настоящее время показатели КОС определяют эквилибрационным микрометодом Аструпа. Данная методика позволяет, помимо истинного рН крови, получить показатель напряжения СО2 в плазме (рСО2), истинный бикарбонат крови (АВ), стандартный бикарбонат (SB), сумму всех оснований крови (ВВ) и показатель дефицита или избытка оснований (ВЕ).
Кислотно-щелочной баланс: 8 шагов, и вы на коне!
Анализ кислотно-щелочного состояния / равновесия / баланса (кому как больше нравится) является неотъемлемой частью быстрой оценки тяжести состояния пациента при различных патологиях. Поэтому широкое и абсолютно оправданное внедрение в клиническую практику анализа кислотно-основного равновесия и газового состава крови диктует необходимость обеспечить информационную поддержку по данной проблеме.
Первое знакомство с данной темой происходит еще на 3 курсе медицинского университета на кафедре патологической физиологии, но обычно она проходится «галопом по Европам», и на выходе при первой реальной встрече с данными, касающимися оценки кислотно-щелочного состояния (КЩС) и газового состава крови, возникает проблема. Данная информация не претендует на новаторство, однако может быть полезна как студентам, осваивающим эту тему, так и при повторении уже закончившим университет специалистам различных специальностей.
Пару вступительных слов… Что же относится к нарушениям КЩС?
Расстройства кислотно-основного равновесия (КОР) — это нарушения физико-химического гомеостаза. Кислотно-основное равновесие определяется соотношением ионов Н + и ОН - , влияющим на активность ферментов, интенсивность метаболических процессов, функции ряда органов, чувствительность рецепторов к медиаторам, проницаемость клеточных мембран. Расстройства КОР сопровождают практически все заболевания, поэтому аналогично другим видам нарушений обмена веществ относятся к типовым патологическим процессам.
Исследование газового состава артериальной крови включает определение в ней парциального давления кислорода (pO2) и углекислого газа (pCO2), рН, насыщения кислородом SaO2, концентрации HCO3.
Целями исследования газового состава крови являются:
- Оценка эффективности газообмена в легких;
- Оценка сохранности системы, регулирующей функцию дыхания;
- Определение кислотно-щелочного равновесия (КЩР) крови;
- Оценка эффективности респираторной поддержки.
Приступим непосредственно к анализу представленных вам данных. Для быстроты оценки изменений газового состава крови мы воспользуемся правилом из всеми известной игры «крестики-нолики».
Что нужно помнить для начала? Конечно же, нормы показателей. В нашем случае нас интересуют три показателя:
- рН (7,35-7,45);
- рСО2 (45-35 мм рт. ст.);
- уровень HCO3 (22-26 ммоль/л).
NB! Напомним, что:
- Ацидоз — это типовой патологический процесс, характеризующийся относительным или абсолютным понижением pH;
- Алкалоз — это типовой патологический процесс, характеризующийся относительным или абсолютным увеличением pH.
Следующим пунктом следует оценить парциальное давление углекислого газа в крови (рСО2) и концентрацию в ней бикарбонатов. Это позволит вам понять возможный тип нарушения кислотно-щелочного равновесия и характер компенсации процесса.
Ответьте для себя на вопрос: «Что является причиной сдвигов pH крови?»
NB! Напомним, что:
- рСО2 отражает респираторный компонент изменения рН, напрямую или косвенно связанный с нарушением функции легких;
- НСО3 отражает метаболический компонент изменения рН, включающий в себя нарушения работы буферных систем или функции физиологических систем, а также нарушения метаболизма в том или ином виде, приводящие к накоплению кислот.
Для наилучшего запоминания взаимозависимости изменений рН, рСО2 и концентрации HCO3 можно применять мнемоническое правило RO-ME:

Respiratory — Opposite (значение рН противоположно показателю рСО2):
- Когда рН увеличивается, рСО2уменьшается = респираторный алкалоз;
- Когда рН уменьшается, рСО2увеличивается = респираторный ацидоз.
Metabolic — Equal (значение рН изменяется синхронно с показателем изменения концентрации HCO3):
- Когда рН увеличивается, НСО3увеличивается = метаболический алкалоз;
- Когда рН уменьшается, НСО3уменьшается = метаболический ацидоз.
Постарайтесь внимательно и вдумчиво понять зависимость показателей, которые мы используем. Это поможет вам максимально быстро расшифровывать изменения газового состава крови.
Перейдем непосредственно к игре «крестики-нолики». Рисуете на листке бумаге сетку 3×3, как показано на рисунке ниже. Как мы видим, верхняя строка отражает тип нарушения КЩР.

Теперь обратимся, к примеру, к этим данным, полученным при исследовании газового состава крови пациента К., 35 лет:
pH: 7,26, pCO2: 32 мм рт. ст., HCO3: 18 ммоль/л
Начнем заполнять нашу сетку (прим. — нормальные показатели представлены в начале данного поста). Как мы видим, показатели рН и HCO3 смещаются в сторону ацидоза (Acidic), а показатель рСО2 — в сторону алкалоза (Basic).
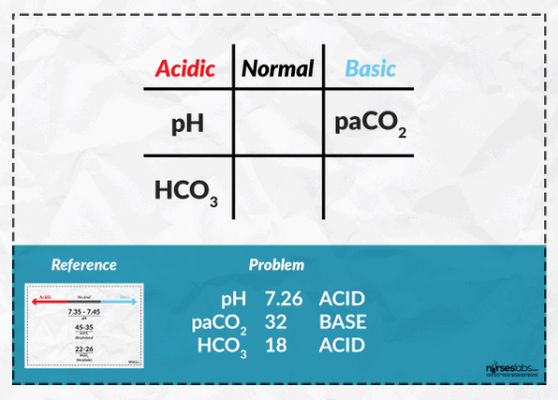
Итак, один вертикальный ряд закрыт! Заполнены все клетки столбца «Acidic». Так как HCO3 является метаболическим компонентом, значит, данный тип изменения КЩР — метаболический ацидоз (для самопроверки не забываем про правило RO-ME).
Рассмотрим другой пример. Пациент Г., 47 лет:
pH: 7,52, pCO2: 55 мм рт. ст., HCO3: 32 ммоль/л
Как мы видим, показатели рН и НСО3 смещаются в сторону алкалоза, а показатель рСО2 — в сторону ацидоза.

Итак, один вертикальный ряд закрыт! Заполнены все клетки столбца «Alkalosis». Так как HCO3 является метаболическим компонентом, значит, данный тип изменения КЩР — метаболический алкалоз (для самопроверки не забываем про правило RO-ME).
Рассмотрим другой пример. Пациент О., 56 лет:
pH: 7,29, pCO2: 36 мм рт. ст., HCO3: 17 ммоль/л
В этом случае показатели рН и HCO3 смещаются в сторону ацидоза, а показатель pCO2 находится в пределах референсных значений.
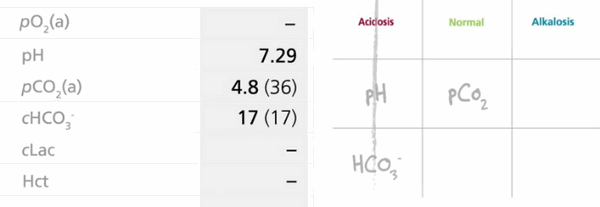
Итак, один вертикальный ряд закрыт! Заполнен весь столбец «Acidosis». Так как HCO3 является метаболическим компонентом, то данный тип изменения КЩР — метаболический ацидоз (для самопроверки не забываем про правило RO-ME).
Теперь коснемся вопроса о компенсации изменений КЩР. Ацидоз/алкалоз может быть компенсированным, субкомпенсированным или декомпенсированным. Компенсированные формы связаны с сохранением жизнедеятельности клетки, в то время как некомпенсированные формы вызывают нарушения функции клетки. Показателем компенсации является величина рН артериальной крови.
NB! Запомните правило:
- Если рН находится в пределах нормы, а показатели pCO2 и HCO3 — нет = компенсация;
- Если рН находится за пределами нормы (в любую из сторон), а pCO2и HCO3 также вне пределов нормы = субкомпенсация (прим. — изменены все три показателя);
- Если рН находится за пределами нормы (в любую из сторон), pCO2или HCO3 также вне пределов нормы = декомпенсация (прим. — изменены только два из трех показателей).
Вернемся к нашим примерам:
Пример 1. Как мы выяснили, у нашего больного К., 35 лет, произошло изменение КЩР по типу метаболического ацидоза. Вспоминаем про правило выше. Все три показателя находятся вне пределов референсных значений, что свидетельствует о частичной компенсации. По итогу мы имеем: «Метаболический ацидоз с частичной компенсацией».
Пример 2. В этом случае у больного Г., 47 лет, произошло изменение КЩР по типу метаболического алкалоза. Все три показателя находятся вне пределов референсных значений, что свидетельствует о частичной компенсации. По итогу мы имеем: «Метаболический алкалоз с частичной респираторной компенсацией».
Пример 3. По имеющимся данным можно сделать вывод, что у нашего больного О., 56 лет, произошло изменение КЩР по типу метаболического ацидоза. Действуем по вышеуказанному правилу: только два показателя находятся за пределами своих нормальных значений (рН, HCO3), из чего следует диагноз: «Метаболический ацидоз, декомпенсированный».
И еще один пример для закрепления. Пациент И., 63 года:
pH: 7,44, pCO2: 30 мм рт. ст., HCO3: 21 ммоль/л
Казалось бы, выше мы говорили о том, что степень компенсации КЩР определяется на основании уровня рН. Что же мы видим? рН находится в пределах референсных значений, что наводит нас на мысль о том, что организм уже победил данное патологическое изменение КЩР. Но нам требуется узнать первопричину его изменения.
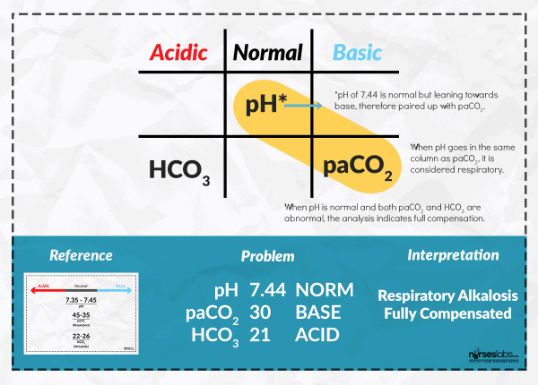
Хоть рН и находится в пределах нормы (рН: 7,44), но все же он является «слегка щелочным». По итогу условно примем, что показатель рН смещен больше в сторону столбца «Basic», а значит у данного больного изначально развился «респираторный алкалоз». Смещение показателя HCO3 в сторону столбца «Acidic» свидетельствует о том, что организм смог включить компенсаторный механизм и привести рН в пределы нормальных значений. По итогу в данном случае мы имеем: «Респираторный алкалоз, компенсированный».
Для закрепления вышеизложенной информации предлагаем вам посмотреть следующие видео:
Также для быстрой оценки нарушений КЩС можно использовать номограмму Siggaard-Andersen:
1 ГБОУ ВПО «Саратовский Государственный медицинский университет им. В.И. Разумовского Минздрава России»

2. Нормальная физиология: учебник [Н.А. Агаджанян, Н.А. Барабаш, А.Ф. Белов и др.] / Под ред. проф. В.М. Смирнова. - 3-е изд. - М.: Издательский центр «Академия», 2010. - 480 с.
3. Физиология человека / В.Ф. Киричук, О.Н. Антипова, Н.Е. Бабиченко, В.М. Головченко, Е.В. Понукалина, И.В. Смышлеева, Л.К. Токаева / Под ред В.Ф. Киричука. 2-е изд. - Саратов: Изд-во Саратовского медицинского университета, 2009. - 343 с.
4. Физиология и патофизиология красной крови: учеб. пособие / Н.П. Чеснокова, В.В. Моррисон, Е.В. Понукалина, Т.А.Невважай; под общ. ред. проф. Н.П. Чесноковой. - Саратов: Изд-во Сарат. мед. ун-та, 2013. - 80 с.
5. Патофизиология крови. Пер. с англ. - М. - СПб.: «Издательство БИНОМ» - «Невский Диалект», 2000. - 448 с., ил.
6. Механизмы развития болезней и синдромов / А.Ш. Зайчик, Л.П. Чурилов. Книга 1-я: учебник для студентов медицинских вузов. - СПб., 2007, ЭЛБИ. - 507 с.
7. Гематологический атлас. С.. Луговская, М.Е. Почтар. 3-е изд. - Москва - Тверь: ООО «Изд-во Триада», 2011. - С. 3-23.
8. Клеточные и молекулярные механизмы регуляции системы гемостаза в норме и патологии: монография / Б.И. Кузник. - Чита: Экспресс-издательство, 2010. - С. 261-368.
9. Гематология / Под ред проф. О.А. Рукавицына, А.Д. Павлова, Е.Ф. Морщаковой и др. - Изд-во СПб.: ООО «Д.П.», 2007. - С. 29-34.
Эритропоэз и механизмы его регуляции
В эмбриональном периоде кроветворение осуществляется вначале в кровяных островках желточного мешка, затем примерно спустя 5 недель эмбрионального развития - в печени. Селезенка включается в процесс кроветворения с 16 недели внутриутробного развития. Первые гемопоэтические элементы появляются в костном мозге на 2-ом месяце эмбрионального развития, однако миелоидный период кроветворения начинается на 4-5-м месяцах эмбрионального развития, вытесняя постепенно кроветворение в печени и селезенке. Костномозговой эритропоэз осуществляется вне синусов, в строме костного мозга, то есть эктраваскуляторно. К моменту рождения ребенка костный мозг развивается полностью, а экстрамедуллярное кроветворение практически завершается. Постэмбриональный период кроветворения начинается после рождения ребенка и продолжается на протяжении всей жизни. Гемопоэз осуществляется в специализированных гемопоэтических тканях: миелоидной (эпифизы трубчатых костей и полости многих губчатых костей) и лимфоидной (тимус, селезенка, лимфатические узлы). В миелоидной ткани образуются эритроциты, лейкоциты, тромбоциты. В лимфоидной ткани идет дальнейшая дифференцировка и созревание лимфоцитов, а также плазматических клеток - основных продуцентов антител.
Постэмбриональный гемопоэз обеспечивает процессы физиологической регенерации крови, то есть её обновление, что компенсирует физиологические процессы разрушения дифференцированных клеток крови.
В условиях нормы функциональная активность органов кроветворения и кроверазрушения строго сбалансирована, что обеспечивает относительное постоянство содержания эритроцитов и других клеток в периферической крови. Разрушение эритроцитов происходит примерно после 120-дневного пребывания их в системной циркуляции при участии тканевых макрофагов селезенки, лимфатических узлов, печени. Гемоглобин, освобождающийся в процессе распада эритроцитов, трансформируется в билирубин в клетках моноцитарно-макрофагальной системы, а затем в гембилирубин (непрямой билирубин), вступая во взаимодействие с белками крови или липопротеидами. Гембилирубин в свою очередь элиминируется из системного кровотока печеночными клетками, где превращается в прямой билирубин (соединение билирубина с глюкуроновой кислотой). Прямой билирубин вместе с желчью поступает в кишечник, постепенно превращается в другие желчные пигменты (стеркобилиноген, уробилиноген) которые, выделяясь с калом и мочой, придают им окраску. При внутриклеточном разрушении эритроцитов основным продуктом, образующимся после распада гемоглобина, является билирубин, а при внутрисосудистом гемолизе большие количества гемоглобина соединяются с α2-гликопротеином-гаптоглобином, который не проникает в мочу.
Основным регулятором эритропоэза является эритропоэтин - гликопротеид, интенсивно вырабатывающийся в условиях гипоксии. При гипоксических состояниях различного генеза концентрация эритропоэтина возрастает в десятки раз по сравнению с нормой. Основным источником синтеза эритропоэтина являются почки (до 90 %), печень (около 10 %), а также макрофаги костного мозга и селезенки. Для эритропоэтина характерен мембранный тип рецепции эритропоэтинчувствительными клетками костного мозга с последующими активацией митоза и дифференцировки клеток, в частности, стимуляцией транспорта железа в эритрокариоцитах, синтеза цепей глобина, ферментов образования гема, синтеза мембранных белков и эритроцитарных антигенов.
Эритропоэз стимулируется под влиянием катехоламинов, глюкокортикоидов, андрогенов, гормонов щитовидной железы, инсулина, плацентарного пролактина, ИЛ-3, ИЛ-6, ИЛ-9, ИЛ-11, КСФ, фолиевой кислоты, витаминов С, В12, железосодержащих препаратов.
Эритропоэз угнетается при повышенной оксигенации тканей, когда снижается образование эритропоэтина, а также под влиянием эстрогенов, глюкагона, ацетилхолина, интерферонов, ФНО-а, ИЛ-1, ИЛ-5, эритроцитарных кейлонов.
После рождения у ребенка в течение нескольких дней отмечают эритроцитоз - содержание эритроцитов составляет 5,5⋅1012/л, в то же время имеется высокое содержание гемоглобина (156-200 г/л). В течение первого года жизни изменяется антигенная структура эритроцитов, возникает прогрессирующее снижение фетального гемоглобина. К концу первого года жизни содержание фетального гемоглобина не превышает 1 %.
Общая характеристика эритроцитов
Эритроциты - самая многочисленная популяция клеток крови, обладающих разнообразными функциями, в частности дыхательной, трофической, детоксицирующей. Количество эритроцитов довольно вариабельно в условиях нормы: так, у женщин оно колеблется от 3,7⋅1012/л до 4,7⋅1012 /л, а у мужчин - от 4,5⋅1012/л до 5,5⋅1012 /л. Сдвиг этих показателей до нижней или верхней границы нормы может быть одним из признаков болезни.
Около 85 % всех эритроцитов имеют форму двояковогнутого диска, то есть являются дискоцитами. Форма эритроцита определяет цепь ауторегулирующих процессов, направленных на поддержание движения крови, её реологических свойств. В условиях патологии появляются эритроциты различной формы, такие состояния именуют пойкилоцитозом. Среди аномальных по форме эритроцитов различают овалоциты, аннулоциты, сфероциты, акантоциты, стоматоциты, щизоциты и другие формы, имеющие в ряде случаев определённое диагностическое значение.
Обычная в условиях нормы форма дискоцита значительно увеличивает площадь диффузии газов, электролитов и других субстратов. Средний диаметр эритроцита (нормоцита) в области краёв составляет 7,5 мкм, а максимальная толщина эритроцита в области краёв составляет 2 мкм. Эритроциты с диаметром от 2 до 6 мкм - микроциты, а с диаметром от 9 до 16 мкм - макроциты. Количество макро- и микроцитов в крови здорового человека в среднем составляет 15-20 %. Резкое увеличение содержания в крови микро- и макроцитов, именуемое анизоцитозом, является одним из признаков нарушения гемопоэза, характерным для анемий, лейкоцитозов, заболеваний инфекционно-аллергической природы. За время свой жизни в периферической крови эритроцит совершает кругооборот более 1 млн. раз, что вызывает развитие механических и метаболических изменений в эритроцитах. Эритроциты обладают пластичностью, то есть способностью к деформации при прохождении через узкие извитые капилляры диаметром 2,5-7,5 мкм. По мере старения их способность к деформации снижается, они застревают в капиллярах красной пульпы селезенки и там разрушаются в процессе фагоцитоза тканевыми макрофагами. Эластичность эритроцитов определяется особенностями структуры белка спектрина, гемоглобина, а также соотношением различных фракций липидов в мембране клеток.
Эритроциты играют важную роль в регуляции кислотно-основного состояния организма, в процессах свертывания крови и фибринолиза за счет адсорбции на их мембране разнообразных ферментных факторов этих систем. Эритроциты являются регуляторами водно-солевого обмена в связи со способностью депонировать воду и минеральные соли при нахождении их в венозной крови. Одной из главных функций эритроцитов является участие в иммунологических реакциях организма за счет наличия в мембранах эритроцитов комплекса полисахаридо-аминокислотных соединений, обладающих свойствами антигенов. Следует помнить, что суммарный объем эритроцитов приблизительно в 160 раз превышает таковой лейкоцитов и тромбоцитов, а потому кровь можно рассматривать как двухфазную систему, представляющую собой взвесь (суспензию) эритроцитов в плазме. При этом эритроцит подвергается в токе крови действию напряжения сдвига - оно более значительно у края и направлено в сторону стенки и менее выражено в центре сосуда. Разница действующих векторов силы у разных краёв обеспечивает вращательное движение эритроцитов в текущей жидкости, что при столкновении с тромбоцитами, имеющими меньший размер и худшую деформируемость по сравнению с эритроцитами, приводит к отбрасыванию кровяных пластинок к стенке сосуда. Благодаря этому пристеночный слой оказывается обогащенным тромбоцитами. Указанный эффект обусловлен величиной гематокрита, размером эритроцитов и тромбоцитов и ригидностью их мембран. Увеличение любого из указанных параметров сопровождается усилением передвижения кровяных пластинок к стенке сосуда, а при наличии повреждения эндотелия - адгезией к субэндотелию.
Буферные свойства эритроцитов. Как известно, на единицу объема эритроцит связывает в 60 раз большее количество О2, чем плазма крови. О2 хорошо растворим в воде, поэтому диффузия его в растворе происходит очень быстро. Связывание О2 с эритроцитами определяется парциальным давлением газа в плазме и сорбционными свойствами Нв. В капиллярах легких, где давление О2 высоко (рО2 = 133 гПа), высоко и сродство Нв к О2, что обеспечивает трансмембранный перенос газа и связывание его с гемоглобином. В капиллярах тканей, где рО2 равно 40-50 гПа, сродство Нв к О2 резко снижается. При этом происходит выход кислорода из эритроцитов.
Транспорт СО2 через мембрану эритроцита также осуществляется за счет диффузного давления (в капиллярах легких рСО2 = 53гПа, а в капиллярах тканей - 61 гПа). Диффузия СО2 в растворах происходит примерно в 20 раз быстрее, чем О2.
Высокая скорость равновесия содержания СО2 в системе эритроцит - плазма крови обеспечивается наличием в эритроцитах особого фермента - карбоангидразы, катализирующего реакции трансформации СО2 и Н2О в углекислоту (Н2СО3), а также мощными системами трансмембранного обмена анионами.
При понижении концентрации СО2 в эритроцитах возникает отрицательный заряд Нв, что приводит к уменьшению содержания внутриклеточной воды, а при увеличении содержания СО2 в эритроцитах - они набухают.
Известно, что осмотическое давление в эритроцитах несколько выше, чем в плазме крови, что связанно с высокой внутриклеточной концентрацией белков по сравнению с плазмой крови. При этом содержание низкомолекулярных осмотически активных веществ (ионов натрия) в эритроцитах значительно меньше, чем в плазме крови. Величина осмотического давления в эритроцитах обеспечивает достаточный или нормальный тургор этих клеток. Осмотическое давление плазмы и эритроцитов в условиях нормы находится в динамическом равновесии, что обуславливает стабильность структуры эритроцитов.
При помещении эритроцитов в коллоидно-осмотическую среду с более низким осмотическим давлением (гипотонические растворы) может наступить осмотический или коллоидно-осмотический гемолиз. Последний обусловлен тем, что вода поступает в эритроциты до того момента, пока не разрывается мембрана и гемоглобин выходит в окружающую среду.
В умеренногипотонической среде эритроциты приобретают сферическую форму, их называют в связи с этим сфероцитами. Способность эритроцитов сохранять свою структуру при развитии гипоосмотических состояний или в гипоосмотической среде получила название осмотической устойчивости, или резистентности эритроцитов. Верхняя граница резистентности или максимальная устойчивость эритроцитов соответствует примерно 0,5-0,4 % раствора хлорида натрия.
При помещении эритроцитов в гипертоническую среду происходит их сморщивание в связи с потерей воды и уменьшением объема.
Эритроцитам свойственна способность к оседанию. Удельная масса цельной крови в норме для взрослого составляет в среднем 1,05-1,06. Удельная масса эритроцитов (1,085-1,096) выше, чем плазмы крови (1,02-1,027), поэтому эритроциты в пробирке с кровью, лишенной возможности свертываться, способны медленно оседать на дно. Скорость оседания эритроцитов в значительной мере определяется белковым составом плазмы крови, в частности уровнем мелкодисперсных белков-альбуминов. В связи с этим важная роль в обеспечении величины СОЭ отводится соотношению альбуминово-глобулиновых фракций белков крови. СОЭ у мужчин в среднем составляет 1-10 мм/ч, у небеременных женщин 2-15 мм/ч. При некоторых патологических процессах и заболеваниях, а также во второй половине беременности СОЭ повышается, так как увеличивается содержание в крови грубодисперсных белков глобулиновой фракции, получивших название аггломеринов, а также за счет усиления образования фибриногена.
При замедлении скорости кровотока и повышении вязкости крови эритроциты проявляют способность к агрегации. Вначале агрегация носит обратимый характер, при этом образуются ложные агрегаты, или монетные столбики. В случае быстрого восстановления кровотока они распадаются на полноценные клетки с сохраненной мембраной и внутриклеточной структурой.
Пластичность или деформируемость - это способность эритроцитов к обратимой деформации при прохождении через узкие извитые капилляры, микропоры. Данное свойство определяется особенностями структуры мембраны эритроциты, наличием в ней особого белка спектрина.
Таким образом, основными физиологическими и физико-химическими свойствами эритроцитов являются следующие:
- способность к оседанию;
- способность к агрегации;
- деструкция после определенного периода циркуляции в кровотоке.
1. Дыхательная функция заключается в захвате и переносе кислорода к тканям и экскреции СО2 из организма. Это обеспечивается содержащимся в эритроцитах белком гемоглобином. Гемоглобин - сложный белок состоит из групп гема и белкового остатка - глобина. Содержание гемоглобина у мужчин составляет 130-160 г/л, у женщин 120-140 г/л.
2. Трофическая функция эритроцитов связана с их способностью транспортировать аминокислоты, нуклеотиды, пептиды к различным органам и тканям, способствуя обеспечению репаративных процессов. В ряде случаев эту функцию называют транспортной.
3. Детоксиксицирующая функция эритроцитов обусловлена их способностью адсорбировать токсические продукты эндогенного или экзогенного происхождения и частично инактивировать их.
4. Участие в процессах свертывания крови за счет адсорбции на их мембране плазменных факторов свертывания крови
5. Участие в регуляции кислотно-основного состояния организма (буферная функция) за счет гемоглобина обеспечивающего до 70 % буферной ёмкости крови.
6.- Ферментативная функция связана с наличием в эритроцитах большого количества ферментов, в частности карбоангидразы, метгемоглобинредуктазы, ферментов гликолиза.
Читайте также:
