Предоперационная подготовка при повторной операции на легком. Анестезия при бронхиальных свищах
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Кафедра и клиника хирургии Института последипломного образования Самарского государственного медицинского университета и Самарской областной клинической больницы им. М.И. Калинина
Повторные операции при длительном просачивании воздуха после видеоторакоскопических резекций легких
Журнал: Эндоскопическая хирургия. 2011;17(4): 10‑13
Корымасов Е.А., Бенян А.С. Повторные операции при длительном просачивании воздуха после видеоторакоскопических резекций легких. Эндоскопическая хирургия. 2011;17(4):10‑13.
Korymasov EA, Benian AS. Reoperations for continuous air leak after videothoracoscopic lung resections. Endoscopic Surgery. 2011;17(4):10‑13. (In Russ.).
Одно из наиболее частых осложнений после видеоторакоскопических резекций легких - длительное просачивание воздуха. Особенно очевидной представляется актуальность данной проблемы при диагностических резекциях с целью биопсии у пациентов с диффузными поражениями легких, когда резекция на уровне заведомо пораженных тканей сопряжена с высоким риском персистенции бронхопульмональных свищей. В послеоперационном периоде у этих пациентов применяются различные методы лечения: от консервативных и вспомогательных методов до повторных операций. Представленный опыт является попыткой иллюстрации общей характеристики видеоторакоскопических резекций легких, наиболее часто наблюдающихся осложнений, анализа их причин и введения лечебно-диагностического алгоритма при этих осложнениях.
В настоящее время в легочной хирургии отмечается тенденция к выбору вида операционного доступа в зависимости от объема резецируемой легочной ткани [1]. Видеоторакоскопические технологии прочно заняли свое место в хирургии буллезной эмфиземы и спонтанного пневмоторакса, округлых образований легких, патологических процессов в интерстициальной ткани легких [2]. Определяющими факторами выполнения эндоскопической операции при этом служат небольшой объем удаляемой легочной ткани и преимущественно краевой характер резекции [3]. Несмотря на то что параметры объема резецируемой ткани при открытых и видеоторакоскопических операциях существенно различаются, общей проблемой остается длительное просачивание воздуха, наблюдающееся у 3—25% пациентов [4]. Особую значимость данное осложнение приобретает при диагностических вмешательствах с целью биопсии у пациентов с диффузным поражением легких неясной этиологии, когда резекция на уровне заведомо пораженных тканей сопряжена с высоким риском персистенции бронхопульмональных свищей и развития послеоперационной эмпиемы плевры [5].
В данной работе представлена попытка определить роль и место повторных операций в тактике ведения пациентов после видеоторакоскопической резекции легкого при осложненном течении послеоперационного периода.
Материал и методы

В отделении торакальной хирургии кафедры и клиники хирургии ИПО Самарского государственного медицинского университета и Самарской областной клинической больницы им. М.И. Калинина видеоторакоскопические операции выполняются с 1999 г. За этот период выполнены 267 видеоторакоскопических и 116 видеоассистированных резекций легких. Диагностические резекции легочной ткани с целью биопсии выполнялись при диффузных процессах в легких (248 пациентов). Целью таких операций была морфологическая верификация заболевания легких. В результате хирургической диагностики выявлены злокачественные процессы легких у 33 (13,3%) пациентов, туберкулез — у 12 (4,8%), хроническая обструктивная болезнь легких — у 28 (11,3%), различные виды диссеминированных и интерстициальных заболеваний легких — у 175 (70,6%). Распределение оперированных пациентов в зависимости от установленного диагноза представлено в табл. 1.

В качестве основного лечебного вмешательства видеоторакоскопические и видеоассистированные резекции легких были применены у 135 пациентов: у 98 — при буллезной эмфиземе легких, у 9 — при туберкуломах, у 18 — при доброкачественных новообразованиях и кистах легких, у 3 — при метастатическом поражении легких, у 2 — при паразитарном поражении легких. Распределение оперированных пациентов в зависимости от характера патологии представлено в табл. 2.
При выборе доступа между видеоторакоскопией и видеоассистированной операцией с миниторакотомией ориентировались на объем предполагаемой резекции и возможность использования эндоскопических режущих и сшивающих инструментов, а также на навыки и предпочтения оперирующего хирурга. Учитывали также, что по травматичности оба вида доступа почти не различаются. В любом случае видеоторакоскопия была первым этапом вмешательства с целью ревизии органов плевральной полости, оценки объема предполагаемой резекции и степени спаечного процесса. Затем в зависимости от размеров патологических объектов, их распространенности, локализации, объемов и способов резекции определяли необходимость выполнения вспомогательной миниторакотомии.
Для выполнения видеоторакоскопических резекций были применены линейные и артикуляционные сшиватели. Всего выполнено 38 стейплерных резекций легкого. Эндоскопические аппаратные резекции выполняли при буллезной эмфиземе и доброкачественных образованиях легких. При выполнении диагностических резекций с целью биопсии отдавали предпочтение бесшовной технологии резекции легкого, которую осуществляли с помощью гармонического ультразвукового скальпеля. Применение этой технологии также обосновано при удалении глубоко расположенных образований. Ультразвуковая резекция легкого была выполнена у 251 пациента преимущественно с интерстициальными заболеваниями. В большинстве случаев при резекции легкого, осуществляемой по краю долей, дополнительное прошивание легочной ткани не требовалось. Однако при локализации патологических очагов на поверхностях долей и при большой поверхности поражения резекцию дополняли эндоскопическими швами на легочную ткань. Видеоассистированные резекции легких через мини-доступ с применением ранорасширителя и сшивающих аппаратов УО-40, УДО-38 выполняли при значительном объеме поражения, обусловливающем необходимость удаления большой части легкого, а также при необходимости осуществления механического шва легочной ткани и в отсутствие эндоскопических сшивателей (у 94 пациентов).
По окончании этапа резекции принимали решение о необходимости укрепления линии легочной резекции с целью достижения аэростаза. Для этого выполняли аппликацию коллагеновых пластин ТахоКомб, которые накладывали на линию легочного шва и зону резекции в сухом виде, желтой маркированной стороной к ране и прижимали в течение 4—5 мин. Описанный способ герметизации был применен у 82 (21,4%) пациентов.
Результаты и обсуждение
Общая тактика ведения пациентов после видеоторакоскопической резекции легкого, а также такие частные ее вопросы, как применение вспомогательных методов или определение показаний к реторакоскопии, базируются на оценке расправления легкого в послеоперационном периоде. Основными объективными критериями расправления легкого являются степень просачивания воздуха по подводному дренажу, рентгенологические признаки выполнения легким всей плевральной полости, отсутствие или наличие подкожной эмфиземы. В качестве дополнительных критериев учитывали характер фоновой патологии легких, объем и уровень выполненной резекции при первой операции, методику резекции, степень дыхательной недостаточности, возраст пациента. Оценка всех критериев, проведенная с учетом фактора времени (число дней, прошедших после операции), направлена на оптимизацию тактики ведения пациентов с длительным просачиванием воздуха.
Среди 383 пациентов, оперированных в нашей клинике, длительное просачивание воздуха было отмечено у 90 (23,5%). При этом нами были выделены следующие понятия: «затянувшееся», «продленное» и «патологическое» просачивание воздуха. Затянувшимся считали просачивание воздуха более 3 сут (58 пациентов/15,1%), продленным — более 7 сут (21 пациент/5,5%), патологическим — более 10 сут (11 пациентов/2,9%).
У пациентов с затянувшимся и продленным просачиванием применяли вспомогательные методы купирования бронхопульмонального свища и послеоперационного пневмоторакса. Повторное дренирование плевральной полости при неадекватном функционировании существующих дренажей применено у 7 (1,8%) больных. С целью уменьшения объема плевральной полости 11 (2,9%) пациентам был наложен пневмоперитонеум. Плевроаспирация была использована у 24 (6,3%). Длительное дренирование у пациентов с малой остаточной полостью было предпринято в 3 наблюдениях (0,8%). Пломбировка остаточной полости аутологичной кровью позволила обтурировать послеоперационный бронхопульмональный свищ у 2 (0,5%) больных.
При сохранении патологического просачивания воздуха в сроки более 10 сут после операции и, как правило, неэффективности вспомогательных методов лечения течение послеоперационного периода считали осложненным. В подобной ситуации считали дальнейшее консервативное ведение неоправданным ввиду высокого риска развития перманентного бронхоплеврального свища и эмпиемы плевры. У 11 (2,9%) пациентов были выставлены показания к повторной операции с целью выявления и устранения причины послеоперационного пневмоторакса. Из них у 9 пациентов первой операцией была диагностическая видеоторакоскопия по поводу диффузных легочных диссеминаций неясной этиологии. Два пациента оперированы повторно после предшествующей видеоторакоскопической резекции по поводу буллезной эмфиземы. Патологическое просачивание воздуха после диагностических видеоторакоскопических резекций именно у данных пациентов, на наш взгляд, связано с основным заболеванием, по поводу которого выполнялась биопсия легкого. Краевая резекция при этом производилась на уровне заведомо пораженных тканей.
Характер исходной патологии у пациентов, которым были проведены повторные вмешательства, представлен в табл. 3.
При выборе доступа для повторного вмешательства ориентировались на выполнение реторакоскопии (у 9 пациентов) или видеоассистированной операции (у 2). Доступ в плевральную полость осуществляли через места ранее стоявших торакопортов. Выполнения дополнительных разрезов не потребовалось. Конверсия в торакотомию после предшествующей реторакоскопии была предпринята у одного больного вследствие неэффективности эндоскопических приемов устранения бронхопульмонального свища.
Наиболее частой находкой во время повторных операций были бронхопульмональные свищи в зоне резекции; они были обнаружены у 7 (1,8%) пациентов. У 5 из них во время первой операции была выполнена резекция с помощью ультразвукового скальпеля, у 2 — аппаратная резекция легкого (УО-40). Свищи располагались преимущественно на поверхностях долей, где силы растяжения легочной ткани выше. Происхождение бронхопульмональных свищей наиболее вероятно было связано с исходным состоянием легочной ткани на уровне резекции или техническими погрешностями при выполнении резекции. Визуализация зоны бронхопульмональных свищей во время повторной операции была возможна после выполнения полноценного пневмолиза в зоне резекции легкого. Как правило, наличие остаточной полости облегчает выполнение манипуляций. В наших наблюдениях все выявленные бронхопульмональные свищи имели паренхиматозное происхождение, т.е. являлись следствием несостоятельности на уровне кортикального слоя паренхимы легкого. У 4 больных свищи располагались поверхностно на уровне резекции, у 3 других — в глубине воронкообразной раны легкого.
У одного (0,3%) пациента после диагностической краевой резекции легкого также сформировался персистирующий бронхопульмональный свищ. Плановое гистологическое исследование позволило выявить неясной этиологии организующую пневмонию, что было неблагоприятным прогностическим фактором в плане возможности спонтанного закрытия свища. При повторной видеоторакоскопии причиной персистенции свища оказались плевролегочная спайка в непосредственной близи от патологической зоны и постоянная тракция легочной ткани при дыхании.
В одном (0,3%) наблюдении при реторакоскопии были выявлены буллы, не замеченные во время первой операции.
Неадекватное функционирование дренажей вследствие их миграции обнаружено при повторной операции у одного (0,3%) пациента, обтурация дренажа — также у одного (0,3%).
Окончательное распределение пациентов в зависимости от причины патологического просачивания воздуха было следующим:
Бронхопульмональный свищ в зоне резекции — 7, незамеченная неликвидированная во время первой операции причина пневмоторакса — 1; надрыв легкого из-за наличия спайки с грудной стенкой — 1; миграция дренажа — 1; обтурация дренажа — 1.
С целью устранения причины послеоперационного пневмоторакса у 7 пациентов выполнено прошивание зоны свища П-образными атравматичными швами. Несмотря на воспаление, отек и рыхлость легочной ткани, подобное прошивание достаточно эффективно и технически просто выполнимо.
У 2 больных выполнена аппаратная резекция края легкого, несущего свищ или буллу. На линию шва с целью ее укрепления во всех наблюдениях проводилась аппликация пластин ТахоКомб соответствующего размера.
У 2 пациентов с неадекватным функционированием дренажной системы соответствующее редренирование позволило ликвидировать послеоперационный пневмоторакс. Во всех случаях интраоперационно легкое расправлено с помощью гипервентиляции. Осложнений после повторных операций не отмечено. Средние сроки просачивания воздуха составили 1,5 сут, окончательного расправления легкого и удаления дренажей — 2,6 сут.
Заключение
Хирургическая тактика при длительном просачивании воздуха базируется на оценке расправления легкого в послеоперационном периоде. Объективными критериями расправления легкого являются: степень просачивания воздуха по подводному дренажу, рентгенологическая картина выполнения легким плевральной полости, отсутствие или наличие подкожной эмфиземы. Показания к реторакоскопии возникают в тех случаях, когда примененный лечебно-диагностический алгоритм оказывается неэффективен и имеются веские основания для хирургического устранения причины пневмоторакса, поскольку дальнейшее выжидание сопряжено с высоким риском развития послеоперационной эмпиемы плевры с бронхоплевральным свищем. Во время повторного видеоторакоскопического вмешательства можно визуализировать область бронхопульмонального свища, выполнить прошивание этой зоны, провести дополнительные мероприятия по обеспечению аэростаза, выполнить прицельное адекватное дренирование плевральной полости.
Предоперационная подготовка при повторной операции на легком. Анестезия при бронхиальных свищах
Хирургия:
Предоперационная подготовка к резекции легкого. Анестезиологические аспекты резекции легкого
Основная цель подготовки пациентов перед расширенной резекцией лёгкого — оптимизация физического состояния и сердечно-лёгочной функции. Этого достигают благодаря полному отказу от курения в течение нескольких недель до операции и выполнением физических упражнений в виде дозированной ходьбы. Цель тренировки— ходьба на 1,5—3 км без остановок.
Пациентам с повышенным риском сердечно-лёгочных осложнений в предоперационном периоде полезна тренировка стимулированной спирометрией. Сердечно-лёгочная реабилитация пациентов с высоким общим риском может улучшить физическое состояние и состояние сердечно-лёгочной функции в течение 4—6 нед и значительно уменьшить общий риск.
Важная составляющая предоперационной подготовки — лекарственное лечение. Пациенты с двумя и более сердечно-сосудистыми факторами риска в предоперационном периоде должны принимать р-адреноблокаторы, уменьшающие риск инфаркта миокарда. Пациентов с хронической обструктивной болезнью лёгких и доказанными функциональными лёгочными тестами с бронходилататорами лечат соответствующими препаратами.
По возможности доза глюкокортикоидов должна бьпь снижена до минимальной поддерживающей дозы. Высокие дозы этих препаратов ухудшают заживление ран и тем самым могут привести к неблагоприятным последствиям при наложении механического шва на паренхиму лёгкого, при ушивании культи бронха или наложении бронхиальных анастомозов.
Мнения хирургов о назначении антибиотиков перед резекцией лёгкого противоречивы. Большинство хирургов дают антибиотики перед и после операции, хотя рандомизированные исследования показали их слабую клиническая эффективность. Антибиотики показаны при пневмонэктомии ввиду возможного тяжелейшего осложнения этой операции — эмпиемы плевры.
Их обычно назначают при операции по поводу абсцесса лёгкого, бронхоплевральных свищей, лобэктомии с наложением бронхиального анастомоза или при других вмешательствах, при которых есть микробная контаминация плевры или высока её вероятность.
Пациент должен придерживаться здоровой диеты. Недостаточное питание, в том числе раковая кахексия, приводят к снижению иммунитета и предрасполагают к инфекционным осложнениям. К сожалению, очень сложно провести коррекцию нутритивной недостаточности за короткий промежуток времени, даже путём интенсивного энтералыюго и парентерального питания.
Анестезиологические аспекты резекции легкого
Общение и сотрудничество с анестезиологом, обладающим опытом анестезиологического обеспечения операций на лёгких, необходимо. Основные анестезиологические задачи — отключение лёгкого во время операции, измерение центрального венозного давления (ЦВД) и/или измерение артериального давления (АД), интра- и послеоперационное обезболивание, назначение премедикации.
Обеспечение технических требований операции зависит от способностей анестезиолога выбрать соответствующий способ введения в наркоз, обеспечить мониторинг и организовать вентиляцию. Информация, представляемая хирургом, предопределяет действия анестезиолога в отношении трансфузии препаратов крови и факторов свёртывания и определения времени экстубации после операции.
Задача анестезиолога — обратить внимание хирурга на любые проблемы, препятствующие проведению операции: на осложнения, связанные с введением в наркоз, на гемодинамические нарушения во время операции, на патологические показатели лабораторных анал и зов, факторы, препятствующие отключению лёгкого.
Отличительная особенность анестезиологического обеспечения резекции лёгкого состоит в необходимости одиолёгочной вентиляции и способах наилучшего её достижения. Резекцию лёгкого можно выполнить и на вентилируемом лёгком, причём такую методику обычно применяли в первые десятилетия после начала внедрения этих операций.
Современный успех операции связан с поддержанием оптимальной вентиляции у пациентов с пограничной функцией лёгких, с уменьшением вероятности респираторассоциированной травмы, быстрым введением в наркоз, с отсутствием необходимости заменять однопросветную трубку двухпросветной перед тем, как изменить положение пациента (если бронхоскопию выполняли под наркозом перед торакотомией), и с улучшившимися возможностями санации дыхательных путей.
Бронхиальный свищ
МКБ-10

Общие сведения
Причины
Формирование врожденных бронхиальных свищей происходит внутриутробно. Возникновение бронхопищеводных и трахеопищеводных свищей обусловлено неполным разделением дыхательной и пищеварительной систем на определенном этапе эмбриогенеза под влиянием различных факторов, воздействующих на плод (авитаминоза, внутриутробных инфекций, травм, радиации и пр.). В большинстве случаев при таком пороке развития имеется свищевой ход между главным бронхом (обычно правым) и пищеводом. Этиология приобретенных бронхиальных свищей может быть различной:
- Послеоперационные дефекты. Наиболее часто встречаются послеоперационные свищи, обусловленные несостоятельностью культи бронха или ее некрозом, эмпиемой плевры, распространенностью опухолевого процесса по стенке бронха и пр. Как показывают статистические данные, послеоперационные бронхиальные свищи в 2 раза чаще формируются после пневмонэктомий, выполненных по поводу рака легкого, чем после других резекционных вмешательств (лобэктомии, билобэктомии и др.).
- Инфекции легких и бронхов. На втором месте среди причин приобретенных бронхиальных свищей стоят специфические и неспецифические гнойно-деструктивные процессы легких: актиномикоз, туберкулез, абсцесс легкого, бактериальные деструкции легких. Реже к образованию дефекта в стенке бронха приводят спонтанный пневмоторакс, распад раковой опухоли, эхинококкоз легкого, перфорация в бронхиальное дерево дивертикулов пищевода, кисты или абсцесса печени.
- Травматические повреждения. Третья группа факторов, приводящих к формированию бронхиальных свищей, связана с закрытыми травмами грудной клетки, ранением легкого и пр.
Патогенез
Классификация
Кроме деления на врожденные и приобретенные, бронхиальные свищи подразделяются на единичные (62%) и множественные (38%, в т. ч. «решетчатое легкое»). С учетом этиологического фактора они могут иметь посттравматическое, постинфекционное, послеоперационное происхождение. В зависимости от уровня локализации различают свищи главных, долевых, сегментарных, субсегментарных бронхов и альвеолярные фистулы. В клинической практике наибольшую ценность представляет анатомическая классификация, в рамках которой выделяют:
Наружные (торакобронхиальные) свищи
Внутренние свищи
Симптомы бронхиальных свищей
Критериями, определяющими симптоматику бронхиальных свищей, выступают их анатомические особенности, диаметр, сроки образования дефекта, наличие или отсутствие инфекционного процесса. К числу общих симптомов, сопровождающих развитие патологии, относятся признаки интоксикации (лихорадка с ознобами, слабость, разбитость, головная боль, плохой аппетит) и дыхательной недостаточности (цианоз, одышка, боли в грудной клетке). Кроме этого, для различных видов бронхиальных свищей характерны свои специфические проявления.
Наружные (бронхокожные, бронхоплеврокожные) свищи характеризуются наличием видимого дефекта на коже грудной стенки, из которого периодически отходит слизистое или слизисто-гнойное отделяемое, а при кашле и натуживании может выделяться воздух. Попадание в свищевой ход воды провоцирует возникновение резкого приступообразного кашля и приступа удушья. Иногда снятие окклюзионной повязки вызывает усиление кашля, одышки и цианоза, нарушение голоса вплоть до афонии.
Бронхиальные свищи, сообщающиеся с «сухой» плевральной полостью, проявляются сухим кашлем или откашливанием незначительного количества слизистой мокроты. При бронхоплевральных свищах, развившихся на фоне гнойного плеврита, общее состояние больных отягощается гнойно-резорбтивной лихорадкой, интоксикацией, истощением. Отмечается отхождение большого объема гнойной, зловонной мокроты при кашле, выраженная одышка, выделение воздуха из плеврального дренажа, подкожная эмфизема. Клинику бронхолегочных свищей определяют субфебрилитет, кашель с выделением слизисто-гнойной мокроты, потливость, слабость.
Основным признаком бронхоорганных свищей служит откашливание больным содержимого того органа, с которым сообщается бронх: съеденной пищи, желчи, желудочного или кишечного содержимого. Врожденные трахео- и бронхопищеводные свищи могут быть заподозрены вскоре после рождения ребенка на основании поперхивания при кормлении, вздутия желудка, развития аспирационной пневмонии. Основным проявлением приобретенных свищей служит кашель, связанный с приемом жидкости и пищи, иногда - удушье.
Осложнения
Длительное течение бронхиальных свищей может привести к возникновению пневмонии и хронической эмпиемы плевры. Возможны осложнения в виде кровохарканья или легочного кровотечения, аспирационной пневмонии другого легкого. Системные последствия представлены сепсисом, массивным внутренним кровотечением, висцеральным амилоидозом.
Диагностика
При осмотре пациента с предполагаемым диагнозом «бронхиальный свищ» обращает внимание цианоз кожи и слизистых, одышка, тахикардия, характерная деформация концевых фаланг пальцев («барабанные палочки», «часовые стекла»). Аускультация выявляет рассеянные разнокалиберные хрипы.
Бронхокожные свищи, открывающиеся на поверхности грудной стенки, обнаруживаются визуально. С диагностической целью может быть проведено зондирование свища с введением водного раствора метиленового синего. Возникновение кашля с выделением окрашенной мокроты подтверждает наличие бронхиального свища. Для получения информации о протяженности и конфигурации свищевого хода производится фистулография с контрастными веществами. В ряде случаев уточнить локализацию, количество, размеры свищевых ходов позволяет диагностическая торакоскопия, выполняемая через свищевое отверстие в грудной стенке.
Лечение бронхиальных свищей
В большинстве случаев бронхиальные свищи требуют оперативного лечения. Вместе с тем, в отношении некоторых фистул бронхов может быть применена консервативная тактика. Лечением данной патологии должны заниматься торакальные хирурги, владеющие всем арсеналом методов ведения больных с бронхиальными свищами. Консервативное лечение бронхиальных свищей предполагает проведение мероприятий по санации гнойных полостей: дренирование плевральной полости, промывание антисептическими растворами, введение протеолитических ферментов и антибиотиков, удаление инородных тел, наложение аппарата активной аспирации и т. п. После облитерации остаточных полостей возможно самострельное закрытие небольших бронхиальных свищей.
Имеется положительный опыт ликвидации свищей с помощью химического прижигания или электрокоагуляции фистулы, позволяющих разрушить эпителиальную выстилку и стимулировать рост соединительной ткани в канале. При крупных фистулах может применяться временное эндоскопическое закрытие свищнесущего бронха специальной поролоновой пломбой - такая тактика позволяет осуществить лаваж гнойной полости и создать благоприятные условия для оперативной ликвидации бронхиального свища.
Консервативное лечение бронхиальных свищей оказывается успешным лишь в 10-12% случаев, поэтому большинству пациентов показано оперативное закрытие дефекта. Для оперативного устранения торакобронхиального свища может выполняться его иссечение с последующим ушиванием, мышечная пластика лоскутом на ножке. При послеоперационных свищах показано выполнение реампутации культи бронха. Устранение пищеводно-бронхиальных свищей требует ушивания дефектов со стороны пищевода и бронха, возможно - резекции измененной части легкого. Закрытие бронхоплеврального свища может производиться с помощью интраплевральной торакопластики или декортикации легкого.
Прогноз и профилактика
Исход и перспективы выздоровления зависят от причины, приведшей к формированию бронхиального свища, полноты, адекватности и своевременности лечебных мероприятий. Наиболее серьезный прогноз и высокая летальность (30-70%) отмечается при послеоперационных свищах, осложненных эмпиемой плевры. При возникновении бронхиального свища выжидательная тактика недопустима; необходимо как можно более раннее начало консервативных мероприятий, проведение хирургического вмешательства после необходимой подготовки. Профилактика приобретенных бронхиальных свищей заключается в соблюдении техники обработки культи бронха, своевременной терапии гнойно-деструктивных заболеваний легких, предупреждении травм грудной клетки.
1. Лечение постпневмонэктомических бронхиальных свищей в торакальной онкохирургии: обзор литературы и собственный опыт/ Душко Н.Е.// Клиническая онкология. - 2015 - №2 (18).
2. Хирургическая тактика при бронхиальных свищах после пневмонэктомии/ Худайбергенов Ш.Н., Ирисов О.Т., Хаялиев Р.Я., Эшонходжаев О.Д.// Клиническая медицина Казахстана. - 2013 - №2 (28).
3. Трахеофибробронхоскопия в лечении бронхиальных свищей/ Худайбергенов Ш.Н., Ирисов О.Т., Хаялиев Р.Я., Эшонходжаев О.Д.// Клиническая медицина Казахстана. - 2013 - №2 (28).
Несостоятельность культи бронха
Несостоятельность культи бронха - осложнение лоб-, билоб- или пульмонэктомии, представляющее собой дефект швов, наложенных на культю, и обеспечивающее прохождение воздуха в плевральную полость, экссудата - в бронхи и трахею. Проявляется болями на стороне операции, кашлем с обильным отделением кровянистой жидкости, одышкой, лихорадкой, подкожной эмфиземой. Диагностируется на основании клиники, данных лучевых методов исследования лёгких, бронхоскопии. Для закрытия дефекта культи выполняется бронхоскопия с электрохимической коагуляцией или реторакотомия с торакопластикой или реампутацией бронха.

Несостоятельность культи бронха является тяжёлым осложнением хирургической резекции лёгкого или пульмонэктомии, приводящим к появлению бронхиального свища. Развивается у 2-30% больных, прооперированных по поводу различных заболеваний лёгких. Справа встречается в 5 раз чаще, чем слева. Занимает первое место в структуре послеоперационной летальности в торакальной хирургии. При расхождении швов главного бронха этот показатель составляет 50-70%. Чем шире просвет ампутированного бронха, тем выше риск появления дефекта швов и сложнее лечение их несостоятельности. У пациентов, перенесших пульмонэктомию, осложнение наблюдается в 10-20 раз чаще по сравнению с больными, которым была произведена лобэктомия.
Несмотря на новые методики прошивания культи бронха, частота возникновения дефекта швов остаётся высокой. До сих пор ведутся исследования, направленные на поиск основных причин образования бронхиальных свищей и способов их профилактики. На сегодняшний день выделяются следующие факторы, провоцирующие развитие данного послеоперационного осложнения:
- Особенности строения бронха. Несостоятельность швов чаще выявляется в мембранозной части органа. Возникновение дефекта может быть обусловлено её перерастяжением. Наличие широкой мембранозной части (более 14 мм) характерно для главного правого бронха и требует особой обработки его культи в ходе операции.
- Технические погрешности оперативного вмешательства. Технические ошибки при выполнении операции могут привести к нарушению микроциркуляции краёв раны и стать препятствием нормальному заживлению первичным натяжением. При использовании сшивающего аппарата возможно раздавливание стенок органа его браншами. При неаккуратном выделении главного бронха из окружающей клетчатки повреждаются бронхиальные артерии. К техническим погрешностям также относят оставление слишком длинной культи, пересечение органа вблизи бифуркации трахеи, травмирование хряща и надхрящницы, наложение некачественных швов.
- Распространение инфекции, неопластического процесса. При распространении опухолевого процесса на пересечённый бронх бронхиальный свищ появляется в результате распада тканей. Инфицирование культи бронха приводит к нагноению швов. Возникает их несостоятельность. Источником инфекции являются абсцессы и каверны лёгкого, регионарные лимфатические узлы, плевральная полость. Возможно случайное ятрогенное инфицирование.
- Другие патологические состояния. Несостоятельность резецированного бронха чаще диагностируется при наличии у больного сопутствующей патологии - сахарного диабета, хронических неспецифических заболеваний лёгких. Риск образования дефекта выше у пациентов с длительной интубацией трахеи, массивной интраоперационной кровопотерей. Применение предоперационной химиотерапии в лечении рака лёгкого снижает частоту развития данного осложнения.
Механизм развития патологического состояния до конца не изучен. Установлено, что в результате некробиотических процессов, происходящих в стенках оперированного бронха, через 7-10 дней после хирургического вмешательства возникает размягчение и расслабление швов. Их несостоятельность отмечается при недостаточно прочном соединении тканей культи. Кроме того, формированию дефекта после пневмонэктомии способствует отсутствие лёгочной паренхимы, способной укрыть резецированный бронх.
Несостоятельность бронхиальной культи после лоб- или билобэктомии наблюдается при недостаточном расправлении оставшейся части лёгкого и формировании полости. Содержащийся в ней экссудат контактирует со швами, ещё больше их размягчает и прорывается в бронх, образуя свищ. Многие авторы считают, что разгерметизация культи формируется при кашле или глубоком вдохе из-за градиента давления, направленного из трахеобронхиального дерева в остаточную плевральную полость. Через образовавшееся отверстие в полость плевры шунтируется воздух, что впоследствии становится причиной эмпиемы. В обратном направлении устремляется экссудат, аспирация которого приводит к развитию острой пневмонии противоположного лёгкого.
По времени возникновения различают острую, появляющуюся в первые двое суток, раннюю, диагностируемую на 3-14 сутки, и позднюю, развивающуюся спустя 15 суток после операции недостаточность бронхиальной культи. По величине дефекта выделяют I (диаметр отверстия до 0,4 см), II (0,4-1 см) и III (от 1 см до полного раскрытия бронха) степени патологического состояния. В зависимости от этиологического фактора несостоятельность ампутированного участка воздухоносного пути классифицируется как:
- Первичная. Выявляется в течение первой недели послеоперационного периода. Связана с техническими погрешностями оперативного вмешательства, препятствующими срастанию краёв раны.
- Вторичная. Заживающие первичным натяжением швы распадаются в результате вторичного инфицирования, внутригрудного кровотечения или распространения опухоли на культю. Обнаруживается через 1-3 недели после пневмонэктомии или резекции лёгкого.
Симптомы
Клиническая картина острого раскрытия бронха III степени разворачивается быстро. Состояние больного резко утяжеляется. Отмечаются интенсивные боли, чувство тяжести в груди, кашель с отхождением большого количества (полным ртом) жидкого кровянистого содержимого плевральной полости. Стремительно нарастает общая слабость, снижается артериальное давление. Кожные покровы пациента приобретают бледно-цианотичный оттенок, покрываются холодным липким потом. Возникает выраженная одышка, нарушается сознание. Иногда присутствует подкожная эмфизема.
Несостоятельность I-II степени протекает легче. Симптомы осложнения появляются на 7-21 день послеоперационного периода. Характерно повышение температуры тела до фебрильных значений, развитие или усиление болей в грудной клетке и кашля. Изначально сухой мучительный кашель постепенно становится влажным. Откашливается слизисто-гнойная мокрота. При определённом положении тела интенсивный приступ кашля завершается обильным отделением жидкого сукровичного содержимого. Запах препаратов, которые вводятся внутриплеврально, ощущается пациентом во время выдоха. У некоторых больных наблюдается подкожная эмфизема лица, шеи, груди, живота.
Острая тяжёлая несостоятельность ампутационной бронхиальной культи ведёт к развитию дыхательной недостаточности, шока. До 70% случаев такого состояния после пульмонэктомии заканчиваются летальным исходом. Бронхиальная несостоятельность всегда становится причиной формирования бронхиального свища с последующей эмпиемой плевры. Часто развивается аспирационная пневмония здорового лёгкого. Если оперативное вмешательство осуществлялось по поводу туберкулёзного процесса, происходит диссеминация.
Диагностический поиск при подозрении на несостоятельность культи бронха осуществляет торакальный хирург. При необходимости к обследованию пациента привлекаются фтизиатры и онкологи. При осмотре оценивается общее состояние, сознание и положение тела больного, цвет и влажность кожных покровов. Промокание повязки в области послеоперационной раны при соответствующих жалобах может служить косвенным признаком развития бронхиальной несостоятельности. Другими симптомами патологического состояния являются откашливание плеврального содержимого в положении на больном боку и постоянное выделение воздуха через плевральный дренаж. Окончательный диагноз устанавливается с помощью:
- Физикального исследования. Во время активной аспирации содержимого полости плевры над трахеей аускультативно определяется характерный шум движущегося воздуха. Аспирационная пневмония второго лёгкого проявляется локальным притуплением перкуторного звука и ослаблением или усилением дыхания и влажными хрипами в проекции инфильтрата.
- Бронхоскопии. Относится к основным диагностическим исследованиям. Позволяет визуализировать образовавшееся отверстие, определить его локализацию, оценить размеры, состояние краёв раны. С помощью бронхоскопии осуществляется электрическая, химическая или электрохимическая коагуляция, способная устранить бронхиальную несостоятельность I степени или, в качестве временной меры, аллообтурация большого дефекта поролоном.
- Рентгенографии, КТ грудной полости. В раннем послеоперационном периоде на рентгенограмме и компьютерных томограммах можно обнаружить смещение или отсутствие танталовых скоб, применяющихся при механическом сшивании раны. Позднее появляются признаки пневмоторакса, гидроторакса с горизонтальным уровнем. Для уточнения локализации отверстия иногда используется бронхография.
Лечение
Основные лечебные мероприятия направлены на снижение летальности от данного осложнения и предотвращение рецидивов. Тактика и этапы лечения патологии зависят от размера, времени возникновения и выявления бронхиального свища, а также от общего состояния пациента. Различают следующие основные варианты ведения больного с диагностированной несостоятельностью бронхиальной культи:
- Экстренное повторное хирургическое вмешательство. Является наиболее эффективным методом закрытия дефекта швов бронха. Осуществляется при полном раскрытии органа, если его несостоятельность выявлена в течение первых двух дней после операции и эмпиема плевры ещё не успела развиться. Состояние пациента должно быть стабильным. Выполняется реторакотомия. При достаточно длинной культе возможна реампутация бронха. Иногда проводится циркулярная резекция бифуркации трахеи с созданием анастомоза между дыхательными путями. Достаточно эффективным методом хирургического лечения является пластика культи бронха. Чаще применяется восьмирёберная торакопластика, оментопластика, реже - диафрагмопластика или плевризация резецированного органа.
- Консервативное лечение. Консервативная терапия эффективна только у больных с очень небольшими (до 4-10 мм) дефектами культи оперированного органа. Производится лечебная бронхо- или торакоскопия. Отверстие коагулируют лазером, применяют фибриновый клей, прижигают специальными химическими средствами либо комбинируют эти методики. Одновременно осуществляют активное дренирование полости плевры, назначают антибактериальную терапию.
- Выжидательная тактика. Показана при обнаружении свища на фоне нагноительного процесса плевральной полости. Выполнять реторакотомию в этом случае не имеет смысла. Устанавливается торакостома, регулярно удаляется гнойный экссудат. При необходимости с помощью бронхоскопа область дефекта бронха обтурируется поролоновым шариком. Оперативное лечение проводится после полной санации плевральной полости.
Всем пациентам назначается парентеральное введение антибиотиков широкого спектра действия. Плевральная полость промывается антисептиками, туда же вводятся бактериофаги, чаще (с учётом возбудителя эмпиемы) активные в отношении синегнойной палочки. Для стимуляции факторов иммунной защиты используются иммуномодуляторы, препараты крови. В период реабилитации показана лечебная физкультура и дыхательная гимнастика.
Прогноз при развитии пострезекционной негерметичности бронха всегда серьёзный. До 70% больных погибают в послеоперационном периоде. Летальность повышается при выборе консервативного метода лечения и необходимости применения выжидательной тактики. Несостоятельность послеоперационной культи часто рецидивирует. В целях профилактики, выполняя резекцию лёгкого, необходимо учитывать анатомические особенности бронха, аккуратно выделять его из окружающих тканей, стараясь не нарушить васкуляризацию, не повредить хрящ и надхрящницу. Культя бронха не должна соприкасаться с экссудатом остаточной полости. Существуют разнообразные способы её герметизации.
1. Система профилактики несостоятельности культи бронха и бронхиальных свищей после пневмонэктомии/ В. В. Лишенко// Военная медицина - 2010 - №4.
2. Лечение постпневмонэктомических бронхиальных свищей в торакальной онкохирургии: обзор литературы и собственный опыт/ Душко Н.Е.// Клиническая онкология - 2015 - №2.
3. Несостоятельность швов культи бронха в хирургии рака легкого/ Аксарин А.А., Тер-Ованесов М.Д.// Хирургия - 2014 - №9.
Подготовка к торакальной операции
В подавляющем большинстве случаев операции в торакальной хирургии - плановые. О том, что пациенту запланирована операция он узнает за несколько недель, а иногда и несколько месяцев до даты операции. Поэтому, наиболее важным шагом для пациента, после того как он узнала о планировании хирургического вмешательства является отказ от курения.
Курение не только является провоцирующим фактором для развития большого количества легочных заболеваний, но оно так же усугубляет их течение, а в послеоперационном периоде удлиняет сроки госпитализации и сроки заживления послеоперационных ран.
Таким образом отказ от курения до операции является первостепенной задачей для пациента.
Поступление в хирургическое отделение
Пациенты поступают в отделения торакальной хирургии за 3-7 дней до предполагаемого дня операции (обычно этих сроков достаточно для проведения всего необходимого объема диагностических мероприятий), в редких случаях может потребоваться чуть больше времени для предоперационной подготовки.
В день вашего поступления ваш лечащий врач проведет с вами беседу в ходе которой он расспросит вас о вашем состоянии, о том где и как вы лечились до этого, а также он объяснит дальнейшие действия, необходимые для диагностики вашего состояния и определения наиболее правильной хирургической тактики в вашем случае.
Диагностические мероприятия
Стандартный набор диагностических процедур, выполняемых на отделении торакальной хирургии состоит из:
- Спирометрии,
- ЭКГ (электрокардиограммы),
- ФБС (фибробронхоскопии),
- ФГДС (фиброгастродуоденоскопии),
- КТ ОГК и ОБП (компьютерной томографии органов грудной клетки и органов брюшной полости, выполняемой с введением внутривенного контрастного вещества),
а так же ряда лабораторных анализов:
В некоторых случаях проводятся дополнительные диагностические мероприятия:
- УЗИ ОГК (ультразвуковое исследование органов грудной клетки)
- УЗИ ОБП (ультразвуковое исследование органов брюшной полости)
- КПНТ (кардиопульмональное ОАК (общий анализ крови),
- БАК (биохимический анализ крови),
- ОАМ (общий анализ мочи).
- нагрузочное тестирование)
- КИФВД (комплексное исследование функции внешнего дыхания)
- ЧББЛ (чрезбронхиальная биопсия легкого)
- Трансторакальная биопсия легкого под КТ- или УЗ-навигацией
- EBUS-TBNA (эндобронхиальная тонкоигольная аспирационная биопсия под ультразвуковой навигацией)
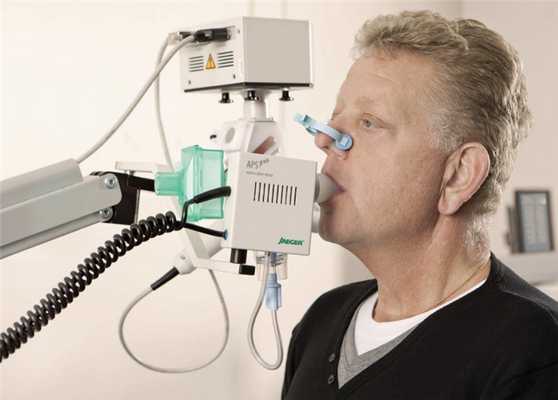
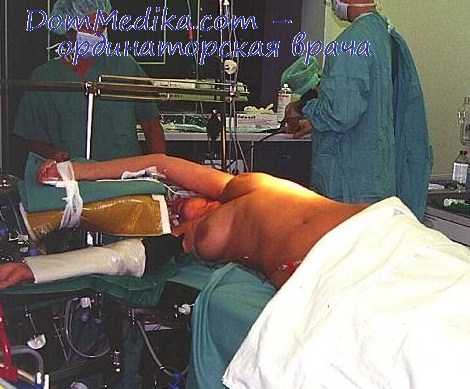
Это метод, позволяющий оценить объем вдыхаемого и выдыхаемого воздуха, а также скорость его прохождения по дыхательным путям в спокойном и форсированном состоянии.
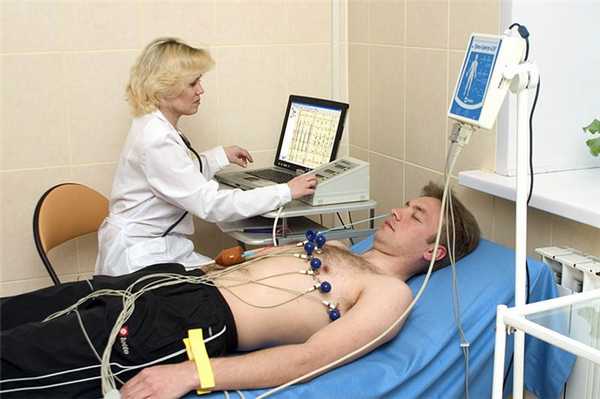
Это методика регистрации и исследования электрических полей, образующихся при работе сердца.
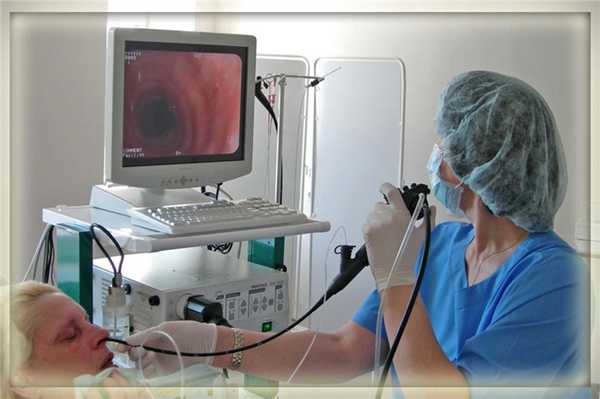
Это лечебно-диагностическая процедура, которая предполагает осмотр и проведение определенных манипуляций в верхних дыхательных путях. Для этих целей используется специальный оптический прибор — бронхоскоп, который имеет вид гибкой трубки диаметром 3-6 мм, оснащенной специальной холодной лампой, видеокамерой и каналом для подведения манипуляционных инструментов.
Исследование проводится в первой половине дня. В день исследования, до его проведения нельзя кушать и пить.
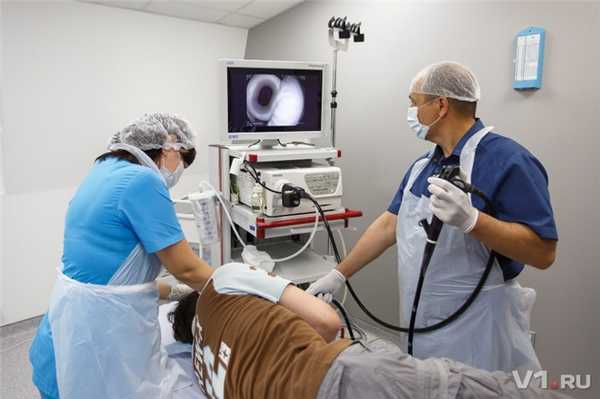
Это лечебно-диагностическая процедура, которая предполагает осмотр и проведение определенных манипуляций в пищеводе, желудке и двенадцатиперстной кишке. Для этих целей используется специальный оптический прибор — гастроскоп, который, как и бронхоскоп, имеет вид гибкой трубки, однако большего диаметра (5-12мм), оснащенной специальной холодной лампой, видеокамерой и каналом для подведения манипуляционных инструментов.
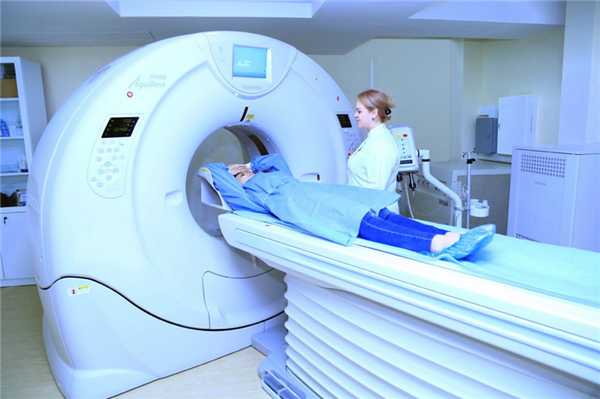
Это рентгенологическое исследование, позволяющее получить рентгеновское изображение внутренних органов. Перед исследованием вам будет установлен внутривенный катетер, по которому вам введут рентгенкотрастное вещество, необходимое для более точной диагностики расположения сосудов корня легкого.
Не волнуйтесь, доза лучевой нагрузки, получаемая вами при выполнении КТ очень незначительная и не может причинить вред вашему здоровью.
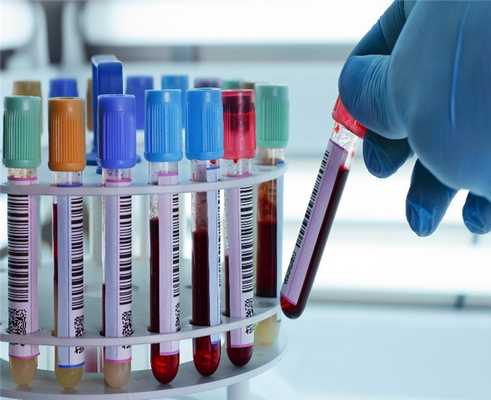
Все лабораторные анализы сдаются с утра. Анализы крови берут натощак, а для сдачи анализа мочи необходима средняя порция утренней мочи.
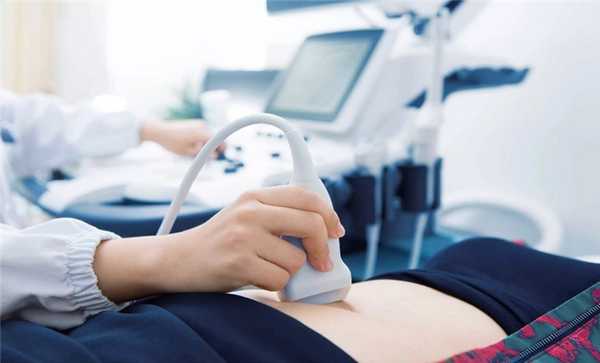
Это неинвазивная диагностическая методика, основанная на визуализации структур организма с помощью ультразвуковых волн.
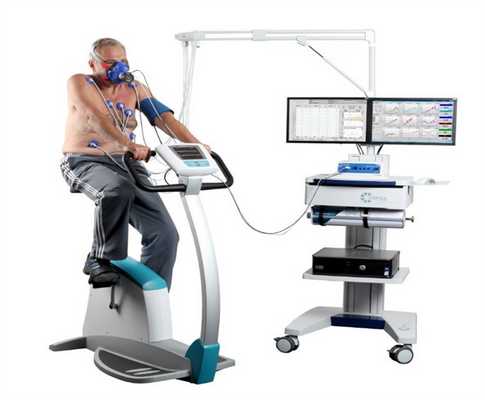
Это диагностическая методика, используемая для оценки толерантности к физической нагрузке, определения причин ее снижения, а также показаний к проведению оперативных вмешательств.
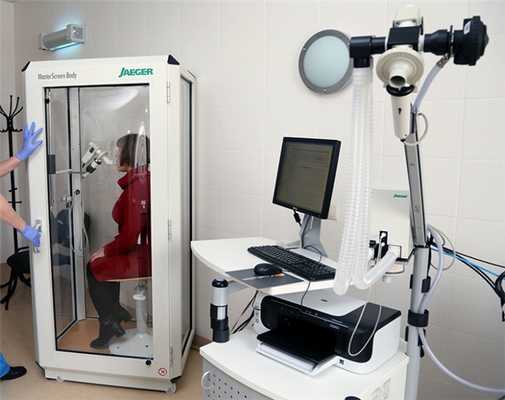
Более детальный диагностический метод для определения состояния дыхательной системы чем спирометрия.
Диагностическая методика, заключающаяся в выполнении биопсии участка легкого/лимфатического узла под контролем рентгеноскопии, при проведении ФБС. Метод малоинвазивный и не требует общей анестезии.
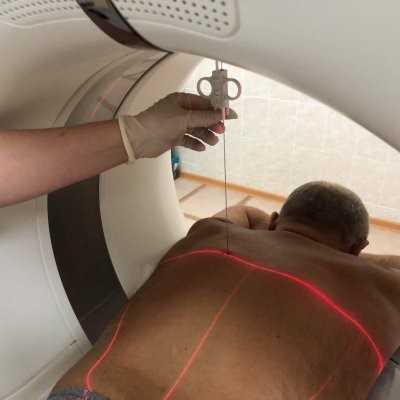
Это один из новейших способов диагностики, использующий метод компьютерной томографии или ультразвукового исследования, для более точного выполнения биопсии и взятия образца ткани для дальнейшего гистологического исследования. Метод малоинвазивный и не требует общей анестезии.
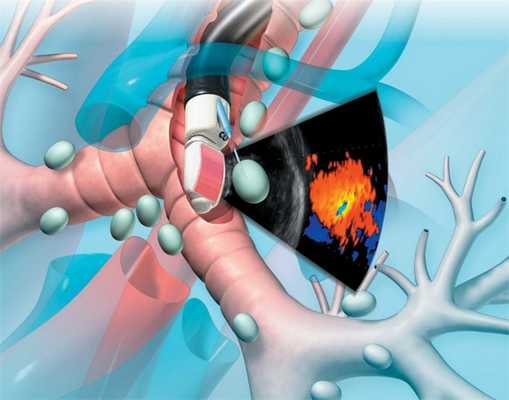
Методика выполнения эндобронхиальной биопсии под УЗ-навигацией используется для исследования средостенных лимфатических узлов на предмет их поражения. Выполняется исследование в условиях палаты интенсивной терапии под общей анестезией. Длительность составляет от 30 до 60 минут. После выполнения процедуры пациент остается в палате интенсивной терапии еще в течение 2-3х часов, а затем переводится обратно на хирургическое отделение. В день выполнения процедуры, пациент не может кушать и пить до начала исследования.
Прием лекарственных препаратов
Большинство пациентов, поступающих на хирургическое отделение принимают те или иные лекарственные средства. Обязательно проинформируйте своего лечащего врача обо всех препаратах которые вы принимаете на данный момент. Это очень важно и не стоит этим пренебрегать. Так за неделю до оперативного вмешательства следует прекратить прием:
- Аспририна и всех аспиринсодержащих препаратов (Анацин, Агренокс, Алкозельцер и т.д.)
- Плавикса
- Тиклида
- Варфарина
За два дня до операции следует прекратить прием НПВС (нестероидных противовоспалительных средств):
- Ибупрофен, Напроксен , Кетопрофен
- Диклофенак, Фентиазак
- Кеторолак, Амтолметин
- Индометацин
- Пироксикам, Мелоксикам, Лорноксикам
- Анальгин
- Эторикоксиб
- Целекоксиб и др.
В день перед операцией прием пищи должен закончиться до 20:00, до полуночи можно выпить стакан воды или кружку чая. О времени, на которое запланирована ваша операция вам сообщит ваш лечащий врач.
Вам сделают клизму после последнего приема пищи, а перед сном вам дадут лекарственный препарат (миорелаксант) для глубокого сна.
Утром в день операции нельзя ничего пить и кушать.
О длительности проведения оперативных вмешательств, их видах и особенностях вы может узнать у вашего лечащего врача.
Читайте также:
- Диагностика аберрантных арахноидальных грануляций синусов твердой мозговой оболочки по КТ, МРТ
- Увеит при хроническом детском кожно-неврологическом и суставном синдрома
- Гемоглобин. Роль гемоглобина в транспорте кислорода
- Ювенильный ревматоидный артрит
- Шоковые реакции. История определения шоковой реакции
