Преимущества одномоментной резекции легких. Разработка анестезии резекции легких
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Дословно — внутригрудная хирургия, то есть на органах грудной клетки, от латинского слова thorax — грудная клетка.
По характеру выполнения операции подразделяют на радикальные и нерадикальные.
Под радикальной операцией (R0) понимают удаление пораженного органа или его резекцию (удаление, иссечение) в пределах здоровых тканей с клетчаткой и лимфатическими узлами.
Операция считается нерадикальной, если по линии резекции удаленной ткани микроскопически выявляются опухолевые клетки (R1) либо в оставшейся части органа визуально определяется опухоль (R2).
По объему удаляемой ткани операции делятся на анатомические и неанатомические резекции.
В современной онкологии радикальное хирургическое лечение РЛ подразумевает пневмонэктомию (удаление всего легкого) или анатомическое удаление части легкого и лимфатических узлов.
Что значит анатомическая резекция легкого?
Это удаление легочной ткани по анатомическому строению легких. Анатомической резекцией является удаление одной доли (лобэктомия), двух долей (билобэктомия), сегмента (сегментэктомия) и бронхопластика легких.
К неанатомической резекции легкого относится атипичная (она же клиновидная или краевая) резекция легкого, применяемая в определенных ситуациях.
Пневмонэктомия — удаление всего легкого целиком.
Лобэктомия — удаление доли легкого, то есть анатомическая резекция доли. При удалении отдельной доли перевязываются входящие в нее сосуды и бронхи. В норме в правом легком три доли, а в левом — две. Соответственно, если удаляют одну долю справа — это одна треть легкого, удаление двух долей (билобэктомия) в правом легком — две трети, а удаление одной доли слева — половина легкого.
Сегментэктомия — удаление одного или нескольких сегментов путем разделения входящих в них сосудистых и бронхиальных структур. Один сегмент составляет приблизительно одну десятую часть легкого. Эта процедура часто применяется для лечения пациентов, которые по медицинским показаниям не смогут перенести удаление большого объема легочной ткани, или при очень маленьких опухолях.

Резекция с бронхопластикой является альтернативой пневмонэктомии или билобэктомии. Эта процедура позволяет сохранить легочную ткань путем удаления доли, содержащей опухоль, с частью вовлеченного бронха в здоровой доле. После удаления пораженного участка здоровые части бронхов сшиваются между собой.

Таким образом, альтернативой полному удалению легкого является бронхопластика с сохранением здоровой части легочной ткани. К сожалению, такие операции не всегда выполнимы, иногда даже во время операции приходится принимать решение об удалении легкого целиком.
Атипичная (клиновидная или краевая) резекция — это неанатомическое удаление части легкого, то есть сосуды и мелкие дыхательные пути не иссекаются и не перевязываются по отдельности. Клиновидная резекция легкого напоминает удаление куска пирога.
Хирургическая резекция легких может быть выполнена:
- открытым способом, то есть торакотомия;
- минимально инвазивными методами:
- видеоассистированная торакоскопическая хирургия;
- робот-ассистированная торакоскопическая хирургия.
Как производятся операции на органах грудной клетки?
Один из наиболее часто используемых доступов (разрезов) при открытых операциях — торакотомия. Разрез производится в одном из межреберных промежутков, его точное место зависит от расположения опухоли и планируемого объема операции. В разрез устанавливается ранорасширитель, чтобы хирурги могли работать инструментами в крайне ограниченном пространстве грудной клетки.
В минимально инвазивной торакальной хирургии используется торакоскоп, соединенный с видеокамерой. Объектив и инструменты, необходимые для проведения операции, вводятся между ребер в грудную полость через несколько небольших разрезов.
В отличие от открытых операций, руки хирурга остаются снаружи и манипулируют инструментами, находящимися внутри грудной клетки.
При роботизированном доступе хирург управляет инструментами с отдельной консоли.
![]()
Хирург во время операции находится за консолью, он видит перед собой изображение операционного поля и управляет инструментами. Непосредственно в теле пациента работает робот-манипулятор, оснащенный камерой и инструментами, которые перемещаются в режиме реального времени в ответ на движения рук хирурга на консоли.
Минимально инвазивные методы все чаще демонстрируют преимущества по сравнению с открытой торакотомией, например, более короткий период восстановления. С точки зрения онкологического прогноза сравнение минимально инвазивных и открытых лобэктомий ранних стадий рака легкого разницы не показало.
Выводы:
При раке легкого наиболее часто выполняется операция по удалению доли легкого с прилежащими лимфатическими узлами. Врачи всегда стараются сохранить максимальное количество здорового органа, поэтому вместо удаления целой доли может быть выполнено удаление сегмента, а вместо удаления целого легкого — резекция с бронхопластикой. И несмотря на, казалось бы, явные преимущества минимально инвазивной хирургии перед открытыми операциями, не всегда это может быть лучшим решением для конкретного пациента. Необходимо обсуждать с хирургом различные варианты оперативного вмешательства.
Сегментарная резекция легкого
Торакоскопическая сегментарная резекция или сегментэктомия легкого - малоинвазивная, технически сложная операция, заключающаяся в удалении сегмента легкого. Ее целью является устранение патологически измененных тканей при сохранении максимального объема здоровых. Хирургическое вмешательство выполняется торакальным хирургом с задействованием специального эндоскопического оборудования, что резко снижает вероятность развития осложнений и сокращает послеоперационный период.
Показания к проведению
Операция выполняется при:
- туберкулезе (кавернозном туберкулезе, туберкулеме легкого, казеозной пневмонии);
- раке легкого, включая периферический рак легкого, метастатическое поражение легкого, карциноид;
- доброкачественных опухолях легкого, в частности хондроме;
- неспецифических заболеваниях легких (бронхоэктатической болезни, буллезной эмфиземе легких, абсцессе легкого);
- врожденных заболеваниях легких (секвестрации, гипоплазии, кисте легкого);
- паразитарных заболеваниях легких и средостения, в частности эхинококкозе.
Противопоказания
Торакоскопическая сегментарная резекция не может быть проведена при:
- нарушениях свертываемости крови;
- инфекционных заболеваниях кожи в области операционного поля;
- диффузных заболеваниях легких, сопровождающихся распространенным поражением легочной ткани;
- декомпенсированных формах хронических заболеваний;
- наличии метастаз злокачественных опухолей в лимфатических узлах.
Также вопрос о рациональности проведения операции ставится при выраженном нарушении дыхательной функции и тяжелом поражении легкого, в том числе обусловленном сопутствующими заболеваниями.
Операция
![Сегментарная резекция легкого]()
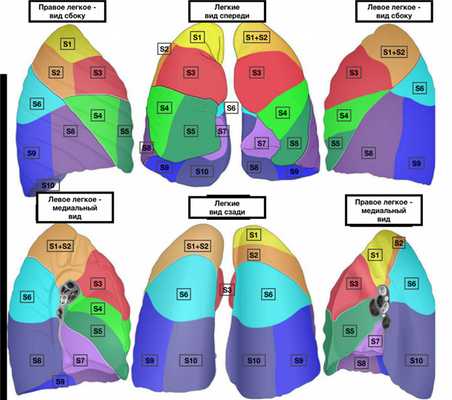
Сегментарная резекция подразумевает удаление одного сегмента легкого, т. е. одной его структурной части. Деление на сегменты условное, но оно выполнено не в произвольном порядке, а по междолевым щелям. Правое легкое имеет 10 сегментов, левое - 9. Они группируются в доли: 3 в правом легком и 2, соответственно, в левом. Каждый легочный сегмент имеет форму неправильной трапеции и свой сегментарный бронх, отдельную ветвь легочной артерии и вены.
Торакоскопическая сегментарная резекция - видеоторакоскопическая операция (VATS), подразумевающая удаление сегмента легкого с помощью эндоскопического оборудования, а именно торакоскопа, снабженного видеокамерой, и двух манипуляторов. Они вводятся в тело через 3 точечных прокола в области грудной клетки, что позволяет сократить до минимума травматизацию тканей, избежать раздвижения ребер и тем самым облегчить послеоперационный период и снизить риск развития осложнений.
Хирургические вмешательства на легких и органах средостения отличаются высокой сложностью из-за особенностей анатомии грудной стенки, сложности строения органов дыхательной системы, что и обусловило более медленное внедрение в торакальную хирургию эндоскопических технологий, тогда как в других областях медицины они применяются уже относительно давно.
![Сегменты легких]()
Анестезиологическое пособие
Операция осуществляется под интубационным наркозом, что предполагает введение в трахею эндотрахеальной трубки, подключенной к специализированному аппарату. В течение всей операции именно он будет «дышать» за пациента, контролировать все жизненные показатели и точно регулировать концентрацию препаратов для поддержания наркоза.
Эндотрахеальный наркоз позволяет регулировать интенсивность легочной вентиляции, вводить миорелаксанты, расслабляющие мышцы, что важно для торакоскопической операции. Также он исключает риск выхода пациента из сна и ухудшение самочувствия в послеоперационный период из-за передозировки препаратами.
Интубация осуществляется после внутривенного наркоза, в результате чего пациент засыпает и не испытывает дискомфорта от введения трубки. Она производится в положении лежа на боку. Для фиксации тела в нужном положении используют специальные валики.
Ход операции
В ходе операции хирург:
- визуально оценивает состояние легочной ткани;
- нагнетает воздух через установленную в трахею трубку, что приводит к раздуванию легких и позволяет идентифицировать подлежащий резекции сегмент;
- пережимает соответствующий сегментарный бронх, чтобы нужный сегмент легкого оставался раздутым;
- «спускает» избыточный воздух из остальных сегментов;
- накладывает лигатуру на питающую выделенный сегмент артерию;
- планомерно удаляет с помощью эндоскопических инструментов пораженный сегмент;
- повторно плавно нагнетает воздух в легкие для выявления их возможных повреждений и кровотечений;
- при отсутствии осложнений накладывает швы.
Для оттока образующегося после хирургического вмешательства экссудата в послеоперационную рану устанавливают 2 дренажные трубки и осуществляют экстубацию (удаление трубки из трахеи). После этого дренажные трубки подключают к аспиратору, а пациента переводят в отделение интенсивной терапии.
Подготовка к операции
Изначально пациент получает консультацию торакального хирурга, во время которой врач подробно описывает сложившуюся ситуацию, объясняет диагноз и последствия отсутствия лечения, рассказывает о предлагаемой операции, особенностях ее выполнения и рисках. После этого пациент получает время на принятие решения.
При согласии на проведение торакоскопической сегментарной резекции легкого больному нужно предоставить медицинскую карту или рассказать врачу об имеющихся хронических заболеваниях, аллергических реакциях, перечислить все принимаемые на постоянной основе лекарственные средства и честно признаться в имеющихся вредных привычках (курение, употребление алкоголя и т. д.). Это важно, так как для снижения риска развития тяжелого кровотечения необходимо отменить или как минимум снизить дозу антикоагулянтов, за месяц до операции отказаться от курения.
Также каждый пациент подвергается комплексному предоперационному обследованию, целью которого является исключение противопоказаний и сбор максимально возможного количества данных для планирования хода хирургического вмешательства. В него входит ряд анализов:
- ОАК и ОАМ;
- определение скорости свертываемости крови;
- определение группы крови, резус-фактора;
- анализ на ВИЧ, сифилис, гепатиты.
Также в обязательном порядке проводятся ЭКГ, иногда назначается ПЭТ-КТ и биопсия.
После завершения обследования его результаты оценивает терапевт, а при наличии хронических заболеваний и профильные специалисты. Если противопоказаний не обнаружено, пациент получает разрешение на проведение операции. После этого совместно с торакальным хирургом определяется дата плановой госпитализации и непосредственно проведения хирургического вмешательства. Поскольку оно выполняется под общей анестезией, как минимум за 10—12 часов до него пациент должен полностью отказаться от употребления пищи и напитков.
Восстановление
Первые 12 часов пациент проводит в отделении интенсивной терапии. В это время медперсонал постоянно следит за жизненными показателями, регулярно проверяет дренажные трубки и вводит обезболивающие и другие препараты.
Через день проводится контрольный ОАК, результаты которого позволяют оценить степень послеоперационной анемии и качество функционирования почек. При отсутствии осложнений пациента переводят в обычную палату, но продолжают мониторинг состояния сердечно-сосудистой системы и дренажных трубок, а также проведение медикаментозной терапии. Нередко требуется кислородная терапия. В первое время питание возможно только жидкой, измельченной пищей.
При торакоскопической сегментарной резекции легкого выписка из стационара обычно осуществляется через 2—3 дня. За это время пациент уже переходит на полутвердую пищу и восстанавливает способность к самообслуживанию. Иногда дренажные трубки удаляют уже после выписки.
Для быстрой и эффективной реабилитации показано:
- проводить занятия по дыхательной гимнастике;
- пройти курс физиотерапевтических процедур;
- продолжать прием назначенных медикаментов (анальгетиков - по требованию);
- соблюдать в течение недели щадящий режим физических нагрузок;
- отказаться от самостоятельно вождения автомобиля на 7 дней;
- соблюдать рекомендованную врачом диету.
После торакоскопической сегментарной резекции легкого обязательно проводятся контрольные осмотры оперировавшим торакальным хирургом.
Преимущества одномоментной резекции легких. Разработка анестезии резекции легких
ФГУ Московский научно-исследовательский онкологический институт им. П.А. Герцена Минздравсоцразвития России, Москва
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН
ФГБУ "МНИОИ им. П.А. Герцена" Минздрава России
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
Одномоментное хирургическое вмешательство при раке легкого с метастатическим поражением головного мозга
Журнал: Онкология. Журнал им. П.А. Герцена. 2013;2(5): 49‑52
Зайцев А.М., Куржупов М.И., Пикин О.В., Картовещенко А.С. Одномоментное хирургическое вмешательство при раке легкого с метастатическим поражением головного мозга. Онкология. Журнал им. П.А. Герцена. 2013;2(5):49‑52.
Zaĭtsev AM, Kurzhupov MI, Pikin OV, Kartoveshchenko AS. One-stage surgery for brain metastases and lung cancer. P.A. Herzen Journal of Oncology. 2013;2(5):49‑52. (In Russ.).Приведенное наблюдение демонстрирует современные возможности одномоментного хирургического лечения при раке легкого с метастатическим поражением головного мозга. Приведен клинический случай синхронного выявления рака легкого с метастазами в головном мозге и последующего симультанного хирургического лечения.
В Российской Федерации статистики по метастатическому поражению головного мозга нет, но считается, что в среднем ежегодно выявляется 14—16 новых случаев на 100 000 населения [1, 2]. Рак легкого стоит на первом месте по частоте метастазирования в головной мозг, достигая 40—60% [3—5]. После выявления метастатического поражения головного мозга медиана выживаемости больных, в зависимости от вида лечения, составляет 5—15 мес [6]. Синхронное выявление первичного опухолевого очага и метастатического поражения головного мозга отмечается в 15—20% случаев и является прогностически неблагоприятным фактором [5]. При анализе отечественной и зарубежной литературы выявлено 3 работы, в которых проводились симультанные операции: 1) в ВМА им. С.М. Кирова МО РФ (Санкт-Петербург) с 1994 по 2004 г. оперированы 9 больных, выживаемость у 6 составила от 1,5 до 2 лет, один больной прожил более 4 лет [7]; 2) в ГВКГ им. Н.Н. Бурденко МО РФ (Москва) с 1980 по 1995 г. оперированы 4 больных, у которых произведена пневмонэктомия и удаление внутримозгового метастаза, хирургическое лечение больные перенесли удовлетворительно [8]; 3) в ГВКГ им. Н.Н. Бурденко МО РФ (Москва) с 1998 по 2008 г. выполнено 3 симультанных операции в объеме пневмонэктомии и удаления внутримозгового метастаза, хирургическое лечение прошло без осложнений [9].
Приводим собственное клиническое наблюдение успешного симультанного лечения рака легкого с метастазом в головном мозге.
Пациентка М., 56 лет, с диагнозом: периферический рак верхней доли правого легкого IV стадии T2N2M1, метастатическое поражение паратрахеальных, трахеобронхиальных лимфатических узлов справа. Метастатическое поражение головного мозга. Осложнение основного заболевания: симптоматическая эпилепсия.
В конце июля 2009 г. развился генерализованный судорожный приступ с потерей сознания. При магнитно-резонансной томографии (МРТ) головного мозга с контрастным усилением (07.09.2009) выявлено 2 объемных образования (одно в левой теменно-затылочной области размером 32×31×29 мм; второе — в правом полушарии мозжечка, округлой формы, диаметром 6 мм) (рис. 1). Рисунок 1. Магнитно-резонансные томограммы головного мозга в Т1-режиме с контрастным усилением, аксиальная проекция, до операции. Метастатическая опухоль в левой теменно-височной области головного мозга (а); метастатическая опухоль в правой гемисфере мозжечка (б). При спиральной компьютерной томографии (СКТ) органов грудной полости (07.09.2009) выявлен периферический рак верхней доли правого легкого (объемное образование с бугристыми лучистыми контурами размером 59×54 мм, неоднородной структуры, с кальцинатом в центре, интимно прилежащее к задней висцеральной плевре), медиастинальная лимфаденопатия (группы медиастинальных лимфатических узлов размерами 8—12 мм) (рис. 2). Рисунок 2. Компьютерная томограмма органов грудной полости. Периферический рак верхней доли правого легкого. 11.09.2009 поступила в МНИОИ им. П.А. Герцена для лечения. Состояние при поступлении удовлетворительное, показатели витальных функций стабильны, компенсированы; неврологически на фоне ясного сознания и наличия признаков внутричерепной гипертензии на глазном дне (застойный диск зрительного нерва) выявляются левополушарная симптоматика в виде умеренного пареза лицевого нерва по центральному типу справа, правосторонней пирамидной недостаточности; мозжечковая симптоматика в виде нарушения координации и статики; пароксизмальная симптоматика, проявляющаяся генерализованными судорожными приступами с потерей сознания, индекс по шкале Карновского 80 баллов.
Проведено дополнительное обследование.
При ультразвуковом исследовании органов брюшной полости, печени, почек, забрюшинного пространства, надключичных областей, шеи, грудной клетки, малого таза (17.09.2009) эхографическая картина периферического образования верхней доли правого легкого с подрастанием к грудной стенке, метастатическое поражение паратрахеальных, трахеобронхиальных узлов справа (конгломерат с признаками выхода процесса за капсулу узлов). Миома матки. Хронический бескаменный холецистит.
При сцинтиграфии скелета (15.09.2009): очаговые аномалии в распределении радиофармпрепарата в костях отсутствуют.
При видеобронхоскопии (16.09.2009) в гортани, трахее и бронхах до 5 порядка видимой опухолевой патологии не выявлено.
![]()
23.09.2009 произведена симультанная операция: верхняя лобэктомия справа, медиастинальная лимфаденэктомия, удаление метастатической опухоли левой теменно-височной области с интраоперационной флюоресцентной навигацией и фотодинамической терапией (рис. 3, см. на цв.вклейке). Рисунок 3. Флюоресцентная диагностика. а — вид головного мозга и внутримозгового метастаза в белом свете; б — режим флюоресценции (красный цвет — опухоль, темносиний — мозговая ткань); в — полость удаленной опухоли в белом свете; г — режим флюоресценции (нет флюоресцирующих участков, опухоль удалена); д — верхняя лобэктомия справа (на держалке верхняя полая вена); е — препарат удаленного легкого.
Под эндотрахеальным наркозом выполнена переднебоковая торакотомия по пятому межреберью справа. Жидкости и диссеминации в плевральной полости не выявлено. В верхней доле правого легкого в проекции S2 определяется узловое образование с пупковидным втяжением в центре размером 3,5×3,5 см. Пальпируются плотные увеличенные лимфатические узлы бронхопульмональной группы. Выполнена передняя и задняя медиастинотомия. Удалены увеличенные корневые, паратрахеальные, трахеобронхиальные лимфатические узлы, клетчатка переднего средостения с лимфатическими узлами. Решено выполнить операцию в объеме верхней лобэктомии. Выделен и обработан передний ствол легочной артерии. Выделена, обработана артерия S2. Выделены верхняя легочная вена и вена верхней доли, последняя обработана по аналогичной методике. Выделен верхнедолевой бронх. Бронхопульмональные лимфатические узлы сдвинуты в сторону удаляемой доли. Верхнедолевой бронх пересечен. При помощи аппарата УО-40 произведено разделение легочной ткани верхней доли от средней и нижней. Препарат удален. Культя бронха ушита отдельными узловыми швами по принятой методике. Разделена легочная связка. Выполнено удаление бифуркационных лимфатических узлов, лимфатических узлов легочной связки. Гемостаз. Промывание плевральной полости, проверка на аэростаз. Дренирование плевральной полости двумя дренажами. Послойное ушивание торакотомной раны. Далее в положении больной лежа на правом боку в левой теменно-височной области выполнен разрез мягких тканей. Костно-пластическая трепанация свободным лоскутом. Твердая мозговая оболочка (ТМО) напряжена, пульсацию мозгового вещества не проводит. Вскрыта линейным разрезом. Выявлено опухолевое образование, выходящее на кору головного мозга в задних отделах теменно-височной области, малинового цвета, с большим количеством патологических сосудов в строме, участками распада, инфильтративным ростом в перифокальную зону. Произведено удаление опухоли путем попеременной диссекции и коагуляции в пределах неизмененного вещества головного мозга, под контролем флюоресцентной навигации. Тщательный гемостаз. Сеанс интраоперационной фотодинамической терапии. Мощность лазера 800 мВт, диффузор 2 см, плотность энергии 80 Дж/см 2 , длительность сеанса 16 мин. Проверка гемостаза компрессией яремных вен на шее. Ложе опухоли выложено фрагментами гемостатической марли. Мозговое вещество запало, появилась отчетливая пульсация. ТМО ушита атравматической иглой. Костный лоскут уложен на место, фиксирован по периметру узловыми швами. Послойные швы на мягкие ткани. Повязка.
Гистологическое исследование: 1) малодифференцированный неороговевающий рак верхней доли правого легкого с обширными очагами некроза, периваскулярным, периневральным ростом, раковыми эмболами в расширенных сосудистых щелях, в том числе вблизи опухоли. Опухоль прорастает в висцеральную плевру без вовлечения прилежащих скелетных мышц. Метастаз рака в одном бронхопульмональном лимфатическом узле, инфильтративный рост за пределы капсулы. Метастазы в лимфатических узлах; 2) метастаз рака в ткань головного мозга.
Контрольные КТ (24.09.2009) (рис. 4) Рисунок 4. Компьютерная томограмма головного мозга, аксиальная проекция, выполненная в первые сутки после операции. Опухоль в левой теменно-височной области удалена, данных об осложнениях нет. и МРТ (28.09.2009) (рис. 5) Рисунок 5. Магнитно-резонансные томограммы головного мозга в Т1-режиме без контрастного усиления, аксиальная проекция, после операции. Опухоль в левой теменно-височной области удалена, данных за осложнения нет (а); опухоль в левой теменно-височной области удалена, накопления контраста нет (б); опухоль в правой гемисфере мозжечка без динамики (в). головного мозга с контрастным усилением подтвердили удаление опухоли левой теменно-височной области, данных за ишемические и геморрагические осложнения нет. Остается второе объемное образование в правом полушарии мозжечка диаметром до 6 мм.
Контрольная рентгенография органов грудной клетки (30.09.2009): левое и оставшаяся часть правого легкого расправлены, воздушны. Тень органов средостения практически не смещена. Плевральные синусы свободны.
Послеоперационный период протекал гладко. Послеоперационные раны зажили первичным натяжением. 06.10.2009 выписана в удовлетворительном состоянии с положительной динамикой в неврологическом статусе — регрессировала левополушарная симптоматика, сохраняется мозжечковая симптоматика, пароксизмальной симптоматики за время стационарного лечения не отмечено.
В НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН 12.10.2009 на установке «Гамма-нож» проведено лечение объемного образования в правом полушарии мозжечка.
16.10.2009 на консилиуме, учитывая анамнез, объем проведенного лечения, гистологический характер опухоли, рекомендована лучевая терапия легких. В октябре—ноябре 2009 г. проведена лучевая терапия легких.
![]()
17.11.2009 при МРТ головного мозга выявлены новые полушарные метастазы (1—1,5 см в диаметре) (рис. 6). Рисунок 6. Магнитно-резонансные томограммы головного мозга в Т1-режиме с контрастным усилением, аксиальная проекция, контроль 17.11.2009. Выявлены новые метастатические опухоли в правой лобной доле (а); в левой лобной доле (б). 18.12.2009 стереотаксическая радиохирургия (СРХ) на «Гамма-ноже». 20.01.2010 при МРТ головного мозга выявлены новые метастазы (1—1,5 см в диаметре). 29.01.2010 на консилиуме рекомендовано облучение всего головного мозга (ОВГМ), от которого больная отказалась. 09.03.2010 СРХ на «Гамма-ноже» (2 очага). 23.03.2010 при МРТ головного мозга выявлены новые метастазы в головном мозге. В апреле 2010 г. на консилиуме повторно рекомендовано ОВГМ, которое проведено в мае—июне 2010 г. С июля 2010 г. получала полихимиотерапию по схеме EP. В декабре 2010 г. при контрольном обследовании выявлена генерализация опухолевого процесса, рекомендовано симптоматическое лечение. В марте 2011 г. больная скончалась.
Заключение
Приведенное наблюдение демонстрирует возможность симультанной операции у больных раком легкого с метастатическим поражением головного мозга, эффективность и безопасность данного лечения. Больная прожила 18 мес при медиане выживаемости данной группы больных 9 мес.
Первый опыт одномоментной резекции легкого и экстраплеврального пневмолиза с установкой силиконовой пломбы при распространенном деструктивном лекарственно-устойчивoм туберкулезe легких: клинический случай
![Обложка]()
Обоснование. Рост числа больных с лекарственно-устойчивыми формами распространенного деструктивного туберкулеза легких диктует не только необходимость расширения показаний к хирургическому лечению, но и разработки новых интраоперационных технологий, снижающих риск развития послеоперационных осложнений и дальнейшего прогрессирования туберкулезного процесса. При длительном хроническом течении деструктивного лекарственно-устойчивого туберкулеза достичь стабилизации процесса, необходимой для успешного выполнения резекции легкого, часто бывает невозможным. Торакопластические операции, обычно выполняемые при противопоказаниях к резекционным вмешательствам, являются не только травматичными для больного, но и не обеспечивают должной степени компрессии легкого.
Описание клинического случая. Представлен клинический пример больного распространенным фиброзно-кавернозным туберкулезом с широкой лекарственной устойчивостью возбудителя, у которого кавернозные изменения наблюдались на фоне выраженного цирроза легочной ткани. Чтобы достичь эффекта, выполнена экстраплевральная резекция легкого, после которой одномоментно с целью предотвращения перерастяжения оставшейся части легкого экстраплеврально была установлена силиконовая пломба. Данные гистологического исследования операционного материала подтверждают выраженную степень активности туберкулезного воспаления, несмотря на предшествующую длительную противотуберкулезную терапию.
Заключение. Благодаря низкой травматичности и высокой эффективности операция симультантного экстраплеврального пневмолиза с пломбировкой силиконовым имплантом и резекции легкого может быть использована в комплексном лечении распространенного деструктивного туберкулеза легких с широкой лекарственной устойчивостью возбудителя и длительным хроническим рецидивирующим течением заболевания.
Ключевые слова
Полный текст
ОБОСНОВАНИЕ
Известно, что применение хирургических методов увеличивает эффективность лечения фиброзно-кавернозного туберкулеза до 75% [1, 2]. Распространенный характер деструктивного процесса на фоне низкой эффективности противотуберкулезной химиотерапии вследствие множественной или широкой лекарственной устойчивости микобактерий туберкулеза часто делает невозможным выполнение резекционной операции [3], поэтому чаще приходится обращаться к коллапсохирургии, эффективность которой составляет 53-70% [4].
Операция экстраплевральной торакопластики с резекцией 5-8 ребер крайне травматична, поскольку деформирует и изменяет экскурсию грудной клетки, приводит к нарушению функции плечевого пояса [5]. По этой причине многие больные фиброзно-кавернозным туберкулезом с множественной или широкой лекарственной устойчивостью микобактерий часто отказываются от торакопластики, что снижает эффективность их лечения. До настоящего времени ведется поиск эффективного коллапсохирургического метода — альтернативы традиционной торакопластике [5, 6], при этом хорошо себя зарекомендовал разработанный в Центральном научно-исследовательском институте туберкулеза (Москва; далее ЦНИИТ) экстраплевральный пневмолиз силиконовым имплантом, который обеспечивает стойкий коллапс полостных образований в измененном туберкулезным процессом легком и не изменяет конфигурации грудной клетки. Метод защищен патентом [7]. В качестве пломбы используется силиконовый имплант молочной железы, предназначенный для постоянного нахождения в организме человека и не вызывающий реакцию отторжения. Иногда из-за цирротической деформации легочной ткани плотности импланта бывает недостаточно для обеспечения необходимого коллабирующего эффекта. Поэтому возникла необходимость выполнения в этих условиях одномоментного экстраплеврального пневмолиза и экстраплевральной резекции легкого. Приводим клинический пример первого опыта подобной успешной операции у больного деструктивным туберкулезом легких с широкой лекарственной устойчивостью микобактерий возбудителя и наличием цирротического компонента.
КЛИНИЧЕСКИЙ ПРИМЕР
О пациенте
Пациент А., 48 лет, житель Республики Дагестан, поступил на лечение в хирургический отдел ЦНИИТ 23.03.2016. Из анамнеза: болен с 2013 года, когда появились жалобы на кашель с мокротой слизисто-гнойного характера, подъем температуры до субфебрильных цифр, кровохарканье. Обратился к фтизиатру по месту жительства, установлен диагноз «Инфильтративный туберкулез легких в фазе распада». Назначена противотуберкулезная химиотерапия в объеме изониазид в дозе 0,6 г/ сут, этамбутол по 1,8 г/сут, протионамид по 5,0 мг/ сут, пиразинамид по 1,5 г/сут, левофлоксацин по 1,5 г/ сут. Отмечалась отрицательная динамика, процесс трансформировался в фиброзно-кавернозный туберкулез, из-за чего больной был направлен в ЦНИИТ, и в связи с эпизодами кровохарканья в анамнезе 31.10.2015 был госпитализирован в хирургическое отделение.
На момент поступления: состояние больного удовлетворительное. Жалобы на кашель со слизисто-гнойной мокротой, одышку при сильной физической нагрузке. При аускультации: дыхание ослаблено в верхних отделах справа, где прослушиваются влажные разнокалиберные хрипы. Частота дыхательных движений 16/мин, пульс 76/ мин, артериальное давление 120/80 мм рт.ст., тоны сердца ясные, ритмичные. Живот мягкий, безболезненный. Физиологические отправления в норме.
На обзорных рентгенограммах и компьютерной томографии легких определяется фиброзное сморщивание верхней доли и S6 правого легкого, S1-2 левого легкого. Множественные разнокалиберные тонко- и толстостенные каверны: крупные в верхних отделах и мелкие в нижних отделах правого легкого (рис. 1).
Рис. 1. Рентгенографическое (А) и КТ (Б) исследование органов грудной клетки у больного А. при поступлении (описание в тексте)
Функция внешнего дыхания: жизненная емкость легких 62,9% д.в., объем форсированного выдоха за 1 сек 48,1% д.в.; газовый состав крови: РаО2 61 мм рт.ст., SaО2 90,9%, РаСО2 42 мм рт.ст. Снижение вентиляционной способности легких по смешанному типу, умеренное снижение жизненной емкости легких. Умеренная артериальная гипоксемия.
Электрокардиограмма: ритм синусовый, перегрузка правого предсердия.
Исследование мокроты методом люминесцентной микроскопии выявило кислотоустойчивые микобактерии (+++) трехкратно, методом полимеразно-цепной реакции обнаружена ДНК микобактерий. При посеве на жидких питательных средах (BACTEC MGIT 960) выявлен рост культуры микобактерий с лекарственной устойчивостью к изониазиду, рифампицину, этамбутолу, этионамиду, капреомицину, амиацину, фторхинолонам; сохранена чувствительность микобактерий к линезолиду.
Общий анализ крови: гемоглобин 142 г/л, лейкоциты 6,4×10 9 /л, палочкоядерные 1%, сегментоядерные 53%, эозинофилы 4%, лимфоциты 29%, моноциты 3%, скорость оседания эритроцитов 20 мм/ч (W).
Диагноз, лечение
Установлен клинический диагноз: «Фиброзно-кавернозный туберкулез правого легкого в фазе обсеменения. Микобактерии (+). Широкая лекарственная устойчивость микобактерий».
Больному с учетом полученных данных о широкой лекарственной устойчивости микобактерий в отделении проводились противотуберкулезная химиотерапия по схеме: моксифлоксацин, теризидон, пиразинамид, ПАСК (парааминосалициловая кислота), линезолид, капреомицин в дозировках, соответствующих массе тела больного, а также витаминотерапия и гепатопротекторы. В качестве патогенетического лечения накладывался искусственный пневмоперитонеум; проведен курс внутривенного лазерного облучения крови: 15 ежедневных процедур длительностью 8 мин при помощи полупроводникового арсенид-галлиевого лазера с длиной волны 630 нм, мощностью 25 мВт на частоте 3000 Гц.
В результате у больного наблюдалась положительная клинико-рентгенологическая динамика: прибавка в весе на 6 кг за 6 мес, стойкое абациллирование, дальнейшее рассасывание перифокальной инфильтрации и уплотнение очагов обсеменения по данным контрольных рентгенограмм.
Больной был осмотрен на консилиуме: учитывая двустороннюю распространенность процесса, решено выполнить экстраплевральный пневмолиз справа с установкой силиконовой пломбы.
На операции 18.05.2016 при выполнении экстраплеврального пневмолиза выявлен выраженный цирроз верхушки легкого, на фоне которого определялась ригидная фиброзная каверна с измененной плеврой в ее проекции. Принято решение о экстраплевральной резекции ригидного участка. Таким образом, S1-2 правого легкого, содержащие каверну, резецированы с помощью наложения сшивающего аппарата «СОМИ-80», после чего установлена силиконовая пломба объемом 275 мл. Положение пломбы представлено на рис. 2. Продолжительность операции составила 175 мин, кровопотеря — 610 мл.
![]()
Рис. 2. Положение импланта в экстраплевральном пространстве после выполнения резекции верхней доли правого легкого
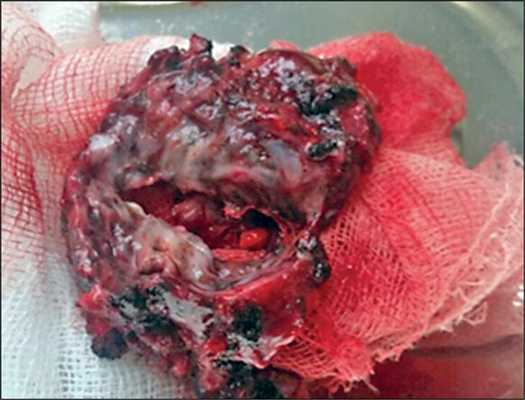
На макропрепарате (рис. 3) видна цирротически измененная легочная ткань, на фоне которой определяется толстостенная каверна, содержащая жидкие казеозные массы, окруженная более мелкими очагами казеоза.
![]()
Рис. 3. Удаленный фрагмент легкого с фиброзной каверной
Согласно гистологическому заключению № 2475-84/16 (рис. 4, 5), в ткани легкого имеются очаги казеозного некроза, большинство из которых с признаками организации в виде соединительнотканной капсулы с элементами грануляционной ткани. По периферии слабовыраженная эпителиоидно-клеточная реакция и лимфоидные скопления, встречаются единичные многоядерные макрофаги (см. рис. 4А). Один из очагов казеозного некроза с расплавлением и лейкоцитарной инфильтрацией (см. рис. 4Б).
![]()
Рис. 4. А — морфологические признаки прогрессирования фиброзно-кавернозного туберкулеза, участок гематогенного отсева. Б — расплавление казеозных масс с лейкоцитарной инфильтрацией стенок туберкулезной каверны. Окраска гематоксилином и эозином, ×120
Заключение: «Морфологическая картина соответствует фиброзно-кавернозному туберкулезу с обсеменением и выраженной активностью процесса, что можно расценить как прогрессирование».
Послеоперационный период без особенностей, дренаж удален на 3-и сут, швы сняты на 10-е сут после операции.
Больной завершил лечение по рекомендациям ЦНИИТ, вернулся к привычному образу жизни, самочувствие его удовлетворительное.
Рентгенографическое и компьютерно-томографическое исследование через 1,5 мес после операции: в динамике дальнейшее расправление правого легкого под пломбой. Дополнительных очагово-инфильтративных изменений в легких не выявлено (см. рис. 5).
![]()
Рис. 5. Рентгенографическое исследование от 04.07.16 и КТ органов грудной клетки от 22.06.2016 при выписке
ОБСУЖДЕНИЕ
Клинико-рентгенологические особенности и данные морфологического исследования операционного материала у больных распространенным деструктивным туберкулезом с множественной или широкой лекарственной устойчивостью микобактерий доказывают активный характер туберкулезного процесса без тенденции к отграничению и заживлению очагов воспаления. Поэтому коллапсохирургические операции, которые в отличие от резекций обеспечивают биомеханический покой легочной ткани, создают условия для заживления полостей и рассасывания инфильтративных и очаговых изменений в легком, становятся все более востребованными.
Все шире внедряется в клиническую практику экстраплевральный пневмолиз силиконовым имплантом, который обеспечивает максимальный эффект компрессии полостных образований. В то же время при длительном течении деструктивного процесса развиваются фиброзные изменения легочной ткани и стенок каверны, в результате чего достичь полноценного коллапса полостей с помощью пломбы обычно не удается. В данной ситуации, согласно нашему опыту, целесообразно выполнение одномоментной экстраплевральной резекции легкого и пломбировки силиконовым имплантом, что препятствует перерастяжению оставшейся легочной ткани, предотвращая развитие эмфиземы и прогрессирование туберкулезного воспаления в оставшихся очагах.
ЗАКЛЮЧЕНИЕ
Резекционные операции, направленные на санацию очага туберкулезной инфекции, можно сочетать с коллапсохирургическими технологиями, способствующими заживлению полостей и рассасыванию казеозных масс. Сочетание этих методик может быть оптимальным при прогрессирующем распространенном деструктивном туберкулезе легких с широкой лекарственной устойчивостью микобактерий с преобладанием цирротического компонента. Симультантность экстраплевральных резекций и пломбировки после комплексной предоперационной подготовки с использованием таких патогенетических методов, как внутривенное лазерное облучение крови и искусственный пневмоперитонеум, демонстрирует эффективность подобного подхода в достижении стойкого клинического излечения пациента с хроническим рецидивирующим течением заболевания.
Информированное согласие
От пациента получено информированное согласие на использование его персональных данных в качестве иллюстраций профессиональной деятельности, а также в научной работе, статьях и обучающих материалах.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Работа выполнена в рамках темы НИР № 0515-2019-0017 «Разработка хирургических методов лечения распространенного туберкулеза органов дыхания и костно-суставной системы».
КОНФЛИКТ ИНТЕРЕСОВ
Авторы подтверждают отсутствие конфликта интересов, который необходимо обнародовать.
УЧАСТИЕ АВТОРОВ
Е.В. Красникова — разработка концепции, написание текста, создание дизайна исследования; Л.Н. Лепеха — разработка концепции, проведение и анализ патогистологического изучения операционного материала с определением степени активности туберкулезного воспаления; В.К. Алиев — подготовка иллюстраций, форматирование текста; А.Э. Эргешова — курация пациента весь период его нахождения в клинике, участие в операции; Р.В. Тарасов — подготовка текста, выбор иллюстраций, редактирование; М.А. Багиров — разработка органосохраняющего направления во фтизиохирургии, создание концепции данного клинического наблюдения, выполнение операции.
Удаление злокачественных опухолей легкого
Операции при злокачественных опухолях легких — сложные хирургические вмешательства, которые сопровождаются риском серьезных осложнений и требуют длительного восстановительного периода. Их могут выполнять только торакальные , имеющие соответствующий опыт, в клиниках, где есть операционные, оборудованные соответствующим образом. Существуют малоинвазивные техники, которые позволяют снизить риски и сократить восстановительный период.
![Щербаков Сергей Анатольевич]()
В международной клинике Медика24 для этого есть все необходимое. В наших операционных установлена современная аппаратура экспертного класса от ведущих мировых производителей. У нас работают ведущие врачи, которые могут правильно оценить состояние пациента, определить оптимальный объем хирургического вмешательства, правильно подготовить к нему больного. Они выполняют операции любой степени сложности, в том числе малоинвазивные, торакоскопические.
Радикальные операции являются основным методом лечения при ранних стадиях немелкоклеточного рака легкого (НМРЛ) — это наиболее распространенная форма заболевания, на нее приходится 85% случаев. При мелкоклеточном раке легкого (МРЛ), на который приходятся оставшиеся 15%, показания к хирургическому вмешательству намного более ограничены. Такие злокачественные опухоли на момент установления диагноза обычно уже успевают сильно распространиться в организме и являются неоперабельными. Мелкие единичные новообразования, которые можно удалить, встречаются менее чем у одного из 20 пациентов.
Как пациента готовят к операции по поводу рака легкого?
Перед хирургическим вмешательством больной проходит всестороннее обследование, которое помогает оценить размер, локализацию, количество опухолевых очагов, стадию заболевания, выявить очаги в регионарных лимфатических узлах и отдаленные метастазы. Это помогает разобраться, возможна ли радикальная операция в данном случае, и какой вариант хирургического вмешательства оптимален. Применяют такие методы диагностики, как компьютерная томография, томография, , цитологическое исследование мокроты, биопсия ткани легкого. Могут быть назначены эндоскопические исследования: бронхоскопия, эзофагоскопия (исследование пищевода), эндоУЗИ. Чтобы оценить состояние внутригрудных лимфатических узлов, выполняют медиастиноскопию. Торакоскопия позволяет провести биопсию, оценить состояние плевры.
![Предоперационные обследования]()
Также в предоперационное обследование входят:
- Функциональные легочные тесты. Они помогают оценить дыхательную функцию, выяснить, сможет ли ее обеспечить оставшаяся легочная ткань.
- Оценка состояния системы и других внутренних органов.
- Стандартное предоперационное обследование, которое включает общий и биохимический анализы крови, общий анализ мочи, исследование свертываемости, группы крови, , тесты на инфекции (ВИЧ, сифилис, вирусные гепатиты).
Хирург должен выяснить, какими сопутствующими заболеваниями страдает пациент, какие лекарственные препараты он постоянно принимает, есть ли у него аллергические реакции на лекарства.
Предварительно врач объясняет пациенту, какой вид операции планируется, с какой целью, каковы возможные риски, какие могут быть осложнения, последствия. Получив от доктора всю необходимую информацию, пациент или его законный представитель должен подписать информированное письменное согласие.
Как показывает статистика, удаление злокачественных опухолей легких возможно лишь примерно у 30% пациентов. У остальных противопоказаниями к радикальной операции становятся:
- прорастание злокачественной опухоли в соседние органы, в результате чего ее невозможно удалить полностью;
- злокачественная опухоль в пределах легкого, которая неоперабельная размеров, особенностей локализации;
- множественные метастазы;
- выраженная дыхательная, недостаточность;
- тяжелые поражения внутренних органов.
Разновидности операций по удалению злокачественных опухолей легких
Все хирургические вмешательства при злокачественных опухолях легких выполняются под общей анестезией. Объем операций бывает разным, в зависимости от размера, локализации злокачественного новообразования, функционального состояния легких. Обычно хирурги стремятся выполнить вмешательство в максимально возможном объеме, так как за счет этого удается с максимальной вероятностью удалить всю опухолевую ткань и добиться минимального риска рецидива.
- — предпочтительное и наиболее распространенное хирургическое вмешательство при раке легкого. Во время него удаляют долю органа. Анатомически правое легкое состоит из трех долей, левое — из двух долей, разделенных бороздами.
- Пневмонэктомия (пульмонэктомия) — удаление всего легкого. Такое вмешательство может быть показано при центральном раке легкого. — удаление сегмента легкого. Эту операцию также называют клиновидной резекцией, во время нее удаляют часть доли. Таким хирургическим вмешательствам отдают предпочтение, когда нужно максимально сохранить легочную ткань, если есть риск того, что она не сможет полноценно справляться со своей функцией после удаления целой доли.
- Рукавная лобэктомия является альтернативой пневмонэктомии, когда злокачественная опухоль находится в главном или долевом бронхе. Хирург пересекает бронх выше и ниже пораженного участка и удаляет его. Затем соединяют оставшиеся концы.
Во время всех этих операций, помимо легочной ткани, удаляют близлежащие лимфатические узлы, так как в них тоже могут находиться раковые клетки.
Читайте также:
- УЗИ, рентгенограмма при гипофасфатазии у плода
- Клиника опухоли головного мозга и ее диагностика
- Показания к операции при неспецифическом язвенном колите. Виды операций при язвенном колите.
- Третий и четвертый тоны сердца при сердечной недостаточности. Хрипы и отеки при сердечной недостаточности
- Причины и механизмы развития гистиоцитозов из клеток Лангерганса. Этиология, патогенез