Пренатальная диагностика патологии сердечно-сосудистой системы.
Добавил пользователь Валентин П. Обновлено: 08.01.2026
1 Кыргызский государственный медицинский институт переподготовки и повышения квалификации им. С.Б. Даниярова
Проблема врожденных пороков развития остается актуальной на сегодняшний день, в частности врожденные пороки сердца являются одной из основных причин детской смертности. Важной задачей акушерской службы является своевременная постановка диагноза, что включает в себя качественное скрининговое УЗИ, при необходимости детальный осмотр сердца плода. Необходимо отметить, что до настоящего времени нет конкретной связи с какими-либо факторами развития сердечной патологии, поэтому своевременная и грамотная внутриутробная диагностика пороков сердца играет важную роль. В данной статье проведен анализ 48 случаев различных врожденных пороков сердца, среди которых встречались как изолированные сердечные аномалии, так и сочетание с дефектами других систем. Сложные пороки сердца в большинстве случаев закончились летально. Изолированные дефекты межжелудочковой перегородки, которые в большинстве случаев имеют хороший прогноз, у плодов наших пациенток сочетались с хромосомными и генетическими заболеваниями. Наиболее ранний срок описания структуры пороков сердца пришелся на 18 недель беременности. Обучение врачей пренатальной диагностики правильному обследованию при врожденных пороках сердца, оснащение диагностических кабинетов ультразвуковыми аппаратами экспертного класса позволят значительно повысить качество выявления внутриутробной кардиальной патологии, а также сочетанных пороков развития плода.
1. Бокерия Е.Л. Перинатальная кардиология: настоящее и будущее. Часть 1: врожденные пороки сердца // Российский вестник перинатологии и педиатрии. 2019. № 3. С. 5-10.
2. Pavliceka J., Gruszkaa T., Kapralovab S., Prochazkac M., Silhanovad E., Kaniovad R., Polanskaa S., Cernickovac R., Klaskova E. Associations between congenital heart defects and genetic and morphological anomalies. The importance of prenatal screening. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2019. Vol. 163. No. 1. P. 67-74.
3. Тюменева А.И. Пренатальная диагностика сложных врожденных пороков сердца: автореф. дис. … канд. мед. наук. Москва, 2008. 24 с.
4. Чепурных Е.Е., Григорьев Е.Г. Врожденные пороки сердца // Сибирский медицинский журнал (Иркутск). 2014. № 3. С. 121-127.
5. Hernandez-Andrade E., Patwardhan M., Cruz-Lemini M., Luewan S. Early evaluation of the fetal heart. Fetal Diagnosis and Theraphy. 2017. Vol. 42. P. 161-173.
6. Charafeddine F., Hachem А., Kibbi N., Abutaqa M., Bitar F., Bulbul Z., El-Rassi I., Arabi M. The first fetal echocardiography experience for prenatal diagnosis of congenital heart disease in Lebanon: successes and challenges. J Saudi Heart Associations. 2019. Vol. 31. P. 125-129.
7. Bravo-Valenzuela N., Peixoto A. B., Júnior E. A. Prenatal diagnosis of congenital heart disease: a review of current knowledge. Indian heart journal. 2018. Vol. 70. P. 150-164.
8. Jortveit J., Wik G., Degaard J. S., Sitras V., Perminov K.V., Holmstrom H. Diagnosis of severe congenital heart defects in Norway 2016. Tidsskrift for Den norske legeforening. 2019. P. 1-8.
9. Медведев М.В., Кубрина М.В., Галкина О.Л., Копытова Е.И., Полотова Е.В., Марченко Н.П. Атрезия легочной артерии с дефектом межжелудочковой перегородки: мультицентровой анализ случаев пренатальной диагностики // Пренатальная диагностика. 2017. Т. 16. № 2. С. 108-116.
Сердечная патология является одной из основных причин детской смертности и находится на втором месте среди причин младенческой смертности. Частота составляет 8 случаев на 1000 новорожденных [1, 2].
Неблагоприятный прогноз для жизни представляют сложные врожденные пороки сердца (ВПС). Под термином «сложный» понимают такие сердечные аномалии, как гипоплазированные камеры сердца, атрезии клапанов, аномальное отхождение магистральных сосудов, единственный желудочек, то есть изменения в сердце, при которых невозможно выполнить полную хирургическую коррекцию [3].
Критические пороки сердца, требующие хирургического вмешательства в ранний неонатальный период, составляют 25 % от всех врожденных сердечных аномалий. В первую неделю умирает 29 % новорожденных, к концу первого года жизни - 87 % [4].
Первое ультразвуковое скрининговое обследование (11-13 недель) является важным осмотром. В случае обнаружения увеличения толщины воротникового пространства, отклонения сердечной оси, рекомендуется расширенное обследование сердца (фетальная эхокардиография). При рутинном ультразвуковом исследовании лишь в 40 % выявляются пороки сердца у плодов, при том что детальный осмотр позволяет выявлять до 90 % сердечных пороков внутриутробно. Для своевременного выявления врожденных пороков сердца необходимо детально обследовать сердце плода ультразвуковым методом при втором скрининговом обследовании (18-22 недели) [5, 6].
Применяя фетальную эхокардиографию, возможно определить структуру порока и спрогнозировать исход для плода [7]. Особенно это касается сложных пороков сердца, так как имеет место позднее выявление патологии, при осмотре неонатологом в родильном доме или после выписки домой [8].
Данная тема является актуальной. Врачи пренатальной диагностики встречаются с трудностями точного определения структуры сердечных пороков, что связано с большой вариабельностью кардиальной аномалии у плодов.
Задачей врачей-гинекологов является правильная тактика ведения беременной после установки диагноза, так как своевременная хирургическая помощь спасает жизни детей и влияет на качество дальнейшей жизни.
Цель исследования: проанализировать течение беременности при выявлении кардиальной патологии у плодов, определить точность внутриутробной диагностики, описать случаи сочетания сердечных пороков с патологией развития других органов плода.
Материалы и методы исследования
В центре диагностики матери и плода «Family» г. Бишкек с января 2019 г. по ноябрь 2020 г. было осмотрено 48 беременных женщин с пороками сердца плода, требующими хирургической коррекции после рождения. Всем новорожденным было проведено эхокардиографическое обследование после родов врачами-кардиологами для уточнения структуры пороков. В случаях прерывания беременности, для подтверждения диагноза проводилось патологоанатомическое вскрытие.
Осмотр беременных выполнялся на ультразвуковых аппаратах General Electric (GE) Voluson E8 и E10, c использованием программы fetal heart. Также использовалась программа STIC (постобработка снимков, полученных в режиме объемного сканирования), основным являлся двумерный режим с цветовым и импульсным доплеровским картированием. У всех пациентов было получено информированное согласие на участие в нашем исследовании. Результаты были обработаны путем вычисления относительных величин (в %).
Результаты исследования и их обсуждение
Среди 48 плодов с ВПС сложные пороки сердца были в 40 случаях (83,3 %). Из общего количества умерли после родов 23 ребенка (47,9 %). Прервали беременность 3 женщины (6,2 %), в двух случаях проводилось патологоанатомическое вскрытие плодов. Третья беременная после заключения медицинской комиссии прервала беременность в сроке 31 неделя, в связи с плохим прогнозом для жизни ребенка. Диагноз был подтвержден методом эхокардиографии.
Из факторов риска, по анализам обменных карт, острые респираторные вирусные инфекции (ОРВИ) до 12 недели перенесли 14 женщин (29,1 %), ОРВИ во втором триместре перенесли 4 женщины (8,3 %). Анемия легкой степени имела место в 12 случаях (25,0 %), хроническая ревматическая болезнь сердца у матери - один случай (2,0 %). Многоплодные беременности как фактор риска в нашем случае встречались в двух случаях (4,1 %), обе дихориальные, диамниотические двойни.
Количество плодов мужского пола составило - 31 (64,5 %), женского 17 (35,4 %). Маловесными (вес менее 2600 г.) родились 9 детей (18,7 %), из них 8 имели сочетание порока сердца с ненормальным развитием других органов, в одном случае порок сердца был изолированным.
При ультразвуковом исследовании фетоплацентарное нарушение кровотока 1 степени выявлено у одной беременной (2,0 %), задержка внутриутробного развития у 4 (8,3 %), маловодие у 2 (4,1 %), многоводие у 5 (10,4 %), причем избыточное количество вод во всех случаях сочеталось с множественными пороками развития.
Сложности при ультразвуковом осмотре вызывали неправильное положение плода, большой срок гестации (после 35 недель), многоводие, маловодие. Необходимо отметить, что технология STIC информативна при осмотрах четырехкамерной проекции сердца (пороки атривентрикулярных клапанов, гипоплазии желудочков, дефекты межжелудочковой перегородки). Для осмотра выходных трактов желудочков, особенно при повороте оси сердца, осмотр в двумерном режиме является предпочтительным. Также для осмотра органов других систем маловодие и неудобное положение плода являются помехами для трехмерного ультразвука.
Структура выявленных пороков оказалась многообразна. Нами были диагностированы: у 5 плодов (10,4 %) двойное отхождение сосудов от правого желудочка, аномалия Эбштейна - 1 (2,0 %), транспозиция магистральных сосудов - 3 (6,2 %), стеноз легочной артерии - 7 (14,5 %), изолированный перимембранозный дефект межжелудочковой перегородки - 3 (6,2 %), декстрапозиция аорты с дефектом межжелудочковой перегородки - 5 (10,4 %), атрезия легочной артерии - 4 (8,3 %), атриовентрикулярный канал -5 (10,4 %), тетрада Фалло - 6 (12,5 %), перерыв дуги аорты - 1 (2,0 %), атрезия трикуспидального клапана - 1 (2,0 %), атрезия митрального клапана - 4 (8,3 %), из них в двух случаях аортальный клапан был атрезирован, также в двух случаях имелось двойное отхождение сосудов от правого желудочка. Коарктация аорты составила один случай (2,0 %), единственный желудочек - 2 (4,1 %).
После рождения вскрытие проводилось в одном случае - ребенку с аномалией Эбштейна, который умер в родильном доме на вторые сутки. Согласно заключению патологоанатома, причиной смерти стала острая сердечная недостаточность, дилатация полостей сердца, острый венозный застой внутренних органов.
В двух случаях единственного желудочка диагностика оказалась затруднительной как внутриутробно, так и после родов. В первом случае трикуспидальный клапан был атрезирован и полость правого желудочка практически отсутствовала, также имелся единый сосуд, исходящий из функционально единого желудочка. После родов рекомендовалась компьютерная томография для уточнения диагноза. При телефонном разговоре с матерью мы узнали, что в возрасте 10 месяцев ребенок еще не прошел полного обследования, но в развитии значительно отставал, не мог переворачиваться и самостоятельно не сидел.
Во втором случае мы диагностировали правосформированное, праворасположенное сердце в сочетании с единым атриовентрикулярным клапаном, двойным отхождением сосудов от правого желудочка, ребенок умер в первый месяц жизни.
Среди плодов с кардиальной патологией в 6 случаях (12,5 %) было сочетание с хромосомными аберрациями и генетическим заболеванием: синдромом Дауна - 4 случая, синдромом Ди Джорджи - один случай; также наблюдался один случай редкой генетической патологии (синдром Холта - Орама, наследственное заболевание, сочетание порока сердца с отсутствием первого пальца на кистях обеих рук до аплазии лучевой кости).
После родов успешно прооперированы были двое детей с тетрадой Фалло, также двое детей со стенозом клапана легочной артерии. Один ребенок с диагнозом двойного отхождения сосудов от правого желудочка благополучно оперирован в Турции. К сожалению, в случаях транспозиции магистральных сосудов и единственного желудочка детям было отказано в проведении оперативного лечения как местными, так и зарубежными хирургами в связи с высоким риском смерти сразу после операции.
Приводим наблюдение о несовпадении нашего диагноза с эхокардиографическим заключением после родов. В нашем центре при плановом обследовании на 30 неделе беременности был установлен диагноз коарктации аорты с дефектом межжелудочковой перегородки. В родильном доме при проведении эхокардиографии был выявлен только дефект мышечной перегородки, коарктация была исключена. Ребенок умер через 2 недели после родов, от вскрытия родители отказались. Мы пришли к выводу, что портативные ультразвуковые аппараты, на которых обследуют детей в родильных домах, могут вызывать сложности визуализации и неполную диагностику, что связано с менее четким изображением, чем на стационарном оборудовании.
По данным литературы, внутриутробная диагностика пороков сердца возможна с 13 недели беременности, в частности таких сложных для выявления ВПС, как атрезия легочной артерии [9]. В нашем центре плод с атрезией легочной артерии и дефектом межжелудочковой перегородки был выявлен в 18 недель беременности. Данная беременность была прервана в связи с неблагоприятным прогнозом для жизни. Патологоанатомическое вскрытие подтвердило диагноз. По нашему мнению, 18 неделя беременности (второе скрининговое обследование) является наиболее ранним сроком для точного определения структуры порока. Связано это с тем, что магистральные сосуды сердца плода плохо видны в сроки первого скринингового обследования, что может приводить к неточной диагностике.
Из 48 случаев с ВПС 16 плодов (33,3 %) имели множественные пороки развития, причем такие изменения, как гидроцефалия, укорочение трубчатых костей, выявлялись на сроках после 30 недель. А случаи атрезии ануса были обнаружены только при рождении детей. Таким образом, выявление любых изменений в сердце является поводом для обязательного повторного ультразвукового обследования в сроки 25-30 недель (таблица).
Возможности эхокардиографии плода в I триместре беременности (11-14 недель)
Московский областной НИИ акушерства и гинекологии (МОНИИАГ), Россия.
Гомельский областной медико-генетический центр с консультацией "Брак и семья", Гомель, Беларусь.
УЗИ сканер HS60
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
- Семьи, имеющие ребенка с ВПС.
- Семьи с ВПС у одного или обоих супругов.
- Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
- Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): "Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга".
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира - это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки - в I триместре беременности 8. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или "белого" журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат "перу" специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды - в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца (рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр.
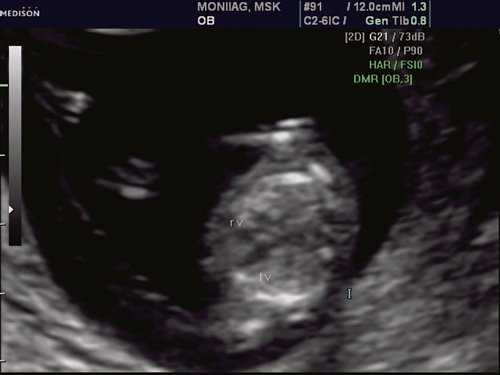
Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.
Возможности фетальной ультразвуковой кардиологии в диагностике фиброэластоза эндокарда
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Фиброэластоз эндокарда - это диффузное утолщение эндокарда одной или более сердечных камер, образуемое коллагеновой либо эластической тканью. Поражение может быть изолированным или сочетаться с другими врожденными аномалиями сердца, являясь причиной врожденных нарушений ритма сердечных сокращений. Первое описание относится к XVIII веку (Lancusi, 1740). По литературным данным, частота колеблется от 4 до 17 % (Банкл Г., 1980) [I].
Этиология патологии неясна. В настоящее время по многим гипотезам среди наиболее вероятных причин называют воспалительные процессы под воздействием вируса Коксаки - свинки. К возможным причинам также относят коллагеновые заболевания, аутоиммунность, врожденные обменные нарушения, затруднение лимфооттока (Schryer M.J., Karnauchow P.N., 1974) [2]. Наследственность также является предметом обсуждения, поскольку имеются случаи наследственной передачи заболевания по аутосомно-рецессивному типу или X-сцепленному типу наследования (Chen S. et al. 1971 [3], Westwood M. et al, 1975) [4].
Фиброэластоз эндокарда чаще поражает левые отделы сердца. В соответствии с размерами левого желудочка он подразделяется на два типа: дилатированный, наиболее частый, при котором левый желудочек увеличен в размерах и гипертрофирован, и контрактильный, при котором размеры левого желудочка нормальные или даже уменьшены. Степень фиброза миокарда бывает различна (Hastreiter A.F., 1968) [5].
Экстракардиальные аномалии редко сочетаются с фиброэластозом эндокарда.
Материалы и методы
В отделении функциональной диагностики Научного центра акушерства, гинекологии и перинатологии РАМН ежегодно проходят скрининговое исследование более 2000 беременных. Фиброэластоз эндокарда был выявлен в 3 случаях в изолированном виде (дилатированный тип - 2 пациентки и контрактильный - 1 случай) и в 7 наблюдениях в сочетании с врожденными пороками сердца. По отношению к общему числу диагностированных врожденных аномалий сердечно-сосудистой системы патология составила 2,7%.
Наиболее часто фиброэластоз наблюдался при патологии левого сердца: стенозе и коарктации аорты, синдроме гипоплазии левого желудочка, врожденном митральном стенозе и при парашутообразном митральном клапане. Кроме того, имелось сочетание стеноза легочной артерии и трикуспидальной атрезии с фиброэластозом эндокарда.
Исследования проведены на ультразвуковых приборах с высокой разрешающей способностью с использованием трансдюсеров 3,5 и 5,0 МГц. Использованы следующие модификации метода: В-сканирование, М-метод, цветное допплеровское картирование потока, допплерография.
При скрининговом исследовании в 3 наблюдениях у молодых первобеременных при минимальном сроке гестации 24 недели выявлены одинаковые изменения сердца плода. Отмечалось значительное увеличение размеров сердца за счет левого желудочка с шарообразной его конфигурацией. Верхушка сердца полностью сформирована левым желудочком. Миокард левого желудочка утолщен и полость сферически расширена, при этом межжелудочковая перегородка выпячивается в полость правого желудочка (рис. 1).
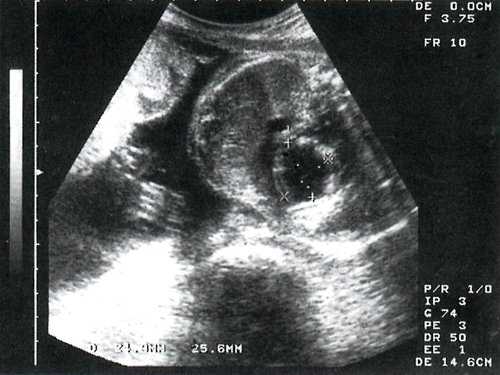
Рис. 1. Эндокардиальный фиброэластоз у плода в 26 недель гестации. Четырехкамерное сечение сердца плода.
Сосочковые мышцы также уплотнены. В качестве ультразвукового признака, который не отмечается ни при какой-либо другой аномалии сердца, было обращено внимание на признак "светящегося" эндокарда - плотного и блестящего, степень отражения от которого наблюдается и при незначительном уменьшении усиления ультразвукового луча.
Сократимость миокарда левого желудочка значительно изменена: амплитуды сокращения и диастолического расслабления представлены практически в виде прямой линии (рис. 2).
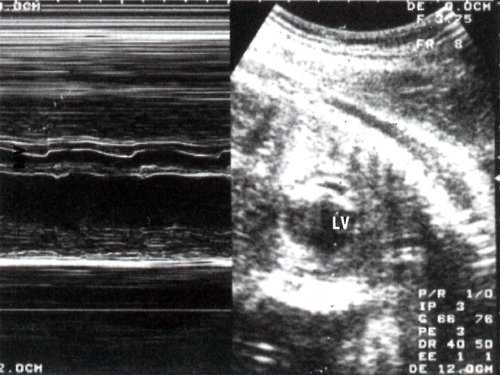
Рис. 2. В и М-сканирование на уровне поперечного сечения левого желудочка сердца плода 24 недель гестации . Отмечается значительное уменьшение амплитуды раскрытия створок митрального клапана. LV - увеличенный левый желудочек.
Степень раскрытия створок (3 мм) и кровоток через митральный клапан значительно уменьшены (рис. 3).
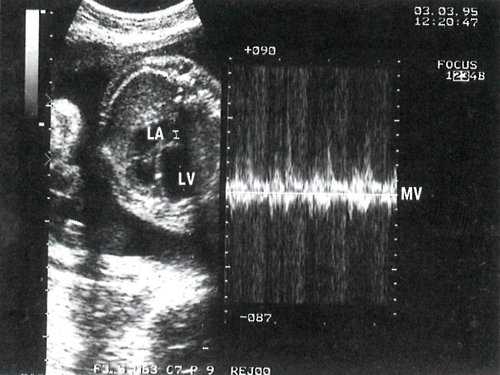
Рис. 3. В-сканирование на уровне четырехкамерного сечения и допплеркардиография потока через митральное отверстие. Контрольный объем расположен под створками митрального клапана. LA - левое предсердие.
В отличие от митрального клапана, кровоток через трикуспидальный клапан увеличен. Выявляется также трикуспидальная регургитация (рис. 4).
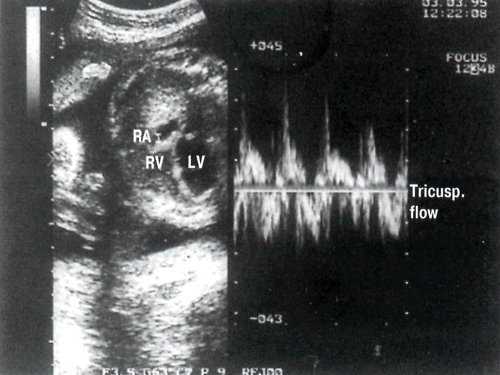
Рис. 4. В-сканирование четырехкамерного сечения сердца плода и оценка кровотока через трикуспидальный клапан. Контрольный объем в полости правого предсердия. LV - левый желудочек. RV - правый желудочек.
Следует отметить, что ни в одном из наблюдений изолированной формы фиброэластоза эндокарда сердечной недостаточности у плода не отмечалось.
На основании полученных данных, свидетельствующих о выраженных нарушениях функции сердца, резком нарушении сократимости миокарда левого желудочка, значительной ультразвуковой плотности миокарда, круглой форме увеличенного левого желудочка и прогибании его в полость правого желудочка, "светящемся" характере миокарда и уменьшении кровотока через митральное отверстие, было высказано предположение о наличии изолированной формы фиброэластоза эндокарда.
Беременность у всех пациенток была прервана. Данные аутопсии подтвердили предполагаемый диагноз антенатального ультразвукового исследования.
В литературе имеются описания единичных случаев предположительного диагноза фиброэластоза эндокарда. Диагноз был поставлен окончательно после рождения ребенка при наличии признаков застойной сердечной недостаточности (Allan L. et al., 1981) [6]. Авторы, описавшие ультразвуковые признаки фиброэластоза, обращали внимание на контрактильные способности миокарда (Bovicelli L. et al., 1984) [7], учитывали индекс укорочения передне-заднего размера желудочков по формуле, предложенной для кардиологии взрослых (Feigen-baum H., 1976) [8].
Безусловно, антенатальная диагностика фиброэластоза основывается в значительной степени на нарушении сократимости миокарда и плотности эндокарда. По нашим данным, наиболее характерным является плотность эндокарда, достигающая нескольких миллиметров, эхопозитивность структуры эндокарда и "светящийся" эндокард (см. рис. 1). В зависимости от формы полость может быть расширена и представлять классический вариант патологии - неподвижные стенки, блестящий плотный эндокард и выпячивание межжелудочковой перегородки в сторону правого желудочка, т.е. шарообразная форма левого желудочка.
Отсутствие сердечной недостаточности при столь выраженных нарушениях со стороны сердца плода можно объяснить значительной дилатацией левого желудочка, так как при любом увеличении объема крови требуется меньшая внутренняя экскурсия стенки расширенного желудочка, и нормальный ударный объем достигается меньшей силой сокращения по сравнению с нормой, тем более, что основной нагрузке антенатально подвержен правый желудочек.
Представленные наблюдения являются иллюстрацией антенатальной ультразвуковой диагностики изолированной дилатированнной формы фиброэластоза эндокарда левого желудочка.
При наличии фиброэластоза эндокарда показано прерывание беременности, поскольку симптомы недостаточности кровообращения возникают в первые месяцы после рождения и большинство детей погибает до двух лет жизни.
Таким образом результаты наблюдений подтверждают значимость ультразвуковой диагностики в выявлении таких редких врожденных аномалий сердца у плода, как фиброэластоз эндокарда, что позволяет определить акушерскую тактику ведения беременных и априори способствовать уменьшению неонатальной смертности.
Литература
- Г. Банкл. Врожденные пороки сердца и крупных сосудов. - М.: Медицина, 1980.
- Schryer M.J.P., Karnauchow P.N. Endocardial fibroelastosis. - Am. Heart J. - 1974. - v.88. - p.557.
- Chen S., Thompson M.W., Rose V. Endocardial fibroelastosis: Family studies with special reference to counselling. - J.Pediatr., 1971.-79.-385.
- Westwood M., Hariss R., Burn J. et al. Heredity in primary endocardial fibroelastosis. - Br. Heart J. 1975. - 37. - 1077.
- Hastreiter A.F. Endocardial Fibroelastosis. In: Heart Disease in Infants, Children and Adolescents. Moss-Adams,Williams and Vilkins Co., Baltimore, 1968.
- Allan L., Litlle D., Campbell S., Whitenead M. Fetal ascites associated with Congenital Heart Disease: Case Report. Brit J. of Obstetrics and Gynecology 1981. - v.88. -p.453-455.
- Bovicelli L., Picchio F.M., Piu G. et al. Prenatal diagnosis of endocardial fibroelastosis. - Pren. Diagn. - 1984. - 4.-67.
- Feigenbaum H. Echocardiography. Philadelfia, 1976.
- Rustico M.A., Benettoni A., Bussani R., Maieron A. et al. Early fetal endocardial fibroelastosis and critical aortic stenosis: A case report // Ultrasound Obstetr. Gynecol. - 1995. - v.5. - p. 202-205.
УЗИ сканер WS80
Диагностика и лечение кардиальной патологии у плода

Авторы: Беспалова Е.Д., Суратова О.Г.,Бокерия Е.Л., Бартагова М.Н., Гасанова Р.М., Тюменева А.И.
Под редакцией: Л.А.Бокерия
Количество страниц: 244
УДК: 618.33:616.1-07-08
Копирайт: © НЦССХ им. А.Н. Бакулева, 2015
Аннотация: В книге рассматриваются особенности эмбриогенеза, анатомии и гемодинамики сердечно-сосудистой системы плода в норме и при различной врожденной кардиальной патологии. Детально отражены возможности ультразвуковых методик в пренатальной диагностике врожденных пороков сердца и нарушений сердечного ритма у плода в разные сроки беременности. Описан методологический алгоритм допплерэхокардиографического исследования сердечно-сосудистой системы плода. Особое внимание уделено изучению новой ультразвуковой методике 3D-, 4D-реконструкции сердца и сосудов плода, что наиболее важно для пренатальной диагностики критических врожденных пороков сердца с обструкцией магистральных артерий. Впервые представлен материал по пренатальной диагностике различных форм нарушений сердечного ритма у плода. Даны подробные алгоритмы лечения сложных форм фетальных аритмий. Значительное внимание уделено вопросу влияния внутриутробной ультразвуковой диагностики сложных врожденных пороков сердца и нарушений ритма на постнатальный прогноз на основании комплексного анализа эходопплеркардиографического исследования сердца и магистральных артерий у плода. Книга предназначена для специалистов по ультразвуковой диагностике, акушеров-гинекологов, неонатологов и врачей смежных специальностей.
Глава 1. Эмбриогенез, анатомия и гемодинамика сердечно-сосудистой системы плода в норме
1.1. Эмбриональное формирование сердечно-сосудистой системы
1.2. Фетальное кровообращение
Глава 2. Современные методы визуализации сердечно-сосудистой системы плода
2.1. Двухмерная эхокардиография (2D-режим)
2.3. Трехмерная реконструкция (3D-режим)
2.4. Трехмерная реконструкция в реальном режиме времени (4D-режим)
Глава 3. Методологический алгоритм проведения пренатальной допплер-ЭхоКГ и количественная оценка состояния сердечно-сосудистой системы плода в норме
3.1. Факторы, влияющие на качество допплер-ЭхоКГ плода
3.2. Показания и противопоказания к применению метода
3.3. Методика проведения пренатальной допплер-ЭхоКГ
3.4. Количественная оценка анатомических и гемодинамических параметров сердца плода с помощью разных режимов сканирования
3.5. Оценка внутрисердечной гемодинамики плода
3.6. Оформление результатов пренатальной ЭхоКГ
3.7. Количественные параметры сердечно-сосудистой системы плода в норме по данным допплер-ЭхоКГ
Глава 1. Причины возникновения кардиальной патологии
Глава 2. Пренатальная диагностика ВПС с атриовентрикулярными шунтами
2.1. Дефекты межжелудочковой перегородки
2.2. Дефекты межпредсердной перегородки
2.3. Атриовентрикулярная коммуникация
Глава 3. Пороки конотрункуса
3.1. Особенности эмбриогенеза, анатомии и гемодинамики разных форм конотрункальных ВПС
3.2. Транспозиция магистральных артерий
3.3. Двойное отхождение магистральных сосудов
3.4. Тетрада Фалло
3.5. Атрезия легочной артерии с ДМЖП
3.6. Общий артериальный ствол
3.7. Диагностические возможности и прогностическая значимость пренатальной допплер-ЭхоКГ в выявлении пороков конотрункуса у плода
Глава 4. Пренатальная диагностика патологии системы дуги аорты
Глава 5. Пренатальная диагностика синдрома гипоплазии левых отделов сердца
Глава 6. Пренатальная диагностика врожденных пороков сердца, обусловленных недоразвитием правых отделов сердца
Глава 7. Пренатальная диагностика единственного желудочка сердца
Глава 8. Пренатальная диагностика редких и комбинированных ВПС
8.1. Сердечные неоплазмы
8.2. Аномалия Эбштейна
8.3. Трехпредсердное сердце
8.4. Аномальное отхождение левой коронарной артерии от легочного ствола - синдром Бланда-Уайта-Гарленда (СБУГ)
8.5. Аномальный дренаж легочных вен
8.6. Комбинированные ВПС
Глава 9. Применение методов трех-четырехмерной реконструкции в фетальной эхокардиографии
Перинатальный кардиологический центр (ПКЦ)

Перинатальный кардиологический центр — единственный в РФ специализированный перинатальный центр, где обследуются, наблюдаются, проходят амбулаторное и стационарное лечение беременные, имеющие сердечную патологию у себя и у своего будущего ребенка.
ПКЦ — единственный в РФ центр, где проводится ранняя эхокардиографическая диагностика ВПС и нарушений ритма у плода, начиная с 13-й недели беременности.
ПКЦ — единственный в РФ центр, где осуществляется диагностика и прицельное лечение плода с органическими нарушениями сердечного ритма.
ПКЦ — единственный в РФ центр, где проводится обучение внутриутробной диагностике патологии сердечно-сосудистой системы.
ПКЦ — единственный в РФ центр, где осуществляются телеконсультации, консилиумы, телесеминары и лекции по внутриутробной диагностике врожденных пороков сердца с регионами РФ.
Каждый год в России рождается почти 25 тысяч детей с врожденными пороками сердца (ВПС). Больше половины из них нуждаются в срочной операции, необходимой для спасения жизни новорожденного. Более 75% детей, которым не была вовремя проведена хирургическая операция, погибают, не дожив до одного года. Основная причина трагического исхода — позднее выявление порока, не оставляющее времени врачам и шансов ребенку и его родителям.
Основные направления клинической работы
В целях развития внутриутробной кардиологии в РФ, в ФГБУ «НМИЦССХ им. А.Н. Бакулева» Минздрава России, где накоплен колоссальный опыт диагностики и лечения врожденных пороков сердца у новорожденных, в течение последних ведется работа по внутриутробной диагностике кардиальной патологии.
В 2002 г., впервые в РФ, в ФГБУ «НМИЦССХ им. А.Н. Бакулева» Минздрава России создано отделение перинатальной кардиологии (Перинатальный кардиологический Центр). В центре работают высококвалифицированные врачи разных специальностей: кардиологи, акушеры-гинекологи, врачи ультразвуковой и функциональной диагностики. Их совместные усилия направлены на то, чтобы помочь женщинам с заболеваниями сердца выносить и родить здорового ребенка и сохранить жизнь новорожденным с врожденными пороками сердца.
Виды операций, разработанных и внедрённых в отделении
максимально раннее исключение порока сердца у плода;
постановка точного диагноза и определение дальнейшей тактики ведения беременности;
решение вопроса о прерывании беременности на ранних сроках в случае выявления множественной патологии у плода;
выбор срока и способа родоразрешения в зависимости от конкретной патологии;
выбор способа кардиохирургического лечения новорожденного;
выявление причин возникновения кардиальной патологии у плода, лечение женщины и планирование последующей беременности.
Статистика
С 2002 г. в отделении обследовано более 35 тысяч беременных женщин из Москвы, Московской области и всех регионов РФ.
Условия пребывания в отделении
Перинатальный кардиологический центр оснащен самым современным диагностическим оборудованием. Ультразвуковое исследование плода производится на аппаратах, которые располагают набором специальных встроенных программ, позволяющих осуществлять максимально эффективную и, что не менее важно, безопасную внутриутробную диагностику. Используемые в этих программах мощности ультразвукового излучения не оказывают негативного влияния на развитие плода и здоровье будущей мамы.
Кардиомонитор — одна из новейших разработок в области фетального мониторирования, дает возможность наблюдать за изменениями сердечного ритма плода начиная уже с 24 недели беременности.
Широкий спектр анализов, направленных на выявление инфекционных возбудителей в организме беременной женщины, производится в современных лабораториях, оснащенных специальными высокочувствительными анализаторами.
В отделении работают 5 специалистов ультразвуковой диагностики, два кардиолога, три акушера-гинеколога.
Сотрудники отделения
Заведующий перинатальным кардиологическим центром
врач кардиолог

врач акушер-гинеколог
врач ультразвуковой диагностики

научный сотрудник






старшая медицинская сестра
Научная деятельность отделения
135 публикаций в российской и международной печати. 3 монографии. 9 кандидатских диссертаций и 3 докторские диссертации.
Подробнее об отделении
Когда можно узнать, что у ребенка ВПС. Квалифицированные специалисты, работающие на современной диагностической аппаратуре, могут обнаружить практически любой ВПС уже на 16-18 неделе беременности. Это позволяет правильно спланировать дальнейшую беременность, обеспечить прием родов в специализированном роддоме и, не торопясь и основательно, подготовить ребенка к операции в первые дни жизни. Эффект своевременной операции поразителен - 97% детей не только выживает, но и избавляется навсегда от этой болезни.
Куда обратиться беременным
В настоящее время в России существует только одно лечебное учреждение, профессионально и успешно занимающееся этой проблемой - Перинатальный кардиологический Центр, является структурным подразделением ФГБУ «НМИЦССХ им. А.Н. Бакулева» Минздрава России. Руководитель Перинатального кардиологического Центра - кандидат медицинских наук Гасанова Рена Мамедовна.
Основными пациентками Центра являются здоровые беременные женщины, так как 90% детей с ВПС рождаются в благополучных семьях, не относящихся к группе высокого риска. Это семьи молодых и здоровых родителей, без вредных привычек и зависимостей, у которых не было веских оснований для опасения по поводу рождения больного ребенка.
У здоровых женщин врачи Центра исключат риск развития порока сердца у плода на 16-18 неделе беременности.
У беременных с высоким риском формирования порока сердца у плода (наличие у самой женщины врожденного и приобретенного порока сердца, в том числе и оперированного, а также, если в семье ранее рождались дети с пороками сердца) специалисты Центра могут выявить порок сердца у плода уже на 12-14 неделе.
Мы являемся единственным в России специализированным перинатальным центром, где по специальным медицинским программам наблюдаются, обследуются и лечатся беременные, имеющие заболевания сердца у себя или у своего будущего ребенка. Мы подробно информируем наших пациенток о способах, возможностях и реальных перспективах хирургического лечения ВПС после рождения малыша.
В Центре беременную женщину одновременно наблюдают кардиолог и акушер-гинеколог.
В обследовании используются передовые методики - прицельное исследование сердца плода, акушерское ультразвуковое обследование, кардиомониторинг, допплерометрия, лабораторно-инструментальное обследование матери для исключения инфекции у плода.
Если будущая мама решила сохранить беременность и побороться за своего ребенка, то наши врачи обязательно ей помогут. Сразу же после рождения, в роддоме, ребенка с ВПС проконсультирует опытный кардиолог Центра Бакулева, назначит правильное лечение, и при необходимости обеспечит его перевод в Центр им. А. Н. Бакулева для операции.
Врожденный порок сердца
Врожденные пороки сердца это целая группа заболеваний, при которых нарушаетсянормальная структура и строение сердца и сосудов, а как следствие, страдает и работа сердца как органа в целом. Врожденными же они называются потому, что их закладка происходит еще в утробе матери и ребенок появляется на свет уже с неправильно сформированным сердцем. Такое “неправильное” сердце неспособно эффективно выполнять свою главную функцию — функцию насоса, который доставляет кровь, насыщенную кислородом и питательными веществами, ко всем органам и тканям организма.
В результате такого состояния, называемого кардиологами сердечной недостаточностью, неизбежно страдает весь организм в целом. В нем нарушаются процессы обмена веществ и работа всех основных органов и систем, включая головной мозг, почки, органы пищеварения, мышцы и пр. В конечном итоге, без правильного лечения, такое состояние приводит к гибели организма. Именно поэтому проблема врожденных пороков сердца была и до сегодняшнего дня остается актуальной и крайне сложной проблемой современной медицины.
Данные статистики говорят о том, что сегодня более 2% детей рождаются с различными дефектами и аномалиями развития. Четвертую часть из них составляют врожденные пороки сердца. Таким образом, каждый 200-тый новорожденный ребенок имеет какой-либо дефект в строении сердца. При этом, почти в половине случаев это тяжелые и сложные пороки, при которых сохранить жизнь ребенка возможно только в том случае, если оказание специализированной помощи последует в первые дни или даже часы после его рождения.
Читайте также:
