Применение методов генной инженерии. Показания ( оправданность ) применения генной инженерии. Причины применения генной инженерии.
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Генная инженерия (генетическая инженерия), совокупность методов молекулярной генетики, направленных на искусственное создание новых, не встречающихся в природе сочетаний генов. Те или иные чужеродные для данного организма гены вводят в его клетки и встраивают в его геном с различными целями:
для изучения строения и функций генетического аппарата,
для эффективной наработки продукта данного гена (для гормона или антибиотика),
для придания организму-хозяину каких-либо желаемых свойств (для сельскохозяйственных растений и животных - большей продуктивности или большей устойчивости к инфекциям или паразитам),
для замещения (компенсации) генов, дефекты которых вызывают наследственные заболевания, и др.
Генно-инженерная технология использует всё разнообразие сложных и тонких методов современной генетики, позволяющих работать с ничтожными количествами генетического материала. Основные этапы и операции генной инженерии включают:
выделение из клеток ДНК, содержащей нужный ген;
разрезание ДНК на мелкие фрагменты с помощью специальных ферментов;
соединение фрагментов ДНК с т. н. векторами, обеспечивающими проникновение в клетку; клонирование (размножение) нужного гена;
создание рекомбинантной (гибридной) ДНК из участков ДНК (генов) разного происхождения; введение (микроинъекция) генетического материала в культивируемые клетки организма-хозяина или в его яйцеклетку.
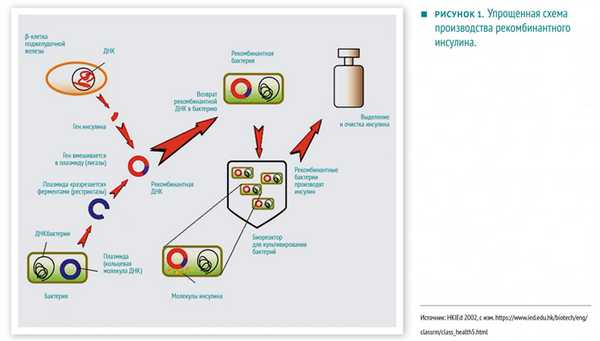
После того как в нач. 70-х гг. 20 в. был разработан метод получения рекомбинантных ДНК, чужеродные гены стали вводить в клетки бактерий, растений и животных (Рекомбинантная ДНК — это искусственно полученная молекула ДНК). Такие организмы получили название трансгенных. Очень быстро генная инженерия нашла практическое применение как основа биотехнологии. Уже в 80-е гг. 20 в. с помощью бактериальных клеток, в которые вводили гены человека, ответственные за синтез гормонов инсулина и соматотропина и антивирусного белка интерферона, было налажено производство этих важных для медицины препаратов. В мощную индустрию превратилось получение и разведение используемых в сельском хозяйстве трансгенных растений и трансгенных животных.
Практические результаты генной инженерии. Генная инженерия служит для получения желаемых качеств изменяемого или генетически модифицированного организма. В отличие от традиционной селекции, в ходе которой генотип подвергается изменениям лишь косвенно, генная инженерия позволяет непосредственно вмешиваться в генетический аппарат, применяя технику молекулярного клонирования. Примерами применения генной инженерии являются получение новых генетически модифицированных сортов зерновых культур, производство человеческого инсулина путём использования генномодифицированных бактерий, производство эритропоэтина в культуре клеток или новых пород экспериментальных мышей для научных исследований.
Особенности организации генетического аппарата и передача наследственности у бактерий, вирусов и у прокариот. Бактерий , вирусы как объект генетики. Трансформация, трансдукция и конъюгация у бактерий и их значение. Эписомы и плазмиды.
27. Генная инженерия. Использование методов генной инженерии для получения диагностических, профилактических и лечебных препаратов.
Из многих сотен препаратов, полученных методом генетической инженерии, в практику внедрена только часть: интерфероны, интерлейкины, фактор VIII, инсулин, гормон роста, тканевый активатор плазминогена, вакцина против гепатита В, моноклональные антитела для предупреждения отторжения при пересадках почки, диагностические препараты для выявления ВИЧ и др. Это обстоятельство можно объяснить несколькими причинами.
Во-первых, длительное время к этим препаратам и рекомбинантным штаммам микроорганизмов относились настороженно, опасаясь, что может произойти неуправляемое распространение экологически опасных рекомбинантных микроорганизмов.
Во-вторых, использование рекомбинантных штаммов продуцентов предусматривает разработку сложных технологических процессов по получению и выделению целевых продуктов.
В-третьих, при получении препаратов методом генетической инженерии всегда возникает вопрос об идентичности активной субстанции, вырабатываемой рекомбинантным штаммом-продуцентом, природному веществу, т. е. требуется проведение исследовательских работ, направленных на доказательство идентичности, а также иногда решение дополнительных задач по приданию продукту природного характера.
Метод генетической инженерии является единственным при получении препаратов, если природный микроорганизм или животные и растительные клетки не культивируются в промышленных условиях. Например, возбудитель сифилиса или малярийный плазмодий практически не растет на искусственных питательных средах. Поэтому для получения диагностических препаратов или вакцин прибегают к клонированию или синтезу генов протективных антигенов, их встраиванию в легко культивируемые бактерии. При выращивании этих рекомбинантных бактерий-реципиентов получают нужные антигены, на основе которых создают диагностический препарат или вакцину. Таким образом, уже производится вакцина против гепатита В. Ген HBs-антигена вируса гепатита встроен в дрожжевую клетку; при выращивании дрожжей образуется HBs-антиген, из которого готовят вакцину.
Метод генетической инженерии предпочтительнее также в том случае, когда микроорганизм высоко патогенен и опасен при промышленном производстве. Например, для получения из ВИЧ диагностических препаратов и вакцин предпочитают не выращивать вирус в больших количествах, а необходимые антигены получают методом генетической инженерии. К настоящему времени практически все основные антигены ВИЧ (р24, gp41, gp!20 и др.) получены путем выращивания рекомбинантных штаммов Е. coli или дрожжей, способных продуцировать эти антигены. На основе рекомбинантных белков уже созданы диагностические препараты для обнаружения СПИДа.
Метод генетической инженерии используют в том случае, когда исходное сырье для получения препарата традиционным способом является дефицитным или дорогостоящим. Например, лейкоцитарный а-интерферон получают из лейкоцитов донорской крови человека. Из 1 л крови получают 2.3 дозы высоко-концентрированного интерферона. На курс лечения онкологического больного требуются сотни доз препарата. Следовательно, массовое производство и применение лейкоцитарного интерферона из крови нереально. Производство лейкоцитарного интерферона методом генетической инженерии значительно экономичнее и не требует дефицитного сырья (крови). Его получают путем выращивания рекомбинантных штаммов бактерий (Е. coli, псевдомонад), способных продуцировать интерферон в результате встройки им гена а-интерферона.
Иммуноцитокины (ИЛ, факторы роста и т.д.) получают путем культивирования клеток (лимфоцитов, макрофагов и др.) на искусственных питательных средах. Однако процесс этот сложен, продукция иммуноцитокинов незначительна и не имеет практического значения. Поэтому для получения иммуноцитокинов применяют метод генетической инженерии. Уже созданы рекомбинантные штаммы Е. coli и другие штаммы, продуцирующие интерлейкины (ИЛ-1, 2, 6 и др.), фактор некроза опухолей, фактор роста фибробластов и др. Это значительно ускорило процесс внедрения иммуноцитокинов в практику.
Метод генетической инженерии используется для получения принципиально новых продуктов и препаратов, не существующих в природе. Например, только с помощью генетической инженерии можно получить рекомбинантные поливалентные живые вакцины, несущие антигены нескольких микроорганизмов. Получен рекомбинантный штамм вируса оспенной вакцины, продуцирующий HBs-антиген вируса гепатита В, бешенства, клещевого энцефалита. Такие живые вакцины называют векторными.
Метод генетической инженерии позволяет также заменить многие методы, основанные на получении продуктов in vivo, на способы получения этих продуктов in vitro. До последнего времени диагностические, лечебные и профилактические сыворотки получали из крови иммунизированных лошадей или вакцинированных людей-доноров. В настоящее время этот дорогой и , непростой способ вытесняется гибридомной техникой получения антител. Эта техника основана на получении клеток-гибридом путем слияния В-лимфоцитов, взятых от иммунизированных животных и миеломных (раковых) клеток. Образующаяся гибридная клетка (гибридома) обладает способностью миеломной клетки быстро размножаться на искусственных питательных средах и продуцировать при этом антитела (так же, как В-лимфоцит) к антигену, использованному для иммунизации. Гибридомы, продуцирующие антитела, могут выращиваться в больших масштабах в культиваторах или специальных аппаратах. Поскольку образующиеся гибридомой антитела Іпроизошли⌡ от одной родоначальной клетки (В-лимфоцита), то они называются моноклональными антителами. Моноклональные антитела широко используются для создания диагностических препаратов, а также в некоторых случаях применяются с лечебной целью (в онкологии).
Многие фармакологические средства до сих пор получают путем переработки лекарственныхтрав. Для этого необходимо организовать сбор этих трав или выращивать их на плантации. Биотехнология и генетическая инженерия позволяют получать эти же природные фармакологические вещества путем выращивания в промышленных условиях культур клеток лекарственных растений. В настоящее время налажен выпуск таким способом десятков лекарственных средств, среди них женьшень, строфантин и др.
Генная инженерия — раздел биотехнологии, связанный с целенаправленным конструированием in vitro новых комбинаций генетического материала, способного размножаться в клетке и синтезировать определенный продукт. Генная инженерия решает следующие задачи: 1) получение генов путем их синтеза или выделения из клеток; 2) получение рекомбинантных молекул ДНК; 3) клонирование генов или генетических структур; 4) введение в клетку генов или генетических структур и синтез чужеродного белка.
Рекомбинантные, биосинтетические вакцины, - это вакцины, полученные методами генной инженерии. Суть метода: гены вирулентного микроорганизма, отвечающие за синтез протективных антигенов, встраивают в геном какого-либо безвредного микроорганизма, который при культивировании продуцирует и накапливает соответствующий антиген. Примером может служить рекомбинантная вакцина против вирусного гепатита B, вакцина против ротавирусной инфекции, АДС, поливалентная бактериальная вакцина. Наконец, имеются положительные результаты использования т.н. векторных вакцин, когда на носитель - живой рекомбинантный вирус осповакцины (вектор) наносятся поверхностные белки двух вирусов: гликопротеин D вируса простого герпеса и гемагглютинин вируса гриппа А. Происходит неограниченная репликация вектора и развивается адекватный иммунный ответ против вирусной инфекции обоих типов. На современном этапе развития иммунологии как фундаментальной медико-биологической науки стала очевидной необходимость создания принципиально новых подходов к конструированию вакцин на основе знаний об антигенной структуре патогена и об иммунном ответе организма на патоген и его компоненты. Биосинтетические вакцины представляют собой синтезированные из аминокислот пептидные фрагменты, которые соответствуют аминокислотной последовательности тем структурам вирусного (бактериального) белка, которые распознаются иммунной системой и вызывают иммунный ответ. Важным преимуществом синтетических вакцин по сравнению с традиционными является то, что они не содержат бактерий и вирусов, продуктов их жизнедеятельности и вызывают иммунный ответ узкой специфичности. Кроме того, исключаются трудности выращивания вирусов, хранения и возможности репликации в организме вакцинируемого в случае использования живых вакцин. При создании данного типа вакцин можно присоединять к носителю несколько разных пептидов, выбирать наиболее иммуногенные из них для коплексирования с носителем. Вместе с тем, синтетические вакцины менее эффективны, по сравнению с традиционными, т.к. многие участки вирусов проявляют вариабельность в плане иммуногенности и дают меньшую иммуногенность, нежели нативный вирус. Однако, использование одного или двух иммуногенных белков вместо целого возбудителя обеспечивает формирование иммунитета при значительном снижении реактогенности вакцины и ее побочного действия.
Третье поколение вакцин - генно-иненерные вакцины
Биосинтетические - искусственно созданные антигены микробов. Для их получения используют дрожжевую клетку, в которую встраивают ген патогенного микроорганизма, отвечающий за синтез данного антигена.
Что такое генная инженерия и зачем вмешиваться в природу организмов

Современная генная инженерия позволяет «включать» и «выключать» отдельные гены, программируя новый генотип, в том числе, и человеческий. Это вызывает немало опасений, хотя многие открытия уже принесли человечеству пользу
Содержание:
Генная инженерия — это современное направление биотехнологии, объединяющее знания, приемы и методики из целого блока смежных наук — генетики, биологии, химии, вирусологии и так далее — чтобы получить новые наследственные свойства организмов.
Перестройка генотипов происходит путем внесения изменений в ДНК (макромолекулу, обеспечивающую хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов) и РНК (одну из трех основных макромолекул, содержащихся в клетках всех живых организмов).
Если внести в растение, микроорганизм, организм животного или даже человека новые гены, можно наделить его новой желательной характеристикой, которой до этого он никогда не обладал. С этой целью сегодня генная инженерия используется во многих сферах. Например, на ее основе сформировалась отдельная отрасль фармацевтической промышленности, представляющая собой одну из современных ветвей биотехнологии.

История развития
Истоки
Основы классической генетики были заложены в середине XIX века благодаря экспериментам чешского-австрийского биолога Грегора Менделя. Открытые им на примере растений принципы передачи наследственных признаков от родительских организмов к их потомкам в 1865 году, к сожалению, не получили должного внимания у современников, и только в 1900 году Хуго де Фриз и другие европейские ученые независимо друг от друга «переоткрыли» законы наследственности.
Параллельно с этим шел процесс формирования знаний о ДНК. Так, в 1869 году швейцарский биолог Фридрих Мишер открыл факт существования макромолекулы, а в 1910 году американский биолог Томас Хант Морган обнаружил на основе характера наследования мутаций у дрозофил, что гены расположены линейно на хромосомах и образуют группы сцепления. В 1953 году было сделано важнейшее открытие — американец Джон Уотсон и британец Фрэнсис Крик установили молекулярную структуру ДНК.
На подъеме
К концу 1960-х годов генетика активно развивалась, а ее важными объектами стали вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов, а в 1970-х годах был открыт ряд ферментов, катализирующих реакции превращения ДНК.
Генная инженерия как отдельное направление исследовательской работы зародилась в США в 1972 году, когда в Стэнфордском университете ученые Пол Берг, Стэнли Норман Коэн, Герберт Бойер и их научная группа внедрили новый ген в бактерию кишечной палочки (E. coli), то есть создали первую рекомбинантную ДНК.
Техника ПЦР была впервые разработана в 1980-х годах американским биохимиком Кэри Маллисом. Будущий лауреат Нобелевской премии по химии (1993 года), обнаружил в специфический фермент — ДНК-полимеразу, который участвует в репликации ДНК. Этот фермент буквально считывает отрезки цепи нуклеотидов молекулы и использует их в качестве шаблона для последующего копирования генетической информации.
Новая эра
В 1996 году методом пересадки ядра соматической клетки в цитоплазму яйцеклетки на свет появилось первое клонированное млекопитающее — овца Долли. Это событие стало революционным в истории развития генной инженерии, потому что впервые стало возможным серьезно говорить о создании клонов и выращивании живых организмов на основе молекул.
Технологии генной инженерии
Генная инженерия за короткий срок оказала огромное влияние на развитие различных молекулярно-генетических методов и позволила существенно продвинуться на пути познания генетического аппарата.
Так, появилась технология CRISPR — инструмент редактирования генома. В 2014 году MIT Technology Review назвал его «самым большим биотехнологическим открытием века». Он основан на защитной системе бактерий, которые производят специальные ферменты, позволяющие им защищаться от вирусов.
«Каждый раз, когда бактерия убивает вирус, она разрезает остатки его генома, будь то ДНК или РНК, и сохраняет их внутри последовательности CRISPR, как в архив. Как только вирус атакует снова, бактерия использует информацию из «архива» и быстро производит защитные белки Cas9, в которых заключены фрагменты генома вируса. Если вдруг эти фрагменты совпадают с генетическим материалом нынешнего атакующего вируса, Cas9 как ножницами разрезает захватчика, и бактерия снова в безопасности», — поясняет Алевтина Федина, медицинский директор Checkme.
Уникальное открытие состоялось в 2011 году, когда биологи Дженнифер Дудна и Эммануэль Шарпантье обнаружили, что белок Cas9 можно обмануть. Если дать ему искусственную РНК, синтезированную в лаборатории, то он, найдя в «архиве» соответствие, нападет на нее. Таким образом, с помощью этого белка можно резать геном в нужном месте — и не просто резать, а еще и заменять другими генами.

Теоретически, технология CRISPR может позволить редактировать любую генетическую мутацию и излечивать заболевание, которое она вызывает. Но практические разработки CRISPR в качестве терапии еще только в начальной стадии, и многое еще непонятно.
Есть и другие методы генной инженерии, например, ZFN и TALEN.
- ZFN разрезает ДНК и вставляет туда заготовленный заранее новый фрагмент с помощью белков с ионами цинка (отсюда название — Zinc Finger Nuclease).
- TALEN делает то же самое, только используя TAL-белки. Для обеих технологий приходится создавать отдельные белки, а это очень долгая работа, поэтому пока два этих метода особого применения не нашли.
Где и как применяется генная инженерия
Медицина
Уже сейчас активно применяется инсулин человека (хумулин), полученный посредством рекомбинантных ДНК. Клонированные гены человеческого инсулина были введены в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали. С 1982 года компании США, Японии, Великобритании и других стран производят генно-инженерный инсулин.
Кроме того, несколько сотен новых диагностических препаратов уже введены в медицинскую практику. Среди лекарств, находящихся в стадии клинического изучения, препараты, потенциально лечащие артрозы, сердечно-сосудистые заболевания, онкологию и СПИД. Среди нескольких сотен генно-инженерных компаний 60% заняты именно разработкой и производством лекарственных и диагностических средств.
«В медицине среди достижений генной инженерии сегодня можно выделить терапию рака, а также другие фармакологические новинки — исследования стволовых клеток, новые антибиотики, прицельно бьющие по бактериям, лечение сахарного диабета. Правда, пока все это на стадии исследований, но результаты многообещающие», — говорит Алевтина Федина.
Сельское хозяйство
В сельском хозяйстве одна из важнейших задач генной инженерии — получение растений и животных, устойчивых к вирусам. В настоящее время уже есть виды, способные противостоять воздействию более десятка различных вирусных инфекций.
Еще одна задача связана с защитой растений от насекомых-вредителей. Путем генетической модификации растений можно уменьшить интенсивность обработки полей пестицидами. Например, трансгенные растения картофеля и томатов стали устойчивы к колорадскому жуку, растения хлопчатника — к разным насекомым, в том числе и к хлопковой совке.
Использование генной инженерии позволило сократить применение инсектицидов (препаратов для уничтожения насекомых) на 40-60%.
Благодаря генной инженерии зерновые культуры стали более устойчивы к климатическим условиям, кроме того появилась возможность увеличить количество витаминов и полезных веществ в продукте. Например, можно обогатить рис витамином «А» и выращивать его в тех регионах, где люди имеют массовую нехватку этого элемента.
С помощью генной инженерии пытаются решить и экологические проблемы. Так, уже созданы особые сорта растений с функцией очистки почвы. Они поглощают цинк, никель, кобальт и иные опасные вещества из загрязненных промышленными отходами почв.
Скотоводство
В Кемеровской области работа генетиков позволила получить устойчивое к вирусу лейкоза племенное поголовье высокопродуктивных животных. Для проведения эксперимента кузбасские ученые отобрали здоровых коров черно-пестрой породы массой до 500 кг. Животным трансплантировали модифицированные эмбрионы, устойчивые к вирусу лейкоза. В середине сентября 2020 года родилось 19 телят с измененными генами.
«В месячном возрасте была проведена оценка, которая показала, что телята отличаются от своих сверстников только устойчивостью к вирусу. Пять особей отобрали для дальнейшей селекционной работы. Это позволит закрепить наследственные признаки устойчивости к вирусу лейкоза у последующих поколений», — пояснила руководитель проекта, доктор биологических наук, профессор кафедры зоотехнии Кузбасской ГСХА Татьяна Зубова.
По словам Зубовой, лейкоз крупного рогатого скота — вирусная хронически неизлечимая болезнь, при которой возникают поражение кроветворной системы и новообразования. Данное заболевание наносит значительный ущерб генофонду пород и мясной промышленности в целом, потому что мясо зараженных животных запрещено употреблять в пищу. Единственным доступным методом борьбы с лейкозом ранее было только уничтожение зараженного скота.
Этот успех позволяет говорить о том, что в дальнейшем будет возможно редактировать гены крупного рогатого скота и от других болезней.
С прицелом на человека
В 2009 году группа ученых под руководством молодого исследователя Джея Нейтца из Вашингтонского университета сумели с помощью генной терапии вернуть обезьянам способность различать оттенки зеленого и красного, которой они были лишены от рождения.
В область сетчатки глаза двух подопытных обезьян был введен безвредный вирус, несущий недостающий ген фоточувствительного рецептора. Вскоре после процедуры обе обезьяны начали различать оттенки красного и зеленого на сером фоне. Два года наблюдения не выявили у них каких-либо нарушений, поэтому ученые не исключают, что данную методику уже вскоре можно будет применять у людей, страдающих дальтонизмом.
Ученые шагнули еще дальше и уже пробуют выращивать в теле животных органы для трансплантации людям. Для минимизации риска отторжения тканей животным вводят специальные гены. Этими опытами занимается научная лаборатория Рослинского института в Великобритании, которая представила миру овцу Долли.
В 2019 году британские ученые вывели кур, яйца которых содержат два вида человеческих белков, способных противодействовать артриту и некоторым видам онкологических заболеваний. В яйцах содержится человеческий белок под названием IFNalpha2a, обладающий мощными противовирусными и противораковыми свойствами, а также человеческий и свиной вариант белка под названием макрофаг-CSF, который планируют использовать для создания препарата, стимулирующего самостоятельное заживление поврежденных тканей.
Изменение ДНК человека
Первые клинические испытания методов генной терапии были предприняты 22 мая 1989 года с целью генетического маркирования опухоль-инфильтрующих лимфоцитов в случае прогрессирующей меланомы.
14 сентября 1990 года в Бетесде (США) четырехлетней девочке, страдающей наследственным иммунодефицитом, обусловленным мутацией в гене аденозиндезаминазы (АDA), были пересажены ее собственные лимфоциты.
Работающая копия гена ADA была введена в клетки крови с помощью модифицированного вируса, в результате чего клетки получили возможность самостоятельно производить необходимый белок. Через шесть месяцев количество белых клеток в организме девочки поднялось до нормального уровня.
После этого область генной терапии получила толчок к дальнейшему развитию. С 1990-х годов сотни лабораторий ведут исследования по использованию генной терапии для лечения различных заболеваний. Уже сегодня с помощью генной терапии можно лечить диабет, анемию и некоторые виды онкологии.
Генная терапия
Генная терапия — введение, удаление или изменение генетического материала, в частности ДНК или РНК, в клетке пациента для лечения определенного заболевания.
Существует три основных стратегии использования генной терапии:
- Замена мутировавшего гена, вызывающего заболевание, здоровой копией.
- Инактивация или «выбивание» мутировавших генов, которые функционируют неправильно.
- Введение нового гена в организм, помогающего бороться с болезнью.
Наиболее часто применяемый метод включает вставку «терапевтического» гена для замены «ненормального» или «вызывающего болезнь».
В 2015 году впервые была проведена процедура изменения ДНК человека с целью продления молодости клеток, когда американке Элизабет Пэрриш 44 лет ввели в организм препарат, влияющий на ДНК, а в 2018 году китайский ученый Хэ Цзянькуй заявил, что с его помощью у двух детей-близнецов якобы изменены гены для выработки у них иммунитета к вирусу ВИЧ, носителем которого являлся их отец.

Все это, с одной стороны, выглядит грандиозно и обнадеживает, но с другой, — вызывает опасения, ведь генетические манипуляции, теоретически, возможно использовать не только в благих и мирных целях.
После эксперимента с ДНК близнецов в Китае, ЮНЕСКО выступила с инициативой о запрете изменения генов у новорожденных до того момента, пока достоверно не будет доказана безопасность таких манипуляций.
Этическая сторона вопроса
В 1997 году ЮНЕСКО выпустила Всеобщую декларацию о геноме человека и его правах, рекомендовав мораторий на генетическое вмешательство в зародышевую линию человека, а в декабре 2015 года на международном саммите по геномному редактированию человека изменение гаметоцитов и эмбрионов для генерации наследственных изменений у людей было объявлено безответственным.
Российское сообщество генетиков в большинстве своем считает, что такие эксперименты на данный момент преждевременны и требуют более глубокого исследования и обсуждений.
«Вопрос клонирования уже давно стоит на горизонте. Этично ли выращивать клонов, чтобы потом забирать их органы для трансплантации человеку… Большой вопрос. Само собой, это абсолютно нормально, что нет единой точки зрения, ведь смысл подобных дискуссий как раз в том, чтобы найти правильные формулировки и отрегулировать потенциально спасительное, но при этом очень опасное знание», — говорит Алевтина Федина.
Страх неизвестности
Вариантов развития событий в области генной инженерии существует множество, и далеко не все они изучены и, в принципе, известны. Поэтому они должны быть последовательно зафиксированы и регламентированы.
Естественно, больше всего опасений вызывают плохие сценарии развития событий. Как правило, все начинается с помощи людям и изобретения новых лекарств. Но потом человек может прийти к желанию сделать своего ребенка светловолосым и зеленоглазым или создать армию универсальных солдат, не боящихся боли и не ведающих страха.
Олег Долгицкий, социальный философ, отмечает, что современное общество настолько неоднородно в культурном и экономическом плане, что любые методы, способные существенно изменить геном, могут создать условия не только для классового, но и видового расслоения, где представители «первого мира» смогут существенно продлевать свою жизнь и не бояться никаких болезней, в отличие от менее богатых людей. Это является серьезнейшей почвой для конфликтов и столкновений.
Эксперты убеждены, что генная инженерия — это будущее медицины. Возможность избавить младенца от пожизненного гнета заболевания, излечить людей от рака, найти лекарство против ВИЧ — за всем этим будет стоять генная инженерия. При этом желание человека изменить, например, цвет глаз или предотвратить наследственное заболевание, несмотря на все риски, будет только расти. И похоже, что остановить этот процесс уже не представляется возможным.
Ген’иальная медицина

Череда поистине великих достижений в области генетики, молекулярной биологии и вирусологии связывает между собой литры жизненно необходимого инсулина и сою в колбасе, повседневный «ИФА на сифилис» и будущие сады на Марсе. Сугубо теоретические знания о структуре ДНК да лигазах-рестриктазах обернулись в недалеком прошлом вполне практической генетической инженерией. Полученные с ее помощью продукты могут обидно называться «генетически модифицированными» и стоить значительно дешевле на полке в супермаркете либо гордо именоваться «рекомбинантными» и быть заслуженно дорогими, находясь в аптеке. Последующее же неизбежное развитие генной инженерии, по разным прогнозам, может привести как к долгой счастливой жизни без голода и болезней, так и к зомби-апокалипсису в результате побега инфицированной мартышки от доигравшихся, наконец, ученых.
- получать рекомбинантные РНК и ДНК;
- выделять гены из организма (клеток);
- осуществлять манипуляции с генами и вводить их в другие организмы.
Свойства любого организма (цвет лепестков/шерсти/волос, способность усваивать глюкозу, возможность вырасти до 2 метров и т. д.) зависят от белков. Белки кодируются определенными генами. Ген можно «вырезать» из ДНК какого‑либо организма ферментами или, зная последовательность аминокислот в нужном белке, собрать ген этого белка из отдельных нуклеотидов, затем «вставить» его в ДНК бактерии (растения, животного), которая начнет производить заданный белок. За кажущейся простотой — десятилетия научного поиска, отмеченные несколькими Нобелевскими премиями.
Плазмида — внехромосомная молекула ДНК бактерий или дрожжей, как правило, кольцевая, способная к автономной репликации. В генной инженерии используется как вектор.
Рестриктазы — ферменты бактерий, узнающие и атакующие определенные последовательности нуклеотидов в ДНК. В генной инженерии рестриктазы «вырезают» фрагменты из молекулы ДНК вектора, что позволяет вставить на освободившееся место нужный ген.
Значение генной инженерии для медицины
Продукты генной инженерии как‑то исподволь, но прочно вошли в медицинскую практику: лекарства для лечения редких болезней, рекомбинантный инсулин, вакцины против вируса гепатита В — без них современному врачу трудно представить себе мир. Генно-инженерными методами производят некоторые высокоселективные аллергены для кожных проб, некоторые реагенты для иммуноферментного анализа и многое другое. На этапе доклинических испытаний медикаментов приносятся в жертву миллионы генетически измененных животных.
Ниже в порядке усложнения технологии и степени отрыва от реальности представлены основные примеры применения генной инженерии в медицине.
Сегодня на вооружении у врачей есть ряд препаратов, для которых критически важно точное соответствие аналогам в организме. Это препараты заместительной терапии при эндокринологических заболеваниях, гематологических болезнях (эритропоэтин, гранулоцитарный колониестимулирующий фактор, факторы свертывания крови, некоторые моноклональные антитела и др.), вирусных инфекциях (интерфероны), инфаркте миокарда и ишемическом инсульте (фибринолитики) и многих других.
- Идентичность веществ по структуре человеческим. Инсулин, производившийся из поджелудочных желез свиней и крупного рогатого скота, отличался от человеческого по одной и трем аминокислотам, соответственно, это часто приводило к нежелательным реакциям.
- Более низкая цена и удобное производство. Для получения 200 г сухого вещества того же инсулина требуется поджелудочных желез от более чем 6000 коров (или свиней). То же количество может быть произведено бактериями, содержащимися в 1000 л культуральной жидкости.
- Отказ от специфического сырья, которое полностью не очищается, например, гипофизы трупов использовались для получения соматотропного гормона, а моча женщин в менопаузе — традиционный источник фолликулостимулирующего и лютеинизирующего гормонов.
Бактерии и дрожжи, культуры клеток яичника китайского хомячка и моркови, продуцирующие сырье для препаратов, — это хорошо, но довольно дорого, к тому же сборка некоторых сложных молекул тем же бактериям недоступна из‑за биохимических различий с человеком. Идея перевода «биореакторов» на подножный корм или удобрения давно витала в воздухе. Механизм в целом тот же: нужный ген встраивается в ДНК животного или растения. ДНК микроинъекцией вводится в ядро оплодотворенной яйцеклетки, которая имплантируется в матку. Большинство эмбрионов, конечно, погибает, а среди родившихся животных далеко не все производят нужное вещество. Тем не менее на сегодняшний день мы имеем трансгенных коров, коз, свиней, кроликов, кур, лососей и шелкопряда. Из их биологических жидкостей в экспериментах получены человеческие α-антитрипсин, альбумин, гемоглобин, эритропоэтин, гормоны, факторы свертывания крови, шовный и перевязочный материал… Стоило ли ради свиной спермы отходить от женской мочи, пока не ясно, ведь сложности с очисткой сохраняются, да и цена этих препаратов с учетом технологического процесса всё еще будет очень высокой.

Логическое продолжение трансгенных растений — так называемые съедобные лекарства (в основном вакцины). В самом деле, зачем тратить время и средства на выделение белков холерного вибриона, малярийного плазмодия, вирусов гепатита В, бешенства и иммунодефицита человека из томатов, бананов и картофеля, если их можно съесть и так? По крайней мере, в опытах на мышах удается достигнуть развития иммунного ответа, и даже термическая обработка в ряде случаев не снижает эффективности съедобной вакцины. Антигены в кишечнике «встречаются» с антигенпрезентирующими клетками, далее всё, как обычно. Преимущества очевидны: очень дешево, вкусно и в большом количестве. Основные недостатки: возможность развития иммунологической толерантности вместо иммунного ответа, вариабельность содержания интересующего белка от плода к плоду даже с одного куста, и в итоге — неясность «дозирования».
«Австралийский антиген», белок оболочки вируса гепатита В и капсидные белки нескольких типов вируса папилломы человека для соответствующих вакцин продуцируют трансгенные дрожжи. Принцип тот же, что и с инсулином, только вместо человеческого синтезируется вирусный белок. Этим же путем идут создатели испытываемой сейчас противогриппозной вакцины, в основе которой лежит иммуногенный белок клеточной стенки М2, высококонсервативный, в отличие от почти ежегодно «обновляемых» гемагглютинина и нейраминидазы (тех самых «H» и «N» с порядковыми номерами в названии очередного подтипа вируса).
Также возможно создание вирусных и бактериальных векторов. При этом гены высокоиммуногенных белков вводятся в непатогенные вирусы и бактерии, после чего, например, штаммы шигелл начинают экспрессировать антигены малярийного плазмодия, а сальмонеллы — белки вируса иммунодефицита человека. Попадая в организм, такие «овцы в волчьих шкурах» индуцируют не только гуморальный, но и клеточный иммунный ответ. Особый плюс подобных «сальмонелльных» вакцин — это возможность их перорального приема, что значительно упростит иммунизацию населения и снизит уровень напряженности (и шума) в прививочных кабинетах детских поликлиник.
Важнейшим успехом генной инженерии в медицине, венцом иммунопрофилактики и перспективным методом лечения опухолей и аутоиммунных заболеваний считаются ДНК-вакцины. В плазмиду встраивают промотор и ген интересующего белка (оболочки вируса, клеточной стенки бактерии, опухолевый антиген). Полученные векторы тем или иным путем вводятся в организм и попадают в ядро антигенпрезентирующей клетки. В ней продуцируется чужой белок, который «режется» на короткие пептиды и представляется для распознавания клеткам иммунной системы. Таким образом, роль «биореактора» играют уже клетки организма человека. Большинство таких вакцин пока обладают недостаточной иммуногенностью, ведутся работы по ее повышению.
Дальнейшее развитие данной отрасли науки привело к появлению генной терапии. Тут уже всё по‑взрослому, хотя пока и экспериментально. Устраняются посредники типа бактерий, коз и бананов. Как правило, так пытаются лечить тяжелые и редкие наследственные или спорадически возникающие заболевания, патогенез которых обусловлен дефектом какого‑либо одного гена, например, первичные иммунодефициты. При этом другие методы лечения неэффективны или труднодоступны, и терять, в общем, нечего. Результаты впечатляющие, но и цена нежелательных реакций высока.
В начале 2000‑х гг. в Англии и Франции проводились клинические испытания генной терапии Х-сцепленного тяжелого комбинированного иммунодефицита, при котором нарушен синтез общего рецептора нескольких цитокинов, отвечающих за дифференцировку и пролиферацию лимфоцитов. При отсутствии аллогенной трансплантации гемопоэтических стволовых клеток дети умирают от тяжелых инфекций в 1‑й год жизни. В ходе испытаний 20 маленьким пациентам были трансплантированы собственные (то есть дефектные) стволовые клетки костного мозга, в которые был введен ретровирусный вектор, несущий ген нормального белка рецептора и вирусный промотор. Блестящие результаты — восстановление функций иммунной системы, отсутствие рецидива в течение всего периода наблюдения (4-11 лет) — были омрачены развитием Т-клеточного острого лимфобластного лейкоза у 5 детей (известно, что один ребенок погиб). Выяснилось, что ген белка и вирусный промотор у всех 5 заболевших встроились в ДНК рядом с протоонкогенами, т. е. генами, при усилении экспрессии которых возможно неконтролируемое деление клеток. Встраивание генного материала в ДНК хозяина в наше время в основном дело случая.
Первые ошибки были учтены, в настоящее время исследователи выбирают неонкогенные вирусы с известными местами встраивания в человеческую ДНК, или плазмиды.
Ведутся разработки препаратов генной терапии и для более «народных» болезней: ишемической болезни сердца, хронической критической ишемии нижних конечностей (местно вводятся гены фактора роста эндотелия сосудов — с целью стимуляции ангиогенеза), опухолей различной локализации (блокада онкогенов, индукция апоптоза) и, конечно, сахарного диабета I типа. Есть надежда, что они будут дешевле.
В общем, в генной инженерии остается достаточно технологических трудностей, иммунологического несоответствия, опасности инфицирования человека вирусами животных с потенциальным появлением новых болезней. Всего этого упрямые и беспринципные ученые не очень‑то и боятся. Понятно, что у человечества хватит мозгов, чтобы как‑то решить эти проблемы, остается надеяться, что хватит ума не наделать новых.
Читайте также:
- Рентгенограмма, КТ, МРТ артропатии дугоотростчатых суставов шейного отдела позвоночника
- Абсцесс орбиты: причины, диагностика, лечение
- Укладка при рентгенограмме локтевого сустава в аксиолатеральной проекции (методе Койла)
- Укладка при рентгенограмме пальца руки в ЗП проекции
- Организация эпидемического процесса. Биологическая основа эпидемического процесса.
