Пример инфаркта миокарда у ребенка. Инфаркт миокарда при тетраде Фалло
Добавил пользователь Евгений Кузнецов Обновлено: 02.02.2026
Рассмотрены подходы к дифференциальной диагностике синдрома боли в грудной клетке у пациента в отделении неотложной кардиологии. Выделены признаки, позволившие исключить диагноз острого коронарного синдрома и диагностировать с учетом критериев, предложенн
Difficult diagnosis. Acute myocardial Infarction or myopericarditis? E. A. Temnikova, A. I. Kondratiev, V. V. Savilova, A. S. Denisova, A. E. Kolyadko, M. V. Temnikov
The approaches to the differential diagnosis of chest pain syndrome for patients admitted to the emergency cardiology department were reviewed. The symptoms which allow to exclude the diagnosis of acute coronary syndrome and diagnose myopericarditis, based on the criteria of the European Society of Cardiology were highlighted.
Несмотря на совершенствование медицинских технологий, дифференциальный диагноз боли в грудной клетке остается сложной задачей, так как ее могут вызывать многие заболевания и состояния, а также их сочетания [1]. Особое значение имеет своевременное и точное распознавание прогностически неблагоприятных клинических ситуаций, требующих специальной тактики лечения. Острый коронарный синдром (ОКС) относится к патологии, актуальность максимально быстрой диагностики которой хорошо известна и не вызывает сомнений. Однако гипердиагностика ОКС также является существенной проблемой. За рубежом до 90% лиц с острой болью в груди, направленных в отделения неотложной помощи, не имеют острой коронарной патологии 4. По отечественным данным, диагноз ОКС не подтверждается у трети пациентов, поступающих в стационар [5]. Необоснованное инвазивное и медикаментозное лечение значительно увеличивает затраты на лечение, ухудшает течение заболеваний, приведших к развитию болевого синдрома, а также создает дополнительные риски, связанные с госпитализацией и диагностическими манипуляциями, включая инфекционные и процедурные осложнения 7.
С согласия пациента нами представлен клинический случай дифференциального диагноза с исключением ОКС. Пациент К., 34 лет, доставлен в скоропомощную больницу бригадой скорой медицинской помощи (СМП). Боль в средней трети грудины с иррадиацией в обе стороны по передней грудной стенке и плечевые суставы впервые появилась без видимых причин накануне вечером дома. Она не сопровождалась одышкой и сердцебиением, не ограничивала значимо обычную физическую активность, но усиливалась при глубоком вдохе. Пациент дважды принял таблетированные обезболивающие препараты на основе метамизола натрия, но боль не прошла. В два часа ночи боль стала резкой, интенсивной, и пациент вызвал бригаду СМП. При осмотре на дому фельдшером состояние пациента описано как удовлетворительное, указаны уровень артериального давления (АД) 140/90 мм рт. ст., пульс — 82 в минуту. Клинические проявления и данные электрокардиограммы (ЭКГ) оценены как проявления ОКС, введены парентерально нитрат и наркотический анальгетик (морфин), купировавшие боль; даны внутрь ацетилсалициловая кислота и клопидогрел в нагрузочных дозах. Дополнительно в приемном отделении выяснено, что у пациента в 17 лет после дорожной травмы удалена селезенка, последние 10 лет постепенно нарастает масса тела, отягощен семейный анамнез (отец умер в 54 года внезапно, на аутопсии выявлен ранее не диагностированный постинфарктный кардиосклероз). Ранее пациент длительно работал машинистом электропоезда и регулярно проходил тщательные медицинские осмотры, которые не выявляли никаких других отклонений в состоянии здоровья и лабораторных показателях. Последние 7 лет работа связана с физическими нагрузками (контроль строящихся объектов на местности), затруднений при выполнении ее не ощущал.
При осмотре на момент госпитализации состояние удовлетворительное. Тип телосложения гиперстенический. Повышенного питания, индекс массы тела (ИМТ) 34 кг/м 2 . Отеков нет. Кожный покров чистый. Зев гиперемирован, миндалины не увеличены. Щитовидная железа не увеличена. Грудная клетка правильной формы. Над легкими перкуторный легочный звук. Дыхание везикулярное, в нижних отделах, под лопатками жесткое. Частота дыхательных движений 16 в минуту. Границы сердца перкуторно не расширены. Пульс одинаковый на обеих руках, хорошего наполнения, ритмичный 86 в минуту. АД 120/80 мм рт. ст. на обеих руках. Тоны сердца ритмичные, 86 в минуту, акцент 2 тона над легочной артерией. Живот увеличен за счет подкожно-жировой клетчатки, по средней линии послеоперационный шов, при пальпации мягкий, безболезненный. Размеры печени перкуторно по Курлову увеличены на 2 см, при пальпации ее край эластичный, безболезненный. Почки не пальпируются.
На ЭКГ при поступлении — синусовый ритм 86 в минуту, подъем сегмента ST во II, III, AVF и всех грудных отведениях (рис. 1). Обзорная рентгенография органов грудной клетки патологии не выявила (рис. 2). При лабораторном обследовании в анализе периферической крови: лейкоцитоз 12,55 × 10 9 л без сдвигов в лейкоцитарной формуле, повышение уровня тропонина (0,12 нг/мл при референсном значении 0-0,1 нг/мл).
Характер болевого синдрома у пациента (отсутствие связи с физической нагрузкой и усиление его при дыхании, постепенное нарастание боли в течение нескольких часов) и тип изменений на ЭКГ (элевация с вогнутостью сегмента ST в большинстве отведений конкордантно максимальному зубцу комплексa QRS) не укладывались в типичную клиническую картину инфаркта миокарда и в большей степени соответствовали проявлениям перикардита. Но имевшееся повышение уровня маркера некроза миокарда не позволяло исключить повреждение миокарда ишемического или воспалительного характера. При эхокардиографии (Эхо-КГ) отсутствовали признаки гипокинеза и перикардиального выпота, не было нарушений сократимости миокарда, но имелись признаки дилатации правых отделов сердца (расширение полостей правых желудочка (3,8 см) и предсердия в диастолу (5,2 см)), незначительное увеличение размеров левого предсердия в диастолу (4,2 см), утолщение межжелудочковой перегородки с толщиной в базальных отделах до 1,3 см в диастолу при нормальном индексе массы миокарда левого желудочка.
Пациент повторно тщательно опрошен, выяснено, что за 2 недели до госпитализации он «перенес на ногах», без лечения острое заболевание (общее недомогание, мышечная слабость, першение в горле без кашля и насморка), а ранее неоднократно болел ангинами с тяжелым течением, по поводу которых даже госпитализировался в инфекционную больницу (последний раз год назад).
Таким образом, на момент госпитализации в отделение первичное обследование пациента не позволяло точно дифференцировать у пациента острый миокардит или перикардит с острым инфарктом миокарда.
Диагноз определенного острого миокардита, по мнению всех авторитетных экспертных сообществ, необходимо обосновывать гистологическими, иммунологическими или иммуногистологическими критериями, доказывающими поражение сердца воспалительной природы 11. Это делает практически невозможным достоверную диагностику миокардита в рутинной клинической практике и очень приблизительной оценку частоты заболевания. Последние статистические подсчеты предполагают развитие миокардитов в 22 случаях на 100 000 пациентов в год [12], хотя есть и сведения о том, что вирусный миокардит возможен у 1-5% пациентов с острыми вирусными инфекциями [13]. Вирусы в развитых странах считаются самой частой причиной миокардита 15. Спектр вирусов, наиболее часто определяемых как причина миокардита, различен в зависимости от географического региона и меняется с течением времени [13, 18-20]. Важно, что при определенных клинических вариантах течения миокардита могут чаще выявляться определенные типы вирусов. Например, при клинической картине псевдокоронарного или инфарктоподобного течения миокардита в биоптатах миокарда часто определяется парвовирус B19 [21]. Именно его геном в настоящее время в Европейской популяции является одной из наиболее частых находок у пациентов с подтвержденным диагнозом миокардита [9].
В случае псевдокоронарного варианта миокардита, как и при ОКС, у пациентов имеются: острая боль в груди; изменения сегмента ST и зубца T на ЭКГ; могут определяться нарушения глобальной или очаговой сократимости или дисфункция желудочков, по данным Эхо-КГ, и повышаться уровни тропонинов T и I. Однако присутствуют анамнестические данные о перенесенной за 1-4 недели до болевого синдрома острой респираторной или кишечной инфекции и отсутствуют ангиографические данные об острых формах ишемической болезни сердца [9, 14, 22, 23]. Во всех случаях подозрения на миокардит экспертами рекомендуется обязательное исключение заболеваний, которые могли бы объяснить возникшие клинические проявления. При болевом синдроме в груди самым информативным методом для исключения ишемической болезни сердца (ИБС) является диагностическая коронароангиография (КАГ) [9, 23].
КАГ выявила у пациента протяженный (до 4 см) участок стеноза 90% просвета сосуда в проксимальном сегменте правой коронарной артерии (ПКА) (рис. 3) и ровные контуры всех остальных сосудов без признаков стенозирования. Для уточнения характера изменений во время КАГ проведена проба с введением нитроглицерина, однако ее результат оценен как сомнительный.
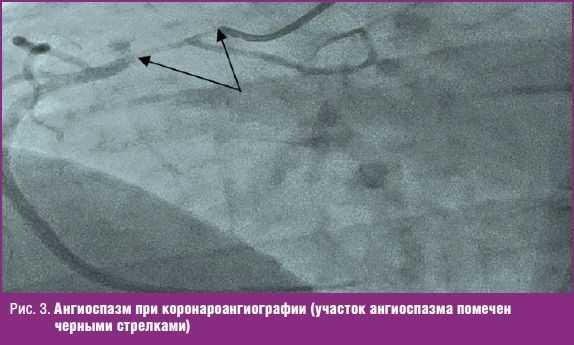
Таким образом, на этом этапе диагностики в пользу диагноза ОКС были неблагоприятный семейный анамнез по ИБС и сочетание приступа боли в груди с изменениями ЭКГ и повышением уровня тропонина. Сомнения в диагнозе острой коронарной патологии поддерживали: молодой возраст пациента и данные о тщательном наблюдении ранее, не выявлявшем каких-либо признаков заболеваний сердца и сосудов; характер болевого синдрома и его длительность; тип изменений на ЭКГ; протяженные ангиографические изменения только одного коронарного сосуда. Запись КАГ была пересмотрена с экспертами и обсуждена в консилиуме. Коллегиально изменения ПКА оценены как протяженный спазм.
В литературе широко представлен коронароспазм при вирусном миокардите, вызванном парвовирусом B19. Его связывают с вовлечением в воспалительный процесс эндотелиальных клеток сосудов и гиперкатехоламинемией. Повреждение кардиомиоцитов на небольших участках возникает вторично и обусловлено миграцией воспалительных клеток из коронарного сосуда в интерстиций. Клиническая картина в этих случаях проявляется псевдокоронарным болевым синдромом и, как правило, отсутствием симптомов выраженной сердечной недостаточности (СН) 27.
Вазоспазм коронарных артерий достаточно часто описан и при перикардите, и при миоперикардите 30. Диагноз миоперикардита не часто используется в отечественной клинической практике. Между тем, с практической точки зрения, в ряде ситуаций он наиболее точно описывает патологию пациента. К тому же одновременное поражение перикарда и миокарда не является редкостью из-за их общей, чаще всего вирусной, этиологии. Термином «миоперикардит» обозначается перикардит с известным или клинически подозреваемым вовлечением миокарда [31]. Миоперикардит — наиболее частый вариант комбинации мио- и перикардитов в клинической практике. Его диагностируют при сочетании острого воспалительного перикардиального синдрома (ОВПС) с повышенными маркерами повреждения миокарда (тропонин I или Т, КФК-МВ) при отсутствии признаков новых нарушений функции левого желудочка (ЛЖ) по данным визуализации [31]. В свою очередь, ОВПС диагностируется при наличии хотя бы двух из четырех критериев: перикардитическая боль в груди, перикардиальные шумы, новый распространенный подъем ST или депрессия PR на ЭКГ, перикардиальный выпот (новый или ухудшившийся). Дополнительно подтверждать диагноз могут: повышение маркеров воспаления (т. е. С-реактивный белок (СРБ), скорость оседания эритроцитов (СОЭ), лейкоциты крови) и данные за воспаление перикарда методами компьютерной томографии и магнитно-резонансного исследования сердца. Для уточнения диагноза считается обязательным минимумом проведение аускультации, ЭКГ, Эхо-КГ, рентгенографии, обычных анализов крови, включая маркеры воспаления (т. е. СРБ или СОЭ) и поражения миокарда (КФК, тропонины). Подозрение на миоперикардит при отсутствии или незначительной дисфункции ЛЖ, без симптомов СН не требует проведения эндомиокардиальной биопсии. Однако для исключения ОКС при соответствующей клинической картине показана КАГ [31]. Анамнестически миокардиту, перикардиту и их сочетаниям часто предшествует или иногда сопутствует острая респираторная инфекция (особенно острый тонзиллит, пневмония) или гастроэнтерит.
В дальнейшем боли в груди пациента не беспокоили, состояние оставалось удовлетворительным, гемодинамика была стабильной (пульс на фоне назначенной терапии не чаще 60 в минуту, удовлетворительных свойств, АД не выше 120/80 мм рт. ст. на обеих руках). По литературным данным, динамика ЭКГ-изменений при остром миоперикардите не имеет четкой характеристики [31, 33]. На контрольных ЭКГ к концу первых суток от начала болезни уменьшилась элевация сегмента ST в V1-V2, но сохранялись изменения в других отведениях, отмечался транзиторный синдром WPW (рис. 4). Лабораторно оставался лейкоцитоз с уменьшением относительного количества сегментоядерных лейкоцитов и повышением лимфоцитов к концу первой недели госпитализации, с конца первых суток госпитализации отмечалось повышение общей КФК (516,0 ЕД/л) и ее МВ-фракции (30,6 ЕД/л). В день поступления и в дальнейшем отмечалось незначительное повышение уровня антистрептолизина О (не более полутора норм), что не позволяло расценивать эти изменения как свидетельство перенесенной острой стрептококковой инфекции. Уровень СРБ через 2 дня снизился вдвое, а к 10-му дню госпитализации нормализовался. Отклонений в белковых фракциях не выявлено.
При ультразвуковом исследовании (УЗИ) органов брюшной полости описаны признаки гепатомегалии с диффузными изменениями в печени, характерными для жирового гепатоза, и повышенная эхогенность поджелудочной железы, в ложе оперативно удаленной селезенки округлая добавочная долька. Мультиспиральная компьютерная томография (МСКТ) органов грудной полости, выполненная через неделю после КАГ, не выявила изменений органов грудной клетки, в том числе признаков кальциноза коронарных артерий (расчетный индекс кальциноза по Агатстон составил 0). С диагностической целью еще через неделю было выполнено МСКТ — исследование области сердца в низкодозовом объемном режиме с использованием проспективной ЭКГ-синхронизации. Признаков стойких и динамических стенозов просветов коронарных артерий выявлено не было.
Заключительный клинический диагноз пациента: «Основное заболевание: острый миоперикардит (I30.1). Осложнения: вазоспастическая стенокардия. Сопутствующие заболевания: ожирение абдоминального типа. ИМТ 35 кг/м 2 . Транзиторный синдром WPW. Травма селезенки. Спленэктомия (1998 г.). Хронический тонзиллит, ремиссия».
Исходя из клинических проявлений, наиболее вероятный этиологический фактор миоперикардита в данном случае — парвовирус В19. Подтверждения вирусной этиологии заболевания серологическими исследованиями современные рекомендации по перикардиту и миокардиту считают нецелесообразным [9, 23, 31].
Пациент изначально получал стандартную для ОКС терапию, затем основу терапии составили ацетилсалициловая кислота, ингибитор ангиотензинпревращающего фермента (периндоприла аргинин 10 мг) и бета-блокатор (метопролола тартрат 50 мг). Выписан из отделения в удовлетворительном состоянии без жалоб. На контрольных амбулаторных осмотрах в последующие 1,5 года жалоб не предъявлял, снижения толерантности к физической нагрузке не отмечал. Состояние оценивалось как удовлетворительное. Однако периодически отмечалось повышение уровня АД до первой степени артериальной гипертензии.
При лабораторном обследовании пациента повышение уровня лейкоцитов в общем анализе крови при нормальном уровне СОЭ и снижении СРБ сохранялось в течение месяца.
На ЭКГ покоя в динамике ритм синусовый, ЧСС 70 в минуту, синдром WPW (рис. 4); при суточном мониторировании ЭКГ кроме синдрома WPW отмечены редкие одиночные наджелудочковые и желудочковые экстрасистолы. Контроль ЭхоКГ через 2, 9 и 12 месяцев дополнительно к выявленным ранее изменениям определил наличие уплотнения листков перикарда по задней стенке левого желудочка и эхо-свободное пространство в полости перикарда размером до 5 мм по периметру сердца в диастолу; оставались признаки увеличения полости левого предсердия и правого предсердия, гипертрофии межжелудочковой перегородки и задней стенки левого желудочка при нормальных показателях индекса массы миокарда левого желудочка; зон гипокинеза не выявлено, сократительная способность миокарда оценена как удовлетворительная, нарушений глобальной систолической и диастолической функций левого желудочка не было. С учетом появления незначительного по объему выпота в перикард исключены нарушения функции щитовидной железы (тиреоидный профиль лабораторно) и проведено УЗИ щитовидной железы (патологии не выявлено). Таким образом, появление малого (менее 10 мм) выпота в перикарде [31] и уплотнение листков перикарда, по данным УЗИ сердца, можно рассматривать как определенную стадийность течения миоперикардита. В то же время симптомы увеличения предсердий и утолщения МЖП невозможно однозначно трактовать как проявления поражения сердца при артериальной гипертонии (диагноз установлен исходя из данных наблюдения после выписки) или проявления и последствия миоперикардита.
Правильность интерпретации данных КАГ при первичном обследовании пациента подтвердили не только отсутствие клинических признаков атеросклероза коронарных артерий в дальнейшем, но и данные проведенных в последующем МСКТ. Кроме этого УЗИ брахиоцефальных сосудов через год также не выявило признаков атеросклероза периферических сосудов.
Быстрое улучшение состояния и доброкачественное течение заболевания у пациента вполне укладывается в стандартное описание проявлений миоперикардита. Как правило, прогноз при вовлечении миокарда в воспалительный процесс перикарда благоприятный, в литературе не описано развитие СН с ухудшением гемодинамики или смерть больных с миоперикардитом [31].
Вывод. Для правильного врачебного заключения, определяющего выбор тактики ведения пациента, необходим тщательный критический анализ всех имеющихся у пациента симптомов и данных анамнеза, а также постоянная настороженность в отношении более редких причин развития синдрома болей в груди.
Литература
Е. А. Темникова* , 1 , доктор медицинских наук, профессор
А. И. Кондратьев*, кандидат медицинских наук
В. В. Савилова**
А. С. Денисова*
А. Е. Колядко*
М. В. Темников***
* ФГБОУ ВО ОмГМУ Минздрава России, Омск
** БУЗОО ГК БСМП № 1, Омск
*** ФГБВОУ ВО ВМА им. С. М. Кирова МО РФ, Санкт-Петербург
Трудный диагноз. Острый инфаркт миокарда или миоперикардит?/ Е. А. Темникова, А. И. Кондратьев, В. В. Савилова, А. С. Денисова, А. Е. Колядко, М. В. Темников
Для цитирования: Лечащий врач № 1/2019; Номера страниц в выпуске: 71-81
Теги: сердце, воспаление, парвовирус, диагностика
В путешествие c болезнью сердца
Каким пациентам с сердечно-сосудистыми заболеваниями не показаны длительные поездки? Может ли аспирин снизить риск тромбоза глубоких вен? Какие советы следует дать отправляющимся в путешествие пациентам, принимающим ингибиторы АПФ для предупреждения
Каким пациентам с сердечно-сосудистыми заболеваниями не показаны длительные поездки?
Может ли аспирин снизить риск тромбоза глубоких вен?
Какие советы следует дать отправляющимся в путешествие пациентам, принимающим ингибиторы АПФ для предупреждения обезвоживания?
 |
| Рисунок 1. Ненужное ограничение передвижения усугубляет снижение качества жизни у страдающих сердечно-сосудистыми заболеваниями |
Чтобы дать правильный совет, необходимо принять во внимание вид транспорта и цель путешествия (см. раздел «Опасности и преимущества каждого вида транспорта»). Научно-исследовательских работ, посвященных путешествиям пациентов, страдающих серьезными сердечно-сосудистыми заболеваниями, очень мало, поэтому в основе приведенных здесь рекомендаций лежит скорее опыт, накопленный автором и его коллегами, и здравый смысл, нежели строгие факты.
При поездках за границу необходимо адекватное медицинское страхование. В Британском фонде больных с сердечно-сосудистыми заболеваниями можно получить информацию о страховых компаниях, оказывающих такого рода услуги.
Как и положено, перед путешествием надо провести вакцинацию, профилактику малярии и т. п.
Обезвоживание. При желудочно-кишечных расстройствах потеря жидкости происходит быстро, а это может усугубить гипотензию, особенно если пациент принимает ингибиторы АПФ.
При жарком климате наблюдается усиленное потоотделение; если не происходит адекватного восполнения соли и воды, это может привести к умеренной дегидратации. У пациентов с сердечной недостаточностью нередко развиваются тяжелые нарушения функции почек.
Таким больным сразу же по прибытии к месту назначения рекомендуется взвеситься при первой же возможности (как правило, весы в ванных комнатах отелей не точны, поэтому лучше пользоваться одними и теми же весами). В случае потери веса более чем на 3 кг необходимо принять меры.
Если пациент принимает мочегонные, их следует отменить до восстановления веса. Необходимо увеличить потребление соли (в виде соленых орешков, хрустящего картофеля и т. п.), а также объем выпитой жидкости. Не следует возмещать недостаток жидкости, употребляя алкогольные напитки.
Пациентам с поносом и рвотой нужно сразу же взвеситься, чтобы следить за последующей регидратацией. Можно посоветовать не принимать диуретики до восстановления массы тела.
Полезно также отменить ингибиторы АПФ до тех пор, пока пациент не возвратится к нормальному весу, так как обезвоживание обычно ведет к активации ренин-ангиотензиновой системы как защиты против гипотензии. В этих условиях даже низкая доза ингибиторов АПФ короткого действия вызывает сильную и длительную гипотензию и может привести к почечной недостаточности.
Изменения в диете. Такие изменения могут повлиять на обмен натрия. С уменьшением потребления соли снижается давление, особенно у пациентов, принимающих ингибиторы АПФ. Значительное увеличение концентрации натрия в организме зачастую вызывает отек легких или периферические отеки у пациентов с сердечной недостаточностью. Изменения в диете могут отразиться и на антикоагулянтной терапии за счет влияния на кишечную флору, так как происходит поглощение витамина К и всасывание некоторых препаратов. Нужно предупредить пациентов о необходимости соблюдать умеренность в употреблении алкоголя.
Ежедневное взвешивание позволяет оценивать гидратацию и солевой баланс. Коагуляционные тесты должны проводиться до путешествия. В случае пребывании за границей более двух — трех недель эти анализы необходимо по возвращении сделать вновь.
Алкоголь. При сердечном заболевании неалкогольного происхождения допускается умеренное потребление алкоголя.
Фоточувствительность. Терапия амиодароном вызывает острую повышенную чувствительность кожи к солнечному свету, хотя проходят месяцы или годы, прежде чем в коже накапливается достаточное количество препарата.
Повышенную реакцию вызывает свет видимого спектра, поэтому стандартные кремы для загара считаются неэффективными. Необходимо порекомендовать пациентам носить панаму и прикрывать руки и ноги, выходя на солнце. Если это по каким-то причинам невозможно, целесообразно использовать крем, блокирующий весь видимый спектр. Он имеется в специальных аптеках.
- Особые советы пациентам с распространенными кардиологическими проблемами
Пароксизмальная фибрилляция предсердий. Если пациент беспокоится перед полетом, предложите ему за час до вылета принять бета-блокатор (25 — 59 мг атенолола, к примеру), чтобы предотвратить приступ.
Проверьте, нет ли противопоказаний к назначению бета-блокаторов. Непременно за несколько дней проведите пробное лечение, чтобы убедиться в отсутствии обратной реакции, способной причинить пациенту вред в полете. Для пациентов с болезнями органов дыхания альтернативным препаратом может служить верапамил (80 мг внутрь).
Больных нужно обучить приемам, помогающим остановить приступ (проба Вальсальвы, погружение лица в холодную воду; можно также порекомендовать быстро выпить большой стакан ледяной воды).
Верапамил и бета-блокаторы (но не в комбинации) — единственные препараты, которые пациенты могут безопасно назначать себе сами. Эти лекарства останавливают некоторые приступы и контролируют скорость желудочковых сокращений.
Атенолол или верапамил (один раз в день) контролируют скорость сердечных сокращений; при этом большинство пациентов возвращаются к синусовому ритму в течение 24 часов. Риск тромбоэмболии сохраняется все время, пока отсутствует синусовый ритм. Поэтому, если нет уверенности, что синусовый ритм восстановился, необходимо срочно обратиться за помощью.
Стенокардия. Для беспокойных больных оптимальной защитой может служить прием лекарственного препарата за час до путешествия. Бета-блокатор может быть добавлен к обычной схеме лечения. Не назначайте вместе бета-блокатор и верапамил.
Пациенты, принимающие ингибиторы АПФ в связи с гипертензией или сердечной недостаточностью, должны избегать обезвоживания. Для контроля за гидратацией достаточно внимательно следить за весом. В большинстве отелей имеются напольные весы, а сопровождающие туристическую группу операторы всегда готовы прийти на помощь.
Инфаркт миокарда в недалеком прошлом. В первые две недели после инфаркта миокарда поездки и полеты запрещаются; желательно также воздерживаться от ненужных переездов в течение шести недель. При отсутствии противопоказаний пациентам назначается ежедневный профилактический прием бета-блокатора, так как доказано, что он снижает смертность по крайней мере в течение года после инфаркта.
При приемы ингибиторов АПФ, как уже было сказано выше, необходимо избегать обезвоживания. Имеется повышенный риск венозных тромбозов.
Недавнее хирургическая операция на сердце. Следует воздерживаться от длительных поездок в течение минимум двух (а предпочтительно даже шести) недель после операции. В послеоперационный период повышается риск ТГВ.
Сердечная недостаточность. Основная опасность для таких пациентов заключается в излишествах разного рода, будь то алкоголь, соль или инсоляция. Все эти моменты освещены выше.
Поражения клапанов сердца. Особых рекомендаций для таких больных не существует, но при развитии на фоне этого состояния аритмий, стенокардии или сердечной недостаточности необходимо принять соответствующие меры.
Полезные адреса
British Heart Foundation, 14 Fitzharding St, London, WIH 4DH, tel 0171 935 0185, fax 0171 486 1273.
The Medical Officer, British Airways PLC, PO Box 10, Healthrow Airport, London TW6 2JA.
Обратите внимание!
- С помощью врача пациент должен проверить, насколько состояние его здоровья соответствует требованиям данного транспортного средства, и проинформировать соответствующий персонал о своем заболевании
- Бета-блокаторы могут применяться для предупреждения стенокардии или аритмий, провоцируемых волнением или перевозбуждением
- Пациенты, принимающие ингибиторы АПФ или диуретики, должны регулярно взвешиваться на одних и тех же весах, чтобы вовремя обнаружить обезвоживание или задержку жидкости
- Больным, применяющим антикоагулянты, необходимо провести оценку свертываемости крови перед и во время поездки (в случае если она продолжается более двух — трех недель)
- Пациенты, прошедшие курс лечения амиодароном, обладают повышенной чувствительностью к солнечному свету, поэтому им следует избегать длительного пребывания на солнце или применять крем, блокирующий проникновение излучения всего видимого спектра
- По крайней мере в течение двух недель после инфаркта миокарда или хирургических вмешательств на сердце (оптимальное время — шесть недель) путешествия противопоказаны
Опасности и преимущества различных видов транспорта
Преимущества. Автомобиль считается наиболее привычным и почти не вызывающим у больного тревоги видом транспорта. Пациент, как правило, едет «от двери до двери» и в любой момент может остановиться.
Недостатки. Длительные поездки могут вызывать напряжение, особенно если пациент сам ведет машину.
Советы. В случае длительных поездок необходимо делать остановки.
Противопоказания. Для пассажиров четких противопоказаний нет, но любое состояние, сопряженное с риском внезапной потери контроля над управлением, исключает возможность вождения.
- Путешествие по железной дороге и на автобусе
Преимущества. С поездкой на поезде или автобусе связано меньше стрессовых ситуаций, чем при вождении. Обычно есть возможность сходить в туалет; пациенты могут встать и размять ноги.
Недостатки. В случае возникновения проблем не всегда просто остановиться.
Советы. Для многих поезд и автобус — идеальные средства передвижения.
Противопоказания. Для пассажироров четкие противопоказания отсутствуют.
Преимущества. Отсутствие стрессовых ситуаций (если, конечно, пациент не страдает морской болезнью).
Недостатки. Бывает нелегко получить квалифицированную медицинскую помощь, хотя на борту имеется медицинский персонал. Недомогания чаще развиваются именно во время морских путешествий и связаны с потерей солей и воды при рвоте. Кроме того, не исключено, что пациент не будет иметь возможность принять препарат обычным образом.
Советы. Больным, недавно перенесшим тяжелые заболевания, например, инфаркт миокарда или приступ стенокардии, путешествовать морем не рекомендуется. Изменения в диете и образе жизни могут существенно повлиять на состояние сердечно-сосудистой системы (см. ниже раздел «Подготовка к путешествию»)
Полезно иметь с собой антигистаминные препараты от морской болезни, которые в случае предрасположенности следует принимать профилактически, или же просто иметь с собой на всякий случай. Ниже приводятся рекомендации на случай обезвоживания.
Преимущества. Самолет — самый быстрый способ передвижения на длинные расстояния, с ним, как правило, связано меньше неудобств, чем с остальными видами транспорта.
Недостатки. Некоторые пациенты очень волнуются перед полетом. У самых заядлых путешественников после возникновения у них сердечных проблем может наблюдаться повышенная тревожность; тревога же нередко провоцирует аритмию или приступ стенокардии. Даже в специальных кабинах напряжение кислорода падает примерно до 75 mmHg (103 mmHg на уровне моря). Это приводит к пониженному насыщению крови кислородом, что очень опасно для пациентов с тяжелыми легочными заболеваниями, а также сопутствующими им сердечными заболеваниями или сердечной недостаточностью и стенокардией. Длительное ожидание в аэропортах и долгий путь к выходу после приземления могут создавать дополнительные трудности. Воздействие длительных перелетов на водный баланс неоднозначно. Пониженное давление в кабинах может привести к увеличению вентиляции и потере жидкости в процессе дыхания. Недостаток питья или же избыток алкоголя только усугубляют ситуацию. У пациентов, получающих ингибиторы АПФ и диуретики, при обезвоживании развивается гипотензия. Длительное обездвиживание, особенно с опущенными ногами, может стать причиной тромбоза глубоких вен (ТГВ). Риск снижается, если пациент уже принимает варфарин, но другие сердечные больные относятся к группе повышенного риска.
Советы. Следует поинтересоваться, предоставляет ли аэропорт соответствующее обслуживание (носильщик, электрические вагонетки, кресло для больных и т. п.). Все авиалинии IATA имеют единый медицинский сертификат и врачебную комплектацию, с которой пациент может ознакомиться во время покупки билета. Пациенты со стенокардией или пароксизмальной фибрилляцией предсердий должны до вылета принять бета-блокатор (при отсутствии противопоказаний).
С гипоксией можно бороться путем дополнительной оксигенации, которую предоставляют сами авиалинии (если это указано в перечне услуг). Риск отравления двуокисью углерода для пациентов с респираторными заболеваниями стоит оценить предварительно: перед тем как заказать билеты, необходимо сделать специальные анализы газового состава крови.
Для предовращения ТГВ пациентам следует пить столько, сколько необходимо. Во время длительного перелета следует также регулярно делать упражнения для ног. Неясно, снижает ли риск ТГВ прием аспирина. Нужно обязательно предупредить пациента о последствиях чрезмерного употребления алкоголя.
Пациентам с тяжелой стенокардией или сердечной недостаточностью не стоит летать самолетом без крайней необходимости. В общем случае, если пациент способен пройти сотню ярдов по ровной местности с обычной скоростью без затруднений дыхания и болей в груди, значит, он может путешествовать на самолетах. В течение десяти дней после кардиохирургических манипуляций или неосложненного инфаркта миокарда летать запрещается. В более тяжелых случаях этот интервал удлиняется.
Если в аэропортах имеются кресла для больных, это должно быть указано в рекламных проспектах.
Тетрада Фалло
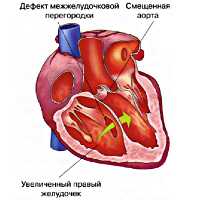
Тетрада Фалло - сочетанная врожденная аномалия сердца, характеризующаяся стенозом выводного тракта правого желудочка, дефектом межжелудочковой перегородки, декстропозицией аорты и гипертрофией миокарда правого желудочка. Клинически тетрада Фалло проявляется ранним цианозом, задержкой развития, одышкой и одышечно-цианотическими приступами, головокружением и обмороками. Инструментальная диагностика тетрады Фалло включает проведение ФКГ, электрокардиографии, УЗИ сердца, рентгенографии грудной клетки, катетеризации полостей сердца, вентрикулографии. Оперативное лечение тетрады Фалло может быть паллиативным (наложение межсистемных анастомозов) и радикальным (полная хирургическая коррекция порока).
МКБ-10
Общие сведения
Тетрада Фалло - сложный врожденный порок сердца «синего» типа, морфологическую основу которого составляют четыре признака: обструкция выходного отдела правого желудочка, обширный ДМЖП, гипертрофия правого желудочка и смещение аорты. В кардиологии тетрада Фалло встречается в 7-10 % случаев среди всех врожденных пороков сердца и составляет половину всех пороков цианотического типа. Подробная анатомическая характеристика порока, как самостоятельной нозологической формы, впервые была дана французским врачом-патологоанатомом Е.L.A. Fallot в 1888 г., по имени которого впоследствии он и был назван.
По структуре дефекта к тетраде Фалло наиболее близки триада Фалло (стеноз отверстия легочной артерии, дефект межпредсердной перегородки и гипертрофия правого желудочка) и пентада Фалло (тетрада Фалло и ДМПП). Тетрада Фалло может сочетаться с другими аномалиями сердца и сосудов: праворасположенной дугой аорты, аномалиями венечных артерий, стенозом ветвей легочной артерии, открытым артериальным протоком, полной формой открытого атриовентрикулярного канала, добавочной левосторонней верхней полой веной, частичным аномальным дренажом легочных вен.
Причины тетрады Фалло
Тетрада Фалло формируется вследствие нарушения процесса кардиогенеза на 2-8 нед. эмбрионального развития. К развитию порока могут приводить перенесенные беременной на ранних сроках гестации инфекционные заболевания (корь, скарлатина, краснуха); прием лекарственных средств (снотворных, седативных, гормональных и др.), наркотиков или алкоголя; воздействие вредных производственных факторов. В формировании ВПС прослеживается влияние наследственности.
Тетрада Фалло нередко встречается у детей с синдромом Корнелии де Ланге (амстердамской карликовостью), включающим олигофрению и множественные аномалии развития («лицо клоуна», атрезию хоан, деформацию ушных раковин, готическое небо, косоглазие, миопию, астигматизм, атрофию зрительных нервов, гипертрихоз, деформацию грудины и позвоночника, синдактилию стоп, уменьшение количества пальцев, пороки развития внутренних органов и т. д.).
Пусковым механизмом тетрады Фалло служит неправильная ротация (против часовой стрелки) артериального конуса, вследствие чего происходит смещение клапана аорты правее относительного легочного. При этом аорта располагается над межжелудочковой перегородкой («аорта-всадник»). Неправильное положение аорты обусловливает смещение легочного ствола, который несколько удлиняется и сужается. Ротация артериального конуса препятствует соединению его собственной перегородки с межжелудочковой перегородкой, что обусловливает образование ДМЖП и последующее расширение правого желудочка.
Классификация тетрады Фалло
С учетом характера обструкции выводного тракта правого желудочка анатомические варианты тетрады Фалло представлены четырьмя типами: эмбриологическим, гипертрофическим, тубулярным и многокомпонентным.
I тип тетрады Фалло - эмбриологический. Обструкция обусловлена смещением конусной перегородки кпереди и влево или (и) ее низким расположением. Зона максимального стеноза соответствует уровню разграничительного мышечного кольца. Фиброзное кольцо легочного клапана практически не изменено или умеренно гипоплазировано.
II тип тетрады Фалло - гипертрофический. В основе обструкции лежит смещение конусной перегородки кпереди и влево или (и) ее низкое расположение, а также выраженные гипертрофические изменения ее проксимального сегмента. Зона максимального стеноза соответствует уровню отверстия выходного отдела правого желудочка и разграничительного мышечного кольца.
III тип тетрады Фалло - тубулярный. Обструкция вызвана неравномерным разделением общего артериального ствола, в результате чего легочный конус оказывается резко гипоплазированным, суженным и укороченным. При данном типе тетрады Фалло может иметь место гипоплазия фиброзного кольца или клапанный стеноз легочного ствола.
IV тип тетрады Фалло - многокомпонентный. Причина обструкции - значительное удлинение конусной перегородки или высокое отхождение перегородочно-краевой трабекулы модераторного тяжа.
В связи с особенностями гемодинамики различают три клинико-анатомических формы тетрады Фалло: 1) с атрезией устья легочной артерии; 2) цианотичная форма со стенозом устья различной степени; 3) ацианотичная форма.
Особенности гемодинамики при тетраде Фалло
Степень гемодинамических нарушений при тетраде Фалло определяется выраженностью обструкции выводного отдела правого желудочка и наличием дефекта в межжелудочковой перегородке.
Наличие значительного стеноза легочной артерии и септального дефекта больших размеров обусловливает преимущественное поступление крови из обоих желудочков в аорту и меньшее - в легочную артерию, что сопровождается артериальной гипоксемией. Ввиду большого дефекта перегородки давление в обоих желудочках становится равным. При крайней форме тетрады Фалло, связанной с атрезией устья легочной артерии, в малый круг кровообращения кровь попадает из аорты через открытый артериальный проток или через коллатерали.
При умеренной обструкции общее периферическое сопротивление выше, чем сопротивление стенозированного выводного тракта, поэтому развивается лево-правый сброс крови, приводящий к развитию ацианотичной (бледной) формы тетрады Фалло. Однако по мере прогрессирования стеноза возникает сначала перекрестный, а в дальнейшем - веноартериальный (право-левый) сброс крови, что означает трансформацию порока из «белой» формы в «синюю».
Симптомы тетрады Фалло
В зависимости от времени появления цианоза выделяют пять клинических форм и соответственно столько же периодов манифестации тетрады Фалло: раннюю цианотичную форму (появление цианоза с первых месяцев или первого года жизни), классическую (появление цианоза на втором-третьем году жизни), тяжелую (протекает с одышечно-цианотическими приступами), позднюю цианотичную (появление цианоза к 6-10 годам) и ацианотичную (бледную) форму.
При тяжелой форме тетрады Фалло цианоз губ и кожных покровов появляется с 3-4 месяцев и становится стабильно выраженным к 1 году. Синюшность усиливается при кормлении, плаче, натуживании, эмоциональном напряжении, физической нагрузке. Любая физическая активность (ходьба, бег, подвижная игра) сопровождается нарастанием одышки, появлением слабости, развитием тахикардии, головокружением. Характерное положение пациентов с тетрадой Фалло после нагрузки - сидя на корточках.
Крайне тяжелым проявлением клинической картины тетрады Фалло служат одышечно-цианотические приступы, которые обычно появляются в возрасте 2-5 лет. Приступ развивается внезапно, сопровождается беспокойством ребенка, усилением цианоза и одышки, тахикардией, слабостью, потерей сознания. Возможно развитие апноэ, гипоксической комы, судорог с последующими явлениями гемипареза. Одышечно-цианотические приступы развиваются вследствие резкого спазма инфундибулярного отдела правого желудочка, что приводит к поступлению всего объема венозной крови через дефект в межжелудочковой перегородке в аорту и усилению гипоксии ЦНС.
Дети с терадой Фалло могут отставать в физическом (гипотрофия II-III ст.) и моторном развитии; они часто болеют повторными ОРВИ, хроническим тонзиллитом, гайморитом, рецидивирующими пневмониями. У взрослых пациентов с тетрадой Фалло возможно присоединение туберкулеза легких.
Диагностика тетрады Фалло
При объективном обследовании пациентов с тетрадой Фалло обращает внимание бледность или синюшность кожных покровов, утолщение пальцевых фаланг («барабанные палочки» и «часовые стекла), вынужденная поза, адинамия; реже - деформация грудной клетки (сердечный горб). Перкуторно обнаруживается незначительное расширение границ сердца в обе стороны. Типичными аускультативными признаками тетрады Фалло служат грубый систолический шум во II-III межреберье слева от грудины, ослабление II тона над легочной артерией и др. Полная аускультативная картина порока фиксируется с помощью фонокардиографии.
Рентгенография органов грудной клетки выявляет умеренную кардиомегалию, типичную форму сердца в виде башмачка, обеднение легочного рисунка. ЭКГ-картина характеризуется значительным отклонением ЭОС вправо, гипертрофическими изменениями миокарда правого желудочка, неполной блокадой правой ножки пучка Гиса.
С помощью УЗИ сердца непосредственно определяются все анатомические компоненты тетрады Фалло: степень легочного стеноза, величина смещения аорты, размер ДМЖП и выраженность гипертрофии правого желудочка.
Зондирование полостей сердца позволяет выявить высокое давление в правом желудочке, снижение насыщения артериальной крови кислородом, прохождение катетера из правого желудочка в аорту. При проведении аортографии и легочной артериографии обнаруживается наличие коллатерального кровотока, ОАП, патологии легочной артерии. При необходимости выполняется левая вентрикулография, селективная коронарография, МСКТ и МРТ сердца.
Дифференциальный диагноз тетрады Фалло проводится с транспозицией магистральных сосудов, двойным отхождением аорты и легочной артерии от правого желудочка, одножелудочковым сердцем, двухкамерным сердцем.
Лечение тетрады Фалло
Все пациенты с тетрадой Фалло подлежат хирургическому лечению. Медикаментозная терапия показана при развитии одышечно-цианотических приступов: ингаляции увлажненного кислорода, внутривенное введение реополиглюкина, натрия гидрокарбоната, глюкозы, эуфиллина. В случае неэффективности лекарственной терапии необходимо незамедлительное наложение аортолегочного анастомоза.
Способ оперативной коррекции тетрады Фалло зависит от тяжести течения порока, его анатомо-гемодинамического варианта, возраста пациента. Новорожденным и детям раннего возраста с тяжелой формой тетрады Фалло на первом этапе требуется проведение паллиативных операций, которые позволили бы снизить степень риска осложнений при последующей радикальной коррекции порока.
К паллиативным (шунтирующим) типам операций при тетраде Фалло относятся: наложение подключично-легочного анастомоза Блелока-Тауссиг, внутриперикардиальное анастомозирование восходящей аорты и правой легочной артерии, наложение центрального аорто-легочного анастомоза с помощью синтетического или биологического протеза, наложение анастомоза между нисходящей аортой и левой легочной артерией и др. Для уменьшения гипоксемии применяются операции открытой инфундибулопластики и баллонной вальвулопластики.
Радикальная коррекция тетрады Фалло предусматривает проведение пластики ДМЖП и устранения обструкции выходного отдела правого желудочка. Обычно она проводится в возрасте от полугода до 3-х лет. Специфическими осложнениями операций, выполняемых при тетраде Фалло, могут являться тромбоз анастомоза, острая сердечная недостаточность, легочная гипертензия, аневризма правого желудочка, АВ-блокада, аритмии, инфекционный эндокардит.
Прогноз тетрады Фалло
Естественное течение порока в значительной мере зависит от степени легочного стеноза. Четверть детей с тяжелой формой тетрады Фалло погибает в первый год жизни, из них половина - в период новорожденности. Без операции средняя продолжительность жизни - 12 лет, менее 5% больных доживают до 40-летия. Причиной гибели больных с тетрадой Фалло чаще всего становится тромбоз сосудов головного мозга (ишемический инсульт) или абсцесс мозга.
Отдаленные результаты радикальной коррекции тетрады Фалло хорошие: пациенты трудоспособны и социально активны, удовлетворительно переносят физические нагрузки. Однако чем в более позднем возрасте выполнена радикальная операция, тем хуже ее отдаленные результаты. Все пациенты с тетрадой Фалло нуждаются в наблюдении кардиолога и кардиохирурга, антибиотикопрофилактике эндокардита перед проведением стоматологических или хирургических процедур, потенциально опасных в отношении развития бактериемии.
Повторный инфаркт миокарда
Повторный инфаркт миокарда - это некроз сердечной мышцы, возникающий после полного завершения предыдущего инфаркта миокарда. Провоцирующими факторами выступают несоблюдение пациентом схемы поддерживающей терапии, физические и умственные перегрузки, тяжелые формы дислипидемии и другие сопутствующие болезни. Патология проявляется некупируемыми сжимающими болями в области сердца, одышкой, предобморочным состоянием, неконтролируемым чувством страха. Для диагностики назначают ЭКГ, ЭхоКГ, коронарографию и комплекс лабораторных исследований. Основу лечения составляет экстренная реперфузия с помощью фибринолитиков, стентирования, баллонной ангиопластики.



Повторные коронарные атаки наблюдаются как минимум у 26,5% пациентов, перенесших инфаркт миокарда (ИМ). Около трети случаев происходит в течение первого года после первичного эпизода нарушения кровотока в сердечной мышце. При постановке диагноза стоит учитывать различия в терминологии: в российской кардиологии повторными называют инфаркты, развивающиеся спустя 8 и более недель от первого сердечного приступа, тогда как в зарубежной практике к этой категории относят второй, третий и все последующие случаи ИМ без привязки к временным интервалам.

Причины
Пациенты, которые сталкивались с критическими кардиоваскулярными событиями, имеют повышенный риск повторного развития инфаркта. Это связано с наличием рубца на миокарде и другими структурно-функциональными патологиями сердечной мышцы, которые нарушают гемодинамику, ухудшают адаптацию сердечно-сосудистой системы к изменяющимся параметрам кровотока. Предрасполагающими факторами формирования повторного инфаркта миокарда (ПИМ) выступают:
- Низкая приверженность терапии. По прошествии 6 месяцев после острого инфаркта только 82% больных продолжают принимать назначенную врачом антитромботическую терапию, к концу первого года лечения комплаенс больных понижается до 38%. Это способствует прогрессирующим нарушениям гемодинамики и повышенному риску тромбозов.
- Стрессовые факторы. В периоде реабилитации после ИМ больные проявляют повышенную чувствительность к эмоциональным и физическим нагрузкам, поэтому несоблюдение щадящего режима чревато острым коронарным синдромом (ОКС). Осложнение возникает вследствие неполного восстановления функции кардиоваскулярной системы.
- Рефрактерная дислипидемия. Нарушения липидного обмена, которые не удается корректировать комбинацией гиполипидемических препаратов, в разы повышают вероятность повторных инфарктов. Для заболевания характерна нестабильность атеросклеротических бляшек, вследствие чего они могут спонтанно отрываться и закупоривать коронарные сосуды.
- Немодифицируемые факторы. К ним относят отягощенную наследственность, мужской пол и пожилой возраст. Эти причины аналогичны таковым при первичном инфаркте, у больных с ишемическими атаками в анамнезе они также имеют большую значимость.
Факторы риска
В группе риска возникновения повторных инфарктов миокарда находятся пациенты с сопутствующими заболеваниями. Вероятность патологии резко повышается при аутоиммунных болезнях: узелковом периартериите, ревматоидном артрите, системной красной волчанке. Предрасполагающим фактором инфаркта являются заболевания крови (тромбоцитопеническая пурпура, истинная полицитемия, тромбоцитозы), метаболические нарушения (амилоидоз, мукополисахаридоз, гомоцистинурия). Острые коронарные атаки чаще возникают у пациентов с установленным искусственным клапаном сердца.
Патогенез
Гибель участка сердечной мышцы при повторном инфаркте происходит по тем же законам, что и первичный случай ОКС. У большинства больных пусковым фактором выступает закупорка сосуда атеросклеротической бляшкой в результате разрыва ее фиброзной капсулы, эрозии стенки, протрузии кальцинированных участков в артериальный просвет. Изредка ПИМ наблюдается при быстром накоплении атеросклеротических отложений в сосудах или кровоизлияниях в эту зону.
Вторым этапом патогенеза является ограничение кровотока в одной из зон сердечной мышцы, которое усугубляется остаточными нарушениями перфузии после предыдущего сердечного приступа. Обратимая ишемия продолжается в течение 2-4 часов, после чего наблюдается гибель миокарда. Далее происходит ферментативное расплавление мышечной ткани, развиваются процессы воспаления и инфильтрации миокарда лейкоцитами, после чего начинается организация рубца.

Классификация
Систематизация повторного инфаркта миокарда не отличается от общепринятой в практической кардиологии. По клиническому течению выделяют развивающийся ИМ — в первые 6 часов, острый - от 6 часов до 7 дней, рубцующийся— 7-28 дней, заживший — с 29 дня болезни. При постановке окончательного диагноза используются разные виды классификаций ПИМ:
- По степени тяжести. Согласно Killip, выделяют 4 класса ИМ - от отсутствия сердечной недостаточности (I) до кардиогенного шока (IV).
- По особенностям патогенеза. Различают повторный инфаркт миокарда с подъемом сегмента ST, который возникает при трансмуральном повреждении и полной окклюзии магистральной венечной артерии, и без подъема ST, развивающийся при ограничении кровотока на небольшом участке.
- По локализации. В зависимости от локализации повреждения сердечной мышцы левого желудочка выделяют переднебоковой, передневерхушечный, нижнебоковой, заднебазальный и другие варианты ПИМ. В особую категорию относят правожелудочковый инфаркт.
- По глубине повреждения. Наиболее опасным является трансмуральный ИМ, который захватывает все слои миокарда. Также выделяют интрамуральный, субэпикардиальный и субэндокардиальный варианты заболевания.
Симптомы повторного инфаркта миокарда
По клиническому течению ПИМ практически не отличается от впервые возникшего коронарного синдрома. Однако у пациентов с предшествующими ишемическими событиями в анамнезе чаще развиваются атипичные, в том числе безболевые формы инфаркта миокарда. У трети больных наблюдается продромальный период в виде сжимающих болей в груди, перебоев в работе сердца. Далее инфаркт проходит типичные периоды: острейший, острый, подострый и постинфарктный.
При классической форме ИМ основной жалобой пациентов являются резкие боли в левой половине грудной клетки. Они возникают внезапно, могут быть связаны с сильным стрессом или физической активностью. Болевой синдром длится дольше 20 минут, не поддается купированию нитроглицерином, как обычный приступ стенокардии. Боли отдают в руку, лопатку, нижнюю челюсть. Пациент ощущает сильное беспокойство и страх смерти, его кожа покрывается холодным потом и резко бледнеет.
Для астматического варианта характерна сильная одышка и приступ удушья, возникающий без видимой причины. Для облегчения состояния человек занимает положение сидя с упором руками на колени (ортопноэ). Боли в грудной клетке имеют невысокую интенсивность, многие пациенты их не замечают, поскольку внимание сфокусировано на расстройствах дыхания. Тяжелые формы ПИМ сопровождаются хрипами, выделением розовой пены изо рта.
Повторный инфаркт миокарда может протекать в абдоминальной форме, особенно если очаг некроза расположен в нижних отделах сердца. В этом случае интенсивные боли возникают в эпигастральной области. Они напоминают приступ острого панкреатита, гастрита, обострения язвенной болезни. Иррадиация болевого синдрома происходит в межлопаточную область. Больные страдают от тошноты, отрыжки, длительной икоты.
Реже наблюдается аритмическая форма, которая проявляется сильным сердцебиением, приступом головокружения, слабостью. Нарушения центрального кровотока вызывают кратковременные обмороки. Похоже симптомы имеет цереброваскулярный вариант повторного инфаркта, который проявляется симптомами ишемии головного мозга. Изредка наблюдается малосимптомный (стертый) вариант течения ПИМ.
Осложнения
К острым последствиям относят левожелудочковую недостаточность - отек легких и кардиогенный шок. До 90% пациентов имеют нарушения ритма и проводимости, которые иногда переходят в фибрилляцию желудочков и чреваты летальным исходом. Около 15% больных рискуют столкнуться с аневризмой левого желудочка, развивающейся при обширных трансмуральных инфарктах. К поздним осложнениям относят синдром Дресслера, тромбоэндокардит, постинфарктную стенокардию.
Диагностика
Пациенты с признаками сердечного приступа требуют экстренной помощи кардиолога или врача реанимационного отделения. При обследовании определяют неспецифические симптомы острой сердечной недостаточности, по возможности узнают медицинскую историю пациента и наличие у него инфаркта миокарда в прошлом. Обследование проводится в первые 2 часа от поступления больного в стационар, включает следующие методы диагностики:
- ЭКГ. Острая ишемия миокарда определяется при подъеме сегмента ST. К специфическим признакам ИМ относят глубокий зубец Q в стандартных или грудных отведениях, слишком широкий зубец R в сочетании с конкордантным позитивным зубцом Т. При подозрении на поражение задней стенке сердца показана регистрация кардиограммы в дополнительных отведениях V7-V9.
- УЗИ сердца. Эхокардиография назначается при критических проявлениях сердечной недостаточности, в том числе при кардиогенном шоке. Исследование информативно для выявления функциональных нарушений сердечной деятельности, которые возникают в первые минуты от развития инфаркта еще до грубых изменений на электрокардиограмме.
- Коронарография. Рентгенконтрастное исследование венечных сосудов, питающих миокард, признано «золотым стандартом» для подтверждения ПИМ. По результатам диагностики определяют наличие, степень и локализацию тромбоза сосудов, выбирают оптимальный метод консервативного или хирургического устранения препятствий кровотоку.
- Лабораторный комплекс. В кратчайшие сроки после поступления выполняют анализы на тропонин, КФК и прочие миокардиальные маркеры. Полная диагностическая программа включает клинический анализ крови, липидограмму, исследования на глюкозу и гликированный гемоглобин. Ценное прогностическое значение имеет оценка электролитного спектра крови, уровня Д-димера и натрийуретического пептида.
Дифференциальная диагностика
При остром болевом синдроме в груди слева исключают расслоение аорты, тромбоэмболию легочной артерии, перикардит. Сопутствующие нарушения дыхания требуют дифференциальной диагностики со спонтанным пневмотораксом. Атипичные формы повторного инфаркта дифференцируют с острым панкреатитом, пневмонией, межреберной невралгией. При отсутствии четких электрокардиографических и лабораторных критерий ИМ важно исключить нестабильную стенокардию.

Лечение повторного инфаркта миокарда
Экстренная медикаментозная терапия
Первичные терапевтические мероприятия включают введение опиоидных анальгетиков для ликвидации болевого синдрома и оксигенотерапию при снижении сатурации менее 90%. При повторном инфаркте миокарда сразу назначают нагрузочные дозы ацетилсалициловой кислоты в комбинации со вторым антиагрегантом по выбору врача. Терапия дополняется внутривенным введением антикоагулянтов, применением транквилизаторов при выраженной тревожности и беспокойстве больного.
При наличии противопоказаний или технической невозможности проведения хирургического вмешательства стратегией выбора признана фибринолитическая терапия. Она проводится в первые 12 часов от поступления больного и направлена на растворение тромба в венечном сосуде. Вовремя выполненный фибринолиз восстанавливает кровообращение и создает условия для нормализации функций участка миокарда, который находился в состоянии обратимой ишемии.
Хирургическое лечение
Чрескожное коронарное вмешательство (ЧВК) является стандартом реперфузионной терапии у пациентов с повторными инфарктами миокарда. ЧВК рекомендовано всем больным при подъеме ST на кардиограмме, пациентам без элевации ST, которые имеют признаки гемодинамической нестабильности, длительные боли в груди, жизнеугрожающую аритмию. Предпочтительным вариантом является установка стентов с лекарственными покрытиями, альтернативное лечение — баллонная ангиопластика.
Поддерживающая терапия
После стабилизации состояния и выписки пациента назначается продолжительная или даже пожизненная фармакотерапия, направленная на предупреждение повторных случаев инфаркта миокарда. Стандартом лечения называют двойную антитромботическую терапию (ДАТТ), которая включает комбинацию 2-х антиагрегантов. По показаниям проводится тройная терапия, включающая ДАТТ и один антикоагулянт, двойная терапия — антиагрегант и пероральный антикоагулянт.
Прогноз и профилактика
Исход повторного инфаркта зависит от объема повреждения сердечной мышцы, своевременности диагностики заболевания и полноты назначенного лечения. Хотя такие пациенты имеют более высокие риски осложненного течения ИМ, при ранней и комплексной терапии удается восстановить показатели гемодинамики и работу сердечной мышцы. Основными методами профилактики ПИМ являются диспансерное наблюдение у кардиолога и соблюдение схемы ДАТТ после первичного инфаркта.
2. Повторный инфаркт миокарда: оценка, риски, профилактика/ И.В. Самородская, С.А. Бойцов// Российский кардиологический журнал. - 2017. - №6.
3. Основные факторы, определяющие риск развития повторного инфаркта миокарда/ О.Л. Барбараш, Д.Ю. Седых, Е.В. Горбунова// Сердце: журнал для практикующих врачей. - 2017. - №1.
4. Прогнозирование повторного инфаркта миокарда у больных с постинфарктным кардиосклерозом/ А.Н. Шопин// Практическая медицина. - 2011. - №1.
Читайте также:
